Серотонин и эйкозаноиды. Лейкотриены
Добавил пользователь Евгений Кузнецов Обновлено: 27.01.2026
Эйкозаноиды — большая группа внутри- и межклеточных медиаторов, которые образуются из арахидоновой кислоты (полиненасыщеннзя жирная кислота). Они быстро инактивируются в крови, действуют в основном на рядом расположенные клетки (паракринный эффект).
Арахидоновая кислота высвобождается из фосфолипидов клеточной мембраны под действием фосфолипазы А2. Этот фермент активируется при клеточном отеке и увеличении внутриклеточной концентрации Са 2+ . Повышение его активности происходит под действием ряда медиаторов, таких как гистамин, серотонин, брадикинин и норадреналин (через а-рецепторы). Фосфолипаза A2 ингибируется глюкокортикоидами (через липокортин) и адреналином (через β-рецепторы).
Арахидоновая кислота под действием липоксигеназы превращается в лейкотриены, а под действием циклооксигеназы (ЦОГ) — в простагландин G [PGG2]. Из PGG2 (через PGH2) синтезируется тромбоксан Д2 (ТХА2) и простагландины PGF2a, PGE2 и PGI2.
Существует две изоформы циклооксигеназы: ЦОГ1 и ЦОГ2. Обе изоформы подавляются НПВС (например, ацетилсалициловой кислотой). ЦОГ2 может ингибироваться селективно. Воспаление и повреждение тканей активирует как ЦОГ, так и липоксигеназу и таким образом увеличивает образование эйкозаноидов.
Лейкотриены вызывают сужение гладких мышц бронхов, кровеносных сосудов, кишечника и матки. Они ответственны за продолжительный бронхоспазм при астме; их действие на кишечник вызывает диарею, на матку — выкидыш. Лейкотриены косвенно увеличивают проницаемость сосудов и приводят к отекам. Они также способствуют адгезии и хемотаксису, стимулируют высвобождение гистамина, свободных радикалов O2, лизосомных ферментов, а также инсулина.
ТХА2 образуется в основном в тромбоцитах и необходим для свертывания крови. Избыток ТХА2 способствует формированию тромбов и сужению артериол. Введение небольших доз ацетилсалициловой кислоты, таким образом, снижает риск инфаркта миокарда благодаря уменьшению агрегации тромбоцитов.
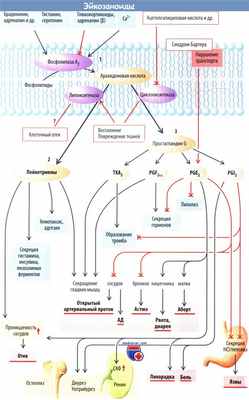
PGF2a стимулирует высвобождение ряда гормонов и сокращение гладких мышц кровеносных сосудов, кишечника, бронхов и матки.
PGE2 ингибирует высвобождение гормонов и липолиз, активирует сокращение гладких мышц в кишечнике и матке. В то же время он подавляет сокращение бронхов и сосудов мышц. Ингибиторы ЦОГ, таким образом, вызывают астму у сенсибилизированных пациентов (так называемая анальгетическая астма). Влияние на сосуды обеспечивает сохранение артериального протока.
С другой стороны, применение ингибиторов ЦОГ в течение последнего триместра беременности вызывает преждевременное закрытие артериального протока. PGE2 увеличивая СКФ. Это повышает проницаемость сосудов и способствует развитию отеков.
PGE2 и PGI2 содействуют деминерализации костей (остеолизу). Они стимулируют образование ренина в почках и путем ингибирования канальцевой реабсорбции Na + и воды способствуют выведению натрия, усиливают диурез. Они поднимают целевой уровень терморегуляции (лихорадка) и вызывают боль. Эффекты простагландинов в значительной степени способствуют развитию инфекции
PGE2 играет защитную рол ь в желудке путем ингибирования секреции HCl и пепсина и стимулирования секреции НСO3 - и слизи, которая защищает слизистую оболочку желудка. Он также вызывает расширение сосудов. Снижение образования PGE2 ингибиторами ЦОГ способствует развитию язвы желудка.
PGE2 защищает мозговой слой почек. Через расширение прямых сосудов улучшается поступление O2 и доступность субстратов, уменьшаются затраты энергии, что препятствует реабсорбции NaCl.
PGE2 имеет большое значение при синдроме Бартера, который развивается при мутации генов Na + -К + -2Cl - -котранспортера, люминальных К + . каналов или базолатеральных Cl - -каналов в петле Генле. В результате дефекта переносчика возникает высокая местная концентрация PGE2 Ингибирующее влияние PGE2 на переносчик Na + в более дистальных отделах нефрона усиливает потери NaCI, а его сосудорасширяющее действие вызывав выраженное падение АД. Опасную для жизни потери соли почками у больных детей можно предотвратил использованием ингибиторов ЦОГ.
- Рекомендуем ознакомиться со следующей статьей "Схема вариантов повреждений нервной системы"
Серотонин и эйкозаноиды. Лейкотриены
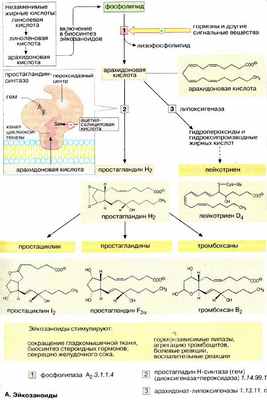
Медиаторы (локальные гормоны) — широко распространенная группа сигнальных веществ, которые образуются почти во всех клетках организма и имеют небольшую дальность действия. Этим они отличаются от классических гормонов, синтезирующихся в специальных клетках желез внутренней секреции. Наиболее важными представителями медиаторов являются гистамин и эйкозаноиды . В этом разделе на примере эйкозаноидов рассматриваются основные свойства медиаторов.
Эйкозаноиды большая группа медиаторов, обладающих широким спектром биологической активности. Предшественником эйкозаноидов является арахидоновая кислота (20:4) (см. с. 54) — полиненасыщенная жирная кислота, входящая в состав фосфолипидов плазматических мембран.
Биосинтез . Эйкозаноиды образуются почти во всех клетках организма. Биосинтез начинается с гидролиза фосфолипидов плазматической мембраны под действием фосфолипазы А 2 [ 1 ]. Активность этого фермента строго контролируется гормонами и другими биорегуляторами, сопряженными с G-белками. Свободная арахидоновая кислота также является биологически активным соединением. Однако гораздо большее значение имеют ее метаболиты: простагландины, простациклины, тромбоксаны и лейкотриены, которые носят групповое название эйкозаноиды (от греч. eikosi — 20).
К эйкозаноидам ведут два главных пути биосинтеза. Первый инициируется простагландин-синтазой, обладающей свойствами циклооксигеназы и пероксидазы [ 2 ], второй — липоксигеназой [ 3 ].
Простагландин-синтаза [ 2 ] катализирует двухстадийную реакцию превращения арахидоновой кислоты в простагландин Н 2 . Последующие реакции, катализируемые различными ферментами, приводят к образованию простагландинов, простациклинов и тромбоксанов .
Окисление полиеновых кислот при участии липоксигеназы приводит к образованию гидроперокси - и гидроксипроизводных жирных кислот , из которых путем дегидратации и за счет различных реакций переноса образуются лейкотриены . На схеме приведены структурные формулы отдельных представителей разных групп эйкозаноидов.
Биологическая активность эйкозаноидов. Эйкозаноиды обладают чрезвычайно разносторонней физиологической активностью. Они служат вторичными мессендже рами гидрофильных гормонов, контролируют сокращение гладко мышечной ткани (кровеносных сосудов, бронхов, матки), принимают участие в высвобождении продуктов внутриклеточного синтеза (гормонов, HCl, мукоидов), оказывают влияние на метаболизм костной ткани, периферическую нервную систему, иммунную систему, передвижение и агрегацию клеток (лейкоцитов и тромбоцитов), являются эффективными лигандами болевых рецепторов.
Эйкозаноиды действуют как локальные биорегуляторы путем связывания с мембранными рецепторами в непосредственной близости от места их синтеза как на синтезирующие их клетки (аутокринное действие), так и на соседние клетки (паракринное действие). В некоторых случаях их действие опосредовано цАМФ и цГМФ.
Метаболизм . Эйкозаноиды инактивируются в течение нескольких секунд в результате восстановления двойных связей и окисления гидроксигрупп. Благодаря быстрому разрушению дальность действия эйкозаноидов ограничена.
Ацетилсалициловая кислота и другие жаропонижающие препараты являются специфическими ингибиторами простагландин-синтазы. Они необратимо инактивируют фермент путем ацилирования остатка серина вблизи активного центра, перекрывая тем самым подход субстрата к активному центру. Этим объясняется болеутоляющее, жаропонижающее и антиревматическое действие подобных препаратов. В желудке такие препараты подавляют биосинтез простагландинов, которые стимулируют выделение мукоидов, защищающих слизистую оболочку от действия протеолитических ферментов. Поэтому продолжительный прием ацетилсалициловой кислоты может вызвать язвенную болезнь желудка и двенадцатиперстной кишки.
Эйкозаноиды и полиненасыщенные жирные кислоты при хронических воспалительных дерматозах Текст научной статьи по специальности «Фундаментальная медицина»
The paper presents brief literature review related to the role of eicosanoids under chronic inflammatory dermatoses. The author highlights a necessity of modern approaches to treat-ment of chronic inflammation and application of polyunsaturat-ed fatty acids that block generating arachidonic acid, a precursor of eicosanoids in human organism.
Похожие темы научных работ по фундаментальной медицине , автор научной работы — Ступин А.В.
Систематический анализ биохимических эффектов эйкозапентаеновой и докозагексаеновой омега 3 пнжк на физиологию беременной и развитие плода
Состав жирных кислот и уровень их метаболитов при частично контролируемой бронхиальной астме на фоне комплексного лечения с применением миллиметровой терапии
EICOSANOIDS AND POLYUNSATURATED FATTY ACIDS UNDER CHRONIC INFLAMMATORY DERMATOSES
The paper presents brief literature review related to the role of eicosanoids under chronic inflammatory dermatoses. The author highlights a necessity of modern approaches to treat-ment of chronic inflammation and application of polyunsaturat-ed fatty acids that block generating arachidonic acid, a precursor of eicosanoids in human organism.
Текст научной работы на тему «Эйкозаноиды и полиненасыщенные жирные кислоты при хронических воспалительных дерматозах»
Через 60 мин. инкубации при температуре 37°С не-прикрепившиеся клетки двукратно отмывали путем заполнения флаконов средой 199, промывную жидкость сливали и во флаконы вносили по 0,2 мл среды 199, после чего клетки разрушались 3-4-кратным замораживанием-оттаиванием. Показатель оценивали по концентрации лизоцима.
Оказалось, что прилипаемость макрофагов к пластику, судя по общему количеству лизоцима, выше, чем к стеклу. Так, поверхность прикрепления к стеклу была 5,5±0,3, а к пластику — 7,8±0,4 мкг/мл. Данный факт можно объяснить высокой поглотительной способностью инертных полимерных частиц латекса, используемых в качестве фагоцитируемых объектов, поглощаемых при отсутствии опсонинов [3], и о повышенной лабилизации лизосомальных мембран при взаимодействии с пластиком (рис. 1). R.J. North [6] описал стремление меньшей по размеру клетки захватить более крупный объект как «феномен неосуществленного фагоцитоза».
Таким образом, проведенный эксперимент свидетельствует о различии функциональных проявлений разных стадий фагоцитарного процесса, связанных с преформациями клеточных (в т.ч. лизосомальных) мембран фагоцитов.
1. Глебов Р.Н. Эндоцитоз и экзоцитоз. — М. : Высшая школа, 1987.
2. Сюч Н.И., Бейлина И.Б. //Журнал микробиологии. — 1995. — № 6. — С. 70-71.
3. Хаитов Р.М., Пинегин Б.В., Истамов Х.И. — Экологическая иммунология. — М. : Медицина, 1995.
4. Шаронов А.С. Оценка изменений стабильности ли-зосомных мембран мононуклеарных фагоцитов как метод аллергодиагностики и скрининга мембрано-тропных и радиопротективных препаратов : метод. рекомендации. — М.: МЗ СССР, 1989.
5. Шаронов А.С., Кузина А.П., Слипчук Г.К. Методика определения прилипаемости фагоцитирующих
1 час 2 часа 6 часов Среднее
Рис. 1. Стабильность лизосомальных мембран фагоцитирующих перитонеальных клеток крыс, прикрепленных на разных поверхностях.
клеток по лизоциму. — Рац. предложение № 2431 от 30.10.2001 г.
6. North R.J. // J. Reticuloendothel. Soc. - 1968. - Vol. 5, No. 2. - P. 203-229.
Поступила в редакцию 30.11.04. COMPARATIVE ASSAY ON ADHESIVE PROPERTIES OF PERITONEAL MACROPHAGES AND STATE OF THEIR LYSOSOMAL MEMBRANES STABILITY BY THEIR ATTACHMENT TO GLASS AND PLASTICS A.S. Sharonov, J.A. Chramova, E.A. Maltseva Vladivostok State Medical University
Summary — Adhesive activity of peritoneal macrophages and state of their lysosomal membranes stability by their attachment to plastics and glass were determined by original methods. It was shown that peritoneal macrophages' ability to attach to plastics is higher than to glass. This way, rise of ILMS occurs in case of their attachment to plastics during different time period of interaction between peritoneal macrophages and glass or plastics, that is associated with rise of phagocytes' lisosomal membranes labilization.
Pacific Medical Journal, 2005, No. 1, p. 87-88.
УДК 616.5-002-036.12-085:577.115.3 А.В. Ступин
И ПОЛИНЕНАСЫЩЕННЫЕ ЖИРНЫЕ КИСЛОТЫ ПРИ ХРОНИЧЕСКИХ ВОСПАЛИТЕЛЬНЫХ ДЕРМАТОЗАХ
Владивостокский государственный медицинский университет
Ключевые слова: жирные кислоты, воспаление.
хронических дерматозов, таких как псориаз, экзема и атопический дерматит, с помощью полиненасыщенных жирных кислот ю-3 ряда. Эти препараты направленно влияют на хронический воспалительный процесс и обладают значительно более мягким действием на организм, чем кортикостероиды или бло-каторы циклооксигеназы.
За последние 20-30 лет произошли большие перемены в понимании патогенеза хронических и затяжных острых воспалительных процессов. Такие медиаторы воспаления, как гистамин, серотонин, кинины, каллекриины, быстро расщепляются соответствующими ферментами и действуют преимущественно при остром или при обострении хронического воспаления. Ведущая роль в поддержании
длительно текущего воспалительного процесса принадлежит биологически активным веществам ли-пидной природы, которые получили общее название «эйкозаноиды». Это обширная группа биохимических соединений, представленная простогландина-ми, тромбоксанами, лейкотриенами, липоксинами, а также гидроксиэйкозатетраеновыми кислотами. Основным предшественником эйкозаноидов в организме являются: арахидоновая кислота (20:4ю-6), в меньшей степени эйкозапентаеновая (20:5ю-3) и дигомо-у-линолиевая (20:3ю-6) кислоты.
Свободной арахидоновой кислоты в организме крайне мало, по большей части она находится во втором положении мембранных фосфолипидов. В норме арахидоновая кислота высвобождается в небольших количествах при участии специфической фосфолипазы А2. При воспалении активность фосфолипазы А2 возрастает, и, соответственно увеличивается количество освобождающейся арахидо-новой кислоты [2]. Далее она метаболизируется двумя основными путями:
1) под действием ферментов циклооксигеназ до про-стогландинов и тромбоксанов;
2) под действием липоксигеназ до лейкотриенов, ли-поксанов и гидроксиэйкозатетраеновых кислот.
Все эйкозаноиды в норме в небольших количествах присутствуют в организме, регулируя различные физиологические процессы: поддержание тонуса гладкой мускулатуры сосудов и полых органов, агрегацию и адгезию тромбоцитов, свертываемость крови, сперматогенез, беременность и зачатие, высвобождение гипоталамических рилизинг-гормо-нов и др.
Например, простогландин F2a, лейкотриены В4, С4 и D4 повышают тонус мускулатуры бронхов, а простогландины Е[ и Е2 снижают его. Под действием простогландина F2a, лейкотриенов В4, С4 и D4, тромбоксанов А2 и В2 повышается тонус сосудистой стенки, а простогландины Аь А2, Еь Е2 и 12 понижают тонус сосудов. Простогландины 12 и Е[ уменьшают агрегацию тромбоцитов, а тромбоксаны А2 и В2 и простогландин Е2 повышают ее [1]. В условиях патологии, при воспалении, количество эйкоза-ноидов резко возрастает. При хронических воспалительных заболеваниях, таких как бронхиальная астма, ревматоидный артрит, неспецифический язвенный колит, системная красная волчанка, псориаз и экзема, лейкоциты, находящиеся в очаге воспаления, высвобождают разнообразные ферменты, в том числе фосфолипазу А2. Это приводит к образованию большого количества свободной арахидо-новой кислоты, которая быстро метаболизируется до эйкозаноидов [2].
Эйкозаноиды в свою очередь вызывают следующие эффекты [1, 3-6]:
1) увеличение проницаемости сосудистой стенки, экссудация жидкой части крови в межклеточное пространство и отек тканей;
2) стаз и сладж крови в венозном сегменте микроциркуляции;
3) расширение микрососудов с увеличением притока крови и гиперемией тканей;
4) повышение местной и общей температуры;
6) усиление миграции лейкоцитов в очаг воспаления (что влечет еще большее высвобождение фосфолипазы А2);
7) нарушение функции экзокринных желез кожи и слизистых оболочек (например, при бронхиальной астме это увеличивает выработку густого вязкого секрета в бронхах);
8) нарушение процессов клеточного деления (например, при псориазе лейкотриет B4 и 12-гидрокси-эйкозатетраеновая кислота действуют на клетки росткового слоя эпидермиса, еще более усиливая их пролиферацию).
Из вышеперечисленного становится понятно, что наиболее эффективными в терапии хронического воспаления будут средства, которые вмешиваются в обмен арахидоновой кислоты, блокируя ее высвобождение или препятствуя ее превращению в эйко-заноиды. Препятствовать этому можно, блокировав фосфолипазу А2. Этим свойством обладают корти-костероидные гормоны и их синтетические аналоги. Также противовоспалительный эффект достигается при применении соединений, блокирующих цикло-оксигеназу и липоксигеназу. Сюда можно отнести нестероидные противовоспалительные препараты, которые блокируют циклооксигеназу и снижают синтез простогландинов. В последние годы появились соединения, блокирующие липоксигеназу (Ап-thralin, Baicalein, Curcumin и др.) [1].
В настоящее время для лечения воспалительных заболеваний с умеренной выраженностью патологического процесса, в частности таких хронических дерматозов, как псориаз, экзема и атопический дерматит, с успехом используются полиненасыщенные жирные кислоты ю-3 ряда, в частности эйкозапентаеновая (20:5ю-3) и докозагексаеновая (22:6ю-3) [7,
9). Эйкозапентаеновая кислота обладает структурным сходством с арахидоновой, конкурирует с ней за липоксигеназы и циклооксигеназы и превращается в эйкозаноиды, обладающие слабой биологической активностью. Докозагексаеновая кислота, взаимодействуя с указанными ферментами, полностью блокирует их за счет образования прочных ко-валентных связей с активными центрами [8].
1. Cascade biochem limited. - England: The innovation center, university campus, reading, Berkshire RG62BX, 1994.
3. Heller A., Koch T, Schmeck J., van Ackern K. // Drugs. - 1998. - Vol. 55. - P. 487-496.
НАБЛЮДЕНИЯ ИЗ ПРАКТИКИ
4. Ikai K. // J. Dermatological. Sci. - 2000. - Vol. 21. -P. 135-146.
5. Kragballe K., Voorhees J.J. // J. Allergy Clin. Immunol. - 1984. - Vol. 74. - P. 426.
6. McGiff J.C. // Ann. Rev. Farmacol. Toxicol. - 1991. -Vol. 31. - P. 339-369.
7. Wright S. // Br. J. Dermatol. - 1991. - Vol. 125. -P. 503-515.
8. Zibon V.A., Miller C.C., Cho Y.H. // Amer. J. Clin. Nutr. - 2000. Vol. 71. - P. 361S-366S.
9. Zurier B. // Ann. Rheum. Dis. - 1991. - Vol. 50. -P. 745-746.
УДК 616.24+617.572]-006.81:611-018 В.С. Тимошенко, В.И. Колесников
СЛУЧАЙ МАССИВНОЙ МЕЛАНОМЫ ЛЕГКОГО В СОЧЕТАНИИ С ПОВЕРХНОСТНОЙ МЕЛАНОМОЙ ПЛЕЧА
Владивостокский государственный медицинский университет
Ключевые слова: меланома, гистогенез.
Еще недавно вопрос о возможности развития первичной меланомы легкого вызывал скептические возражения. Считалось, что поражение нижних дыхательных путей опухолью из меланинобразующей ткани может быть только метастатическим. Однако в последние годы все чаще появляются публикации о первичных меланомах бронхов и легких [2, 6-10]. С морфологической точки зрения наиболее интересным является вопрос о гистогенезе таких опухолей. Известно, что в норме в бронхах и легких не содержится меланоцитов. Вместе с тем некоторые исследователи полагают, что развитие меланомы в легких, как и в других органах, не содержащих меланоцитов, можно связать с опухолевой дифференцировкой клеток-предшественников апудоцитов в меланоцитар-ном направлении. Предполагается также развитие меланом из очажков эктопии меланоцитарного диф-ферона [3, 5, 9]. В.П. Харченко и др. [6] цитировали 29 случаев первичной меланомы легкого, а также привели 4 собственных наблюдения, в том числе случай с первично-множественным поражением органов дыхания. В связи с редкостью первичных меланом легких приводим собственное наблюдение.
Заболевание у мужчины 50 лет началось с подъемов температуры и нарастающей слабости. Через два месяца развился гемипарез, по поводу чего больной и поступил в стационар. При рентгенологическом исследовании в правом легком выявлены тень сливного характера, увеличение прикорневых и подключичных лимфоузлов справа. При цитологическом исследовании последних заподозрены метастазы низкодифференцированного рака. Через две неде-
Поступила в редакцию 01.10.02.
EICOSANOIDS AND POLYUNSATURATED FATTY ACIDS UNDER CHRONIC INFLAMMATORY DERMATOSES A.V. Stupin
Vladivostok State Medical University
Summary — The paper presents brief literature review related to the role of eicosanoids under chronic inflammatory dermatoses. The author highlights a necessity of modern approaches to treatment of chronic inflammation and application of polyunsaturated fatty acids that block generating arachidonic acid, a precursor of eicosanoids in human organism.
ли больной скончался. Посмертный клинический диагноз: «Рак правого легкого IV стадии с метастазами в лимфатические узлы и головной мозг».
При аутопсии в коже левого плеча найдено гладкое, не выступающее над эпидермисом пятно черного цвета 1,0 см в диаметре с четкими границами и погружением в кожу на 0,10,15 см. Правое легкое было тотально поражено опухолевидным конгломератом плотной консистенции, с поверхности и на разрезе черного цвета (рис. 1, а). Опухолевидные узлы черного цвета найдены в бифуркационных, прикорневых и подключичных лимфоузлах справа, парааортальных лимфоузлах, средостении, перикарде, брыжейке кишечника, селезенке. Множественные черные узлы диаметром 1-1,5 см обнаружены в ткани головного мозга при интактных мозговых оболочках. При гистологическом исследовании в коже плеча отмечена пролиферация умеренно атипичных меланоцитов с разрушением базального слоя эпидермиса и началом каплевидной инвазии. Глубина инвазии в серийных срезах не превышала 0,15 см и находилась в пределах сосочкового слоя кожи (рис. 1, б). В ткани правого легкого по стенкам альвеол располагались цепочки атипичных эпителиоподобных клеток (рис. 1, в) с диффузным или гнездным содержанием гранул меланина. В метастатических узлах всех локализаций меланобластические клетки оказались аналогичными таковым в легких и формировали медуллярные пласты (рис. 1, г). Аргирофильная реакция Гримелиуса была диффузно положительной с четким контрастированием меланина.
Патологоанатомический диагноз: «Первичная мелано-ма правого легкого с множественными лимфогенными и гематогенными метастазами в сочетании с поверхностной меланомой кожи левого плеча».
Особенность данного случая не только в тотальном поражении меланомой одного из легких, но и в наличии поверхностной меланомы кожи плеча, что предполагает рассмотреть последнюю как возможный первоисточник опухолевых поражений. Однако сопоставив характер гистологической картины, особенности роста и объема опухолевых поражений, полагаем, что в нашем наблюдении произошло параллельное независимое развитие меланинобразующих опухолей легкого и кожи плеча. В пользу самостоятельности меланомы легкого свидетельствует прежде всего диффузный характер поражения органа на стороне, противоположной процессу на плече, тогда как все обнаруженные метастазы имели типичный узловой характер. Гистоар-хитектоника опухолевых клеток в легком имела альве-олярно-выстилающее расположение, а все метастазы
Серотонин и эйкозаноиды. Лейкотриены
Эйкозаноиды. Воспаление бронхов и выделение эйкозаноидов.
Среди БАВ, выделяемых различными клетками воспаления, большую роль играют эйкозаноиды,- продукты обмена арахидоновой кислоты.
Имеются данные о синтезе различных эйкозаноидов в разных клетках: в частности, эозинофилы выделяют лейкотриен С4; базофилы и тучные клетки - цистеиновые лейкотриены С4, Д4, Е4, простагландин Д2; нейтрофилы и альвеолярные макрофаги - лейкотриен В4; эпителиальные клетки - простагландины Е2, F2, Д2, и простациклин.
Клетки начинают синтез эйкозаноидов под воздействием различных веществ (аллергенов, токсинов, инфекционных агентов), при этом происходит стимуляция липидного метаболизма, активация фосфолипаз приводит к высвобождению в свободном виде арахидоновой кислоты из фосфолипидов клеточных мембран, а затем под влиянием циклоогксигеназных систем - простагландины, простациклины и тромбоксан. Гранулы тучных клеток содержат ферменты, запускающие каскад превращений арахидоновой кислоты. Легкие богаты простагландинами и принимают активное участие не только в их синтезе, но и в метаболизме, регулируя воспалительные реакции и тонус бронхов, поддерживая в норме баланс между различными группами простагландинов, которые имеют разнонаправленное физиологическое действие.
Установлено, что простагландины групп F2 и Д2, а также тромбоксан А2 вызывают бронхоспатическую реакцию и другие проявления, сопутствующие воспалению, а простагландины группы Е и простациклин - бронходилатацию. У больных БА даже в межприступный период в плазме крови повышено содержание метаболитов простагландина F и снижен уровень простагландина Е2. Найдена прямая связь между уровнем простагландина F2a в крови больных БА и степенью выраженности и длительностью бронхоспазма и установлена роль этого простагландина в развитии неспецифической гиперреактивности бронхов и усилении действия различных БАВ, причем эти эффекты потенцируются лейкотриенами, особенно лейкотриеном Д4.
Это позволяет говорить о каскадном действии изначально малых количеств БАВ, а компенсаторное повышение выделения простациклина и его метаболитов эндотелием легочных сосудов, несмотря на его бронходилатирующее действие, не только не устраняет бронхообстрикцию, но даже может ее усугубить из-за неблагоприятного влияния на микроциркуляцию за счет потенцирования воспалительных изменений и образования отека. У больных БА найдено повышение содержания в бронхоальвеолярном лаваже лейкотриенов В4 и тромбоксана А2, образование которых также повышается при активации тромбоцитов и, в свою очередь, стимулирует их агрегацию, влияя на состояние микроциркуляции. Медленно действующее вещество анафилаксии, представляющее собою смесь цистеиновых лейкотриенов, участвует в бронхоспастической реакции, развитии отека и повышении сосудистой проницаемости, потенцируя действие гистамина, и обладает в сотни раз более активным действием, чем гистамин, причем наиболее сильным действием обладает цистеиновый лейкотриен Д4.
Продукты 15-липооксигеназы, выделяющиеся, в основном активированными эозинофилами, усиливают ранний астматический ответ на гистамин у больных БА.
Особенностью выделения лейкотриенов является их немедленный выброс без предшествующего депонирования в секреторных гранулах и последующее непосредственное участие в биохимических реакциях и воспалительной альтерации тканей. Наряду с цистеиновыми лейкотриенами, ЛТ В4, стимулирующий продукцию ИЛ1 и ИЛ2, активирующий нейтрофилы и различные клоны Т-лимфоцитов, вызывающий эозинофильно-нейтрофильное воспаление, играет ведущую роль в развитии поздней аллергической реакции у больных БА, при этом лейкотриены способны формировать специфическую гиперчувствительность бронхов. Имеются данные о значительном повышении выделения цистеиновых ЛТ клетками воспаления в бронхах больных с атопической БА и больных аспириновой астмой. У больных последней группы имеется повышенное выделение лейкотриенов клетками периферической крови после их стимуляции аспирином in vitro. Вместе с тем, известно, что антигены золотистого стафиллококка и вирус гриппа А также стимулируют выброс ЛТ. Таким образом, ЛТ - универсальные БАВ, участвующие в патогенезе воспаления при различных вариантах бронхообструктивното синдрома.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Простагландины, лейкотриены

Простагландины, лейкотриены, а также тромбоксаны, эпоксиды, липоксины и гидроксипероксины относятся к эйкозаноидам (от греч. еicosa – двадцать) - короткодействующим высокоактивным клеточным медиаторам – «местным» гормонам. Почти все они являются жирными кислотами, продуктами метаболизма арахидоновой кислоты, содержащей 20 атомов углерода. Некоторые эйкозаноиды могут быть синтезированы из С18 жирных кислот (линолевой и a-линоленовой).
Исследования простагландинов начались в 1930 году, когда гинекологи Курцрок и Либ обнаружили, что сперма человека вызывает сокращение маточной мускулатуры. В 1934 году Гольдблат и Ван Эйлер независимо друг от друга нашли в семенной жидкости человека вазоактивную жирную кислоту, снижающую артериальное давление у кроликов. Ван Эйлер назвал это вещество простагландином, так как считал, что оно образуется простатой. Структура первых двух простагландинов была определена в 1962 году Бергстрёмом, который назвал их простагландинами F и Е соответственно их способности растворяться в фосфатном буфере или эфире.
Всего известно 10 групп специфических молекул простагландинов, получивших буквенные индексы от А до J. Каждая группа простагландинов состоит из трех серий под номером 1, 2 или 3, определяющим степень насыщения (количество двойных связей) алифатической боковой цепи. Для простагландина F дополнительное обозначение a или b характеризует пространственную конфигурацию гидроксильной группы при С9. Простагландины G2 и Н2 нестабильны и служат предшественниками для дальнейшего синтеза эйкозаноидов (так же, как и 5-, и 15-гидроксиэйкозатетраенаты).
Эйкозаноиды не депонируются в клетке, их синтез регулируется активностью микросомальных ферментов и содержанием субстрата для синтеза – свободных жирных кислот:
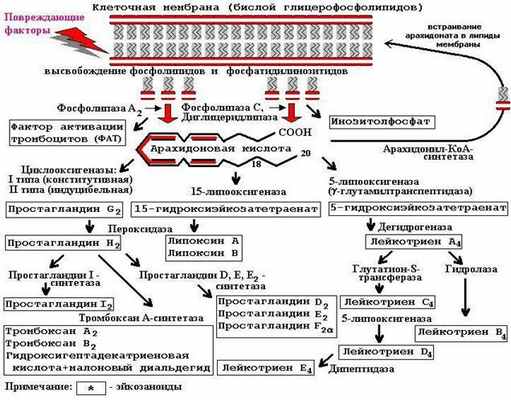
Рисунок 6.1. Схема синтеза эйкозаноидов.
Ферменты синтеза эйкозаноидов являются тканеспецифичными. Например, в эндотелиальных клетках сосудов синтезируются простагландины Е2 и I2 (простациклин), а в тромбоцитах – тромбоксаны.
При расщеплении фосфолипазой А2 фосфолипидов клеточных мембран образуются арахидоновая кислота и фактор активации тромбоцитов – сильный патофизиологический медиатор бронхоспазма и шока. Ингибиторами фосфолипазы А2 являются глюкокортикостероиды – гидрокортизон, преднизолон, дексаметазон и другие (см. раздел «Гормоны коры надпочечников и их синтетические аналоги»), оказывающие наиболее мощный противовоспалительный эффект.
Синтез простагландинов катализируется гемопротеидом циклооксигеназой (ЦОГ, СОХ, эндопероксид-простагландин Н2-синтаза), которая имеется у большинства животных и обнаружена во всех клетках человека, кроме эритроцитов и лимфоцитов.
Блокаторами циклооксигеназного пути окисления арахидоната являются НПВС (см. разделы «Ненаркотические анальгетики» и «Противовоспалительные средства»), например, ацетилсалициловая кислота (необратимый ингибитор ЦОГ), диклофенак, индометацин, нимесулид (обратимые ингибиторы ЦОГ). Все НПВС конкурентно вытесняют арахидоновую кислоту из активного центра циклооксигеназы.
Существует два типа циклооксигеназы: ЦОГ-1 и ЦОГ-2. Эти изоферменты отличаются по химическому составу (на 4 аминокислоты), и по локализации в организме. В организме доминирующей формой, обеспечивающей выработку защитных факторов в ЖКТ, регулирующей тонус бронхов и гемостаз, является постоянно активная (конститутивная) форма - ЦОГ-1.
Экспрессия гена ЦОГ-2 активируется кининами только при массивном повреждении клеточных мембран, продукты ее катализа (простагландины Е2, F2a и I2) запускают болевую и воспалительную реакцию. Экспрессия ЦОГ-2 в очаге воспаления, в путях проведения болевых импульсов (в спинном мозге), и в центре терморегуляции (в гипоталамусе) может быть ослаблена глюкокортикостероидными гормонами и нимесулидом.
Читайте также:
