Сифилис костей. Множественные костные очаги.
Добавил пользователь Morpheus Обновлено: 27.01.2026
Остеома – это доброкачественная опухоль, развивающаяся из костной ткани. Характеризуется медленным ростом и не перерождается в злокачественное образование. Может протекать бессимптомно либо сопровождаться болями.
Чаще остеомы развиваются в детском и юношеском возрасте. Они образуются на костях скелета и могут поражать височную, бедренную, лобную и ключевую кости, полости и орбиты лицевых костей. Доброкачественная опухоль клиновидной и лобной кости может происходить из зародышевых хрящевых остатков.
- солитарными (одиночными);
- множественными.
По типу строения их разделяют на:
- твердые (образованы компактным плотным веществом, которое по структуре схоже со слоновой костью и не содержит костного мозга);
- губчатые (образованы губчатым пористым веществом);
- мозговидные (состоят из широких костномозговых полостей).
По критерию происхождения остеомы классифицируют на:
- гиперпластические (развиваются из костной ткани);
- гетеропластические (образуются из соединительной ткани).
К гиперпластическим остеомам относятся:
- Остеомы. Имеют такую же структуру, как нормальная костная ткань. Появляются на лицевых костях, костях черепа, в стенках придаточных пазух носа (гайморовой, лобной, клиновидной, решетчатой). Могут сдавливать соседние анатомические образования, приводят к нарушениям зрения, эпилептическим припадкам и пр.;
- Остеоидные остеомы. Представляют собой высокодифференцированные костные опухоли, которые по структуре отличаются от нормальной костной ткани. Состоят из богатой сосудами остеогенной ткани, хаотично расположенных костных балочек, зон остеолиза (участки разрушенной костной ткани). Как правило, не превышают в диаметре 1 см. Могут образовывать везде, кроме костей черепа и грудины. 50 % остеоидных остеом — это опухоли большеберцовых костей.
К гетеропластическим остеомам относятся остеофиты. Они бывают:
- наружными (эктостозы) — растут на поверхности кости, поражают кости таза, черепа, лица;
- внутренними (эностозы) — растут в костномозговой канал.
Гетеропластические остеомы могут вырастать не только на костях, но и в местах прикрепления сухожилий, в плевре, диафрагме, мозговой ткани, сердечной оболочке.
Причины остеомы
- сифилис;
- физические травмы;
- подагра;
- ревматизм.
Симптомы остеомы
Симптоматика остеом определяется их расположением:
- остеома на задней стенке лобной пазухи приводит к повышению внутричерепного давления, непроходящим головным болям;
- остеома на нижней стенке лобной пазухи провоцирует сильное выпячивание глазного яблока;
- остеома полости носа характеризуется затруднением носового дыхания, исчезновением обоняния, опущение века, двоением в глазах, снижением остроты зрения, выпучиванием глазного яблока. Если она локализуется в области околоносовых пазух, ухудшается зрение, возникает болевой синдром, происходит деструкция позвоночника;
- остеома лобной кости, расположенная на внутренних пластинах свода черепа, выражается нарушением памяти, головными болями, повышением внутричерепного давления, судорожными припадками;
- остеома затылочной кости провоцирует частые головные боли, может стать причиной эпилептических припадков;
- остеома большеберцовой, таранной и бедренной костей проявляется припухлостью ног, нарушением походки, мышечными болями при ходьбе. Дискомфорт усиливается в ночное время;
- остеома теменной и височной костей не причиняет никаких неудобств. Это только косметический дефект;
- остеома коленного сустава вызывает сложности при передвижении, мешает ходить;
- остеома ребра проявляется болью за грудиной;
- остеома, локализующаяся в области позвонков, способствует формированию сколиоза.
Болевой синдром при остеоме, остеоидной остеоме и остеофитах уменьшается или исчезает после приема анальгетиков.

Диагностика остеомы
Диагностика остеом направлена на выяснение природы опухоли. Обычно для выявления доброкачественного образования достаточно проведения клинико-рентгенологических исследований. Простая остеома на фото выглядит как округлость однородной структуры с четкими границами, остеоидная — как очаг деструкции в виде нечетко очерченного дефекта. Кость вокруг остеоидной остеомы имеет широкую область остеосклероза и заметно утолщена.
В ходе клинической диагностики врач определяет:
- болезненность опухоли при пальпации,
- локализацию новообразования,
- скорость роста (соотносятся размеры остеомы с длительностью заболевания),
- функциональность пораженной ткани/конечности.
Также учитывается формула крови.
- степень деструкции пораженной кости;
- единичное образование или множественное;
- строение остеомы;
- локализацию в кости.
О том, что опухоль доброкачественная, говорит:
- медленный темп роста;
- правильная геометрия/структура образования;
- минимальная степень обызвествления;
- хорошо очерченный контур.
Лечение остеомы
- значительном косметическом дефекте (например, если остеома расположена на голове и сильно выступает над здоровым участком черепа),
- проявлении симптомов сдавливания соседних анатомических образований.
Лечение остеоидных остеом также только хирургическое. Во время операции врач удаляет и пораженный участок, и окружающую его зону остеосклероза. Что касается остеофитов, то их лечение состоит в хирургическом удалении экзостоза.
Если доброкачественное образование никак себя не проявляет, пациенту рекомендуют динамическое наблюдение. Никакого специального лечения опухоли в этом случае не проводится.
Опасность
Остеомы не трансформируются в злокачественные образования и обычно не мешают больному вести привычный образ жизни. Осложнения возникают лишь тогда, когда опухоль сдавливает соседние анатомические структуры. Тогда симптомы заболевания становятся ярко выраженными, пациент оказывается на операционном столе.
Также необходимо знать, что остеомы головы могут привести к абсцессу мозга.
Профилактика
Остеома передается по наследству, поэтому специальной профилактики данного заболевания не существует. Между тем врачи рекомендуют:
- избегать физических травм;
- своевременно лечить заболевания опорно-двигательного аппарата;
- при выявлении новообразований неясной этиологии проходить медицинское обследование.
Данная статья размещена исключительно в познавательных целях и не является научным материалом или профессиональным медицинским советом.
Сифилис костей. Множественные костные очаги.
Сифилис костей. Множественные костные очаги.
Сифилис костей может уже очень рано после заражения (примерно через 6 недель) вызывать очень сильные периостальные боли (череп, ребра, грудина, большеберцовые кости). Жестокие ночные болив большеберцовых костях почти патогномоничны и могут быть сравниваемы по характеру и распространению только с болями при волынской лихорадке.
Клинические и рентгенологические данные в ранних стадиях мало способствуют установлению диагноза; решающее значение принадлежит реакции Вассермана и быстрому эффекту от противосифилитического лечения.
Сифилис костей третичного периода и врожденный сифилис с саблевидными голенями и рентгенологически устанавливаемым разрушением структуры кости и вовлечением периоста в настоящее время являются редкостью (реакция Вассермана!)
Грибковые поражения — актиномикоз, бластомикоз, кокцидиомикоз (в США) — с возрастающей частотой локализуются в костях, но в клинической картине почти всегда на первый план выступают легочные и кожные проявления.
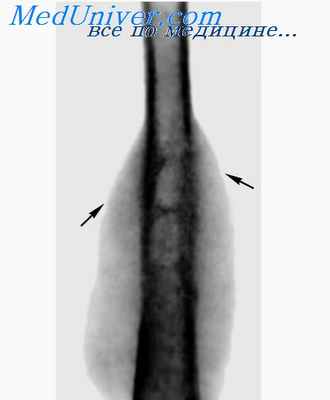
Профессиональные костные некрозы наблюдаются у работающих со сжатым воздухом и на кессонных работах. У первых главную роль играют переломы, у вторых — воздушные эмболии, которые приводят к циркуляторным нарушениям.
Переломы вследствие перегрузки наблюдаются при чрезмерной (часто непривычной) нагрузке костной системы.
Наиболее известны переломы метатарзальных костей у солдат (так называемые маршевые переломы).
Множественные костные очаги.
При множественных костных очагах и диффузных изменениях костей (остеопороз, остеосклероз) у взрослых всегда следует помнить, что часто речь идет не о собственно местном заболевании костей, а о вторичных изменениях костей вследствие какого-то общего заболевания.
При соответствующих изменениях в костях следует поэтому всегда проводить биохимическое исследование крови на содержание общего белка, кальция, фосфора и фосфатазы. Результаты этих исследований могут быть решающими для диагноза. Гиперглобулине м и я говорит в пользу миеломы, гиперкальциемия (с понижением фосфатов) характерна для первичного гиперпаратиреоза (фиброзный остит Реклингаузена) или (с повышением фосфатов) — для вторичного, гиперпаратиреоза. Повышение уровня щелочной фосфатазы подозрительно на наличие остеомаляции, фиброзного остита, болезни Педжета или костных метастазов.
Преимущественно множественные ограниченные костные очаги у взрослых с более или менее выраженными болями в костях наблюдаются при:
а) воспалительных поражения х: остеомиелит, туберкулез, сифилис, грибковые поражения, саркоидоз;
б) опухолях: миелома, первичные опухоли костного мозга;
в) костных метастазах: лимфогранулематоз, гемангио-ма;
г) болезнях накопления: болезнь Гоше, болезнь Ниман— Пика, болезнь Ханд — Шюллер — Кристиана.
Возможно, что редко встречающаяся эозинофильная гранулема, впервые описанная Fraser (1935), является лишь особо доброкачественной формой болезни Шюллер — Кристиана. Соответственно этому эозинофильную гранулему следует рассматривать как частичное проявление болезни Шюллер—Кристиана. Здесь также патогномоничны не резко очерченные костные дефекты в ребрах или других плоских костях. Очаги бывают единичными или множественными. Заболевание развивается преимущественно в юношеском возрасте (описаны, однако, случаи заболевания вплоть до 5-й декады жизни) и начинается, как правило, внезапно болями в костях и припухлостью, усиливающимися, на протяжении недель.
Наблюдается субфебрилитет. В крови небольшая эозинофилия (до 10%), но в общем картина крови не характерна.
Диагноз может быть точно установлен только после пробной эксцизии, хотя клиническая картина довольно типична. Далее характерно быстрое прогрессирование заболевания и хороший эффект лучевой терапии.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Сифилитические поражения костей
Костная система может поражаться во всех стадиях сифилиса: в первичной, вторичной, при раннем и позднем врожденном сифилисе, а также при нейро - и висцеросифилисе. Однако наиболее часто поражение костей наблюдается во вторичном периоде приобретенного сифилиса. Во вторичной стадии сифилиса характерны периоститы, в третичной — периоститы и гуммы (очаги специфического разрушения костной ткани).
При раннем врожденном сифилисе остеохондриты возникают в возрасте от 5 мес. внутриутробной жизни до 12 мес. после рождения. После одного года жизни остеохондриты наблюдают исключительно редко.
Рентгенологически остеохондриты диагностируются по наличию следующих признаков: расширение зоны обызвествления участков хряща, ее зубчатость и намечающаяся полоса разрежения под зоной обызвествления. В тяжелых случаях, в результате распада грануляционной ткани, нарушается связь между эпифизом и метафизом (внутриметафизарный перелом кости). В костях в области диафизов и метафизов верхних и нижних конечностей могут, хотя и редко, образоваться изолированные гуммы, которые с трудом выявляют рентгенологически. Легче диагностировать гуммы, занимающие весь поперечник кости. Периоститы при раннем врожденном сифилисе встречаются очень часто и могут сочетаться с остеохондритами или быть единственным проявлением костного сифилиса.
Поздний врожденный сифилис костей проявляется в возрасте от 8 до 14 лет, для него характерна триада Гетчинсона (клиновидная форма зубов, поражение органов слуха и зрения).
При позднем врожденном сифилисе гуммозные периоститы могут сочетаться с единичными или множественными гуммами, захватывающими только кортикальный слой или всю толщу кости. Диффузные остеопериоститы длинных трубчатых костей конечностей представляют наиболее характерную картину при позднем врожденном сифилисе и сопровождаются развитием саблевидной деформации голеней.
Клинически поражение костей сифилисом проявляется у больных в большинстве случаев болью в костях, чаще трубчатых нижних конечностей, артралгией коленных, плечевых суставов.
Для серологической диагностики сифилиса используют две основные группы тестов: нетрепонемные (с использованием кардиолипинового антиге-на), способные выявлять антифосфолипидные антитела, называемые реагина-ми; трепонемные (с использованием антигенов как патогенных, так и культу-ральных трепонем). Также не утратили своей актуальности RW, темнопольная микроскопия.
Лечение. Прежде всего общее противосифилитическое лечение. Для этих целей широко применяются калиевая и натриевая соли бензилпенициллина, бензатин – бензилпенициллин G, соли висмута (бийохинол, бисмоверол, пентабисмол). Неспецифическая терапия заключается в назначении иммуномодуляторов (пирогенал, пирроксан, тималин, декарис), витаминов, биогенных стимуляторов (алоэ и др.). При наличии патологических переломов — иммобилизируют конечность гипсовой повязкой. Больные должны находиться под постоянным наблюдением специалистов.
К проблеме диагностики раннего врожденного сифилиса: анализ клинического случая
Врожденный сифилис все еще является проблемой для здравоохранения, сифилис может остаться незамеченным у беременных женщин даже в развитых странах при активном дородовом наблюдении. В настоящее время по Международной классификации болезней (МКБ-10) выделя
The problem of the diagnosis of early congenital syphilis: a case report / V. I. Surganova, N. V. Polyakova, N. K. Levchik1, N. V. Zilberberg, T. A. Syrneva / State budgetary institution of the Sverdlovsk region Ural Research Institute of Dermatovenereology and Immunopathology, Ekaterinburg, Russia
Abstract. Congenital syphilis is still a public health concern, and syphilis can go unnoticed in pregnant women, even in developed countries with active antenatal care. Currently, according to the International Classification of Diseases (ICD-10), early (in children under 2 years of age) and late congenital syphilis (in children over 2 years of age) are distinguished. Features of the clinical course of early congenital syphilis make it possible to divide it into early congenital syphilis of infancy (up to 1 year) and early childhood (from 1 to 2 years). The signs of congenital syphilis are diverse and a high index of suspicion must be maintained to make the diagnosis. Early congenital syphilis usually appears in the neonatal period and seldom later than 3-4 months of life and hardly ever in children older than one year of age. We report 20-month-old boy with congenital syphilis who presented bone lesions in the lower extremities and cutaneous eruptions and remained undiagnosed until his mother was diagnosed with secondary syphilis. The article also highlights the possible difficulties in diagnosing syphilis in children of early childhood. For citation: Surganova V. I., Polyakova N. V., Levchik N. K., Zilberberg N. V., Syrneva T. A. The problem of the diagnosis of early congenital syphilis: a case report // Lechaschy Vrach. 2021; 1 (24): 20-23. DOI: 10.26295/OS.2021.43.20.004
Резюме. Врожденный сифилис все еще является проблемой для здравоохранения, сифилис может остаться незамеченным у беременных женщин даже в развитых странах при активном дородовом наблюдении. В настоящее время по Международной классификации болезней (МКБ-10) выделяют ранний (у детей до 2 лет) и поздний врожденный сифилис (у детей старше 2 лет). Особенности клинического течения раннего врожденного сифилиса позволяют разделить его на ранний врожденный сифилис грудного возраста (до 1 года) и сифилис раннего детского возраста (от 1 до 2 лет). Клинические проявления врожденного сифилиса разнообразны, и для своевременного установления диагноза необходимо поддерживать высокий уровень настороженности. Ранний врожденный сифилис обычно проявляется в неонатальном периоде, редко после 3-4 месяца жизни и почти никогда не бывает у детей старше одного года. Представляется анализ случая врожденного сифилиса у мальчика в возрасте 1 год 8 месяцев c поражением костей нижних конечностей и кожными высыпаниями, который оставался недиагностированным до тех пор, пока его матери не был поставлен диагноз вторичного сифилиса. В статье также освещены возможные трудности диагностики сифилиса у детей раннего детского возраста.
Врожденный сифилис – внутриутробная инфекция, поражающая большинство органов и систем, результатом которой может быть гибель плода, мертворождение или рождение больного ребенка. В настоящее время выделяют ранний (у детей до 2 лет) и поздний (от 2 лет и старше) врожденный сифилис. Возможно скрытое течение врожденного сифилиса – с отсутствием клинических симптомов и положительными серологическими тестами. Симптоматика врожденного сифилиса различается в зависимости от срока сифилитической инфекции у ребенка 4.
Характерными ранними проявлениями врожденного сифилиса являются сифилитическая пузырчатка, диффузная инфильтрация кожи Гохзингера (диффузная папулезная инфильтрация), сифилитический ринит (вследствие диффузной воспалительной инфильтрации слизистой оболочки полости носа), остеохондрит длинных трубчатых костей Вегнера. Отмечаются также распространенные или ограниченные высыпания на коже и слизистых оболочках, подобные таковым при вторичном сифилисе (редко розеолы, чаще папулы), алопеция, поражение костей (периостит, остеопороз, остеосклероз, костные гуммы), специфическое поражение внутренних органов (гепатит, гломерулонефрит, миокардит, эндо- и перикардит и др.) и центральной нервной системы. Могут также наблюдаться клинические и лабораторные неспецифические симптомы, свойственные внутриутробным инфекциям.
Ранний врожденный сифилис может манифестировать в любое время до двух лет, но, как правило, клинические симптомы появляются в период новорожденности и редко позднее 3-4 месяцев жизни [13, 17]. До 60-66% детей бессимптомны при рождении [18], две трети имеют клинические проявления около 3-8 недели жизни [19]. Приводятся описания случайного выявления детей с врожденным сифилисом, связанные с более поздним появлением клинических симптомов. В 9,3% случаев врожденный сифилис выявляется в возрасте 1-6 месяцев и в 1,4% – от 6 месяцев до года, обычно при проведении скрининга в соматических стационарах [17].
Диагностика врожденного сифилиса у детей в возрасте от одного до двух лет представляет особенную трудность для дерматовенерологов и врачей других специальностей [11], что обусловлено редкой встречаемостью данной формы, сходством клинической картины со многими заболеваниями различной этиологии.
Мы приводим случай поздней диагностики врожденного сифилиса у пациента в возрасте 1 год 8 месяцев.
Описание случая
В отделение венерологии поступил мальчик 1 года 8 месяцев с направительным диагнозом «вторичный сифилис кожи и слизистых оболочек», который был выявлен как бытовой контакт матери.
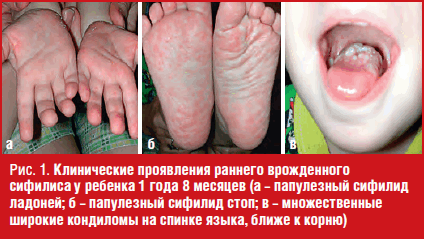
При клиническом осмотре состояние ребенка средней тяжести, кожные покровы бледные, он отказывается вставать на ноги, при попытке поставить на ножки поджимает их к животу, плачет, отмечается хромота на левую ногу. На ладонной поверхности кистей множество папул размером до 0,5 см в диаметре, розового цвета, окруженных эпидермальным венчиком – воротничок Биетта (рис. 1а). На подошвенной поверхности стоп обильные округлые папулы до 1 см в диаметре, розового цвета (рис. 1б). В перианальной области множество папул «ветчинного» цвета, единичные папулы гипертрофированы (широкие кондиломы), некоторые элементы частично эрозированы. Повреждений в области половых органов и перианальной области (следы травмы, разрывы, кровоизлияния) не выявлено. Слизистая оболочка зева гиперемирована, на спинке языка, ближе к корню, множественные гипертрофированные папулы, покрытые белым налетом, 0,5-1,0 см в диаметре (широкие кондиломы) (рис. 1г).
Со слов матери, за 3 месяца до госпитализации ребенок стал жаловаться на боли в нижних конечностях, особенно ночью, отказывался передвигаться самостоятельно. Ребенок был осмотрен хирургом, проведено ультразвуковое исследование левого коленного сустава. Установлен диагноз «ушиб левого коленного сустава», проведено лечение, не давшее положительного эффекта. За 3 недели до госпитализации у мальчика появились высыпания на ладонях и подошвах, в связи с чем мама обратилась к педиатру, затем к дерматовенерологу, который назначил антигистаминные препараты и препараты кальция, однако на фоне проводимого лечения высыпания сохранялись.
После появления высыпаний на коже ладоней и подошв у матери, обращения ее к дерматовенерологу и установления диагноза «вторичный сифилис кожи и слизистых оболочек», ребенок был обследован как имевший бытовой контакт серологическими методами, в результате чего были выявлены положительные результаты.
При сборе анамнеза были получены следующие данные. Мальчик родился доношенным с весом 3400 г, ростом 52 см, находился на естественном вскармливании до 9 месяцев, рос и развивался в соответствии с возрастом. При рождении клинических проявлений врожденного сифилиса не было, серологическое обследование не проводилось. Мать состояла на учете во время беременности у акушера-гинеколога, проходила скрининг на сифилис на сроках 10 недель и 32 недели при помощи реакции микропреципитации (РМП) с получением отрицательных результатов, трепонемные тесты не исследовались. Во время беременности женщина была двухкратно пролечена антибиотиком из группы макролидов (джозамицин): в I триместре 14 дней по поводу обострения хронического пиелонефрита и во II триместре 14 дней по поводу хламидийной инфекции нижних отделов мочеполового тракта. На сроке 36 недель женщина отмечала высыпания в области гениталий, которые акушер-гинеколог расценил как проявления генитального герпеса, на сифилис исследований не проводилось. В родильном отделении были получены положительные результаты РМП и ИФА, но на момент получения результатов обследования пациентка уже была выписана из родильного отделения. Данные обследования не были переданы венерологу по месту жительства, специфического лечения женщина и ребенок не получили. Источник заболевания выявить не удалось, так как отец ребенка выехал в другую страну до рождения ребенка. Сожитель, с которым женщина проживает в настоящее время, здоров. Другие половые контакты женщина отрицает.
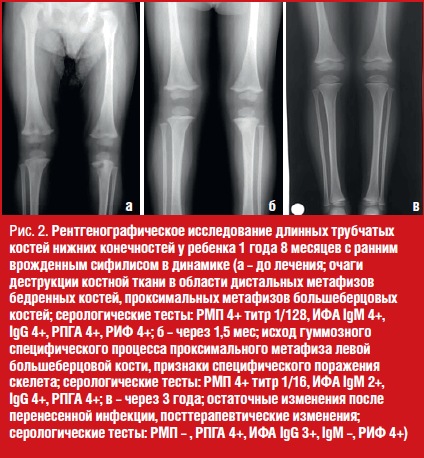
Результаты серологического обследования ребенка при госпитализации: РМП + 1/128, ИФА IgM 4+, IgG 4+, РНГА 4+, РИФ 4+. Данные рентгенографии бедренных костей и голеней: очаги деструкции костной ткани (гуммы) в области дистальных метафизов бедренных костей, проксимальных метафизов большеберцовых костей (рис. 2а).
На основании данных клинического обследования (гуммы длинных трубчатых костей, папулы ладоней, подошв, широкие кондиломы языка и перианальной области), положительных результатов серологических тестов у ребенка и у матери при родах, отсутствия лечения матери во время беременности ребенку был установлен диагноз «врожденный сифилис раннего детского возраста».
Учитывая тяжесть костной патологии, врачебной комиссией было принято решение провести специфическую терапию двумя курсами цефтриаксона в дозе 50 мг/кг/сут. Первый курс проводился 28 дней. В первые сутки терапии отмечалась реакция обострения в виде повышения температуры тела до 38,4 оС с появлением единичной розеолезной сыпи на коже туловища. На фоне терапии розеола регрессировала на 2-е сутки, папулы в области языка – на 5-е сутки, ладоней и подошв – на 19-е сутки, перианальной области – на 14-е сутки. Хромота уменьшилась на 19-е сутки, исчезла на 27-е сутки. При выписке ребенок подвижен, жалоб на болезненность в области нижних конечностях не предъявляет.
Через две недели был проведен второй курс в течение 10 дней. При поступлении? состояние ребенка удовлетворительное, жалоб нет. Наблюдалась положительная динамика серологических показателей крови ребенка со снижением титров РМП в 8 раз, позитивности ИФА IgM – в 2 раза. Заключение рентгенографического исследования длинных трубчатых костей нижних конечностей через 6 недель: «Исход гуммозного специфического процесса проксимального метафиза левой большеберцовой кости. Признаки специфического поражения скелета. Положительная динамика от первичной рентгенограммы» (рис. 2б).
По данным клинико-лабораторного наблюдения полный регресс специфических изменений со стороны костной системы произошел через 6 месяцев (по данным рентгенографического исследования), негативация нетрепонемных тестов – через 2 года.
В настоящее время по Международной классификации болезней (МКБ-10) выделяют ранний (у детей до двух лет) и поздний врожденный сифилис (у детей старше двух лет). Особенности клинического течения раннего врожденного сифилиса (многообразие и возрастная периодичность) позволяют разделить его на ранний врожденный сифилис грудного возраста (до одного года) и раннего детского возраста (от одного до двух лет) [16].
Течение сифилиса в раннем детском возрасте (от одного года до двух лет) – нередко скрытое или малосимптомное, патогномоничные симптомы отсутствуют. К концу первого года клинические проявления (в том числе патогномоничные) стихают, и клиника врожденного сифилиса раннего детского возраста соответствует вторичному периоду приобретенного сифилиса. Кожные проявления представлены папулезной сыпью, мокнущими, вегетирующими папулами (широкими кондиломами) в области кожных складок, перианальной области, половых органов, на слизистой оболочке полости рта, в углах рта. Костная система в этом возрасте поражается у 60% больных [20] в виде ограниченных периоститов и остеопериоститов, которые могут выявляться только при рентгенологическом обследовании. Редко встречаются гуммы костей [21].
При выявлении сифилиса у детей раннего детского возраста нередко возникают диагностические ситуации, когда невозможно установить давность и путь инфицирования [15] и необходимо проводить дифференциальную диагностику врожденного и приобретенного сифилиса.
В нашем случае женщина состояла на учете у акушера-гинеколога и получила дородовое наблюдение, но при этом сифилис остался недиагностированным, и она не получила специфическое лечение во время беременности. Со слов женщины, она имела половые контакты только с двумя половыми партнерами. Отец ребенка, контакты с которым были только в течение I триместра, не обследован, второй, с которым проживает в настоящее время, – здоров. Возможно, заражение женщины сифилисом произошло в I триместре беременности, но активное применение антибиотика-макролида, который имеет некоторую противотрепонемную активность, способствовало удлинению инкубационного периода и поздней позитивации нетрепонемного теста (РМП).
В связи с отсутствием настороженности у врачей-педиатров и дерматовенерологов и недостаточно тщательно проведенным осмотром клинические проявления сифилиса у ребенка, такие как высыпания на ладонях, боли в костях, хромота, были расценены как проявления других нозологий, обследование на сифилис не было проведено, и ребенок был выявлен только как бытовой контакт матери.
Представленный клинический случай обусловлен комплексом диагностических и лечебно-тактических ошибок:
- Женщины во время беременности должны быть обследованы не только нетрепонемными, но обязательно трепонемными тестами. В двух третях случаев первыми у пациентов позитивируются трепонемные тесты. Кроме того, нетремонемные тесты подвержены феномену прозоны, а также быстрее изменяются под влиянием антибактериальной терапии. Это обусловливает более высокую частоту ложноотрицательных результатов нетрепонемных тестов.
- При выявлении эрозивно-язвенных высыпаний на половых органах, особенно у беременной женщины, необходимо было провести лабораторное исследование на сифилис прямыми и непрямыми методами.
- Информация о положительных серологических тестах у матери не была передана дерматологу по месту жительства.
- Недостаточное знание признаков врожденного сифилиса дерматовенерологами и врачами других специализаций, отсутствие должной настороженности.
Заключение
Врожденный сифилис все еще является проблемой для здравоохранения, сифилис может остаться незамеченным
у беременных даже в развитых странах при активном дородовом наблюдении. Врачи должны быть бдительными и рассматривать возможность врожденного сифилиса у любого ребенка с клиническими проявлениями, укладывающимися в клинику сифилиса, несмотря на материнский серологический статус.?
КОНФЛИКТ ИНТЕРЕСОВ. Авторы статьи подтвердили отсутствие конфликта интересов, о котором необходимо сообщить.
CONFLICT OF INTERESTS. Not declared.
Литература/References
В. И. Сурганова, кандидат медицинских наук
Н. В. Полякова, кандидат медицинских наук
Н. К. Левчик 1 , кандидат медицинских наук
Н. В. Зильберберг, доктор медицинских наук, профессор
Т. А. Сырнева, доктор медицинских наук, профессор
ГБУ СО УрНИИДВиИ, Екатеринбург, Россия
К проблеме диагностики раннего врожденного сифилиса: анализ клинического случая/ В. И. Сурганова, Н. В. Полякова, Н. К. Левчик, Н. В. Зильберберг, Т. А. Сырнева
Для цитирования: Сурганова В. И., Полякова Н. В., Левчик Н. К., Зильберберг Н. В., Сырнева Т. А. К проблеме диагностики раннего врожденного сифилиса: анализ клинического случая // 2021; 1 (24): 20-23. DOI: 10.26295/OS.2021.43.20.004
Теги: неонатальный период, внутриутробная инфекция, сифилис
Сифилис костей. Множественные костные очаги.
2 ФГБОУ ВО «Красноярский государственный медицинский университет имени профессора В.Ф. Войно-Ясенецкого» Министерства здравоохранения РФ
Болезнь множественной миеломы и миелодиспластический синдром – достаточно редкие заболевания в онкогематологической практике. Сочетание этих болезней встречается очень редко. В статье представлен случай сочетанной патологии, которая присутствовала у одного больного. Это затруднило первичную диагностику имеющейся патологии у пациента. Только при повторно возникающих жалобах и более тщательном обследовании с привлечением современных методов компьютерной диагностики и химических методов исследования удалось диагностировать сочетанное заболевание крови. Целью данной работы было отразить особенности диагностики и течения редкого сочетания ММ и ХМПЗ. Необычная клиническая картина этого случая маскировала течение двух разных гематологических заболеваний. При синхронном правильном лечении обоих заболеваний наблюдается улучшение состояния больного. Клинически сохраняется умеренный анемический синдром, несмотря на заболевание, пациент вполне адаптирован.
1. Грачев А.Е., Грибанова Е.О., Накастоев И.М. и др. Сочетание множественной миеломы и миелопролиферативного заболевания / А.Е. Грачев, Е.О. Грибанова, И.М. Накастоев и др. // Гематология и трансфузиология. – 2016. – 61. – № 1. – Приложение 1. – С. 103.
2. Менделеева Л.П., Вотякова О.М., Покровская О.С. и др. Национальные клинические рекомендации по диагностике и лечению множественной миеломы / Л.П. Менделеева, О.М. Вотякова, О.С. Покровская // Гематология и трансфузиология. – 2016. – 61. – № 1. –Приложение 2. – С. 1-24.
3. Мещерякова Л.М., Пороткова О.В., Ковалева Л.Г. и др. Первичный миелофиброз / Л.М. Мещерякова, О.В. Пороткова, Л.Г. Ковалева // Онкогематология. – 2011. – № 6(4). –С.50-57.
4. Bose P., Verstovsek S. Prognosis of Primary Myelofibrosis in the Genomic Era / P. Bose, S. Verstovsek // Clin Lymphoma Myeloma Leuk. – 2016 Aug.16. – Suppl: S105-13.
5. Kallick C.A., Friedman D.A., Nyindo M.B. Could ehrlichial infection cause some of the changes associated with leukemia, myelodysplastic diseases and autoimmune disorders, and offer antibiotic treatment options? / C.A. Kallick, D.A. Friedman, M.B. Nyindo // Med Hypotheses. –2015. – Dec. 85(6):891-3.
Ph-негативные хронические миелопролиферативные заболевания (ХМПЗ), множественная миелома (ММ) встречаются не так часто. Множественная миелома (ММ) составляет приблизительно 1 % среди всех злокачественных опухолей, 13 % среди гемопоэтических опухолей [2]. Болеют пациенты возраста старше 40 лет, чаще заболевают мужчины, люди негроидной расы более подвержены риску поражения данным недугом. В переводе с греческого «το μυελό των οστών» означает «костный мозг». Заболевание имеет несколько названий – миеломная болезнь, множественная миелома, болезнь Рустицкого-Калера, секретирующая лимфома, генерализованная плазмоцитома.
Миеломная болезнь – онкологическое заболевание системы кроветворения, которое относят к парапротеинемическим лейкозам. Миелома (плазмоцитома) относится к неизлечимым заболеваниям, однако поддается терапии, которая позволяет добиться длительной ремиссии. Заболевание протекает с низким пролиферативным потенциалом опухолевых клеток, поражающих преимущественно костный мозг и кости, иногда лимфоузлы и лимфоидную ткань кишечника, селезенку, почки и другие внутренние органы.
Миелома – это атипичный сбой в работе белых плазматических клеток и начала их активного, аномального деления. Плазматические клетки в норме отвечают за выработку гуморального иммунного ответа в борьбе с вирусами и эндогенными инфекциями. Аномальные плазматические клетки начинают производство парапротеинов (видоизмененного белка), которые постепенно накапливаются во всем организме и препятствуют работе органов. Миеломные клетки быстро кумулируются в костном мозге, разрушают здоровые ткани и приводят к развитию остеопороза и частым переломам.
На начальных этапах болезни злокачественные клетки формируются в костном мозге, вызывают воспалительные процессы и разрушение костей – чаще ребер, позвоночника, черепа. По мере прогрессирования воспалительный процесс распространяется в кровь и развивается миелома крови. Данное состояние характеризуется: нарушением (ростом) вязкости крови в связи с присутствием в ней большого количества парапротеинов и дефектами кроветворения; снижением иммунитета из-за уменьшения числа иммуноглобулинов; поражением почек в связи с оседанием в клубочках и почечных канальцах видоизмененных белков.
Причина заболевания не установлена окончательно, в большинстве своем миеломой крови болеют люди после лучевых поражений, долгое время имеющие контакт с нефтеперерабатывающими продуктами и другими нездоровыми компонентами и загрязнениями в окружающей среде. Но эти факторы могут быть только сопутствующими. Основной причиной можно назвать возрастные изменения организма. Болезнь может передаваться генетически. Это зависит от мутации гена, детерминирующего созревание В-лимфоцитов. Кроме того, значение имеет степень ожирения. У человека, страдающего ожирением, нарушен обмен веществ, на этом фоне может манифестировать озлокачествление клеток.
Каковы же симптомы множественной миеломы?
- Ноющие боли в костях.
- Патологические белки в тканях провоцируют боли в сердце, суставах, мышцах.
- Хрупкость костей. Патологические переломы костей.
- Понижение иммунной защиты организма. Характерны бактериальные трудно излечиваемые заболевания: бронхит, ангины, отит.
- Гиперкальциемия. Пациент предъявляет жалобы на запоры, тошноту, боли в животе, частое мочеиспускание, слабость, заторможенность.
- Патологическая нефропатия, которая сопровождается дизурическими расстройствами и проявлениями моче- и почечнокаменной болезни. При этом следует сказать, что не наблюдается отеков и гипертонического синдрома.
- Анемия и ее признаки: одышка, головокружение, бледность, сердцебиение, повышенная утомляемость.
- Нарушение свертываемости крови с образованием тромбов, тромбоцитопенией, множественными гематомами на слизистых и коже.
Заболеваемость хроническим идиопатическим миелофиброзом (ХМПЗ) составляет 0,3–0,7 случаев на 100 тысяч населения (1–2 случая на 1000000 населения) [3]. Отсутствует какая-либо приверженность к полу пораженных людей. Заболевание чаще поражает людей старше 60 лет, перенесших лучевые и токсические поражения эндогенного характера. Идиопатический миелофиброз – это неоплатическое заболевание крови, характеризующееся первичным поражением стволовой клетки, при котором происходит необъяснимое увеличение видоизмененных, неполноценных клеток крови при нарастающей тромбоцитопении, лейкоцитопении и эритроцитопении. Происходит замена костного мозга волокнистой нефункциональной тканью и формирование дефицита стволовых клеток. Начальный миелофиброз может протекать совершенно бессимптомно. Пациенты случайно узнают о подобном заболевании при обследовании по поводу другого недуга. Это обусловлено медленным развитием болезни. Развитие заболевания может длиться до 6–7 лет, при этом может быть изолированный лейкоцитоз, или эритроцитоз крови. Морфологическая картина костного мозга длительное время остается нормальной. Заболевание может проявляться неспецифической картиной: ночные поты, слабость, утомляемость, потеря аппетита, снижение массы тела, необъяснимый жар. При инструментальных методах обследования отмечается появление спленомегалии, гепатомегалии. В связи с этим при приеме пищи могут возникать вздутие живота, изжога, неприятные ощущения, отеки голеней и стоп. Лимфаденопатия проявляется редко. Тромбоз селезеночной вены и, как следствие, портальная гипертензия, асцит, варикозное расширение вен пищевода, является грозным осложнением при миелофиброзе. Спленомегалия может достигать крайних размеров, при этом нередко склоняются к удалению селезенки, как единственному возможному способу лечения. Остеосклероз является не редким проявлением миелофиброза. Синдром обусловлен нарушением функции остеокластов и остеобластов и отложением минералов на трабекулах костного мозга. При идиопатическом миелофиброзе мучительно может беспокоить сильный зуд в тепле, ломота в костях, явления подагры, судороги в икрах ног.
Прогрессирование миелофиброза устанавливается на основании клинико-лабораторных данных и информации о размерах селезенки. Важное значение имеют нарастающие симптомы анемии. При прогрессировании анемии и при нарастании спленомегалии прогноз отрицательный. Срок жизни пациента не может превышать 3 лет. Зачастую в 20–30 % случаев летальность наступает от острого лейкоза. Положительный прогноз для жизни пациента зависит от уровня гемоглобина в крови.
Течение миелофиброза принято разделять на 3 фазы:
- Пролиферативную фазу (раннюю).
- Фибротически-склеротическую фазу.
- Острый лейкоз (бластная фаза).
Хронический идиопатический миелофиброз вначале протекает с лейкоцитозом, эритроцитозом, приводящим к устойчивой анемии. Первая и вторая фазы являются хроническим заболеванием, наблюдается постепенное усиление лейкоцитоза.
Диагноз предполагает серьезный период лечения заболевания и проведение мероприятий, включенных в терапию. Среди возможных вариантов дифференциального диагноза необходимо различать:
1. Миелофиброз при разных опухолевых заболеваниях:
- Острая лейкемия.
- Хроническая миелоидная лейкемия.
- Болезнь Ходжкина.
- Лимфома.
- Множественная миелома.
- Метастатическая карцинома.
- Болезнь Вакеза (–Ослера).
2. Миелофиброз при заболевании не опухолевого характера, например:
- ВИЧ–инфекция
- Почечная остеодистрофия.
- Сифилис.
- Гиперпаратиоидизм.
- Ренальная остеодистрофия.
- Системная красная волчанка.
- Туберкулез.
- Гиповитаминоз D.
- Воздействие двуокиси тория.
- Синдром серых тромбоцитов.
Существуют различные идеи возникновения монотипных и сочетанных гематологических онкозаболеваний, в том числе и первичное бактериальное поражение стволовой клетки костного мозга. Расположившись в стволовых клетках костного мозга, паразитическая бактерия может нарушить нормальное развитие и функции многих клеток иммунитета, что проявляется в различных синдромах [5].
Сочетание гематологических опухолей встречается редко. В литературе встречаются единичные публикации [1].
Приводим наш клинический опыт диагностики и ведения пациента с редким сочетанием идиопатического миелофиброза и множественной миеломы.
Цель работы: отразить особенности диагностики и течения редкого сочетания ММ и ХМПЗ.
У больного З., 1939 г.р. с 2013 г. отмечается слабость, потливость, утомляемость. Ухудшение состояния с февраля 2015 г. стала нарастать слабость, одышка, боли за грудиной. Пациент госпитализирован в терапевтическое отделение ГБ №3 г. Красноярска с обострением ХОБЛ, ИБС. В гемограмме – гемоглобин 64 г/л, эритроциты 2,29*10 12 , лейкоциты 5,6*10 9 , тромбоциты 336*10 9 , СОЭ 35 мм/ч. Проводился онкопоиск, онкопатологии не найдено. Выявлено: дивертикулез дистального отдела толстого кишечника, с признаками дивертикулита, эмфизема, диффузный пневмосклероз, умеренно выраженная легочная гипертензия; атрофический гастрит. Результат компьютерной томографии – гепатоспленомегалия, жировой гепатоз, признаки вторичного поражения костей таза, позвоночника. УЗИ предстательной железы – структурные изменения, результат анализа крови на PSA в норме. УЗИ органов брюшной полости (ОБП) – печень 16,7*10,6*7,4см, селезенка 17,5*7,9см. Получал базисную терапию по сопутствующей патологии, препараты железа. Анемический синдром сохранялся. Обследован в Краевом онкологическом диспансере г. Красноярска – в гемограмме (10.06.15г.) – анемия: гемоглобин до 58 г/л, гипохромия, в формуле крови – бластов 5,0 %, миелоцитов 7,0 %, метамиелоцитов 14,0 %, палочкоядерных 9,0 %, сегментоядерных 50,0 %, эозинофилов 2,0 %, базофилов 1,0 %, лимфоцитов 7,0 %, моноцитов 5,0 %. В моче белок отсутствовал. При проведении позитронно-эмиссионной томографии (ПЭТ) (30.06.15 г.) было обнаружено наличие гиперметаболизма меченных позитрон-излучающих радио-фарм-препаратов (РФП) в грудине, в сочетании с изменениями в костной структуре в грудине и костях таза, что характерно для миеломной болезни.
В июле 2015 г. пациент амбулаторно был консультирован гематологом. В миелограмме (07.07.15 г.) – бластов 2,0 %, лимфоцитов 50,0 %, плазматических клеток 1,4 %. Заключение – костный мозг гипоклеточный, сужен красный росток. Тип кроветворения нормобластический. Созревание клеток не задержано. Скопления плазматических клеток не обнаружено. Электрофорез белков плазмы крови (09.07.15 г.) – М-градиент в G зоне и составляет 17,9 % (13,2г/л). В гемограмме стала нарастать анемия: гемоглобин 47 г/л, тромбоцитов 542 тыс. СОЭ 49 мм/ч. С диагнозом парапротеинемический гемобластоз (множественная миелома?) больной госпитализирован в гематологическое отделение ГБ №7. При госпитализации в гемограмме гемоглобин 43 г/л, эритроциты 1,5 млн, лейкоциты 4,7 тыс, сдвиг влево до миелоцитов и единичных бластов. Трепанобиопсия: иммуноморфологическая картина миелопролиферативного заболевания (первичного миелофиброза). Метастатическое поражение костного мозга, лимфопролиферативное заболевание и миеолодиспластический синдром – исключены. Иммунохимия сыворотки и мочи (16.07.15 г.) в сыворотке выявлен М-градиент в гамма фракции, который составляет 20,05 % от общего белка. При иммунофиксации обнаружен парапротеин G каппа. При электрофорезе белков мочи обнаружен белок Бенс-Джонса, представленный легкими цепями каппа, который составляет 20 % от общего белка мочи. Молекулярно-генетический анализ – мутация гена JAK2 – обнаружена, аллельная нагрузка 46,4 %. В генах CALR, MPL – мутации не обнаружена. Клон Пароксизмальной ночной гематурии (ПНГ) – не был обнаружен.
В результате дообследования диагностирован – Идиопатический миелофиброз (Наличие спленомегалии, в лейкоформуле сдвиг влево до миелоцитов и бластов, мутация гена JAK-2 с большой аллельной нагрузкой, данные трепанобиопсии), но наличие парапротеина G каппа в сыворотке крови и очаги деструкции при ПЭТ позволяют предположить и парапротеинемический гемобластоз.
На фоне гемотрансфузий состояние улучшилось, анемический синдром уменьшился, гемоглобин крови увеличился до 100 г/л.
В сентябре 2015 года при иммунохимическом исследовании белков сыворотки и мочи (г. Москва) выявлена моноклональная секреция Gk (10,4г/л) и белка Бенс-Джонса k (выделение с мочой – 0,21г/сут). Снижен уровень поликлонального IgG. Повышено содержание β2-микроглобулина. На КТ – в ключицах, грудине, ребрах, телах позвонков, лопатках, головках плечевых костей определяются множественные мелкие участки разрежения костной ткани по типу очагового остеопороза. Костно-травматических изменений не выявлено. В крестце, костях таза, головках бедренных костей определяются участки разрежения костной ткани по типу очагового остеопороза, в теле правой подвздошной кости более крупный участок размерами 15*11,6мм. В эпифизах большеберцовых и малоберцовых костей имеются множественные участки разрежения костной ткани по типу очагового остеопороза, без четких контуров, неправильной формы. Вновь усилился анемический синдром, тромбоциты, лейкоциты в пределах нормы, появился прежний сдвиг лейкоцитарной формулы влево: гемоглобин 57 г/л, эритроциты 2,03х10 12 , лейкоциты 8,38 х 10 9 , тромбоциты 135 х10 9 миелоциты 6,0 %, юные 70 %, палочкоядерные 18,0 %, сегментоядерные 31,б1 %, моноциты 11,0 % лимфоциты 26,0 %, СОЭ 75 мм/ч.
Выставлен клинический диагноз: Идиопатический миелофиброз, высокий риск по DIPSS. Парапротеинемический гемобластоз (множественная миелома с секрецией парапротеина Gk и белка из Бенс-Джонса k, IIIA ст, с остеодеструктивными изменениями в грудине, ребрах, позвонках, лопатках, головках плечевых костей, бедренных костей, костях таза, больше- и малоберцовых костях). Осложнения: Лейкозная интоксикация. Анемический синдром, средней тяжести. Тромбоцитопения без геморрагического синдрома.
Учитывая анемический синдром, перелита эритро-взвесь № 4 – 1265 мл, назначен преднизолон 40мг/сут № 10 с последующим снижением дозы до 15мг/сут, 6-меркаптопурин 50мг/сут гидроксикарбамид 1г/сутки. На фоне лечения получено клинико-гематологическое улучшение: анемический синдром уменьшился, геморрагического синдрома нет, улучшились показатели крови (Hb 83г/л, лейкоциты 13,2х10 9 , тромбоциты 49х10 9 , СОЭ 48 мм/ч).
Больной амбулаторно продолжал принимать преднизолон 15мг/сут., гидроксикарбамид 1г/сут.
В июле 2016 года проведен курс АР (алкеран 10мг/сут № 10, преднизолон 40 мг/сут № 4), стимуляторы эритропоэза, золидроновая кислота. Впоследствии амбулаторно продолжено лечение стимуляторами эритропоэза (эпоэтин альфа 10000 тыс. МЕ 3 раза в неделю), преднизолон 15 мг в сутки. В сентябре 2016 года в гемограмме пациента Нв 74г/л, эритроциты 2,68 млн., тромбоциты 114 тыс., лейкоциты 14,0 тыс., юные 6,0 %, палочкоядерные 8,0 %, сегментоядерные 63,0 %, лимфоциты 17,0 %, моноциты 6,0 %, СОЭ 30 мм/час. Мутация гена JAK2 в динамике – 36 %, М-градиент в G-зоне и составляет 15,2 % (10,9г/л), на УЗИ ОБП остается спленомегалия 18,9*9,0 см. В настоящее время продолжает получать стимуляторы эритропоэза, гидроксикарбамид 0,5мг в сутки. Клинически сохраняется умеренный анемический синдром, несмотря на заболевание, пациент вполне адаптирован.
Заключение
Необычная клиническая картина этого случая маскировала течение двух разных гематологических заболеваний, что затрудняло своевременное установление диагнозов и выбора метода лечения. При синхронном лечении обоих заболеваний наблюдается улучшение состояния больного.
Читайте также:
