Сигнальные последовательности связывания белков с эндоплазматическим ретикулумом (ЭПР)
Добавил пользователь Евгений Кузнецов Обновлено: 28.01.2026
• В клетке белки должны быть локализованы в сигнальных органеллах и мембранах
• Белки непосредственно поступают из цитозоля в несколько типов органелл
• Эндоплазматический ретикулум (ЭПР) представляет собой исходный компартмент, откуда белки вступают на путь секреции. ЭПР приспособлен к выполнению этой функции
• В некоторые органеллы и в плазматическую мембрану белки поступают по секреторному пути
Способность взаимодействовать с окружающей средой и реагировать на ее изменения имеет критическое значение для выживания и нормального функционирования клетки. В окружающей многоклеточный организм среде находятся питательные вещества, факторы роста, гормоны и другие метаболиты, под действием которых клетка может разделиться, вступить на путь дифференцировки или программированной гибели. Клетка должна чувствовать изменения в составе компонентов окружающей среды и реагировать на них соответствующим образом. В зависимости от своих нужд клетки меняют окружение.
Так, они могут секретировать белки, которые используются для построения или разрушения внеклеточного матрикса; могут передавать сигналы соседним клеткам при прямом контакте; а в многоклеточном организме некоторые клетки (например, эндокринные) секретируют гормоны, которые оказывают дистанционный эффект на другие клетки.
Основными посредниками клетки во взаимодействии с окружающей средой являются секреторные и трансмембранные белки. Эти белки синтезируются каждой клеткой, начиная от простейших бактерий до высокодифференцированных и специализированных клеток млекопитающих. Секреторные белки выходят во внеклеточную среду, а трансмембранные белки остаются в плазматической мембране, причем одна их часть контактирует с внешней средой, а другая остается внутри клетки.

Электронная микрофотография содержимого клетки печени.
Показаны характерные для эукариотической клетки органеллы, содержащие мембрану и обладающие различной плотностью.
Видны ядро, митохондрии, лизосомы, пероксисомы и гранулярный эндоплазматический ретикулум.
Фотография любезно предоставлена Дэниелем С. Френдом.
Необходимость полного или частичного транспорта некоторых белков через плазматическую мембрану создает для клетки проблему их отбора. В клетке белки образуются на рибосомах, в цитоплазме. Поэтому должен существовать механизм селективного отбора и транспорта к плазматической мембране только секреторных и трансмембранных белков. У бактерий селективный отбор при транспорте происходит только на белки, входящие в состав плазматической мембраны и не входящие в нее. В клетках эукариот проблема носит более сложный характер.
В то время, как типичная прокариотическая клетка имеет плазматическую мембрану и не обладает внутриклеточными органеллами, клетки эукариот содержат многочисленные структуры, окруженные мембранами, такие как ядра, митохондрии, хлоропласты (у растений), пероксисомы, эндоплазматический ретикулум (ЭПР), аппарат Гольджи и лизосомы.
Для каждой из этих органелл характерен уникальный набор белков. Таким образом, наряду со способностью выделять секреторные и трансмембранные белки, эукариотическая клетка также должна безошибочно узнавать белки органелл. В типичной клетке органеллы занимают примерно половину общего объема. Это означает, что большая часть белков, синтезирующихся в каждый данный момент времени, должна быть селективно локализована в одной из этих органелл.
Каким образом белки локализуются в органеллах? Обычно для направления белка к специфической органелле клетка использует адресные сигналы, которые представляют собой дискретные последовательности аминокислот в составе его первичной структуры. Характер сигнала определяет органеллу, к которой должен быть направлен белок, и эта органелла имеет аппарат специфического распознавания на белке соответствующего сигнала. Если белок синтезировался без адресного сигнала, то он остается в цитозоле.
Белки некоторых органелл (митохондрий, хлоропластов, ядра и пероксисом) транспортируются из цитозоля после окончания синтеза на рибосомах. Однако для других органелл (ЭПР, аппарат Гольджи, лизосомы и плазматическая мембрана) процесс протекает более сложно. Процесс транспорта белка через эти органеллы вместе с самими органеллами называется секреторный путь. Непосредственно белки не поступают в аппарат Гольджи, лизосомы и плазматическую мембрану. Вместо этого все белки, подлежащие секреции, или предназначенные для этих содержащих мембраны структур вначале проходят через мембрану ЭПР.
Там они приобретают нативную трехмерную структуру, обычно подвергаются ковалентной модификации, и образуют комплексы с другими белками. Затем эти комплексы попадают в аппарат Гольджи, а оттуда или назад, в ЭПР, или далее, в лизосомы и плазматическую мембрану. Перемещение белков между органеллами секреторного пути происходит с участием мелких везикул, которые отпочковываются от мембраны исходной органеллы и сливаются с мембраной органеллы назначения, высвобождая в нее белковое содержимое.
Важнейшая особенность секреторного пути состоит в том, что люмен (внутреннее содержимое) этих органелл по составу напоминает внеклеточное окружение. (Считается, что органеллы возникли в результате инвагинаций плазматической мембраны, специализированной на секреции белка, которые впоследствии превратились в везикулы.) В клетке, секретируемые белки способны принимать нативную структуру, причем это происходит в условиях, близких к тем, в которых они в конце концов должны функционировать.
В отдельных статьях на сайте рассмотрены начальные процессы, которые обеспечивают позиционирование белков на различных органеллах и мембранах внутри клетки. Поскольку почти все белки синтезируются в цитозоле, эти процессы происходят в мембранах органелл, непосредственно импортирующих белки, а именно в мембранах ЭПР, митохондрий, хлоропластов и пероксисом. К числу таких процессов относится узнавание белков, которые, в отличие от других белков цитозоля, должны быть импортированы в органеллу. В дальнейшем эти белки становятся интегральными белками мембраны или транспортируются через нее. Этот процесс известен как транслокация (перенос) белка.
В отдельных статьях на сайте также освещается особая роль, которую играет ЭПР в подготовке белков для экспорта по секреторному пути, и другие функции ЭПР. Вопросы, связанные с транспортом белков по секреторному пути и с их сортировкой в аппарате Гольджи перед адресной доставкой, рассматриваются в отдельных статьях на сайте.
Секреция белков начинается с их адресования и транслокации через мембрану гранулярного эндоплазматического ретикулума.
После формирования нативной структуры и посттрансляционных модификаций белки выходят из ЭПР в везикулах, связывающихся с аппаратом Гольджи.
Большая часть белков переносится из аппарата Гольджи к клеточной поверхности в секреторных везикулах. Органеллы секреторного пути могли возникнуть при интернализации участка плазматической мембраны,
обладающей функцией секреции белка.
В клетках эукариот белки непосредственно не секретируются через плазматическую мембрану,
а транспортируются в люмен ЭПР, который по составу напоминает внешнее окружение клетки.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Сигнальные последовательности связывания белков с эндоплазматическим ретикулумом (ЭПР)
• Адресование белка на ЭПР обеспечивается сигнальной последовательностью, представляющей собой короткую цепочку остатков аминокислот, расположенную обычно с N-концевой стороны
• Единственной особенностью, общей для всех сигнальных последовательностей, является наличие центрального гидрофобного внутреннего участка. Обычно этого участка оказывается достаточно для транслокации любого белка
Все белки, структура которых закодирована в ядре, начинают свой биогенез в цитозоле. Первым этапом транслокации белков через мембрану ЭПР, который необходимо преодолеть, является адресование. Он заключается в том, чтобы доставить секреторные и мембранные белки, но не белки цитозоля, к местам их транслокации на ЭПР. В клетке эти белки узнаются по последовательности, присутствующей во вновь синтезированном белке.
Эта последовательность направляет белок к мембране ЭПР и обычно удаляется после того, как он позиционировался.
Представление о том, что белок может позиционироваться на ЭПР за счет последовательности аминокислот, получило название сигнальной гипотезы. Эта гипотеза была предложена в середине 1970-х гг. в результате проведения классических экспериментов, которые впервые продемонстрировали, как клетки направляют белки к специфическим компартментам. Было показано, что синтез секреторного белка начинается в цитозоле с наращивания аминокислот на N-конце.

Сигнальные последовательности были обнаружены в экспериментах по синтезу секреторных белков в бесклеточной системе in vitro.
При этом образовывались более крупные белки, которые при гель-электрофорезе мигрировали с меньшей скоростью (дорожка 1).
В клетке синтезировались белки меньшего размера (дорожка 2).
Если белки синтезировались в присутствии очищенных препаратов ЭПР in vitro,
то они обладали меньшими размерами (дорожка 3) и были способны к переносу через очищенные препараты ЭПР.
Отщепление этого участка от белка происходит только после того, как белок связался с ЭПР, но до окончания его синтеза. Эти аминокислоты удаляются при транспорте белка через мембрану, поскольку не содержащий их белок обнаруживается только внутри ЭПР и не присутствует в цитозоле.
Напротив, как показывают результаты другого эксперимента, если секретируемый белок синтезируется in vitro, в отсутствие ЭПР, то такие аминокислоты не удаляются. Таким образом, согласно представлениям сигнальной гипотезы, наращивание аминокислот позволяет насцентным белкам позиционироваться на ЭПР, а после начала транслокации эти аминокислоты удаляются. Гипотеза также предполагала, что дополнительные аминокислоты находятся в структуре всех секреторных и мембранных белков, но отсутствуют в белках цитозоля. В дальнейшем все эти предположения подтвердились.
Дополнительные аминокислоты, находящиеся в составе первичной структуры белка, сейчас называются сигнальными последовательностями, и их существование, действительно, представляет собой универсальный механизм адресования новообразующихся секреторных и мембранных белков. В большинстве случаев сигнальные последовательности отщепляются от пребелков, давая зрелые белки, которые транспортируются по секреторному пути.
К числу наиболее удивительных особенностей сигнальных последовательностей относится их разнообразие. Единственный для них общий элемент представляет собой центральный участок, состоящий из 6-20 гидрофобных аминокислот, состав которого для разных белков различен. Большинство сигнальных последовательностей на N-конце также содержат несколько полярных аминокислот. Обычно за гидрофобным доменом расположена С-терминальная область полярных аминокислот, где отщепляется сигнальная последовательность. Однако, строго говоря, ни один из этих полярных доменов не является абсолютно необходимым в адресовании.
В качестве сигнальных могут выступать различные последовательности аминокислот, удовлетворяющие вышеприведенным характеристикам. Тем не менее, несмотря на разнообразие, по способности позиционировать белки на ЭПР и обеспечивать их транлокацию, сигнальные последовательности более или менее взаимозаменяемы. Так, сигнальная последовательность одного белка обычно может быть заменена последовательностью другого, причем это не сказывается на способности белка к адресованию и переносу. Аналогичным образом, присоединение к обычно цитозольному белку сигнальной последовательности вызывает его транслокацию.
Удивительно, что такая кажущаяся неспецифической последовательность аминокислот обеспечивает высокую специфичность процесса адресования.

Сигнальные последовательности, направляющие белки в ЭПР, различаются по длине и составу аминокислот.
Общая черта, присущая всем сигнальным последовательностям - наличие протяженного центрального региона,
который, преимущественно, содержит остатки гидрофобных аминокислот, и часто фланкирован заряженными аминокислотами.
Транспорт белков через эндоплазматический ретикулум (ЭПР) и аппарат Гольджи
Основные положения:
• Все белки, локализованные в ЭПР, аппарате Гольджи или в плазматической мембране, при синтезе вначале связываются с ЭПР.
• Белки переносятся из одного компартмента в другой при участии мембранных везикул, которые отпочковываются от поверхности одной мембраны и сливаются с поверхностью следующей.
• Транспорт белков из окружающей среды в клетку происходит в обратном направлении при участии везикул.
Интеграция белка в мембрану или его трансмембранный транспорт являются своеобразными событиями. Если белок должен пройти через несколько мембран, то его связывание с мембраной происходит на начальном этапе процесса транспорта. После этого он остается в мембранном окружении и транспортируется от одной мембраны к другой в везикуле.
Это, например, характерно для белков, исходно ассоциированных с ЭПР, но в конце высвобождающихся из плазматической мембраны. Аналогичная система используется для транспортировки белков как из клетки, так и в клетку.
Экзоцитоз представляет собой процесс, посредством которого белки транспортируются к плазматической мембране или во внеклеточную среду (обзор путей экзоцитоза).
Некоторые белки секретируются конститутивно, т. е. после синтеза они всегда выходят из клетки. Другие, продуцируемые некоторыми специализированными клетками, например пищеварительные ферменты, выходят только после получения клеткой соответствующего сигнала.
При попадании в ЭПР белок остается в мембране или в люмене до тех пор, пока он не переместится в другую часть системы с участием везикул, или не поступит обратно в цитозоль, где подвергнется деградации.
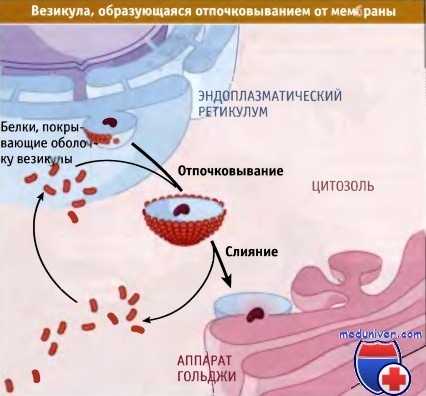
Перенос белков между компартментами,
ограниченными мембраной, происходит при отпочковывании от одного компартмента везикулы,
содержащей белки, и последующим ее слиянием с мембраной другого компартмента.
Транспортные везикулы представляют собой мелкие пузырьки (обычно 100-200 нм в диаметре), которые образуются при «отпочковывании» от мембраны (представления о везикулярном транспорте белков). Пузырек отпочковывается от поверхности одной мембраны и мигрирует к другой мембране, с которой он сливается.
Транспортные пузырьки называются окаймленными везикулами, поскольку их мембрана окружена белковой оболочкой. Различные типы везикул различаются между собой по составу оболочки, которая участвует в позиционировании и отборе транспортируемых белков.
Растворимые белки переносятся из донорного в акцепторный компартмент, находясь внутри везикулы; а мембранные белки переносятся в составе мембраны везикулы. Это означает, что белок может транспортироваться из ЭПР в аппарат Гольджи сквозь стопки Гольджи и к плазматической мембране.
Импорт белков в клетку также происходит с участием окаймленных везикул. Они образуются на плазматической мембране и поступают в клетку; этот процесс носит название эндоцитоз. Эндоцитоз происходит по тому же механизму, что и экзоцитоз, но протекает в обратном направлении.
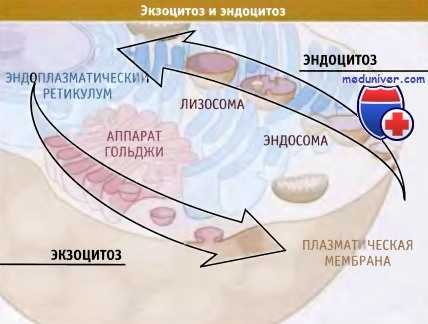
Транспортные везикулы перемещают белки через ЭПР,
аппарат Гольджи и плазматическую мембрану.
Везикулы, которые отпочковываются от плазматической мембраны, включают материал из внеклеточной среды и возвращают его в плазматическую мембрану. Везикулы, которые осуществляют эндоцитоз, отличаются от везикул экзоцитоза составом белковой оболочки.
Некоторые патогенные микроорганизмы поникают в клетку хозяина посредством эндоцитоза; действительно, митохондрии и хлоропласта своим происхождением обязаны эндоцитозу. На рисунке ниже представлены аналогичные механизмы для транспорта вновь синтезированных белков по механизму экзоцитоза и для импорта белков в клетку по механизму эндоцитоза.
В каждом случае белок может транспортироваться при прохождении серии событий отпочковывания и слияния по мере того, как он мигрирует с поверхности одной мембраны на другую.
Один из результатов этого процесса состоит в том, что по мере протекания процессов отпочковывания и слияния происходит постоянное перемещение компонентов от одной мембраны к другой. С количественной точки зрения, при экзоцитозе переносится больше материала, чем при эндоцитозе, и прямой (антероградный) транспорт приводит к сплошному потоку липидов от ЭПР к плазматической мембране. За счет ретроградного транспорта, пустые везикулы возвращают липиды обратно в мембраны. Это обеспечивает целостность мембран.
Везикулярный транспорт белков представляет собой высокоспецифичный процесс. Основной принцип отбора состоит в том, что белок узнается по наличию специфического сигнала (чаще всего это короткая последовательность аминокислот) и включается в везикулу для дальнейшего транспорта. При отсутствии такого сигнала белок остается в компартменте, в котором он находится, или же продвигается медленнее. Отпочковывающиеся везикулы могут селективно включать белки, подлежащие транспорту, оставляя на местах резидентные белки органеллы.
• Сигнальные последовательности адресуют новообразующиеся (синтез которых начался и еще не завершился), секреторные и мембранные белки в ЭПР для последующей транслокации
• Белки транспортируются через мембрану ЭПР по водным каналам, которые могут открываться и закрываться
• Секреторные белки полностью проходят через мембрану ЭПР; трансмембранные белки в нее интегрируются
• Перед выходом из ЭПР белки модифицируются и приобретают нативную конформацию при участии ферментов и шаперонов, содержащихся в люмене
При направлении новообразующихся (насцентных) белков на секреторный путь в клетке возникают следующие проблемы. Во-первых, эти белки должны узнаваться и располагаться в определенных местах транслокации на мембране ЭПР. Этот процесс известен под названием адресование (таргетинг) белка. Далее, они должны либо полностью (в случае растворимых белков), либо частично (в случае мембранных белков) проникать через мембрану ЭПР.
При этом между люменом эндоплазматического ретикулума (ЭПР) и цитозолем не должен происходить обмен другими молекулами. Наконец, после транслокации все белки должны приобрести нативную структуру, а во многих случаях они также должны быть модифицированы или объединены в комплексы с другими белками в люмене ЭПР. В настоящем разделе рассматриваются все эти вопросы.
Эндоплазматический ретикулум (ЭПР) представляет собой лишь одну из нескольких мембранных органелл адресной доставки. К числу остальных относятся митохондрии, хлоропласты, пероксисомы и ядро. Белки, которые предназначены для функционирования в составе ЭПР, должны отличаться от белков, поступающих в другие органеллы или остающихся в цитозоле. В клетке все эти белки различаются с помощью сигнальных последовательностей. Они представляют собой последовательности аминокислот в составе первичной структуры белка, которые узнаются специальным механизмом, расположенном на органелле-мишени.
Как иллюстрирует рисунок ниже, с помощью сигнальных последовательностей белки направляются к определенным органеллам по тому же принципу, как сортируется корреспонденция с использованием почтового кода, и для каждой органеллы используется свой тип сигнальной последовательности.
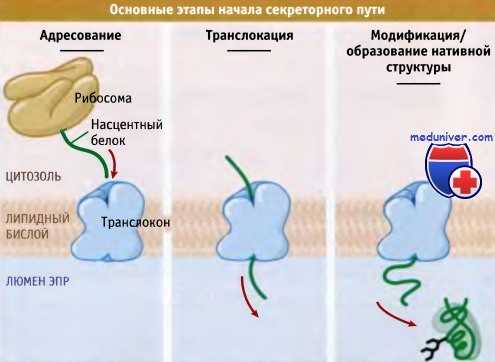
Три основных процесса, затрагивающих ново-образующиеся секреторные и мембранные белки в ЭПР:
1) адресование,
2) транслокация и
3) образование нативной структуры и модификация.
Механизм, позволяющий идентифицировать сигнальную последовательность для эндоплазматического ретикулума (ЭПР), определяет способ переноса белка. Наиболее распространенной формой переноса белка в ЭПР является котрансляционный перенос. Эта транслокация происходит во время синтеза белка на рибосомах, связанных с мембраной ЭПР. Она начинается после того, как сигнальная последовательность узнается в цитозоле особым комплексом, известным под названием сигнал-распознающая частица, или SRP.
SRP соединяется с сигнальной последовательностью и позиционирует белок и синтезирующую его рибосому на ЭПР. Это осуществляется за счет взаимодействия с рецептором (белком, который специфически связывается с SRP), расположенным на мембране ЭПР. Однако некоторые сигнальные последовательности ЭПР не взаимодействуют с SRP. Поэтому такие белки транслоцируются посттрансляционно, после завершения своего синтеза в цитозоле. Различные клетки в разной степени используют эти две формы транслокации белков.
В клетках млекопитающих, в большинстве случаев происходит котрансляционный перенос, а у более простых эукариот, например у дрожжей Saccbaromyces cerevisiae, используются обе формы.
Когда белок позиционируется на эндоплазматический ретикулум (ЭПР), он должен пройти через липидный бислой, окружающий органеллу. Это осуществляется по каналу, который представляет собой водный путь через гидрофобную мембрану. Канал, вместе с ассоциированными белками, называется транслокон. Такое название подчеркивает сложный, интегральный характер этой транслокационной машины. Функционирование канала обеспечивается воротным механизмом, т. е. он открывается только в момент переноса образующегося (насцентного) белка. Воротный механизм также предотвращает прохождение через канал других метаболитов, например небольших молекул, ионов и других белков, и обеспечивает возможность для цитозоля и внутренней части ЭПР существовать как отдельные компартменты.
Каким образом осуществляется воротный механизм? Сигнальная последовательность цепи ново-образующегося белка взаимодействует с белками канала. Это вызывает конформационные изменения и открытие канала, причем белковая цепь начинает проникать вглубь поры. Канал открывается только после позиционирования транспортируемого белка и не реагирует на цитозольный белок, случайно оказавшийся на мембране ЭПР. Важно также, что он открывается настолько, чтобы пропустить белковую цепь в развернутом состоянии и при этом не дать возможность другим молекулам одновременно пройти через канал. Поскольку канал контролируется самой новообразующейся полипептидной цепью, то в ее отсутствие он остается закрытым. Тем самым постоянно поддерживается барьер, создаваемый мембраной ЭПР.
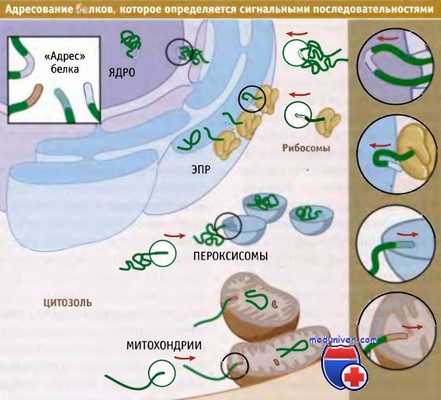
Сигнальные последовательности, специфические для каждой органеллы,
обеспечивают белкам возможность адресно распределяться по клетке.
Белки, которые синтезируются без сигнальной последовательности, остаются в цитоплазме.
К началу транслокации насцентные трансмембранные белки должны быть отсортированы от белков, которым необходимо пройти через канал полностью. Подобно узнаванию сигнальной последовательности, эта сортировка осуществляется самим каналом. Транспорт через липидный бислой прекращается, когда трансмембранный домен, который должен представлять собой гидрофобный сегмент, интегрированный в липидный бислой, узнается транслоконом и перемещается из канала в липидный бислой в латеральном направлении. Для одного полипептида этот процесс может повторяться много раз, и благодаря ему возникает сложная топология мембранных белков многократно пронизывающих мембрану (топология относится к ориентации белка по отношению к мембране).
Для секреторных и трансмембранных белков перенос сопровождается модификацией полипептидной цепи. Например, большая часть сигнальных последовательностей удаляется на ранних этапах транслокации. Ко многим белкам после переноса присоединяются углеводные остатки. Часть белков расщепляется перед окончанием транслокации, и продукты расщепления ковалентно связывается с фосфолипидами.
Наконец, после транслокации, каждый белок должен приобрести нативную структуру. Это обеспечивается несколькими белками, содержащимися в ЭПР. Некоторые из них, называемые молекулярными шаперонами, связываются с новообразующимися белками и предупреждают образование неправильной структуры или их агрегацию. Другие способствуют образованию дисульфидных связей, обеспечивающих нативную структуру, или облегчают сборку мультимерных комплексов.
Вместе все они образуют систему контроля качества, которая обеспечивает образование правильной нативной структуры белков и их сборку в ЭПР. С системой контроля качества тесно связана система ретроградной транслокации, которая узнает белки с неправильной структурой и возвращает их в цитозоль для деградации. Только после прохождения всех стадий контроля качества секреторные и мембранные белки могут покинуть ЭПР и транспортироваться дальше по секреторному пути к местам конечной локализации.
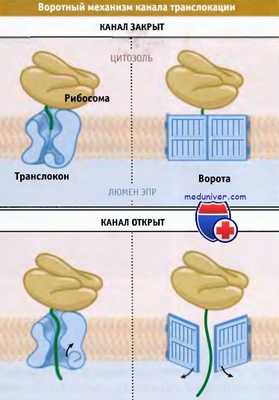
Канал транслокона функционирует как ворота, которые обычно закрыты,
но открываются в присутствии субстрата транслокации.
Ворота открываются лишь настолько, чтобы дать возможность проникнуть белковой цепи.
Контртрасляционная транслокация белков в полость эндоплазматического ретикулума
Транспорт белков в ЭПР осуществляется по мере их синтеза, так как рибосомы, синтезирующие белки с сигнальной последовательностью для ЭПР, «садятся» на специальные транслокационные комплексы на мембране ЭПР. Сигнальная последовательность для ЭПР включает обычно 5-10 преимущественно гидрофобных аминокислот и расположена на N-конце белка. В ее удаленном от конца части имеется консенсусная последовательность, узнаваемая специфической протеазой. Эта сигнальная последовательность опознаётся специальным комплексом — «опознающей сигнал частицей» (signal-recognition particle, SRP). В состав SRP входит шесть белков и короткая молекула РНК [1]. Один участок SRP связывает сигнальную последовательность, а другой связывается с рибосомой и блокирует трансляцию. Отдельный домен SRP отвечает за связывание с SRP-рецептором на мембране ЭПР.
Вместе с SRP рибосома перемещается к ЭПР и связывается с рецептором SRP (интегральным белком) на цитозольной стороне мембраны ЭПР. Этот комплекс (рибосома — SRP — рецептор SRP) связывается с порой — транслокатором белка на мембране ЭПР. Обычно с мРНК связаны несколько рибосом, и на мембране ЭПР сидят полирибосомы, причем каждая рибосома присоединена к своей поре. Дойдя до 3'-конца мРНК, рибосома возвращается в цитоплазму, однако мРНК удерживается у мембраны ЭПР за счет того, что новые рибосомы, вязанные с SRP, присоединяются к ее 5'-концу.
После связывания с транслокатором комплекс SRP — рецептор SRP отделяется от рибосомы, и это приводит к возобновлению трансляции. Сейчас доказано, что белок по мере трансляции проникает в ЭПР через водный канал транслокатора, имеющий воротный механизм и сформированный у эукариот четырьмя субъединицами комплекса Sec61 (гомологичные белки есть и на мембранах бактериальных клеток).
После возобновления трансляции гидрофобный участок сигнальной последовательности остается связан с транслокатором, а вновь синтезируемый белок в виде петли проталкивается внутрь ЭПР. Этот процесс не требует дополнительных затрат энергии АТФ. После того, как С-конец белка отделяется от рибосомы и оказывается внутри ЭПР, протеаза сигнального пептида отрезает его от белка. Белок внутри ЭПР сворачивается, приобретая нормальную конформацию, а сигнальный пептид через открывшийся в транслокаторе боковой канал перемещается в липидный бислой мембраны ЭПР, где быстро разрушается протеазами.
Попавший в ЭПР белок остается в этой органелле, если имеет специальную «удерживающую в ЭПР» (ER-retaining) последовательность из четырех аминокислот на С-конце. Некоторые из остающихся в ЭПР белков играют важную роль в сворачивании и посттрансляционной модификации проходящих через ЭПР белков. Так, фермент дисульфид-изомераза катализирует окисление свободных SH-групп цистеина и образование дисульфидных связей, в белок-шаперон BiP препятствует неправильному сворачиванию и агрегации белков до образования ими четвертичных структур, а также способствует удержанию связанных с ним белков в ЭПР.
SPR-частица и ее рецептор
Частица, распознающая сигнал, связывается с сигнальным пептидом, как только он "сходит" с рибосомы. Это приводит к временной остановке синтеза белка. Возникшая пауза в трансляции , вероятно, дает возможность рибосоме связаться с мембраной ЭР до того, как синтез полипептидной цепи будет завершен. Благодаря этому ненужного высвобождения белка в цитозоль не происходит.
Пауза в трансляции длится до тех пор, пока захватившая рибосому частица не свяжется с SRP-рецептором , находящемся на цитоплазматической стороне мембраны шероховатого ЭР . Он взаимодействует с SRP-связанными рибосомами таким образом, что частица меняет свое положение, и трансляция возобновляется. Одновременно рибосома связывается с мембраной ЭР, и растущая на ней полипептидная цепь переносится к системе транслокации в мембране. Эта система изучена плохо, известно только, что она включает белок-рецептор второго сигнального пептида, отличающийся от SRP. По- видимому, ее роль заключается в связывании рибосомы, на которой синтезировался сигнальный пептид ЭР, с мембраной ЭР; участвует она и в последующем переносе белка через мембрану.
Читайте также:
