Синдром Ашермана. Диагностика и лечение
Добавил пользователь Владимир З. Обновлено: 30.01.2026
Статья посвящена синдрому Ашермана (СА), или так называемым внутриматочным синехиям, характеризующимся образованием спаек и выростов эндометрия с его последующими склерозом и фиброзом. Заболевание осложняется нарушениями менструальной и детородной функций.
В статье подробно рассмотрены причины заболевания: предшествующие механические травмы базального эндометрия, задержка плодных оболочек после родов или самопроизвольного аборта. Описаны методы диагностики СА: УЗИ органов малого таза, гидросонография, гистеросальпингография, отдельное внимание уделено «золотому стандарту» диагностики внутриматочных синехий – гистероскопии.
Методы лечения СА, представленные в статье, направлены на малотравматичное устранение внутриматочных сращений с последующим восстановлением менструальной функции и фертильности; лечение проводится поэтапно. Используемые методики включают в себя: хирургическое рассечение спаек под визуальным контролем при проведении гистероскопии; дальнейшее назначение циклической гормонотерапии эстрогенами и гестагенами, направленной на стимуляцию восстановления эндометрия и его циклической трансформации; антибактериальную терапию при инфекционной этиологии заболевания. Отдельное внимание уделено противорецидивной профилактике противоспаечным гелем, содержащим гиалуроновую кислоту и карбоксиметилцеллюлозу, в частности, изделию медицинского назначения Антиадгезин, который вводят в полость матки после операции.
В статье приведены клинические примеры пациенток с СА, которым было успешно проведено комплексное лечение.
Ключевые слова: синдром Ашермана, внутриматочные синехии, гистероскопия, Антиадгезин.
Для цитирования: Макаренко Т.А., Никифорова Д.Е. Современные возможности в лечении синдрома Ашермана // РМЖ. 2016. № 15. С. 1001–1004.
Для цитирования: Макаренко Т.А., Никифорова Д.Е. Современные возможности в лечении синдрома Ашермана. РМЖ. Мать и дитя. 2016;24(15):1001-1004.
Modern opportunities in treatment of Asherman syndrome
Makarenko T.A., Nikiforova D.E.
Krasnoyarsk State Medical University named after professor V.F. Voyno-Yasenetsky
The paper addresses Asherman syndrome, or so-called intrauterine adhesions, characterized by formation of endometrial adhesions and outgrowths with subsequent sclerosis and fibrosis. The disease is complicated by disorders of menstrual and reproductive functions.
The paper also discusses causes of the disease (previous mechanical injury of basal endometrium, retention of membranes after childbirth or miscarriage) as well as methods of diagnosis ( pelvic ultrasound, hydrosonography, hysterosalpingography). Special attention is paid to the "gold standard" for intrauterine adhesions diagnosis - hysteroscopy.
Methods of Asherman syndrome's treatment are aimed at low traumatic stepwise removal of intrauterine adhesions, followed by restoration of menstrual function and fertility. Useful techniques include: surgical dissection of adhesions under visual control during hysteroscopy; further prescription of cyclic hormone therapy with estrogen and progestin, aimed at stimulating endometrium recovery and its cyclic transformation; antibacterial therapy in case of infectious etiology of the disease. Special attention is paid to antireccurent prevention with gelatinous excipients, particularly Antiadgezin, that is administered into uterine cavity after surgery.
Clinical cases of patients with Asherman syndrome after successful complex treatment are presented.
Key words: Asherman syndrome, intrauterine adhesions, hysteroscopy, Antiadgezin.
For citation: Makarenko T.A., Nikiforova D.E. Modern opportunities in treatment of Asherman syndrome // RMJ. 2016. № 15. P. 1001–1004.
Статья посвящена современным возможностям в лечении внутриматочных синехий (синдрома Ашермана)
Внутриматочные синехии, или синдром Ашермана (СА), — патологическое состояние, характеризующееся образованием спаек и выростов эндометрия с его склерозом и фиброзом. Заболевание названо в честь Д. Ашермана – гинеколога, подробно описавшего и исследовавшего данную патологию. Внутриматочные спайки (синехии) представляют собой соединительнотканные сращения, спаивающие стенки матки и вызывающие ее деформацию. При наличии синехий нормальный эндометрий подвергается атрофической трансформации [1].
Истинное понятие СА включает в себя нарушение менструальной (гипоменорея, аменорея) и детородной функций, обусловленное наличием внутриматочных синехий [2]. Основными клиническими проявлениями этой патологии являются: альгодисменорея, гипоменорея, в тяжелых случаях – аменорея; гематометра, или гематосальпингс; привычное невынашивание беременности, повторные выкидыши, вторичное бесплодие. СА может сопутствовать эндометриоз различной степени тяжести [3]. В 61,5% случаев внутриматочные синехии являются причинами бесплодия [4]. Бесплодие и гипоменорея – наиболее частые клинические проявления СА (55,1% и 32,1% случаев соответственно) [4].
Наиболее частой причиной СА служат предшествующие механические травмы базального эндометрия. Травмирование эндометрия может происходить вследствие хирургического прерывания беременности, использования внутриматочных контрацептивов, диагностических выскабливаний полости матки при маточных кровотечениях или полипах эндометрия, операций на полости матки (миомэктомия, метропластика, конизация шейки матки). Повреждение эндометрия может усугубляться присоединением инфекции во время раневой фазы с развитием эндометрита [5]. Чем больше период задержки плодных оболочек после родов или выкидыша, тем выше вероятность возникновения заболевания. Также имеет значение число процедур: после однократного выскабливания полости матки риск составляет около 16%, а 3 и более процедуры увеличивают вероятность возникновения СА до 32% [3].
В диагностике внутриматочных синехий данные гинекологического исследования неспецифичны. УЗИ малого таза при СА малоинформативно: эхоскопическая картина может быть представлена нечеткими контурами эндометрия, в случае гематометры – анэхогенным образованием в полости матки. Проведение гидросонографии позволяет более четко определять наличие внутриматочных сращений. Гистеросальпингография выявляет одиночные либо множественные дефекты наполнения, имеющие лакунообразную форму и различные размеры. При плотных множественных внутриматочных синехиях полость матки на рентгенограмме выглядит многокамерной, с мелкими, соединяющими отдельные камеры протоками. Однако нередко гистеросальпингография сопровождается ложноположительными результатами из-за наличия в матке слизи, искривлений, обрывков эндометрия.
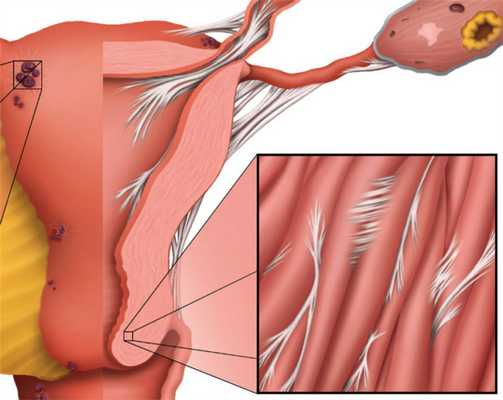
«Золотым стандартом» диагностики внутриматочных синехий является гистероскопия. При гистероскопии внутриматочные синехии определяются как белесоватые бессосудистые тяжи разной плотности и длины, соединяющие стенки матки, обнаруживается облитерация или деформация полости матки.
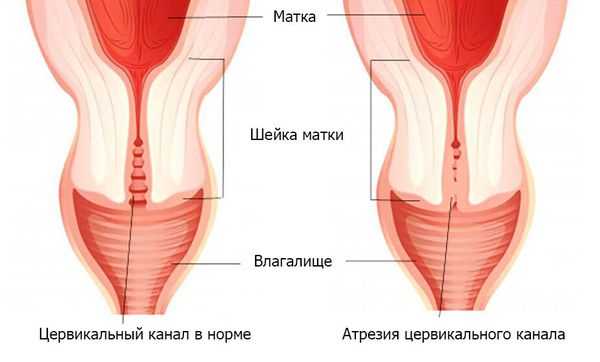
Целью лечебных мероприятий при СА служит малотравматичное устранение внутриматочных сращений с последующим восстановлением менструальной функции и фертильности. На первом этапе показано проведение гистероскопии с целью рассечения спаек под визуальным контролем. Во избежание перфорации матки рекомендуется использовать тонкие офисные гистероскопы, т. к. у таких пациенток имеется полная или частичная атрезия цервикального канала, которая делает невозможными любые хирургические манипуляции без предварительного рассечения синехий цервикального канала при помощи эндоскопических ножниц.
Разделение синехий в зависимости от их плотности производится тубусом гистероскопа, эндоскопическими ножницами, щипцами, гистерорезектоскопом, лазером. Нельзя разрушать синехии вслепую при помощи выскабливания стенок полости матки и цервикального канала кюреткой, т. к. это наносит дополнительную травму уже скомпрометированного эндометрия! Для исключения перфорации матки используется контроль с помощью УЗИ или лапароскопии.
После операционного этапа пациентке с СА назначается циклическая гормонотерапия эстрогенами и гестагенами, направленная на стимуляцию восстановления эндометрия и его циклической трансформации. Назначение комбинированных оральных контрацептивов при этой патологии нецелесообразно, поскольку данная группа препаратов способствует атрофическим изменениям эндометрия.
При инфекционной этиологии СА производится бактериологическое и вирусологическое исследование содержимого полости матки (биоптат, материал вакуумной биопсии) с последующей антибактериальной терапией.
Даже после самого грамотного (бережного и тщательного разрушения) внутриматочных синехий риск рецидивов остается высоким. Средняя частота возникновения рецидива после оперативного лечения внутриматочных синехий – 28% [1].
Для профилактики рецидива в полость матки после операции вводят гелеобразные наполнители, препятствующие контакту стенок и образованию спаек. Примером такого противоспаечного барьера может служить изделие медицинского назначения Антиадгезин (АО «Нижфарм»), представляющий собой гель из высокоочищенной натриевой соли гиалуроновой кислоты, полученной без использования генномодифицированных микроорганизмов [6]. Терапевтический эффект геля Антиадгезин связан с созданием искусственного временного барьера между поврежденными тканями, что обеспечивает эффективное разделение поверхностей на время их заживления. После аппликации геля Антиадгезин в области операционного поля он прилипает к анатомическим поверхностям, не растекаясь, и образует вязкое смазывающее покрытие, которое обеспечивает скольжение соседних поврежденных поверхностей и предупреждает их слипание. Антиадгезин является биодеградируемым покрытием, которое разделяет соприкасающиеся поверхности только на период критической фазы раневого заживления и послеоперационного спайкообразования, продолжающийся в течение 7 дней, не влияя при этом на нормально протекающие процессы регенерации. После применения гель полностью рассасывается [6].
Средние показатели эффективности лечения коррелируют с частотой наступления беременности. При легкой степени заболевания беременность наблюдается у 93% пациенток, при средней — у 78%. Лечение тяжелой степени СА дает возможность забеременеть 57% женщин. Однако рождение здорового ребенка наблюдается в 81, 66 и 32% случаев соответственно тяжести заболевания [1].
Таким образом, внутриматочные синехии и СА как крайне тяжелый их вариант являются многокомпонентной проблемой, требующей комплексного подхода. Тактика ведения таких женщин должна включать диагностический модуль (с использованием преимущественно тонких офисных гистероскопов), щадящую внутриматочную хирургию с введением в полость матки противоспаечных барьеров и послеоперационную реабилитацию с использованием гормональных препаратов, направленных на стимуляцию пролиферации эндометрия, а также на профилактику рецидивов спаечного процесса.
Клинический пример № 1
Пациентка П., 30 лет, поступила в клинику г. Красноярска с жалобами на гипоменорею, постепенно перешедшую в аменорею, вторичное бесплодие. В анамнезе – выскабливание полости матки по поводу неразвивающейся беременности. По результатам УЗИ органов малого таза: эндометрий неравномерной толщины, М-ЭХО до 13 мм с гиперэхогенными фрагментами. Пациентка поступила для планового проведения гистероскопии. Нами был использован офисный гистероскоп B.I.O.H (Storz). При проведении цервикоскопии выявлена полная атрезия цервикального канала за счет грубых синехий. С использованием эндоскопических ножниц с большими техническими сложностями проведено рассечение синехий цервикального канала, гистероскоп был продвинут к полости матки. При осмотре: полость матки резко уменьшена, в виде туннеля визуализируется левое маточное устье. Для исключения аномалии развития половых органов было решено провести лапароскопию, при этом визуализировано тело матки нормальных размеров и формы, обе маточные трубы – без видимой патологии, на обоих яичниках и брюшине малого таза – множественные очаги эндометриоза. Последние коагулированы биполярным электродом. При проведении последующей гистероскопии было выполнено рассечение поперечной синехии полости матки с помощью эндоскопических ножниц (крайне редкий вариант формирования спайки в полости матки). Анатомия полости матки была восстановлена: оба маточных устья стали визуализироваться, полость матки – чуть больше нормы. Эндометрий очень тонкий, с участками фиброзирования и резко усиленным сосудистым рисунком. После адгезиолизиса в полость матки было введено 5 г геля Антиадгезин. Для профилактики формирования СА в послеоперационном периоде была назначена циклическая гормональная терапия на 3 менструальных цикла с использованием препаратов для менопаузальной гормональной терапии, а также курс введения противоспаечного геля Антиадгезин № 5 с интервалом от 3 до 7 дней. В последующем у пациентки отмечено восстановление менструальной функции. Через 3 мес. при проведении контрольной офисной гистероскопии полость матки имела нормальную анатомию, синехии отсутствовали, эндометрий соответствовал фазе менструального цикла. В настоящее время пациентка планирует спонтанную беременность.
Клинический пример № 2
Пациентка К., 32 года, обратилась в профессорскую клинику г. Красноярска в мае 2016 г. с жалобами на вторичное бесплодие. В анамнезе 3 беременности: в 2012 г. при сроке беременности 30–31 нед. проведено экстренное кесарево сечение по поводу преждевременной отслойки нормально расположенной плаценты. Ребенок умер. Далее дважды имели место неразвивавшиеся беременности: в 2013 г. в сроке 8–9 нед. и в 2014 г. в сроке 10 нед., по поводу чего пациентке были проведены выскабливания полости матки. Все беременности возникали спонтанно.
По результатам УЗИ органов малого таза (на 7-й день менструального цикла): эхографически определяются 2 М-эха: справа – высотой 5 мм, слева – 4 мм. Справа эндометрий неравномерной толщины, с гиперэхогенными фрагментами. Ультразвуковое заключение: двурогая матка. Синехии в полости матки? Хронический эндометрит?
Пациентка поступила для проведения лапароскопии и гистероскопии. При проведении лапароскопии: в полости малого таза визуализирована одна матка, широкая, чуть больше нормальных размеров. Область рубца на матке и придатки – без видимой патологии. Спаек в полости малого таза не выявлено. При проведении хромосальпингоскопии – обе маточные трубы свободно проходимы для контраста. Далее была проведена гистероскопия. Первоначально с целью диагностики нами был использован офисный гистероскоп B.I.O.H (Storz). При проведении цервикоскопии – цервикальный канал без особенностей. Полость матки разделена на 2 гемиполости за счет очень широкой внутриматочной перегородки, практически доходящей до внутреннего зева. В правой гемиполости имеются множественные линейные синехии, частично облитерирующие ее, но устье правой маточной трубы свободно. Левая гемиполость несколько меньше правой, устье левой трубы свободно. Область рубца на матке – без особенностей (ниш и деформаций нет).
С использованием эндоскопических ножниц выполнено рассечение синехий в правой гемиполости матки. Далее проведено расширение цервикального канала до № 10 расширителями Гегара. В полость матки введен монополярный гистерорезектоскоп (Storz). При помощи электрода (прямой петли) внутриматочная перегородка полностью рассечена. При контрольном осмотре: полость матки нормальных размеров, устья обеих маточных труб свободные. Эндометрий высотой 2–3 мм (соответствует дню менструального цикла), но с резко усиленным сосудистым рисунком (по типу «земляничного поля»).
По завершении операции в полость матки было введено 3 г геля Антиадгезин. Для профилактики формирования СА в послеоперационном периоде были назначены циклическая гормональная терапия на 2 менструальных цикла с использованием препаратов для менопаузальной гормональной терапии, а также курс введения противоспаечного геля Антиадгезин № 3 с интервалом 5–7 дней. Через 2 мес. при проведении контрольной офисной гистероскопии полость матки имела нормальную анатомию, синехии отсутствовали, эндометрий соответствовал фазе менструального цикла. В настоящее время пациентке разрешено планирование беременности.
Таким образом, внутриматочные синехии (и как крайне тяжелый их вариант – СА) являются многокомпонентной проблемой, требующей комплексного подхода. Тактика ведения таких женщин должна включать диагностический модуль (с использованием преимущественно тонких офисных гистероскопов), щадящую внутриматочную хирургию и послеоперационную реабилитацию с использованием гормональных препаратов, направленных на стимуляцию пролиферации эндометрия, а также профилактику рецидивов спаечного процесса в полости матки при помощи внутриматочного использования современных противоспаечных барьеров (примером которых является Антиадгезин). И только комплексный подход, направленный на все звенья патогенеза, позволит излечить таких пациенток, избежать рецидива и вернуть менструальную и фертильную функции.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Вторичная аменорея - симптомы и лечение
Что такое вторичная аменорея? Причины возникновения, диагностику и методы лечения разберем в статье доктора Барковской Анны Юрьевны, гинеколога со стажем в 6 лет.
Над статьей доктора Барковской Анны Юрьевны работали литературный редактор Вера Васина , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина
Определение болезни. Причины заболевания
В России вторичной аменореей называют отсутствие менструации в течение шести месяцев при регулярном и нерегулярном цикле [1] , в зарубежной практике — отсутствие менструации три и более цикла подряд на протяжении шести месяцев при ранее регулярном цикле [2] .
Следует различать первичную и вторичную аменорею. Первичная аменорея — это состояние, при котором у пациентки никогда не было менструации. Распространённость первичной и вторичной аменореи составляет 3-5 % без учёта физиологических причин: периода беременности и лактации [1] [2] . Доля вторичной аменореи по сравнению с первичной, по данным различных авторов, составляет от 75 % до 90 % . Важно понимать, что аменорея является не самостоятельной патологией, а симптомом болезни. В структуре гинекологических заболеваний с нарушением менструального цикла доля аменореи составляет 10-15 % [1] [2] .
К основным причинам вторичной аменореи относятся: [1] [3] [4] :
1. Патология матки:
2. Функциональные нарушения гипоталамо-гипофизарной системы:
- Аменорея на фоне потери массы тела и психогенная аменорея. Во время стресса организм направляет энергетические ресурсы на выживание, поэтому функции, связанные с процессом размножения, могут на время отключиться. Физический, эмоциональный стресс или сильный голод связаны с повышенной выработкой гормона кортикотропина, который повышает также выработку кортизола. Кортикотропин подавляет высвобождение гонадорелина и снижает чувствительность к нему лютеинизирующего гормона. В результате стресс приводит к повышению уровня пролактина, и менструальный цикл нарушается [12] .
- Повышение уровня гормона пролактина (гиперпролактинемия) .
3. Яичниковые формы аменореи.
- (нарушение, при котором рецепторы в яичниках становятся невосприимчивыми к половым гормонам).
- Синдром истощения яичников (преждевременное прекращение функции яичников).
- Синдром гиперторможения гонадотропной функции (снижение выработки гонадотропинов) — патология, наступившая в ответ на отмену оральных контрацептивов, которые применялись в течение нескольких лет и более.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы вторичной аменореи
Основные жалобы пациенток — это отсутствие менструации в течение шести и более месяцев. Для таких женщин характерно нормальное развитие органов малого таза, женский тип строения фигуры, правильное развитие вторичных половых признаков.
Клиническая картина
При сборе анамнеза врач обращает внимание на факторы, которые могли спровоцировать развитие аменореи. К ним относятся [3] [4] [5] [7] :
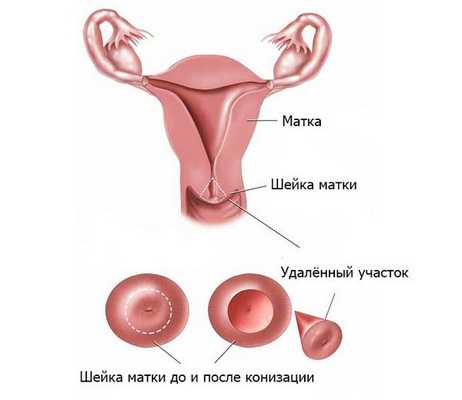
- оперативные вмешательства на органах малого таза — конизация шейки матки (операция по удалению участка в форме конуса при дисплазии шейки матки), хирургический аборт, раздельное диагностическое выскабливание, резекция яичников, удаление кист яичников, удаление маточных труб, удаление миомы матки;
- выраженный стресс, снижение массы тела, повышенная физическая нагрузка;
- симптомы эндокринологических заболеваний — угревая сыпь, алопеция (облысение), гирсутизм (рост волос на лице у женщин), выделения из молочных желёз, предшествующая олигоменорея (длительность цикла превышает 35 дней), головные боли, нарушение зрения, сухость кожи, розовые стрии (растяжки на коже), увеличение веса, сонливость, апатия;
- симптомы недостаточности яичников — приливы (вспышки жара, которые могут сопровождаться резким потоотделением, покраснением кожи, дрожью, учащённым сердцебиением), ощущение сухости во влагалище, нарушение сна, боль в мышцах;
- приём лекарственных средств и наркотиков — нейролептиков, фенотиазинов, галоперидола, метоклопрамида, домперидона, пимозида, сульпирида, резерпина, ингибиторов моноаминоксидазы, опиоидов, амфетаминов, галлюциногенов.
Иногда аменорея связана с атрезией цервикального канала, которая возникла вследствие хирургических вмешательств, например при конизации шейки матки и выскабливании. В таком случае цервикальный канал "зарастает" и менструальная кровь не может излиться из полости матки. Однако, как правило, такие ситуации сопровождаются резкими болями внизу живота в период менструации и в течение шести месяцев (критерий для постановки диагноза "вторичная аменорея") удаётся выявить патологию и бужировать (расширить просвет при помощи металлического стержня — бужа) цервикальный канал.
Патогенез вторичной аменореи
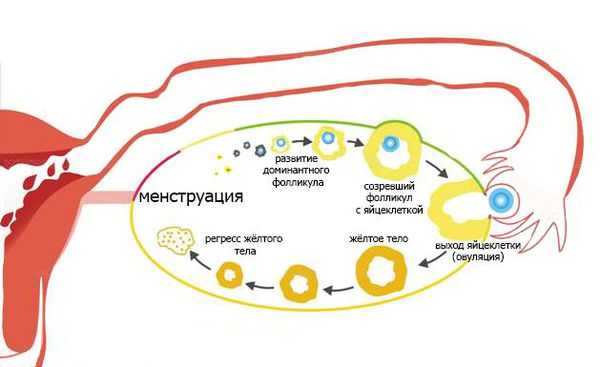
Для понимания патогенеза аменореи важно вспомнить основные принципы регуляции нормального менструального цикла:
- Началом каждого цикла считается первый день менструации. В этот период уровень эстрогена в крови падает.
- Рецепторы гипоталамуса и гипофиза фиксируют низкую концентрацию эстрогена и, для того чтобы его поднять, начинают вырабатывать гонадотропный релизинг-гормон (ГнРГ).
- Под воздействием ГнРГ гипофиз вырабатывает фолликулостимулирующий гормон (ФСГ).
- ФСГ действует на рецепторы яичника, благодаря чему стимулируется рост фолликулов.
- Фолликулы начинают вырабатывать эстрогены, что по механизму отрицательной обратной связи постепенно снижает уровень ФСГ.
- Под действием растущей концентрации эстрогена клетки эндометрия (слизистой оболочки матки) начинают активно делиться, маточное кровотечение (менструация) останавливается.
- Через 12-14 дней формируется доминантный фолликул, уровень эстрогена достигает критической концентрации, что вызывает резкий выброс лютеинизирующего гормона (ЛГ) гипофизом.
- Яйцеклетка попадает в полость малого таза, а затем в маточную трубу и полость матки.
- Ткань, которая осталась после выхода яйцеклетки, под действием ЛГ превращается в жёлтое тело, которое в течение 10-15 дней вырабатывает прогестерон.
- Прогестерон стимулирует рост желёз в эндометрии, трансформируя его таким образом, чтобы он был максимально пригоден для успешной имплантации эмбриона.
- Если беременность не наступила, жёлтое тело редуцируется. Падение концентрации прогестерона приводит к отторжению эндометрия и происходит менструация. Цикл начинается вновь.
Патогенез заболевания различается в зависимости от типа аменореи. Согласно классификации ВОЗ 2001 года, [2] [8] выделяют основные категории:
- Гипогонадотропная нормопролактинемическая овариальная недостаточность — нарушается нормальный суточный ритм выработки гонадотропного релизинг-гормона в гипоталамусе, снижены уровни ФСГ и ЛГ. Стимуляция яичников не происходит, отсутствует овуляция, физиологическая трансформация эндометрия и менструация. Такое нарушение характерно для женщин с резким снижением массы тела, спортсменок с низкой долей жировой ткани, при нервной анорексии.
- Нормогонадотропная нормопролактинемическая овариальная недостаточность — нарушен механизм формирования доминантного фолликула. При этом функция гипоталамуса и гипофиза сохранена. Доминантный фолликул отсутствует, поэтому и овуляция не происходит. Нет жёлтого тела, которое вырабатывало бы прогестерон, вследствие чего эндометрий не трансформируется и не отторгается, менструация не наступает. Классическим примером такого типа нарушения является синдром поликистозных яичников.
- Гипергонадотропная овариальная недостаточность — рецепторы яичника становятся менее чувствительными к воздействию ФСГ и ЛГ: фолликулы яичника вступают в пул овуляции всё в меньшем количестве от цикла к циклу и для роста доминантного фолликула им требуется всё больший уровень ФСГ. За счёт этого ФСГ с каждым циклом растёт, пока яичники не перестанут реагировать на его концентрацию. Таков механизм физиологического развития менопаузы. Примеры этого типа — синдром резистентных яичников, синдром преждевременного истощения яичников, овариальная недостаточность на фоне химиотерапии.
- Аменорея, обусловленная анатомическими дефектами — нарушения рецепции половых гормонов в ткани эндометрия. При этом уровень половых гормонов, состояние яичников, гипофиза, гипоталамуса в норме, патологический процесс происходит только в клетках эндометрия. Такая ситуация характерна для аменореи, возникшей вследствие хирургических вмешательств в полости матки (хирургический аборт, раздельное диагностическое выскабливание полости матки), инфекционных процессов (туберкулёз половых органов, паразитарное заболевание шистоматоз), острых эндометритов, ношения внутриматочной спирали.
- Гиперпролактинемическая овариальная недостаточность, связанная с опухолью гипофиза — патология связана с опухолями, вырабатывающими пролактин. Также причиной может быть гиперплазия ткани гипофиза во время кормления грудью (лактационная аменорея).
- Гиперпролактинемическая овариальная недостаточность, не связанная с опухолью — повышенная выработка пролактина на фоне внешних факторов, например приёма нейролептиков.
- Нормопролактинемическая гипоталамо-гипофизарная дисфункция — нарушение функции гипофиза, которая вызвана сдавлением и ишемией (снижением кровоснабжения) ткани гипофиза. Причиной сдавления могут выступать опухоли головного мозга и опухолевидные образования в области турецкого седла (краниофарингиома, менингиома, киста Ратке, тератома, абсцессы, артериовенозная фистула кавернозного синуса, злокачественные опухоли), синдром "пустого" турецкого седла (грыжеобразное выпячивание оболочек головного мозга, заполненное спинномозговой жидкостью) и синдром Шихена (послеродовая гипофизарная недостаточность вследствие обширного кровотечения).
Отдельно стоит вынести аменорею, связанную с использованием гормональных средств. Так, например, часто можно наблюдать отсутствие менструаций на фоне прологированных (без перерыва на менструацию в течение 3-6 циклов) режимов приёма комбинированных оральных контрацептивов, на фоне приёма диеногеста (препарата для лечения эндометриоза) и использования гормонпродуцирующей внутриматочной спирали. В этом случае аменорея не является патологической, обратима и не вызывает осложнений.
Классификация и стадии развития вторичной аменореи
Аменорею подразделяется на первичную и вторичную:
- При первичной аменорее менструальных кровотечений не было никогда;
- При вторичной — менструации были, но впоследствии исчезли. Также вторичную аменорею разделяют на патологическую и физиологическую. К физиологической относят период беременности, лактации, постменопаузы [1] .
Осложнения вторичной аменореи
Аменорее зачастую сопутствует нарушение фертильности, иногда необратимое. К отдалённым последствиям относят остеопороз (уменьшение плотности и нарушение структуры костной ткани) и повышенный риск сердечно-сосудистых и онкологических заболеваний гормонозависимых органов в постменопаузе. Существует связь между минеральной плотностью костей и уровнем женских гормонов, в частности, снижение уровня эстрогена в некоторых случаях влияет на ломкость костей, так как в них находятся восприимчивые к половым гормонам рецепторы. Тем не менее полная картина этого механизма пока неясна
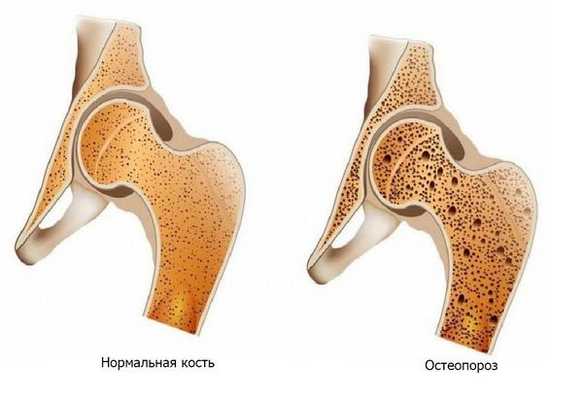
Классическим примером осложнений аменореи являются переломы костей на фоне остеопороза. Подобные травмы часто возникают у девушек, профессионально занимающихся бегом, лёгкой атлетикой, триатлоном, плаваньем [2] [4] [6] .
Важно отметить, что не любой тип аменореи может привести к таким последствиям. Физиологическая аменорея (за исключением периода постменопаузы), нарушения, связанные с приёмом гормональных средств и с анатомическими дефектами, не вызывают подобных осложнений.
Диагностика вторичной аменореи
Для выявления аменореи врач выясняет у пациентки, как долго нет менструации, наличие сопутствующих патологий, наследственные факторы, особенности профессионального анамнеза, приём лекарственных препаратов. При физикальном осмотре оценивается рост, вес, тип телосложения, тургор кожи, тип оволосения, наличие выделений из молочных желёз, угревой сыпи, гирсутизма, стрий, гиперпигментации в естественных анатомических складках.
Далее, производится ультразвуковая диагностика органов малого таза с определением толщины и структуры эндометрия, объёма яичников и количества фолликулов в них.
Обязательным этапом является оценка гормонального статуса. Для этого измеряют уровень ФСГ, ЛГ, эстрадиола, тестостерона, пролактина, ТТГ, прогестерона. Для уточнения могут быть использованы анализы на АКТГ (адренокортикотропный гормон гипофиза), ДГЭАС (андроген, синтезируемый надпочечниками), 17-ОН-прогестерон, кортизол. Также информативными будут следующие пробы:
- гестагеновая проба — пациентка принимает гестагены (стероидные гормоны аналоги прогестерона) в течение 10-14 дней, после чего оценивается отсутствие или наличие менструальноподобной реакции.
- эстроген-гестагеновая проба — в первой фазе пациентке дают препараты эстрогена, во второй фазе — гестагена и оценивают, возникла ли менструальноподобная реакция;
- гонадолибериновая проба — оценка уровней ФСГ, ЛГ до и после введения ГнРГ (аналог гонадотропин-рилизинг-гормона гипоталамуса) [1][2][7][8][9] .
Для выявления макропролактиномы — доброкачественной опухоли гипофиза, которая продуцирует избыточное количество пролактина, проводят МРТ головного мозга.
Для оценки осложнений аменореи выполняется денситометрия — рентгенологическая оценка плотности костей.
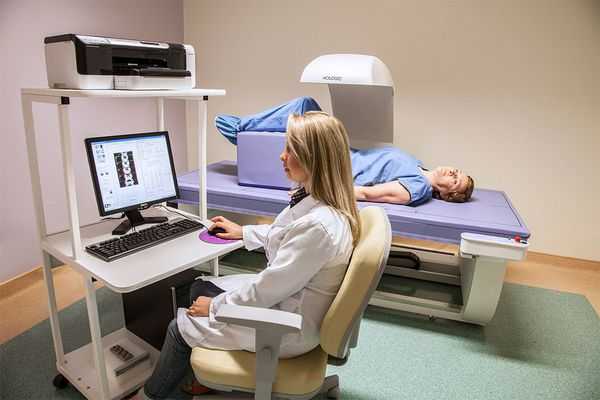
Лечение вторичной аменореи
Целями лечения аменореи являются:
- восстановление менструального цикла;
- профилактика осложнений;
- восстановление фертильности.
В зависимости от причины аменореи используют различные виды терапии:
- При гипогонадотропной нормопролактинемической овариальной недостаточности сперва нормализуют массу тела и корректируют психоэмоциональное состояние. Диета должна быть высококалорийной, сбалансированной, с добавлением витаминов А, Е, Д. При лечении нервной анорексии необходим курс психотерапии. После нормализации массы тела цикл в течение полугода восстанавливается у 80 % девушек. При неэффективности такого подхода могут быть использованы препараты гормональной заместительной терапии натуральными эстрогенами и гестагенами в течение 3-6 циклов. Как правило, такой подход позволяет "разтормозить" гипоталамус и вернуть его к физиологическому цирхоральному типу ритму выработки гормона ГнРГ (состояние, когда его пиковые выбросы происходят приблизительно один раз в час). Если пациентка планирует беременность, то возможна стимуляция овуляции при помощи антиэстрогенов и гонадотропинов [1] .
- При нормогонадотропной нормопролактинемической овариальной недостаточности лечение заключается в коррекции основного заболевания — синдрома поликистозных яичников. Также в первую очередь корректируют вес и питание. Снижение массы тела при избыточном ИМТ на три и более килограмма может запустить спонтанную овуляцию. Инсулинорезистентность преодолевают, соблюдая диету с пониженным содержанием продуктов с высоким гликемическим индексом и назначением метформина. При нормальной массе тела или неэффективности терапии применяют оральные контрацептивы, что позволит предотвратить осложнения и восстановить регулярный цикл. При эндокринном бесплодии стимуляцию овуляции производят с применением антиэстрогенов и гонадотропинов [1][10][11] .
- При гипергонадотропной овариальной недостаточности профилактика осложнений и восстановление менструальной функции заключается в назначении заместительной гормональной терапии в циклическом режиме. Восстановление фертильности возможно с применением вспомогательных репродуктивных технологий с использованием донорской яйцеклетки.
- При аменорее, обусловленной анатомическими дефектами, лечение предполагает хирургическое вмешательство, направленное на восстановление нормальной анатомии органов, например рассечение спаек при внутриматочных синехиях. После операции назначается заместительная гормональная терапия на 3-6 месяцев. Если полное восстановление репродуктивной функции невозможно, пациентке может быть предложено обратиться к помощи программ суррогатного материнства [1][10] .
- При гиперпролактинемической овариальной недостаточности, связанной с опухолью гипофиза, для лечения удаляют анатомический субстрат аменореи. При макропролактиноме или других опухолях головного мозга с выраженными неврологическими симптомами показано хирургическое удаление патологической ткани. При микропролактиноме или бессимптомной макропролактиноме применяют дофаминомиметики.
- При гиперпролактинемической овариальной недостаточности, не связанной с опухолью гипофиза, лекарственную терапию корректируют и при необходимости назначают дофаминомиметики [1][10][11] .
- При нормопролактинемической гипоталамо-гипофизарной дисфункции применяют препараты гормонозаместительной терапии, при необходимости проводят операцию, направленную на восстановление нормальной анатомии головного мозга.
Прогноз. Профилактика
Прогноз зависит от категории аменореи, но в основном для жизни и здоровья при своевременной терапии он благоприятный. Методов специфической профилактики не разработано [1] . К неспецифической профилактике относится здоровый образ жизни, поддержание нормальной массы тела, отказ от необоснованных внутриматочных вмешательств и своевременная коррекция эндокринологических заболеваний.
Внутриматочные синехии ( Синдром Ашермана )
Внутриматочные синехии (синдром Ашермана) – внутриматочные спайки, ведущие к полной или частичной облитерации полости матки. При внутриматочных синехиях наблюдается гипоменструальный синдром или аменорея, альгодисменорея, нарушение детородной функции (невынашивание беременности, бесплодие), иногда развивается гематометра. Синдром Ашермана диагностируется с помощью УЗИ, гистероскопии, УЗ-гистеросальпингоскопии, гормональных проб. Лечение заключается в гистероскопическом рассечении синехий, проведении циклической гормонотерапии. Прогноз в отношении последующего деторождения обусловлен выраженностью и распространенность внутриматочных синехий.

Общие сведения
Внутриматочные синехии представляют соединительнотканные сращения, спаивающие между собой стенки матки и вызывающие ее деформацию. При наличии синехий нормальный эндометрий подвергается атрофической трансформации. Внутриматочные синехии приводят к расстройству менструальной функции, создают механические препятствия для продвижения сперматозоидов, ухудшают условия для имплантации плодного яйца. Отсюда следуют основные проявления синдрома Ашермана – гипоменорея, вторичная аменорея, самопроизвольные аборты, бесплодие.
Причины образования внутриматочных синехий
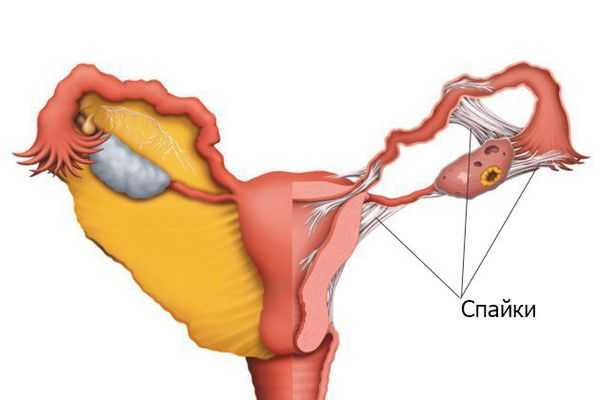
В гинекологии развитие внутриматочных синехий связывают с воздействием инфекционных, травматических агентов и нейровисцеральных факторов. Наиболее частой причиной синдрома Ашермана служат предшествующие механические травмы базального эндометрия. Травмирование эндометрия может происходить вследствие хирургического прерывания беременности, использования внутриматочных контрацептивов, диагностических выскабливаний полости матки при маточных кровотечениях или полипах эндометрия, операций на полости матки (миомэктомии, метропластики, конизации шейки матки). Повреждение эндометрия может усугубляться присоединением инфекции во время раневой фазы с развитием эндометрита.
Развитию внутриматочных сращений может способствовать генитальный туберкулез, диагноз которого подтверждается при биопсии эндометрия или бактериологическом исследовании менструальных выделений. Также негативное влияние на эндометрий оказывают внутриматочные инстилляции, лучевая терапия по поводу опухолей матки и яичников. Нередко образование внутриматочных синехий происходит на фоне предшествовавшей замершей беременности, т. к. остатки тканей плаценты стимулируют активность фибробластов и раннее формирование коллагена до регенерации эндометрия.
Классификация внутриматочных синехий
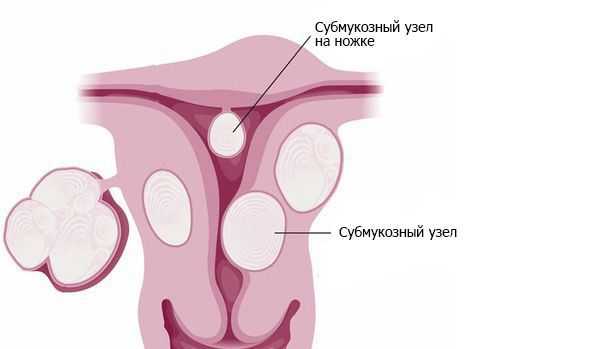
По типу гистологического строения выделяют 3 группы внутриматочных синехий. Пленочные сращения обычно состоят из клеток базального эндометрия, легко поддаются рассечению наконечником гистероскопа и соответствуют легкой форме синдрома Ашермана. При средней степени внутриматочные синехии фиброзно-мышечные, крепко спаяны с эндометрием, при рассечении кровоточат. Тяжелая форма синдрома Ашермана характеризуется плотными, соединительнотканными внутриматочными синехиями, которые с трудом подаются рассечению.
По степени вовлеченности полости матки и распространенности внутриматочных синехий выделяют 3 степени синдрома Ашермана. При I степени в патологический процесс вовлекается менее 25% полости матки, синехии тонкие, не распространяются на дно матки и устья труб. При II степени заболевания синехии занимают от 25% до 75% полости матки, слипание стенок отсутствует, отмечается частичная облитерация дна и устья маточных труб. III степени синдрома Ашермана соответствует вовлечение практически всей полости матки (>75%).
Оперативная гинекология использует международную европейскую классификацию Ассоциации гинекологов-эндоскопистов, согласно которой выделяется пять степеней внутриматочной патологии. В основу классификации положены данные гистероскопии и гистерографии, учитывающие состояние внутриматочных синехий, их протяженность, наличие окклюзии в устьях труб, степень повреждения эндометрия.
Первая степень синдрома Ашермана характеризуется наличием тонких и нежных внутриматочных синехий, которые легко разрушаются при контакте, свободными устьями фаллопиевых труб. При второй степени синдрома Ашермана выявляется плотная одиночная спайка, соединяющая изолированные части полости матки; синехия не разрушается при контакте с концом гистероскопа; устья маточных труб просматриваются. Возможен вариант локализации синехий в зоне внутреннего маточного зева при неизмененных верхних отделах полости матки.
Третьей степени синдрома Ашермана соответствует наличие плотных множественных синехий, соединяющих отдельные части полости матки, и односторонней облитерации устья маточной трубы. При четвертой степени синдрома Ашермана выявляются плотные обширные внутриматочные синехии, частичная окклюзия полости матки и устьев обеих труб. Пятая степень сочетает в себе обширные процессы фиброзирования и рубцевания эндометрия с явлениями I или II, III или IV степени синдрома Ашермана, а также гипоменореей или аменореей.
Симптомы внутриматочных синехий
В зависимости от степени выраженности внутриматочных синехий может развиваться гипоменструальный синдром или вторичная аменорея. При облитерации нижних отделов матки при функциональной сохранности эндометрия в ее верхних отделах, может отмечаться формирование гематометры.
Значительно выраженные внутриматочные спайки при недостатке функционирующего эндометрия препятствуют имплантации плодного яйца; облитерация труб делает невозможным процесс оплодотворения. Поэтому внутриматочные синехии часто сопровождаются невынашиванием беременности или бесплодием. Кроме того, даже наличие слабо выраженных внутриматочных синехий нередко становится причиной неэффективности экстракорпорального оплодотворения.
Диагностика внутриматочных синехий
У большинства женщин с синдромом Ашермана нарушению менструальной и репродуктивной функций предшествуют аборты, выскабливания эндометрия, другие внутриматочные манипуляции, перенесенный эндометрит. Данные гинекологического исследования при внутриматочных синехиях неспецифичны.
УЗИ малого таза при синдроме Ашермана малоинформативно; эхоскопическая картина может быть представлена нерегулярными конурами эндометрия, в случае гематометры - анэхогенным образованием в полости матки. Проведении гистеросальпингоскопии позволяет более четко определять наличие внутриматочных сращений.
Наиболее полная картина представляется при выполнении гистеросальпингографии и гистероскопии. Гистеросальпингография выявляет одиночные либо множественные дефекты наполнения, имеющие лакунообразную форму и различные размеры. При плотных множественных внутриматочных синехиях полость матки на рентгенограмме выглядит многокамерной, с мелкими, соединяющими отдельные камеры протоками. Однако нередко гистеросальпингография сопровождается ложноположительными результатами из-за наличия в матке слизи, искривлений, обрывков эндометрия. При эндоскопической гистероскопии внутриматочные синехии определяются как белесоватые бессосудистые тяжи разной плотности и длины, соединяющие стенки матки, обнаруживается облитерация или деформация полости матки.
Для синдрома Ашермана характерны отрицательные гормональные пробы – отсутствие менструальноподобного кровотечения в ответ на назначение эстрогенов и прогестерона. В ряде случаев в диагностике внутриматочных синехий помогает проведении Пайпель-биопсии с исследованием образцов тканей, что исключает риски дополнительной травматизации эндометрия. Уровень гонадотропных и половых гормонов не изменен, поэтому аменорея при синдроме Ашермана характеризуется как нормогонадотропная.
Лечение внутриматочных синехий
Целью лечебных мероприятий при синдроме Ашермана служит малотравматичное устранение внутриматочных сращений, восстановление нормальной менструальной функции и фертильности. При внутриматочных синехиях первым этапом показано проведение операционной гистероскопии с целью рассечения спаек под визуальным контролем. Разделение синехий в зависимости от их плотности производится корпусом гистероскопа, эндоскопическими ножницами, щипцами, гистерорезектоскопом, лазером. Для исключения перфорации матки используется контроль с помощью УЗИ или лапароскопии.
После операционного этапа пациентке с синдромом Ашермана назначается циклическая гормонотерапия эстрогенами и гестагенами, направленная на стимуляцию восстановления эндометрия и его циклической трансформации. Назначение комбинированной оральной контрацепции при внутриматочных синехиях исключается, поскольку данная группа препаратов способствует атрофическим изменениям эндометрия. При инфекционной этиологии синдрома Ашермана производится бактериологическое исследование мазков и материалов вакуумной биопсии, проводится антибактериальная терапия.
Прогноз и профилактика внутриматочных синехий
Дальнейшие перспективы после трансцервикального рассечения внутриматочных синехий зависят от протяженности и распространенности сращений, степени облитерации полости матки. Наихудший прогноз в отношении восстановления менструаций и фертильности имеют женщины с внутриматочными синехиями туберкулезного генеза.
После рассечения синехий в будущем не исключается их повторное образование. После наступления беременности у пациенток сохраняется высокая вероятность самопроизвольного прерывания беременности, замершей беременности, предлежания плаценты, преждевременных родов, послеродовых осложнений. При невозможности естественного зачатия рекомендуется ЭКО – метод ВРТ, при котором производится искусственное оплодотворение яйцеклетки. Вынашивание плода возможно при помощи суррогатного материнства.
Ведение беременности у женщин с синдромом Ашермана требует от акушера-гинеколога учета всех возможных рисков. Условиями предотвращения образования внутриматочных синехий служат профилактика абортов, бережное и обоснованное проведение внутриматочных манипуляций и операций, своевременное лечение генитальных инфекций, регулярное посещение гинеколога.
Синдром Ашермана - симптомы и лечение
Что такое синдром Ашермана? Причины возникновения, диагностику и методы лечения разберем в статье доктора Дурасова Владимира Владимировича, гинеколога со стажем в 34 года.
Над статьей доктора Дурасова Владимира Владимировича работали литературный редактор Вера Васина , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина
Синдром Ашермана — это заболевание, при котором происходит сращение стенок матки между собой и возникают внутриматочные спайки (синехии).
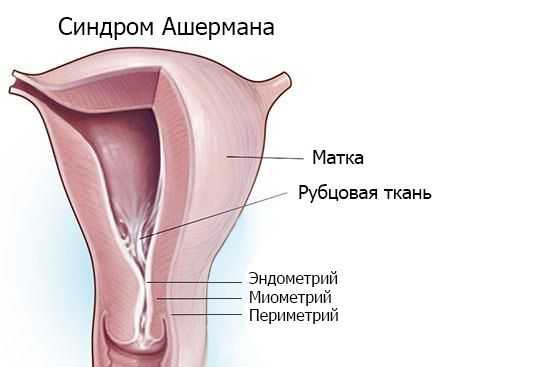
Основная причина патологии — травма эндометрия , особенно на фоне инфекции, которая ведёт к воспалению в полости матки и формированию спаек. Наиболее опасны выскабливания между второй и четвёртой неделей после родов.
Примерно в 90 % случаев синдром Ашермана возникает в результате постабортных или послеродовых вмешательств [4] . В 40 % случаев спайки образуются п осле повторных выскабливаний при неполном аборте и удалении остатков плацентарной ткани [5] . Нередко сращения возникают после гистероскопических вмешательств по удалению субмукозных узлов — доброкачественных образований в подслизистом слое матки. Удаление сразу нескольких узлов повышает вероятность образования спаек [6] .
Синдром Ашермана иногда встречается после наложения шва Линча (процедура для остановки послеродового кровотечения) и после эмболизации маточных артерий (операции по искусственной закупорке сосудов). К редким причинам относят воспаление половых органов при использовании внутриматочной спирали, генитальном туберкулёзе и шистоматозе (токсико-аллергическом заболевании, вызванном гельминтами).
Симптомы синдрома Ашермана
Как правило, женщины самостоятельно замечают заболевание, когда после медицинского аборта или другой внутриматочной процедуры менструации стали скудными ( гипоменоррея ) или исчезли совсем ( аменорея ) [8] . Вместо них внизу живота возникают схваткообразные интенсивные боли, вызванные затруднением оттока менструальной крови. Эти боли появляются каждый месяц, соответствуя фазе менструального цикла, однако выделений при этом нет. К другим симптомам синдрома относят:
- бесплодие;
- выкидыши;
- нарушение плацентации (врастание плаценты и её предлежание ) [9] ;
При патологии кровь скапливается главным образом не в матке (поскольку там нет свободного пространства из-за сращения), а в маточных трубах. Всасывание менструальной крови может приводить к повышению температуры до субфебрильных величин (чуть больше 37 ° ).
Патогенез синдрома Ашермана
Внутриматочные сращения возникают в ответ на травму или удаление эндометрия противоположных стенок полости матки. После травмы в считаные минуты начинается острое воспаление . Воспалительный процесс активирует комплекс биохимических реакций, похожих на те, которые возникают при кровотечении:
- Тромбоциты прилипают к повреждённой поверхности.
- Местный кровоток усиливается, расширяются мелкие сосуды, по которым течёт артериальная кровь (артериолы).
- Клетки, которые помогают организму бороться с воспалением (нейтрофилы и макрофаги), перемещаются к месту травмы.
- Формируется фибриновая плёнка. Поначалу она тонкая, как паутинка, и располагается в зонах, поверхность которых наиболее повреждена, чаще в месте перехода шейки в тело матки (область внутреннего зева), хотя может покрывать и всю полость матки.
- На третий день после травмы начинают расти клетки, формирующие соединительнотканный рубец, а на пятый в фибриновой плёнке развивается сосудистая сеть, что неотвратимо ведёт к образованию сращений в полости матки [7] .
Таким образом, сращения можно обнаружить на пятый день после вмешательства. Следует отметить, что фибриновая плёнка появляется после травмы у всех пациентов — это защитная реакция организма для ограничения повреждённого участка. У многих женщин к пятому дню плёнка рассасывается, и они выздоравливают, но у части запускается процесс образования спаек.
Формирование спаек зависит от степени травмы, состояния иммунной системы, врождённых особенностей и других факторов, многие из которых непонятны до сих пор. Развитию патологии способствуют:
- наличие сгустков крови или остатков плодного яйца в полости матки, что является хорошей питательной средой для микробов;
- заболевания, передающиеся преимущественно половым путём;
- ослабленный иммунитет;
- перенесённое в прошлом вмешательство на шейке матки, ухудшившее её барьерную функцию и другие факторы.
Классификация и стадии развития синдрома Ашермана
Существует несколько классификаций синдрома Ашермана. Одна из самых простых и удобных — классификация по March (2011), который разделял внутриматочные сращения на 3 группы:
- Умеренные — нежные и тонкие спайки, которые занимают менее 25 % полости матки. Устья маточных труб и дно матки свободны или минимально вовлечены.
- Средние — спайками покрыто от 25 до 75 % полости матки, устья маточных труб и дно частично заращены;
- Выраженные — дно и устья маточных труб полностью заращены, спайками покрыто более 75 % полости матки [10] .
Степени развития заболевания более подробно рассмотрены в классификации European Society of Gynecological Endoscopy (1995) [11] .
| Степень | Распространённость внутриматочных спаек |
|---|---|
| 1 | - тонкие и/или плоскостные спайки в устьях маточных труб, которые легко разрушаются тубусом гистероскопа; |
| 2а | - единичные плотные сращения соединяют противоположные зоны полости матки; - устья маточных труб визуализируются; - спайки не могут быть разделены тубусом гистероскопа. |
| 2б | - полное заращение внутреннего зева, при этом верхняя часть полости матки выглядит нормально; |
| 3 | - множественные плотные сращения соединяют противоположные зоны полости матки; - устье одной маточной трубы полностью заращено; |
| 4 | - выраженные плотные сращения с частичным заращением полости матки и устьев обеих маточных труб; |
| 5а | -выраженное рубцевание и разрастание или замещение плотной соединительной тканью внутреннего слоя матки в сочетании со спайками 1 или 2 степени; - аменорея или выраженная гипоменорея; |
| 5б | - выраженное рубцевание и фиброз эндометрия в комбинации со спайками 3 или 4 степени; - аменорея. |
По классификации Американского Общества Репродуктивной Медицины оцениваются данные рентгенодиагностики маточных труб (гистеросальпингографии), гистероскопии, тип спаек, степень нарушений менструальной функции и формируется долгосрочный прогноз по возможности зачать и выносить ребёнка [12] .
| Степень вовлечения полости матки | Менее 1/3 – 1 балл | 1/3-2/3 – 2 балла | 2/3 – 4 балла |
|---|---|---|---|
| Тип спаек | Нежные – 1 балл | Нежные и плотные – 2 балла | Плотные – 4 балла |
| Нарушение менструаций | Норма – 0 баллов | Гипоменоррея – 2 балла | Аменорея – 4 балла |
Суммируя баллы, выделяют 3 стадии:
- слабая — 1-4 балла;
- средняя — 5-8 баллов;
- тяжёлая — 9-12 баллов.
Осложнения синдрома Ашермана
Заболевание может вызывать следующие осложнения:
1. Бесплодие . Беременность возможна только после удачно проведённой операции, при которой удаётся восстановить полноценный объём полости матки и освободить устья маточных труб.
2. Циклические ежемесячные боли. Возникают при заращивании внутреннего зева и нижней трети полости матки.
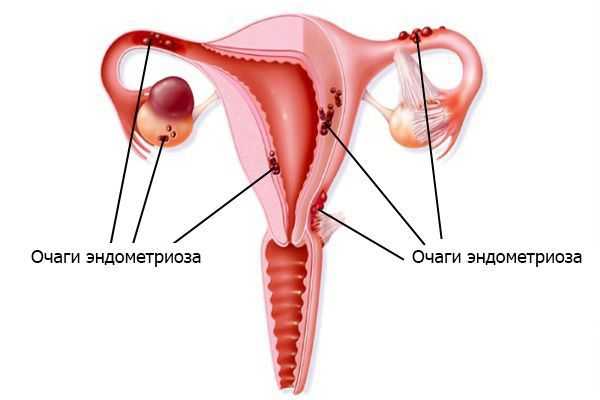
3. Эндометриоз. Выражается в том, что клетки эндометрия (внутреннего слоя стенки матки) разрастаются за пределами этого слоя . Согласно имплантационной теории, заболевание вызвано тем, что большое количество менструальной крови через маточные трубы попадает в брюшную полость. Отток во влагалище при этом затруднён. Обилие крови в брюшной полости приводит к тому, что защитные силы организма не успевают подавлять активность и разрушать клетки эндометрия.
4. Невынашивание беременности, выкидыши . Основная причина состоит в том, что сращения ограничивают функциональный объём полости матки и не дают ей растягиваться.
5. Гипоменструальный синдром (скудные менструации — 1-2 дня, меньше 25 мл, а порой несколько дней в виде "мазни"). Возникает при частичном заращении полости матки.
6. Неправильное прикрепление (врастание в стенку матки) плаценты . Осложнение проявляется, когда плацента не отделяется после родов. Это может вызвать кровотечение и в ряде случаев приводит к удалению матки.
Диагностика синдрома Ашермана
Основные методы диагностики:
- Диагностическая гистероскопия . Метод позволяет визуально оценить степень поражения эндометрия и является золотым стандартом выявления синдрома Ашермана [13] .
- Гистеросальпингография — исследование, при котором в полость матки вводят рентгеноконтрастный раствор и выполняют рентгеновские снимки для получения изображения полости матки и просвета маточных труб. Имеет лишь историческое значение, потому что точность метода невелика, а лучевая нагрузка на гениталии существенна. Облучение может спровоцировать злокачественные заболевания половых органов или ухудшить работу яичников.
- Зондирование полости матки — метод гинекологического исследования, который проводят с помощью специального маточного зонда.
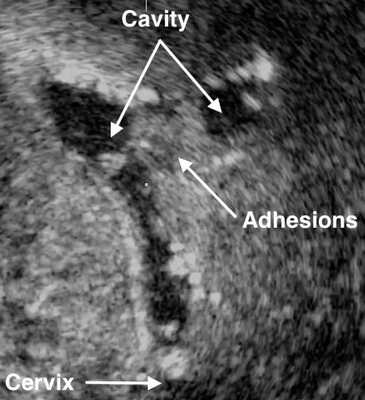
- Ультразвуковое исследование. Если есть спайки, то на снимках видны эхогенные, нерегулярные эксцентричные линейные сигналы — беловатые плотные участки рубцовой ткани или локальное истончение эндометрия. Исследование проводят в лютеиновую фазу (период с момента овуляции и до начала менструаций).
- Соногистерография — ультразвуковое исследование, во время которого в полость матки вводят физиологический раствор.
- Допплеровское исследование— ультразвуковая оценка органических изменений, нарушающих кровоток. Метод позволяет оценить функциональное состояние эндометрия.
- Магнитно-резонансная томография — применяется в случаях тотального поражения полости матки при невозможности провести гистероскопию.
Гистероскопия является самым точным и надёжным методом диагностики синдрома Ашермана . Другие техники выполняют вспомогательное значение и часто дают противоречивые результаты при субмукозных миомах (узлах, растущих в полость матки) и при гиперпластических процессах эндометрия.
Лечение синдрома Ашермана
Операция показана при бесплодии, невынашивании беременности и циклические болях, возникающих из-за затруднения оттока менструальной крови. В последнем случае цель операции состоит в удалении жидкого содержимого из полости матки.
Первые попытки лечить синдром Ашермана заключались в проведении лапаротомии (операции, которая производится путем рассечения передней брюшной стенки скальпелем), утеротомии ( рассечении стенки матки) и пальцевом разрушении спаек. Данные методики имеют лишь историческое значение, поскольку появление гистероскопии значительно улучшило результаты терапии.
Перед операцией, как правило, проводят профилактическое лечение антибиотиками широкого спектра действия. Цель операции — полностью восстановить полость матки. К сожалению, при обширном поражении часто невозможно обнаружить устья маточных труб и найти правильное направление для рассечения сращений. Тогда задача состоит в создании объёма полости матки, достаточного для применения методов вспомогательной репродукции.

Важные аспекты хирургического вмешательства:
- За несколько минут до операции проводят трансвлагалищное УЗИ, чтобы чётко представлять изгиб полости матки. Для навигации в сложных случаях используют ультразвук и лапароскопию, хотя эти методы не могут гарантированно предотвратить разрыв стенок матки, если хирург потеряет правильное направление при рассечении сращений.
- Рассечение сращений производят от центра полости матки латерально (в боковую сторону) и в сторону устьев маточных труб. Рубцовая ткань, в отличие от миометрия, не кровоточит — это является критерием правильности выбранного курса.
- Часто достаточно рассечь плотные сращения в области внутреннего зева и нижней трети полости матки. Это поможет получить доступ ко дну матки, где сращения обычно не очень плотные, и без затруднений освободить устья маточных труб.
Если операция прошла удачно и пациентка чувствует себя хорошо, то уже вечером она может быть выписана. Если процедура была сложной или потребовалось проведение лапароскопии, придётся провести ночь в стационаре.
Прогноз не всегда благоприятен, поэтому особое внимание следует обратить на профилактические меры. Их можно разделить на две группы:
1. Методы первичной профилактики развития спаек в полости матки:
- Бережное отношение к матке при выскабливании, снижение числа повторных вмешательств. Этого можно добиться применением гемостатиков (препаратов, останавливающих кровотечение) после абортов, что уменьшит риск повторного выскабливания. При наличии остатков плодного яйца в полости матки не следует торопиться с выскабливанием, так как 95 % плацентарных полипов (остатков беременности) спонтанно разрушаются в течение трёх месяцев на фоне приёма оральных контрацептивов. Если же повторное опорожнение полости матки необходимо, то выполнить это можно деликатно: методом вакуум-аспирации при ультразвуковой навигации.
- Чтобы предотвратить развитие спаек после внутриматочной хирургии следует ограничить использование электрохирургии в пользу методики Cold Loop ("Холодная петля") . Технология заключается в том, что при удалении субмукозных узлов 1 и 2 типов (когда часть узла находится в полости матки, а часть в стенке) часть узла в матке постепенно удаляется по кусочкам с помощью высокотемпературной петли. Далее узел извлекается из стенки матки с помощью специальных механических устройств, при этом миометрий сокращается и выталкивает остатки узла в просвет полости матки. Очень важно при этом находиться в правильном слое — между псевдокапсулой (растянутыми тканями матки, покрывающими миоматозный узел) и самой миомой. Это позволяет бескровно выделить узел из ложа и обойтись без прижигания тканей, либо использовать её в минимальном объёме на последнем этапе [15] . Это очень важно, поскольку на обожжённой поверхности полости матки легко образуются спайки, а эндометрий восстанавливается очень медленно, да и высокая температура может повредить нижележащий слой миометрия и возникает риск разрыва матки при последующей беременности.
2. Вторичная профилактика — комплекс мер, направленных на снижение риска повторного появления спаек в полости матки после их рассечения:
- После рассечения спаек для стимуляции роста эндометрия следует принимать эстрогены и ввести в полость матки гелевый противоспаечный агент [16][17] . Гель позволяет временно, на пять суток, разобщить противоположные стенки матки и не дать им срастись.
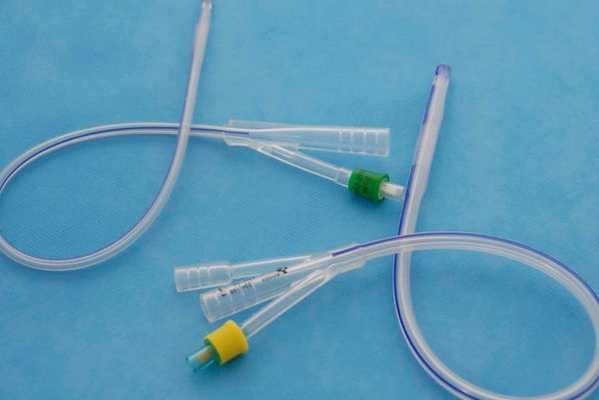
- Применение катетера Фолея (трубки для выведения мочи из мочевого пузыря) — заполненный катетер разобщает стенки матки, он может находиться в полости матки до двух недель. С этой же целью применяют различные пластиковые устройства и внутриматочные спирали. Вероятность повторного образования спаек снижается, но остаётся риск инфицирования [18] .
- Согласно последним исследованиям, для регенерации эндометрия перспективно применение стволовых клеток[20] .
Несмотря на профилактику спаек, они повторно образуются у 25 % женщин с умеренной степенью синдрома Ашермана и у 75 % с тяжёлой. Беременность наступает у 25-75 % оперированных женщин, доношенные дети рождаются в 26-79 % случаях . Разница в данных связана с тем, что не существует общепризнанной классификации синдрома и единого подхода ко вторичной профилактике заболевания.
В дополнение к вышеперечисленным методикам в послеоперационном периоде используют программируемую газовую дистензию . Метод заключается в том, что для разобщения стенок полость матки заполняют углекислым газом. Под давлением газа полость матки растягивается, что приводит к разрушению нежных спаек. Процедуру проводят последовательно на 3, 7 и 10 день после операции. Дополнительным преимуществом является то, что газ, в отличие от жидкости, не переносит в полость матки микроорганизмы, находящиеся на шейке, это делает процедуру более безопасной.
Читайте также:
