Синдром Дени-Дрэша - клиника, диагностика
Добавил пользователь Алексей Ф. Обновлено: 20.01.2026
Синдром Дени-Дрэша - клиника, диагностика
Эти редкие заболевания вызваны мутациями гена — супрессора опухоли Вильмса (WT1), который кодирует фактор транскрипции, в норме подавляющий образование нефробластомы (опухоли Вильмса). Проявления синдрома Дени—Дрэша и синдрома Фрайзера во многом схожи (нарастающий диффузный мезангиальный склероз и дисгенезия гонад с кариотипом XY), но поскольку в их основе лежат разные мутации, то для синдрома Фрайзера нехарактерно развитие нефробластомы.
Диффузный мезангиальный склероз характерен для синдрома Дени—Дрэша, но может быть и самостоятельным заболеванием. У некоторых больных с изолированным диффузным мезангиальным склерозом также есть мутации гена WT1.
Фактор транскрипции WT1 может как подавлять, так и активировать транскрипцию генов, в зависимости от того, с каким участком ДНК он связывается. В свою очередь, другие белки могут изменять его активность. Связываясь с мРНК, WT1 может регулировать экспрессию генов, и на уровне транскрипции, и на посттранскрипционном уровне. В период формирования почки WT1 экспрессируется в конденсирующейся мезенхиме, в образующихся при конденсации мезенхимы везикулах и подоцитах, в окончательной почке его экспрессия сохраняется в подоцитах.
Такой характер экспрессии наводит на мысль, что WT1 участвует в дифференцировке клеток мезенхимы в подоциты и поддерживает их нормальный фенотип. Нарушение функции WT1 ведет к неконтролируемому росту метанефрогенной ткани и образованию нефробластомы или нарушению дифференцировки подоцитов. Фактор транскрипции WT1 экспрессируется также в клетках полового тяжа, гранулезных клетках яичниковых фолликулов и клетках Сертоли. Возможно, нормальная дифференцировка половых желез также зависит от фактора транскрипции WT1.
Для синдрома Дени—Дрэша характерны: нефробластома, дисгенезия гонад с кариотипом XY и наружными половыми органами промежуточного типа и гломерулопатия. Последняя обычно проявляется нефротическим синдромом, возникающим в первый год жизни и приводящим к развитию ХПН к 3 годам.
У детей синдром Дени—Дрэша может быть как полным, так и неполным (гломерулопатия и аномалии половых органов без нефробластомы или гломерулопатия и нефробластома без аномалий половых органов). Как и при других формах дисгенезии гонад с кариотипом XY, у этих больных повышен риск гонадобластом. Если диагноз синдрома Дени—Дрэша не вызывает сомнений, то, учитывая высокий риск нефробластомы, показана двусторонняя нефрэктомия.
Для больных с синдромом Дени—Дрэша характерно специфическое поражение почек — диффузный мезангиальный склероз. Поражаются интракортикальные нефроны, в них расширяется мезангий и облитерируются капилляры клубочка, из-за чего клубочек превращается в бесформенную массу матрикса с венцом из гипертрофированных подоцитов.
Причина заболевания — миссенс-мутация в гене WT1, приводящая к замене аргинина на триптофан в положении 394. Реже встречается замена аспартата на аспарагин в положении 396 и аргинина на гистидин в положении 366. В результате этих мутаций фактор транскрипции WT1 теряет способность связываться с ДНК. В большинстве случаев эти мутации возникают впервые, хотя могут и наследоваться.
Хотя больные с синдромом Дени—Дрэша являются носителями лишь одного мутантного рецессивного аллеля гена WT1, но в нефробластоме поражены оба аллеля, причем каждый аллель несет разные мутации. При синдроме Дени—Дрэша в почках остаются очаги метанефрогенной ткани, несущие унаследованную мутацию гена WT1 в одном из аллелей. Если в клетках этой ткани происходит мутация второго аллеля, то это приводит к неконтролируемой пролиферации клеток и возникновению нефробластомы.
Механизм развития диффузного мезангиального склероза и дисгенезии гонад при синдроме Дени—Дрэша иной, чем при нефробластоме, поскольку больной гетерозиготен и несет лишь один мутантный аллель гена WT1. Эта мутация проявляется как доминантно-негативная, то есть дефектный белок нарушает функцию продукта нормального аллеля, лишая его способности контролировать экспрессию других генов.
Доминантно-негативный характер мутации гена WT1 объясняет, почему поражение почек и аномалии строения наружных половых органов при синдроме Дени—Дрэша более тяжелые, чем при синдроме WAGR, при котором в результате делеции или мутации со сдвигом рамки считывания один аллель гена WT1 становится нулевым, что не мешает экспрессии нормального аллеля.
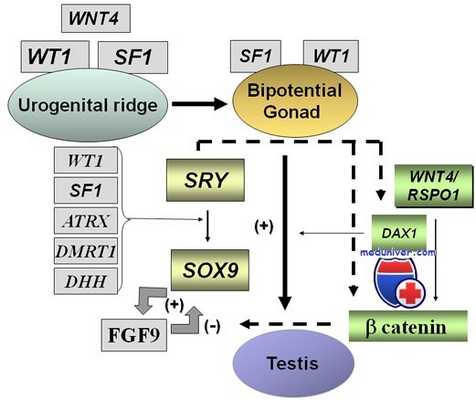
Гены развития гонад
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Опухоль Вильмса
Опухоль Вильмса – это высокозлокачественное новообразование, поражающее паренхиму почек. Развивается у детей раннего возраста. Нередко протекает бессимптомно и обнаруживается при проведении очередного осмотра. При прорастании в чашечную систему возникает макрогематурия, при прорастании в окружающие ткани – болевой синдром. Могут выявляться слабость, недомогание, гипертермия, повышение АД, тошнота, рвота и нарушения стула. Опухоль Вильмса диагностируют на основании данных рентгенографии, экскреторной урографии, УЗИ, КТ и МРТ. Лечение – оперативные вмешательства, химиотерапия, лучевая терапия.
Общие сведения
Опухоль Вильмса – эмбриональная неоплазия высокой степени злокачественности. Названа по имени Макса Вильямса – немецкого хирурга, который в конце XIX века впервые описал процесс гистогенеза данного новообразования, состоящего из эпителиальных, стромальных и эмбриональных клеток. Опухоль является самым злокачественным новообразованием почечной ткани у детей, составляет 20-25% от общего количества онкологических поражений почек у пациентов раннего возраста.
Обычно диагностируется до 5 лет. Может быть врожденной. Девочки и мальчики страдают одинаково часто, средний возраст мальчиков на момент обнаружения объемного образования составляет 3 года 5 месяцев, девочек – 3 года 11 месяцев. В 4-5% случаев носит двухсторонний характер. У взрослых встречается исключительно редко, пациенты с опухолью Вильмса составляют 0,9% от общего числа больных с новообразованиями почек. Лечение осуществляют специалисты в области клинической онкоурологии и нефрологии.
Причины
Установлено, что опухоль Вильмса возникает в результате генетических мутаций, однако причина этих мутаций в большинстве случаев остается неизвестной. У 1-2% больных выявляется наследственная предрасположенность (есть случаи заболевания в семье). Вероятность развития новообразования повышается при некоторых пороках развития, в том числе – при аниридии (недоразвитие или отсутствие радужной оболочки глаза), гемигипертрофии (неравномерное развитие разных половин тела), крипторхизме и гипоспадии.
Данная патология выявляется при некоторых редких синдромах, например, при синдроме Дени-Дреша (включает в себя опухоль Вильмса, мужской псевдогермафродитизм и расстройства функции почек), синдроме Видемана-Беквита (включает увеличение языка и пороки внутренних органов), WAGR-синдроме (включает неоплазию Вильмса, умственную отсталость, отсутствие радужки, пороки развития половой и мочевыводящей системы) и синдроме Клиппеля-Треноне (включает в себя крупные родимые пятна и расширение подкожных вен нижних конечностей, утолщение и удлинение конечностей).
Классификация
В клинической практике обычно используют классификацию по стадиям:
- 1 стадия – новообразование в пределах почки. Почечные сосуды и капсула органа не задействованы. Метастазы отсутствуют.
- 2 стадия – опухоль выходит за пределы почки, поражая сосуды и /или капсулу органа. Подвижность новообразования сохраняется, возможна радикальная операция. Метастазы отсутствуют.
- 3 стадия – неоплазия метастазирует в лимфатические узлы или брюшную полость.
- 4 стадия – выявляется метастатический рак печени, легких, костей, спинного или головного мозга.
- 5 стадия – новообразование носит двухсторонний характер.
Существует также классификация, созданная с учетом гистологических особенностей опухоли. Согласно этой классификации различают две категории новообразований – с благоприятными либо неблагоприятными гистологическими признаками.
Симптомы опухоли Вильмса
Клинические проявления определяются возрастом ребенка, стадией процесса, наличием или отсутствием вторичных очагов в лимфатических узлах и отдаленных органах. На начальных стадиях отмечается бессимптомное течение либо стертая симптоматика: слабость, вялость, ухудшение аппетита, снижение веса, незначительное повышение температуры. В анализе периферической крови определяются повышение СОЭ и умеренная анемия.
Достаточно крупные неоплазии прощупываются через переднюю брюшную стенку. Возможна асимметрия живота. При больших новообразованиях могут возникать явления кишечной непроходимости. Наблюдаются затруднения дыхания, обусловленные сдавлением органов грудной клетки. При пальпации определяется безболезненный подвижный (на 1 и 2 стадии) либо неподвижный (на 3 и 4 стадиях), плотный, обычно гладкий узел. Реже опухоль Вильмса имеет бугристую поверхность.
Боли возникают при сдавлении близлежащих органов, прорастании печени, диафрагмы и забрюшинной клетчатки. Кровь в моче появляется при прорастании чашечно-лоханочной системы, обнаруживается менее чем у 30% больных. Микрогематурия наблюдается чаще макрогематурии. При присоединении инфекции и некрозе опухоли в анализе мочи выявляются протеинурия и лейкоцитурия. Более чем у половины пациентов возникает повышение артериального давления. При появлении отдаленных метастазов клиническая картина дополняется нарушением функции пораженных органов.
Диагностика
Диагноз выставляют врачи-онкоурологи с учетом клинической симптоматики, данных лабораторных и инструментальных исследований. На начальном этапе в качестве дополнительного указания на возможную опухоль Вильмса рассматривают изолированные аномалии развития и характерные синдромы. Назначают анализ периферической крови, общий анализ мочи, анализ крови на онкомаркеры и функциональные почечные пробы. Проводят экскреторную урографию для оценки состояния чашечно-лоханочной системы. Выполняют обзорную рентгенографию грудной клетки, позволяющую выявлять смещение средостения, повышение уровня диафрагмы и вторичные очаги в легких.
Больных направляют на УЗИ забрюшинного пространства, УЗИ брюшной полости, КТ забрюшинного пространства, КТ почек, МРТ почек и другие исследования. При подозрении на поражение полой вены применяют венографию. Для исключения метастазов в кости назначают сцинтиграфию костей скелета и стернальную пункцию с последующим микроскопическим исследованием пунктата. Для исключения поражения ЦНС выполняют КТ и МРТ головного мозга и спинного мозга. Патологию дифференцируют с поликистозом, гидронефрозом, кистой почки, тромбозом почечной вены и другими опухолями почки.
Лечение опухоли Вильмса
Лечение комбинированное, включает в себя хирургическое вмешательство, химиотерапию и радиотерапию. В зависимости от степени поражения органа возможны частичная или тотальная нефрэктомия. Пациентам в возрасте до года операцию проводят без предшествующей химиотерапии. Детям старше 1 года назначают предоперационную химиотерапию в течение 1-2 месяцев. В ходе оперативного вмешательства осуществляют ревизию обеих почек. При двухсторонних новообразованиях выполняют двухстороннюю частичную нефрэктомию или полную нефрэктомию с одной стороны и частичную – с другой.
При обширных поражениях обеих почек ранее проводили полную двухстороннюю нефрэктомию. В настоящее время предпочтение обычно отдают органосохраняющим операциям в сочетании с предоперационной полихимиотерапией, послеоперационной химио- и радиотерапией. Иссекают парааортальные и брыжеечные лимфатические узлы. Проводят гистологическое исследование ткани опухоли и лимфатических узлов для уточнения диагноза и более точной оценки распространенности процесса. При неоперабельных новообразованиях назначают паллиативное лечение: химиотерапию, лучевую терапию, симптоматическую терапию.
Больных после полной двухсторонней нефрэктомии направляют на гемодиализ и ставят в очередь на пересадку почки. Лечение рецидивов комбинированное, включает в себя хирургические вмешательства, радиотерапию и химиотерапию. При проведении противорецидивной терапии используют более агрессивные химиопрепараты, оказывающие негативное влияние на систему кроветворения, поэтому в последующем пациентам может потребоваться трансплантация костного мозга.
Прогноз и профилактика
Прогноз при опухоли Вильмса определяется стадией и гистологическими особенностями новообразования. Пятилетняя выживаемость пациентов с опухолью Вильмса первой стадии составляет 80-90%, второй – 70-80%, третьей – 35-50%, четвертой – меньше 20%. Рецидивы первичного новообразования выявляются у 5-15% больных. Двухлетняя выживаемость при наличии рецидива составляет около 40%. Неблагоприятными прогностическими факторами являются определенные гистологические особенности опухоли Вильмса, возраст больного младше 1,5 лет или старше 5 лет, прерывание курса лучевой терапии или химиотерапии.
После окончания цикла лечения больные опухолью Вильмса в течение 2 лет ежемесячно проходят УЗИ органов брюшной полости и забрюшинного пространства, сдают анализы крови и мочи. Затем обследование осуществляют раз в три месяца. Рентгенографию грудной клетки дважды выполняют с трехмесячным интервалом, в дальнейшем проводят раз в полгода. В отдаленном периоде возможно развитие метастазов и злокачественных новообразований, провоцируемых лучевой терапией. У женщин повышается риск антенатальной гибели плода и рождения ребенка с низким весом.
Аутосомно-рецессивный поликистоз почек - клиника, осложнения
Распространенность аутосомно-рецессивного поликистоза почек (поликистоза почек детского типа) составляет 1 на 6—40 тысяч живых новорожденных. Рано или поздно он приводит к терминальной почечной недостаточности — это может случиться как во внутриутробном периоде, так и после рождения, и даже в зрелом возрасте.
Почки всегда увеличены, поскольку собирательные трубочки расширены в виде веретенообразных кист. Аутосомно-рецессивному поликистозу всегда сопутствует врожденный фиброз печени, но клинически он проявляется не сразу, так как на первый план выходит почечная недостаточность.
Анамнез и клиническая картина аутосомно-рецессивного поликистоза почек
Почечная недостаточность во внутриутробном периоде приводит к маловодию и, как следствие, развитию синдрома Поттер, включающего гипоплазию легких и характерные аномалии лицевого скелета (низко расположенные уши, плоский нос, недоразвитый подбородок — лицо Поттер). В подобных тяжелых случаях нарушение развития почек можно выявить при УЗИ уже во второй половине беременности.
У новорожденных легко пальпируются увеличенные почки, отмечаются признаки ХПН. Начиная в среднем с 6 мес развивается артериальная гипертония. На аутосомно-рецессивный поликистоз почек указывают (в порядке убывания частоты): пальпируемые объемные образования в брюшной полости с обеих сторон; артериальная гипертония; частые инфекции мочевых путей; данные семейного анамнеза или пренатальной диагностики; сопутствующее поражение печени; задержка развития.
Как уже говорилось, чаще всего выявляют объемные образования в брюшной полости (при аутосомно-рецессивном поликистозе почки значительно увеличены), артериальную гипертонию и инфекции мочевых путей. Исследование, в котором принимали участие 66 мальчиков и 49 девочек, больных аутосомно-рецессивным поликистозом почек, показало, что в 11 % случаев диагноз был установлен до рождения, в 41% — в течение первого месяца жизни, в 23% — в грудном возрасте и в 25% — после года.
У 70% детей, начиная в среднем с 7 мес, была снижена СКФ. Среди внепочечных проявлений поликистоза на первом месте стоит врожденный фиброз печени, который нередко осложняется кровотечением из варикозных вен пищевода. Иногда отмечается портальная гипертензия, но функция гепатоцитов при этом остается нормальной. Могут возникать аневризмы внутричерепных артерий. Изредка кисты обнаруживают в поджелудочной железе и селезенке.
У некоторых больных аутосомно-рецессивным поликистозом функция почек может быть более или менее сохранна и в клинической картине преобладают проявления врожденного фиброза печени и портальной гипертензии.
Осложнения аутосомно-рецессивного поликистоза почек. Возможны нагноение кист и обструкция мочевых путей. Частое осложнение — артериальная гипертония. У 15% больных возникает мочекаменная болезнь. Осложнения ХПН — анемия, задержка развития и почечная остеодистрофия. Портальная гипертензия, вызванная фиброзом печени, может приводить к гиперспленизму. В дальнейшем нередко отмечаются бесплодие или осложнения беременности.
УЗИ при поликистозе почек
Доброкачественная семейная гематурия - клиника, диагностика
Изолированная клубочковая гематурия (с эритроцитарными цилиндрами) может быть как спорадическим, так и семейным заболеванием. Биопсия при ней нередко выявляет очень тонкую базальную мембрану клубочка. Это состояние называют болезнью тонких базальных мембран, или доброкачественной гематурией.
Если заболевание поражает нескольких членов семьи и у них нет почечной недостаточности, то говорят о доброкачественной семейной гематурии. Утончение базальной мембраны клубочков встречается при различных заболеваниях, отличных по своим молекулярным основам. Как и синдром Альпорта, доброкачественная семейная гематурия — наследственное поражение базальной мембраны клубочка. Она также проявляется хронической гематурией, но имеет важные отличия:
1) внепочечные проявления заболевания редки;
2) протеинурия, артериальная гипертония и развитие терминальной почечной недостаточности не характерны;
3) пол не влияет на течение заболевания;
4) заболевание наследуется аутосомно-доминантно. Это заболевание трудно гистологически отличить от ранней стадии синдрома Альпорта: в обоих случаях отмечается равномерное истончение базальной мембраны клубочка.
Однако при доброкачественной семейной гематурии базальная мембрана так и остается истонченной, тогда как при синдроме Альпорта со временем она расслаивается и утолщается.
Если у больного с диагнозом доброкачественной семейной гематурии возникают протеинурия и артериальная гипертония, то следует заподозрить вариант синдрома Альпорта, при котором истончение базальной мембраны клубочка преобладает над ее расслаиванием и утолщением.
В одной голландской семье больные, страдающие доброкачественной семейной гематурией, оказались гетерозиготными носителями миссенс-мутации в гене COL4A4. Однако в других семьях, страдающих этим заболеванием, мутации в генах СОb4А3 и СОb4А4 не выявлены, что указывает на генетическую гетерогенность этого заболевания. В настоящее время иммуногистохимические исследования коллагена IV типа в базальной мембране клубочка при доброкачественной семейной гематурии и спорадической болезни тонких базальных мембран не выявили никаких нарушений в распределении ни одной из его шести цепей.
Если в семейном анамнезе есть гематурия без ХПН, наследуемая по аутосомно-доминантному типу, а лучевая диагностика не выявляет изменений в почках и мочевых путях, то предположить диагноз доброкачественной семейной гематурии можно и без биопсии почек. Если семейный анамнез не ясен или вовсе не известен или если есть сопутствующая патология, например протеинурия или глухота, то биопсия почек очень помогает в диагностике.
Доброкачественная семейная гематурия и спорадическая форма болезни тонких базальных мембран не прогрессируют и не требуют лечения.

Синдром Дауна
Синдром Дауна – хромосомная аномалия, при которой в кариотипе имеются дополнительные копии генетического материала по 21-ой хромосоме, т. е. наблюдается трисомия по хромосоме 21. Фенотипические признаки синдрома Дауна представлены брахицефалией, плоским лицом и затылком, монголоидным разрезом глазных щелей, эпикантом, кожной складкой на шее, укорочением конечностей, короткопалостью, поперечной ладонной складкой и др. Синдром Дауна у ребенка может быть выявлен пренатально (по данным УЗИ, биопсии ворсин хориона, амниоцентеза, кордоцентеза) или после рождения на основании внешних признаков и генетического исследования. Дети с синдромом Дауна нуждаются в коррекции сопутствующих нарушений развития.
МКБ-10
Синдром Дауна - аутосомный синдром, при котором кариотип представлен 47 хромосомами за счет дополнительной копии хромосомы 21-ой пары. Синдром Дауна регистрируется с частотой 1 случай на 500-800 новорожденных. Соотношение полов среди детей с синдромом Дауна составляет 1:1. Впервые синдром Дауна описал английский педиатр Л. Даун в 1866 г., однако хромосомная природа и суть патологии (трисомия по хромосоме 21) была выявлена почти столетие спустя. Клиническая симптоматика синдрома Дауна разнообразна: от врожденных пороков развития и отклонений в умственном развитии до вторичного иммунодефицита. Детям с синдромом Дауна требуется дополнительная медицинская помощь со стороны различных специалистов, в связи с чем они составляют особую категорию в педиатрии.
Причины синдрома Дауна
В норме клетки человеческого организма содержат по 23 пары хромосом (нормальный женский кариотип 46,XX; мужской - 46,XY). При этом одна из хромосом каждой пары наследуется от матери, а другая – от отца. Генетические механизмы развития синдрома Дауна кроются в количественном нарушении аутосом, когда к 21-ой паре хромосом присоединяется дополнительный генетический материал. Наличие трисомии по 21-ой хромосоме определяет черты, характерные для синдрома Дауна.
Появление дополнительной хромосомы может быть обусловлено генетической случайностью (нерасхождением парных хромосом в овогенезе или сперматогенезе), нарушением клеточного деления уже после оплодотворения либо наследованием генетической мутации от матери или отца. С учетом этих механизмов в генетике различают три варианта аномалии кариотипа при синдроме Дауна: регулярную (простую) трисомию, мозаицизм и несбалансированную транслокацию.
Большинство случаев синдрома Дауна (около 94%) связано с простой трисомией (кариотип 47,XX, 21+ или 47,ХY, 21+). При этом три копии 21-ой хромосомы присутствуют во всех клетках вследствие нарушения разделения парных хромосом во время мейоза в материнской или отцовской половых клетках.
Около 1-2% случаев синдрома Дауна приходится на мозаичную форму, которая обусловлена нарушением митоза только в одной клетке зародыша, находящегося на стадии бластулы или гаструлы. При мозаицизме трисомия 21-ой хромосомы выявляется только в дериватах этой клетки, а остальная часть клеток имеет нормальный хромосомный набор.
Транслокационная форма синдрома Дауна встречается у 4-5% пациентов. В этом случае 21-я хромосома либо ее фрагмент прикрепляется (транслоцируется) к какой-либо из аутосом и при мейозе отходит вместе с ней во вновь образовавшуюся клетку. Наиболее частыми «объектами» транслокации служат хромосомы 14 и 15, реже – на 13, 22, 4 и 5. Такая перестройка хромосом может носить случайный характер или наследоваться от одного из родителей, являющегося носителем сбалансированной транслокации и имеющего нормальный фенотип. Если носителем транслокации выступает отец, то вероятность рождения ребенка с синдромом Дауна составляет 3%, если носительство связано с материнским генетическим материалом, риск возрастает до 10-15%.
Факторы риска рождения детей с синдромом Дауна
Рождение ребенка с синдромом Дауна не связано с образом жизни, этнической принадлежностью и регионом проживания родителей. Единственным достоверно установленным фактором, повышающим риск появление ребенка с синдромом Дауна, является возраст матери. Так, если у женщин до 25 лет вероятность рождения больного ребенка составляет 1:1400, к 35 годам уже 1:400, к 40 годам - 1:100; а к 45 - 1:35. Прежде всего, это связано со снижением контроля за процессом деления клеток и увеличением риска нерасхождения хромосом. Однако, поскольку частота родов у молодых женщин в целом выше, то, по статистике, 80% детей с синдромом Дауна рождается от матерей в возрасте до 35 лет. По некоторым данным, возраст отца старше 42-45 лет также увеличивает риск развития синдрома Дауна у ребенка.
Известно, что при наличии синдрома Дауна у одного из однояйцовых близнецов, эта патология в 100% случаев будет иметься у другого. Между тем, у разнояйцовых близнецов, а также братьев и сестер, вероятность такого совпадения ничтожно мала. Среди прочих факторов риска – наличие в роду лиц с синдромом Дауна, возраст матери моложе 18 лет, носительство транслокации одним из супругов, близкородственнные браки, случайные события, нарушающие нормальное развитие половых клеток или зародыша.
Благодаря проведению преимлантационной диагностики, зачатие с помощью ВРТ (в т. ч. экстракорпорального оплдотворения) значительно снижает риск рождения ребенка с синдромом Дауна у родителей из групп риска, однако полностью не исключает такой возможности.
Симптомы синдрома Дауна
80-90% детей с синдромом Дауна имеют черепно-лицевые дизморфии: уплощенное лицо и переносицу, брахицефалию, короткую широкую шею, плоский затылок, деформацию ушных раковин; новорожденные – характерную кожную складку на шее. Лицо отличается монголоидным разрезом глаз, наличием эпикантуса (вертикальной складки кожи, прикрывающей внутренний угол глаза), микрогенией, полуоткрытым ртом часто с толстыми губами и большим высунутым языком (макроглоссией). Мышечный тонус у детей с синдромом Дауна обычно понижен; имеет место гипермобильность суставов (в т. ч. атланто-аксиальная нестабильность), деформация грудной клетки (килевидная или воронкообразная).
Характерными физическими признаками синдрома Дауна служат кроткие конечности, брахидактилия (брахимезофалангия), искривление мизинца (клинодактилия), поперечная («обезьянья») складка на ладони, широкое расстояние между 1 и 2 пальцами стоп (сандалевидная щель) и др. При осмотре детей с синдромом Дауна выявляются белые пятна по краю радужки (пятна Брушфильда), готическое (аркообразное нёбо), неправильный прикус, бороздчатый язык.
При транслокационном варианте синдрома Дауна внешние признаки проявляются отчетливее, чем при простой трисомии. Выраженность фенотипа при мозаицизме определяется долей трисомных клеток в составе кариотипа.
У детей с синдромом Дауна чаще, чем у других в популяции встречаются ВПС (открытый артериальный проток, ДМЖП, ДМПП, тетрада Фалло и др.), косоглазие, катаракта, глаукома, тугоухость, эпилепсия, лейкоз, пороки ЖКТ (атрезия пищевода, стеноз и атрезия двенадцатиперстной кишки, болезнь Гиршпрунга), врожденный вывих бедра. Характерными дерматологическими проблемами пубертатного периода являются сухость кожи, экзема, угревая сыпь, фолликулит.
Дети с синдромом Дауна относятся к часто болеющим; они тяжелее переносят детские инфекции, чаще страдают пневмониями, средними отитами, ОРВИ, аденоидами, тонзиллитом. Слабый иммунитет и врожденные пороки являются наиболее вероятной причиной гибели детей в первые 5 лет жизни.
У большинства больных с синдромом Дауна имеются нарушения интеллектуального развития - как правило, умственная отсталость легкой или средней степени. Моторное развитие детей с синдромом Дауна отстает от сверстников; имеет место системное недоразвитие речи.
Пациенты с синдромом Дауна склонны к развитию ожирения, запоров, гипотиреоза, гнездной алопеции, рака яичка, раннему началу болезни Альцгеймера и др. Мужчины с синдромом Дауна, как правило, бесплодны; фертильность женщин заметно снижена ввиду ановуляторных циклов. Рост взрослых больных обычно на 20 см ниже среднего. Продолжительность жизни составляет около 50-60 лет.
Диагностика синдрома Дауна
Для дородового выявления синдрома Дауна у плода предложена система пренатальной диагностики. Скрининг I триместра проводится на сроке беременности 11-13 недель и включает выявление специфических УЗИ-признаков аномалии и определение уровня биохимических маркеров (ХГЧ, РАРР-А) в крови беременной. Между 15 и 22 неделями беременности выполняется скрининг II триместра: акушерское УЗИ, анализ крови матери на альфа-фетопротеин, ХГЧ и эстриол. С учетом возраста женщины рассчитывается риск рождения ребенка с синдромом Дауна (точность - 56-70%; ложноположительные результаты - 5%).
Беременным из группы риска по рождению ребенка с синдромом Дауна предлагается прохождение пренатальной инвазивной диагностики: биопсии хориона, амниоцентеза или кордоцентеза с кариотипированием плода и консультация медицинского генетика. При получении данных за наличие у ребенка синдрома Дауна решение вопроса о пролонгации или прерывании беременности остается за родителями.
Новорожденные с синдромом Дауна в первые дни жизни нуждаются в провдении ЭхоКГ, УЗИ брюшной полости для раннего выявления врожденных пороков развития внутренних органов; осмотре детского кардиолога, детского хирурга, детского офтальмолога, детского травматолога-ортопеда.
Медико-педагогическое сопровождение детей с синдромом Дауна
Излечение хромосомной аномалии на сегодняшний день невозможно; любые предлагаемые методы лечения являются экспериментальными и не имеют доказанной клинической эффективности. Однако систематическое медицинское наблюдение и педагогическая помощь детям с синдромом Дауна позволяют добиться успехов в их развитии, социализации и приобретении ими трудовых навыков.
На протяжении всей жизни больные с синдромом Дауна должны находиться под наблюдением специалистов (педиатра, терапевта, кардиолога, эндокринолога, отоларинголога, офтальмолога, невролога и др.) в связи с сопутствующими заболеваниями или повышенным риском их развития. При выявлении тяжелых врожденных пороков сердца и ЖКТ показана их ранняя хирургическая коррекция. В случае выраженного снижения слуха производится подбор слухового аппарата. При патологии органа зрения может потребоваться очковая коррекция, хирургическое лечение катаракты, глаукомы, косоглазия. При гипотиреозе назначается заместительная терапия тиреоидными гормонами и т. д.
Для стимуляции развития моторных навыков показана физиотерапия, занятия ЛФК. Для развития речевых и коммуникативных навыков детям с синдромом Дауна необходимы занятия с логопедом и олигофренопедагогом.
Обучение детей с синдромом Дауна, как правило, осуществляется в специальной коррекционной школе, однако в рамках интегрированного образования такие дети могут посещать и обычную массовую школу. Во всех случаях дети с синдромом Дауна относятся к категории детей с особыми образовательными потребностями, поэтому нуждаются в дополнительной помощи учителей и социальных педагогов, использовании специальных образовательных программ, создании благоприятной и безопасной среды. Важную роль играет психолого-педагогическая поддержка семей, где воспитываются «солнечные дети».
Прогноз и профилактика синдрома Дауна
Возможности обучаемости и социализации лиц с синдромом Дауна различны; они во многом зависят от интеллектуальных способностей детей и от усилий, прилагаемых родителями и педагогами. В большинстве случаев детям с синдромом Дауна удается привить минимальные бытовые и коммуникационные навыки, необходимые в повседневной жизни. Вместе с тем, известны случаи успехов таких пациентов в области изобразительного искусства, актерского мастерства, спорта, а также получения высшего образования. Взрослые с синдромом Дауна могут вести самостоятельную жизнь, овладевать несложными профессиями, создавать семьи.
О профилактике синдрома Дауна можно говорить только с позиции уменьшения возможных рисков, поскольку вероятность рождения больного ребенка существует в любой паре. Акушеры-гинекологи советуют женщинам не откладывать беременность на поздний возраст. Прогнозировать рождение ребенка с синдромом Дауна призвано помочь генетическое консультирование семей и система пренатального скрининга.
Читайте также:
- Проявления аллергической реакции в офтальмологии. Этапы аллергической реакции
- Мышцы гортани. Наружные и собственные мышцы гортани
- Прямокишечно-влагалищный свищ при раке шейки матки, влагалища или вульвы
- Лучевая диагностика смешанной опухоли надпочечника
- Специфическая симптоматическая терапия мигрени. Базисное лечение мигрени.
