Синдром Лея на МРТ головного мозга
Добавил пользователь Алексей Ф. Обновлено: 29.01.2026
Синдром Лея представляет собой довольно опасное заболевание, в результате которого происходит поражение центральной нервной системы. Чаще всего данная патология встречается у детей 2-3лет. Редко оно появляется у подростков и взрослых.
Какими причинами вызывается синдром Лея?
Основной причиной появления болезни является недостаточность ферментов, которые отвечают за выработку энергии. Так же существуют и вторичные причины. Такие, как:
- генетическая предрасположенность;
- наличие очагов некроза в мозжечке;
- различные мутации генов;
- осложнения после перенесенных дегенеративных заболеваний нервной системы;
- наличие процесса повреждающего клетки мозга;
Наличие каких симптомов свидетельствует о появлении патологии?
Характерными симптомами заболевания являются:
- тошнота сопровождающаяся рвотой;
- резкое снижение массы тела;
- сначала ухудшение, а затем отсутствие аппетита;
- полная задержка психического развития;
- присутствие клонических судорог;
- приступы постоянной смены тонуса мышц;
- тремор в конечностях;
- нарушение координации движений;
- частые респираторные заболевания;
- нарушенный акт глотания;
- ухудшение остроты зрения вплоть до слепоты;
- нарушения рефлексов в сухожильях;
- спутанность сознания, иногда обмороки;
- быстрая утомляемость;
- постоянная сонливость;
При этом в группе риска находятся дети с генетической предрасположенностью. Без своевременного начатого лечения, болезнь заканчивается летальным исходом. Продолжительность жизни составляет около 5лет.
Какие существуют стадии заболевания?
Согласно классификации синдром Лея имеет 2основные стадии своего развития, с характерными для каждой из них симптоматикой. А именно:
- Подострая — сопровождается мышечной слабостью сменяющаяся гипертонусом, общей слабостью организма, нарушение тонуса мышц, большим скоплением в организме молочной кислоты, тремором конечностей, нарушением равновесия в вертикальном положении, недостаточностью вентиляции легких и поражением миокарда.
- Прогрессирующая — проявляется в виде тонических судорог, нарушением движений в различных мышцах, редко возникающие приступы эпилепсии и слабоумием.
Какие проводятся диагностические методы выявления болезни?
В первую очередь специалистом проводиться визуальный осмотр пациента и сбор его жалоб. В качестве дополнительных методов назначается прохождение МРТ головного мозга позволяющее определить характерные нарушения, электрокардиография, сдача биохимического анализа крови и электроэнцефалограммы. В дополнение к выше перечисленным методам обследования, назначается консультация узких специалистов.
Какое назначается лечение при синдроме Лея?
Не всегда назначенное лечение является эффективным. Если патология перешла в хроническую форму, летальный исход неизбежен. Основной целью всего назначенного лечения, является улучшение состояния нервной системы. Поэтому прописываются препараты содержащие В1, антибиотики широкого спектра действия. При этом следует четко соблюдать назначенную диету, при которой ограничивается суточное употребление белка.
Синдром Лея считается достаточно серьезным заболеванием, способным привести к развитию ряда осложнений, и даже летальный исход. Поэтому при появлении первых симптомов, необходимо сразу обратиться к врачу. Так же не стоит забывать и о мерах профилактики. В них входят своевременное лечение центральной нервной системы, вести здоровый образ жизни, употреблять только сбалансированное питание, употреблять побольше витаминов, полностью отказаться от вредных привычек.
Синдром Лея на МРТ головного мозга
Диагностика MELAS по КТ, МРТ головного мозга
а) Терминология:
1. Сокращения:
• Митохондриальная миопатия, энцефалопатия, лактоацидоз и инсультоподобные эпизоды (MELAS)
2. Определение:
• Наследственное заболевание, характеризующееся нарушением внутриклеточного производства энергии и обусловленное точечными мутациями в митохондриальной ДНК (мтДНК)
б) Визуализация:
1. Общие характеристики MELAS:
• Лучший диагностический критерий:
о Острая стадия: инсультоподобное поражение коры:
- «Перемежающееся распространение» (появление поражений в одном месте, исчезновение, повторное появление в другом месте) является классическим признаком
- Поражения распространяются на мозговую ткань с пересечением границ бассейнов кровоснабжения
• Локализация:
о Инсульт: теменно-затылочные > височно-теменные области
о Кальцификации: базальные ганглии (БГ)
• Размеры:
о Вариабельны, характерны их увеличение и мультифокальный тип поражения
• Морфология:
о Острая стадия: отечность извилин
о Хроническая стадия: супра- и инфаренторальная атрофия, глубокое белое вещество (БВ) и лакунарные инфаркты БГ
2. КТ признаки MELAS:
• Бесконтрастная КТ:
о Симметричная кальцификация БГ
• КТ с контрастированием:
о Накопление контраста гирального характера вариабельной степени выраженности
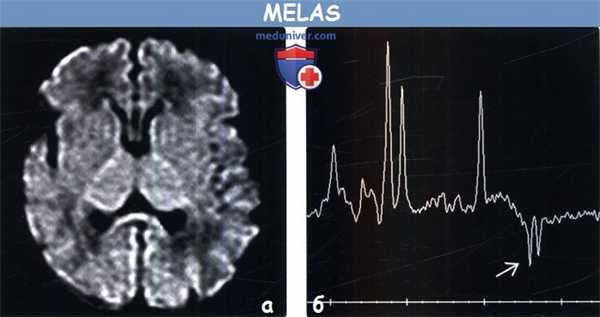
(а) MPT, ДВИ, аксиальный срез: у девочки возрастом 22 дня с микроцефалией молочнокислым ацидозом отмечается нормальная картина; зон ограничения диффузии не выявляется.
(б) Протонная МР-спектроскопия, время эхо 144 мс с зоной интереса в базальных ганглиях: у этой же пациентки подтверждается наличие дублета лактата на 1,3 ppm. Обратите внимание, что пик лактата инвертируется при времени эхо 135-144 мс. Протонная МР-спектроскопия с использованием данного времени эхо может помочь отличить лактат от липидов.
4. Ангиография:
• Традиционная ангиография
о Острая стадия: расширение артерий коры, выраженное капиллярное контрастное «пятно» на фоне отсутствия окклюзии артерий
5. Радионуклидная диагностика:
• ОФЭКТ:
о Острая стадия: при ОФЭКТ с Тс-99m-ГМПАО позволяет выявить выраженное усиление накопления радиофармпрепарата
6. Данные других методов исследования:
• КТ с ксеноном позволяет выявить локальную гиперперфузию в острую стадию инсультоподобного эпизода, в более поздний период - гипоперфузию
• В большинстве случаев поданным электромиографии отмечаются признаки миопатии
• При ЭЭГ могут наблюдаться очаговые периодические эпилептиформные разряды
7. Рекомендации по визуализации:
• Лучший инструмент визуализации:
о МРТ с мультивоксельной МР-спектроскопией
• Совет по протоколу исследования:
о Оцените пики лактата в неизмененных участках головного мозга
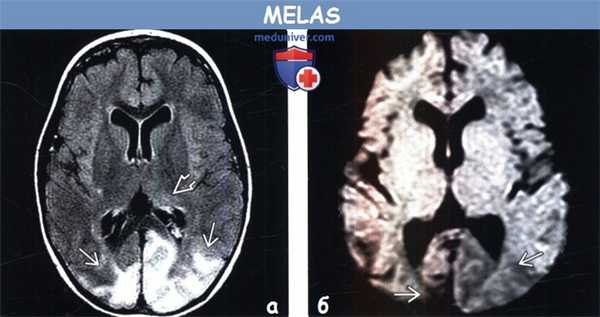
(а) МРТ-исследование в динамике, FLAIR, аксиальный срез: у этой же пациентки в возрасте 3,5 лет в левом таламусе определятся новая зона слабого повышения интенсивности сигнала. Кроме того, в коре/субкортикальном белом веществе затылочных долей визуализируется новая протяженная зона гиперинтенсивного сигнала и отека.
(б) МРТ, ДВИ, аксиальный срез: в пораженных зонах визуализируется снижение интенсивности сигнала, что указывает на подострый их характер. По данным протонной МР-спектроскопии (не представлены) было выявлено наличие лактата, что часто наблюдается в подострой стадии.
в) Дифференциальная диагностика MELAS:
1. Миоклоническая эпилепсия с «рваными» красными волокнами (MERRF):
• Склонность к поражению БГ, хвостатых ядер
• Часто наблюдаются ишемия/инфаркты в зонах «водораздела»
2. Болезнь Лея:
• Обычно мутации комплексов электронно-транспортной цепи (К-ЭТЦ) I-V
• Подострая некротизирующая энцефаломиопатия
• Мутация гена SURF1:
о Характерно поражение таламических ядер, нижних отделов ствола мозга
3. Синдром Кернса-Сейра (СКС):
• Атаксия, офтальмоплегия, пигментный ретинит
• Диффузная симметричная кальцификация БГ, хвостатых ядер, субкортикального БВ
• Повышение интенсивности сигнала от БГ на Т1- и Т2-ВИ; часто вовлекаются БВ мозжечка, задние столбы продолговатого мозга
4. Эпилептический статус:
• Может привести ктранзиторным отеку, контрастированию извилин
• Отсутствие повышения Lac в неизменной мозговой ткани, СМЖ
5. Наследуемый по материнской линии синдром сахарного диабета и глухоты (MIDD):
• Также мутация A3243G в митохондриальной ДНК
• Сахарный диабет, нейросенсорная тугоухость, низкий рост ± самопроизвольный аборт
• Отсутствие инсультоподобных эпизодов
• Бесконтрастная КТ: диффузная атрофия и кальцификация БГ
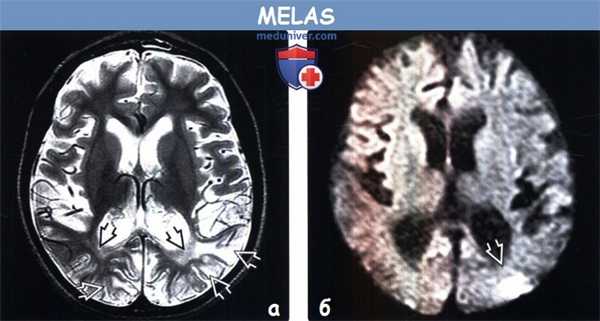
(а) MPT, Т2-ВИ, аксиальный срез: у девочки 12 лет с давним анамнезом MELAS определяется распространенная потеря объема коры и субкортикального белого вещества больших полушарий в сочетании с повышением интенсив нсоти сигнала от перитритонального белого вещества и субкортикального белого вещества/коры теменно-затылочных областей.
(б) МРТ, ДВИ, аксиальный срез: у этого же ребенка отмечается ограничение диффузии в области полюса левой затылочный доли, что указывает на острое поражение на фоне хронических изменений.
г) Патология:
1. Общие характеристики MELAS:
• Этиология:
о Патофизиологические механизмы остаются невыясненными:
- Нарушение окислительного метаболизма головного мозга
- Митохондриальная ангиопатия мелких артерий, артериол, капилляров головного мозга
о Также может играть роль гиперперфузия, вазогенный отек с нарушением проницаемости гематоэнцефалического барьера в острую стадию инсультоподобного эпизода
• Генетика:
о МтДНК попадает в зиготу исключительно из ооцита (материнское наследование)
о Осторожно: взаимосвязь фенотипа с генотипом вариабельна:
- Мутации могут проявиться не только как MELAS, но и как другие фенотипы:
МТТ1: наиболее часто-замена А на Г в нуклеотиде 3243 мтДНК
- Полигенетический характер: MTTQ, MTTL1, МТТН, МТТК, МТТС, МТБТС1, MTND1, MTND5, MTND6, МТБТС2
- MELAS: перекрытие с синдромами Лея, MERRF, СКС и др.
• Ассоциированные аномалии:
о Некоторые аномалии развития коры связаны с A3243G-мутациями
2. Макроскопические и хирургические особенности:
• Диффузная генерализованная атрофия
• Множественные инфаркты коры и глубокого БВ/БГ
• Выраженная минерализация БГ
3. Микроскопия:
• При трихромном окрашивании наблюдается повышенное количество разорванных красных волокон в скелетных/сердечной мышцах
• Может отмечается периваскулярная кальцификация как в сером (СВ), так и в БВ
• Иммуногистохимия: СОХ(+) разорванные красные волокна (данный признак может помочь отличить MELAS от MERRF)
• Электронная микроскопия: набухание, увеличение числа дисфункциональных митохондрий в гладких мышцах, эндотелиальных клетках артериол мягкой мозговой оболочки и мелких артерий
д) Клиническая картина:
1. Проявления MELAS:
• Наиболее частые признаки/симптомы:
о Триада: лактоацидоз, судороги, инсультоподобные эпизоды
о Частые: нейросенсорная тугоухость, диабет, низкий рост
о Когнитивные нарушения, депрессия, психоз, деменция
о Атаксия, мышечная слабость (миопатия), периферическая нейропатия
о Острая головная боль, мигрени, эпизодическая рвота, интермиттирующая дистония, альтернирующая гемиплегия
• Другие признаки/симптомы:
о Гетероплазмия и случайная митотическая сегрегация мтДНК, вариабельность в разных тканях → фенотипическая гетерогенность и «перекрытие» с другими митохондриальными синдромами:
- Сердце: кардиомиопатия, нарушения проводимости
- Зрительные нарушения: скотомы, гемианопсия, офтальмоплегия, макулопатия (прогрессирующая атрофия пигментного эпителия сетчатки в области желтого пятна)
- Почечная дисфункция (включая синдром Фанкони и фокальный сегментарный гломерулосклероз)
- Нарушение моторики ЖКТ, гастропарез, псевдообструкция кишечника
• Клинический профиль:
о Дети более старшего возраста или молодые взрослые с мышечной слабостью и эпилепсией или острым инсультоподобным синдромом
2. Демография:
• Возраст:
о Появление инсультоподобных эпизодов обычно происходит в детстве/раннем взрослом возрасте:
- Средний возраст появления симптомов заболевания составляет 15 лет
- У 90% пациентов симптомы появляются к 40 годам
• Эпидемиология:
о Нечастая, но значимая причина инсульта в педиатрической практике
о Распространенность носителей мутации т.3243А > G составляет 0,6% или 60 случаев на 100000 человек
о Заболеваемость (Финляндия): 3243А > G = 18.4 на 100000 человек
3. Течение и прогноз:
• Рецидивирующие инсультоподобные события с постоянным или обратимым неврологическим дефицитом
• Прогрессирующее течение с периодическими обострениями
4. Лечение:
• Кофакторная и поддерживающая терапия
е) Диагностическая памятка:
1. Обратите внимание:
• Подумайте о возможном наличии MELAS у пациента с острым инсультоподобным поражением коры, распространяющимся по ней с пересечением привычных границ бассейнов кровоснабжения
• Рассмотрите возможность наличия MELAS у взрослых пациентов, поступающих в лечебное учреждение с необычными и повторными инсультоподобными эпизодами
2. Советы по интерпретации изображений:
• Получить МР-спектроскопию в СМЖ, «невовлеченный» мозг
Диагностика синдрома Лея по КТ, МРТ
а) Терминология:
1. Сокращения:
• Синдром Лея (ЛС)
2. Синонимы:
• Подострая некротизирующая энцефаломиелопатия
3. Определение:
• Генетически гетерогенное митохондриальное заболевание, характеризующееся прогрессирующей нейродегенерацией
1. Общие характеристики синдрома Лея:
• Лучший диагностический критерий:
о Двустороннее симметричное ↑ интенсивности сигнала на Т2-ВИ/FLAIR от скорлупы и периакведуктального серого вещества (ПАСВ)
• Локализация:
о Часто:
- Базальные ганглии (БГ): полосатые тела (скорлупа > головки хвостатых ядер) > бледные шары (БШ)
- Ствол мозга (СтМ): ПАСВ, черная субстанция/субталамиче-ские ядра, мост, продолговатый мозг
- Таламусы, зубчатые ядра
о Нечасто: белое вещество (БВ) (большой мозг> мозжечок, возможен кавитирующий характер изменений), спинной мозг, серое вещество коры
• Размеры:
о СтМ: мелкие дискретные очаги (< 1 см):
- Вовлечение центральных трактов БВ
о БГ: вовлечение задних отделов скорлупы является классическим признаком, но наблюдается не всегда; возможно поражение всех компонентов чечевицеобразных ядер
о Таламусы: фокальное вовлечение дорсомедиальных ядер является классическим признаком, но наблюдается не всегда
• Морфология:
о За исключением поражения БВ, поражения других структур характеризуются двусторонностью и симметричностью
о Ранние стадии заболевания характеризуются отеком и увеличением объема структур; потеря объема мозговых структур характерны для поздней стадии заболевания:
- Отек ПАСВ может вызвать гидроцефалию
о Вовлечение нижних отделов СтМ (мост, продолговатый мозг) и отсутствие вовлечения БГ являются характерными признаками СЛ, связанного с SURF1- мутацией
о Необычный внешний вид:
- Преобладание поражения БВ (имитирует лейкодистрофию)
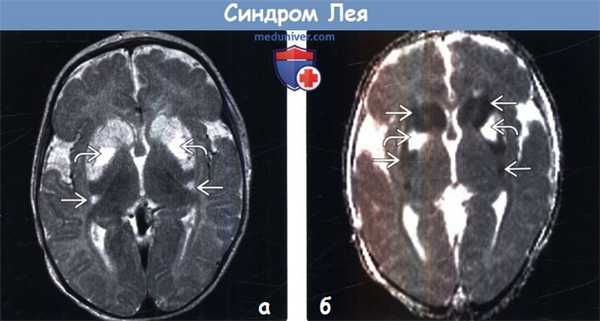
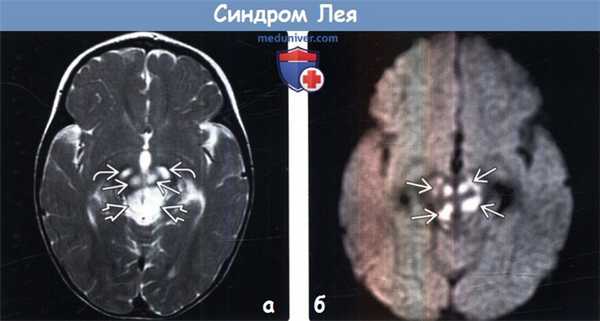
(а) МРТ, Т2-ВИ FSE, аксиальный срез: у младенца с гипотонией и энцефалопатией определяется повышение интенсивности сигнала от головок хвостатых ядер и скорлупы. Обратите внимание на вовлечение наиболее задних отделов скорлупы. Центральные отделы скорлупы характеризуются гиперинтенсивным сигналом.
(б) МРТ, карта ИКД, аксиальный срез: у того же пациента определяется ограничение диффузии в области головок хвостатых ядер и большей части пораженной скорлупы билатерально, тогда как центральные отделы скорлупы характеризуются повышенным коэффициентом диффузии что указывает на предшествующее кавитирующее поражение.
2. КТ признаки синдрома Лея:
• Бесконтрастная КТ:
о Низкая плотность; иногда нормальная рентгенологическая картина
• КТ с контрастированием
о Накопление контрастного вещества нехарактерно
3. МРТ признаки синдрома Лея:
• Т1-ВИ:
о Гипоинтенсивный сигнал:
- Возможно наличие гиперинтенсивных участков = кровь или некроз
• Т2-ВИ:
о Гиперинтенсивный сигнал
• FLAIR:
о Гиперинтенсивный сигнал:
- В хроническую стадию заболевания может наблюдаться разрешение участков изменения сигнала или кистозной энцефаломаляции (гипоинтенсивный сигнал)
• ДВИ:
о Ограничение диффузии в зоне острого поражения
• МР-спектроскопия:
о ↑ пика холина, ↓ пика NAA
о Часто присутствует пик лактата; может быть высоким
4. УЗИ:
• Гиперэхогенность глубоких ядер, БВ
5. Рекомендации по визуализации:
• Лучший инструмент визуализации:
о МРТ с ДВИ/МР-спектроскопия
в) Дифференциальная диагностика синдрома Лея:
1. Глубокая перинатальная асфиксия:
• ↑ интенсивности сигнала на Т2-ВИ и Т1-ВИ от дорсолатеральных отделов скорлупы, латеральных отделов таламусов, дорзальных отделов СтМ, перироландовой коры:
о В немиелинизированном головном мозге повышение интенсивности сигнала наТ2-ВИ идентифицировать затруднительно
о Повышение интенсивности сигнала на Т1 -ВИ наблюдается в подострую стадию (3-10 дней)
• Перинатальная асфиксия в анамнезе
2. Митохондриальная энцефалопатия, лактоацидоз, инсультоподобные эпизоды (MELAS):
• ↑ интенсивности сигнала на T2-BИ/FLAIR от скорлупы (кальцификация в хроническую стадию)
о Возможна асимметричность или односторонность поражения
• Инсультоподобные изменения сигнальных характеристик в теменно-затылочных областях полушарий:
о Характерно несоответствие бассейнам кровоснабжения и ДВИ(-)
3. Глутаровая ацидурия 1-го типа (ГА1):
• ↑ интенсивности сигнала на T2-BИ/FLAIR от полосатых тел, БШ ± поражение БВ
• Характерное расширение височных покрышек
4. Болезнь Вильсона-Коновалова:
• ↑ интенсивности сигнала на Т2-ВИ/FLAIR от скорлупы, БШ, средний мозг, таламусы:
о Изменения на Т2-ВИ очевидны у детей более старшего возраста, подростков
• Гиперинтенсивный на Т1-ВИ сигнал от БШ вследствие печеночной недостаточности
(а) МРТ, Т2-ВИ, аксиальный срез: отмечается повышение интенсивности сигнала от ножек мозга, красных ядер и покрышки среднего мозга (включая периакведуктальное серое вещество). Эти структуры являются частой локализацией поражения ствола мозга при синдроме Лея.
(б) МРТ, ДВИ, аксиальный срез: определяется ограничение диффузии (гиперинтенсивные участки) в пораженных участках среднего мозга. Ограничение диффузии указывает на острую стадию поражения, в то время как повышение диффузии больше указывает на хроническую стадию поражения.
1. Общие характеристики синдрома Лея:
• Этиология:
о Механизм взаимосвязи между митохондриальной дисфункцией и нейродегенерацией точно неизвестен
о Нарушение биоэнергетических процессов (потеря АТФ) и производство активных форм кислорода, вероятно, являются ключевыми факторами в митохондрии-опосредуемом апоптозе
о Дефицит коэнзима Q10 и митохондриальное истощение также причастны к развитию синдрома Лея (СЛ)
• Генетика:
о Синдром Лея (СЛ) характеризуется чрезвычайной генетической гетерогенностью
о Аутосомно-рецессивный (АР), Х-сцепленный и материнский тип наследования мутированных белков, участвующих в производстве энергии в митохондриях:
- Мутации часто связаны с комплексами электрон-транспортной цепи (К-ЭТЦ) I-V
- АР наследование: мутация гена SURF1 (9q34) является наиболее частой причиной СЛ из-за недостатка К-ЭТЦ IV (цитохром С-оксидазы, СОХ)
- Другие АР мутации: гены NDUFV1/NDUFS8 (11 q 13), NDUFS4 (5q 11.1), NDUFS7 → дефицит К-ЭТЦ I; NDUFS3 -> дефицит дегидрогеназы НАДГ; ген BCFIA(5р15) → дефицит К-ЭТЦ II; ген BCS1L (2q33) → дефицит К-ЭТЦ III и не-SURF1 мутации → дефицит СОХ
- Х-сцепленное наследование: ген PDFIA1 (Хр22.2-р22.1) → пируватдегидрогеназа
- Материнское наследование (мутации мтДНК): ген MT-ATP6 → дефицит К-ЭТЦ V (при мутационной нагрузке > 90% вызывает ЛС), НАПН (нейропатия, атаксия, пигментный ретинит) при мутационной нагрузке 70-90%); гены MT-ND5, MT-ND6 → дефицит К-ЭТЦ I; ген MT-CO3 → дефицит СОХ; гены тРНК МТ-ТК, MT-TV
• Ассоциированные аномалии:
о У 50-75% пациентов с синдромом Лея (СЛ) имеются обнаруживаемые биохимические или молекулярные аномалии
о Эмбриология-анатомия:
- Основная роль митохондрий = продукция АТФ посредством окислительного фосфорилирования
- Митохондрии содержат собственную ДНК (мтДНК, в среднем 5 мтДНК на митохондрию)
- МтДНК попадает в зиготу исключительно из ооцита (материнское наследование)
- Митохондрии/мтДНК распределяются случайным образом между дочерними клетками
- МтДНК и ядерная ДНК (яДНК) кодируют субъединицы комплексов электрон-транспортной цепи (К-ЭТЦ) I, III—V; нДНК кодирует субъединицы К-ЭТЦ II
о Головной мозг и поперечно-полосатые мышцы являются высокозависимыми от окислительного фосфорилирования органами → при митохондриальных заболеваниях претерпевают наиболее выраженные изменения
о Вариабельное количество митохондрий/клеток, случайное распределение митохондрий/мтДНК в дочерние клетки → для всех митохондриальных заболеваний фенотипическая гетерогенность типична
2. Макроскопические и хирургические особенности:
• Коричневато-серые желатинозные или полостные участки в полосатых телах, БШ, СтМ, зубчатых ядрах, таламусах, спинном мозге, белом веществе
3. Микроскопия:
• Спонгиозная дегенерация, глиоз, потеря нейронов, демиелиниза-ция, пролиферация капилляров
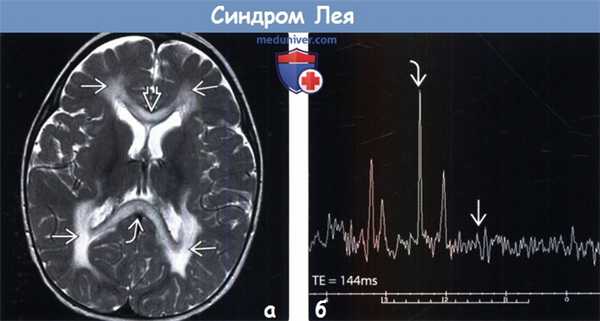
(а) МРТ, Т2-ВИ, аксиальный срез: определяется повышение интенсивности сигнала от колена и валика мозолистого тела, распространяющееся на пери вентрикулярное и глубокое белое вещество, а также задние бедра внутренних капсул.
(б) Одновоксельная протонная МР-спектроскопия (ТЕ = 144 мс): у того же пациента определяется минимальный пик лактата на 1,33 ppm и аномальный пик на 2,4 ppm, что соответствует сукцинату. Был поставлен диагноз "дефицит сукцинатдегидрогеназы вследствие БСНА-мутации".
1. Проявления синдрома Лея:
• Наиболее частые признаки/симптомы:
о Проявления: задержка/регрессия психомоторного развития, гипотония
- Синдром Лея (СЛ) является клиническим диагнозом; вызывать данные проявления могут многие митохондриальные заболевания
о Другие признаки/симптомы:
- Прогрессирующая дисфункция СтМ и БГ:
Атаксия, офтальмоплегия, птоз, рвота, нарушения проглатывания и дыхания, дистония
о Раннее проявление заболевания, дисфункция СтМ, периферическая нейропатия и быстрое неврологическое ухудшение характерно для СЛ, вызванного SURF1-мутацией
о Метаболические стрессовые факторы (например, инфекция) могут «демаскировать» заболевание или вызвать ее ухудшение о Повышение лактата в СМЖ, сыворотке крови, моче является классическим признаком, но наблюдается не всегда
о Клинический диагноз:
- Прогрессирующая нейродегенерация
- Признаки/симптомы дисфункции СтМ и БГ
- ↑ лактата в крови + СМЖ
- Биохимический дефект, выявленный с помощью митохондриального анализа биоптата скелетных мышц или культивируемых фибробластов кожи
- МРТ → характерные поражения БГ или СтМ
о Пренатальная диагностика: проба ворсинчатого хориона (мутации и биохимические дефекты)
• Клинический профиль:
о Младенец с психомоторной регрессией, гипотонией
2. Демография:
• Возраст:
о У большинства заболевание проявляется в возрасте двух лет
о Манифестация заболевания в более старшем детском и взрослом возрасте встречается нечасто
• Половая принадлежность:
о Отсутствует
• Этническая принадлежность:
о Отсутствует
• Эпидемиология:
о Митохондриальные заболевания = 1: 8500
о СЛ у детей < 6 лет = 1: 32000 (наиболее частое митохондриальное заболевание в данной возрастной группе)
3. Течение и прогноз:
• Естественное течение; прогрессирующая нейродегенерация, приводящая к дыхательной недостаточности и смерти в детском возрасте
• Прогноз: неблагоприятный (особенно при SURF1 -мутации); СЛ у детей более старшего возраста/взрослых характеризуется более медленным прогрессированием
4. Лечение синдрома Лея:
• Отсутствие метода, позволяющего добиться излечения
• Потенциальная роль антиоксидантов и ингибиторов репликации мтДНК
е) Диагностическая памятка. Советы по интерпретации изображений:
• Вовлечение скорлупы является классическим признаком, но наблюдается не всегда
• Вовлечение таламусов и ПАСВ имитирует энцефалопатию Вернике; однако маммиллярные тела при синдроме Лея не поражаются
• Для SURF1 -мутаций характерно поражение только ствола мозга SURF1
MELAS на МРТ головного мозга
а) Терминология:
• Митохондриальная миопатия, энцефалопатия, лактоацидоз и инсультоподобные эпизоды (MELAS)
• Наследственное заболевание, характеризующееся нарушением внутриклеточного производства энергии и обусловленное точечной мутацией в мтДНК
б) Визуализация MELAS:
• Инсультоподобное поражение коры, распространяющееся по ней с пересечением границ бассейнов кровоснабжения
о Наиболее часто задние отделы головного мозга
• «Перемежающееся распространение» (появление поражений в одном месте, исчезновение, повторное появление в другом месте) является классическим признаком
• «Дублет» лактата (Lac) на 1,3 ppm в 60-65% случаев:
о Повышенние содержания лактата в СМЖ, «нормальная» картина при исследовании головного мозга методом МР-спектроскопии
• Поражение и кальцификация базальных ганглиев (БГ)
(а) На рисунке аксиального среза изображены патологические изменения при MELAS. Отражено острое развитие гири формного отека коры, который распространяется по ней пересекая границы бассейнов кровоснабжения. Обратите внимание на старые лакуны, генерализованную/локальную атрофию.
(б) MPT, FLAIR, аксиальный срез: у восьмилетней девочки с низким ростом и новым эпизодом появления инсультоподобных симптомов определяется очаг аномального гиперинтенсивного сигнала в правом таламусе наряду с протяженным повышением интенсивности сигнала и аномальным утолщением коры затылочной доли правого полушария головного мозга. Нижележащее БВ в большинстве своем сохранно. (а) МРТ, Т2-ВИ, аксиальный срез: у этой же пациентки наблюдаются очаг в таламусе и отечная кора правой затылочной доли со схожими характерстиками сигнала. Обратите внимание на некоторое расширение субарахноидальных пространств, что может быть результатом недоедания, лекарственного воздействия или проявлениями самой болезни.
(б) МРТ, ДВИ, аксиальный срез: отмечается ограничение диффузии в пораженных участках головного мозга, что подтверждает острый характер поражения.
в) Патология:
• МтДНК попадает в зиготу исключительно из ооцита (наследование по материнской линии)
• Осторожно: взаимосвязь фенотипа с генотипом вариабельна
• Мутации могут проявиться не только как MELAS, но и как другие митохондриальные заболевания
г) Клиническая картина MELAS:
• Классическая триада MELAS: лактоацидоз, судороги, инсультоподобные эпизоды:
о Появление инсультоподобных эпизодов обычно происходит в детстве/раннем взрослом возрасте
о Также наблюдаются: нейросенсорная тугоухость, диабет, низкий рост
д) Диагностическая памятка:
• Подумайте о возможном наличии MELAS у пациента с острым инсультоподобным поражением коры, распространяющимся по ней с пересечением привычных границ бассейнов кровоснабжения
• Рассмотрите возможность наличия MELAS у взрослых пациентов, поступающих в лечебное учреждение с необычными и повторными инсультоподобными эпизодами
Кафедра нервных болезней факультета послевузовского профессионального образования врачей Московской медицинской академии им. И.М. Сеченова
Научный центр неврологии РАМН, Москва
КГБУЗ "Красноярский краевой Центр по профилактике и борьбе со СПИД и инфекционными заболеваниями"
Радиологически изолированный синдром (МРТ-критерии и тактика ведения больного)
Журнал: Журнал неврологии и психиатрии им. С.С. Корсакова. Спецвыпуски. 2016;116(10‑2): 47‑52
Метод МРТ головного мозга для диагностики неврологических заболеваний за последние два десятилетия стал применяться значительно чаще. Это привело к увеличению обнаружения случайных находок. Наиболее часто среди них встречаются асимптомные очаги в белом веществе головного мозга. В некоторых случаях последние, если основываться на радиологических критериях, могут интерпретироваться как очаги демиелинизации. Тем не менее при отсутствии клинических симптомов, характерных для рассеянного склероза (РС), диагноз достоверного РС не может быть поставлен пациентам с такими случайными находками. Данной категории больных теперь выставляется диагноз радиологически изолированного синдрома (РИС). В статье рассматриваются диагностический и клинический подходы к пациентам с РИС.
Доступность метода МРТ головного мозга в последние годы позволила широко применять его в неврологии. Это привело к увеличению обнаружения случайных находок. Чаще всего причиной обращения для проведения МРТ головного мозга, в ходе которого обнаруживаются случайные находки, являются головная боль, черепно-мозговая травма, эндокринологическая и психиатрическая патология [1—9]. Наиболее распространенными среди этих случайных находок являются очаги в белом веществе головного мозга. В некоторых случаях такие очаги, учитывая их внешний вид и локализацию, могут быть интерпретированы как демиелинизирующий процесс, но в то же время они никак не связаны с определенной клинической симптоматикой. В связи с этим был предложен термин «радиологически изолированный синдром» (РИС). Впервые он был использован D. Okuda и соавт. [10]. Речь идет об описании очаговых изменений характерной локализации и размеров, отвечающих радиологическим критериям рассеянного склероза (РС), у пациентов без какого-либо соответствующего анамнеза или клинических проявлений в настоящем времени [10—12].
Предложенные критерии РИС представлены в табл. 1. Критерии F. Barkhof для радиологического доказательства диссеминации процесса приведены в табл. 2.

Таблица 1. Диагностические критерии РИС [10]
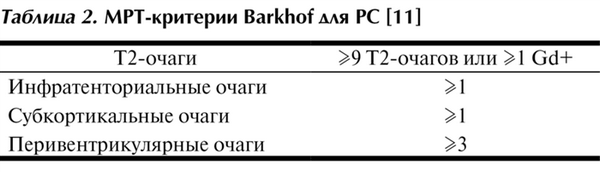
Таблица 2. МРТ-критерии Barkhof для РС [11]
До внедрения МРТ в повседневную практику подобные случайные находки выявлялись на аутопсии в небольшом проценте случаев. Так, с 1961 по 1996 г. было проведено четыре крупных патологоанатомических исследования, в ходе которых в 0,08—0,3% случаев выявлялись очаги демиелинизации при отсутствии соответствующих анамнеза и клиники у больных при жизни [13—16]. Проведенные МРТ-исследования показали, насколько чаще встречаются бессимптомные очаговые изменения демиелинизирующего генеза, особенно у родственников больных РС. В недавнем исследовании [17], в котором использовалась 3 Т МРТ, характерные для РИС очаговые изменения, соответствующие демиелинизирующему процессу согласно критериям F. Barkhof [11], были выявлены в 3% случаев у родственников больных РС и в 2,4% случаев у практически здоровых людей. В другом исследовании [18] распространенность очагового поражения белого вещества головного мозга, соответствующая демиелинизирующему процессу согласно критериям F. Barkhof и другим диагностическим МРТ-критериям, составила 7% у здоровых пациентов — родственников первой линии больных РС.
К настоящему времени клиническая и прогностическая значимость субклинических очагов у пациентов с РИС остается спорной. Однако неопровержимым является тот факт, что пациенты с РИС относятся к группе с повышенным риском развития достоверного РС: около 2/3 пациентов имеют прогрессирование по данным МРТ и около 1/3 пациентов — появление клинических симптомов в течение 5 лет наблюдения [19]. Так, в 2009 г. были опубликованы результаты исследования, в ходе которого показано, что практически в 50% случаев в ближайшие 3 года после постановки диагноза РИС отмечается увеличение количества очагов демиелинизации без какой-либо клинической манифестации, а в 30% случаев происходит трансформация РИС в клинически изолированный синдром (КИС) или достоверный РС [9]. Среднее время между постановкой диагноза РИС и прогрессированием до постановки диагноза КИС составило 5,4 года (от 1,1 до 9,8 года).
К предикторам более быстрой трансформации РИС в КИС или клинически достоверный РС относятся большое количество гиперинтенсивных очагов в режиме Т2, наличие очагов инфратенториальной или спинальной локализации и выявление олигоклональных IgG в ликворе [20]. В своем исследовании C. Lebrun [21] проследил скорость перехода с РИС в КИС у 70 пациентов — у 33% пациентов появились клинические симптомы в среднем за 2,3 года. В данном исследовании характерные для демиелинизации изменения зрительных вызванных потенциалов, молодой возраст и накопление контрастного вещества очагами чаще наблюдались у пациентов с быстрым прогрессированием до клинически достоверного РС, тогда как накопление контрастного вещества очагами и инфратенториальная их локализация ассоциировались только с радиологическим прогрессированием. Наличие олигоклональных антител в ликворе или увеличение их титров с большим количеством Т2-очагов представляется как предиктор перехода в КИС. Эти данные подобны тем при КИС, при которых наличие олигоклональных антител и два гиперинтенсивных очага в режиме Т2 являются предикторами перехода КИС в РС [22]. В другом исследовании [20] наиболее сильным маркером клинического прогрессирования было наличие очагов в шейном отделе спинного мозга: у 21 (84%) из 25 пациентов с РИС с очагами в шейном отделе спинного мозга на МРТ наблюдалось появление клинических симптомов в среднем в течение 1,6 года.
Таким образом, наличие очагов в шейном отделе спинного мозга, соответствующие изменения в ликворе и большое количество Т2-очагов на МРТ головного мозга при первичном сканировании могут служить показанием для формирования группы пациентов с РИС для пристального динамического наблюдения с целью своевременной постановки диагноза достоверного РС и начала патогенетической терапии [23]. Было высказано мнение, что пациентов с РИС, опираясь на клинические и радиологические маркеры, целесообразно распределять на две группы — с низким и высоким риском перехода в Р.С. Однако необходимо принимать во внимание, что большинство из проведенных к настоящему времени исследований включали относительно небольшое количество пациентов с РИС с небольшими периодами наблюдения, в связи с чем для реализации указанного предположения необходимо проведение более длительных наблюдений за такими пациентами.
При попытке обобщения имеющихся к настоящему времени данных, касаемых РИС, логично возникает вопрос о практической значимости полученной информации в отношении РИС. Всем очевидно, что эти данные свидетельствуют о том, что РИС может быть предшественником Р.С. Однако РИС, вероятно, представляет собой гетерогенную группу. Некоторые из этих пациентов, вероятно, имеют относительно мягкую и доброкачественную форму РС с настолько незначительными симптомами, что они не обнаруживаются клинически и могут никогда не прогрессировать, в то время как у других пациентов с РИС симптомы заболевания и/или новые очаги на МРТ будут появляться позднее. В свою очередь из последней группы можно выделить подгруппу пациентов, которые могут иметь относительно более высокий риск развития РС, если они в дополнение имеют соответствующий один фактор риска или более, такой как семейный анамнез, отягощенный в отношении РС, большое количество Т2-очагов на МРТ при первичном сканировании, наличие очагов в шейном отделе спинного мозга и наличие олигоклональных антител.
Возникает и другой вопрос о том, какие рекомендации могут быть по лечению пациентов с РИС. Несмотря на то что существует мнение о необходимости применения соответствующей иммуномодулирующей терапии у таких пациентов с целью замедления клинического и радиологического прогрессирования, по аналогии с пациентами с КИС, пока не проводились исследования, которые показали бы, что данное лечение действительно эффективно и необходимо пациентам с РИС, даже при наличии высокого риска развития Р.С. Кроме того, необходимо учитывать, что факторы риска у таких пациентов могут быть не всегда явными, а также МРТ-картина не всегда однозначно может соответствовать радиологическому РС [24, 25]. Учитывая всю неопределенность в отношении диагностики и лечения данной категории больных, к настоящему времени в мире только небольшая часть пациентов с РИС получают иммуномодулирующую терапию (off-label), что не дает пока возможности проследить ее долгосрочные перспективы при РИС [19].
В подтверждение неоднозначности подходов к РИС в настоящее время приводим клиническое наблюдение.
Больной М., 1982 г. р., в октябре 2014 г. получил травму лица в области левой скуловой дуги, после которой появилась выраженная стойкая головная боль в левой височной области. Проведена МРТ головного мозга, при которой были выявлены субдуральная гематома слева, очаговые изменения в мозолистом теле и перивентрикулярно (рис. 1).
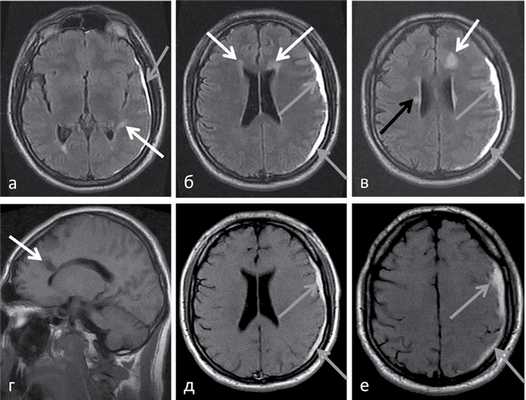
Рис. 1. МРТ головного мозга в режимах Т2-FLAIR (а—в) и Т1 без введения контрастного вещества (г—е) (октябрь 2014 г.). В левой лобно-теменно-височной области определяется зона лентовидной формы, повышенной интенсивности МР-сигнала в режимах Т2 FLAIR и Т1 (за счет внеклеточного метгемоглобина) — подострая субдуральная гематома (серые стрелки). Кроме этого, в субкортикальных и глубоких отделах белого вещества обоих полушарий большого мозга определяются множественные очаги повышенной интенсивности МР-сигнала в режиме Т2 FLAIR, которые могут соответствовать очагам демиелинизации (белые стрелки). Обращает на себя внимание наличие небольшого очага демиелинизации в перивентрикулярном белом веществе вблизи тела правого бокового желудочка, который при последующем МРТ-исследовании значительно увеличится в размерах (черная стрелка). Контрастное вещество не вводилось.
Соматический анамнез без особенностей. При неврологическом осмотре какой-либо патологии не выявлено. Проведено стационарное лечение в связи с субдуральной гематомой (оперативное лечение не проводилось).
В январе 2015 г. консультирован в Межокружном отделении РС, где на основании клинико-МРТ-данных поставлен диагноз РИС. Рекомендовано клинико-МРТ-наблюдение. В августе 2015 г. пациент отметил онемение и слабость в левых конечностях, дизартрию. В неврологическом статусе обращало на себя внимание наличие мелкоразмашистого горизонтального нистагма, дизартрии, легкого левостороннего гемипареза, левосторонней гемигипестезии, легкого вестибуло-атактического синдрома. Повторно выполнена МРТ головного мозга, при которой отмечены появление новых очагов, накапливающих контрастное вещество, а также значительное увеличение в размере очага в правом полушарии большого мозга (рис. 2). Поставлен диагноз РС (псевдотуморозная форма), дебют. Проведена гормональная пульс-терапия (5 г метилпреднизолона) — без эффекта. В сентябре 2015 г. проведен повторный курс гормональной пульс-терапии (5 г метилпреднизолона) в связи с продолжением нарастания неврологического дефицита — без эффекта, симптоматика продолжала усугубляться в виде усиления слабости и онемения в левых конечностях. В октябре 2015 г. проведено 4 сеанса плазмафереза с гормональной пульс-терапией (5 г метилпреднизолона) с положительным эффектом. В связи с высокой активностью заболевания пациенту начата терапия препаратом натализумаб, на фоне которой отмечается стабилизация заболевания.
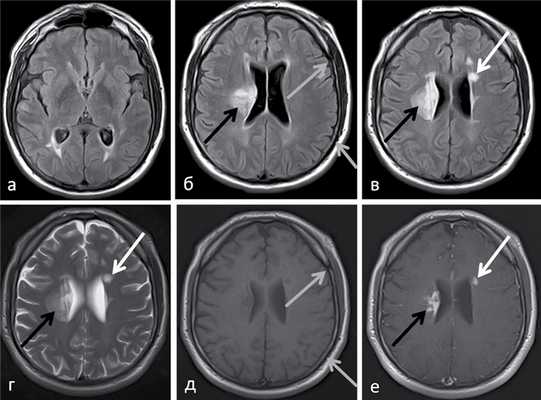
Рис. 2. МРТ головного мозга в режимах Т2-FLAIR (а—в), Т2 (г), Т1 без введения контрастного вещества (д) и Т1 с введением контрастного вещества (е) (август 2015 г.). При проведении МРТ головного мозга в динамике отмечается полное разрешение субдуральной гематомы (серые стрелки, отсутствие зоны повышенной интенсивности МР-сигнала). На фоне множественных очагов демиелинизации, визуализируемых ранее, наблюдаются новые очаги, накапливающие контрастное вещество (белые стрелки), а также появление большого перивентрикулярного очага вблизи тела правого бокового желудочка, до 2,5—3 см в диаметре (располагающегося на месте небольшого очага, визуализируемого при предыдущем МРТ-исследовании), неоднородно интенсивно накапливающего контрастное вещество с небольшими признаками объемного воздействия на тело правого бокового желудочка (черные стрелки). Таким образом, речь идет о демиелинизирующем процессе головного мозга с наличием псевдотуморозного очага на фоне классических очагов демиелинизации.
В клинической практике Межокружного отделения РС совместно с отделением лучевой диагностики Научного центра неврологии наблюдается достаточно большое число пациентов с РИС. На этапе постановки диагноза РИС данной категории больных проводится дообследование с целью исключения возможной другой патологии, приводящей к появлению похожих очаговых изменений по данным МРТ головного мозга. В дальнейшем врач совместно с пациентом может выбрать один из следующих вариантов наблюдения: только клиническое наблюдение (и проведение следующего МРТ-исследования только при появлении клинической симптоматики) или клинико-МРТ-наблюдение, в ходе которого 1 раз в 6—12 мес проводится МРТ головного мозга [26, 27]. При выявлении радиологического прогрессирования рекомендуется проведение иммунологического исследования ликвора на олигоклональные IgG. Если с течением времени происходит трансформация РИС в РС, в большинстве случаев пациентам будет начата соответствующая иммуномодулирующая терапия. Пока отсутствует опыт использования патогенетической терапии у пациентов с РИС, имеющих только радиологическое прогрессирование при последующих сканированиях (без наличия клинического прогрессирования).
Обобщая все вышесказанное, можно сделать заключение, что остается достаточно много вопросов, которые требуют дальнейшего более детального изучения. Существуют ли какие-либо биологические или другие маркеры, которые могут помочь дифференцировать различные группы пациентов с РИС без или с последующим прогрессированием? Нужно ли назначать иммуномодулирующую терапию пациентам с РИС при наличии факторов риска быстрой трансформации в РС?
Будущие рандомизированные исследования смогут не только ответить на вопрос, является ли раннее начало терапии пациентов с РИС необходимым для предотвращения конверсии в РС или радиологического прогрессирования, но и помогут также дополнительно подтвердить значимость факторов риска быстрой трансформации заболевания. Таким образом, в связи с недостаточным к настоящему времени объемом знаний о патологической значимости РИС, его взаимосвязи с РС, а также из-за отсутствия информации о влиянии соответствующей иммуномодулирующей терапии при РИС на долгосрочный прогноз заболевания, клинический подход и ведение таких пациентов пока остаются окончательно не ясными.
Читайте также:
- Послеоперационная печеночная недостаточность у пожилых. Факторы риска
- Операции при пупочной грыже. Пластика по Мейо. Пластика по Сапежко. Пластика по Лексеру.
- Клапанный стеноз легочной артерии. Тоны сердца при стенозе легочной артерии
- Меры предосторожности при дайвинге и профилактика сопряженных травм
- Направления лечения в психотерапии
