Синдром Тэя - клиника, диагностика, лечение
Добавил пользователь Дмитрий К. Обновлено: 29.01.2026
Механизмы развития веснушек и других меланиновых меланозов
К наиболее важным меланиновым пигментам относят: эумеланин, придающий коже коричневый и даже черный цвет, и феомеланин, обеспечивающий более светлые тона от желтого до светло-коричневого. Меланин формируется при участии двух типов тирозиназы — TPRI-1 и TPRI-2 (Tyrozine Related Protein-1,-2).
Синтез меланина происходит из тирозина в меланоцитах, клетках базального слоя эпидермиса. В коже функционируют эпидермальные, фолликулярные и не содержащие пигмент (светлые) биполярные меланоциты. Под действием тирозиназы в меланосомах (особые органеллы меланоцитов) из тирозина образуется диоксифенилаланин (ДОФА) или промеланин, который полимеризуется в меланин. Клетки, фагоцитирующие меланин, называют меланофагами. Меланоциты и меланофаги содержатся в эпидермисе и дерме.
По дендритным отросткам меланоцитов меланосомы мигрируют в соседние кератиноциты и, таким образом, распределяются в эпидермисе, определяя цвет кожи. В ходе естественной десквамации пигментосодержащие клетки поверхностного рогового слоя постепенно отшелушиваются. Полный жизненный цикл пигментосодержащей клетки составляет около 28 дней.
Цвет кожи зависит не от количества меланоцитов, которое примерно постоянно у людей разных рас, а от количества меланина в одной клетке. Содержание меланина в коже подвергается колебаниям в различные периоды жизни. Регуляция меланогенеза осуществляется нервной системой и эндокринными железами. Стимулируют синтез меланина меланоцитостимулирующий гормон гипофиза, АКТГ, половые гормоны, медиаторы симпатической нервной системы, тормозят — мелатонин и медиаторы парасимпатической нервной системы.
Образование меланина стимулируется УФО, что объясняет возникновение загара как адаптивной защитной биологической реакции. У представителей негроидной расы меланин распределен равномерно по всему эпидермису от базального до рогового слоя, а внутри каждого кератиноцита — в виде крупных меланосом эллиптической формы, надежно прикрывающих ядро клетки. В коже европейцев меланосомальные комплексы в основном сосредоточены только в базальном слое и неравномерно — в кератиноцитах.
В настоящее время выделяют три возможных механизма развития меланиновой гиперпигментации. Во-первых, увеличение выработки меланосом и их последующая транспортировка в кератиноциты. По этому механизму гипермеланоз развивается вторично при экзогенном воздействии гормональных средств, псораленов, других химических агентов или, возможно, обусловлен генетическими факторами. Во-вторых, увеличение размера меланосом. Этот тип характерен для гиперпигментации от наружного использования псораленов.
В-третьих, уменьшение скорости кератинизации эпидермиса. Такая гиперпигментация может возникнуть при использовании цитостатиков.

Веснушки у подростка
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Синдром Рубинштейна-Тейби
Синдром Рубинштейна-Тейби – генетически гетерогенное (по последним данным) наследственное заболевание, характеризующееся поражением центральной нервной системы, деформациями костей скелета и рядом других пороков развития. Симптомами этого состояния являются прогрессирующая умственная отсталость, низкий рост, расширение фаланг пальцев, полидактилия на ногах, разнообразные нарушения со стороны внутренних органов. Диагностика синдрома Рубинштейна-Тейби производится на основании данных настоящего статуса пациента, молекулярно-генетических анализов и других исследований. Специфического лечения данной патологии не существует, применяют симптоматическую терапию в зависимости от типа пороков и нарушений.
Общие сведения
Синдром Рубинштейна-Тейби – генетическое заболевание, которое сопровождается нарушениями интеллектуального и физического развития, а также разнообразными пороками скелета и внутренних органов. Впервые данная патология была выявлена в 1963 году и описана американскими педиатрами Дж. Рубинштейном и Г. Тейби – сами исследователи назвали заболевание «синдромом широкого первого пальца кистей и стоп, специфического лица и умственной отсталости». Дальнейшие исследования в области генетики подтвердили, что синдром Рубинштейна-Тейби является аутосомно-доминантной патологией, но подавляющее большинство случаев возникает вследствие спонтанных мутаций различного типа. Встречаемость составляет порядка 1:100 000-125 000, мальчики и девочки поражаются примерно с одинаковой частотой. Особенностью синдрома Рубинштейна-Тейби является повышенный риск развития различных онкологических заболеваний – главным образом, некоторых типов лейкозов, опухолей мозговых оболочек и нервных тканей.
Причины синдрома Рубинштейна-Тейби
Синдром Рубинштейна-Тейби обладает выраженной генетической гетерогенностью, однако различные типы этого заболевания не имеют каких-либо особенностей клинического течения. Наиболее часто причиной этой патологии выступают повреждения гена CREBBP, который расположен на 16-й хромосоме. Он кодирует так называемый CREB-связывающий белок, являющийся важным транскрипционным фактором, контролирующим экспрессию огромного количества генов. Появление в гене CREBBP различных изменений (точечных мутаций, транслокаций, микроделеций в 16-й хромосоме) приводит либо к образованию дефектного белка, неспособного выполнять свои функции, либо к полной блокировке его выделения. Это становится причиной развития синдрома Рубинштейна-Тейби.
В последние годы молекулярно-генетические исследования данной патологии подтвердили, что в ее развитии играют роль и мутации гена EP300, который располагается на 22-й хромосоме. Продуктом экспрессии данного гена является протеин p300, который, как и CREB-связывающий белок, относится к группе транскрипционных факторов. По данным исследований, идентифицировать характер генетического дефекта при синдроме Рубинштейна-Тейби удается в 55-60% случаев, примерно у половины пациентов обнаруживаются мутации гена CREBBP, еще у 40-45% выявляются делеции и другие хромосомные перестройки, затрагивающую 16-ю хромосому, и лишь у 3% больных наблюдаются мутации гена EP300. Все это указывает на возможность участия других генов в развитии этого заболевания.
Дефект белка-фактора транскрипции или его малое выделение (по причине гаплонедостаточности) приводит к многочисленным нарушениям, обусловленным недостаточной стимуляцией ряда других генов. Это можно заметить по характерной клинической картине синдрома Рубинштейна-Тейби. Оба транскрипционных фактора влияют на активность образования новых связей между нейронами, формирование долговременной памяти, стимуляцию иммунного ответа, развитие репродуктивной системы. Недостаточность этих белков ведет к целому каскаду патологических процессов в организме, что и составляет клинику синдрома Рубинштейна-Тейби. Кроме того, вышеуказанные транскрипционные факторы также влияют на активность антионкогенов, поэтому при их дефекте значительно возрастает риск развития злокачественных новообразований.
Симптомы синдрома Рубинштейна-Тейби
Симптоматика синдрома Рубинштейна-Тейби характеризуется значительным разнообразием у разных больных, что отражается на тяжести течения заболевания и его прогнозе. Обычно уже при рождении можно обнаружить некоторые признаки этой патологии – деформации лица и черепа (микро- или брахицефалия, расширение переносицы, эпикант, клювовидный нос), высокое арковидное нёбо, изменение формы и положения ушных раковин, расширенные фаланги пальцев, особенно первых. На ногах у больных синдромом Рубинштейна-Тейби нередко выявляется полидактилия. Иногда уже при рождении определяются признаки пороков развития внутренних органов – бледность или цианоз (при поражении легких или сердца), длительная желтуха новорожденных, крипторхизм.
При дальнейшем течении синдрома Рубинштейна-Тейби отмечается прогрессирующее отставание ребенка в физическом и умственном развитии от здоровых сверстников, затрудненное развитие речи и моторных навыков. Также наблюдается косоглазие, миопия. Выражение лица больных характеризуется гримасой, напоминающей улыбку, возникает гирсутизм, примерно у половины пациентов определяется наличие красного невуса в области лба, затылка или шеи. В старшем возрасте у больных синдромом Рубинштейна-Тейби выявляются искривления позвоночного столба различного характера и низкий рост (не более 150-160 сантиметров). Могут определяться деформации грудной клетки и (реже) другие скелетные аномалии, у мальчиков в большинстве случаев отмечается крипторхизм.
Постоянным признаком синдрома Рубинштейна-Тейби является умственная отсталость. Как правило, диагностируется ЗПР, олигофрения, значительная задержка речевого развития по сравнению со здоровыми сверстниками. Отмечаются нарушения концентрации внимания, больные легко отвлекаются на посторонние раздражители при выполнении какого-либо задания, возможны резкие перепады настроения. При этом лица с синдромом Рубинштейна-Тейби хорошо идут на контакт, легко социализируются. Среди других неврологических симптомов заболевания нередко обнаруживается плохая координация движений, изредка наблюдаются судорожные приступы.
Синдром Рубинштейна-Тейби может также проявляться различными нарушениями со стороны внутренних органов – головного мозга, сердца, почек и мочевыделительных путей, терминальных отделов пищеварительной системы. Кроме того, у таких больных значительно повышается риск возникновения онкологических заболеваний, в основном развивающихся в раннем возрасте. К ним относят различные формы лейкозов, меланому, некоторые типы лимфом. Поэтому до пубертатного периода больные синдромом Рубинштейна-Тейби должны периодически проходить обследования у онколога для ранней диагностики злокачественных новообразований.
Диагностика и лечение синдрома Рубинштейна-Тейби
Для выявления синдрома Рубинштейна-Тейби используют данные общего осмотра больного, рентгенологических исследований и молекулярно-генетических анализов, вспомогательную роль могут играть УЗИ и МРТ. При осмотре определяются характерные для этого заболевания аномалии развития лица (изменение формы и размеров черепа и носа, антимонголоидный разрез глаз), укорочение и расширение фаланг больших пальцев на руках и ногах, иногда – полидактилия. У взрослых больных синдромом Рубинштейна-Тейби также выявляют уменьшение роста, глубокую умственную отсталость, искривления позвоночника. На рентгенограммах можно увидеть изменения костей фаланг, позвоночника и грудной клетки, костный возраст несколько отстает от фактического.
Молекулярно-генетическая диагностика синдрома Рубинштейна-Тейби выполняется врачом-генетиком, который может использовать множество методов для определения этого заболевания. Точечные мутации в генах CREBBP и ЕР300 выявляются посредством прямого автоматического секвенирования кодирующей последовательности. Методика FISH используется в том случае, когда подозревается наличие делеций или транслокаций на 16-й хромосоме, также приводящих к развитию синдрома Рубинштейна-Тейби. Так как на основании фенотипических данных крайне сложно определить возможный тип генетического дефекта, в рамках диагностики этого заболевания нередко приходится применять сразу несколько техник современной молекулярной генетики.
Вспомогательные методы диагностики позволяют выявить сопутствующие нарушения внутренних органов при синдроме Рубинштейна-Тейби. К таким методам относят ультразвуковые исследования (УЗИ почек и мочевыделительных путей, ЭхоКГ), электрокардиографию, магнитно-резонансную томографию и другие методики. Нередко у больных синдромом Рубинштейна-Тейби диагностируют врожденные пороки сердца (открытый Боталлов проток, дефект межжелудочковой перегородки), аритмии, аномалии почек (удвоение, гипоплазия) и мочевыделительных путей (атрезии на различных участках). Также при этом заболевании нарушается формирование мозолистого тела головного мозга, что определяется при помощи магнитно-резонансной томографии. У части больных синдромом Рубинштейна-Тейби отмечаются пороки развития легких и пищеварительной системы.
Специфического лечения данной патологии на сегодняшний момент не существует, все терапевтические мероприятия сводятся к облегчению симптомов, коррекции аномалий и пороков развития, угрожающих жизни больных. Назначаются ноотропные средства, препараты кальция и витамина Д, для уменьшения выраженности умственной отсталости рекомендуют специализированную психологическую помощь. В ряде случаев при синдроме Рубинштейна-Тейби применяют хирургические методы лечения – для устранения пороков сердца, аномалий развития прямой кишки и мочевыделительных путей, крипторхизма. Также может потребоваться лечение у офтальмолога, а при признаках развития злокачественного новообразования – консультация и лечение у онколога.
Прогноз и профилактика синдрома Рубинштейна-Тейби
Согласно мнению большинства специалистов, прогноз синдрома Рубинштейна-Тейби чаще всего неопределенный или неблагоприятный. Это связано с тем, что данное заболевание характеризуется значительным спектром разнообразных нарушений – от относительно безопасных для жизни (легкие скелетные аномалии, умственная неполноценность) до ярко выраженных, способных привести к смерти в раннем возрасте (тяжелые пороки развития сердца, легких, почек). Кроме того, значительно повышен риск развития онкологических патологий. Поэтому прогноз синдрома Рубинштейна-Тейби составляется строго индивидуально, исходя из конкретной клинической картины и общего состояния больного. Каких-либо специфических методов профилактики этого заболевания из-за его частого спонтанного развития на сегодняшний день не разработано.
Болезнь Тея-Сакса ( Ганглиозидоз GM2 , Идиотия Тея-Сакса , Ранняя детская амавротическая идиотия )
Болезнь Тея-Сакса – это генетическое заболевание, характеризующееся недостаточностью фермента гексозаминидазы А, скоплением липоидных макромолекул в нейронах, нарушением функций головного и спинного мозга. Проявляется деградацией физических навыков и психических функций: распадом глотательного рефлекса, речи и произвольных движений, утратой слуха и зрения, снижением интеллекта. Развиваются судорожные приступы, атрофия мышц, паралич, деменция. Специфические методы диагностики – офтальмоскопия глазного дна, исследование количества гексозаминидазы в крови и нейронах. Лечение паллиативное, нацелено на облегчение симптомов.
МКБ-10
Синонимы болезни Тея-Сакса (БТС) – ганглиозидоз GM2, идиотия Тея-Сакса, ранняя детская амавротическая идиотия. Является одним из вариантов лизосомных болезней накопления. Названа по фамилиям двух врачей – невропатолога из США Бернарда Сакса и офтальмолога из Великобритании Уоррена Тея. В 80-е годы XIX века они впервые опубликовали независимые описания данной патологии. Ее распространенность крайне низка, в общей популяции средняя частота носителей рецессивного измененного гена составляет около 0,3%. Эпидемиологические показатели наиболее высоки в группе евреев ашкенази (носительство мутации определяется у 3%), а также у франкоканадцев и каджунов. Пик заболеваемости приходится на возраст от полугода до 2 лет, реже симптомы дебютируют у подростков и взрослых.
Причины
Метаболические нарушения, составляющие основу заболевания, вызваны мутацией гена HEXA, который находится на длинном плече 15 хромосомы. Он кодирует альфа-субъединицу фермента лизосом бета-N-ацетилгексозаминидазы А. Болезнь Тея-Сакса наследуется по аутосомно-рецессивному принципу – для возникновения симптоматики необходимо присутствие в хромосоме двух мутированных генов. Риск болезни у ребенка существует, только если оба супруга являются носителями мутации, составляет 25%. Таким образом, патология может проявиться в любом поколении независимо от того, когда произошла мутация. Носительство долгое время может оставаться скрытым – в этом случае доминантный «здоровый» ген в состоянии обеспечить организм производством фермента на 50% и более, что достаточно для нормального протекания биохимических реакций.
К началу 2000-х годов выявлено более 100 различных мутаций в генах HEXA: вставки в пары оснований, делеции пар оснований, сплайс-сайт мутации, точечные мутации и другие варианты изменений структуры гена. Каждая из этих мутаций определенным образом влияет на строение фермента и подавляет его активность. Разнообразие мутаций пары генов – компаундная гетерозиготность – определяет наличие нескольких форм болезни. Одинаково мутировавшие гены в аллели вызывают полную инактивацию катаболизма ганглиозидов. Наследование разных (не одинаковых) мутаций в паре генов чаще проявляется уменьшением активности фермента, а не полной инактивацией.
Патогенез
Основой развития болезни является отсутствие или недостаточная активность гексозаминидазы A – лизосомального фермента, катализирующего биодеградацию макромолекул ганглиозидов, олигосахаридов, гликозаминогликанов и гликолипидов. Ганглиозиды – тип жирных кислот, липидные компоненты мембран нейронов и глиальных клеток. Они обеспечивают активность нервных клеток: влияют на скорость и интенсивность нейропередачи, проведение нервных импульсов, распределение и хранение информации, формирование памяти. В норме ганглиозиды производятся, выполняют свои функции и быстро расщепляются в процессе многоступенчатой реакции с участием ферментов. Для гидролиза этих сложных липидов необходимы три компонента: альфа- и бета-субъединицы гексозаминидазы А, белок-активатор GM2A. При недостаточности альфа-гексозаминидазы А процесс биодеградации замедляется или становится полностью невозможным. Ганглиозиды накапливаются в лизосомах клеток головного, спинного мозга, приводят к их дисфункции и гибели.
Классификация
В зависимости от особенностей генетического дефекта, сохранности функций гексозаминидазы заболевание имеет быстропрогрессирующее или медленно прогрессирующее течение, проявляется в раннем детстве, подростничестве или во взрослом возрасте. Согласно этим характеристикам выделено 3 формы болезни:
- Острая инфантильная. Наиболее распространенная. Симптомы возникают через несколько месяцев после рождения. Течение прогрессирующее. Быстро ухудшаются двигательные навыки, развивается слепота, глухота, паралич. Смерть наступает в течение 2-3 лет.
- Поздняя ювенильная. Встречается крайне редко. Первые проявления обнаруживаются в промежутке от 2 до 10 лет. Постепенно распадаются приобретенные сложные навыки – ходьба, речь, письмо. Средняя продолжительность жизни больных – 15 лет.
- Хроническая взрослая. В научной литературе описаны единичные случаи данной формы, которая начинается в 25-30 лет. Характеризуется нарушением речи, произвольных двигательных актов, расстройствами психики (психозы). Прогноз летальности неизвестен.
Симптомы болезни Тея-Сакса
Клиническая картина болезни отражает процессы поражения ЦНС. При инфантильной форме первые симптомы становятся заметными к 3-5 месяцам, до этого развитие соответствует норме: ребенок держит голову, переворачивается на живот и обратно, агукает, улыбается при виде взрослого, устанавливает визуальный контакт. К 6 месяцам снижается заинтересованность окружающим миром. Малыш подолгу смотрит в сторону, апатичен, малоподвижен, чувствителен к громким звукам, яркому свету. Он перестает узнавать близких людей, с трудом фокусирует взгляд на любимых игрушках.
Ювенильная форма дебютирует менее явными симптомами. На начальном этапе несколько усиливается эмоциональная неустойчивость, при выполнении сложных двигательных комплексов – беге, ходьбе, быстром письме – появляется едва заметная дискоординация движений. Через некоторое время неуклюжесть и неловкость нарастают, замечаются окружающими и самим ребенком. К подростковому возрасту походка становится шаткой, неустойчивой. Формируются гиперкинезы – внезапные непроизвольные движения различных групп мышц. Нарушения координации не позволяют продолжать школьное обучение. Параллельно появляются расстройства речи сложного мозжечково-дизартрического характера: теряется плавность и ритмичность, произношение становится медленным, смазанным, невнятным. Поздние стадии болезни характеризуются частыми эпилептическими приступами, стойким снижением интеллектуальных функций (деменцией), утратой произвольности движений, параличом.
Хроническая форма заболевания имеет менее выраженные симптомы, течение сравнительно легкое. У пациентов наблюдаются перепады настроения, неуклюжесть, ухудшается произношение. На протяжении нескольких лет снижаются интеллектуальные функции: утрачивается способность к абстрактному мышлению, сравнению и анализу явлений и предметов, нарастает забывчивость и рассеянность. Спустя несколько лет после начала болезни развиваются психические расстройства: больные неадекватны в поведении, аффективно возбудимы, склонны к состояниям ажитации и глубокой депрессии, подвержены психозам с галлюцинациями и бредом. При длительном течении формируется органическая деменция.
Осложнения
В число симптомов БТС входят эпилептические приступы, представляющие собой результат внезапных вспышек аномальной биоэлектрической активности мозга. При их высокой частоте физическая и психическая деградация происходит быстрее. Во время приступа больные падают, бьются в конвульсиях, что сопровождается высоким риском удушья (западение корня языка), получения смертельных травм. Основным осложнением острой инфантильной формы заболевания являются инфекции: у детей снижены функции иммунной системы, поражение органов дыхания носит рецидивирующий характер, протекает крайне тяжело. Распространенная причина смерти – пневмония.
Диагностика
Обследование проводится детским неврологом, офтальмологом, генетиком, психиатром. Процесс постановки диагноза начинается со сбора клинико-анамнестических данных. Как правило, выявляются случаи БТС у родственников, наличие периода нормального развития пациента, затем деградация – распад приобретенных навыков, сформировавшихся функций. Дифференциальная диагностика направлена на исключение дегенеративных заболеваний ЦНС, ювенильной идиотии, эпилепсии. Для подтверждения диагноза выполняются следующие процедуры:
- Исследование глазного дна. Офтальмоскопия выявляет красное пятно на сетчатке напротив зрачка. Оно представляет собой скопление ганглиозидов в ганглиозных клетках.
- Биохимический анализ крови. Лабораторный тест определяет содержание альфа-субъединиц гексозаминидазы А. При острой детской форме патологии итоговые значения близки или равны нулю. При подостром и хроническом течении болезни выявляется остаточная активность фермента. Разработана генодиагностика заболевания.
- Микроскопическое исследование нейронов. В образцах биоматериала изучается содержание ганглиозидов. Характерно обнаружение дегенерации клеток: увеличение в размере, набухание, «баллонообразное» вздутие, заполнение мелкозернистым липоидным веществом.
Лечение болезни Тея-Сакса
В настоящее время эффективные способы терапии отсутствуют. Медицинская помощь больным нацелена на устранение симптомов и поддержание жизнедеятельности. Паллиативное лечение включает переход на зондовое питание, поскольку у пациентов утрачивается глотательный рефлекс, применение антибиотиков, противовирусных и иммуностимулирующих препаратов для борьбы с сопутствующими инфекционными заболеваниями. Терапия противоэпилептическими средствами не приносит положительного результата.
Поиск возможных способов лечения БТС продолжается. Исследования ведутся в трех направлениях: изучаются возможности ферментозаместительной, генной и субстратредуцирующей терапии. Замена отсутствующего фермента оказывается неэффективной из-за большого размера молекул гексозаминидазы, неспособных пройти сквозь гематоэнцефалический барьер и оболочку нейронов. Среди методов генотерапии опробовано введение нового генетического материала в клетки при помощи вирусного вектора и трансплантации стволовых клеток. Но положительных результатов не получено, исследования продолжаются. Наиболее перспективной считается субстратредуцирующая терапия с использованием фермента сиалидазы, который стимулирует катаболизм GM2 ганглиозидов. Ожидается разработка фармакологического препарата, повышающего экспрессию лизосомальных сиалидаз внутри нейронов.
Прогноз и профилактика
2. Клинический случай болезни Тея–Сакса с поздним началом/ Семенова О.В. и соавт.// Нервные болезни. - 2016 - №3.
Постковидный синдром ( Лонг-ковид , Постковид )
Постковидный синдром – это долгосрочные патологические проявления, сохраняющиеся в течение трех и более месяцев после новой коронавирусной инфекции. Основные признаки включают выраженную слабость, тяжесть в грудной клетке, ощущение неполного вдоха, головные, суставные и мышечные боли, нарушения сна, депрессию, снижение когнитивных функций, расстройство терморегуляции и др. Синдром диагностируется клинически с учетом предшествующего инфекционного анамнеза. Лечение включает симптоматическую фармакотерапию, реабилитацию (ЛФК, дыхательная гимнастика, поливитамины, физиотерапия).
Постковидный синдром (постковид, лонг-ковид) – новый, еще малоизученный феномен в современной терапевтической практике. Однако, несмотря на это, данная нозология уже признана мировым медицинским сообществом и заняла свое место в МКБ-10. По статистике, признаки постковидного синдрома испытывают на себе 10-20% людей, переболевших COVID-19. Различные симптомы у них сохраняются до 3-6 месяцев после перенесенной инфекции. Некоторые исследователи разделяют постковид и лонг-ковид, считая первый осложнениями излеченного COVID-19, а второй – хронической персистенцией вируса в организме.
Этиология постковидного синдрома непосредственно связана с перенесенной коронавирусной инфекцией. По данным ВОЗ, клиническое выздоровление при легком течении COVID-19 наступает примерно через 2 недели, а при средне-тяжелом и тяжелом – через 3-6 недель. Однако было замечено, что определенная симптоматика у больных сохраняется спустя несколько недель и даже месяцев после того, как инфекция разрешилась, а ПЦР-тест на коронавирус стал отрицательным. Предполагается, что постковидный синдром может быть связан с:
- остаточным воспалением (реконвалесцентная фаза);
- длительной персистенцией SARS-CoV-2 в скрытых очагах (латентная инфекция, подобно герпесу или ВИЧ);
- ПИТ-синдромом (длительная иммобилизация, ИВЛ);
- социальной изоляцией.
Факторы риска
Согласно наблюдениям, имеющимся на сегодняшний день, наиболее подверженными развитию постковидного синдрома являются следующие группы пациентов:
- взрослые старше 50 лет;
- лица, перенесшие тяжелую форму ковидной инфекции и длительную вентиляцию легких;
- люди с хроническими заболеваниями: ХСН, легочными патологиями, артериальной гипертензией, ожирением, сахарным диабетом, аутоиммунными заболеваниями.
Корреляция между тяжестью клинического течения COVID-19 и частотой и/или тяжестью постковидных симптомов прослеживается не всегда. Поствирусные синдромы характерны для периода реконвалесценции после других коронавирусов (в частности, SARS-CoV-1 и вызываемого им ТОРС), а также гриппа, инфекционного мононуклеоза, лихорадки Q, бруцеллеза и др.
Механизм постковидного синдрома, предположительно, связан с хроническим тромбоваскулитом, который преимущественно поражает нервную систему (центральную, периферическую, вегетативную), легкие, почки, кожу. SARS-CoV-2 инфицирует эндотелий сосудов, оказывая прямое повреждающее действие и нарушая его антикоагуляционные свойства. В результате возникают условия для образования микротромбов в микроциркуляторном русле.
Кроме этого, может иметь место иммунокоплексный ответ, связанный с отложением в сосудистых стенках внутренних органов иммунных депозитов, активацией системы комплемента, вызывающих аутоиммунное воспаление. Свою лепту в постковидный синдром, наряду с тромботической микроангиопатией и васкулитом, вносит венозная тромбоэмболия, тканевая гипоксия и ишемия органов.
Также нельзя не учитывать нейтротропность SARS-CoV-2, который попадая в ЦНС периваскулярно и трансневрально (через обонятельный нерв), напрямую поражает гипоталамус, лимбический комплекс, мозжечок, стволовые структуры.
Воздействие на ЦНС сопровождается нарушением терморегуляции, обоняния, слуха, сна, депрессивными состояниями. Поражение вегетативной НС проявляется дизавтономией, которая приводит в лабильности пульса, АД, дыхания, расстройствам пищеварения. Реакция периферической нервной системы выражается нарушениями чувствительности.
Симптомы
Четкой и однозначной клинической картины постковидного синдрома не существует, т. к. у разных пациентов набор симптомов варьируется в широких пределах. У одних выздоровевших долгосрочные симптомы напоминают те, которые они испытывали во время заражения, у других – появляются новые признаки. Такая вариабельность объясняется индивидуальным преморбидным фоном, поражением различных органов, предшествующим лечением и медицинскими вмешательствами.
В 80% случаев постковидный сидром сопровождается приступами резчайшей слабости. Многие пациенты буквально не могут подняться с кровати, не способны выполнять привычную повседневную физическую нагрузку. Более чем у половины страдающих постковидом нарушаются нормальные ритмы жизнедеятельности: развивается бессонница по ночам, дневная сонливость, изменяется режим сна и бодрствования. Часто больные сообщают о том, что видят необычные яркие сновидения.
Около 45% переболевших отмечают ночную и дневную потливость, периодический субфебрилитет или гипотермию, приступы познабливания. Примерно столько же сообщают о дыхательных нарушениях: чувстве заложенности в груди, бронхоспазме, кашле, нехватке воздуха. Депрессивные состояния, лабильность настроения, плаксивость присутствуют у 45-60% постковидных больных. Более чем в 40% наблюдений беспокоят цефалгии, кардиалгии, тахикардия. Нарушения регуляции АД сопровождаются гипертоническими кризами (30%), реже – эпизодами гипотонии и ортостатической гипотензии (15%).
Порядка 30% пациентов указывают на выпадение волос, ощущение жжения кожи. Кожные васкулиты сопровождаются вазоспазмом, папулезно-геморрагической сыпью. Характерны расстройства функции органов чувств: нарушения зрения, слуха, потеря вкусовых ощущений, аносмия. У четверти переболевших сохраняется диарея. Около 20% предъявляют жалобы на появление узелков и болезненности по ходу вен (флебиты), кожных сыпей.
Также может наблюдаться шаткость походки, диффузные миалгии, тремор конечностей, трудности с концентрацией внимания и памятью. У женщин нередки менструальные нарушения. У 75% больных симптомы постковидного синдрома носят волнообразный характер, у четверти – постоянный.
Постковидный синдром вызывает существенное снижение качества повседневной жизни. 30-35% людей спустя 3-4 месяца после заражения все еще не могут осуществлять полноценный уход за собой и детьми, вернуться к работе, нормальному ритму жизни. Треть переболевших, ранее занимавшихся спортом, не способны продолжать свои ежедневные упражнения в течение как минимум 6 месяцев.
Психиатрические последствия SARS-COV-2 ассоциированы с затяжными депрессиями (отмечаются у 60% переболевших) и суицидальными мыслями (20%). Исследования показывают увеличение числа случаев посттравматических стрессовых расстройств (ПТСР), панических атак, обсессивно–компульсивных расстройств на фоне COVID-19 по сравнению с прединфекционным уровнем.
В отдаленном периоде повышен риск тромбозов, тромбоэмболий, внезапной сердечной смерти. Неврологические осложнения включают ишемические инсульты, миелиты, полинейропатии, редко ‒ синдром Гийена-Барре. Реальные долгосрочные последствия новой коронавирусной болезни для популяционного здоровья еще предстоит оценить в ближайшие годы.
Диагностика постковидного синдрома во многом носит субъективный характер и основывается в основном на жалобах больных. В зависимости от превалирующих симптомов лечение может осуществлять врач-терапевт, невролог или кардиолог. Рекомендуемые исследования:
- Лабораторная диагностика. Для подтверждения факта перенесенного COVID-19 (если он не был лабораторно верифицирован ранее) следует сдать анализ на антитела к SARS-CoV-2. С целью оценки остаточных воспалительных изменений исследуют ОАК, СОЭ, СРБ, прокальцитонин, для выявления коагуляционных нарушений важны показатели Д-димера, фибриногена, РФМК.
- Инструментальная диагностика. При длительно сохраняющихся жалобах со стороны ССС необходимо пройти ЭКГ, мониторирование АД, ЭхоКГ. Если преобладают симптомы дыхательной дисфункции, целесообразно проведение спирометрии, по показаниям ‒ КТ легких. При других признаках постковида может потребоваться УЗИ ОБП и почек, УЗДС вен нижних конечностей, ЭЭГ, полисомнография.
- Психодиагностика. Больным с тревожными и депрессивными симптомами, когнитивными нарушениями необходима консультация клинического психолога или психотерапевта с проведением патопсихологической диагностики.
Лечение постковидного синдрома
Существенное негативное влияние синдрома на качество жизни диктует необходимость разработки стратегии постковидной реабилитации. В настоящее время клинические рекомендации по лечению постковида не разработаны. В основном терапия носит симптоматическую и общеукрепляющую направленность. Пациентам, испытывающим постковидные симптомы, рекомендуется:
- Фармакотерапия. Для купирования неврологических симптомов назначаются комбинированные препараты (магний+пиридоксин), глицин, валериана. При тахикардии и кардиалгии обосновано применение бета-блокаторов. Некоторым выздоровевшим пациентам показан пролонгированный прием глюкокортикоидов и прямых антикоагулянтов. Рекомендован прием витаминов С, D, добавок цинка и селена.
- Физкультура. Расширение физической активности должно быть постепенным, но систематическим. В постковидном периоде полезны дозированные занятия лечебной физкультурой, дыхательной гимнастикой, ходьба, плавание.
- Физиотерапия. В рамках комплексных программ постковидной реабилитации используются физиотерапевтические процедуры: магнитотерапия, импульсные токи, электрофорез, небулайзерная терапия. Обосновано применение оздоровительного массажа, галотерапии, рефлексотерапии.
- Психотерапия. Для коррекции психоэмоциональных расстройств используется когнитивно-поведенческая терапия, мотивационное интервьюирование.
Среднесрочные и долгосрочные последствия COVID-19 для здоровья переболевших на данный момент неизвестны. Течение постковидного синдрома может быть волнообразным, растягиваться на многие месяцы. В большинстве случаев в течение полугода постковидный синдром постепенно регрессирует или исчезает полностью. У некоторых пациентов сохраняются длительные полиорганные нарушения, развиваются осложнения.
Следует избегать действия триггеров, которые могут провоцировать обострения постковидной симптоматики: значительных физических нагрузок, переутомления, стрессовых ситуаций, инсоляции. Женщинам и мужчинам репродуктивного возраста, перенесшим коронавирусную инфекцию, на протяжении полугода не рекомендуется планировать зачатие. Также всем переболевшим в течение этого периода следует воздержаться от любой плановой иммунизации.
1. Коронавирусный синдром: профилактика психотравмы, вызванной COVID-19/ Соловьева Н.В., Макарова Е.В. , Кичук И.В. // РМЖ. - №9. – 2020.
2. Into the looking glass: Post-viral syndrome post COVID-19/ R. Perrin, L. Riste, M. Hann – Nov., 2020.
3. Post-COVID-19 Fatigue: Potential Contributing Factors/ Thorsten Rudroff, Alexandra C. Fietsam, Justin R. Deters, Andrew D. Bryant, John Kamholz// Brain Sci. - 2020, №10.
4. Needs to Prepare for «Post-COVID-19 Syndrome»/ Robert L. Klitzman// The American Journal of Bioethics. ‒ 26 Oct. 2020.
Синдром Тэя - клиника, диагностика, лечение
Болезнь Тея-Сакса: причины, диагностика, лечение
Этиология и встречаемость болезни Тея-Сакса. Болезнь Тея-Сакса (MIM №272800), раннедетский ганглиозидоз GM2, — панэтническое аутосомно-рецессивное заболевание распада ганглиозидов, вызванное недостаточностью гексозаминидазы А (см. главу 12). Кроме раннедетской тяжелой формы, недостаточность гексозаминидазы А вызывает легкую форму болезни с началом в юношеском или взрослом возрасте.
Встречаемость недостаточности гексозаминидазы А широко варьирует в различных популяциях; встречаемость болезни Тея-Сакса в Северной Америке колеблется от 1 на 3600 новорожденных у евреев ашкенази до 1 на 360 000 среди не ашкенази евреев. Сравнимую с евреями-ашкенази встречаемость болезни Тея-Сакса имеют французские канадцы, каджуны в Луизиане и амиши в Пенсильвании. Повышенная частота носительства в этих четырех популяциях — следствие генетического дрейфа, хотя не исключено преимущество гетерозигот.
Патогенез болезни Тея-Сакса
Ганглиозиды — церамидовые олигосахариды, присутствующие в поверхностных мембранах всех клеток, но больше всего их в клетках мозга. Ганглиозиды концентрируются в поверхностных мембранах нейронов, особенно в аксонах и дендритах. Они функционируют как рецепторы различных гликопротеиновых гормонов и бактериальных токсинов и задействованы в дифференцировке клеток и межклеточном взаимодействии.
Гексозаминидаза А — лизосомный фермент, состоящий из двух субъединиц. а-Субъединица кодируется геном НЕХА в хромосоме 15, а бета-субъединица — геном НЕХВ в хромосоме 5. В присутствии белка-активатора гексозаминидаза А удаляет концевой N-ацетилгалактозамин из ганглиозида GM2.
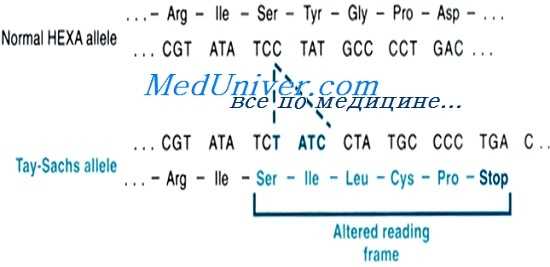
Мутации генов а-субъединицы или белка-активизатора вызывают накопление GM2 в лизосомах и, этим самым, раннедетский, позднедетский или взрослый тип болезни Тея-Сакса. [Мутация а-субъединицы вызывает болезнь Сандхоффа (MIM № 268800)].
Механизм того, как накопление ганглиозида GM2 вызывает смерть нейронов, полностью не определен, хотя, по аналогии с болезнью Гоше, нейропатологию могут вызывать токсичные побочные продукты ганглиозида GM2. Уровень остаточной активности гексозаминидазы А обратно пропорционален тяжести болезни.
Пациенты с раннедетской формой ганглиозидоза GM2 имеют два патологических аллеля, приводящих к полному отсутствию активности гексозаминидазы. Пациенты с формами ганглиозидоза GM2 с началом в юношеском или взрослом возрасте — обычно сложные гетерозиготы по аллелю с полным отсутствием функции и аллелю с небольшой остаточной активностью гексозаминидазы А.
Фенотип и развитие болезни Тея-Сакса
Судороги обычно начинаются в конце первого года жизни и непрерывно становятся все тяжелее. Дальнейшее ухудшение на втором году жизни заканчивается децеребрационной ригидностью, затруднениями глотания, тяжелыми судорогами и, наконец, вегетативным состоянием.
Ганглиозидоз GM2 с позднедетским началом выявляют на 2-4 годах жизни, он характеризуется неврологической симптоматикой, начинающейся с атаксии и дискоординации. К концу первого десятилетия большинство пациентов имеют спастичность и судороги; к 10-15 годам у большинства развивается децеребрационная ригидность и вегетативное состояние со смертью обычно во втором десятилетии жизни. Снижение зрения отмечают, но может не быть «вишневой косточки» на глазном дне; атрофия зрительного нерва и пигментный ретинит часто появляются в конце течения болезни.
Взрослый тип ганглиозидоза GM2 имеет выраженную клиническую изменчивость (прогрессирующая дистония, спиноцеребеллярная дегенерация, патология моторных нейронов или психиатрические нарушения). До 40% больных имеют прогрессирующие психиатрические проявления без психоза. Зрение затрагивается редко, и данные офтальмологического обследования обычно в норме.
Особенности фенотипических проявлений болезни Тея-Сакса:
• Возраст начала: от раннего детства до взрослого возраста
• Нейродегенерация
• «Вишневая косточка»
• Психоз
Лечение болезни Тея-Сакса
Диагноз ганглиозидоза GM2 ставят на основании выявления как отсутствующей или почти отсутствующей активности гексозаминидазы А в сыворотке крови или в лейкоцитах, так и нормальной или повышенной активности гексозаминидазы В. Для диагностики также можно использовать анализ мутаций в гене НЕХА, но обычно его выполняют только для уточнения транспортного носительства и пренатальной диагностики.
Болезнь Тея-Сакса в настоящее время — инкурабельное заболевание; следовательно, лечение направлено на устранение симптомов и паллиативный уход. Почти все больные требуют фармакологического лечения судорог. Психиатрические проявления пациентов с взрослым типом ганглиозидоза GM2 обычно не поддаются стандартным антипсихотическим или противодепрессивным средствам; наиболее эффективны препараты лития и электросудорожная терапия.
Риски наследования болезни Тея-Сакса
Для потенциальных родителей без GM2-ганглиозидоза в семейном анамнезе эмпирический риск родить ребенка, больного СМ2-ганглиозидозом, зависит от частоты заболевания в их этнических группах. Для большинства жителей северной Америки эмпирический риск носительства составляет приблизительно 1 на 250-300, но для евреев-ашкенази эмпирический риск носительства — приблизительно 1 на 30. Для пары, в которой оба родителя носители, риск родить ребенка с ганглиозидозом GM2 равен 1/4.
Пренатальная диагностика основана на идентификации мутаций в гене НЕХА или на определении недостаточности гексозаминидазы А в тканях плода, например, ворсинах хориона или амниоцитах. Для эффективной идентификации пораженного плода с помощью анализа мутации в гене НЕХА обычно необходимо, чтобы мутации, вызывающие ганглиозидоз GM2 в семье, уже были известны.
Скрининг популяций высокого риска на носительство и последующие превентивные мероприятия уменьшили встречаемость болезни Тея-Сакса среди евреев-ашкенази почти на 90%. По традиции такой скрининг выполняют по определению активности гексозаминидазы А сыворотки крови с искусственным субстратом.
Этот чувствительный метод, тем не менее, не способен различить патологические мутации и псевдонедостаточность (снижение распада искусственного субстрата, но нормальный распад естественного субстрата); следовательно, носительство обычно подтверждают молекулярным анализом НЕХА. В гене НЕХА обнаружено два аллеля псевдонедостаточности и более 70 патологических мутаций.
Среди евреев-ашкенази, положительных по результатам ферментного скрининга, 2% — гетерозиготны по аллелю псевдонедостаточности, и 95-98% гетерозиготны по одной из трех патологических мутаций, две вызывают раннедетскую форму, одна — взрослую форму GM2-ганглиозидоза. В отличие от этого, среди остальных североамериканцев, положительных по результатам ферментативного скрининга, 35% — гетерозиготны по аллелям псевдонедостаточности.
Пример болезни Тея-Сакса. Семейная пара, оба евреи ашекенази, направлена в клинику генетики для оценки риска родить ребенка с болезнью Тея-Сакса. Сестра жены умерла от болезни Тея-Сакса в детстве. Дядя мужа по отцу находится в психиатрической лечебнице, но его диагноз неизвестен. Как муж, так и жена отказались от скрининга на носительство болезни Тея-Сакса в подростковом возрасте.
Анализ фермента показал, что как муж, так и жена имеют чрезвычайно низкую активность гексозаминидазы А. Последующий молекулярный анализ мутаций, преобладающих у евреев ашкенази, подтвердил, что у жены имеется патогенная мутация, тогда как у мужа только аллель псевдонедостаточности.
Читайте также:
- Питание при постгастррезекционной дистрофии. Смеси Нутрихим
- Непрерывно-узловой шов. Двухрядный шов. Шов Альберта. Шов Черни. Шов Кирпатовского. Шов Вахтангишвили.
- Примеры эпителиомы (аденомы) пигментного эпителия сетчатки симулирующей меланоцитому
- Лучевая диагностика рака двенадцатиперстной кишки
- Развод и девичья фамилия. Как пережить трудности развода?
