Сосудистые мальформации толстой кишки - диагностика
Добавил пользователь Евгений Кузнецов Обновлено: 28.01.2026
Сосудистые мальформации толстой кишки - диагностика
Ангиодисплазия — наиболее распространенная сосудистая мальформация толстой кишки. Этот отчетливый клинический и патологический синдром поражения слепой и/или восходящей ободочной кишки встречается у больных 70—80 лет. Иногда, при развитии в более молодом возрасте, заболевание бывает связано с поражением клапана аорты и хроническими обструктивными заболеваниями легких.
Поражения множественные, маленького размера, плоские, при рентгенографии с двойным контрастированием барием практически не видны. Более широкое применение колоноскопии подтвердило, что данная патология оказывается значительной и частой причиной кровотечения из нижних отделов ЖКТ. Кровотечения бывают эпизодические и обильные или незначительные и приводят к железодефицитной анемии.
Попытки терапевтической облитерации тепловыми методами при помощи эндоскопа приводят к раннему рецидиву, так как видимое поражение — лишь верхушка гораздо более выраженных сосудистых аномалий, расположенных глубоко в слизистой оболочке.
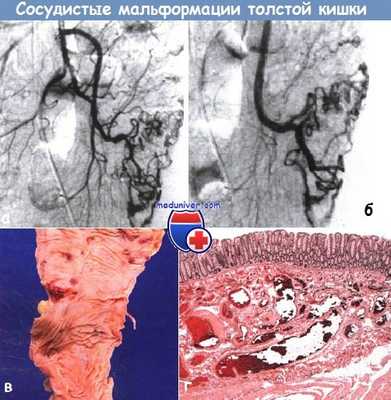
а,б - Ангиография при ангиодисплазии. В ранней артериальной фазе (а) видно расширение подвздошно-толстокишечных артерий и их дистальных ветвей, кровоснабжающих толстую кишку с сосудистыми озерами и ранним венозным возвратом, ниже дистальных ветвей подвздошно-толстокишечной артерии отмечено раннее появление контраста в венах.
Поздняя артери альная фаза (б). Крайне выраженный венозный дренаж от слепой кишки, в артериальной системе тонкой кишки все еще виден контраст.
в - Правосторонняя гемиколэктомия, операционный препарат: длинный отрезок восходящей ободочной кишки с множественными ангиодисплазиями в слизистой оболочке.
г - Микроскопическая картина спорадической сосудистой эктазии (ангиодисплазия) правой половины толстой кишки.
На поверхности подслизистого слоя наблюдается пролиферация застойных эктазированных посткапиллярных венул и вен.
При остром кровотечении бывает сложно выполнить колоноскопию. В таком случае участки расширенных сосудов иногда диагностируют при помощи селективной ангиографии, решая вопрос о необходимости терапевтической эмболизации. При контрастном рентгенологическом исследовании отмечают быстрое раннее заполнение дренирующих вен из-за наличия артериовенозных шунтов. Поражения менее 3—5 мм в диаметре практически не видны, но это не отменяет необходимости резекции пораженного участка толстой кишки.
Даже когда при колоноскопии и ангиографии не удается установить истинную причину поражения, эти исследования позволяют хирургу сократить объем резекции. Макроскопическими методами диагностики определяют множественные мелкие участки поражения. Гистологический спектр поражений варьирует от небольшого количества расширенных подслизистых вен с несколькими тонкостенными капиллярами в слизистой оболочке до полностью замещающих участки слизистой оболочки скоплений сосудов, содиняющихся с эктазированными капиллярами. Внутриартериальное введение сульфата бария в свежий послеоперационный препарат служит хорошим методом диагностики небольших поражений.
Выраженная ангиодисплазия может представлять собой крайнюю форму множественных телеангиэктазий, но генетическое происхождение может различаться. Толстокишечное кровотечение может давать клиническую картину болезни Рандю— Вебера—Ослера.
Гемангиомы и сосудистые мальформации толстой кишки дают кровотечение как при синдроме Клиппеля—Треноне, включающего кожные гемангиомы, варикозные вены, гипертрофию костей и мягких тканей отдельной конечности. Встречают несиндромные гемангиомы толстой кишки. У пациентов с портальной гипертензией, как правило, обнаруживают варикоз вен толстой кишки.
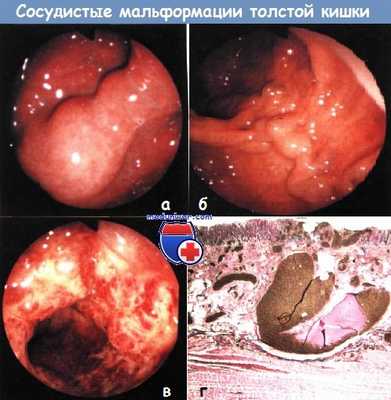
а - Сосудистая мальформация толстой кишки у пациента с синдромом Клиппеля-Треноне.
б - Гемангиома толстой кишки.
в - Варикозные вены в толстой кишке у больного с портальной гипертензией.
г - Микроскопическая картина спорадической сосудистой эктазии (ангиодисплазии) правой половины толстой кишки.
Подслизистое поражение обнаружено при введении в сосуды операционного препарата бария с желатином.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Ангиодисплазия толстой кишки
Ангиодисплазия толстой кишки – это заболевание, сопровождающееся расширением и деформацией сосудов, кровоснабжающих дистальный отдел кишечника. Основным симптомом болезни являются периодические кровянистые выделения из прямой кишки, которые при длительном течении патологии могут привести к развитию анемии. Для диагностики используется общий анализ крови, анализ кала на скрытую кровь, колоноскопия, ангиография мезентериальных сосудов, ирригоскопия и радионуклидная сцинтиграфия толстого кишечника. Наиболее эффективны малоинвазивные хирургические методы лечения, консервативные методики находятся на стадии разработки.
МКБ-10
Общие сведения
Ангиодисплазия толстой кишки является дегенеративным заболеванием, в основе которого лежит стойкая дилатация кровеносных сосудов с их деформацией и истончением. Болезнь выявляется преимущественно у пожилых людей в возрасте старше 60 лет. Ангиодисплазия одинаково часто встречается у мужчин и женщин. Данная патология является причиной 4% всех случаев кровотечений из толстого кишечника. Заболевание в большинстве случаев не приводит к летальному исходу, но значительно ухудшает качество жизни пациентов. Диагностикой и лечением патологии занимаются проктологи Специалисты разрабатывают инновационные методы лечения болезни, которые бы могли эффективно препятствовать кровотечениям из толстого кишечника.
Причины
На сегодняшний день точные причины ангиодисплазии толстой кишки до конца не ясны. Дисплазию могут вызывать постоянные спазмы толстого кишечника, при которых происходит расширение кровеносных сосудов. Часто причиной данной патологии являются болезни желудочно-кишечного тракта, сердечно-сосудистые заболевания, патология почек и легких, проблемы с кровеносными сосудами кишечника и болезнь Виллебранда. Независимо от причины, приобретенная ангиодисплазия представляет собой заболевание, при котором наблюдается патологическое строение нормально сформированных кровеносных сосудов кишечника. Ученые также называют подобное состояние сосудистыми эктазиями или телеангиэктазиями.
По мнению большинства специалистов в сфере современной проктологии, под влиянием различных причин наступает периодическая обструкция вен подслизистого слоя, которая является следствием спазма гладкой мускулатуры. Все это с течением времени приводит к дилатации вен и капиллярной сети. На этом фоне формируется приобретенная ангиодисплазия толстой кишки. Данное патологическое состояние может сопровождаться ишемией, которая усугубляет течение заболевания. В ряде случаев ангиодисплазия толстой кишки может быть врожденной. Эта патология представляет собой наличие в кишечнике сосудистого образования – сосудистой мальформации. Врожденный вариант ангиодисплазии считается более редкой патологией.
Симптомы ангиодисплазии
Основным проявлением ангиодисплазии толстой кишки являются кровотечения. На фоне этого часто развивается анемия. Большинство кровотечений не являются жизнеугрожающими. Только у 15% пациентов наблюдаются массивные потери крови, которые могут стать причиной летального исхода. Приобретенная ангиодисплазия толстой кишки развивается чаще всего у лиц старше 60 лет. Основной жалобой больных являются кровотечения из заднего прохода. Эти симптомы возникают на фоне физической нагрузки или же появляются без конкретной причины. Часто пациенты с данной патологией подвергаются оперативным вмешательствам по поводу кишечных кровотечений. Больные с ангиодисплазией толстой кишки обращаются к проктологам, хирургам и гастроэнтерологам, однако после операции четко установить причину кровотечений не удается.
Врожденная ангиодисплазия толстого кишки начинает проявляться в раннем детстве или сразу после рождения. Клиническая картина в таком случае также представлена кишечными кровотечениями. Нередко кровянистые выделения появляются после каждого акта дефекации. Важным симптомом данного заболевания является абсолютная безболезненность кровотечений и их четкая связь с выделением каловых масс. Кроме того, при врожденной ангиодисплазии толстой кишки наблюдается тенденция к нарастанию объема кровотечений с течением времени. Период манифестации заболевания, частота и выраженность клинических проявлений зависят от степени поражения толстого кишечника.
Диагностика
Диагностические мероприятия при подозрении на ангиодисплазию толстой кишки назначаются в ходе консультации проктолога. Для диагностики заболевания используется эндоскопия и другие инструментальные методики. Основным методом считается колоноскопия с биопсией, которая позволяет изучить состояние слизистой толстого кишечника. При ангиодисплазии толстой кишки могут наблюдаться локальные изменения, которые характерны для геморрагической телеангиэктазии, синдрома CREST и синдрома Шерешевского-Тернера. Отличительной особенностью ангиодисплазии является то, что при этой патологии не наблюдается остальных клинических проявлений, характерных для данных синдромов.
Колоноскопия имеет высокую разрешающую способность, благодаря которой можно четко диагностировать распространение патологического процесса по толстому кишечнику. При ангиодисплазии врожденного генеза эндоскопически выявляются сосудистые выпячивания на слизистой оболочке, которые имеют вид неровных возвышений разнообразной формы. Данные сосудистые элементы, как правило, наполнены кровью. Следующим важным методом диагностики заболевания является ангиография, при которой изучают состояние сосудов толстого кишечника. Эта методика предусматривает введение рентгенконтрастного вещества в венозный кровоток. Более узконаправленной диагностической процедурой считается сцинтиграфия толстой кишки. Ее проводят путем введения меченых эритроцитов. Ограничением данной методики является то, что кровотечение при ангиодисплазии обычно не носит постоянного характера.
Контрастное рентгенологическое исследование - ирригоскопия с введением бария позволяет не только диагностировать ангиодисплазию толстой кишки, но и уточнить ее распространенность по отделам кишечника. Кроме того, данная методика позволяет определить состояние окружающих тканей, ширину и функциональные возможности кишки. Также для диагностики данного заболевания используются лабораторные исследования. Обязательным является проведение общего анализа крови, в котором можно обнаружить признаки анемии вследствие кровопотери. Рекомендуется проводить анализ кала на скрытую кровь, который позволяет определить наличие крови в испражнениях.
Лечение ангиодисплазии толстой кишки
Основным методом лечения заболевания являются эндоскопические облитерирующие операции. Однако их проведение не исключает вероятность повторных кровотечений. Если больному по какой-либо причине нельзя провести хирургическое лечение, ему показана эмболизация сосудов посредством введения специальных полимеров или гелевой пены. Терапевтическая тактика при ангиодисплазии толстой кишки зависит от объема кровопотери, периодичности возникновения кровотечений и других факторов. В последнее время все чаще используется медикаментозное лечение, которое устраняет кровотечения вследствие дисплазии в сосудах кишечника. По данным ряда исследований, хорошие результаты дают гормональные препараты октреотид и талидомид. Однако, по данным других специалистов, эти средства оказались недостаточно эффективными.
Перспективными методами лечения в последнее время считают воздействие на мезентериальный кровоток и блокаду вазорасширяющих пептидов. Наиболее распространенными терапевтическими методами лечения считают применение препаратов эстрогена и прогестерона. При небольших редко возникающих кишечных кровотечениях могут использоваться методы фотокоагуляции, эндоскопической абляции и склерозирующей терапии . Если у пациента часто возникают профузные кровотечения, которые резко ухудшают клиническое состояние и приводят к анемизации, то ему показано удаление кровоточащего участка кишечника. Чаще всего производится сигмоидэктомия, возможно проведение резекции прямой кишки. После подобных вмешательств выполняются реконструктивные операции на сигмовидной и прямой кишке.
Прогноз и профилактика
Профилактика ангиодисплазии толстой кишки заключается в своевременном лечении болезней желудочно-кишечного тракта и другой хронической патологии, способной спровоцировать развитие данного заболевания. Прогноз для жизни в большинстве случаев благоприятный, хотя проктологам не всегда удается добиться полного излечения пациентов.
Болезнь Гиршспрунга - диагностика
Болезнь Гиршспрунга — результат отсутствия автономных интрамуральных ганглиев в подслизистом и мышечном нервных сплетениях дистальной части толстой кишки. Заболевание в разной степени поражает толстую и прямую кишку и очень редко — тонкую кишку. Поражения возникают через каждые 3—10 см. Между нормальными и аганглионарными участками кишки располагаются гипоганглионарные сегменты.
Заболевание характерно для младенцев и маленьких детей, у старших детей и взрослых лиц проявляется как пожизненный запор. Существует семейная предрасположенность к данной патологии; мужчины заболевают чаще, чем женщины. Аганглиноз вызывает функциональную гиперактивность. Дефицит пропульсивной активности приводит к тому, что внутренний сфинктер находится в состоянии постоянного сокращения, степень которого зависит от ближайшего расширения. Большую часть случаев обнаруживают в течение первой недели жизни.
Отсутствие выделения мекония, рвота желчью и растяжение живота требуют медицинского вмешательства. В менее тяжелых случаях с задержкой выделения мекония, запором, растяжением живота разной степени выраженности заболевание вначале не диагностируют. При дефекации фекалии в виде лент и имеют отвратительный запах. При пальпации в брюшной полости прощупывают каловые массы, бывает видимая перистальтика, реже всего наблюдают недержание кала.
Часто диагноз ставят после обзорной рентгенограммы брюшной полости при обнаружении растяжения кишечных петель газом с его отсутствием в полости таза. Контрастное рентгенологическое исследование (лучше с водорастворимыми препаратами) позволяет определить суженный колоректальный сегмент с проксимальным расширением (мегаколон).
Диагноз подтверждают манометрическими исследованиями, устанавливая аганглионарные сегменты и отсутствие расслабления внутреннего сфинктера в ответ на баллонную дилатацию прямой кишки. Поздняя постановка диагноза чревата серьезными осложнениями: перфорацией кишечника, недоеданием, задержкой роста. В легких случаях единственным симптомом бывает хронический запор, иногда со стеркоральной язвой, которые возникают и при отсутствии болезни Гиршспрунга.
При болезни Гиршспрунга в процесс вовлечены оба сплетения, поэтому необходимы биопсии на всю толщину стенки кишки. Для гистологического подтверждения диагноза достаточно стандартной биопсии прямой кишки с захватом подслизистого слоя. Гистологическое исследование обнаруживает отсутствие ганглионарных клеток. Аномальные нейроны определяют специфическими методами окраски, в свежеполученных образцах ткани находят избыток ацетилхолинэстеразы. В слизистой оболочке и подслизистом слое увеличены количество и размер положительно окрашенных волокон.
Для определения длины пораженного сегмента при планировании хирургического лечения необходимо взять многочисленные биопсии по все длине прямой и дистальной части толстой кишки.
а - Обзорная рентгенограмма брюшной полости взрослого с недавно диагностированной болезнью Гиршспрунга.
Прямая кишка (показана стрелкой) значительно расширена.
б - Зона перехода расширенной нормальной кишки к нерасширенному аганглионарному участку.
Боковой рентгеновский снимок с использованием контраста.
в - Стеркоральные язвы у пациента с болезнью Гиршспрунга. Ректороманоскопия.
г - Стеркоральная язва в нижних отделах толстой кишки при простом запоре. Гистологическое исследование прямой кишки при болезни Гиршспрунга.
Криостатные срезы (а) окрашены для выявления ацетилхолинэстеразы.
При таком способе окраски у пациента с болезнью Гиршспрунга видны аномально утолщенные нервные волокна в слизистой оболочке (б) и редкие тонкие нервные волокна в обычной слизистой оболочке.
Артериовенозные мальформации головного мозга ( Церебральные АВМ )
Артериовенозные мальформации головного мозга — врожденные аномалии церебральных сосудов, характеризующиеся образованием локального сосудистого конгломерата, в котором отсутствуют капиллярные сосуды, а артерии напрямую переходят в вены. Артериовенозные мальформации головного мозга проявляются упорными головными болями, эпилептическим синдромом, интракраниальным кровотечением при разрыве сосудов мальформации. Диагностика осуществляется при помощи КТ и МРТ сосудов головного мозга. Лечение хирургическое: транскраниальное иссечение, радиохирургическое вмешательство, эндоваскулярная эмболизация или комбинация этих методик.
Артериовенозные мальформации головного мозга (церебральные АВМ) — измененные участки церебральной сосудистой сети, на которых вместо капилляров имеются многочисленные разветвления извитых артерий и вен, формирующих единый сосудистый конгломерат, или клубок. АВМ относятся к сосудистым аномалиям развития головного мозга. Встречаются у 2 человек из 100 тыс. населения. В большинстве случаев клинически дебютируют в период от 20 до 40 лет, в отдельных случаях — у лиц старше 50 лет. Артерии, формирующие АВМ, имеют истонченные стенки с недоразвитым мышечным слоем. Это обуславливает главную опасность сосудистых мальформаций — возможность их разрыва.
При наличии АВМ головного мозга риск ее разрыва оценивается примерно 2-4% в год. Если кровоизлияние уже имело место, то вероятность его повтора составляет 6-18%. Смертность при внутричерепном кровоизлиянии из АВМ наблюдается в 10% случаев, а стойкая инвалидизация отмечается у половины пациентов. Из-за истончения артериальной стенки на участке АВМ может сформироваться выпячивание сосуда — аневризма. Летальность при разрыве аневризмы сосудов головного мозга намного выше, чем при АВМ, и составляет около 50%. Поскольку АВМ опасны внутричерепным кровоизлиянием в молодом возрасте с последующей летальностью или инвалидизацией, их своевременная диагностика и лечение являются актуальными проблемами современной нейрохирургии и неврологии.
Причины АВМ головного мозга
Артериовенозные мальформации головного мозга возникают в результате внутриутробных локальных нарушений формирования церебральной сосудистой сети. Причинами таких нарушений являются различные вредоносные факторы, влияющие на плод в течение антенатального периода: повышенный радиоактивный фон, внутриутробные инфекции, заболевания беременной (сахарный диабет, хронический гломерулонефрит, бронхиальная астма и др.), интоксикации, вредные привычки беременной (наркомания, курение, алкоголизм), прием во время беременности фармпрепаратов, имеющих тератогенный эффект.
Церебральные артериовенозные мальформации могут располагаться в любом месте головного мозга: как на его поверхности, так и в глубине. В месте локализации АВМ отсутствует капиллярная сеть, циркулирование крови происходит из артерий в вены напрямую, что обуславливает повышенное давление и расширение вен. При этом сброс крови в обход капиллярной сети может повлечь за собой ухудшение кровоснабжения церебральных тканей в месте расположения АВМ, приводя к хронической локальной ишемии мозга.
Классификация АВМ головного мозга
По своему типу мальформации церебральных сосудов классифицируются на артериовенозные, артериальные и венозные. Артериовенозные мальформации состоят из приводящей артерии, дренирующей вены и расположенного между ними конгломерата измененных сосудов. Выделяют фистулезную АВМ, рацинозную АВМ и микромальформацию. Около 75% случаев занимают рацинозные АВМ. Изолированные артериальные или венозные мальформации, при которых наблюдается извитость соответственно только артерии или только вены, встречаются достаточно редко.
По размеру церебральные АВМ подразделяются на малые (диаметром менее 3 см), средние (от 3 до 6 см) и большие (свыше 6 см). По характеру дренирования АВМ классифицируют на имеющие и не имеющие глубокие дренирующие вены, т. е. вены, впадающие в прямой синус или систему большой церебральной вены. Различают также АВМ, локализующиеся в или за пределами функционально значимых областей. К последним относят сенсомоторную кору, мозговой ствол, таламус, глубинные зоны височной доли, сенсорную речевую область (зону Ве́рнике), центр Брока, затылочные доли.
В нейрохирургической практике для определения риска оперативного вмешательства по поводу церебральных сосудистых мальформаций используется градация АВМ в зависимости от совокупности баллов. Каждому из признаков (размер, тип дренирования и локализация по отношению к функциональным зонам) присуждается определенное количество баллов от 0 до 3. В зависимости от набранных балов АВМ классифицируется от имеющей незначительный операционный риск (1 балл) до связанной с высоким операционным риском из-за технической сложности ее ликвидации, большого риска смертельного исхода и инвалидности (5 баллов).
Симптомы АВМ головного мозга
В клинике церебральных АВМ выделяют геморрагический и торпидный варианты течения. По различным сведениям, геморрагический вариант составляет от 50% до 70% случаев АВМ. Он типичен для АВМ небольшого размера, имеющих дренирующие вены, а также для АВМ, располагающихся в задней черепной ямки. Как правило, в таких случаях у пациентов наблюдается артериальная гипертензия. В зависимости от локализации АВМ возможно субарахноидальное кровоизлияние, которое занимает около 52% от всех случаев разрыва АВМ. Остальные 48% приходится на осложненные кровоизлияния: паренхиматозные с формированием внутримозговой гематомы, оболочечные с образованием субдуральной гематомы и смешанные. В ряде случаев осложненные кровоизлияния сопровождаются кровоизлиянием в желудочки головного мозга.
Клиника разрыва АВМ зависит от ее локализации и скорости истечения крови. В большинстве случаев наблюдается резкое ухудшение состояния, нарастающая головная боль, расстройство сознания (от спутанности до комы). Паренхиматозные и смешанные кровоизлияния наряду с этим проявляются очаговой неврологической симптоматикой: нарушениями слуха, зрительными расстройствами, парезами и параличами, выпадением чувствительности, моторной афазией или дизартрией.
Торпидный вариант течения более типичен для церебральных АВМ среднего и большого размера, располагающихся в мозговой коре. Для него характерны кластерные цефалгии — следующие друг за другом пароксизмы головной боли, длящиеся не дольше 3 часов. Цефалгия не носит такого интенсивного характера как при разрыве АВМ, но является регулярной. На фоне цефалгий у ряда пациентов возникают судорожные приступы, которые зачастую имеют генерализованный характер. В других случаях торпидная церебральная АВМ может имитировать симптомы внутримозговой опухоли или другого объемного образования. В таком случае наблюдается появление и постепенное нарастание очагового неврологического дефицита.
В детском возрасте встречается отдельный вид церебральной сосудистой мальформации — АВМ вены Галена. Патология является врожденной и заключается в наличии АВМ в области большой вены мозга. АВМ вены Галена занимают около трети всех случаев сосудистых церебральных мальформаций, встречающихся в педиатрии. Характеризуются высокой летальностью (до 90%). Наиболее эффективным считается хирургическое лечение, проведенное на первом году жизни.
Диагностика АВМ головного мозга
Поводом для обращения к неврологу до разрыва АВМ могут быть упорные головные боли, впервые возникший эпиприступ, появление очаговой симптоматики. Пациенту проводится плановое обследование, включающее ЭЭГ, Эхо-ЭГ и РЭГ. При разрыве АВМ диагностика осуществляется в экстренном порядке. Наиболее информативны в диагностике сосудистых мальформаций томографические методы. Компьютерная томография и магнитно-резонансная томография могут быть использованы как для визуализации тканей мозга, так и для исследования сосудов. В случае разрыва АВМ МРТ головного мозга более информативно, чем КТ. Она дает возможность выявить локализацию и размер кровоизлияния, отдифференцировать его от других объемных интракраниальных образований (хронической гематомы, опухоли, абсцесса головного мозга, церебральной кисты).

При торпидном течении АВМ МРТ и КТ головного мозга могут оставаться в норме. Обнаружить сосудистую мальформацию в таких случаях позволяет лишь церебральная ангиография и ее современные аналоги — КТ сосудов и МР-ангиография. Исследования церебральных сосудов проводятся с использованием контрастных веществ. Диагностика осуществляется нейрохирургом, который также оценивает операционный риск и целесообразность хирургического лечения АВМ. При этом следует учитывать, что при разрыве, в связи с компрессией сосудов в условиях гематомы и отека мозга, томографический размер АВМ может быть существенно меньше реального.
Лечение АВМ головного мозга
Артериовенозные мальформации головного мозга при их разрыве или при опасности такого осложнения подлежат удалению. Предпочтительно плановое оперативное лечение АВМ. В случае разрыва оно проводится после ликвидации острого периода кровоизлияния и рассасывания гематомы. В остром периоде по показаниям возможно хирургическое удаление образовавшейся гематомы. Одновременная ликвидация и гематомы, и АВМ проводится лишь при лобарной локализации сосудистой мальформации и ее небольшом диаметре. При кровоизлиянии в желудочки в первую очередь показано наружное вентрикулярное дренирование.
Классическое хирургическое удаление АВМ осуществляется путем трепанации черепа. Производится коагуляция приводящих сосудов, выделение АВМ, перевязка отходящих от мальформации сосудов и иссечение АВМ. Такое радикальное транскраниальное удаление АВМ осуществимо при ее объеме не более 100 мл и расположении вне функционально значимых зон. При большом размере АВМ зачастую прибегают к комбинированному лечению.
Когда транскраниальное удаление АВМ затруднительно из-за ее расположения в функционально значимых областях мозга и глубинных структурах, проводится радиохирургическое удаление АВМ. Однако этот метод эффективен лишь для мальформаций размером не более 3 см. Если размер АВМ не превышает 1 см, то ее полная облитерация происходит в 90% случаев, а при размерах свыше 3 см — в 30%. К недостатком метода относится длительный период (от 1 до 3 лет), необходимый для полной облитерации АВМ. В ряде случаев требуется поэтапное облучение мальформации в течение ряда лет.
К способам ликвидации церебральных АВМ относится также рентгеноэндоваскулярная эмболизация приводящих к АВМ артерий. Ее проведение возможно, когда имеются доступные для катетеризации приводящие сосуды. Эмболизация проводится поэтапно, и ее объем зависит от сосудистого строения АВМ. Полной эмболизации удается достигнуть только у 30% пациентов. Субтотальная эмболизация получается еще у 30%. В остальных случаях эмболизация удается лишь частично.
Комбинированное этапное лечение АВМ заключается в стадийном использовании нескольких перечисленных выше методов. Например, при неполной эмболизации АВМ следующим этапом проводится транскраниальное иссечение ее оставшейся части. В случаях, когда не удается полное удаление АВМ, дополнительно применяется радиохирургическое лечение. Такой мультимодальный подход к лечению церебральных сосудистых мальформаций показал себя как наиболее эффективный и оправданный в отношении АВМ большого размера.
Хронический запор - диагностика
Синдром кишечной псевдообструкции — функциональная аномалия ЖКТ, проявляющаяся кишечной непроходимостью, при которой обзорная рентгенография брюшной полости, рентгеноконтрастное исследование с барием и компьютерная томография не обнаруживают никакой органической патологии. Заболеванию сопутствуют дивертикулез тощей кишки и частичная мальротация. Надо также обследовать больных на наличие расширения двенадцатиперстной кишки.
У пациентов, которым возможно проведение биопсии на всю толщину кишечной стенки, дифференциальную диагностику висцеральной миопатии проводят с коллагенозом и вакуолизирующей миопатией гладких мышц кишечника. Заболевание может носить семейный характер.
Признано существование первичной, семейной и висцеральной нейропатии. У большинства пациентов причина заболевания остается неизвестной, хотя предполагают наличие различных нейроаномалий ЖКТ. У некоторых больных при сочетании нейропатии, дивертикулеза тощей кишки и поноса считают, что значение имеет избыточный рост бактерий.
У пациентов с приобретенным мегаректумом и мегаколоном первые симптомы поражения толстого кишечника могут возникать в детстве. В большинстве случаев патогномоничным считается длительный простой запор, особенно в сочетании с задержкой умственного развития и псхическими заболеваниями. Описано развитие синдрома Огилви (возникновение мегаколона после различных критических ситуаций), обычно происходящего после акушерских манипуляций и других травм брюшной полости и таза.
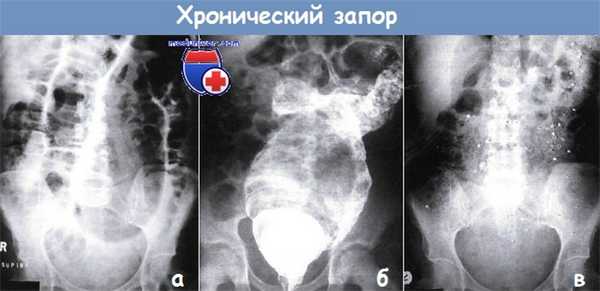
а - Массивная дилатация тонкой и толстой кишки у пациента с приобретенным мегаколоном, диагностированным после полного прекращения пассажа кишечного содержимого.
б - Контрастное исследование при мегаректуме; подготовку кишечника не проводили. Видно значительно расширенную каловыми массами прямую и заполненную контрастом сигмовидную кишку.
в - Аномальный результат исследования «формами» кишки у женщины с генерализованным замедлением скорости пассажа по толстой кишке.
За 120 ч до рентгеновского исследования были отмечены кольцевые контуры. Также остаточные количества бария обнаружены в червеобразном отростке и дивертикулах сигмовидной кишки.
Тем не менее за несколько дней до исследования клизма с барием дала нормальный результат.
В основе заболевания, возможно, лежит легкое нейрональное повреждение. Исследование может выявить недержание кала, хотя при его развитии во взрослом возрасте такое встречается нечасто. Прямая кишка заполнена каловыми массами, нередко бывает «каловый завал». Степень расширения толстой кишки лучше всего определяют при рентгенологическом исследовании с использованием водорастворимых контрастных средств, которые, в отличие от бария, не накапливаются в прямой кишке.
Исследование проводят без предварительной подготовки прямой кишки, что позволяет точно оценить расширение проксимальной части толстой кишки и диаметр прямой кишки. Патологическим считают диаметр свыше 6,5 см на границе таза, определенный с помощью бокового снимка, и диаметр слепой кишки более 12 см. Иногда необходимо хирургическое лечение.
Тяжелый запор в основном бывает у молодых женщин. При нормальных данных физикального исследования и исключения таких заболеваний, как мегаколон, метаболических причин (гипотиреоз и гиперкальциемия), системных расстройств (амилоидоз, системная склеродермия), ставят диагноз «тяжелый идиопатический запор». Нарушение перистальтики отражает характерная картина «пустой» прямой кишки.
Клизма с барием не позволяет обнаружить патологию. Медленный пассаж по толстой кишке определяют при помощи «простого» исследования, когда рентгеновский снимок получают спустя 120 ч после принятия внутрь трех последовательных порций контрастного вещества (в 0, 24 и 48 ч). В норме через 120 ч выводится 80% контрастного вещества. Некоторые авторы полагают, что тактика ведения больного в значительной степени зависит от уровня замедления прохождения содержимого по толстой кишке. Результаты простого измерения можно уточнить с помощью сцинтиграфии.
Для исключения миопатии и нейропатии применяют аноректальные физиологические тесты, с помощью которых определяют признаки затруднения акта дефекации, сопровождающиеся одновременным сокращением сфинктеров и мышц тазового дна. В этом случае полезно обучение больных методу биологической обратной связи.
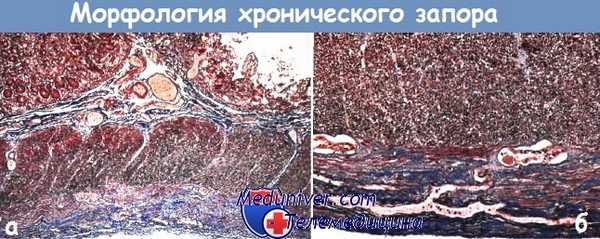
а - Висцеральная миопатия. Трехцветная окраска микропрепарата кишечной стенки.
Дегенерация и фиброзное замещение внешнего продольного слоя мышечной пластинки, внутренний циркулярный слой относительно мало затронут.
б - Висцеральная миопатия при большом увеличении.
Заметна характерная дегенерация наружного слоя мышечной пластинки с исчезновением миоцитов и фиброзом при отсутствии воспаления, сосудистого заболевания и поражения нервов.
Читайте также:
