Строение и функции фибронектина
Добавил пользователь Валентин П. Обновлено: 21.01.2026
По функции белки межклет. матрикса можно разделить на:
1. Aдгезивные белки – белки с выраженными адгезивными свойствами
2. Белки, подавляющие адгезию клеток
Адгезивные белки:
Фибронектин – неколлагеновый структурный гликопротеин, синтезируемый и
выделяемый в межклеточное пространство многими клетками. Построен из двух идентичных ППЦ, соединённых дисульфидными мостиками у своих С-концов.
ППЦ содержит 7-8 доменов, на каждом из которых расположены специфические
центры для связывания коллагена, протеогликанов, гиалуроновой к-ты, углеводов плазматических мембран, гепарина, фермента трансглутаминазы. Может способствовать адгезии клеток.
Существует несколько форм фибронектина:
Растворимый, или плазменный, фибронектин синтезируется гепатоцитами
Нерастворимый, или тканевый фибронектин синтезируется фибробластами или
эндотелиоцитами, глиоцитами и эпителиальными клетками.
Обе формы способствуют адгезии и распространению эпителиальных и
мезенхимальных клеток, стимулируют пролиферацию и миграцию эмбриональных и опухолевых клеток, контролируют дифференцировку и поддержание цитоскелета клеток, активно участвуют в воспалительных и репаративных процессах.
Каждая субъединица фибронектина содержит последовательность Арг-Гли-Асп
(RGD), с помощью которой он может присоединяться к клеточным рецепторам (интегринам). Эти рецепторы опосредованно взаимодействуют с актиновыми микрофиламентами, которые находятся в цитозоле. В этом процессе участвуют так называемые белки прикрепления: талин, винкулин, α-актинин. С помощью таких белок-белковых взаимодействий информация может передаваться из межклеточного матрикса внутрь клетки, а также в обратном. Фибронектин участвует в миграции клеток.
Ламинин – наиболее распространённый неколлагеновый гликопротеин базальных
мембран. Состоит из трёх ППЦ: А, В1 и В2, имеет крестообразную форму с 3 одноцепочечными ветвями и одной трёхцепочечной ветвью
Каждая цепь ламинина содержит несколько глобулярных и стержневидных
доменов, на которых имеются специфические центры связывания для различных веществ.
Ламинин взаимодействует со всеми структурными компонентами базальных
мембран, включая коллаген IV типа, нидоген, фибронектин, ГСПГ. Молекула ламинина имеет несколько центров связывания с клетками.
Главные функции ламинина определяются его способностью связывать клетки и
модулировать клеточное поведение. Он может влиять на рост, морфологию, дифференцировку и подвижность клеток. Ламинин выполняет роль адгезивного белка для различных эпителиальных и мезенхимальных клеток.
Нидоген – сульфатированный гликопротеин базальных мембран, образует с
ламинином плотный, нековалентно связанный комплекс. Состоит из одной ППЦ, содержащей три глобулярных домена. Один из доменов нидогена имеет центр связывания ламинина, в области другого домена находится центр связывания коллагена IV типа.
Нидоген может выступать в качестве одного из связывающих мостов между
различными компонентами межклет. матрикса и участвовать в образовании тройных комплексов ламинин-нидоген-коллаген.
Строение и функции фибронектина
• Основная функция фибронектина, белка внеклеточного матрикса, заключается в прикреплении клеток к матрицам, содержащим фиблиллярный коллаген
• Известно, по меньшей мере, 20 различных форм фибронектина. Все они образуются за счет альтернативного сплайсинга одного гена
• Растворимые формы фибронектина присутствуют в жидких тканевых средах, в то время как его нерастворимые формы образуют волокна во внеклеточном матриксе
• Волокна фибронектина состоят из сшитых между собой полимеров гомодимерных форм фибронектина
• Фибронектиновые белки содержат шесть структурных областей, каждая из которых состоит из серии повторяющихся единиц
• Фибрин, гепарансульфат протеогликан и коллаген связываются с различными участками фибронектина и интегрируют его волокна в сеть внеклеточного матрикса
• В некоторых клетках экспрессируются рецепторы интегрина. которые связываются с последовательностью Arg-GLy-Asp (RGD), присутствующей в фибронектине
Фибронектины (от латинского fibra (волокно) и nectere (связывать, соединять)) экспрессируются в соединительной ткани почти у всех животных. Эти белки образуются в клетках нескольких типов, включая фибробласты, гепатоциты, клетки эндотелия, а также некоторые клетки нервной системы, выполняющие структурные функции. У человека по меньшей мере 20 разных фибронектинов образуются за счет альтернативного сплайсинга по четырем сайтам первичного транскрипта единственного фибронектинового гена.
Образующиеся варианты обладают специфичностью, в зависимости от типа клеток. Фибронектины подразделяют на две группы: растворимые (или фибронектины плазмы), которые присутствуют в различных тканевых жидкостях (например, в плазме, цереброспинальной и амниотической жидкости) и нерастворимые (или клеточные), образующие волокна во внеклеточном матриксе почти во всех тканях.
В тканях фибронектины скрепляют клетки с внеклеточным матриксом, регулируют их форму и организацию цитоскелета, способствуют свертыванию крови, а также контролируют функционирование многих клеток в процессе развития и заживления ран. В процессе свертывания крови фибронектин связывается с тромбоцитами на месте повреждения, а позже, при заживлении раны, он поддерживает миграцию новых клеток, по мере того, как они покрывают раневую поверхность. Многие опухолевые клетки также экспрессируют фибронектины, выполняющие роль субстрата для миграции клеток при образовании метастазов.
Фибронектины необходимы для нормального протекания процессов развития: мыши с выключенной функцией соответствующего гена погибают в раннем эмбриогенезе.
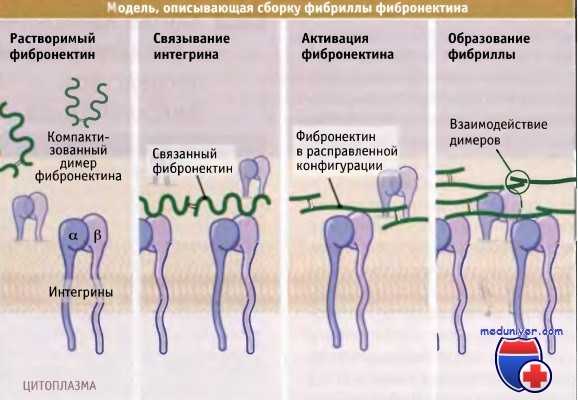
Димеры фибронектина выходят из клетки в скрученной конформации, которая препятствует их ассоциации с другими димерами.
После связывания с интегриновыми рецепторами на поверхности клеток, фибронектиновые димеры расправляются, и открывают сайты связывания, к которым присоединяются другие димеры.
Накопление димеров фибронектина приводит к образованию из них фибриллы, связанной с поверхностью клетки.
Клетки связываются с фибронектином посредством специфических рецепторов, называемых интегринами. Подобно другим интегриновым рецепторам, фибронектиновые рецепторы участвуют в активации внутриклеточных путей передачи сигналов, контролирующих рост, подвижность и дифференцировку клеток.
Зрелый фибронектин, секретируемый клеткой, всегда представляет собой растворимый димер, образованный при участии двух дисульфидных мостиков, и обычно содержит две копии одного варианта фибронектина. Более того, димеризация фибронектина играет существенную роль для правильного образования нерастворимых фибронектиновых волокон. Для сборки растворимых фибронектинов в нерастворимые сети необходимы прямые контакты с клетками. Хотя механизм образования фибронектиновых волокон не совсем понятен, большинство моделей предполагает, что вначале димеры фибронектина связываются с интегриновыми рецепторами на поверхности клеток.
В дальнейшем клетки изменяют свою форму, за счет этого молекулы фибронектина растягиваются, принимая более вытянутую конфигурацию, близкую к линейной. К таким растянутым молекулам дополнительно присоединяются димеры фибронектина, образуя плотную сеть, которая под микроскопом выглядит в виде волокнистых структур, ориентированных вдоль актиновых волокон. Эти фибронектиновые волокна могут связываться с другими компонентами внеклеточного матрикса, превращая его в прочную опорную структуру.
Для выполнения своих функций фибронектины связываются с различными другими белками внеклеточного матрикса. Исследование связывания с использованием фрагментов фибронектина, полученных при ограниченном протеолизе, позволило выяснить функциональную организацию данного белка. Он содержит набор коротких последовательностей, называемых фибронектиновые повторы. Из-за альтернативного сплайсинга порядок расположения этих повторов варьирует. Повторяющиеся последовательности подразделяются на три группы, которые называются тип I, II и III.
Они последовательно нумеруются, начиная с амино-концевого участка белка. На рисунке ниже представлены функции этих повторов.
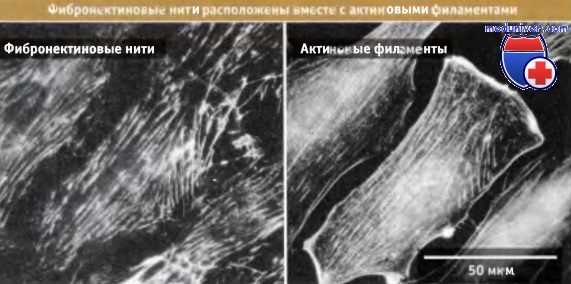
Фотографии клеток, полученные с помощью флуоресцентного микроскопа.
Видны сети связанных фибронектиновых нитей (слева) и актиновых филаментов (справа), которые расположены одинаково.
Окрашивание иммунофлуоресцентным методом на фибронектин и актин соответственно.
Фибронектиновые нити и актиновые филаменты связаны вместе с помощью интегриновых рецепторов и связанных с ними белков.
• Поблизости от концевой аминогруппы расположен остаток глутамина, представляющий собой субстрат для фактора ХШа, фермента, связывающего фибронектин с фибрином, фибриногеном или другими фибронектинами в процессе свертывания крови.
• Повторы, относящиеся к типу I (1-5), которые связываются с фибрином, белком, участвующим в процессе свертывания крови, и с гепарансульфатом протеогликаном.
• Повторы типа I (6-9) и типа II (1-2), связывающиеся с коллагеном.
• Модульный экстрадомен-В (ED-B), который присутствует, главным образом, в фибронектине эмбриональных тканей, при заживлении ран и в ткани опухолей. Это позволяет предполагать, что домен может играть роль при перестройке ткани, происходящей в области интенсивного клеточного роста. В фибронектинах плазмы домен не обнаружен.
• Экстрадомен-А (ED-A), который, подобно ED-B, отсутствует в фибронектинах плазмы. По-видимо-му, он способствует усилению связывания клеток с фибронектином, хотя это является всего лишь предположением.
• Последовательности типа III (12-14), образующие область связывания с гепарансульфатом, который присоединяется к синдекановым рецепторам.
• Сопрягающий сегмент типа III (IIICS), который при сплайсинге образует различные по длине модули и, следовательно, множественные формы фибронектина. У человека идентифицированы, по меньшей мере, пять разных вариантов сплайсинга IIICS. Некоторые из них могут регулировать апоптоз. Этот сегмент связывается с двумя интегрино-выми рецепторами за счет последовательности Leu-Asp-Val.
• Один повтор типа II и три повтора типа III, образующие второй сайт связывания для фибрина, который участвует в свертывании крови.
• Поблизости от концевой карбоксильной группы белка два остатка цистеина образуют дисульфидные связи с другим полипептидом фибронектина.
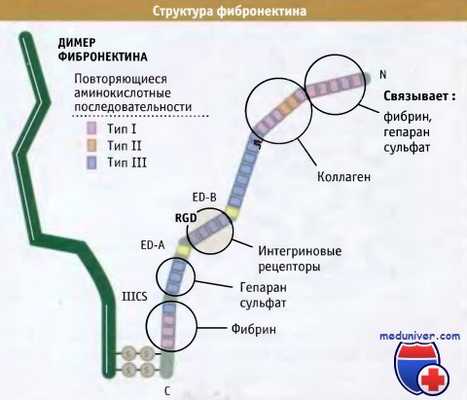
Два полипептида фибронектина ковалентно связаны друг с другом через дисульфидные связи, расположенные у карбоксильного концевого участка.
Каждый полипептид состоит из шести доменов, включающих небольшие повторяющиеся последовательности.
Отмечены основные области связывания.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
История изучения внеклеточного матрикса (ВКМ)
• Исследования внеклеточного матрикса и межклеточных контактов миновали четыре исторических этапа. Для каждого этапа была характерна определенная стадия технического прогресса, которая позволяла все более детальное изучение этих структур.
• Современные исследования в этой области направлены на выяснение вопроса, каким образом белки внеклеточного матрикса и межклеточные контакты управляют поведением клеток
Подобно другим разделам клеточной биологии, исследования внеклеточного матрикса и межклеточных контактов прошли через четыре исторических этапа. Первый этап начался в середине XVII в. и был связан с изобретением микроскопа, с помощью которого можно было наблюдать отдельные клетки. По мере разработки все более изощренных методов, позволяющих видеть субклеточные структуры, исследователи пришли к выводу о сложном строении поверхности и содержимого клетки.
Одновременно с развитием клеточной теории биологи начали понимать, насколько важную роль играют клетки в развитии сложных организмов. Стало возможным оценить на структурном уровне невероятную вариабельность форм, размеров и способов организации клеток в ткани. В середине XIX в. оформилась новая область биологии — гистология. Задачей гистологии стало исследование мельчайших структур (часто называемых ультраструктурами), составляющих ткани многоклеточных организмов.
Однако в картине, описывающей архитектуру ткани, отсутствовала одна деталь. Что находится в межклеточном пространстве? Главным образом изучали те структуры, которые можно было наблюдать с помощью микроскопа. Структурам, невидимым в микроскоп, уделяли меньше внимания. Под обычным, световым микроскопом, межклеточное пространство в большинстве тканей выглядело довольно слабо прокрашенным и имело аморфную структуру. В ранних гистологических описаниях о нем вообще нет упоминаний.

Вторая стадия началась в середине XX в., с появлением мощных световых и электронных микроскопов. При анализе в световом микроскопе препаратов тканей, окрашенных гистологическими красителями, было обнаружено, что внеклеточное пространство заполнено жидкой средой. В электронном микроскопе в этом пространстве была заметна сеть, состоящая из структурного материала. Более того, стало ясно, что на поверхности клеток формируются специальные контакты, которые взаимодействуют с этим материалом и друг с другом.
Наконец признали, что ткани состоят из клеток, жидкой среды и этого внеклеточного материала. Этой группе структурных материалов было дано название: внеклеточный матрикс. Однако с помощью микроскопа было невозможно рассмотреть отдельные компоненты внеклеточного матрикса.
Начало третьей стадии пришлось на 1970-е гг., когда было разработано много новых методов, позволяющих фракционировать, выделять и характеризовать отдельные компоненты клетки. По мере использования новых методов биохимии, генетики, молекулярной биологии и микроскопии, клеточная биология начала быстро развиваться. Например, разработка экспресс-методов секвенирования ДНК позволила исследователям секвенировать полностью геном у нескольких организмов. Таким образом, вероятно, что вскоре мы сможем идентифицировать у них каждый ген.
Используя эти методы для идентификации сотен белков, входящих во внеклеточный матрикс и составляющих межклеточные контакты, мы сталкиваемся со следующим важным вопросом: каковы функции этих белков? В настоящее время считается общепризнанным, что внеклеточный матрикс играет критическую роль не только в формировании трехмерной организации тканей, но также контролирует рост, подвижность, дифференцировку и взаимодействие входящих в них клеток.
Более того, эти функции регулируются контактами, посредством которых клетки соединяются друг с другом и с внеклеточным матриксом. В настоящее время основные усилия исследователей в этой области направлены на выяснение молекулярных механизмов, обеспечивающих эти функции, что составляет четвертый этап исследований внеклеточного матрикса и межклеточных контактов. В данной главе мы обсудим основные подходы, позволяющие разобраться в этих механизмах.
Процедура окрашивания красителями позволяет гистологам визуализировать особенности клеток в тканевых препаратах.
На фотографии представлен препарат эпителия, окрашенный гистологическими красителями для выявления формы и расположения клеток в эпителиальном слое. На электронных микрофотографиях видно, что межклеточное пространство заполнено волокнистым материалом.
На фотографиях видны коллагеновые фиблиллы в межклеточном пространстве между фибробластами в соединительной ткани (слева) и в роговице глаза (справа).
• Основная функция коллагена состоит в обеспечении структурной опоры тканей
• Коллагены представляют собой семейство, состоящее более чем из 20 различных белков внеклеточного матрикса. Эти белки — наиболее распространенные в царстве животных
• Все коллагены организованы в тройные спирализованные «коллагеновые субъединицы», обладающие суперспиральной структурой и состоящие из трех отдельных полипептидов
• Коллагеновые субъединицы выходят из клеток и затем, во внеклеточном пространстве, собираются в более крупные фибриллы и волокна
• Мутации в коллагеновых генах вызывают множество патологических состояний, начиная от появления морщин до развития хрупкости костей и таких тяжелых заболеваний, как образование кожных волдырей
Семейство коллагенов включает более 20 белков, которые относятся к наиболее распространенным белкам клеток животных. У многоклеточных организмов коллагены существуют по крайней мере 500 млн лет. Почти все клетки животных синтезируют и секретируют по меньшей мере одну из форм коллагена.
Коллагены обеспечивают тканям структурную поддержку и существуют во множественных формах, организованных в различные структуры. Все белки семейства коллагенов характеризуются одним общим свойством: они собраны в тонкие (примерно 1,5 нм диаметром) тройные спиральные суперспирализованные структуры, состоящие из трех субъединиц коллагеновых белков, которые удерживаются вместе ковалентными и нековалентными связями.
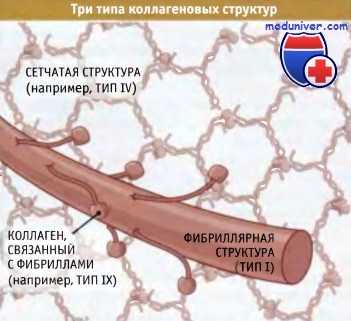
Коллагеновые субъединицы собираются в тройные спиральные структуры, которые организуются в фибриллы или в сеть,
где они связаны между собой другими белками внеклеточного матрикса, включая коллагены, связанные с фибриллами.
Суперспирализованные структуры бывают трех типов — фибриллярные, слоистые и связанные с фибринами:
• В фибриллярных коллагенах суперспирализованные спирали организованы в фибриллы или «канаты», которые обеспечивают прочность структуры вдоль единственнной оси (такая структура напоминает прочный стальной трос, образованный проволочными пучками). Когда эти фибриллы собраны в параллельно расположенные пучки, как в сухожилиях, они обеспечивают невероятную прочность структуры, которая способна противостоять усилиям, развиваемым мышцами, закрепленными на костях.
• Слоистые коллагены представляют собой сеть, состоящую из суперспирализованных спиральных структур. Они в меньшей степени устойчивы к мышечным усилиям, но гораздо лучше противостоят растяжению в нескольких направлениях. Сеть таких структур, например, характерна для кожи.
• Третий тип коллагена, известный как «фибриллярные связки», образует суперспирализованные спиральные структуры, связывающие коллагеновые фибриллы вместе.
Независимо от организации, коллагены образуют основную каркасную структуру внеклеточного матрикса. Такие входящие во внеклеточный матрикс белки, как фибронектин и витронектин, связываются с коллагенами и вплетены в структуры, образованные коллагеновым каркасом. Один из представителей семейства коллагенов представляет собой трансмембранный белок, который участвует в формировании межклеточных контактов.
Существует примерно 20 различных типов коллагена, большая часть которых может быть сгруппирована в четыре класса. Каждая из тройных спиралеобразных структур обозначается римской цифрой (I, II, III и т. д.). Каждая коллагеновая субъединица имеет обозначение как субъединица а, а ее типу присвоен номер (а1, а2, а3 и т. д.), после которого римской цифрой обозначен тип, в котором она находится. Например, основной фибриллярный коллаген хвоста (и других тканей) крыс относится к типу I и состоит из двух копий субъединиц а1(1) и одной копии субъединицы а2 (I).
На рисунке ниже представлена структура коллагеновых волокон. Три полипептидные субъединицы параллельно обернуты вокруг друг друга и образуют суперспирализованную спиральную структуру длиной 300 нм. Для коллагенов характерна повторяющаяся последовательность аминокислот, содержащая элемент глицин-X-Y, где X и Y могут представлять собой любую аминокислоту, но обычно это пролин и гидроксипролин соответственно.
Такая последовательность способствует плотной упаковке трех субъединиц и облегчает образование суперспиральной структуры. Субъединицы длиной 300 нм скрепляются вместе посредством ковалентных связей, которые образуются между N-концевым участком одной субъединицы и С-концевым участком примыкающей к ней. Суперспирализованные спиральные структуры располагаются параллельно, образуя между собой небольшие зазоры (64-67 нм). Эти зазоры обеспечивают характерный вид (исчерченность) фибрилл, видимый в электронном микроскопе.

Коллагеновые белки подразделяются на четыре основные группы, которые отличаются по молекулярной формуле,
характеру полимерных форм и по распределению в тканях. Некоторые группы включают коллагены нескольких типов.
Полностью собранные коллагеновые структуры (фибриллярные или сетчатые) по размерам оказываются гораздо больше, чем сами клетки; некоторые фибриллы могут достигать нескольких миллиметров длины. Таким образом, субъединицы коллагена синтезируются и секретируются в виде суперспирализованных спиральных структур, и окончательные этапы их сборки происходят вне клетки. Как показано на рисунке ниже, синтез коллагена и дальнейший его процессинг происходят на протяжении всего секреторного пути. При синтезе коллагеновые белки направляются в гранулярный эндоплазматический ретикулум (ЭПР) при участии частиц, распознающих сигнал и связанного с ними белкового аппарата.
Коллагеновые субъединицы синтезируются в виде крайне длинных полипептидов, которые называются проколлагены и содержат пропептиды, представляющие собой «хвосты», расположенные на амино- и карбоксильном концах.
После того как проколлагены попали в просвет ЭР, по мере транспорта из ЭР через аппарат Гольджи и в секреторные везикулы, они претерпевают серию модификаций. В процессе транспорта проколлагена через ЭР и аппарат Гольджи, к боковым цепям пролина и лизина, находящимся в средней части молекул проколлагена, добавляются гидроксильные группы (-ОН). При этом образуются гидроксипролин и гидроксилизин.
Эти модификации обеспечивают правильное образование водородных связей, которые скрепляют вместе три субъединицы в суперспирализованной спиральной структуре. Между амино- и карбоксиконцевыми частями пропептидов образуются дисульфидные связи, которые затем обеспечивают правильное расположение трех проколлагеновых субъединиц с образованием тройной спиральной суперспирализованной структуры. Затем спираль образуется спонтанно, в направлении от С-конца к N-концу.
Пропептиды препятствуют взаимодействию суперспирализованных спиралей друг с другом, тем самым предотвращая полимеризацию коллагена в клетке. Когда произошла секреция тройных спиралей проколлагена, ферменты, которые называются протеазы проколлагена, отщепляют пропептиды. Остающийся белок, известный под названием тропоколлагена, почти весь организован в тройную спираль и представляет собой основную структурную единицу коллагеновой фибриллы.
Фибриллы собираются просто: боковые цепи лизина в тропоколлагене модифицируются при действии фермента лизилоксидазы, образуя аллизины. Эти модифицированные лизины образуют ковалентные сшивки, которые обеспечивают полимеризацию тропоколлагенов. Лизилоксидаза представляет собой внеклеточный фермент, и эта стадия сборки фибрилл происходит только после выхода проколлагена из клетки. После сборки фибриллы могут объединяться, образуя большие пучки или волокна, характерные для фибриллярного коллагена.
Принимая во внимание всю важность коллагена в обеспечении структурной поддержки тканей, можно представить, какие тяжелые последствия для организма будет иметь нарушение процесса сборки фибрилл. Мутации в генах, кодирующих синтез коллагенов или ферментов, модифицирующих проколлаген, вызывают развитие множества генетических заболеваний, затрагивающих практически все ткани. Например, коллаген типа I представляет собой основной структурный белок костной ткани. Мутации в коллагеновых генах этого типа служат причиной незавершения остеогенеза, т. н. развития «болезни хрупких костей».
Мутации в коллагеновом гене типа IV приводят к нарушению сборки базальной ламины в большинстве эпителиальных тканей и к развитию такого кожного заболевания, как буллезный эпидермоз.
Клетки связываются с коллагеном посредством специфических рецепторов, называемых интегринами. Эти рецепторы обеспечивают возможность обратимого связывания клеток с коллагенами по мере их движения по внеклеточному матриксу. Интегриновые рецепторы также активируют пути передачи сигналов, так что связывание с коллагенами (и с другими белками внеклеточного матрикса) изменяет активность в клетке биохимических процессов и, таким образом, способствует контролю над ростом и дифференцировкой клеток.
Схематическое строение тройной спиральной структуры коллагена (наверху),
организация витой структуры в фибрилле (в середине) и фибрилл в коллагеновом волокне (внизу).
Наличие 67-нм зазора между соседними спиральными структурами обусловливает видимую в электронном микроскопе исчерченность фибрилл, составляющих волокно. Посттрансляционная модификация и сборка субъединиц проколлагена в тройные спиральные структуры происходит при внутриклеточном перемещении по секреторному пути.
Однако сборка фибрилл происходит во внеклеточном пространстве после секреции тройных спиралей, обладающих витой структурой.
Для упрощения в тройных структурах не показаны гидроксильные группы и сахарные остатки. Лизилоксидаза катализирует ковалентное связывание двух боковых цепей лизина с образованием аллизинов (альдегидных производных лизина),
которые затем образуют между собой альдольную связь.
Фибронектин
Фибронектин - один из ключевых белков межклеточного матрикса, неколлагеновый структурный гликопротеин, синтезируемый и выделяемый в межклеточное пространство многими клетками. Он построен из двух идентичных полипептидных цепей, соединённых дисульфидными мостиками у своих С-концов (рис. 15-19). Полипептидная цепь фибронектина содержит 7-8 доменов, на каждом из которых расположены специфические центры для связывания разных веществ. Фибронектин может связывать
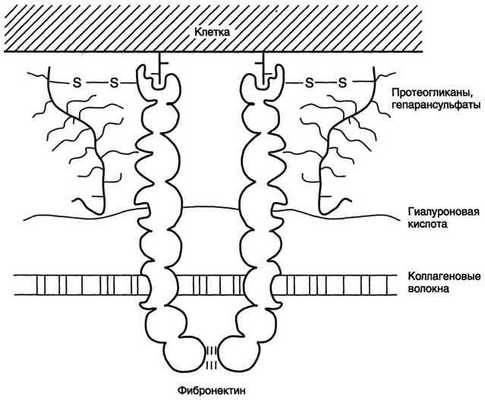
Рис. 15-19. Строение фибронектина.
коллаген, протеогликаны, гиалуроновую кислоту, углеводы плазматических мембран, гепарин, фермент трансглутаминазу. Благодаря своей структуре фибронектин может выполнять интегрирующую роль в организации межклеточного вещества, а также способствовать адгезии клеток. Существует несколько форм фибронектина, которые синтезируются разными клетками. Растворимый, или плазменный, фибронектин синтезируется гепатоцитами. Нерастворимый, или тканевый фибронектин синтезируется в основном фибробластами или эндотелиоцитами, глиоцитами и эпителиальными клетками. Обе формы фибронектина вовлекаются в разнообразные процессы: способствуют адгезии и распространению эпителиальных и мезенхимальных клеток, стимулируют пролиферацию и миграцию эмбриональных и опухолевых клеток, контролируют дифференцировку и поддержание цитоскелета клеток, активно участвуют в воспалительных и репаративных процессах. Это связано с тем, что каждая субъединица фибронектина содержит последовательность Арг-Гли-Асп (RGD), с помощью которой он может присоединяться к клеточным рецепторам (интегринам). Эти рецепторы опосредованно взаимодействуют с актиновыми микрофиламентами, которые находятся в цитозоле. В этом процессе участвуют так называемые белки прикрепления (от англ. attach - прикреплять proteins): талин, винкулин, α-актинин (рис. 15-20).
С помощью таких белок-белковых взаимодействий информация может передаваться из межклеточного
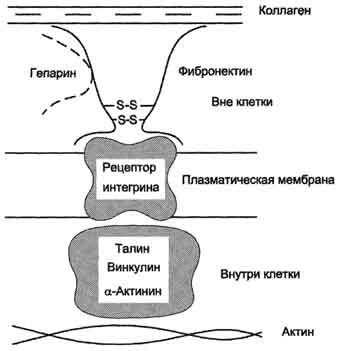
Рис. 15-20. Схема взаимодействия фибронектина с интегрином.
матрикса внутрь клетки, а также в обратном направлении - из клетки наружу, таким образом влияя на протекающие в клетке процессы. Известно также, что фибронектин участвует в миграции клеток, которые могут присоединяться к его RGD-участкам, и, таким образом, фибронектин как бы помогает им перемещаться в межклеточном матриксе. В межклеточном матриксе, окружающем трансформированные (или опухолевые) клетки, количество фибронектина заметно снижено, что может быть одной из причин появления метастазов.
Ламинин- наиболее распространённый некол-лагеновый гликопротеин базальных мембран. Он состоит из трёх полипетидных цепей: А, В1 и В2. Молекула ламинина имеет крестообразную форму с тремя одноцепочечными ветвями и одной трёхцепочечной ветвью (рис. 15-21). Каждая цепь ламинина содержит несколько глобулярных и стержневидных доменов, на которых имеются специфические центры связывания для различных веществ. Ламинин взаимодействует со всеми структурными компонентами базальных мембран, включая коллаген IV типа, нидоген, фибронектин, ГСПГ. Кроме того, молекула ламинина имеет несколько центров связывания с клетками. Главные функции ламинина определяются его способностью связывать клетки и модулировать клеточное поведение. Он может влиять на рост, морфологию, дифференцировку и подвижность клеток. Ламинин выполняет роль адгезивного белка для различных эпителиальных и мезенхимальных клеток.
Нидоген- сульфатированный гликопротеин базальных мембран, образует с ламинином плотный, нековалентно связанный комплекс; сила связывания нидогена с коллагеном IV типа гораздо меньше, чем с ламинином. Этот белок представлен одной полипептидной цепью, содержащей три глобулярных домена (рис. 15-21). Один из доменов нидогена имеет центр связывания ламинина, в области другого домена находится центр связывания коллагена IV типа. Таким образом, нидоген может выступать в качестве одного из связывающих мостов между различными компонентами межклеточного матрикса и участвовать в образовании тройных комплексов ламинин-нидоген-коллаген. Кроме этого, нидоген содержит RGD-последовательность и поэтому может присоединяться к клеточной поверхности.
Читайте также:
