Теломераза как признак рака
Добавил пользователь Алексей Ф. Обновлено: 28.01.2026
О теломерах, защитных «колпачках» на кончиках хромосом, ученым известно довольно давно, но до сих пор в теломерной биологии остается масса вопросов. Один из основных можно сформулировать так: может ли увеличение теломер предотвратить старение, или это прямая дорога к развитию раковой опухоли? Частично ответ удалось получить, исследуя семьи с наследственной предрасположенностью к онкологическим заболеваниям
При каждом делении клетки хромосомы, содержащие наш генетический материал, становятся немного короче. Но функциональным последовательностям ДНК ничего не грозит: удар берут на себя расположенные на концах хромосом теломеры. Прежде чем они закончатся, клетка успевает выполнить примерно 50 делений, а затем наступает момент, называемый пределом Хейфлика, и клетка гибнет.
Наращивать теломеры способен фермент теломераза, которая в норме работает в стволовых и половых клетках, а в обычных клетках отсутствует. Зато теломераза активна в клетках большинства видов рака.
Из этих фактов возникла идея, что истощение резерва теломер блокирует развитие рака, и только те клетки, которым удается активировать теломеразу, могут преодолеть барьер и продолжать размножаться, превращаясь во все более злокачественные. Эта гипотеза была впервые предложена несколько десятилетий назад, но до сих пор не была доказана, хотя наблюдения и некоторые эксперименты на мышах вроде бы подтверждают ее.
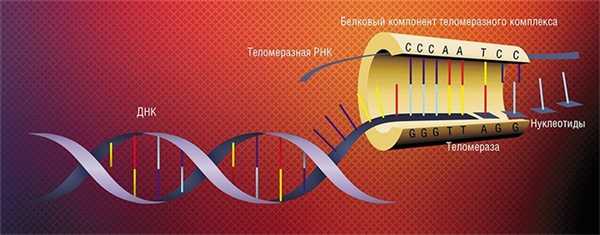
Число клеточных делений, которые клетка может выполнить до остановки делений, зависит от начальной длины теломер. При рождении теломеры человека имеют определенную среднюю длину, характерную для нашего вида. Считается, что этого резерва теломер достаточно для поддержания деления клеток, необходимого для нормального развития и гомеостаза тканей. Если теломеры будут слишком длинными, их резерв не исчерпается вовремя, клетки получат дополнительные деления, во время которых могут произойти мутации, в том числе активирующие теломеразу, и создадутся благоприятные условия для развития рака.
Ученые из США и Нидерландов, занимаясь проблемой связи длины теломер и рака, обнаружили несколько голландских семей с наследственным раком разной локализации, у представителей которых были мутации в гене TINF2, кодирующем белок TIN2. Этот белок принадлежит к группе белков, участвующих в регуляции длины теломер: снижение его функции способствует работе теломеразы.
С помощью технологии редактирования генов CRISPR ученые создали и исследовали клетки, несущие такие же мутации, как в голландских семьях с предрасположенностью к онкологическим заболеваниям. Это были нормальные, здоровые клетки, их теломеры адекватно выполняли свою функцию, клеточный геном был стабилен. Просто в них были более длинные теломеры – как и у членов обследуемых семей.
Ученые пришли к выводу, что TINF2 можно назвать геном-супрессором опухоли. Инактивация даже одной его копии в результате мутации приводит к предрасположенности к раку, так как слишком длинные теломеры позволяют клеткам делиться дольше «положенного». Ученые считают, что вряд ли мутации TINF2 приводят к удлинению теломер в родительских клетках, скорее всего, ущербный TIN2 не способен в должной степени сдержать теломеразу, которая активна во время раннего эмбрионального развития.
Известно, что другие мутации TIN2, которые вызывают чрезмерное укорочение теломер, ведут к развитию синдромов недостаточности костного мозга. Таким образом, длина теломер должна находиться строго в определенных пределах, чтобы не возникало ни преждевременного истощения стволовых клеток, ни развития рака.
Укорочение теломер защищает от рака
На концах хромосом есть особые участки — теломеры. Они нужны для защиты генетического материала и укорачиваются после каждого деления клетки. Многие знают о том, что укорочение теломер — признак старения. Недавно ученые доказали, что это еще и один из важнейших естественных механизмов профилактики рака.
Профессор Тиция де Ланге (Titia de Lange), один из соавторов исследования, отмечает:
ДНК в теломерах укорачивается при каждом клеточном делении. В конечном итоге запас длины теломер истощается, и клетка прекращает делиться.
Ученые проанализировали мутации у членов семей, в которых часто встречаются онкозаболевания, и обнаружили, что укорочение теломер, видимо, помогает предотвратить рак за счет остановки клеточных делений. Это своего рода ограничивающий механизм.
Многолетний спор ученых
В теле человека есть клетки, в которых хромосомы не укорачиваются — это стволовые клетки, в том числе предшественницы яйцеклеток и сперматозоидов. В них активен фермент теломераза, который добавляет теломерную ДНК на концах хромосом. В остальных клетках этого фермента нет, и в них длина теломер постоянно сокращается. Из-за этого клетка в среднем может делиться до 50 раз.
Еще несколько десятилетий назад ученые предположили, что укорочение теломер естественным образом предотвращает развитие злокачественных опухолей. Даже если в организме возникнет опухолевая клетка, она сможет поделиться не более 50 раз. У раковых клеток остается единственная возможность преодолеть это ограничение — активировать теломеразу.
Эта гипотеза подтвердилась в ходе научных исследований. Оставалась лишь одна проблема: никому не удалось обнаружить в здоровых клетках систему, которая ограничивала бы удлинение теломер.
Ответ найден
Теломеры могут защищать от рака только в случае, когда изначально они были нормальной длины. Если же человек родился с чрезмерно длинными теломерами, то они не успеют ограничить размножение опухолевых клеток. Каждая «неправильная» клетка сможет делиться больше пятидесяти раз, и за это время в ней могут появиться многие новые мутации, включая те, которые активируют теломеразу.
Авторы исследования смогли выявить белки, которые ограничивают длину теломер в культурах клеток человека. Среди них оказался белок TIN2. Ученые обнаружили, что, если его заблокировать, то теломеры сильно удлиняются. Тем не менее, оставалось непонятно, влияет ли TIN2 на длину теломер во время внутриутробного развития.
Ответ не удавалось найти до тех пор, пока ученые не решили обследовать членов нескольких семей, в которых часто встречались злокачественные опухоли. Генетический анализ показал, что у этих людей есть мутация в гене TINF2, кодирующем белок TIN2.
Используя технологию редактирования генома CRISPR, исследователи создали клетки с аналогичной мутацией. Эти клетки оказались совершенно нормальными, за исключением одной особенности: у хромосом были слишком длинные теломеры. Аналогичное явление было обнаружено и в клетках людей из семей, в которых часто встречались злокачественные опухоли.
Профессор Ланге объясняет:
Эти данные доказывают: если человек родился с длинными теломерами, у него будет повышен риск развития рака. Мы обнаружили, что люди с мутацией, нарушающей ограничение длины теломер, чаще страдают злокачественными опухолями молочной железы, толстой и прямой кишки, щитовидной железы, меланомой. Широкий спектр разных типов злокачественных опухолей в обследованных нами семьях указывает на важную роль укорочения теломер как защитного механизма.
Чем больше становится известно о генах злокачественных опухолей, тем больше появляется возможностей для борьбы с ними. Достижения молекулярной биологии и генетики уже помогли создать много эффективных противоопухолевых препаратов. В Европейской клинике доступны оригинальные препараты последнего поколения — наши врачи применяют их в соответствии с актуальными версиями международных протоколов.
Теломераза как признак рака
Генетика рака толстой кишки. В чем причина?
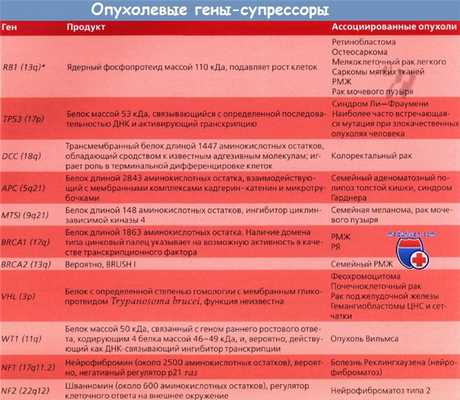
Рак толстой кишки занимает 2-е место по смертности от злокачественных новообразований. По мере старения общества показатель летальности от рака этой локализации будет увеличиваться. Это неудивительно, если вспомнить об этиологии заболевания и особенностях патоморфологических изменений толстой кишки: ее слизистая оболочка представлена одноклеточным эпителием с быстрым периодом полного обновления и постоянной экспозицией к воздействию канцерогенных факторов.
Следовательно, ДНК этих клеток постоянно и быстро делится и реплицируется. В результате вероятность накопления ошибок и злокачественной трансформации со временем увеличивается. Модель рака толстой кишки, разработанная Vogelstein и соавт., иллюстрирует эти механизмы. Мутации гена-супрессора аденоматозного полипоза толстой кишки (adenomatous polyposis coli, АРС) ведут к разрастанию полипов толстой кишки в раннем возрасте. Для уточнения характера любого заболевания толстой кишки можно легко получить образец ткани путем биопсии. По мере роста полипа он становится доступен для обследования гастроэнтерологом с использованием ряда исследований. Рак толстой кишки хорошо изучен также потому, что существуют семьи, члены которых подвержены редкому заболеванию — семейному аденоматозному полипозу толстой кишки. У этих больных толстая кишка покрывается сотнями и тысячами полипов, один или несколько из которых, как правило, малигнизируются в зрелом возрасте.
Именно у этой категории больных впервые был обнаружен ген АРС. В большинстве спорадических опухолей толстой кишки выявляют соматические мутации гена АРС. В более редких семейных случаях отмечается мутация гена АРС, передающаяся по наследству и в связи с этим присутствующая во всех эпителиальных клетках кишечника, что и предрасполагает к развитию полипов. Соматическая мутация ведет к активации онкогена ras и ускорению роста полипа, который, тем не менее, еще остается доброкачественным. Однако с годами полип может приобрести мутации генов-супрессоров DCC и ТР53, которые ведут к автономному неконтролируемому росту злокачественных клеток рака толстой кишки.
Семейная предрасположенность к раку толстой кишки достаточно широко распространена и делится на две группы: с образованием полипов и без них. Полипозы включают семейный аденоматозный полипоз толстой кишки, синдром Пейтца— Егерса, семейный ювенильный полипоз и гиперпластический полипоз. Риск рака толстой кишки у всех больных с названными синдромами повышен. Например, медиана возраста появления рака толстой кишки при семейном аденоматозном полипозе составляет 40 лет.
К синдромам без полипоза относится наследственный неполипозный колоректальный рак (ННПКРР). У этих пациентов злокачественную опухоль толстой или прямой кишки выявляют в возрасте около 40 лет. У большинства больных ННПКРР идентифицируют генетические дефекты в системе репарации ДНК. Мутации происходят в основном в гене MLH1, однако результаты последних исследований свидетельствуют о частом поражении таких генов, как MSH2 и MSH6. ННПКРР сопровождается и другими онкологическими заболеваниями: раком эндометрия (РЭ), раком яичника (РЯ), раком молочной железы (РМЖ) и опухолями нервной системы.
Семейный рак толстой кишки составляет примерно 3—5 % всех случаев рака этой локализации. Однако риск рака толстой кишки также повышен у родственников больных любой формой этого заболевания. Поэтому в большинстве случаев рака толстой кишки можно наблюдать, по крайней мере отчасти, наследственный компонент. Факторы окружающей среды играют важную роль в развитии заболевания; полученные данные указывают, что диета с высоким содержанием клетчатки может снижать вероятность развития рака толстой кишки. Фактор риска — рацион питания с высоким содержанием жира и красного мяса.
*Локализация на хромосоме
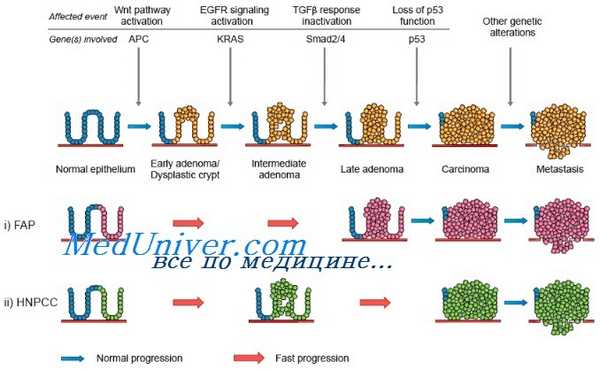
Молекулярные изменения, происходящие при раке толстой кишки, хорошо исследованы Vogelstein и соавт., подробно описавшими прогрессию нормального эпителия в рак. Первыми генами, для которых была установлена связь с раком толстой кишки, стали гены семейства ras, изначально выявленные в вирусах саркомы крыс. Эти гены наиболее часто обнаруживают в промежуточных полипах толстой кишки без дисплазии. В аденомах на ранних стадиях мутации ras встречаются редко, но в промежуточных полипах — регулярно, что свидетельствует о важной роли этих генов в раннем развитии рака толстой кишки.
Опухолевый ген-супрессор АРС принимает участие на самых первых этапах канцерогенеза при раке толстой кишки и был выявлен в исследованиях по изучению утраты гетерозиготности, показавших часто встречающуюся утрату длинного плеча хромосомы 5 (5q). Еще один ген, связанный с развитием рака толстой кишки, — ген-супрессор ТР53, расположенный на коротком плече хромосомы 17 (17р). Мутация этого гена — относительно позднее событие при раке толстой кишки. ТР53 — важный ген в контроле клеточного цикла и апоптоза. Утрата гена-супрессора DCC на длинном плече хромосомы 18 (18q) происходит на промежуточных и поздних этапах канцерогенеза при раке толстой кишки. Этот ген кодирует белок, ответственный за клеточную адгезию.
Ген DPC4, также расположенный на длинном плече хромосомы 18, вовлечен в сигнальную систему, связанную с трансформирующим фактором роста b.
При развитии рака толстой кишки происходит последовательное приобретение ряда мутаций. Для развития злокачественной опухоли обязательного прохождения всех этапов не требуется, однако предполагается, что необходимо по меньшей мере 6 или 7 генетических событий. У больных наследственным неполипозным колоректальным раком (ННПКРР) эти мутации развиваются вследствие неспособности эпителиальных клеток слизистой оболочки кишечника выявлять и устранять ошибки, происходящие во время нормального клеточного деления. Исследования Vogelstein и соавт. продемонстрировали модель, которая может быть применена и к другим опухолям.
Эта работа подробно иллюстрирует поэтапную природу канцерогенеза и взаимодействие генов-супрессоров и онкогенов, однако не объясняет поздних механизмов прогрессии опухоли, в частности приобретения ею инвазивности и способности к метастазированию. Данные свойства опухолевых клеток могут быть объяснены мутациями в других генах, которые еще только предстоит выявить. Тем не менее рак толстой кишки представляет удобную модель для исследователей, изучающих различные опухоли. Цель исследований — описать естественное течение опухолевого заболевания как ряд генетических событий, происходящих в определенной относительно небольшой группе генов. Такая «генетическая история» даст четкие представления всех молекулярных изменений, необходимых для трансформации нормальной клетки в опухолевую, и, в свою очередь, определит мишени для будущих диагностических и терапевтических методов.
Генетика семейного рака кишечника
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Как определить рак: диагностика и анализы
Все больше людей интересует, как выявить рак у себя на ранних стадиях. Это связано с увеличением онкологической настороженности в обществе, повышением медицинской образованности населения, а также ростом числа доброкачественных и злокачественных опухолей. Мировая статистика говорит о том, что в 2018 году в мире зафиксировано более 17 млн новых случаев рака, при этом от онкологических заболеваний умерло 9,6 млн человек.

По данным отечественного Минздрава, в России в 2017 году на первое место вышел рак кожи — 617,2 тыс. случаев, на втором месте находится рак груди — 70,6 тыс. случаев, на третьем расположился рак трахеи, рак бронхов и рак легких — 62,2 тыс. случаев.
Кому стоит провериться на онкологию:
- Активные курильщики — особенно часто у них возникает рак гортани, легких и рак губы.
- Лица, злоупотребляющие алкоголем — рак поджелудочной железы или печени, рак желудка.
- Пациенты с гепатитами В или С, а также другими канцерогенными инфекционными заболеваниями — может возникать рак печени.
- Часто загорающие или активно посещающие солярии — рак кожи, меланома.
- Люди в возрасте 50 лет и старше — повышены риски рака простаты у мужчин, рака молочной железы у женщин.
- При наличии раковых заболеваний у ближайших родственников. Наследственность – важный фактор, способный повысить вероятность онкозаболевания.
- Малая физическая активность, избыточный вес негативно сказываются на состоянии иммунной защиты, которая является важнейшим фактором защиты организма от раковых клеток.
- Носительство вируса папилломы человека повышает риск рак шейки матки у женщин, рака гортани у обоих полов.
- Жители крупных городов и мегаполисов — возникающие при стирании автомобильных шин частицы вместе с выхлопами транспорта повышают риск злокачественной онкологии дыхательной системы и кожи.
- Работники «грязных» производств — обилие в воздухе сажи, свинца, асбеста и других мелких частиц повышает вероятность рака легких и не только.

Диагностика рака на ранней стадии
Ранняя диагностика рака критически важна для каждого человека, поскольку в этом случае значительно повышается шанс на удачное лечение. Например, пятилетняя выживаемость на ранних стадиях сквамозно-клеточной карциномы составляет более 90% при условии своевременной диагностики и адекватной терапии. Исходы у пациентов с поздними стадиями этого рака значительно хуже — при наличии метастазов в лимфоузлы пятилетняя выживаемость составляет всего 25–45%. При Т-клеточной лимфоме разница в исходах еще более значительная: на ранних этапах десятилетняя выживаемость достигает 97–98%, тогда как на поздних этапах — всего 20%.
Специалисты Американского онкологического общества провели многолетние наблюдения за исходами терапии пациентов с меланомой — одного из самых злокачественных раков кожи. Было установлено, что прогноз успешного лечения значительно возрастает при выявлении меланомы на ранних стадиях:
- Локализованная опухоль, которая не выходит за пределы кожи — 98%
- Региональное распространение с прорастанием в близлежащие лимфоузлы — 64%
- Отдаленные метастазы в легких, печени и других органах — 23%
Подобные цифры можно найти для любых типов злокачественных опухолей. Например, пятилетняя выживаемость пациентов с раком желудка при ранней диагностике значительно увеличивается:
- Локализованная опухоль, которая не выходит за пределы слизистой желудка — 68%
- Региональное распространение с прорастанием в близлежащие лимфоузлы — 31%
- Отдаленные метастазы в печени и других органах — 5%
Все это говорит о невероятной важности своевременной диагностики рака, поскольку только в этом случае можно гарантировать высокую вероятность успешного лечения и благоприятного исхода. Каждому человеку следует не только регулярно проходить общее обследование организма на рак, но и самостоятельно обращать внимание на первые признаки онкологических заболеваний. Ведь зачастую организм сигнализирует о проблемах — надо лишь внимательно к нему прислушаться.
Первые признаки онкологических заболеваний органов
Вся дальнейшая информация о том, как определить рак, не должна восприниматься в качестве обязательного критерия наличия онкологии. Любой из указанных симптомов сам по себе не говорит о присутствии в организме доброкачественной или злокачественной опухоли. Однако эти признаки должны вызывать настороженность с последующим визитом к врачу — только квалифицированный медицинский специалист, после внимательного осмотра и проведения ряда анализов, может говорить о наличии или отсутствии рака.
Проблемы с мочеиспусканием — с возрастом они появляются у многих мужчин и женщин. К таким проблемам относятся:
- Частое мочеиспускание, особенно по ночам
- Внезапные позывы в туалет
- Слабое мочеиспускание, длящееся дольше, чем обычно
- Чувство жжения во время мочеиспускания
- Подтекание мочи при кашле, чихании, во время смеха, напряжения мышц живота и др.
Эти симптомы могут вызывать гиперплазия или рак предстательной железы у мужчин, слабость мышечного сфинктера мочеиспускательного канала у женщин, инфекции, передаваемые половым путем у обоих полов, и др. В любом случае, стоит незамедлительно обратиться к врачу.
Кровь в моче или стуле — является одним из признаков рака мочевого пузыря, почек или толстого кишечника. Однако кровь может также возникать при урогенитальной инфекции или геморрое. В любом случае, это состояние не является нормальным, поэтому следует записаться на прием к медицинскому специалисту: урологу, хирургу или терапевту.
Изменения кожи — особое внимание следует обратить на родинки и любые другие пятна. Изменение цвета, размера или формы родинки является поводом для обращения к врачу. Также следует обращать внимание на беспричинное потемнение или осветление какой-либо области кожи. Врач может назначить биопсию — взятие небольшого кусочка из подозрительного участка для анализа на рак под микроскопом.
Увеличение и/или болезненность лимфоузлов — может являться реакцией на простуду или на воспалительный процесс в лимфатических узлах, так называемый лимфаденит. Однако в ряде случаев увеличение лимфоузлов говорит о раке, поэтому нужно без промедления посетить лечащего врача.
Нарушение голоса и/или глотания — может быть признаком рака гортани, которому особенно подвержены активные курильщики. Для диагностики врач может назначить рентгеноскопию с барием, компьютерную или магнитно-резонансную томографию и другие процедуры.
Изжога — неспецифический признак, который сам по себе не говорит о наличии злокачественной опухоли. Однако прогрессирующая изжога может возникать при раке пищевода, желудка или ротоглотки.
Изменения на слизистой рта — особенно тщательно ротовую полость следует осматривать активным курильщикам. Наличие белых, красноватых или сероватых бляшек на слизистой может быть признаком рака и является поводом для визита к врачу.
Резкая потеря веса — злокачественные клетки раковой опухоли требуют много энергии для деления, которую они берут из поступающей в организм пищи. Поэтому значительный объем питательных веществ не доходит до нужных органов и тканей, и человек начинает быстро терять вес. Если фиксируется беспричинное снижение массы тела, это может говорить о раке внутренних органов. Поэтому нужно как можно скорее записаться на прием к врачу.
Жар — в большинстве случаев повышение температуры тела и жар свидетельствуют о том, что организм борется с инфекцией. Но постоянный или возникающий регулярно без явной причины жар может свидетельствовать о раке крови.
Изменения груди — если грудь женщины изменила свою структуру или форму, либо в молочных железах начали прощупываться узловатые или иные образования, это является поводом для обращения к медицинскому специалисту. Врач может назначить маммографию — рентгеновское обследование, помогающее выявить рак молочной железы. Сегодня женщин во всем мире учат регулярному самообследованию груди, что является важным методом ранней диагностики злокачественных опухолей. Однако в 2017 году в Европе было зафиксировано 2470 случаев рака молочной железы у мужчин, поэтому им также следует быть внимательными и регулярно обследовать свою грудь на предмет любых изменений.
Боль — при увеличении размеров раковой опухоли она начинает давить на окружающие структуры: мышцы, сосудистые пучки, нервные волокна, соединительнотканную капсулу органов и др. Это может вызывать болевые ощущения, которые сами по себе не говорят о наличии рака, но являются поводом для посещения врача.
Какие анализы укажут на онкологическое заболевание?
Самостоятельный осмотр тела и визит к медицинскому специалисту являются важными критериями своевременной диагностики рака. При этом есть ряд лабораторных методов, которые также могут помочь в выявлении злокачественных опухолей.
- Общий анализ крови — распространенный и даже «рутинный» метод, который заключается в подсчете различных типов кровяных клеток. С его помощью можно заподозрить рак крови, если выявлено слишком много или слишком мало клеток определенных типов или присутствуют аномальные кровяные тельца. Для подтверждения диагноза рака может быть назначена биопсия костного мозга.
- Биохимический анализ крови — дает общую информацию о метаболизме и работе внутренних органов: поджелудочной железы, печени, почек, желчного пузыря и др. Определенные изменения в биохимии крови могут говорить о наличии того или иного рака, например предстательной железы.
- Белки плазмы — этот анализ помогает выявлять особые белки в плазме крови, которые называются иммуноглобулинами. Их число может быть повышено у пациентов с множественной миеломой и другими типами рака крови. относят к уточняющим тестам и не могут служить в качестве основного метода выявления рака.
Анализ мочи
В анализе мочи можно найти отклонения, указывающие на возможное наличие злокачественной опухоли, только в определенных случаях:
Рак органов мочевыделительной системы может привести к тому, что в моче появляется кровь. В большом объеме она хорошо заметна визуально, а в малых количествах может быть обнаружена лабораторно. Это неспецифический признак, он встречается не только при онкологических, но и при многих других заболеваниях, например, камнях в почках и мочевом пузыре, гломерулонефрите, инфекционном процессе.
При распаде опухолевой ткани в моче могут появиться кетоновые тела. Их наличие – также неспецифический признак, чаще всего он свидетельствует не об опухолевом процессе, а о сахарном диабете.
Белок Бенс-Джонса представляет собой легкие цепи иммуноглобулинов. Их появление в моче может свидетельствовать о миеломной болезни (злокачественном поражении костного мозга) или макроглобулинемии Вальденстрема.
В остальных случаях анализ мочи при онкологических заболеваниях неинформативен. Он может лишь выявить некоторые нарушения в организме, но ничего не говорит непосредственно об опухолевом процессе.
Анализ кала
Кровь в кале может свидетельствовать о злокачественной опухоли в кишечнике. Но это неспецифический симптом. Он часто встречается при геморрое, кишечных полипах и других заболеваниях кишки. В то же время, при раке кровь не всегда видна визуально, и ее можно обнаружить только с помощью специальных анализов. Иногда для скрининга колоректального рака вместо колоноскопии применяют такие лабораторные исследования, как анализ кала на скрытую кровь и анализ фекальной ДНК.
Может ли общий анализ крови показать рак?
С помощью общего анализа крови невозможно диагностировать рак, но он в целом может помочь в ранней диагностике, так как показывает, что с организмом пациента не всё в порядке, и требуется дальнейшее обследование. Возможны такие неспецифические отклонения, как повышение или снижение уровня лейкоцитов, снижение уровня эритроцитов и гемоглобина (анемия), снижение числа тромбоцитов, ускорение СОЭ, появление в крови незрелых клеток. Подобные отклонения в анализах могут быть вызваны как самим раком, так и противоопухолевой терапией.
Онкомаркеры
Анализы на онкомаркеры основаны на выявлении в крови химических веществ, вырабатываемых опухолевыми клетками. Универсального теста, который может безошибочно указать на наличие того или иного рака, нет. Это связано с тем, что уровни данных химических веществ могут повышаться в том числе и при некоторых нераковых состояниях. Ниже представлены наиболее популярные онкомаркеры — какие из них сдавать для профилактики и что они могут показать:
- простат-специфический антиген (ПСА) — рак предстательной железы;
- углеводный антиген 125 (CA-125) — рак яичников;
- кальцитонин — медуллярный рак щитовидной железы;
- альфа-фетопротеин (АФП) — рак печени;
- хорионический гонадотропин человека (ХГЧ) — рак яичка и рак яичников.
Анализ крови на раковые клетки CancerSEEK — направлен на выявление циркулирующих в крови клеток злокачественной опухоли. Его также называют жидкой биопсией.
Указанные выше анализы помогают врачу заподозрить наличие злокачественной опухоли в организме. Однако для подтверждения рака обязательно выполняют диагностическую биопсию — взятие кусочка ткани из подозрительного участка на гистологическое исследование. Только под микроскопом можно достоверно установить, является ли конкретное образование злокачественной опухолью, а также определить вид.
Биопсия может быть взята с поверхности кожи, со слизистых, из внутренних органов, мышц, костей и др. В ряде случаев выполняется диагностическая малоинвазивная операция с использованием эндоскопа.

Другие методы диагностики рака
Диагностическая визуализация — рентгеновские исследования, маммография, компьютерная и магнитно-резонансная томография, позитронно-эмиссионная томография, совмещенная с томографией, двухфотонная рентгеновская абсорциометрия, УЗИ органов брюшной полости, печени и др.
Эндоскопические исследования:
- эзофагогастродуоденоскопия — исследование желудка и 12-перстной кишки;
- колоноскопия — исследование толстого кишечника;
- кольпоскопия — исследование влагалища и шейки матки;
- эндоскопическая ретроградная холангиопанкреатография — изучение желчных протоков, желчного пузыря и печени с помощью эндоскопа и рентгеновских методов;
- сигмоидоскопия — обследование сигмовидной кишки.
Генетический скрининг — картирование генетического профиля человека для выявления наследственной предрасположенности к той или иной злокачественной опухоли.
Скрининговые исследования, которые доступны на данный момент, достаточно просты и не отнимают много времени. Но иногда они помогают спасти жизнь. Хотите узнать, какие виды скрининга нужно проходить вам? Узнайте у онколога в клиниках «Евроонко».
X Международная студенческая научная конференция Студенческий научный форум - 2018

В 1961 г. Хайфлик и Мурхиад показали, что культура соматических клеток имеет ограниченный период жизни . В 1973 г. Оловников предположил, что укорочение концов хромосом (теломер) определяет возможное число делений клетки . Теломеры защищают геном клетки от деградации, участвуют в мейотическом спаривании хромосом и в регуляции транскрипции генов прителомерной области. В клетках, способных размножаться бесконечно (бессмертных), должен существовать механизм, компенсирующий укорочение теломер. В 1985 г. Блекберн и Грейберг открыли фермент, удлиняющий теломеры, – теломеразу . Теломераза – рибонуклеопротеиновый комплекс, состоящий из абсолютно необходимых для активности компонентов: молекулы РНК – tr и теломеразной обратной транскриптазы – tert; также в состав теломеразы может входить ряд ассоциированных с ними белков. tr является матрицей для tert при удлинении теломер с помощью теломеразы. Теломераза в клетках человека существует в видедимера и содержит две субъединицы обратной транскриптазы и две молекулы РНК . В теломеразе человека c htert связываются: p23/p90 – шаперон, отвечающий за сборку/ конформацию комплекса; 14-3-3, обеспечивающий ядерную локализацию; tP1 с неизвестной функцией. С htr связываются белки hGAr1, Dyskerin/nAP57, hnHP2, c1/c2, отвечающие за стабильность, созревание и локализацию РНК; La, hStau, вероятно, отвечающие за присоединение к теломерам; L22, участвующий в процессинге ядерной локализации; hnOP10, A1/uP1, tP1 с неизвестными функциями , tcAB1, отвечающий за локализацию htr в тельцах Кахаля и связывание с теломерами . Ферментативная активность теломеразы человека в лизате ретикулоцитов кролика детектируется при добавлении htr и htert . Заметим, что выполнение теломеразой своих функций in vivo не всегда совпадает с наличием теломеразной активности, измеренной in vitro. Например, добавление гемаглютининового эпитопа на С-конец htert при сохранении теломеразной активности препятствует удлинению теломер.
Понимание того, как работает теломераза, и регулирующих ее работу механизмов может быть использовано в онкодиагностике. cама теломераза и ее регуляторы могут быть важными мишенями антираковой терапии. На активность теломеразы влияют белки, имеющие множество функций в клетке, соответственно, их воздействие не обязательно специфично. Также встречаются случаи, когда регуляторы теломеразы действуют совместно либо несколько регуляторов объединены в каскад.
Целью данного обзора является обобщение и систематизация данных о регуляции теломеразы при онкогенезе.
Выявление взаимосвязи системы регуляции теломеразы с другими онкогенами может помочь в разработке комплексной диагностики рака, позволяющей выявлять заболевание и определять тактику борьбы с ним на наименее агрессивной стадии.
Детектируемая in vitro теломеразная активность появляется в лейкоцитах в G1-фазе . С другой стороны, in vivo теломеры реплицируются во время S-фазы. В течение большей части клеточного цикла htr накапливается в тельцах Кахаля при помощи tcAB1 , в S-фазе совмещаясь с теломерами в клетках. htert также в S-фазе клеточного цикла перемещается на теломеры . Это свидетельствует о существовании регуляции на уровне пространственной локализации активной теломеразы (фермента) и теломеры (субстрата). Не всегда наблюдается корреляция активности теломеразы и длины теломер. Например, при лейкемии зависимость между длиной теломер и активностью теломеразы отсутствует. Активность теломеразы в зависимости от числа деленийхорошо описывается двухшаговой гипотезой клеточного старения и обретения бессмертия (иммортализации) – теорией М1/М2. В эмбриональных клеточных линиях теломераза активна, и длина теломер поддерживается на постоянном уровне. В стволовых клетках активность теломеразы ниже и позволяет лишь частично компенсировать укорочение теломер. В соматических клетках активность теломеразы отсутствует. Укорочение теломер приводит в момент М1 – достижение предела Хайфлика – к переходу клеток в состояние сенессенса (старения), которое может быть преодолено инактивацией (удалением) prB/p16 или p53. Клетки, преодолевшие М1, продолжают делиться и входят в состояние кризиса М2 (точка Б на рис. 2), сопровождающееся массовой клеточной смертью. Уцелевшие клетки перерождаются в раковые. Раковые клетки способны к неограниченному делению и поддержанию длины теломер (как правило, с помощью теломеразы). Если экспрессирующие htr соматические клетки трансфицировать геном htert до момента М2, в них, как и в раковых, происходит удлинение и стабилизация теломер. Активность теломеразы не проявляется в соматических клетках и тканях человека за редким исключением. Показано ее наличие в репродуктивных тканях, а также в быстро обновляющихся тканях, например, в некоторых клетках крови, кишечном эпителии и базальном слое клеток кожи , при этом в соматических клетках с активной теломеразой уровень ее активности ниже, чем в раковых
Частота детекции теломеразной активности в различных опухолях. В большинстве опухолевых клеток (80–90 %) теломераза активна и является основным инструментом поддержания длины теломер. Доброкачественные опухоли и другие предраковые поражения представлены как опухолями, в которых теломеразная активность проявляется почти в 100 % случаев, так и опухолями, в которых активность теломеразы не определяется . Опухолевые клетки некоторых типов могут использовать альтернативный механизм поддержания длины теломер, основанный на рекомбинации . Хотя при трансфекции геном htert клеток с альтернативным механизмом поддержания теломер работают оба механизма, при объединении клеточных линий с разными механизмами в гибридах присутствует теломераза, а признаки альтернативного механизма удлинения теломер пропадают . Следует отметить, что сама по себе теломераза не является онкогеном. Клеточные линии, трансфицированные геном htert, долгое время не показывают признаков злокачественной трансформации . Активность теломеразы может появляться вследствие отбора клонов при критическом укорочении теломер (рис. 2, точка Б). Сначала клетки начинают усиленно делиться, при этом у них укорачиваются теломеры, затем выживают те из них, у которых активируется теломераза. В этом случае теломеразная активность может быть маркером опухолевой прогрессии и отрицательного прогноза. Так, при лимфогранулематозе основное увеличение активности теломеразы происходит при переходе от первой ко второй стадии . При другом варианте развития событий теломеразная активность появляется одновременно с другими ведущими к раку нарушениями метаболизма вследствие исходного клеточного поражения. В этом случае активность теломеразы появляется в самом начале заболевания и служит маркером начала онкологических процессов. Например, при раке шейки матки нет зависимости активности теломеразы от стадии рака – теломераза активна уже на первой стадии, а ее активация происходит во время предопухолевых заболеваний . Теломераза может быть исходно активна в исследуемом типе клеток, и эта активность лишь усиливается при переходе к раку, например, при гемобластозе. Также теломераза может быть исходно активна в случае перерождения стволовой клетки . В этом случае теломеразная активность будет обнаруживаться при начале роста опухоли, поскольку метод ее детекции не позволяет увидеть активность из одной клетки на фоне окружающей ткани, но уже небольшой пул теломеразаположительных клеток будет заметен. К сожалению, в большинстве исследований можно найти информацию лишь о наличии теломеразной активности в определенном типе рака. Механизмы активации теломеразы изучают, как правило, на клеточных линиях, и редко можно сказать, какой механизм и с какой частотой встречается в исследуемом типе рака in vivo.
Онкосупрессоры P53 И P73
Белок p53 регулирует множество генов, участвующих в контроле клеточного цикла и онкогенезе (p21, MDM-2, Bax, c-Fos/Jun, prB, 14-3-3σ, Bcl2 и ряд других) . p53 противодействует онкогенезу, включая механизмы ареста клеточного цикла и апоптоза в ответ на различные поражения клетки . Этот белок неактивен более чем в половине типов человеческих опухолей . Восстановление функционального р53 в раке шейки матки, лимфоме Беркитта, раках молочной и поджелудочной желез приводит к ингибированию теломеразной активности за счет подавления экспрессии htert . Этот эффект проявляется в течение нескольких часов после индукции p53, до того как происходит нарушение клеточного цикла и начинается апоптоз. Мутации в доменах р53, ответственных за связывание деацетилаз гистонов и корепрессора Sin3A, не влияют на угнетение htert, хотя деацетилазы участвуют в ингибировании транскрипции htert белком p53. Мутации р53 в домене связывания с ДНК, домене олигомеризации или домене активации транскрипции приводит к деактивации р53 по отношению к теломеразе. При этом p53 не связывается in vivo с промотором htert, т.е. его действие на промотор непрямое. p53 может использовать в качестве посредников белки р21, e2F и белки группы prB. Для проявления ингибирования р53 необходим Sp1. Мутации в участках связывания Sp1 ликвидируют подавление активности промотора htert с помощью р53 . Эксперименты в клетках Drosophila Schneider SL2 показали, что активация промотора htert, зависящая от эктопической экспрессии Sp1, аннулируется p53 дикого типа. p53 взаимодействует с Sp1 и предотвращает его связывание с промотором htert in vitro . р53, возможно, использует в качестве посредника белок р21 , хотя в аналогичных более ранних экспериментах обнаружено, что р21 не является посредником в действии р53 на теломеразу. Белок p73 проявляет онкосупрессорные функции, подобно р53. Изучение не вырабатывающих p53 клеток показало, что суперэкспрессия С-концевых изоформ p73 (α, β, γ, δ) приводит к уменьшению активности промотора htert. Угнетение экспрессии htert происходит при посредничестве эндогенного p73 после активации e2F1 в клетках. Мутации в участках связывания Sp1 в основной части промотора htert нивелируют репрессию промотора htert с помощью p73, свидетельствуя об участии Sp1 в этом процессе в качестве посредника. Кроме того, р73 связывается с Sp1, что подтверждает участие Sp1 в p73-зависимом угнетении экспрессии htert.
Клеточная локализации In vitro высокая активность теломеразы наблюдается в цитоплазматическом экстракте, а не в ядерном, хотя для работы теломеразы в клетке она должна быть локализована вместе с теломерами в ядре . При этом in vivo GFP-содержащая теломераза локализуется в ядре . При связывании nF-kB (р65 субъединица) с белком htert фактор некроза опухолей α (tumor necrosis factor α, он же tnF α) индуцирует перенос из цитоплазмы в ядро htert, связанный с nF-kB. Белок 14-3-3, отвечающий за ядерную локализацию, связывается с теломеразой. Доминант-негативный 14-3-3 направляет в цитоплазму htert, в норме локализованный в ядре. Мутантный htert, не способный связываться с 143-3, локализуется в цитоплазме. 14-3-3 мешает связываться белку crM1 с neS-мотивом (nuclear export signal, сигнал экспорта из ядра). Ингибирование crM1/экспортин1 пути ядерного экспорта, как и нарушение neS-мотива, приводит к уменьшению локализации htert в цитоплазме [170]. htert большую часть клеточного цикла не локализуется в нуклеолях, тельцах Кахаля или на теломерах. В S-фазе клеточного цикла htert перемещается в нуклеоли, затем в тельца Кахаля и затем на теломеры [15, 16].
Регуляция теломеразная РНК
В тканях взрослых людей высокий уровень экспрессии теломеразной РНК обнаружен в первичных сперматоцитах и клетках Сертоли, средний уровень экспрессии – в лимфатических фолликулах, слабый уровень экспрессии – в эпителии, а в клетках нервной системы и тканях, происходящих из мезенхимы, экспрессия htr отсутствует . Заметный уровень экспрессии обнаружен в тонком кишечнике, яичниках, селезенке, тимусе, почках и простате. Низкий уровень экспрессии htr наблюдается в мозге, печени, желудке, поджелудочной железе, легких и сердце.
В теломераза-положительных образцах опухолевых тканей наблюдали сильную экспрессию htr, а в теломераза-негативных саркомах мягких тканей только половина экспрессировала htr в различной степени. В теломераза-негативных опухолях нет связи между экспрессией htr и пролиферативным статусом, длиной теломер и экспрессией htert . Повышенная экспрессия htr не связана с теломеразной активностью, например, в раке легких . Методом in situ гибридизации определено, что в случае пищевода Баррета и дисплазии пищевода ранней стадии htr отсутствует или экспрессируется со средней эффективностью, а на поздних стадиях развития дисплазии или рака эффективность экспрессии htr велика . В образцах рака легких в случае применения ОТ-ПЦР (обратной транскрипции и ПЦР) htr выявляется в 90-100 % случаев образцов как раковых, так и нормальных тканей . При определении в раке легких методом гибридизации in situ htr обнаруживался всего в 26 % раковых тканей, определенных гистологическим анализом, для некоторых образцов хорошо определяется разница между раковыми и нормальными тканями. Этим же методом определена экспрессия htr в 41 % плоскоклеточной карциномы, 13 % и 17 % аденокарцином молочной железы и яичников, 43 % рака и 40 % предраковых поражений шейки матки . К сожалению, неизвестна дальнейшая судьба пациентов с предраковыми поражениями, поэтому невозможно говорить об экспрессии htr как о маркере развития онкогенного процесса. Для использования экспрессии htr в качестве ракового маркера необходимо проводить точный количественный анализ в отличии от экспрессии htert или определения теломеразной активности. При анализе нейробластом в 9 из 12 образцах раков средних стадий и только в 2 из 8 образцов раков ранних стадий обнаружен высокий или средний уровень экспрессии htr. Заболевание не прогрессировало у пациентов с низким уровнем экспрессии htr или без нее. В случае 8 образцов рака (от 7 пациентов) со средним или высоким уровнем экспрессии htr развитие болезни было неблагополучным. Следует отметить, что в случае поздней стадии болезни с обширными метастазами (4 образца) экспрессия htr была слабой. Экспрессия htr в ганглионейробластомах и ганглионейромах ограничена только нервными клетками, в леммоцитах она отсутствует. Таким образом, в неметастазирующих нейробластомах экспрессия htr оказалась хорошим прогностическим фактором . Для рака Вильямса именно экспрессия htr, но не htert, является предсказательным фактором дальнейшего развития. У 30 % пациентов с наибольшей экспрессией htr (количественную оценку проводили ОТ-ПЦР в реальном времени) вероятность рецидива вдвое выше по сравнению с пациентами с наименьшим уровнем экспрессии htr . Также высокий уровень экспрессии htr коррелирует с плохим прогнозом у пациентов с липосаркомой . Повышение экспрессии htr не всегда совпадает с появлением теломеразной активности. htr ингибирует протеинкиназу контрольных точек Atr. Подавление уровня экспрессии htr приводит к остановке клеточного цикла в G1- и G2-фазах в результате активации белка p53 и протеинкиназы контрольных точек cHK1. Этот эффект не зависит от теломеразной активности. Возрастание экспрессии htr в ответ на ультрафиолетовое облучение предотвращает активацию p53 и cHK1 в результате ингибирования активности Atr, тем самым ослабляя клеточный ответ на повреждение ДНК и позволяя клеткам проходить контрольную точку G2/M. Взаимодействия между htr и AtM не обнаружено, так что механизм этого ингибирования остается неизвестным .
Регуляция в ходе ответв на ионизирующие излучения
Знания о системе регуляции теломеразы позволят более эффективно разрабатывать методики и препараты для подавления теломеразной активности в раковых клетках. К сожалению, многие механизмы регуляции теломеразы тканеспецифичны. Выявление взаимосвязи системы регуляции теломеразы с другими онкогенами может помочь в разработке комплексной диагностики рака, позволяющей выявлять заболевание и определять тактику борьбы с ним на наименее агрессивной стадии. Теломеразная активность является маркером активно делящихся клеток и одним из наиболее универсальных маркеров рака.
Читайте также:
- Показания для обходных анастомозов при неудалимом раке поджелудочной железы
- Печень как депо витаминов. Билирубин желчи в диагностике
- Показания для операции трехсуставного атродеза стопы
- Гомеостатические механизмы при гиперосмотической гипергидратации. Синдром Кона. Гиперосмотическая гипергидратация.
- Методы обследования отторжения трансплантата почки
