Трансплантация стволовых клеток при миелопролиферативных заболеваниях - миелолейкозе
Добавил пользователь Владимир З. Обновлено: 27.01.2026
Первичный миелофиброз (ПМФ) – это хроническое миелопролиферативное новообразование, которое характеризуется фиброзом костного мозга, спленомегалией и анемией с наличием ядросодержащих и каплевидных эритроцитов. Для диагностики необходимо исследование костного мозга и исключение других патологических состояний, которые могут вызвать миелофиброз (вторичный миелофиброз). Лечение обычно поддерживающее, однако ингибиторы JAK2, такие как руксолитиниб или федратиниб, могут уменьшать симптомы заболевания, а трансплантация стволовых клеток может привести к выздоровлению.
Патофизиология первичного миелофиброза
Миелофиброз является реактивным, обратимым увеличением количества коллагена в костном мозге, часто с экстрамедуллярным гемопоэзом (в первую очередь в селезенке). Миелофиброз бывает:
Первичным (чаще всего)
Вторичным по отношению к ряду гематологических заболеваний, злокачественных новообразований и доброкачественных состояний (см. таблицу Патологические состояния, сопровождающиеся миелофиброзом Патологические состояния, сопровождающиеся миелофиброзом ).
Первичный миелофиброз является следствием злокачественного перерождения полипотентных стволовых клеток костного мозга. Эти клетки первичного миелофиброза стимулируют выработку чрезмерного количества коллагена фибробластами костного мозга (которые не вовлечены в процесс злокачественного перерождения). Наиболее часто первичный миелофиброз встречается в возрасте от 50 до 70 лет и преимущественно у мужчин.
Мутации гена Янус-киназы 2 (JAK2) присутствуют в высокой доле случаев первичного миелофиброза. JAK2 относится к группе ферментов тирозинкиназы и участвует в передаче сигнала для эритропоэтина , тромбопоэтина и колониестимулирующего фактора гранулоцитов (G-CSF) среди других единиц. Мутации гена рецептора тромбопоэтина (MPL) или гена кальретикулина (CALR) также могут быть причиной первичного миелофиброза. Тем не менее, наблюдаются редкие случаи первичного миелофиброза, при которых нет ни одной из этих трех мутаций (тройной отрицательный первичный миелофиброз). Некоторые из этих пациентов имеют другие редкие мутации гена MPL, которые могут быть обнаружены только при методах секвенирования нового поколения.
При первичном миелофиброзе ядросодержащие эритроциты (нормобласты) и миелоциты поступают в циркулирующую кровь (лейкоэритробластоз), при экстрамедуллярном гемопоэзе (то есть, из-за фиброза костного мозга, функцию гемопоэза взяли на себя другие органы). Часто повышается уровень сывороточной лактатдегидрогеназы. В конечном итоге развивается недостаточность костного мозга с последующим развитием анемии и тромбоцитопении. Быстро прогрессирующий, не поддающийся лечению химиопрепаратами острый лейкоз Обзоры лейкемии (Overview of Leukemia) Лейкоз представляет собой злокачественное заболевание, характеризующееся производством избыточного количества незрелых или аномальных лейкоцитов, что в конечном итоге приводит к подавлению производства. Прочитайте дополнительные сведения развивается приблизительно у 30% пациентов.
Злокачественный миелофиброз (иногда называемый острым миелофиброзом) представляет собой редкую разновидность миелофиброза, которая характеризуется панцитопенией, миелобластозом и фиброзом костного мозга, который имеет быстро прогрессирующее нисходящее течение и обычно обусловлен типом острого лейкоза, называемого острым мегакариобластным лейкозом.
Симптомы и признаки первичного миелофиброза
У многих пациентов миелофиброз протекает бессимптомно. У некоторых больных отмечаются симптомы анемии, спленомегалии или (на поздних стадиях) общее недомогание, потеря веса, лихорадка, инфаркты селезенки. У некоторых пациентов развивается гепатомегалия. Увеличение лимфатических узлов встречается редко. Сильный экстрамедуллярный гемопоэз может нарушить функцию органов, в которых он происходит, в том числе и головного мозга.
Диагностика первичного миелофиброза
Общий анализ крови (ОАК) и мазок периферической крови
Исследование костного мозга
Исследование на JAK2, CALR, а также MPL мутации
Следует заподозрить первичный миелофиброз у пациентов со спленомегалией, инфарктом селезенки и анемией. При подозрении на данное заболевание необходимо выполнить общий анализ крови и исследовать форменные элементы в мазке периферической крови, а также провести биопсию костного мозга. При наличии миелофиброза в образце костного мозга (что можно обнаружить при окрашивании ретикулином или при трихромном окрашивании – увеличенное содержание коллагена и остеосклероз) необходимо исключить другие заболевания, сопровождающиеся миелофиброзом (см. таблицу Патологические состояния, сопровождающиеся миелофиброзом Патологические состояния, сопровождающиеся миелофиброзом ), с помощью соответствующих клинических и лабораторных методов. Диагноз первичного миелофиброза подтверждается путем обнаружения мутации в JAK2, CALR, или MPL. Панель секвенирования следующего поколения более широкого спектра позволяет обнаружить генные мутации, связанные с повышенным риском лейкозной трансформации, и, следовательно, может быть информативна для прогноза.
Анемия является характерным проявлением заболевания и со временем ее выраженность обычно нарастает. Морфология клеток крови может быть разнообразной. Эритроциты пойкилоцитные. Может наблюдаться ретикулоцитоз и полихроматофилия; характерной морфологической особенностью являются каплевидные (слёзоподобные) эритроциты (дакриоциты). В периферической крови также обычно встречаются ядерные эритроциты и предшественники нейтрофилов. Уровень лейкоцитов обычно повышен, но при этом может сильно варьировать. На поздних стадиях, даже в отсутствие острого лейкоза, могут встречаться миелобласты. Вначале уровень тромбоцитов может быть высоким, нормальным или низким, однако по мере прогрессирования заболевания начинает преобладать тромбоцитопения.
Прогноз при первичном миелофиброзе
Средняя продолжительность жизни при первичном миелофиброзе составляет 5 лет от начала заболевания, но широко варьирует; у некоторых пациентов болезнь быстро прогрессирует, включая развитие острого миелогенного лейкоза Острый миелолейкоз (ОМЛ) При остром миелолейкозе (ОМЛ) злокачественная трансформация и неконтролируемая пролиферация аномально дифференцированных, долго живущих клеток-предшественниц миелоидного ряда вызывает появление. Прочитайте дополнительные сведенияК неблагоприятным прогностическим маркерам относятся значение гемоглобина < 10 г/дл ( < 100 г/л), переливание крови в анамнезе, лейкоцитоз и количество тромбоцитов < 100 000/мкл ( < 100000 × 10 9 /л). Продолжительность жизни пациентов в группе наиболее высокого риска составляет < 1 года, но у тех, кто страдает заболеванием с низким риском, средняя продолжительность жизни составляет 10 лет. Для прогнозирования выживаемости доступны несколько прогностических балльных систем.
Существует ряд полезных систем стратификации риска, которые помогают прогнозировать течение заболевания и принимать решения о назначении медикаментозной терапии или трансплантации стволовых клеток. Международная прогностическая балльная система International Prognostic Scoring System (IPSS) для оценивания миелодиспластических синдромов применяется для вновь диагностированного первичного миелофиброза. Динамическую международную прогностическую балльную систему (DIPSS) можно сипользовать для прогнозирования прогрессирования или выживаемости по мере развития заболевания ( 1 Справочные материалы по прогнозу Первичный миелофиброз (ПМФ) – это хроническое миелопролиферативное новообразование, которое характеризуется фиброзом костного мозга, спленомегалией и анемией с наличием ядросодержащих и каплевидных. Прочитайте дополнительные сведения ). Некоторые системы оценки также включают цитогенетические и молекулярные маркеры (например, DIPSS-плюс [динамическая международная прогностичесская балльная система]).
Справочные материалы по прогнозу
1. Passamonti F, Cervantes F, Vannuchi AM, et al: Dynamic International Prognostic Scoring System (DIPSS) predicts progression to acute myeloid leukemia in primary myelofibrosis. Blood 115:1703-1709, 2010.
Болезни которые можно лечить с помощью стволовых клеток
Именно на этом сайте в 2003 году впервые появилась информация о лечении стволовыми клетками крови, которая была разделена на три больших раздела:
Также важно понимать различия двух методик лечения:
- - пациент получает стволовые клетки от совместимого донора, это может быть сиблинг (брат или сестра), либо неродственный донор. - пациент получает свои собственные стволовые клетки.
Когда родители передают стволовые клетки в общедоступный банк, они тем самым помогают пациентам по всему миру, которые ищут неродственного донора для аллогенной трансплантации. Когда родители сохраняют пуповинную кровь в семейном банке, они дают ребенку воспользоваться стволовыми клетками для аутологичной трансплантации, либо же ближайш родственники (родители, братья, сестры) могут использовать эти стволовые клетки для аллогенной трансплантации.
В нижеприведенном списке содержатся сведения обо ВСЕХ методах лечения, где используются стволовые клетки, вне зависимости от того, откуда они были получены – из костного мозга, периферической крови или пуповинной крови.
Данная страница была разработана Фрэнсис Вертер, Алексеем Берсеневым и Педро Сильва Коуто ©2016-2022.
Стандартные методы лечения
Эти методы лечения применяются в случае болезней, при которых трансплантация кроветворных клеток (трансплантация гемопоэтических стволовых клеток – ТГСК) применяются как стандартные, общепризнанные.
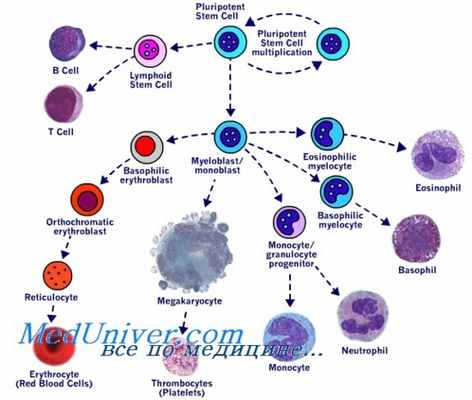
При некоторых заболеваниях это – единственный метод лечения, а в других случаях они могут быть использованы, когда терапия первой линии не дала результата, или же течение болезни оказалось очень агрессивным. Большинство заболеваний, при которых ТГСК является терапией выбора – это патология клеток крови. Процесс пролиферации, то есть развития зрелых клеток крови из стволовых клеток представлен на рисунке сбоку (нажмите, чтобы увеличить), также вы можете почитать о видах клеток иммунной системы подробнее. В США, большинство страховых компаний оплачивают пересадку стволовых клеток в том случае, если это «стандартная терапия» при заболевании, которым страдает пациент.
Лейкоз это вид рака крови, задействованы при этом лейкоциты или белые кровяные тельца.
| Диагноз | Аллогенная | Аутологичная |
| Острый лимфобластный лейкоз (ОЛЛ) | X | |
| Острый миелобластный лейкоз (ОМЛ) | X | |
| Острый бифенотипичный лейкоз | X | |
| Острый недифференцированный лейкоз | X | |
| Хроничекий лимфолейкоз (ХЛЛ) | X | |
| Хронический миелолейкоз (ХМЛ) | X | |
| Ювенильный хронический миелоидный лейкоз (ЮХМЛ) | X | |
| Ювенильный миеломоноцитарный лейкоз (ЮММЛ) | X |
Миелодиспластический синдром также носит название предлейкемии (состояния, которое предшествует лейкозу)
| Диагноз | Аллогенная | Аутологичная |
| Рефрактерная анемия | X | |
| Рефрактерная анемия с кольцевидными сидеробластами (сидеробластная анемия) | X | |
| Рефрактерная анемия с избытком бластов | X | |
| Рефрактерная анемия с избытком бластов в стадии трансформации | X | |
| Хронический миеломоноцитарный лейкоз (ХММЛ) | X |
Лимфома это вид злокачественной опухоли из лейкоцитов, которые циркулируют в крови и в лимфатических сосудах.
| Диагноз | Аллогенная | Аутологичная |
| Лимфома Ходжкина (лимфогранулематоз) | X | X |
| Неходжкинская лимфома (лимфома Беркитта) | X |
Другие нарушения пролиферации клеток крови
| Диагноз | Аллогенная | Аутологичная |
| Анемия это дефицит эритроцитов (красных кровяных телец) или нарушение их функции | ||
| Апластическая анемия | X | |
| Анемия Фанкони ((Первая трансплантация стволовых клеток из пуповинной крови была выполнена в 1988 году пациенту с анемией Фанкони, это – наследственное заболевание)) | X | См. исследования генной терапии |
| Врожденная дизэритропоэтическая анемия | X | |
| Пароксизмальная ночная гемоглобинурия (ПНГ) | X | |
| Наследственная патология эритроцитов Эритроциты содержат гемоглобин, их функция – перенос кислорода в организме. | ||
| Серповидноклеточная анемия | X | |
| Большая бета-талассемия (также известна под названием анемия Кули) | X | |
| Анемия Даймонда-Блекфена | X | |
| Парциальная красноклеточная аплазия | X | |
| Наследственные болезни тромбоцитов Тромбоциты это клетки, которые необходимы для свертывания крови. | ||
| Амегакариоцитоз / врожденная тромбоцитопения | X | |
| Тромбастения Гланцмана | X | |
| IНаследственные болезни иммунной системы: тяжелый комбинированный иммунодефицит (ТКИД) | ||
| ТКИД с дефицитом аденозиндеаминазы(АДА-ТКИД) | X | |
| ТКИД, сцепленный с Х-хромосомой | X | |
| ТКИД, при котором отсутствуют Т- и В-лимфоциты | X | |
| ТКИД, при котором отсутствуют Т- лимфоциты, В-лимфоциты нормальные | X | |
| Синдром Оменна | X | |
| Наследственные болезни иммунной системы: нейтропении | ||
| Инфантильный генетический агранулоцитоз (синдром Костманна) | X | |
| Миелокатексис | X | |
| Наследственные болезни иммунной системы: другие | ||
| Атаксия-телеангиоэктазия | X | |
| Синдром обнаженных лимфоцитов | X | |
| Общий вариабельный иммунодефицит (ОВИД) | X | |
| Синдром ДиДжорджи | X | |
| Гемофагоцитарный лимфогистиоцитоз | X | |
| Дефицит адгезии лимфоцитов | X | |
| Лимфопролиферативные заболевания | X | |
| Лимфопролиферативные заболевания, сцепленные с Х-хромосомой (Чувствительность к вирусу Эпштейн-Барр) | X | |
| Синдром Вискотта-Олдрича | X | |
| Миелопролиферативные заболевания | ||
| Острый миелофиброз | X | |
| Сублейкемический миелоз (миелофиброз) | X | |
| Истинная полицитемия | X | |
| Эссенциальная тромбоцитопения | X | |
| Патология фагоцитов клеток иммунной системы, которые поглощают и уничтожают чужеродные организмы. | ||
| Синдром Чедиак-Хигаси | X | |
| Хронические гранулематозные заболевания | X | |
| Дефицит актина в нейтрофилах | X | |
| Ретикулярный дисгенез | X | |
| Злокачественные опухоли костного мозга | ||
| Множественная миелома | X | X |
| Плазмоклеточный лейкоз | X | X |
| Макроглобулинемия Вальденстрема | X | X |
Трансплантация при наследственных заболеваниях иммунной системы и других органов
| Диагноз | Аллогенная | Аутологичная |
| Гипоплазия хряща - волос | X | |
| Эритропоэтическая порфирия (болезнь Гюнтера) | X | |
| Синдром Германски- Пудлака | X | |
| Синдром Пирсона | X | |
| Синдром Швахмана – Даймонда | X | |
| Системный мастоцитоз | X |
Трансплантация при наследственных метаболических заболеваниях
| Диагноз | Аллогенная | Аутологичная |
| Мукополисахаридозы (МПС) – болезни накопления | ||
| Синдром Гурлера (МПС-IH) | X | |
| Синдром Шейе (МПС-IS) | X | |
| Синдром Хантера (МПС-II) | X | |
| Синдром Санфилиппо (МПС-III) | X | |
| Синдром Моркио (МПС-IV) | X | |
| Синдром Марота-Лами (МПС-VI) | X | |
| Синдром Слая (Дефицит бета-глюкуронидазы) | X | |
| Муколипидоз II (I-клеточная болезнь) | X | |
| Лейкодистрофии | ||
| Адренолейкодистрофия (АЛД) | X | |
| Болезнь Краббе (глобоид-клеточная лейкодистрофия) | X | |
| Метахроматическая лейкодистрофия | X | |
| Болезнь Пелицеуса-Мерцбахера | X | |
| Лизосомальные болезни накопления | ||
| Болезнь Ниманна-Пика | X | |
| Болезнь Сандхоффа | X | |
| Болезнь Волмана | X | |
| Другие наследственные метаболические болезни | ||
| Синдром Лёш-Нихена | X | |
| Остеопетроз | X |
Солидные опухоли, которые происходят не из органов кроветворения и иммунной системы.
| Диагноз | Аллогенная | Аутологичная |
| нейробластома | X | |
| Медуллобластома | X | |
| ретинобластома | X |
Методы лечения в рамках клинических исследований
«Клиническое исследование» - это исследование, которое проводятся на людях для оценки тех методов лечения, которые не считаются стандартными. Исследования, проходящие в США, представлены на сайте ClinicalTrials.gov, на котором существует база данных с поисковой системой, также на сайте есть информация о множестве международных исследований.
Клиническое исследование на человеке в США всегда представлено фазами:
- Фаза 1: Это исследование безопасности лекарственного препарата, чтобы убедиться, что его применения хорошо переносится.
- Фаза 2: Более крупное исследование для сравнительной оценки эффективности нового метода лечения со стандартным методом лечения.
- Фаза 3: Еще более крупное исследование для изучения влияния различных параметров (например дозы и способа применения препарата) и отслеживания побочных эффектов до вывода препарата на рынок.
- Фаза 4: Постмаркетинговое исследование – для получения дополнительной информации о рисках, преимуществах и оптимальном режиме применения препарата.
Неврологические расстройства
(обратите внимание – ссылки на английском языке – оригинальные исследования)
| Диагноз | Аллогенная | Аутологичная |
| Аутизм | Фаза 2 Фаза 1 | |
| Церебральный паралич | Фаза 2 | Фаза 2 Фаза 2 Фаза 1 Фаза 2 |
| Потеря слуха (приобретенная сенсоневральная тугоухость) | Фаза 2 | |
| Гипоксически-ишемическая энцефалопатия ( (HIE) | Фаза 1 | |
| Повреждения спинного мозга | Наблюдение Фаза 2 |
Аутоиммунные болезни
| Диагноз | Аллогенная | Аутологичная |
| Боковой амиотрофический склероз (ALS) | Наблюдение Фаза 1 | Фаза 1 |
| Болезнть Крона | Фаза 2 плацента Фаза 3 Prochymal Фаза 2 Athersys | Фаза 3 ASTIC |
| Сахарный диабет 1 типа | Фаза 2 | Фаза 1 |
| Реакция трансплантат против хозяина (GvHD) | Фаза 3 Prochymal у детей Фаза 3 Prochymal у взрослых | |
| Одновременная трансплантация почек и стволовых клеток | Фаза 2 | |
| Волчанка | Фаза 1 | review of trials Фаза 2 |
| Рассеянный склероз | Обзор исследований Фаза 1, news | |
| Ревматоидный артрит | Фаза 2 placenta | |
| Системная склеродермия | Фаза 1 | Наблюдение Фаза 2 SCOT Фаза 2 CD34+ |
Болезни сердечно-сосудистой системы
| Диагноз | Аллогенная | Аутологичная |
| Врожденные пороки развития | ||
| Поддержка при различных операциях на открытом сердце | Фаза 1 | |
| Синдром гипоплазии левых отделов сердца (HLHS) | Фаза 1 | |
| Растущие протезы сосудов | Фаза 1, story | |
| Ишемия | ||
| Критическая ишемия конечностей | Фаза 2 | Фаза 2 Фаза 2 Фаза 3 BMAC |
| Компартмент-синдром (боевая травма) | Фаза 1 | |
| Ишемический инсульт | Фаза 2 placenta | Фаза 3 |
| Ишемическая болезнь сердца | Meta-Analysis | |
| Восстановление миокарда | ||
| Острый инфаркт миокарда | Наблюдение Фаза 3 BAMI | |
| Кардиомиопатия | Наблюдение | Фаза 1 Texas Heart Inst. Фаза 3 |
Генная терапия наследственных заболеваний
Обратите внимание, что в этом списке представлены только те методы генной терапии, в которых используются гемопоэтические стволовые клетки. Имеется множество других клинических исследований в области генной терапии, некоторые из них посвящены тем же самым заболеваниям, путь введения при этом может быть другой (внутримышечные инъекции, внутримозговые инъекции и другое)
| Диагноз | Аллогенная | Аутологичная |
| Адренолейкодистрофия | Фаза 2 bluebird bio | |
| Хронические гранулематозы (сцепленные с Х-хромосомой) | Фаза 1 | |
| Анемия Фанкони | Фаза 1, news | |
| ВИЧ | Фаза 1 Calimmune Фаза 1 Hutch | |
| Метахроматическая лейкодистрофия | Фаза 1 Milan | |
| Тяжелый комбинированный иммунидефицит | Фаза 1 X-linked SCID Boston Фаза 1 X-linked SCID St. Jude Фаза 1 X-linked SCID Paris Фаза 1 ADA-SCID UCLA Фаза 1 ADA-SCID Duke | |
| Серповидно-клеточная анемия | planned trial | |
| Талассемия | Наблюдение Фаза 1 St. Jude Фаза 1 MSK Фаза 1 bluebird bio | |
| Синдром Вискотта-Олдрича | Фаза 1 Фаза 1 Milan |
Ортопедия
| Диагноз | Аллогенная | Аутологичная |
| Операции при альвеолярных расщелинах неба | Gintuit FDA-одобрение (НЕ гемопоэтические стволовые клетки) | publication Фаза 1 |
| Протезирование хрящей коленного | Cartistem KFDA-одобрение | Фаза 2 IMPACT |
Разное
| Диагноз | Аллогенная | Аутологичная |
| Бронхолегочная дисплазия (BPD) | Фаза 2 Pneumostem | |
| Буллезный эпидермолиз | публикация, наблюдение | |
| ВИЧ, также известен под названием СПИД | Фаза 1 Hutch Berlin patient PubMed & NPR | |
| Лизосомальные болезни накопления | Внутриутробное переливание крови через пуповину |
Экспериментальные методы лечения
These are diagnoses for which stem cell treatments are being studied either in the laboratory with cell cultures or in animals that mimic the human disease. The experimental therapies are not yet in human clinical trials. In experimental research, it is often not clear whether an eventual therapy, if developed, would be Autologous or Allogeneic.
Due to the explosion of stem cell research and the difficulty keeping track of which studies are promising, this section does not have a list.
Трансплантация стволовых клеток при миелопролиферативных заболеваниях - миелолейкозе
Трансплантация стволовых клеток при миелопролиферативных заболеваниях - миелолейкозе
Термин «миелодиспластические синдромы» объединяет разные дефекты развития кроветворных клеток на стадиях, близких к стволовой клетке. Все они характеризуются неэффективным гематопоэзом и прогрессируют до активного миелолейкоза. При этих состояниях используют те же схемы лечения, что и при остром миелолейкозе, и примерно с теми же результатами.
По данным одного из исследований, при родственной трансплантации стволовых клеток от HLA-идентичных доноров 3-летняя БРВ у 23 детей составила 64 %, а при неродственной трансплантации кроветворных стволовых клеток (ТКСК) (15 детей) — 53%. Трансплантацию следует проводить вскоре после постановки диагноза, так как нарастание числа бластов резко ухудшает прогноз и увеличивает вероятность рецидива. Обычная химиотерапия и другие виды лечения практически не влияют на естественное течение болезни.
Пролиферация одного из миелоидных ростков заканчивается острым миелоподобным лейкозом, хроническим миеломоноцитарным лейкозом, тромбоцитемией, эритремией, сублейкемическим миелозом или ювенильным хроническим миелолейкозом. В этих случаях ТКСК — метод выбора. При использовании клеток от HLA-идентичных сибсов длительная БРВ составляет 80%, а при неродственной трансплантации от совместимых доноров — 45-74 %.
Проводить трансплантацию рекомендуется не позднее, чем через год после установления диагноза, иначе ее эффективность оказывается значительно меньшей (БРВ не более 40-60 %). При трансплантации в активной фазе заболевания БРВ составляет 35-40%, а на фоне бластного криза — 10-20 %. Вероятность рецидива при этом достигает 60 %, тогда как при трансплантации в хронической фазе заболевания она составляет только 10-20%.
Трансплантация кроветворных стволовых клеток (ТКСК) эффективна и при некоторых более редких миелопролиферативных заболеваниях. Она показана в случаях безуспешной консервативной терапии или при переходе заболевания в острый миелоподобный лейкоз. Ее можно проводить и при эритремии, но при тромбоцитемии попытки ТКСК пока не дали положительного результата. Сублейкемический миелоз характеризуется спленомегалий и анемией вследствие прогрессирующего фиброза костного мозга.
Средняя выживаемость больных не превышает 5 лет, и трансплантации кроветворных стволовых клеток (ТКСК) является единственным методом лечения в таких случаях; после нее выжили 7 из 12 больных.
Для ювенильного хронического миелолейкоза характерна активная клональная пролиферация незрелых клеток миелоидного ряда, сочетающаяся с нейрофиброматозом типа I и моносомией по хромосоме 7. Болезнь быстро прогрессирует и не поддается химиотерапии; смерть наступает в среднем через 9 мес. после установления диагноза. ТКСК может спасти таких больных и должна проводиться сразу же после подтверждения диагноза.
Как показывают многие исследования, БРВ после трансплантации кроветворных стволовых клеток (ТКСК) от HLA-идентичных сибсов составляет 30-40% и 20-30% при использовании клеток от несовместимых членов семьи или совместимых, но чужих доноров. В настоящее время в лечении это го заболевания, грозящего нарушением регуляции онкогена RAS, применяют ингибиторы фарнезилтрансферазы, химиотерапию, ретиноевую кислоту и ТКСК.
Комбинированная химиотерапия с трансплантацией периферических стволовых клеток или без нее при лечении пациентов с миелодиспластическим синдромом или острым миелолейкозом
Аутологичная трансплантация стволовых клеток периферической крови (PSCT) по сравнению со вторым интенсивным курсом консолидации после общего курса индукции и консолидации у пациентов с плохим прогнозом, миелодиспластическими синдромами (MDS) и острым миелогенным лейкозом, вторичным (SAML), или MDS, продолжительностью более 6 месяцев
ОБОСНОВАНИЕ: препараты, используемые в химиотерапии, используют разные способы предотвращения деления раковых клеток. поэтому они перестают расти или умирают. Сочетание химиотерапии с трансплантацией периферических стволовых клеток может позволить врачу назначить более высокие дозы химиотерапевтических препаратов и убить больше раковых клеток. ЦЕЛЬ: Рандомизированное исследование III фазы для сравнения эффективности периферических стволовых клеток. трансплантация высоких доз цитарабина при лечении пациентов с миелодиспластическим синдромом или острый миелолейкоз.
Тип вмешательства: Препарат, средство, медикамент
Тип вмешательства: Препарат, средство, медикамент
Тип вмешательства: Препарат, средство, медикамент
Тип вмешательства: Процедура
Тип вмешательства: Процедура
ХАРАКТЕРИСТИКИ ЗАБОЛЕВАНИЯ: - Патологическое подтверждение одного из следующих: - нелеченая рефрактерная анемия с избытком бластов (РАИБ) в трансформации - РАИБ с более чем 10% бластных клеток в костном мозге - Другие миелодиспластические синдромы - глубокие цитопении - Острый миелогенный лейкоз (ОМЛ), возникший после явной миелодиспластики синдромы (МДС) длительностью более 6 месяцев - Отсутствие бластного кризиса при хроническом миелолейкозе - Отсутствие лейкозов после других миелопролиферативных заболеваний - Отсутствие лейкозов после явного МДС продолжительностью менее 6 месяцев - Разрешено следующее: - Вторичные острые лейкозы, вызванные болезнью Ходжкина или другими злокачественными новообразованиями - Вторичные лейкозы после воздействия алкилирующих агентов или радиации ХАРАКТЕРИСТИКИ ПАЦИЕНТА: Возраст: - 16-60 Статус исполнения: - ВОЗ 0-2 Кроветворение: - При РАИБ бластирует более 10% клеток костного мозга - Количество нейтрофилов менее 5000 или количество тромбоцитов менее 200000 - Хронический миеломоноцитарный лейкоз (ХММЛ) с более чем 5% бластных клеток в кости костный мозг или CMML с числом нейтрофилов более 160000 или числом моноцитов больше чем 2600 Печеночная: - билирубин не более чем в 1,5 раза выше нормы Почечный: - Креатинин не более чем в 1,5 раза выше нормы Сердечно-сосудистые: - Нет пациентов с тяжелой сердечной недостаточностью, нуждающихся в диуретиках или фракции выброса менее 50% Неврологический: - Отсутствие тяжелых сопутствующих неврологических заболеваний ПРЕДВАРИТЕЛЬНАЯ КОНКУРСНАЯ ТЕРАПИЯ: Биологическая терапия: - Никаких процедур в течение последних 4 недель: - Модификаторы биологической реакции И / ИЛИ - Низкая доза Ara-C Химиотерапия: - Отсутствие предварительного интенсивного лечения МДС или ОМЛ Эндокринная терапия: - Не указан Лучевая терапия: - Отсутствие предварительного лечения МДС или ОМЛ Операция: - Не указан
Трансплантация стволовых клеток при миелопролиферативных заболеваниях - миелолейкозе
Редакционная коллегия
Алейникова О. В. (Минск, Беларусь)
Борсет М. (Трондхейм, Норвегия)
Галибин О. В. (Санкт-Петербург, Россия)
Зубаровская Л. С. (Санкт-Петербург, Россия)
Климко Н. Н. (Санкт-Петербург, Россия)
Кольб Х. (Мюнхен, Германия)
Крегер Н. (Гамбург, Германия)
Кулагин А. Д. (Санкт-Петербург, Россия)
Ланге К. (Гамбург, Германия)
Мамаев Н. Н. (Санкт-Петербург, Россия)
Михайлова Н. Б. (Санкт-Петербург, Россия)
Моисеев И. С. (Санкт-Петербург, Россия)
Наглер А. (Тель-Авив, Израиль)
Немков А. С. (Санкт-Петербург, Россия)
Парамонов И. В. (Киров, Россия)
Румянцев А. Г. (Москва, Россия)
Савченко В. Г. (Москва, Россия)
Смирнов А. В. (Санкт-Петербург, Россия)
Усс А. Л. (Минск, Беларусь)
Фиббе В. (Лейден, Нидерланды)
Хельтцер Д. (Франкфурт-на-Майне, Германия)
Чечеткин А. В. (Санкт-Петербург, Россия)
Этот номер журнала открывается обзорной статьей проф. Рюдигера Хельманна, посвященной современным стратегиям лечения хронического миелоидного лейкоза (ХМЛ) и роли трансплантации гемопоэтических стволовых клеток (ТГСК), которая значительно изменилась после внедрения ингибиторов трозинкиназы. Доводы автора во многом основаны на результатах большой программы CML Study IV, где изучали дозировки иматиниба, по сравнению с комбинированной терапией иматинибом и цитарабином или интерфероном α при лечении пациентов с первично диагностированным ХМЛ. Обсуждаются проблемы, связанные с прекращением терапии иматинибом.
Проф. Аксел Р. Цандер в своей статье по смежной тематике обсуждает показания к ТГСК при лечении больных клинически гетерогенной группы хронических миелопролиферативных заболеваний. Конкретные молекулярные дефекты выявленные за последние годы, теперь стали объектами специфической таргетной терапии, которая обеспечивает долгосрочные ремиссии у многих пациентов с хроническим миелоидным лейкозом, первичным миелофиброзом, хотя аллогенная ТГСК применяется в случаях развития злокачественного процесса и у больных групп высокого риска.
Ряд противоречий возникает во время отбора больных с острым миелобластным лейкозом для проведения алло-ТГСК. Эти аспекты критически рассматриваются в статье Роберта П. Гэйла. По его мнению, ранее применявшиеся и более современные статистические приемы не являются достаточно точными, чтобы прогнозировать вероятность рецидива и выявить пациентов высокого риска, даже если основываться на известных факторах риска у данных больных и индивидуальных биологических особенностях злокачественных клеток.
Д-р Марина О. Попова и соавт. описывают свой клинический опыт лечения ВИЧ-инфицированных больных,леченных методом аутологичной ТГСК, параметры выживаемости и частоту рецидивов через 12 мес. после трансплантации. Исследование типа «случай-контроль» с соответствующим образом подобранными группами пациентов проводилось в одном центра (EBMT CIC725) и планировалось для проспективной оценки безопасности и эффективности ауто-ТГСК для пациентов с ВИЧ-ассоциированными лимфомами.
Другую оригинальную работу представили д-р Иван С. Моисеев и соавт. Статья посвящена ныне изучаемому лечению циклофосфамидом (Цф) реакции «трансплантат против хозяина» (РТПХ). Сравнение данного подхода с профилактикой РТПХ, основанной на применении ингибиторов кальциневрина показывает определенноу преимущество терапии ЦФ в плане основных клинических исходов и результатов ТГСК.
Клинический случай общей вариабельной иммунной недостаточности (ОВИН) и основные подходы к ее диагностике описаны в докладе д-ра Андрея В. Козлова и соавт. Указаны результаты многих иммунологических и генетических тестов, в т.ч. секвенирование следующего поколения, приводится ряд общепризнанных клинических критериев диагностики ОВИН.
Вопросы, обсуждаемые в статье проф. Александра С. Немкова и его сотрудника Жанг И, касаются возможной роли эндотелиальной дисфункции в заболеваниях сердца и потенциально благоприятных долгосрочных эффектах внутрикоронарного введении\ононуклеарных клеток костного мозга.
Данный выпуск журнала содержит также краткую сводку регионального клинического протокола лечения болезни Ходжкина с применением новых таргетных препаратов и ПЭТ-контроля терапии (авторы: проф. Борис В. Афанасьев и соавт.). Этот протокол одобрен ведущими клиническими экспертами Санкт-Петербурга.
Для русскоязычных читателей, полный текст мульцентровой обсервационной программы для Северо-Запада России опубликован здесь же на русском языке.
Редакционная статья
Профессор Борис В. Афанасьев, главный редактор журнала «Клеточная Терапия и Трансплантация» (СТТ)
Профессор Аксель Р. Цандер, Со-редактор журнала СТТ (Германия)
Профессор Герард Вагемакер, Со-редактор журнала СТТ (Нидерланды)
Читайте также:
