Трансплантация стволовых клеток при остром лейкозе
Добавил пользователь Alex Обновлено: 27.01.2026
Именно на этом сайте в 2003 году впервые появилась информация о лечении стволовыми клетками крови, которая была разделена на три больших раздела:
Также важно понимать различия двух методик лечения:
- - пациент получает стволовые клетки от совместимого донора, это может быть сиблинг (брат или сестра), либо неродственный донор. - пациент получает свои собственные стволовые клетки.
Когда родители передают стволовые клетки в общедоступный банк, они тем самым помогают пациентам по всему миру, которые ищут неродственного донора для аллогенной трансплантации. Когда родители сохраняют пуповинную кровь в семейном банке, они дают ребенку воспользоваться стволовыми клетками для аутологичной трансплантации, либо же ближайш родственники (родители, братья, сестры) могут использовать эти стволовые клетки для аллогенной трансплантации.
В нижеприведенном списке содержатся сведения обо ВСЕХ методах лечения, где используются стволовые клетки, вне зависимости от того, откуда они были получены – из костного мозга, периферической крови или пуповинной крови.
Данная страница была разработана Фрэнсис Вертер, Алексеем Берсеневым и Педро Сильва Коуто ©2016-2022.
Стандартные методы лечения
Эти методы лечения применяются в случае болезней, при которых трансплантация кроветворных клеток (трансплантация гемопоэтических стволовых клеток – ТГСК) применяются как стандартные, общепризнанные.
При некоторых заболеваниях это – единственный метод лечения, а в других случаях они могут быть использованы, когда терапия первой линии не дала результата, или же течение болезни оказалось очень агрессивным. Большинство заболеваний, при которых ТГСК является терапией выбора – это патология клеток крови. Процесс пролиферации, то есть развития зрелых клеток крови из стволовых клеток представлен на рисунке сбоку (нажмите, чтобы увеличить), также вы можете почитать о видах клеток иммунной системы подробнее. В США, большинство страховых компаний оплачивают пересадку стволовых клеток в том случае, если это «стандартная терапия» при заболевании, которым страдает пациент.
Лейкоз это вид рака крови, задействованы при этом лейкоциты или белые кровяные тельца.
| Диагноз | Аллогенная | Аутологичная |
| Острый лимфобластный лейкоз (ОЛЛ) | X | |
| Острый миелобластный лейкоз (ОМЛ) | X | |
| Острый бифенотипичный лейкоз | X | |
| Острый недифференцированный лейкоз | X | |
| Хроничекий лимфолейкоз (ХЛЛ) | X | |
| Хронический миелолейкоз (ХМЛ) | X | |
| Ювенильный хронический миелоидный лейкоз (ЮХМЛ) | X | |
| Ювенильный миеломоноцитарный лейкоз (ЮММЛ) | X |
Миелодиспластический синдром также носит название предлейкемии (состояния, которое предшествует лейкозу)
| Диагноз | Аллогенная | Аутологичная |
| Рефрактерная анемия | X | |
| Рефрактерная анемия с кольцевидными сидеробластами (сидеробластная анемия) | X | |
| Рефрактерная анемия с избытком бластов | X | |
| Рефрактерная анемия с избытком бластов в стадии трансформации | X | |
| Хронический миеломоноцитарный лейкоз (ХММЛ) | X |
Лимфома это вид злокачественной опухоли из лейкоцитов, которые циркулируют в крови и в лимфатических сосудах.
| Диагноз | Аллогенная | Аутологичная |
| Лимфома Ходжкина (лимфогранулематоз) | X | X |
| Неходжкинская лимфома (лимфома Беркитта) | X |
Другие нарушения пролиферации клеток крови
| Диагноз | Аллогенная | Аутологичная |
| Анемия это дефицит эритроцитов (красных кровяных телец) или нарушение их функции | ||
| Апластическая анемия | X | |
| Анемия Фанкони ((Первая трансплантация стволовых клеток из пуповинной крови была выполнена в 1988 году пациенту с анемией Фанкони, это – наследственное заболевание)) | X | См. исследования генной терапии |
| Врожденная дизэритропоэтическая анемия | X | |
| Пароксизмальная ночная гемоглобинурия (ПНГ) | X | |
| Наследственная патология эритроцитов Эритроциты содержат гемоглобин, их функция – перенос кислорода в организме. | ||
| Серповидноклеточная анемия | X | |
| Большая бета-талассемия (также известна под названием анемия Кули) | X | |
| Анемия Даймонда-Блекфена | X | |
| Парциальная красноклеточная аплазия | X | |
| Наследственные болезни тромбоцитов Тромбоциты это клетки, которые необходимы для свертывания крови. | ||
| Амегакариоцитоз / врожденная тромбоцитопения | X | |
| Тромбастения Гланцмана | X | |
| IНаследственные болезни иммунной системы: тяжелый комбинированный иммунодефицит (ТКИД) | ||
| ТКИД с дефицитом аденозиндеаминазы(АДА-ТКИД) | X | |
| ТКИД, сцепленный с Х-хромосомой | X | |
| ТКИД, при котором отсутствуют Т- и В-лимфоциты | X | |
| ТКИД, при котором отсутствуют Т- лимфоциты, В-лимфоциты нормальные | X | |
| Синдром Оменна | X | |
| Наследственные болезни иммунной системы: нейтропении | ||
| Инфантильный генетический агранулоцитоз (синдром Костманна) | X | |
| Миелокатексис | X | |
| Наследственные болезни иммунной системы: другие | ||
| Атаксия-телеангиоэктазия | X | |
| Синдром обнаженных лимфоцитов | X | |
| Общий вариабельный иммунодефицит (ОВИД) | X | |
| Синдром ДиДжорджи | X | |
| Гемофагоцитарный лимфогистиоцитоз | X | |
| Дефицит адгезии лимфоцитов | X | |
| Лимфопролиферативные заболевания | X | |
| Лимфопролиферативные заболевания, сцепленные с Х-хромосомой (Чувствительность к вирусу Эпштейн-Барр) | X | |
| Синдром Вискотта-Олдрича | X | |
| Миелопролиферативные заболевания | ||
| Острый миелофиброз | X | |
| Сублейкемический миелоз (миелофиброз) | X | |
| Истинная полицитемия | X | |
| Эссенциальная тромбоцитопения | X | |
| Патология фагоцитов клеток иммунной системы, которые поглощают и уничтожают чужеродные организмы. | ||
| Синдром Чедиак-Хигаси | X | |
| Хронические гранулематозные заболевания | X | |
| Дефицит актина в нейтрофилах | X | |
| Ретикулярный дисгенез | X | |
| Злокачественные опухоли костного мозга | ||
| Множественная миелома | X | X |
| Плазмоклеточный лейкоз | X | X |
| Макроглобулинемия Вальденстрема | X | X |
Трансплантация при наследственных заболеваниях иммунной системы и других органов
| Диагноз | Аллогенная | Аутологичная |
| Гипоплазия хряща - волос | X | |
| Эритропоэтическая порфирия (болезнь Гюнтера) | X | |
| Синдром Германски- Пудлака | X | |
| Синдром Пирсона | X | |
| Синдром Швахмана – Даймонда | X | |
| Системный мастоцитоз | X |
Трансплантация при наследственных метаболических заболеваниях
| Диагноз | Аллогенная | Аутологичная |
| Мукополисахаридозы (МПС) – болезни накопления | ||
| Синдром Гурлера (МПС-IH) | X | |
| Синдром Шейе (МПС-IS) | X | |
| Синдром Хантера (МПС-II) | X | |
| Синдром Санфилиппо (МПС-III) | X | |
| Синдром Моркио (МПС-IV) | X | |
| Синдром Марота-Лами (МПС-VI) | X | |
| Синдром Слая (Дефицит бета-глюкуронидазы) | X | |
| Муколипидоз II (I-клеточная болезнь) | X | |
| Лейкодистрофии | ||
| Адренолейкодистрофия (АЛД) | X | |
| Болезнь Краббе (глобоид-клеточная лейкодистрофия) | X | |
| Метахроматическая лейкодистрофия | X | |
| Болезнь Пелицеуса-Мерцбахера | X | |
| Лизосомальные болезни накопления | ||
| Болезнь Ниманна-Пика | X | |
| Болезнь Сандхоффа | X | |
| Болезнь Волмана | X | |
| Другие наследственные метаболические болезни | ||
| Синдром Лёш-Нихена | X | |
| Остеопетроз | X |
Солидные опухоли, которые происходят не из органов кроветворения и иммунной системы.
| Диагноз | Аллогенная | Аутологичная |
| нейробластома | X | |
| Медуллобластома | X | |
| ретинобластома | X |
Методы лечения в рамках клинических исследований
«Клиническое исследование» - это исследование, которое проводятся на людях для оценки тех методов лечения, которые не считаются стандартными. Исследования, проходящие в США, представлены на сайте ClinicalTrials.gov, на котором существует база данных с поисковой системой, также на сайте есть информация о множестве международных исследований.
Клиническое исследование на человеке в США всегда представлено фазами:
- Фаза 1: Это исследование безопасности лекарственного препарата, чтобы убедиться, что его применения хорошо переносится.
- Фаза 2: Более крупное исследование для сравнительной оценки эффективности нового метода лечения со стандартным методом лечения.
- Фаза 3: Еще более крупное исследование для изучения влияния различных параметров (например дозы и способа применения препарата) и отслеживания побочных эффектов до вывода препарата на рынок.
- Фаза 4: Постмаркетинговое исследование – для получения дополнительной информации о рисках, преимуществах и оптимальном режиме применения препарата.
Неврологические расстройства
(обратите внимание – ссылки на английском языке – оригинальные исследования)
| Диагноз | Аллогенная | Аутологичная |
| Аутизм | Фаза 2 Фаза 1 | |
| Церебральный паралич | Фаза 2 | Фаза 2 Фаза 2 Фаза 1 Фаза 2 |
| Потеря слуха (приобретенная сенсоневральная тугоухость) | Фаза 2 | |
| Гипоксически-ишемическая энцефалопатия ( (HIE) | Фаза 1 | |
| Повреждения спинного мозга | Наблюдение Фаза 2 |
Аутоиммунные болезни
| Диагноз | Аллогенная | Аутологичная |
| Боковой амиотрофический склероз (ALS) | Наблюдение Фаза 1 | Фаза 1 |
| Болезнть Крона | Фаза 2 плацента Фаза 3 Prochymal Фаза 2 Athersys | Фаза 3 ASTIC |
| Сахарный диабет 1 типа | Фаза 2 | Фаза 1 |
| Реакция трансплантат против хозяина (GvHD) | Фаза 3 Prochymal у детей Фаза 3 Prochymal у взрослых | |
| Одновременная трансплантация почек и стволовых клеток | Фаза 2 | |
| Волчанка | Фаза 1 | review of trials Фаза 2 |
| Рассеянный склероз | Обзор исследований Фаза 1, news | |
| Ревматоидный артрит | Фаза 2 placenta | |
| Системная склеродермия | Фаза 1 | Наблюдение Фаза 2 SCOT Фаза 2 CD34+ |
Болезни сердечно-сосудистой системы
| Диагноз | Аллогенная | Аутологичная |
| Врожденные пороки развития | ||
| Поддержка при различных операциях на открытом сердце | Фаза 1 | |
| Синдром гипоплазии левых отделов сердца (HLHS) | Фаза 1 | |
| Растущие протезы сосудов | Фаза 1, story | |
| Ишемия | ||
| Критическая ишемия конечностей | Фаза 2 | Фаза 2 Фаза 2 Фаза 3 BMAC |
| Компартмент-синдром (боевая травма) | Фаза 1 | |
| Ишемический инсульт | Фаза 2 placenta | Фаза 3 |
| Ишемическая болезнь сердца | Meta-Analysis | |
| Восстановление миокарда | ||
| Острый инфаркт миокарда | Наблюдение Фаза 3 BAMI | |
| Кардиомиопатия | Наблюдение | Фаза 1 Texas Heart Inst. Фаза 3 |
Генная терапия наследственных заболеваний
Обратите внимание, что в этом списке представлены только те методы генной терапии, в которых используются гемопоэтические стволовые клетки. Имеется множество других клинических исследований в области генной терапии, некоторые из них посвящены тем же самым заболеваниям, путь введения при этом может быть другой (внутримышечные инъекции, внутримозговые инъекции и другое)
| Диагноз | Аллогенная | Аутологичная |
| Адренолейкодистрофия | Фаза 2 bluebird bio | |
| Хронические гранулематозы (сцепленные с Х-хромосомой) | Фаза 1 | |
| Анемия Фанкони | Фаза 1, news | |
| ВИЧ | Фаза 1 Calimmune Фаза 1 Hutch | |
| Метахроматическая лейкодистрофия | Фаза 1 Milan | |
| Тяжелый комбинированный иммунидефицит | Фаза 1 X-linked SCID Boston Фаза 1 X-linked SCID St. Jude Фаза 1 X-linked SCID Paris Фаза 1 ADA-SCID UCLA Фаза 1 ADA-SCID Duke | |
| Серповидно-клеточная анемия | planned trial | |
| Талассемия | Наблюдение Фаза 1 St. Jude Фаза 1 MSK Фаза 1 bluebird bio | |
| Синдром Вискотта-Олдрича | Фаза 1 Фаза 1 Milan |
Ортопедия
| Диагноз | Аллогенная | Аутологичная |
| Операции при альвеолярных расщелинах неба | Gintuit FDA-одобрение (НЕ гемопоэтические стволовые клетки) | publication Фаза 1 |
| Протезирование хрящей коленного | Cartistem KFDA-одобрение | Фаза 2 IMPACT |
Разное
| Диагноз | Аллогенная | Аутологичная |
| Бронхолегочная дисплазия (BPD) | Фаза 2 Pneumostem | |
| Буллезный эпидермолиз | публикация, наблюдение | |
| ВИЧ, также известен под названием СПИД | Фаза 1 Hutch Berlin patient PubMed & NPR | |
| Лизосомальные болезни накопления | Внутриутробное переливание крови через пуповину |
Экспериментальные методы лечения
These are diagnoses for which stem cell treatments are being studied either in the laboratory with cell cultures or in animals that mimic the human disease. The experimental therapies are not yet in human clinical trials. In experimental research, it is often not clear whether an eventual therapy, if developed, would be Autologous or Allogeneic.
Due to the explosion of stem cell research and the difficulty keeping track of which studies are promising, this section does not have a list.
Трансплантация стволовых клеток при остром лейкозе
алло-ТГСК — аллогенная трансплантация гемопоэтических стволовых клеток
БВ — безрецидивная выживаемость
Д+ — день после трансплантации
КМ — костный мозг
МAК — миелоаблативные режимы кондиционирования
ОВ — общая выживаемость
ОМЛ — острый миелобластный лейкоз
ПСКК — периферические стволовые клетки крови
РИК — режим кондиционирования со сниженной интенсивностью
РТПЛ — реакция трансплантат против лейкоза
РТПХ — реакции трансплантат против хозяина
TRM (transplant-related mortality) — летальный исход, связанный с трансплантацией
Не вызывает сомнения, что аллогенная трансплантация гемопоэтических стволовых клеток (алло-ТГСК) — один из наиболее эффективных методов лечения пациентов со злокачественными заболеваниями системы крови. Терапевтический эффект алло-ТГСК связан с двумя принципиально различными механизмами воздействия на лейкозные клоногенные клетки: использованием цитостатических препаратов и иммунологической реакцией трансплантат против лейкоза (РТПЛ).
Острый миелобластный лейкоз (ОМЛ) — одно из наиболее частых показаний к алло-ТГСК (родственной, неродственной, гаплоидентичной) [1]. Двухлетняя общая выживаемость (ОВ) пациентов составляет 18—30 и 52% соответственно при сравнении результатов терапии без алло-ТГСК и c проведенной алло-ТГСК [2—4]. До последнего времени факторами, ограничивающими проведение алло-ТГСК, были возраст пациента, стадия заболевания, высокий индекс коморбидности, обусловленный сопутствующими заболеваниями [5]. Внедрение режимов кондиционирования со сниженной токсичностью и новых препаратов для поддерживающей терапии существенно расширило границы применения метода, сняв ограничения по возрасту и стадии заболевания для проведения алло-ТГСК. Дополнительным фактором, определяющим сроки проведения алло-ТГСК, является наличие/отсутствие HLA-совместимого донора. Хорошо известно, что совместимый родственный донор доступен не более чем 30% пациентов, возможность нахождения неродственного донора для остальных колеблется от 40 до 80% и напрямую зависит от этнической принадлежности реципиента. Тем не менее рост числа алло-ТГСК при ОМЛ за последние годы в основном происходит за счет алло-ТГСК от неродственного донора у пациентов в первой ремиссии [6].
Интенсивность применения алло-ТГСК на более ранних стадиях заболевания по-прежнему ограничивает летальность, связанную с трансплантацией, которая более высокая в группе пациентов, получивших алло-ТГСК от неродственного донора [7—9]. Это обстоятельство сохраняет тенденцию к взвешенному подходу и попытке сохранения баланса при принятии решения в пользу алло-ТГСК между летальностью после алло-ТГСК и риском рецидива ОМЛ.
Решающим показанием к алло-ТГСК в первой ремиссии ОМЛ в настоящее время служит наличие факторов, прогнозирующих рецидив ОМЛ. Особая роль при определении показаний к алло-ТГСК принадлежит цитогенетическим [10] и молекулярно-биологическим [11] факторам прогноза. На основании структурных и количественных хромосомных аберраций пациенты с ОМЛ делятся на 3 группы риска. Доля больных благоприятной группы риска составляет 10—20% (кариотип — t(8;21)(q22;q22); inv(16)(p13.1q22) или t(16;16)(p13.1;q22); мутации в генах NPM1, CEBPA). По данным рандомизированных исследований, алло-ТГСК в этой группе больных в первой ремиссии не имеет преимуществ по сравнению с химиотерапией (ХТ) [12—14]. Пятилетняя ОВ и безрецидивная выживаемость (БВ) равна 55 и 46% соответственно [15]. Доля пациентов высокой группы риска составляет 30—40% (кариотип — inv(3)(q21q26.2) или t(3;3)(q21;q26.2); t(6;9)(p23;q34); t(v;11)(v;q23); –5 или del(5q); –7; abnl(17p); комплексные аномалии кариотипа). Алло-ТГСК этой группе пациентов показана в первой ремиссии как общепринятый стандарт. 3-летняя ОВ пациентов с ОМЛ в первой ремиссии и неблагоприятными хромосомными аномалиями после родственной и неродственной алло-ТГСК составляет 45 и 37%, а трехлетняя БВ — 42 и 34% соответственно [16], что существенно выше данных ХТ — 3,6—5 и 8% соответственно [15, 17]. Почти 40—50% пациентов находятся в группе промежуточного прогноза. У них имеется нормальный кариотип и отсутствуют молекулярно-биологические маркеры. Для этой группы пациентов вопрос необходимости алло-ТГСК в первой ремиссии остается открытым.
Цель исследования: оценить эффективность алло-ТГСК у пациентов с ОМЛ в первой ремиссии заболевания в зависимости от режимов кондиционирования, источника трансплантата, особенностей реципиента и донора.
Материалы и методы
В исследование включили 66 пациентов в возрасте от 8 до 60 лет с диагнозом ОМЛ, которым проведена алло-ТГСК в первой ремиссии в период с 2003 по 2012 г.; медиана наблюдения 12 мес (3—101 мес).
В соответствии с цитогенетическими группами риска больные распределились следующим образом: низкий риск (t(8;21)(q22;q22); inv(16)(p13.1q22) или t(16;16)(p13.1;q22)) — у 7 (11%), промежуточный риск (нормальный кариотип, хромосомные аномалии, не относящиеся к низкому и высокому риску) — у 31 (47%) и высокий риск (inv(3)(q21q26.2) или t(3;3)(q21;q26.2); t(6;9)(p23;q34); t(v;11)(v;q23); –5 или del(5q); –7; abnl(17p); комплексные аномалии кариотипа) — у 10 (15%). Цитогенетическое исследование не проводилось у 18 (27%) пациентов.
Показанием к алло-ТГСК у больных ОМЛ в первой ремиссии с низким риском по цитогенетической классификации явилось наличие признаков минимальной остаточной болезни после окончания курсов консолидации или первичная резистентность, характеризующаяся отсутствием ремиссии острого лейкоза после двух курсов индукционной терапии.
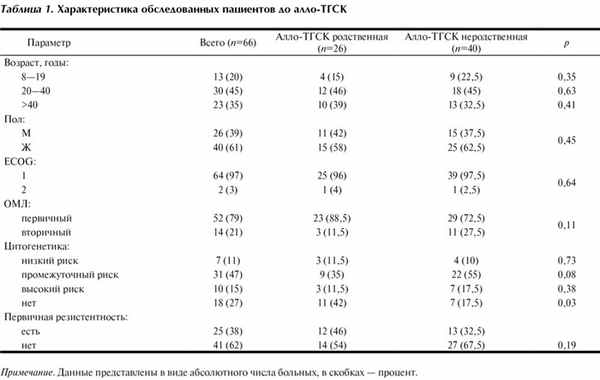
Характеристика пациентов до алло-ГСК представлена в табл. 1.
Алло-ТГСК от родственного донора проведена 26 пациентам, алло-ТГСК от неродственного донора — 40, из них 4 от частично HLA-несовместимых в локусах генов А, С и DQB1 доноров. Миелоаблативные режимы кондиционирования (MAК) включали бусульфан в дозе 16 мг/кг и циклофосфан в дозе 120 мг/кг, режимы кондиционирования со сниженной интенсивностью (РИК) — сочетание флюдарабина — 150 мг/м 2 с бусульфаном 8 мг/кг или мелфаланом 140 мг/м 2 .
Для профилактики острой реакции трансплантат против хозяина (РТПХ) использовали циклоспорин А или такролимус в комбинации с метотрексатом (15 мг/м 2 в 1-й день после трансплантации — Д+1 и 10 мг/м 2 в 3-й и 6-й дни после трансплантации — Д+3 и Д+6) или мофетила микофенолатом (30 мг/кг 2 раза в сутки). При алло-ТГСК от неродственного донора с целью профилактики острой РТПХ в режим кондиционирования добавляли антилимфоцитарный глобулин в дозе 60 мг/кг.
Режимы кондиционирования со сниженной токсичностью назначали пациентам с высокой степенью «предлеченности», осложнениями тяжелой степени при проведении ХТ, в возрасте старше 40 лет, с высоким индексом коморбидности.
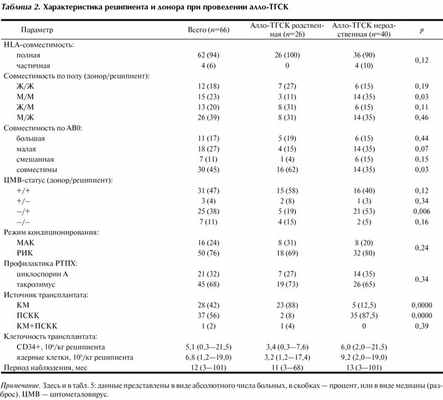
Источником трансплантата при родственной алло-ТГСК наиболее часто был костный мозг (КМ) — у 28 (42%) пациентов, а в случае неродственной алло-ТГСК — периферические стволовые клетки крови (ПСКК) — у 37 (56%). Подробные характеристики реципиента, донора и трансплантата представлены в табл. 2.
Статистический анализ данных выполняли в программе SPSS Statistics v.17 и Statistica 8. ОВ рассчитана по методу Каплана—Майера. Летальность, связанная с трансплантацией, и вероятность рецидива определяли с помощью программы R Statistic. Сравнение ОВ выполняли при помощи логрангового теста, сравнительный анализ долей — с использованием точного критерия Фишера. Так называемыми конечными точками, т.е. оцениваемыми исходами, были алло-ТГСК, смерть, связанная с трансплантацией, рецидив, острая и хроническая РТПХ. Данные о пациентах, которые оставались в состоянии ремиссии на момент анализа, представлены на 01.09.12.
Результаты
Первичное неприживление трансплантата отмечено у 1 (4%) пациента после родственной и у 1 (2,5%) пациента после неродственной алло-ТГСК. Пациент после родственной алло-ТГСК умер на Д+28 от тяжелого геморрагического синдрома, после неродственной алло-ТГСК — на Д+39 в результате сепсиса и полиорганной недостаточности, несмотря на реинфузию аутологичных клеток КМ, выполненную на Д+30.
Общая выживаемость пациентов после различных видов алло-ТГСК. 9-летняя ОВ пациентов с ОМЛ после алло-ТГСК в первой ремиссии вне зависимости от типа донора и источника трансплантата составила 65%, БВ — 50% (табл. 4). Не выявлена зависимость ОВ от источника трансплантата и степени совместимости по HLA-системе пары реципиент—донор. Результаты 5-летней ОВ при алло-ТГСК от родственного, полностью или частично HLA-несовместимого неродственного донора сопоставимы: 56, 68 и 71% (р=0,8) (см. рисунок, а). Рисунок 1. ОВ пациентов с ОМЛ в первой ремиссии после алло-ТГСК в зависимости от типа донора и HLA-совместимости (а; n=66).
ОВ пациентов также не зависела от возраста на момент проведения алло-ТГСК: от 8 до 19 лет — 67%, от 20 до 40 лет — 63%, старше 40 лет — 60% (р=0,45). Пятилетняя ОВ пациентов с вторичными ОМЛ не отличалась от таковой у больных первичным ОМЛ — 80 и 60% соответственно (р=0,36). ОВ при использовании МАК была выше, чем при РИК, — 78 и 58% соответственно, однако различие не достигало статистической значимости (р=0,4).
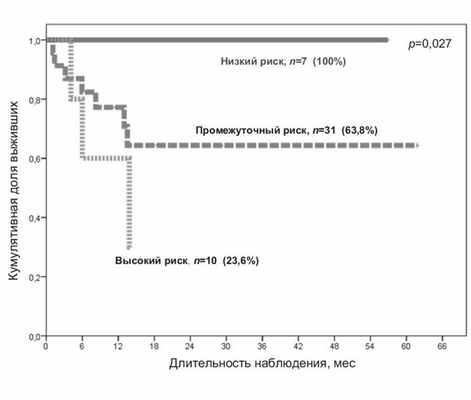
В нашем исследовании показано, что ОВ зависит от цитогенетической группы риска: в группе высокого риска ОВ составила 24%, в группе промежуточного риска — 64%, в группе низкого риска — 100% (р=0,027) (см. рисунок, б). Рисунок 1. ОВ пациентов с ОМЛ в первой ремиссии после алло-ТГСК в зависимости от цитогенетических групп риска (б; n=48).
Не выявлено влияния на ОВ первичной химиорезистентности, ЦМВ-статуса донора и реципиента, их несовместимости по полу и группе крови по системе АВ0, а также использования КМ по сравнению с ПСКК. Профилактика острой РТПХ на основе режимов, содержащих циклоспорин А, несколько увеличивала ОВ пациентов — 71%, при применении такролимуса — 53%, однако это различие не было статистически значимым (р=0,55) (см. табл. 4).
Из неинфекционных осложнений, связанных с алло-ТГСК, только острая РТПХ IV степени оказывала существенное влияние на выживаемость пациентов — 0. При вариантах I—II и III степени острой РТПХ 5-летняя ОВ была равна 80%.
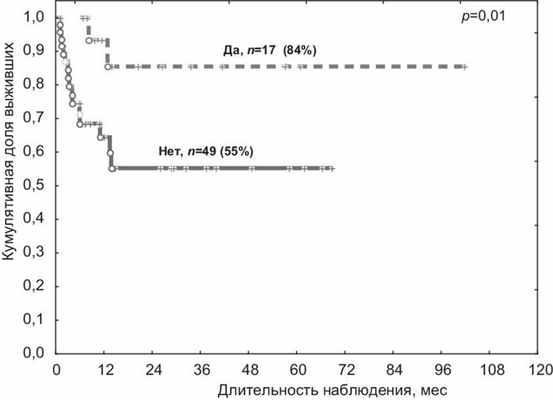
При долгосрочном наблюдении пациентов с ОМЛ в первой ремиссии с хронической РТПХ выявлено достоверное увеличение 5-летней ОВ по сравнению с пациентами без хронической РТПХ — 84 и 55% соответственно (р=0,01) (см. рисунок, в), Рисунок 1. ОВ пациентов с ОМЛ в первой ремиссии после алло-ТГСК в зависимости от развития хронической РТПХ (в; n=66). что было ассоциировано со снижением риска рецидива в общей группе пациентов (р=0,01) (см. табл. 4).
Осложнения после алло-ТГСК. Вероятность рецидива и летальность, связанная с трансплантацией, не зависели от возраста и пола пациента, вида ОМЛ (первичный или вторичный), наличия первичной химиорезистентности, ЦМВ-статуса донора и реципиента, их несовместимости по полу и группе крови по системе АВ0, источника трансплантата (КМ, ПСКК), режима кондиционирования и профилактики острой РТПХ.
Вероятность рецидива была выше после родственной алло-ТГСК по сравнению с алло-ТГСК от неродственного донора — 35 и 13% (р=0,08), тогда как летальность, связанная с трансплантацией, не отличалась — 22 и 23% (р=0,7) и была меньше при использовании ПСКК по сравнению с КМ — 13 и 34% (р=0,09) соответственно.
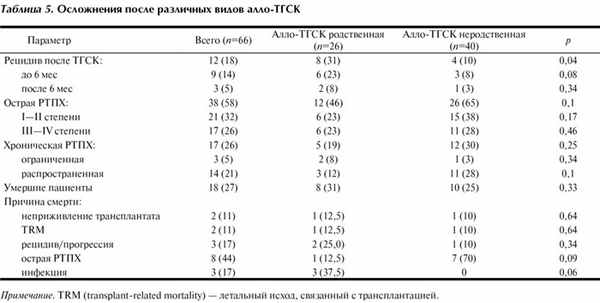
Рецидив развился у 12 (18%) пациентов, из них у 9 (75%) в период до 6 мес после алло-ТГСК (р=0,08) (табл. 5). Число рецидивов после родственной алло-ТГСК оказалось достоверно больше, чем после неродственной, — 8 (31%) и 4 (10%) соответственно (р=0,04). При констатации рецидива пациентам отменяли иммуносупрессивную терапию, проводили курс высокодозной ХТ по схеме FLAG или HDARA-C с последующей инфузией донорских лимфоцитов, иногда стимуляцией иммуноадоптивного эффекта интерлейкином-2 или α-интерфероном.
В нашем исследовании вероятность рецидива в зависимости от цитогенетических групп была следующей: в группе низкого риска — 43%, промежуточного — 26%, высокого риска — 15%, различия статистически незначимы (р=0,37).
Развитие острой РТПХ отмечалось у 38 (58%) пациентов, в том числе клинически значимой III—IV степени тяжести у 17 (45%). Статистически значимых различий по частоте развития острой РТПХ между родственной и неродственной алло-ТГСК не выявлено (р=0,1).
Хроническую РТПХ после алло-ТГСК оценивали у пациентов, проживших более 100 дней. Распространенная форма хронической РТПХ чаще отмечалась после неродственной алло-ТГСК, чем после родственной, — в 11 (92%) и 3 (60%) случаев соответственно (р=0,1). Частота развития ограниченной РТПХ, наоборот, выше после родственной алло-ТГСК — 2 (8%) и 1 (3%) случай. Однако различия статистически незначимы (р=0,34).
Летальность при родственной и неродственной алло-ТГСК не различалась — 8 (31%) и 10 (25%) соответственно (р=0,33). При алло-ТГСК от родственного донора у большинства пациентов причиной смерти служили инфекционный процесс (р=0,06) и рецидив заболевания (р=0,34), а при неродственной — острая РТПХ (р=0,09).
По результатам нашего исследования не получено существенных различий по ОВ и летальности, связанной с трансплантацией, при родственной и неродственной алло-ТГСК, в том числе от частично HLA-совместимого донора. По результатам ранее проведенных исследований из Сиэтла у 85 пациентов с неродственным донором и 135 пациентов с родственным донором, отнесенных в группу промежуточного риска (58 и 83 пациентов соответственно, остальные — с нормальным кариотипом), ОВ составила 37, 33 и 22% соответственно, что не отличается от результатов, представленных нами [18].
Полученное различие по 5-летней ОВ пациентов в зависимости от цитогенетической группы риска (100% при низком риске, 64% при промежуточном и 24% при высоком риске; р=0,027) подтверждает важность выполнения этого исследования в дебюте заболевания. По результатам исследований HOVON/SAKK и EORTC/GIMEMAAML-10, алло-ТГСК при ОМЛ в первой ремиссии также обеспечивает длительную ремиссию и общую выживаемость 40 и 58% соответственно, даже у пациентов с высоким цитогенетическим риском [19, 20], тогда как у пациентов данной категории, получавших ХТ, 4-летняя вероятность рецидива составляла 73% [18].
Более низкая вероятность рецидива при алло-ТГСК от неродственного донора (13%), в большей степени от частично HLA-несовместимого донора (0) по сравнению с алло-ТГСК от родственного донора (35%) (р=0,08), а также при наличии хронической РТПХ (р=0,01) и острой РТПХ III степени по сравнению с острой РТПХ I—II степени (р=0,06) свидетельствует о возможном влиянии эффекта РТПЛ.
У пациентов, получивших MAК по сравнению с РИК, достигнуты несколько более высокая 5-летняя ОВ (78% против 58%; р=0,4) и меньшая 5-летняя вероятность рецидива (14% против 26%; р=0,4) в отсутствие различия по летальности, ассоциированной с трансплантацией (25 и 21%; р=0,9), однако эти различия статистически незначимы. Показания к проведению РИК или MAК при ОМЛ в первой ремиссии не имеют объективных критериев и основаны на оценке перед алло-ТГСК индекса коморбидности [21], определения риска летального исхода в баллах [22], что в сочетании с возрастом помогает объективизировать критерии для выбора оптимального режима кондиционирования. Например, пациенты с высоким риском рецидива должны рассматриваться как кандидаты на применение МАК, а пациенты более старшего возраста и/или при наличии сопутствующих заболеваний — на применение РИК. Важно отметить, что большинство исследований сообщали о схожих результатах по БВ и ОВ у пациентов с MAК и РИК, другие — о снижении летальности, связанной с трансплантацией, при РИК по сравнению с МАК [23, 24] или об отсутствии различий этого показателя [25, 26].
Заключение
Таким образом, эффективность алло-ТГСК у пациентов с ОМЛ в первой ремиссии напрямую зависит от факторов прогноза, в нашем исследовании — цитогенетических. Другие факторы, такие как возраст, тип донора, режим кондиционирования, несовместимость по группе крови, полу, HLA-системе, профилактике острой РТПХ, не имеют принципиального значения и относятся к параметрам выбора индивидуализированного подхода при выполнении алло-ТГСК. У пациентов с ОМЛ и неблагоприятными прогностическими факторами выполнение алло-ТГСК показано в первой ремиссии при наличии HLA-совместимого родственного или неродственного донора. Показания к алло-ТГСК для группы пациентов с благоприятными цитогенетическими признаками, гетерогенны, поскольку эти пациенты нуждаются в уточнении факторов прогноза на основании более детального обследования с помощью молекулярно-биологических методов в момент установления диагноза.
Аллогенная трансплантация гемопоэтических стволовых клеток при острых лейкозах у детей, подростков и молодых взрослых в Республике Беларусь
Аллогенная трансплантация гемопоэтических стволовых клеток (ТГСК) является общепризнанным методом лечения детей очень высокой группы риска острого лимфобластного лейкоза (ОЛЛ) и высокой группы риска острого миелобластного лейкоза (ОМЛ). Применение аллогенной ТГСК для определенных групп риска острых лейкозов значительно улучшает выживаемость этих пациентов по сравнению с химиотерапевтическими режимами. Цель данного исследования: сравнить результаты ТГСК у детей, подростков и молодых взрослых за 2 последовательных равных временных периода для выявления проблемных вопросов процедуры трансплантации и последующей их коррекции. Данное исследование одобрено независимым этическим комитетом и утверждено решением ученого совета ГУ «Республиканский научно-практический центр детской онкологии, гематологии и иммунологии» (Республика Беларусь). В исследование были включены 166 пациентов: 101 с ОЛЛ и 65 с ОМЛ, которым была проведена первая ТГСК в соответствии с протоколом лечения в 1-й линии или рецидиве за 2 последовательных временных периода: с 1998 по 2008 г. и с 2009 по 2018 г. Для всей группы пациентов выявлено увеличение общей (на 13%) и бессобытийной (на 7%) выживаемости за счет снижения посттрансплантационной летальности, не связанной с рецидивом, на 16% (р = 0,077). Значимое улучшение выживаемости с течением времени произошло в группе пациентов, имеющих острую или хроническую реакцию «трансплантат против хозяина». Полученные данные свидетельствуют, что все пациенты с острыми лейкозами, имеющие показания к ТГСК в 1-й линии лечения или рецидиве, должны быть трансплантированы от любого доступного донора, поскольку это существенно повысит их шансы на выздоровление.
Ключевые слова
Об авторах
член-корр. НАН РБ, д-р мед. наук, профессор, главный научный сотрудник,
Республика Беларусь, 223053, Минский район, д. Боровляны, ул. Фрунзенская, 43
Список литературы
1. Karachunskiy A., Tallen G., Roumiant- seva J., Lagoiko S., Chervova A., von Stackelberg A., et al.; ALL-MB study group. Reduced vs. standard dose native E. coli-asparaginase therapy in childhood acute lymphoblastic leukemia: long-term results of the randomized trial Moscow– Berlin 2002. J Cancer Res Clin Oncol 2019; 145 (4): 1001–12. DOI: 10.1007/s00432-019-02854-x
2. Шелихова Л.Н., Илюшина M.А., Семиглазова К.В., Шеховцова Ж.Б., Шашелева Д.А., Хисматуллина Р.Д. и др. Аллогенная трансплантация гемопоэтических стволовых клеток от гаплоидентичного донора с TCR-ab-деплецией у детей с химиорезистентным острым миелобластным лейкозом. Вопросы гематологии/онкологии и иммунопатологии в педиатрии 2019; 18 (2): 11‒21.
3. Румянцев А.Г. Эволюция лечения острого лимфобластного лейкоза у детей: эмпирические, биологические и организационные аспекты. Вопросы гематологии/онкологии и иммунопатологии в педиатрии 2015; 14 (1): 5–15.
4. Pui C.H., Mullighan C.G., Evans W.E., Relling M.V. Pediatric acute lymphoblastic leukemia: where are we going and how do we get there? Blood 2012; 120 (6):1165–74.
5. Dalle J.H., Balduzzi A., Bader P., Lankester A., Yaniv I., Wachowiak J., et al. Allogeneic stem cell transplantation from HLA-mismatched donors for pediatric patients with acute lymphoblastic leukemia treated according to the 2003 BFM and 2007 international BFM studies: impact of disease risk on outcomes. Biol Blood Marrow Transplant 2018; 24 (9):1848–55.
6. Oliansky D.M., Rizzo J.D., Aplan P.D., Arceci R.J., Leone L., Ravindranath Y., et al. The role of cytotoxic therapy with hematopoietic stem cell transplantation in the therapy of acute myeloid leukemia in children: an evidence-based review. Biol Blood Marrow Transplant 2007; 13 (1): 1–25.
7. Balduzzi A., Valsecchi M.G., Uderzo C., De Lorenzo P., Klingebiel T., Peters C., et al. Chemotherapy versus allogeneic transplantation for very high-risk childhood acute lymphoblastic leukaemia in first complete remission: comparison by genetic randomisation in an international prospective study. Lancet 2005; 366 (9486): 635–42.
8. Brissot E., Rialland F., Cahu X., Strullu M., Corradini N., Thomas C., et al. Improvement of overall survival after allogeneic hematopoietic stem cell transplantation for children and adolescents: a three-decade experience of a single institution. Bone Marrow Transplant 2016; 51:267–72.
10. Zhang M.J., Davies S.M., Camitta B.M., Logan B., Tiedemann K., Eapen M., et al. Comparison of outcomes after HLAmatched sibling and unrelated donor transplantation for children with highrisk acute lymphoblastic leukemia. Biol Blood Marrow Transplant 2012; 18:1204–10.
11. Peters C., Cornish J.M., Parikh S.H., Kurtzberg J. Stem Cell Source and Outcome after Hematopoietic Stem Cell Transplantation (HSCT) in Children and Adolescents with Acute Leukemia. Pediatr Clin North Am 2010; 57 (1): 27–46.
12. Wawrzyniak-Dzierżek E., Gajek K., Ślęzak A., Rybka B., Ryczan-Krawczyk R., Gorczyńska E., et al. Pediatric unmanipulated haploidentical hematopoietic stem cell transplantation with post-transplant cyclophosphamide and reduced intensity, TBI-free conditioning regimens in salvage transplantations. Adv Clin Exp Med. 2019; 28 (9): 1223–8.
13. Munchel A.T., Kasamon Y.L., Fuchs E.J. Treatment of hematological malignancies with nonmyeloablative, HLA-haploidentical bone marrow transplantation and high dose, post-transplantation cyclophosphamide. Best Pract Res Clin Haematol 2011; 24 (3): 359–68.
14. Leung W., Campana D., Yang J., Pei D., Coustan-Smith E., Gan K., et al. High success rate of hematopoietic cell transplantation regardless of donor source in children with very high-risk leukemia. Blood 2011; 118 (2): 223–30.
15. Boztug H., Sykora K.-W., Slatter M., Zecca M., Veys P., Lankester A., et al. European Society for Blood and Marrow Transplantation Analysis of Treosulfan Conditioning Before Hematopoietic Stem Cell Transplantation in Children and Adolescents with Hematological Malignancies. Pediatr Blood Cancer 2016; 63:139–48.
16. Mateos M.K., O’Brien T.A., Oswald C., Gabriel M., Ziegler D.S., Cohn R.J., et al. Transplant-related mortality following allogeneic hematopoietic stem cell transplantation for pediatric acute lymphoblastic leukemia: 25-year retrospective review. Pediatr Blood Cancer 2013; 60: 1520-7.
17. Willasch A.M., Peters C., Sedláček P., Dalle J.H., Kitra-Roussou V., Yesilipek A., et al. Myeloablative conditioning for allo- HSCT in pediatric ALL: FTBI or chemotherapy? – A multicenter EBMT-PDWP study. Bone Marrow Transplant 2020. DOI: 10.1038/s41409-020-0854-0
Аутологичная трансплантация гемопоэтических стволовых клеток для консолидации ремиссии острого миелобластного лейкоза с факторами неблагоприятного прогноза в дебюте заболевания
Введение. Роль аутологичной трансплантации гемопоэтических стволовых клеток (аутоТГСК) у взрослых больных острым миелобластным лейкозом (ОМЛ) с факторами неблагоприятного прогноза в дебюте заболевания сегодня окончательно не определена.
Цель работы – представить результаты одноцентрового проспективного исследования эффективности аутоТГСК у больных ОМЛ с факторами неблагоприятного прогноза в дебюте заболевания.
Материалы и методы. С 2007 по 2014 г. в исследование были включены 42 пациента с первичным ОМЛ с 1 или более факторами неблагоприятного прогноза в дебюте заболевания. АутоТГСК была выполнена 16 пациентам (из них 9 – женщины) в возрасте 20–57 лет (медиана 38 лет) без доступного совместимого аллогенного (родственного или неродственного) донора. В целях выявления роли отдельных прогностических факторов проводили анализ зависимости отдаленных результатов от различных показателей в дебюте ОМЛ и характеристик аутоТГСК.
Результаты. При медиане наблюдения 49 мес (диапазон 5–86 мес) 5-летние показатели общей, бессобытийной и безрецидивной выживаемости составили 47, 47 и 51 % соответственно. Показатели летальности, связанной с трансплантацией, через 100 дней и 2 года после выполнения аутоТГСК составили 0 и 6 % соответственно. Развитие рецидива ОМЛ отмечено у 44 % больных. В ходе поискового анализа выявлено благоприятное прогностическое влияние на общую выживаемость включения тотального терапевтического облучения в состав режима кондиционирования перед аутоТГСК (р = 0,045).
Заключение. Проведение аутоТГСК у больных в ремиссии ОМЛ с факторами неблагоприятного прогноза в дебюте заболевания оказывает длительный противоопухолевый эффект. При отсутствии полностью совместимого аллогенного донора выполнение аутоТГСК можно рассматривать в качестве альтернативного варианта лечения.
Ключевые слова
Об авторах
Список литературы
1. Miller K. B., Pihan G. et al. Clinical manifestations of acute myeloid leukemia. In: Hematology. Basic Principles and Practice. 5th edn. Ed. by R. Hoffman, E. J. Benz, J. S. Shattil et al. New York: Churchill Livingstone, 2009. Pp. 933–63.
2. Meshinchi S., Appelbaum F. R. Structural and functional alterations of FLT3 in acute myeloid leukemia. Clin Cancer Res 2009;15(13):4263–9.
3. Sitnicka E., Buza-Vidas N., Larsson S. et al. Human CD34+ hematopoietic stem cells capable of multilineage engrafting NOD/SCID mice express flt3: distinct flt3 and c-kit expression and response patterns on mouse and candidate human hematopoietic stem cells. Blood 2003;102(3):881–6.
4. Маркина И. Г., Тупицын Н. Н., Волкова М. А., Френкель М. А. Влияние иммунофенотипа бластных клеток на прогноз острого нелимфобластного лейкоза. Вестник РОНЦ им. Н. Н. Блохина РАМН 2000;2(11):30–6. [Markina I. G., Tupitsyn N. N., Volkova M. A., Frenkel’ M. A. Influence of immunophenotype of blast cells on the prognosis of acute nonlymphoblastic leukemia. Vestnik RONC im. N. N. Blokhina RAMN = Bulletin of N. N. Blokhin RCRС of RAMS 2000;2(11):30–6. (In Russ.)].
5. Тупицын Н. Н., Попа А. В., Маркина И. Г. Клиническое значение иммунофенотипа острых миелобластных лейкозов. Гематология и трансфузиология 1999;(3):3–8. [Tupitsyn N. N., Popa A. V., Markina I. G. The clinical significance of immunophenotype in acute myeloid leukemia. Gematologiya i transfuziologiya = Hematology and Transfusiology 1999;(3):3–8. (In Russ.)].
6. Munker R., Hildebrandt G. C., Atkinson K. Therapeutic decision making in BMT/SCT for acute myeloid leukemia. In: The BMT data book. Including cellular therapy. 3rd edn. Ed. by R. Munker, G. C. Hildebrandt, H. M. Lazarus, K. Atkinson. New York: Cambridge University Press, 2013. Pp. 25–40.
7. Программное лечение заболеваний системы крови. Под ред. В. Г. Савченко. М.: Практика, 2012. С. 153–207. [Protocol treatment of blood diseases. Ed. by V. G. Savchenko. Moscow: Praktika, 2012. Pp. 153–207. (In Russ.)].
8. Sureda A., Bader P., Cesaro S. et al. Indications for allo- and auto-SCT for haematological diseases, solid tumours and immune disorders: current practice in Europe, 2015. Bone Marrow Transplant 2015;50(8):1037–56.
9. NCCN. Clinical Practice Guidelines in Oncology (NCCN Guidelines). Acute Mueloid Leukemia. v. 1.2015.
10. Cassileth P. A., Harrington D. P., Appelbaum F. R. et al. Chemotherapy compared with autologous or allogeneic bone marrow transplantation in the management of acute myeloid leukemia in first remission. N Engl J Med 1998;339(23):1649–56.
11. Munker R., Lazarus H. M., Atkinson K. The BMT data book. 2nd edn. 2009. 32 р.
12. Lazarus H. M., Pérez W. S., Klein J. P. et al. Autotransplantation versus HLAmatched unrelated donor transplantation for acute myeloid leukaemia: a retrospective analysis from the Center for International Blood and Marrow Transplant Research. Br J Haematol 2006;132(6):755–69.
13. Munker R., Hildebrandt G. C., Lazarus H. M. The BMT data book. 3rd edn. 2013. 37 р.
15. Burnett A. K., Goldstone A. H., Stevens R. M. et al. Randomised comparison of addition of autologous bone-marrow transplantation to intensive chemotherapy for acute myeloid leukaemia in first remission: results of MRC AML 10 trial. UK Medical Research Council Adult and Children’s Leukaemia Working Parties. Lancet 1998;351(9104):700–8.
18. Tutschka P. J., Copelan E. A., Klein J. P. Bone marrow transplantation for leukemia following a new busulfan and cyclophosphamide regimen. Blood 1987;70(5):1382–8.
19. Mollee P., Gupta V., Song K. Long-term outcome after intensive therapy with etoposide, melphalan, total body irradiation and autotransplant for acute myeloid leukemia. Bone Marrow Transplant 2004;33(12):1201–8.
20. Абдусаламов С. Н., Мелкова К. Н., Чернявская Т. З. и др. Градация интенсивности и подходы к оптимизации сопроводительной терапии при трансплантации костного мозга. Клиническая онкогематология 2009;2(4):334–42. [Abdusalamov S. N., Melkova K. N., Chernyavskaya T. Z. et al. Gradation of intensity and approaches to optimizing supportive care in bone marrow transplantation. Klinicheskaya onkogematologiya = Clinical Oncohematology 2009;2(4):334–42. (In Russ.)].
21. Абдусаламов С. Н., Мелкова К. Н., Горбунова Н. В. и др. Профилактические режимы ведения больных и подходы к оптимизации сопроводительной терапии при трансплантации костного мозга. Клиническая онкогематология 2010;3(1):21–9. [Abdusalamov S. N., Melkova K. N., Gorbunova N. V. et al. Prophylactic patient management and approaches to optimizing supportive care in bone marrow transplantation. Klinicheskaya onkogematologiya = Clinical Oncohematology 2010;3(1):21–9. (In Russ.)].
22. Wilson W. H., Jain V., Bryant G. et al. Phase I and II study of high-dose ifosfamide, carboplatin, and etoposide with autologous bone marrow rescue in lymphomas and solid tumors. J Clin Oncol 1992;10(11):1712–22.
25. Apperley J., Carreras E., Gluckman E. et al. Haematopoietic stem cell transplantation. The EBMT Handbook. 5th edn. 2008.
26. Zittoun R. A., Mandelli F., Willemze R. et al. Autologous or allogeneic bone marrow transplantation compared with intensive chemotherapy in acute myelogenous leukemia. N Engl J Med 1995;332(4): 217–23.
27. Isidori A., Bonifazi F., Visani G. et al. Autologous stem cell transplantation for acute myeloid leukemia patients in first complete remission: a 10-year follow-up study of 118 patients. Haematologica 2005;90(1):139–41.
28. Sabty F. A., Demeckova E., Bojtarova E. et al. Is there still a role for autologous stem cell transplantation in acute myeloid leukemia? Neoplasma 2013;60(2):167–73.
30. Dusenbery K. E., Daniels K. A., McClure J.S. et al. Randomized comparison of cyclophosphamide-total body irradiation versus busulfan-cyclophosphamide conditioning in autologous bone marrow transplantation for acute myeloid leukemia. Int J Radiat Oncol Biol Phys 1995;31(1):119–28.
31. Мелкова К. Н., Горбунова Н. В., Чернявская Т. З. и др. Тотальное облучение организма человека при трансплантации костного мозга. Клиническая онкогематология 2012;5(2):96–114. [Melkova K. N., Gorbunova N. V., Chernyavskaya T. Z. et al. The total body irradiation in bone marrow transplantation. Klinicheskaya onkogematologiya = Clinical Oncohematology 2012;5(2):96–114. (In Russ.)].
32. Hengeveld M., Suciu S., Chelgoum Y. High numbers of mobilized CD34+ cells collected in AML in first remission are associated with high relapse risk irrespective of treatment with autologous peripheral blood SCT or autologous BMT. Bone Marrow Transplant 2015;50(3):
34. Vellenga E., van Putten W. L., Boogaerts M. A. Peripheral blood stem cell transplantation as an alternative to autologous marrow transplantation in the treatment of acute myeloid leukemia? Bone Marrow Transplant 1999;23(12): 1279–82.
35. Gorin N. C., Labopin M., Blaise D. Higher incidence of relapse with peripheral blood rather than marrow as a source of stem cells in adults with acute myelocytic leukemia autografted during the first remission. J Clin Oncol 2009;27(24):3987–93.
36. Gorin N. C., Labopin M., Reiffers J. Higher incidence of relapse in patients with acute myelocytic leukemia infused with higher doses of CD34+ cells from leukapheresis products autografted during the first remission. Blood 2010;116(17):3157–62.
ЧТО СЛЕДУЕТ ЗНАТЬ О ПЕРЕСАДКЕ КОСТНОГО МОЗГА
В народе когда говорят «пересадка костного мозга», подразумевают пересадку стволовых клеток. В этом смысле костный мозг понимается как источник стволовых клеток. У взрослых источником стволовых клеток может выступать кровь. Также стволовые клетки извлекаются из пуповинной крови.

Профессор клиники Аджибадем Адана, детский гематолог-онколог Бюлент Антмен ответил на вопросы, касающиеся пересадки костного мозга.
При каких заболеваниях требуется пересадка костного мозга?
— Первую группу составляют заболевания крови. На первом месте стоит лейкемия. При лейкемии, которая не поддается лечению, или рецидивирующей лейкемии, особенно при таких заболеваниях, как острый лимфобластный лейкоз, острый миелоидный лейкоз и хронический миелоидный лейкоз трансплантация костного мозга имеет важное значение. Хотя при диагнозе «острый лимфобластный лейкоз» пересадка может быть первым методом лечения. Заболевания, при которых костный мозг вообще не вырабатывает клетки крови, таких как апластическая анемия, трансплантация костного мозга является единственным методом лечения. Этот вид заболевания может быть врожденным, а также может развиться со временем. Некоторые вирусы, химические вещества и лекарства могут привести к апластической анемии. При врожденных заболеваниях крови пересадка костного мозга также занимает важное место. В лечении талассемии, известной как средиземноморская анемия, серповидно-клеточной анемии и при некоторых других редких заболеваниях крови пересадка костного мозга применяется как единственный метод лечения.
Следом за болезнями крови идут онкологические заболевания. Наблюдаемая у детей неходжкинская лимфома возглавляет этот перечень, следом идут болезни, не поддающиеся лечению другим образом или рецидивирующие, лимфома Ходжкина в случае рецидива. Для пациентов с такими диагнозами трансплантация костного мозга является единственным шансом на спасение.
Кто может быть донором костного мозга?
— В донорстве костного мозга может использоваться пуповинная кровь, сохранившаяся в плаценте и пупочной вене после рождения ребенка.
Существует ли опасность для донора?
— Вокруг трансплантации костного мозга существует много заблуждений относительно вреда для донора. Также как и при пересадке печени или почек, подобная ошибочная информация приводит к тому, что люди не хотят выступать донорами. Однако процедура трансплантации не несет в себе никакого вреда. Тем не менее, дети возрастом до 2 лет и те, кто старше 60 лет, не рассматриваются в качестве донора костного мозга. Перед забором стволовых клеток проводятся анализы крови, при которых изучаются ее показатели. Для оценки общего состояния пациента, проводятся медицинские обследования, в ходе которых исследуется печень, почки и кровь.
Аллогенная трансплантация проводится в операционной. Забор стволовых клеток осуществляется с помощью специальной иглы, которая вводится непосредственно в тазовую кость, где располагается основной резервуар костного мозга. Затем контейнер содержащей стволовые клетки доставляется в лабораторию для отбора стволовых клеток. Отбор стволовых клеток проводится на аппарате афереза. После этого оценивается количество живых клеток, на основании чего определяется, подходит ли отобранное количество для рецепиента. Если количество достаточное, то начинается подготовка к трансплантации. Количество костного мозга после забора у донора восстонавляется в течении 2-х недель.
Как осуществляется пересадка?
— Рецепиент также должен пройти подготовку к трансплантации. Как и во время подготовки почвы к выращиванию полезных культур выпалываются все сорняки, так же и перед пересадкой новых стволовых клеток, клетки собственного костного мозга пациента полностью разрушаются при помощи химиотерапии и лучевой терапией. Таким образом, освобождается место для новых клеток. Кроме того, во время подготовки пациенту проводят системное тестирование, чтобы быть уверенным, что физическое состояние позволит ему перенести процедуру. Как правило, подготовка продолжается от 7 до 8 дней, и только после подготовки проводится процедура трансплантации. Новые стволовые клетки вводят пациенту внутривенно, подобно переливанию крови. Катетер Хикмана, вводится в крупную вену обычно в районе шеи, затем под кожей на груди подводится к сердцу. Стволовые клетки, что были ранее взяты у донора, подаются по катетеру прямо в систему сердечно-сосудистого кровообращения. Запрограммированные природой клетки донора распределяются в костном мозге пациента и подобно семенам в плодородной почве, начинают образовывать новые дееспособные кровяные клетки.
Что ожидает пациентов после трансплантации?
— В случае если у пациента онкологическое заболевание крови, для подавления деффектных клеток больному проводят курс лечения ХТ благодоря, которой разрушаются не только раковые клетки пациента, но и здоровые клетки костного мозга. Только после такого рода лечения, становиться возможным пересадка здорового донорского костного мозга. После начинается период иммунносупрессивной терапии, направленная на подавление иммунной системы пациента, которая может считать пересаженные клетки чужеродными.
Однако, это делает человека беззащитным перед инфекциями из внешнего мира. Поэтому основные усилия направлены на то, чтобы пациент ничем не заразился.
На 14-й дней после трансплантации определяется, воспроизводятся пересаженные клетки или нет. Однако, до достижения определенного количества клеток крови в течение 30-40 дней пациент содержится в стерильной среде. Если количество клеток увеличилось, то процедура трансплантации считается успешной. За этот период происходит увеличение числа кровяных клеток, вырабатываются эритроциты, лейкоциты и тромбоциты, а также если никакой инфекции не обнаружено, пациент может использовать общую среду с другими пациентами в больнице и переводится из бокса в отделение. Пациент находиться в клинике в течение 45-60 дней. После лечения, если состояние пациента удовлетворительное, больной выписывается. Следует так же отметить, что в течении года после выписки, пациенту необходимо находиться под потоянным контролем врача для обеспечения защиты от инфекций и контроля его восстановления.
Очень повезло, что у меня есть братья!
История 16 летней девочки из Аданы Х.Ф. с диагнозом лейкемия, которая выздоровела благодаря пересадке костного мозга от старшего брата.
Проф.Док. Бюлент Антмен знает эту пациентку в течение четырех лет. Отец на пенсии, мать домохозяйка, в семье 9 детей, Х.Ф. родилась шестой. Рассказывая о том, как началась ее болезнь, она говорит следующее: «В то время я училась в шестом классе. Был экзамен. У меня кружилась голова, тошнило. Я не смогла ответить на вопросы, хотела все выбросить из головы и уйти домой. Ушла из школы, с трудом добралась до дома. В аптеке купили лекарство от тошноты. Не помогало, пошли в больницу, оттуда отправили на обследование в Медицинский факультет университета Acibadem. Лечащим врачом стал доктор Бюлент Антмен…»

Поставили диагноз, начали лечение и, казалось, победили болезнь. Через определенные промежутки Х.Ф. сдавала анализ на общий объем костного мозга. В один из дней поступил звонок из больницы «Приходите, сделаем еще один тест», начался новый период лечения. Ее болезнь рецидивировала. Поэтому было принято решение о пересадке костного мозга. На вопрос, как нашли подходящего донора, Х.Ф. улыбаясь ответила: «Я очень счастлива, потому что мне подошел костный мозг старшего брата и старшей сестры. Мне очень повезло. Здесь я вижу больных, у кого нет братьев, кто не может найти донора, поэтому я считаю себя очень везучей».
Доктор принял решение для первой попытки пересадки взять клетки у старшего брата, если будет отторжение, тогда у сестры. Первая попытка оказалась успешной.
Х.Ф. безостановочно рассказывает о своих планах после выздоровления: «Хочу пойти в школу. Поступлю в лицей. Я вижу своих друзей и волей-неволей расстраиваюсь. Вначале переживала из-за волос, но теперь не думаю об этом, как бы то ни было заново отрастут. Эта болезнь меня многому научила. Вместо того, чтобы жаловаться, пытаюсь смотреть на ситуацию с хорошей стороны. Хочу выучиться и получить профессию».
Читайте также:
