Тубулин в структуре микротрубочек
Добавил пользователь Алексей Ф. Обновлено: 27.01.2026
В обзоре литературы представлены данные о белке микротрубочек βIII-тубулине (TUBB3): его структуре, функциях, роли в опухолевой прогрессии, экспрессии в нормальных клетках, а также в опухолях нервной системы и в эпителиальных опухолях разных локализаций. Рассмотрены основные принципы работы системы микротрубочек и связь TUBB3 с родственными белками семейства ß-тубулинов. Проанализированы перспективы использования TUBB3 в клинической практике как прогностического маркера агрессивности течения заболевания и резистентности опухоли к лекарственной терапии. Сформулировано новое представление о молекулярной диагностике локальной распространённости опухолевого процесса на основании сравнительной оценки уровня экспрессии TUBB3 в нормальной и опухолевой ткани каждого больного. В заключение обоснована необходимость изучения экспрессии TUBB3 и других опухолевый маркеров не только в самой опухоли, но и в нормальной ткани органа, визуально не вовлечённой в опухолевый процесс.
Ключевые слова
Раскрытие информации о конфликте интересов:
Авторы заявляют об отсутствии конфликта интересов.
Информация о статье:
Депонировано (дата): 06.05.2020
Все авторы прочитали и одобрили окончательную рукопись статьи.
Информация о рецензировании:
"Антибиотики и Химиотерапия" благодарит анонимного рецензента (рецензентов) за их вклад в рецензирование этой работы.
Комментарий редакции:
В случае возникновения разночтений в тексте или расхождений в форматировании между pdf-версией статьи и её html-версией приоритет отдаётся pdf-версии.
Об авторах
Список литературы
1. Jordan M.A., Wilson L. Microtubules as a target for anticancer drugs. Nat Rev Cancer 2004; 4: 253-265.
2. David-Pfeuty T., Erickson H.P., Pantaloni D. Guanosinetriphosphatase activity of tubulin associated with microtubule assembly. Proc Natl Acad Sci USA 1977; 74: 12: 5372-5376.
3. Rezania V., Azarenko O., Jordan M.A. et al. Microtubule assembly of isotypically purified tubulin and its mixtures. Biophys J 2008; 95: 4: 1993-2008.
4. Luduena R.F. Multiple forms of tubulin: different gene products and covalent modifications. Int Rev Cytol 1998; 178: 207-275.
5. Gadadhar S., Bodakuntla S., Natarajan K. et al. The tubulin code at a glance. J Cell Sci 2017; 130: 8: 1347-1353.
6. Luduena R.F. A hypothesis on the origin and evolution of tubulin. Int Rev Cell Mol Biol 2013; 302: 41-185.
7. Ono S. Ancient linkage groups and frozen accidents. Nature. 1973; 244: 5414: 259-262.
8. Katsetos C.D., Herman M.M., Mörk S.J. Class III beta-tubulin in human development and cancer. Cell Motil Cytoskeleton 2003; 55: 2: 77-96.
10. Jiang Y.Q., Oblinger M.M. Differential regulation of beta III and other tubulin genes during peripheral and central neuron development. J Cell Sci 1992; 103 ( Pt 3): 643-651.
11. Drâberovâ E., Del Valle L., Gordon J. et al. Class III β-tubulin is constitutively coexpressed with glial fibrillary acidic protein and nestin in midgestational human fetal astrocytes: implications for phenotypic identity. Neuropathol Exp Neurol 2008; 2008: 341-354.
12. Portyanko A., Kovalev P., Gorgun J., Cherstvoy E. Beta(III)-tubulin at the invasive margin of colorectal cancer: possible link to invasion. Virchows Arch 2009; 454: 5: 541-548.
13. Jouhilahti E.M., Peltonen S., Peltonen J. Class III beta-tubulin is a component of the mitotic spindle in multiple cell types. J Histochem Cytochem 2008; 56: 12: 1113-1119.
14. Guo J., Walss-Bass C., Luduena R.F. The beta isotypes of tubulin in neuronal differentiation. Cytoskeleton (Hoboken) 2010; 67: 7: 431-441.
15. Fanara P. et al. Stabilization of hyperdynamic microtubules is neuroprotective in amyotrophic lateral sclerosis. J Biol Chem 2007; 282: 32: 23465-23472.
16. Gan P.P., Pasquier E., Kavallaris M. Class III beta-tubulin mediates sensitivity to chemotherapeutic drugs in non small cell lung cancer. Cancer Res 2007; 67: 19: 9356-9363.
17. Davies K.J., Doroshow J.H. Redox cycling of anthracyclines by cardiac mitochondria. I. Anthracycline radical formation by NADH dehydrogenase. J Biol Chem 1986; 261: 7: 3060-3067.
18. Sheldon K.L., Maldonado E.N., Lemasters J.J. et al. Phosphorylation of voltage-dependent anion channel by serine/threonine kinases governs its interaction with tubulin. PLoS One / ed. Kahle P J 2011; 6: 10: e25539.
19. Rostovsteva, T.K., Gurnev, P.A., Chen, M.Y., Bezrukov S.M. Membrane lipid composition regulates tubulin interaction with mitochondrial voltage-dependent anion channel. Biol Chem 2012; 287: 29589-29598.
20. Cicchillitti L., Penci R., Di Michele M. et al. Proteomic characterization of cytoskeletal and mitochondrial class III beta-tubulin. Mol Cancer Ther 2008; 7: 7: 2070-2079.
21. McCarroll J.A., Gan P.P., Erlich R.B. et al. TUBB3//3III-tubulin acts through the PTEN/AKT signaling axis to promote tumorigenesis and anoikis resistance in non-small cell lung cancer. Cancer Res 2015; 75: 2: 415-425.
22. Jordan A., Hadfield J.A., Lawrence N.J. et al. Tubulin as a target for anticancer drugs: agents which interact with the mitotic spindle. Med Res Rev 1998; 18: 4: 259-296.
23. Karki R., Mariani M., Andreoli M. et al. βIII-Tubulin: biomarker of taxane resistance or drug target? Expert Opin Ther Targets 2013; 17: 4: 461-472.
24. Freedman H., Huzil J.T., Luchko T. et al. Identification and characterization of an intermediate taxol binding site within microtubule nanopores and a mechanism for tubulin isotype binding selectivity. J Chem Inf Model 2009; 49: 2: 424-436.
25. Andreoli M., Persico M., Kumar A. et al. Identification of the first inhibitor of the GBP1:PIM1 interaction. Implications for the development of a new class of anticancer agents against paclitaxel resistant cancer cells. J Med Chem 2014; 57: 19: 7916-7932.
26. Raspaglio G., Filippetti F., Prislei S. et al. Hypoxia induces class III beta-tubulin gene expression by HIF-1alpha binding to its 3' flanking region. Gene 2008; 409: 1-2: 100-108.
27. Raspaglio G., De Maria I., Filippetti F. et al. HuR regulates beta-tubulin isotype expression in ovarian cancer. Cancer Res 2010; 70: 14: 5891-5900.
28. Mozzetti S., Martinelli E., Raspaglio G. et al. Gli family transcription factors are drivers of patupilone resistance in ovarian cancer. Biochem Pharmacol 2012; 84: 11: 1409-1418.
30. De Gendt K., Denolet E., Willems A. et al. Expression of Tubb3, a beta-tubulin isotype, is regulated by androgens in mouse and rat Sertoli cells. Biol Reprod 2011; 85: 5: 934-945.
31. Mariani M., Zannoni G.F., Sioletic S. et al. Gender influences the class III and V /З-tubulin ability to predict poor outcome in colorectal cancer. Clin Cancer Res 2012; 18: 10: 2964-2975.
32. Terry S., Ploussard G., Allory Y. et al. Increased expression of class III beta-tubulin in castration-resistant human prostate cancer. Br J Cancer 2009; 101: 6: 951-956.
33. Shibazaki M., Maesawa C., Akasaka K. et al. Transcriptional and post-transcriptional regulation of ßIII-tubulin protein expression in relation with cell cycle-dependent regulation of tumor cells Oncol 2012; 40: 3: 695-702.
34. Mariani M., Karki R., Spennato M. et al. Class III /в-tubulin in normal and cancer tissues Gene 2015; 563: 2: 109-114.
35. Tischfield M.A., Baris H.N., Wu C. et al. Human TUBB3 mutations perturb microtubule dynamics, kinesin interactions, and axon guidance. Cell 2010; 140: 1: 74-87.
37. Lewis S.A., Cowan N.J. Complex regulation and functional versatility of mammalian alpha- and beta-tubulin isotypes during the differentiation of testis and muscle cells. J Cell Biol 1988; 106: 6: 2023-2033.
38. Peknicova J., Kubatova A., Sulimenko V. et al. Differential subcellular distribution of tubulin epitopes in boar spermatozoa: recognition of class III-tubulin epitope in sperm tail. Biol Reprod 2001; 65: 672-679.
39. Locher H., Frijns J.H., Huisman M.A., de Sousa Lopes S.M. TUBB3: Neuronal Marker or Melanocyte Mimic? Cell Transplant 2014; 23: 11: 1471-1473.
40. Yu H., Fang D., Kumar S.M. et al. Isolation of a novel population of multipotent adult stem cells from human hair follicles. Am J Pathol 2006; 168: 6: 1879-1888.
41. Katsetos C.D., Del Valle L., Geddes J.F. et al. Localization of the neuronal class III beta-tubulin in oligodendrogliomas: comparison with Ki-67 proliferative index and 1p/19q status. J Neuropathol Exp Neurol 2002; 61: 4: 307-320.
42. Katsetos C.D., Del Valle L., Legido A. et al. On the neuronal/neuroblastic nature of medulloblastomas: a tribute to Pio del Rio Hortega and Moises Polak. Acta Neuropathol. 2003; 105: 1: 1-13.
43. Packer R.J., Sutton L.N., Rorke L.B. et al. Prognostic importance of cellular differentiation in medulloblastoma of childhood. J Neurosurg 1984; 61: 2: 296-301.
44. Ikota H., Kinjo S., Yokoo H. et al. Systematic immunohistochemical profiling of 378 brain tumors with 37 antibodies using tissue microarray technology. Acta Neuropathol 2006; 111: 5: 475-482.
45. Katsetos C.D., Del Valle L., Geddes J.F. et al. Aberrant localization of the neuronal class III beta-tubulin in astrocytomas. Arch Pathol Lab Med 2001; 125: 5: 613-624.
46. Katsetos C.D., Draber P., Kavallaris M. Targeting /βIII-tubulin in glioblastoma multiforme: from cell biology and histopathology to cancer therapeutics. Anticancer Agents Med Chem 2011; 11: 8: 719-728.
47. Jirâsek T., Pisarikova E., Viklicky V. et al. Expression of class III beta-tubulin in malignant epithelial tumours: an immunohistochemical study using TU-20 and TuJ-1 antibodies. Folia Histochem Cytobiol 2007; 45: 1: 41-45.
48. Kavallaris M., Kuo D.Y., Burkhart C.A. et al. Taxol-resistant epithelial ovarian tumors are associated with altered expression of specific beta-tubulin isotypes. J Clin Invest 1997; 100: 5: 1282-1293.
50. Ferrandina G., Zannoni G.F., Martinelli E. et al. Class III -Tubulin Overexpression Is a Marker of Poor Clinical Outcome in Advanced Ovarian Cancer Patients. Clin Cancer Res 2006; 12: 9: 2774-2779.
51. Su D., Smith S.M., Preti M. et al. Stathmin and tubulin expression and survival of ovarian cancer patients receiving platinum treatment with and without paclitaxel. Cancer 2009; 115: 11: 2453-2463.
52. Umezu T., Shibata K., Kajiyama H. et al. Taxol resistance among the different histological subtypes of ovarian cancer may be associated with the expression of class III beta-tubulin. Int J Gynecol Pathol 2008; 27: 2: 207-212.
53. Aoki D., Oda Y., Hattori S. et al. Overexpression of class III beta-tubulin predicts good response to taxane-based chemotherapy in ovarian clear cell adenocarcinoma. Clin Cancer Res 2009; 15: 4: 1473-1480.
54. Jakobsen J.N., Santoni-Rugiu E., Sorensen J.B. Longitudinal assessment of TUBB3 expression in non-small cell lung cancer patients. Cancer Chemother Pharmacol 2014; 73: 1: 43-51.
55. Jakobsen J.N., Santoni-Rugiu E. S.J.B. Use of TUBßIII for patient stratification and prognosis in lung cancer. Lung Cancer Manag 2015; 4: 2: 97-110.
56. Lebok P., Öztürk M., Heilenkötter U. et al. High levels of class III ß-tubulin expression are associated with aggressive tumor features in breast cancer. Oncol Lett 2016; 11: 3: 1987-1994.
57. Kanojia D., Morshed R.A., Zhang L. et al. III-Tubulin Regulates Breast Cancer Metastases to the Brain. Mol Cancer Ther 2015; 14: 5: 1152-1161.
58. Urano N., Fujiwara Y., Doki Y. et al. Clinical significance of class III beta-tubulin expression and its predictive value for resistance to docetaxel-based chemotherapy in gastric cancer. Int J Oncol 2006; 28: 2: 375-381.
59. Gao J., Lu M., Yu J.W. et al. Thymidine Phosphorylase/ß-tubulin III expressions predict the response in Chinese advanced gastric cancer patients receiving first-line capecitabine plus paclitaxel. BMC Cancer. 2011; 11: 1: 177.
60. Jirâsek T., Cipro S., Musilovâ A. et al. Expression of class III beta-tubu-lin in colorectal carcinomas: an immunohistochemical study using TU-20 & TuJ-1 antibody. Indian J Med Res 2009; 129: 1: 89-94.
61. Sun H., Shi L., He X., Zheng S. Expressions of TUBB3 and gamma-synuclein in colorectal adenocarcinoma and their clinical significance. Zhonghua Yi Xue Za Zhi 2015; 95: 1242-1244.
62. Портянко А.С. Ремоделирование цитоскелета в патогенезе и прогрессии аденокарциномы и хронических воспалительных заболеваний толстой кишки: дис.. д-ра. биол. наук: 14.03.02 Минск 2016: 43.
63. Egevad L., Valdman A., Wiklund N.P. et al. Beta-tubulin III expression in prostate cancer Scand J Urol Nephrol 2010; 44: 6: 371-377.
64. Ploussard G., Terry S., Maillé P. et al. Class III beta-tubulin expression predicts prostate tumor aggressiveness and patient response to docetaxel-based chemotherapy. Cancer Res 2010; 70: 22: 9253-9264.
65. Hinsch A., Chaker A., Burdelski C. et al. /βIII-tubulin overexpression is linked to aggressive tumor features and genetic instability in urinary bladder cancer. Hum Pathol 2017; 61: 210-220.
66. Quaas A., Rahvar A.H., Burdelski C. et al. /βIII-tubulin overexpression is linked to aggressive tumor features and shortened survival in clear cell renal cell carcinoma World J Urol 2015; 33: 10: 1561-1569.
67. Ferrandina G., Martinelli E., Zannoni G.F. et al. Expression of class III beta tubulin in cervical cancer patients administered preoperative radiochemotherapy: correlation with response to treatment and clinical outcome. Gynecol Oncol 2007; 104: 2: 326-330.
68. Koh Y., Kim T.M., Jeon Y.K. et al. Class III beta-tubulin, but not ERCC1, is a strong predictive and prognostic marker in locally advanced head and neck squamous cell carcinoma. Ann Oncol 2009; 20: 8: 1414-1419.
69. Kaira K., Serizawa M., Koh Y. et al. Expression of Excision Repair Cross-Complementation Group 1, Breast Cancer Susceptibility 1, and ßIII-Tubulin in Thymic Epithelial Tumors. J Thorac Oncol 2011; 6: 3: 606-613.
70. Akasaka K., Maesawa C., Shibazaki M. et al. Loss of class III beta-tubulin induced by histone deacetylation is associated with chemosensitivity to paclitaxel in malignant melanoma cells. J Invest Dermatol 2009; 129: 6: 1516-1526.
72. Ishida M., Kushima R., Okabe H. Aberrant expression of class III beta-tubulin in basal cell carcinoma of the skin. Oncol Rep 2009; 22: 4: 733-737.
73. Powell S., Kaizer A., Koopmeiners J.S. et al. High expression of class IIIß tubulin in small cell lung carcinoma. Oncol Lett 2013; 7: 2: 405-410.
75. Yoon S.O. et al. Class III beta-tubulin shows unique expression patterns in a variety of neoplastic and non-neoplastic lymphoproliferative disorders. Am. J. Surg. Pathol. 2010; 34: 5: 645-655.
76. Okuda K., Sasaki H., Dumontet C. et al. Expression of excision repair cross-complementation group 1 and class III beta-tubulin predict survival after chemotherapy for completely resected non-small cell lung cancer. Lung Cancer 2008; 62: 1: 105-112.
78. Azuma K., Sasada T., Kawahara A. et al. Expression of ERCC1 and class III β-tubulin in non-small cell lung cancer patients treated with carboplatin and paclitaxel. Lung Cancer 2009; 64: 3: 326-333.
79. Ikeda S., Takabe K., Suzuki K. Expression of ERCC1 and class IIIbeta tubulin for predicting effect of carboplatin/paclitaxel in patients with advanced inoperable non-small cell lung cancer. Pathol Int 2009; 59: 12: 863-867.
80. Zhang Q., Zhu X., Zhang L. et al. A prospective study of biomarker-guided chemotherapy in patients with non-small cell lung cancer. Cancer Chemother Pharmacol 2014; 74: 4: 839-846.
81. Chen X., Wu J., Lu H. et al. Measuring ß-tubulin III, Bcl-2, and ERCC1 improves pathological complete remission predictive accuracy in breast cancer. Cancer Sci 2012; 103: 2: 262-268.
82. Leandro-Garcfa L.J., Leskelä S., Landa I. et al. Tumoral and tissue-specific expression of the major human beta-tubulin isotypes. Cytoskeleton (Hoboken) 2010; 67: 4: 214-223.
83. Ishida M., Kushima R., Okabe H. Aberrant expression of class III beta-tubulin in basal cell carcinoma of the skin. Oncol Rep 2009; 22: 4: 733-737.
84. Orfanidis K., Wäster P., Lundmark K. et al. Evaluation of tubulinß-3 as a novel senescence-associated gene in melanocytic malignant transformation. Pigment Cell Melanoma Res 2017; 30: 2: 243-254.
85. Мамичев И.А., Богуш Т.А., Дудко Е. А. и др. Иммунофлуоресцентный анализ экспрессии бета-III тубулина в опухолевой и окружающей нормальной ткани пациентов с немелкоклеточным раком легкого. Росс биотер журнал. - 2016. - Т. 15. - № 2. - С. 16-18.
Тубулин в структуре микротрубочек
• Микротрубочки представляют собой полые полимеры гетеродимеров тубулина и обладают полой структурой
• Микротрубочка образована из 13 линейных цепей субъединиц, которые называются протофиламентами и связаны между собой латерально
• Наличие латеральных связей между протофиламентами стабилизирует микротрубочки и ограничивает добавление и удаление субъединиц к концам микротрубочек
• Микротрубочки представляют собой поляризованные полимеры. Их плюс-концы заканчиваются b-тубулином и собираются быстрее. Минус-концы содержат а-тубулин. и они собираются медленнее
Основной структурной единицей микротрубочек является белок тубулин. Он представляет собой гетеродимер, состоящий из двух близких белков, а- и b-тубулина. Эти белки обладают на 40% одинаковой первичной структурой и никогда не обнаруживаются поодиночке. Во всех случаях одна молекула а-тубулина и одна b-тубулина связаны вместе, образуя 100 кДа гетеродимер.
Этот гетеродимер обычно для простоты называется «тубулин», чтобы подчеркнуть факт, что он всегда функционирует как единое целое. Поскольку а- и р-тубулин имеют круглую форму, их гетеродимер похож на плод арахиса. Эта структура исследована при атомном разрешении: а- и b-тубулин имеют близкое строение и в димере расположены «линейно» так, что передняя часть молекулы одного примыкает к задней части молекулы другого.
Каждая молекула а- и b-тубулина связывает молекулу ГТФ. Строение гетеродимера тубулина показывает, что ГТФ, связанный с а-тубулином, расположен поблизости от места его контакта с b-тубулином. Этот ГТФ никогда не гидролизуется и не обменивается с нуклеотидами, находящимися в растворе. Напротив, ГТФ, связанный с р-тубулином, оказывается открытым с другой стороны гетеродимера и может обмениваться с нуклеотидами, находящимися в растворе.
При сборке микротрубочек ГТФ гидролизуется до ГДФ. Этот гидролиз приводит к изменению конформации гетеродимера тубулина, что играет важную роль в динамических превращениях микротрубочек.
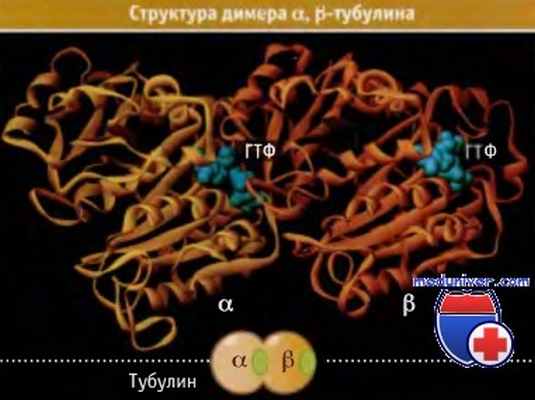
Трехмерная структура гетеродимера тубулина, основного строительного блока микротрубочек.
Золотистым и медно-красным цветом выделены полипептидные цепи, составляюшие две белковые субъединицы,
а зеленым цветом — две молекулы ГТФ, связанные с каждым гетеродимером.
Можно видеть сходство структур двух субъединиц и их расположение в комплексе как «голова к хвосту».
В самом низу схематически представлен димер тубулина.
Микротрубочки представляют собой белковые полимеры, состоящие из тысяч тубулиновых субъединиц, организованных в полые структуры. Обычно микротрубочка состоит из 13 линейных цепей субъединиц, расположенных по длине параллельно; каждая цепь носит название протофиламент.
Эти протофиламенты, показанные на рисунке ниже, соединяются по бокам, образуя микротрубочку. Хотя возможно образование микротрубочки из 11-15 протофиламентов, большая их часть, присутствующая в клетках, образована из 13 протофиламентов. Такая микротрубочка имеет диаметр 25 нм, т. е. в пять раз превышающий толщину ее стенки.
Гетеродимеры тубулина связаны по типу «голова к хвосту» вдоль длины каждого протофиламента. В большинстве примыкающих протофиламентов а-тубулины располагаются ближе к другим а-тубулинам и b-тубулины к другим b-тубулинам. Поскольку примыкающие протофиламенты по отношению друг к другу выровнены не строго, то наблюдается некоторая прерывистость или шов, в котором а-тубулины одного протофиламента примыкают к b-тубулинам следующего. Возможно, что этот шов играет важную роль в сборке микротрубочек.
Каждый гетеродимер тубулина в микротрубочке образует прочные нековалентные связи с соседними гетеродимерами. Как схематически изображено на рисунке ниже, эти нековалентные связи возникают в продольном и латеральном направлениях между димерами в протофиламенте. Одна продольная связь оказывается сильнее, чем одна латеральная связь, но наличие многочисленных латеральных связей делает полимер прочным. Легко продемонстрировать, почему это так.
Субъединицы в отдельном протофиламенте соединены только продольными связями. Все связи обладают одинаковой прочностью, так что они характеризуются равной вероятностью разрыва. Это делает один протофиламент способным к фрагментации. В микротрубочке субъединицы в середине полимера также образуют латеральные связи с субъединицами в примыкающих протофиламентах. Для разрыва микротрубочки необходимо, чтобы у всех 13 протофиламентов одновременно в одном и том же месте разорвались продольные связи. Это крайне маловероятное событие, и поэтому микротрубочки рвутся крайне редко.
Наличие латеральных связей между субъединицами также делает маловероятным диссоциацию димеров тубулина в середине микротрубочки, поскольку высвобождение димера в этом случае требует одновременного разрыва нескольких связей.
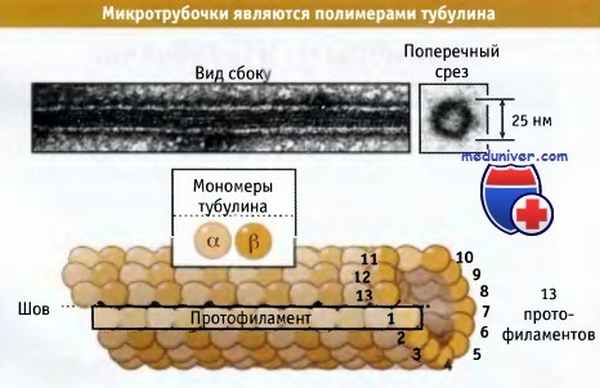
Строение небольшого участка микротрубочки.
В протофиламенте отдельные гетеродимеры тубулина расположены друг за другом,
а сами протофиламенты связаны между собой боковыми связями, образуя полую трубочку.
Все гетеродимеры ориентированы одинаковым образом — с одного конца микротрубочки расположены b-субъединицы, а с другого — а-субъединицы.
В верхней части рисунка представлена электронная микрофотография микротрубочки, полимеризованной из очищенного тубулина.
Вместо этого субъединицы добавляются только к концам филаментов, и там же происходит их диссоциация. В этих местах каждая субъединица присоединена к остатку микротрубочки несколькими связями.
Очищенные препараты гетеродимеров тубулина способны спонтанно образовывать боковые и продольные связи, приводящие к образованию микротрубочек. Поэтому сборка микротрубочек представляет собой процесс самосборки, при котором вся информация, необходимая для построения окончательной структуры, содержится в субъединицах. Примерами процессов самосборки является также полимеризация актиновых филаментов и сборка капсид некоторых вирусов.
Характер расположения субъединиц в микротрубочке обусловливает различия структуры ее концов. В каждом протофиламенте все гетеродимеры тубулина ориентированы одинаково, и в пределах микротрубочки все протофиламенты направлены также одинаково. Таким образом, кэп b-тубулина открыт с одной стороны микротрубочки (который называется плюс-конец), в то время как а-тубулин открыт с другого конца (минус-конец). Такая организация придает микротрубочке два очень важных свойства.
Во-первых, два ее конца становятся структурно различными и ведут себя по-разному. Как мы увидим, клетки часто используют это свойство, например регулируя независимую сборку с двух концов микротрубочки. Во-вторых, каждая микротрубочка представляет собой полярную структуру (т. е. обладает внутренней двунаправленностью), и ее можно рассматривать как направленную определенным образом. Это полярность характерна для всей микротрубочки, а не только для ее концов. Стоит лишь посмотреть на поверхность микротрубочки в любой точке, даже расположенной в середине, и можно определить направление плюс- и минус-концов.
Полярность микротрубочек позволяет им выполнять функцию двунаправленных путей для белковых молекулярных моторов и существенна для выполнения их роли во внутриклеточной организации.
Рисунок ниже иллюстрирует организацию микротрубочек в соответствии с их полярностью. Например, в фибробластах и других клетках с радиальным расположением микротрубочек они организованы так, что их минус-концы направлены к центру клетки, а плюс — к ее периферии. В эпителиальных клетках микротрубочки расположены параллельно друг другу, и идут сверху вниз, причем плюс-концы находятся внизу, а минус — наверху.
Аналогичным образом, все микротрубочки в аксоне ориентированы в одном и том же направлении. Для каждого типа клеток полярность расположения микротрубочек существенна для поддержания их структуры и функционирования.
Гетеродимеры тубулина образуют продольные связи (по длине протофиламента) и боковые связи (между субъединицами в примыкающих протофиламентах).
Одиночные протофиламенты склонны к диссоциации, поскольку все связи обладают одной и той же прочностью и разрываются с равной вероятностью.
Наличие боковых связей в микротрубочке делает маловероятным разрыв полимера в середине.
Субъединицы добавляются или диссоциируют только на концах микротрубочек, где каждая удерживается меньшим количеством связей, чем в середине.
Для простоты показаны только три протофиламента. В каждом из трех типов клеток все микротрубочки имеют одинаковую полярность.
Это позволяет использовать полярность микротрубочки как чувствительный индикатор направления в цитоплазме.
Например, в эпителиальной клетке направление от «+» к «-» означает «вверх».
Форма клетки и ее способность различать специализированные области на поверхности или внутри зависят от полярности микротрубочек.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Биология клетки/Часть 1. Клетка как она есть/7/6
Микротрубочки - трубочки диаметром около 24-25 нм, состоящие из белка тубулина. Микротрубочки есть во всех клетках эукариот и могут собираться в цитоплазме, а у многих эукариот и внутри ядра. Микротрубочки:
- Участвуют в поддержании формы клеток
- Влияют на взаимное расположение органелл (например, ЭПС и аппарата Гольджи)
- Обеспечивают транспорт веществ (по их поверхности, как по рельсам, мс помощью двигательных белков кинезинов и динеинов могут передвигаться мембранные пузырьки с грузом и макромолекулы)
- Составляют основу жгутиков и ресничек эукариот, при участии динеинов обеспечивают ресничное и жгутиковое движение
- Составляют основу центриолей, которые во многих клетках эукариот выполняют роль ЦОМТ - центра организации микротрубочек
- Образуют веретено деления и обеспечивают расхождение хромосом к полюсам клетки в ходе ее деления
Содержание
Тубулин — глобулярный белок. В клетках эукариот есть несколько слегка различающихся генов-ортологов, которые кодируют три разных формы тубулина — α-тубулин, β-тубулин и γ-тубулин. У каждого из этих белков выделяют три домена. Одна молекула α-тубулина и одна молекула β-тубулина в цитоплазме клеток объединяются в димер (изображен на рисунки). В составе такого димера к каждой молекуле тубулина присоединено по одной молекуле ГТФ.
На самом деле каждую из форм тубулина кодирует не один ген, а около десятка, так что каждая форма существует в виде множества подтипов. Они могут быть специфичны для определенных тканей. Например, тубулин III-β встречается только в нейронах. Кроме того, по одному гену кодируют еще две формы тубулина — δ- и ε-тубулин, которые, как и γ-тубулин, встречаются в основном в центриолях.
Новые молекулы тубулина могут прикрепляться как к ±, так и к --концу микротрубочки, но легче (при более низкой концентрации) присоединяются к + -концу (и легче отделяются от --конца).
Тубулин способен связываться в растворе с молекулами ГТФ. Рост микротрубочек осуществляется только за счет присоединения димеров тубулина, в которых обе субъединицы связаны с молекулами ГТФ. В стенках микротрубочек происходит гидролиз ГТФ, связанной с β-субъединицей, до ГДФ (связанная с α-субъединицей ГТФ стабильна). Связанная с ГДФ форма тубулина легче отделяется от микротрубочек, что определяет динамическую нестабильность микротрубочек — при определенных условиях они быстро распадаются почти полностью.
Микротрубочка распадается, когда расщепление ГТФ происходит быстрее, чем присоединение новых димеров. Тогда защитная "шапочка" (кэп) на +-конце из димеров, связанных с ГТФ, разрушается, и после эого быстро отваливаются от микротрубочки димеры, связанные с ГДФ.
[[1]] Анимация сборки и разборки микротрубочки
По поверхности микротрубочек, как по рельсам, могут транспортироваться мембранные пузырьки (везикулы) с грузом или макромолекулы. Их перемещение осуществляют две группы моторных белков - кинезины и динеины. Кинезины перемещаются по микротрубочке от --конца к +-концу, то есть обеспечивают транспорт к периферии клеток. Динеины двигаются в противоположном направлении - от +-конца микротрубочки к --концу, то есть обычно перемещают грузы к центру клетки.
Транспорт к периферии клетки часто называют антероградным транспортом, транпорт к центру - ретроградным (особенно эти термины применимы к движению по отросткам клеток - например, аксонам или дендритам. Одно из семейств кинезинов (кинезины-14, в том числе NCD дрозофилы, KAR3 почкующихся дрожжей и ATK5 арабидопсиса, двигаются по микротрубочкам от +-конца к --концу.
[2] Строение и функции кинезинов и динеинов (англ.)
Реснички и жгутики — органеллы, которые есть у многих групп эукариот. Это тонкие (диаметром 0,1-0,6 мкм) волосковидные выросты на поверхности клетки. Длина их составляет от 3-15 мкм до 2 мм (реснички гребных пластинок гребневиков).
Жгутики и реснички всех эукариот имеют сходное строение, поэтому иногда их обозначают общим термином ундулиподии. Это сходство — одно из свидетельств единого (монофилетического) происхождения эукариот. Ундулиподии есть у большинства групп протистов, у споровых и некоторых голосеменных растений раст и практически у всех животных. Настоящие грибы (Eumycota) лишены жгутиков и ресничек.
Различие между жгутиками и ресничками на самом деле заключается в характере их движения: реснички совершают удары в одной плоскости, а жгутик вращается (одновременно по нему может пробегать волна). Но в зоологии принято называть жгутиковыми любые клетки, у которых есть один подвижный жгутик (или ресничка). При наличии многочисленных ресничек клетки называют ресничными.
У многих беспозвоночных животных ими покрыта вся поверхность тела (ресничные черви, личинки кишечнополостных и губок) или отдельные его участки (например, жабры у полихет и двустворчатых моллюсков, подошва ноги у брюхоногих моллюсков). У коловраток из специализированных ресничек состоит коловращательный аппарат. У многих беспозвоночных (кишечнополостные, гребневики, турбеллярии и др.) реснички также имеются на клетках кишечного эпителия.
У позвоночных (в том числе человека) клетки с подвижными ресничками также есть во многих органах. У человека ресничным эпителием выстланы дыхательные пути, евстахиевы трубы, семявыносящие канальцы, желудочки мозга и спинномозговой (центральный) канал. Видоизмененные реснички служат световоспринимающим аппаратом фоторецепторов сетчатки глаза и воспринимающим запахи аппаратом хеморецепторов обонятельного эпителия.
Подвижные реснички и жгутики либо служат для движения, либо создают токи жидкости. Эти токи могут приносить пищу или кислород из внешней среды или служить для транспорта растворенных веществ внутри организма. Неподвижные жгутики и реснички (часто сильно видоизмененные) служат рецепторами у самых разных групп организмов.
Биофизик РУДН смоделировал поведение элементов микротрубочек клетки для химического воздействия на их рост и распад
Биофизик РУДН смоделировал молекулярную динамику роста важнейших элементов жизнедеятельности клетки — микротрубочек. Исследователи построили модель взаимодействия субъединиц микротрубочек с учётом их внутренних и внешних связей. Результаты позволяют сформировать более полную модель динамической нестабильности микротрубочек. Это позволит подобрать химические агенты для терапии некоторых заболеваний, в том числе новообразований и нейродегенеративных патологий.
Микротрубочки — важный компонент цитоскелета, отвечающий за деление и развитие клетки. Структурная единица микротрубочки — димер тубулина, который собирается в более крупный компонент — нить протофиламента. В структуре димера тубулина также выделяют два типа молекул — ГТФ (гуанинтрифосфат) и ГДФ (гуаниндифосфат). Сейчас считается, что процесс замены молекул ГТФ на ГДФ влияет на динамику процессов сборки и разборки микротрубочки. Эти процессы приводят к так называемой динамической нестабильности микротрубочек, которая определяет транспорт веществ внутри клетки и процесс разделения хромосом при делении клетки.
Илья Коваленко из РУДН, доктор физико-математических наук, разработал компьютерную модель на основе молекулярной и броуновской динамики с учётом внешних и внутренних взаимодействий димеров тубулина. Каждый димер вовлечён в два типа внешнего взаимодействия: боковое (взаимодействие между соседними димерами по кольцу микротрубочки) и продольное (взаимодействие между соседними димерами вдоль нити микротрубочки). Модель позволяет визуализировать в динамике форму как отдельных протофиламентов (тубулиновых нитей) разной длины, так и протофиламентов, включённых в состав стенки микротрубочек.
«Броуновская динамика позволяет моделировать крупные структуры на больших временных интервалах, а молекулярная динамика позволяет наряду с электростатическими взаимодействиями учесть взаимодействия с молекулами растворителя, а также локальные и глобальные изменения тубулина» — Илья Коваленко, биофизик РУДН.
Микротрубочки довольно прочны и по своей жёсткости сравнимы с органическим стеклом. На степень жёсткости микротрубочки влияет процентное соотношение димеров с ГТФ и ГДФ димерами тубулина. ГДФ-связанные димеры всегда стремятся выгнуться из стенки микротрубочки. При этом нарушится целостность стенки и начнётся процесс её разборки, который непосредственно повлияет на степень жёсткости микротрубочки. От этих искривлений ГДФ-димеров спасают ГТФ-димеры, которые «натягивают» ГДФ-димеры и не позволяют ему выгибаться. Ранее экспериментально было показано влияние присутствия ГТФ-димеров на жёсткость микротрубочки, однако детальные механизмы этого процесса остаются неясными.
Модель, разработанная Ильей Коваленко вместе с коллегами, продемонстрировала влияние длины свободной нити протофиламента на степень её жёсткости: наращивание нити на основе димера тубулина со временем приводит к отклонению и закручиванию только концевой области нити от положения центра масс димеров. Такое изменение формы связано с влиянием продольных внешних связей между тубулиновыми димерами. Это наблюдается для димеров как с ГТФ-, так и с ГДФ-молекулами.
Также результатом моделирования стал вывод о влиянии типа молекулы (ГТФ или ГДФ) на степень гибкости внешних, но не внутренних связей для отдельной нити. До момента замены в димере тубулина ГТФ на ГДФ его внешние связи слабее внутренних на величину связи с одной фосфатной группой. При встраивании новых димеров тубулина в стенку микротрубочки ей энергетически выгоднее выпрямлять свободные искривлённые протофиламенты с ГТФ-молекулами, чем более жёсткие с ГДФ-молекулами.
Однако различие в степени сопротивления протофиламентов к выпрямлению для димеров с ГТФ и ГДФ молекулами не столь значительно, как считалось ранее. Это ставит под сомнение представление о решающей роли процесса замены ГТФ молекул на ГДФ в димере тубулина.
Если добавить во внутреннюю среду клетки препараты, замедляющие процесс присоединения нитей димеров тубулина не только с ГТФ-молекулами, но и с ГДФ-молекулами, можно добиться замедления роста микротрубочек. Такое химическое управление трубочками позволяет проводить терапию новообразований и нейродегенеративных заболеваний.
Тубулин Одина помог разобраться в эволюции ядерных клеток
Эукариоты, или ядерные — самые сложноустроенные из живых клеток, давшие начало всем многоклеточным существам. Биологи узнали об их возникновении больше благодаря изучению тубулина Одина — белка клеточного скелета одного из «архей Асгарда», ближайших родственников эукариот.
Микротрубочки и молекула кинезина, которая тащит вдоль них везикулу / © John Leibler
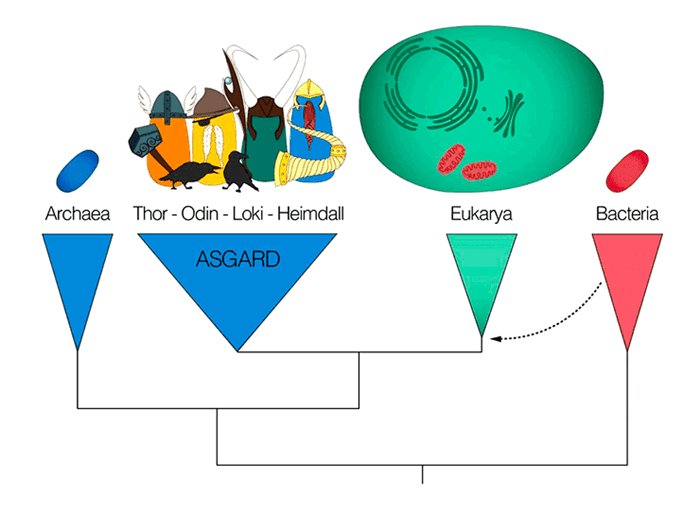
Современные биологи разделяют все живое на три группы по типу организации клетки — это так называемые домены жизни. К первому относят бактерии, просто устроенные микробы без ядра. Второй домен — эукариоты, сложные клетки с ядром и другими органеллами, к которым относят различных протистов и всех многоклеточных (включая растения и животных).
Третью группу выделили намного позже других — это археи (их раньше еще называли архебактерии), сильно напоминающие бактерии по размеру и строению клеток. Они тоже очень мелкие, всегда одноклеточные и лишены ядра. Однако, когда ученые побольше узнали об устройстве архей на молекулярном уровне, были удивлены: эти клетки совмещают в себе отдельные свойства и бактерий, и эукариот.
С помощью термочувствительных флуоресцентных сенсоров ученые измерили температуру внутри клеток и выяснили, что «слипание» молекул бета-амилоида (одна из причин развития болезни Альцгеймера) вызыва.
На самом деле, археи стали прародителями всех эукариот, включая человека. На заре эволюции, более 2,7 миллиарда лет назад, начался один из самых важных и устойчивых симбиозов. Тогда некоторые бактерии поселились внутри крупной археи, став ее митохондриями (позднее также хлоропластами растений) — так и возникли первые ядерные клетки. Выходит, все животные и растения «населены» древними микробами, ставшими их неотъемлемой частью.
Важной вехой в понимании этих давних событий стало открытие асгардархей, то есть «архей из Асгарда». Асгард — огороженный город богов в скандинавской мифологии. Такие археи представляют собой ближайших родственников эукариот и имеют с ними общие черты. Отдельные группы этих «кузенов» эукариот назвали в честь скандинавских богов Локи, Тора, Одина и Хеймдалля.
В центре внимания нового исследования японских ученых оказались одинархеи — часть одноклеточного Асгарда, названная в честь Одина — верховного божества, шамана и мудреца. Авторы статьи в Science Advances сосредоточились на одном из белков одинархеи, живущей в черных курильщиках, — тубулине Одина. Тубулин образует длинные микротрубочки, часть клеточного скелета. своеобразной «клеточной арматуры», которая нужна для поддержания формы клетки, ее деления и направленного транспорта веществ.
Возникновение тубулина стало важным этапом на пути усложнения клеток и их эукариотизации — перехода к ядерной структуре. Лишь благодаря ней на Земле появились все многоклеточные существа, включая растения, грибы и животных. Как правило, бактерии и археи лишены тубулина, однако одинархеи, как оказалось, имеют похожий на него (то есть гомологичный) белок — тубулин Одина.
Биохимики тщательно исследовали его с помощью криоэлектронной микроскопии, специфических красителей и молекулярного моделирования. Они обратили особое внимание на процесс сборки микротрубочек и смогли сделать довольно неожиданные выводы.
«Структура его филамента (нитевидного комплекса, образованного тубулином Одина, — Прим. ред.) оказалась неожиданной. Диаметр составил 100 нанометров — это намного больше, чем у тубулина эукариот, — поделился Акихиро Нарита (Akihiro Narita) из Университета Нагои (Япония). — Архитектура также уникальна. Молекулы сначала полимеризуются в небольшие дуги, а затем собираются в нечто вроде спиральной пружины. Мы можем рассматривать эту структуру как переходное звено эволюции между FtsZ (гомологом тубулина у бактерий, который также способен полимеризоваться в виде колец) и тубулином растений и животных».
Авторы заключают, что функциональный тубулин впервые возник еще у одинархеот и по большому счету унаследован эукариотами в готовом виде. Выходит, жесткий и прочный тубулин появился раньше первых ядерных клеток и стал их важной предпосылкой. Это могло быть связано с увеличением генома древних клеток — в процессе деления им приходилось перемещать все большие грузы на большие расстояния.
Читайте также:
