Вены плода. Развитие венозного кровообращения у эмбриона
Добавил пользователь Morpheus Обновлено: 30.01.2026
Рева И.В. 1, 2 Гармаш А.И. 1 Садовая Я.О. 1 Шиндина А.Д. 1 Индык М.В. 1 Калинин И.О. 1 Шек Л.И. 1 Фургал А.А. 1 Сорокин В.А. 1 Рева Г.В. 1, 2
Для создания фундаментальной платформы по внедрению клеточных технологий в лечение сосудистой патологии необходимо исчерпывающее знание и понимание процессов эмбрионального васкулогенеза и механизмов постнатального ангиогенеза. Противоречивые данные не только по механизмам индукции и ингибирования развития сосудов, но и источников развития эндотелия, противоречия в сроках эмбрионального васкулогенеза, и даже по размерам эмбриона в разные сроки, особенно в самый ранний сразу после имплантации, тормозят развитие не только ангиологии, но и трансплантологии. Клеточные взаимодействия в условиях васкулогенеза изучены в эксперименте на лабораторных животных, а полученные результаты только условно могут быть экстраполированы на человека. На материале эмбриона человека установлено, что васкулогенез в различных органах имеет морфологические отличия, в сердце, печени и нервной трубке кровеносные сосуды отсутствуют, а первичные капилляры идентифицируются в экто- и мезенхиме. Идентификация клеток с рецепторами CD68 и CD163 свидетельствует об их участии в морфо- и васкулогенезе. Полученные данные об особенностях васкулогенеза в различных органах эмбриона человека способствуют пониманию органной специфичности эндотелия.
1. Kupatadze D.D., Nabokov V.V., Malikov S.A., Polozov R.N., Kanina L.Ia., Veselov A.G. Current problems in the reconstructive surgery of the locomotor apparatus in children //Vestn. Khir. Im. I.I. Grek. 1997; 156(2):94-6.
2. Brewster L., Robinson S., Wang R., Griffiths S., Li H., Peister A., Copland I., McDevitt T. Expansion and angiogenic potential of mesenchymal stem cells from patients with critical limbischemia // J. Vasc. Surg. 2017 Mar; 65(3):826-838.e1. DOI: 10.1016/j.jvs.2015.02.061.
3. Banin VV. Role of pericytes in mechanism of vessel neovascularisation in the regenerating connective tissue // Morfologiia. 2004; 125(1):45-50.
5. Liu X., Li Q., Niu X., Hu B., Chen S., Song W., Ding J., Zhang C., Wang Y. Exosomes Secreted from Human-Induced Pluripotent Stem Cell-Derived Mesenchymal Stem Cells Prevent Osteonecrosis of the Femoral Head by Promoting Angiogenesis // Int J Biol Sci. 2017 Feb 6; 13(2):232-244. DOI: 10.7150/ijbs.16951.
6. Tournois C., Pignon B., Sevestre M.A., Al-Rifai R., Creuza V., Poitevin G., Franсois C., Nguyen P. Cell therapy in critical limb ischemia: A comprehensive analysis of two cell therapy products // Cytotherapy. 2017 Feb; 19(2):299-310. DOI: 10.1016/j.jcyt.2016.10.013.
7. Nguyen H.L., Boon L.M., Vikkula M. Vascular Anomalies Caused by Abnormal Signaling within Endothelial Cells: Targets for Novel Therapies // Semin Intervent Radiol. 2017 Sep; 34(3):233-238. DOI: 10.1055/s-0037-1604296.
8. Varazashvili M.N., Mchedlishvili G.I. The hematocrit in the microcirculatory bed of the brain // Fiziol. Zh SSSR Im I.M. Sechenova. 1991 Jun; 77(6):12-9.
9. Mchedlishvili G.I. Disturbances of the normal structuring of the blood flow in the microvessels as the cause of hemorheological disorders // Fiziol. Zh Im I M Sechenova. 1996 Dec; 82(12):41-7.
11. Catani L., Sollazzo D., Bianchi E., Ciciarello M., Antoniani C., Foscoli L., Caraceni P., Giannone F.A., Baldassarre M., Giordano R., Montemurro T., Montelatici E., D’Errico A., Andreone P., Giudice V., Curti A., Manfredini R., Lemoli R.M. Molecular and functional characterization of CD133 + stem/progenitor cells infused in patients with end-stage liver disease reveals their interplay with stromal liver cells // Cytotherapy. 2017 Sep 13. pii: S1465-3249(17)30660-6. DOI: 10.1016/j.jcyt.2017.08.001.
12. Dreyer C.H., Kjaergaard K., Ditzel N., Jоrgensen N.R., Overgaard S., Ding M. Optimizing combination of vascular endothelial growth factor and mesenchymal stem cells on ectopic bone formation in SCID mice // J Biomed Mater Res A. 2017 Sep 6. DOI: 10.1002/jbm.a.36195.
13. Caporali A., Martello A., Miscianinov V., Maselli D., Vono R., Spinetti G. Contribution of pericyte paracrine regulation of the endothelium to angiogenesis // Pharmacol Ther. 2017 Mar; 171:56-64. DOI: 10.1016/j.pharmthera.2016.10.001.
14. Mathiyalagan P., Liang Y., Kim D., Misener S., Thorne T., Kamide C.E., Klyachko E., Losordo D.W., Hajjar R.J., Sahoo S. Angiogenic Mechanisms of Human CD34 + Stem Cell Exosomes in the Repair of Ischemic Hindlimb // Circ Res. 2017 Apr 28; 120(9):1466-1476. DOI: 10.1161/CIRCRESAHA.116.310557.
15. Rigato M., Fadini G.P. Circulating stem/progenitor cells as prognostic biomarkers in macro- and microvascular disease. A narrative review of prospective observational studies.//Curr Med Chem. 2017 Sep 20. DOI: 10.2174/0929867324666170920154020.
17. Wu Q.H., Ma Y., Ruan C.C., Yang Y., Liu X.H., Ge Q., Kong L.R., Zhang J.W., Yan C., Gao P.J. Loss of osteoglycin promotes angiogenesis in limb ischaemia mouse models via modulation of vascular endothelial growth factor and vascular endothelial growth factor receptor 2 signalling pathway // Cardiovasc Res. 2017 Jan; 113(1):70-80. DOI: 10.1093/cvr/cvw220.
20. Guerin C.L., Rossi E., Saubamea B., Cras A., Mignon V., Silvestre J.S., Smadja D.M. Human very Small Embryonic-like Cells Support Vascular Maturation and Therapeutic Revascularization Induced by Endothelial Progenitor Cells // Stem Cell. 2017 Aug; 13(4):552-560. DOI: 10.1007/s12015-017-9731-7.
21. Welt K., Schippel K., Mironov V.A., Mironov A.A., Alimov G.A., Bobrik I.I., Banin V.V., Karaganov J.L. Vascular endothelium (review). I. General morphology. 2A: histogenesis of the vascular endothelium // Gegenbaurs Morphol Jahrb. 1990; 136(2):163-99.
22. Kang J.M., Yoon J.K., Oh S.J., Kim B.S., Kim S.H. Synergistic Therapeutic Effect of Three-Dimensional Stem Cell Clusters and Angiopoietin-1 on Promoting Vascular Regeneration in Ischemic Region // Tissue Eng Part A. 2017 Sep 26. DOI: 10.1089/ten.TEA.2017.0260.
23. Banin V.V., Muller F.S. Effect of hydrogen peroxide on the permeability of the walls of the mesenteric venules for fluorescein // Fiziol Zh SSSR Im I M Sechenova. 1988 Aug; 74(8):1149-57.
24. Calderon G.A., Thai P., Hsu C.W., Grigoryan B., Gibson S.M., Dickinson M.E., Miller J.S. Tubulogenesis of co-cultured human iPS-derived endothelial cells and human mesenchymal stem cells in fibrin and gelatin methacrylate gels // Biomater Sci. 2017 Jul 25; 5(8):1652-1660. DOI: 10.1039/c7bm00223h.
26. Du W., Zhang K., Zhang S., Wang R., Nie Y., Tao H., Han Z., Liang L., Wang D., Liu J., Liu N., Han Z., Kong D., Zhao Q., Li Z. Enhanced proangiogenic potential of mesenchymal stem cell-derived exosomes stimulated by a nitric oxide releasing polymer // Biomaterials. 2017 Jul; 133:70-81. DOI: 10.1016/j.biomaterials.2017.04.030.
28. Bikfalvi A. History and conceptual developments in vascular biology and angiogenesis research: a personal view // Angiogenesis. 2017 Jul 24. DOI: 10.1007/s10456-017-9569-2.
29. Putman D.M., Cooper T.T., Sherman S.E., Seneviratne A.K., Hewitt M., Bell G.I., Hess D.A. Expansion of Umbilical Cord Blood Aldehyde Dehydrogenase Expressing Cells Generates Myeloid Progenitor Cells that Stimulate Limb Revascularization // Stem Cells Transl Med. 2017 Jul; 6(7):1607-1619. DOI: 10.1002/sctm.16-0472.
30. Rossi E., Smadja D., Goyard C., Cras A., Dizier B., Bacha N., Lokajczyk A., Guerin C.L., Gendron N., Planquette B., Mignon V., Bernabеu C., Sanchez O., Smadja D.M. Co-injection of mesenchymal stem cells with endothelial progenitor cells accelerates muscle recovery in hind limb ischemia through an endoglin-dependent mechanism // Thromb Haemost. 2017 Aug 3; 117(10). DOI: 10.1160/TH17-01-0007.
31. Кнорре А.Г. Краткий очерк эмбриологии человека с элементами сравнительной, экспериментальной и патологической эмбриологии. – 1967. – С. 202–209.
32. Robertson D.J. Congenital arteriovenous fistulae of the extremities // J. Cardiovasc Surg (Torino). 1965 Sep-Oct; 5(6):Suppl:237-40.
Врожденные пороки развития сосудов являются причиной приблизительно 20 % смертей в неонатальном периоде, а также занимают значительное место в практике акушерства и гинекологии, медицинской генетике, детской хирургии и ортопедии, патологической анатомии [1]. Аномалии развития артерий и вен, такие как агенезия, аплазия, артериальные и венозные аневризмы, недоразвитие клапанного аппарата вен возникают при нарушении образования сосудистых стволов. По данным Brewster L., Robinson S., Wang R., Griffiths S., Li H., Peister A., Copland I., McDevitt T. (2017) нарушения ангиогенеза, критичные для жизни, наблюдаются среди населения в 1 % случаев [2], а связанные с заболеванием периферических артерий – в 10 % [3–5]. При этом традиционные варианты реваскуляризации возможны только у 50 % пациентов, остальным потребуются методы клеточной терапии, с использованием клеток костного мозга, мезенхимальных стволовых клеток (мск), обладающих большим потенциалом в качестве альтернативы реваскуляризационной терапии [6]. Nguyen H.L., Boon L.M., Vikkula M. (2017) указывают на то, что возникают сосудистые аномалии как следствие неправильного развития и регуляции ангиогенеза [7]. Исследуя ангиогенез, Varazashvili M.N., Mchedlishvili G.I. (1991), Mchedlishvili G.I. (1996) пришли к выводу, что агрегация эритроцитов вызывает нарушения кровотока и ишемию [8–10].
Знания о патофизиологических основах сосудистых аномалий резко возросли за последние 5 лет, дополнив теорию эмбриогенеза сосудистой системы молекулярно-генетическими находками [11]. Нарушения общих внутриклеточных сигнальных путей, часто активирующие мутации, по мнению автoров новых концепций, вызывают эндотелиальную клеточную дисфункцию [12–14]. Mathiyalagan P., Liang Y., Kim D., Misener S., Thorne T., Kamide C.E., Klyachko E., Losordo D.W., Hajjar R.J., Sahoo S. (2017) большую роль отводят СD34+ стволовым клеткам, которые, по их мнению, способны через паракринную секрецию влиять на ангиогенез. Подавляя и одновременно модулируя экспрессию генов, участвующих в ангиогенезе, ответственных за синтез сосудистого эндотелиального фактора роста, ангиопоэтина 1 и ангиопоэтина 2 (ANG1, ANG2), metallopeptidase 9 (MMP9), thrombospondin 1(TSP1), они оказывают терапевтический эффект при ишемии задних конечностей у мыши, что может быть перспективным для экстраполяции в медицинскую практику [15].
Предметом острых дискуссий является вопрос происхождения эндотелия. Rigato M., Fadini G.P. (2017) считают, что циркулирующие прогениторные клетки (circulating progenitor cells, СРС) и эндотелиальные прогениторные клетки (endothelial progenitor cells, ЕРС) являются незрелыми клетками, участвующими в сосудистой регенерации и связанными со многими аспектами макро-и микрососудистых заболеваний [16]. Lu W., Li X. (2017) считают стволовые/прогениторные клетки (VSCs) выполняющими ключевую роль в развитии организма и важным источником всех видов сосудистых клеток, необходимых для создания, поддержания, регенерации и ремоделирования кровеносных сосудов. Авторы выделяют четыре основных типа VSCs, в том числе эндотелиальные прогениторные клетки (Ерс), гладкие мышечные прогениторные клетки (SMPCs), перициты и мезенхимальные стволовые клетки (Мск) [17]. Lin C.S., Lue T.F. (2013) подвергают сомнению роль перицитов, как стволовых, с учётом экспериментальных доказательств их ингибирующих ангиогенез свойств и функционального разнообразия [18]. Мезенхимальные стволовые клетки (мск) существуют в большинстве тканей взрослого человека и располагаются вблизи или внутри кровеносных сосудов. Ibrahim M., Richardson M.K. (2017) свидетельствуют о важности изучения ангиогенеза, так как состояние этого вопроса тормозит развитие трансплантологии, методов репаративной регенерации во всех областях медицины, и на современном этапе имеет недостаточность в изучении на материале человека [19]. Guerin C.L., Rossi E., Saubamea B., Mignon V., Silvestre J.S., Smadja D.M. (2017), подтвердив результаты Банина В.В., Куприянова В.В., Karaganov J.L., Мчедлишвили, Welt с соавторами [20] выдвинули концепцию реваскуляризации критически ишемизированной конечности за счёт выделенных из костного мозга мелких эмбрионально подобных плюрипотентных эндотелиальных прогениторных клеток, способных дифференцироваться в эндотелиоциты с терапевтическим реваскуляризационным потенциалом [21].
Поскольку ангиодисплазии не относятся к казуистическим находкам, существует острая необходимость разработки стратегий консервативного лечения на основе клеточных технологий. Однако, по данным Kang J.M., Yoon J.K., Oh S.J., Kim B.S., Kim S.H. (2017), в клинической практике использование взрослых стволовых клеток имеет ряд ограничений, таких, как низкая выживаемость клетки и низкая терапевтическая эффективность [22]. Несмотря на значительные успехи в изучении ангиогенеза, наличие нескольких противоречивых концепций развития сосудов в теле эмбриона человека (из мезенхимы и целома), а также участия в ангиогенезе циркулирующих ангиобластов, свидетельствуют о том, насколько далека эта проблема от решения. Множество концепций ангиодисплазий учитывают экзо- и эндогенные, молекулярно-генетические, метаболические и другие факторы, которые на современном этапе не получили окончательного подтверждения, а теория эмбриогенеза сосудистой системы требует значительной доработки, поэтому гистогенез эндотелия на современном этапе является одной из важнейших проблем васкуло- и ангиогенеза [23]. Calderon G.A., Thai P., Hsu C.W, Grigoryan B., Gibson S.M., Dickinson M.E., Miller J.S. (2017) подтвердили исследования Banin V.V. [24]. Jeong H.W., Hernfndez-Rodriguez B., Kim J., Kim K.P., Enriquez-Gasca R., Yoon J., Adams S., Scholer H.R., Vaquerizas J.M., Adams R.H. (2017) указывают, что молекулярные механизмы, регулирующие эндотелиальную активность клеток на различных этапах сосудистого роста, ремоделирования, созревания и покоя, остаются неясными [25]. Васкуло- и ангиогенез представляют собой сложные процессы, которые требуют скоординированных изменений в эндотелиальных клетках [26]. Многочисленные гипотезы происхождения эндотелиоцитов трактуют их развитие в связи с теорией трех зародышевых листков [27]. Существенная роль кровеносных сосудов в тканях и органах человека, понимание функциональных свойств и основополагающей молекулярной основы VSC имеет решающее значение для фундаментальных исследований [28]. Современное неудовлетворительное состояние данных по вопросу эмбрионального ангиогенеза определило направление нашего исследования.
Цель исследования – изучить кровеносные сосуды эмбриона человека в эмбриональном периоде.
Материалы и методы исследования
Исследование выполнено с учётом положений Хельсинской декларации (2000) и с разрешением этического комитета ФГАОУ ВО «Дальневосточный федеральный университет». Биоптаты эмбрионов были получены в соответствии с приказом Минздравмедпрома РФ от 29.04.94 № 82 «О порядке проведения патологоанатомических вскрытий» и в соответствии с номенклатурой клинических лабораторных исследований МЗ РФ (приказ 21 февраля 2000 г. № 64). Изучен материал эмбрионов человека 3, 5, 8 недель эмбрионального развития. Распределение материала представлено в табл. 1.
Вены плода. Развитие венозного кровообращения у эмбриона
Развитие венозной системы плода плода. Формирование вен эмбриона
В предыдущей статье о развитии сосудистой системы в общем уже были описаны закладки первичной венозной системы, приводящей кровь в сердце (кардинальные вены, или кувиеров проток — venae cardinales или ductus Cuvieri, передние кардинальные и задние кардинальные вены — venae praecardinales et postcardinales), а кровь из эмбрионального тела — во внеэмбриональные области (пупочные вены — venae umbilicales и пупочно-брыжеечные вены — venae omphalomesentericae, соединяющееся в общий желточно-пупочный путь -tractus vitelloumbilicalis).
Все эти сосуды открываются в венозный синус — sinus venosus, и в течение эмбриональной жизни подвергаются сложным преобразованиям, причем некоторые из них частично или же полностью исчезают, видоизменяются или же перемещаются, в некоторых случаях соединяются при помощи вновь образованных анастомозов. Ниже будут описаны только наиболее важные процессы развития, происходящие при этом.
Передние кардинальные вены — venae praecardinales приводят кровь в сердце из верхних, краниальных отделов тела, а задние кардинальные вены — venae postcardinales — из нижних, каудальных областей. Обе пары этих сосудов располагаются по бокам тела вентральнее нисходящих (дорсальных) аорт.
В заднюю кардинальную вену открываются латеральные ветви, приводящие сюда кровь из мезонефроса. Однако эти образования вскоре оказываются недостаточными, в связи с этим возникают два новых продольных венозных ствола — нижние кардинальные вены (venae subcardinales), располагающиеся на медиальной стороне мезонефроса. Между задними кардинальными венами и нижними кардинальными венами возникают множественные анастомозы, а верхние концы нижних кардинальных вен открываются в задние кардинальные вены вблизи кувиерова протока.
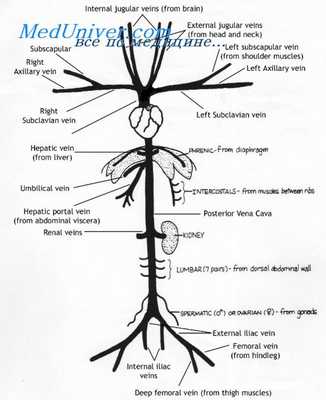
Обе нижние кардинальные вены приблизительно в своих средних отделах, в области, располагающейся каудаль-нее пупочно-брыжеечных вен (ниже печеночной области), со временем образуют широкий взаимный анастомоз, в то время как анастомозы с задними кардинальными венами исчезают в результате постепенной облитерации. Правая нижняя кардинальная вена становится более крупной и краниально врастает в закладку печени, соединяясь здесь с системой печеночных синусоидов, образовавшихся уже ранее из пупочно-брыжеечных вен (желточных вен) путем врастания в эти вены балочек печеночного эпителия, которые их расчленяют. Из этого отдела правой нижней кардинальной вены таким образом возникает краниальная часть нижней, каудальной, полой вены, а именно ее нижний кардинальный и печеночный отделы (первичная нижняя полая вена — vena cava caudalis primitiva).
Между каудальными концами задних кардинальных вен возникает сильный анастомоз, в который открываются образовавшиеся между тем вены, отводящие кровь из нижних конечностей (наружные подвздошные вены — venae iliacae externae). В дорсальных отделах тела, дорсальнее задних кардинальных вен, развивается еще одна пара венозных стволов — верхние кардинальные вены — venae supracardinales, которые своими краниальными и каудальными концами также открываются в задние кардинальные вены.
В поясничной области верхние кардинальные вены по обоим сторонам тела образуют первоначально короткий анастомоз с нижними кардинальными венами (нижне-верхний кардинальный анастомоз). В течение краткого промежутка времени кровь из каудальных отделов тела, таким образом, поступает в сердце одновременно по трем путям: по первоначальным задним кардинальным венам, по вновь образованной первичной нижней полой вене (сформировавшейся из правой нижней кардинальной вены) и по верхним кардинальным венам.
Оба новых венозных ствола (нижние кардинальные вены) становятся более крупными и отводят все больше крови, в ущерб задним кардинальным венам, которые по этой причине постепенно атрофируются и, за исключением малых остатков, подвергаются, наконец, обратному развитию.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Вены верхней конечности эмбриона. Развитие нижней полой вены плода
Вены верхней конечности вначале представляют собой лишь часть общего поверхностного венозного сплетения шеи и грудной клетки, кровь из которых отводится по кардинальным венам. На свободном крае развивающейся почки конечности вскоре появляется краевая вена, преаксиальная и постаксиальная части которой называются соответственно v. cephalica и v. basilica.
Отведение крови из верхней конечности и грудной клетки позднее осуществляется подключичной веной — постепенно увеличивающимся сосудом, связывающим v. basilica с передней кардинальной веной. В развивающуюся подключичную вену впадает самая большая вена грудной клетки — v. thoraco-epigastrica, которая у взрослого человека сохраняется в качестве v. thoracalis lateralis.
Система нижней полой вены. Системные вены в нижней части тела изменяются значительно более радикально, чем в верхней. Одновременно с мезонефросами дегенерируют и задние кардинальные вены. Нижняя полая вена, которая заменяет кардинальные вены, — это сложный сосуд, постепенно формирующийся в результате расширения и удлинения вначале небольших местных сосудов в связи с дегенерацией задних кардинальных вен.
Появление субкардинальных вен приводит к отклонению посткардинального кровотока. Образуются они вдоль вентромедиальных поверхностей мезонефросов и проходят параллельно посткардинальным венам немного вентральнее их. В районе средних частей мезонефросов они сообщаются друг с другом при помощи мелких сосудов, которые вскоре срастаются, образуя интерсубкардинальный анастомоз.
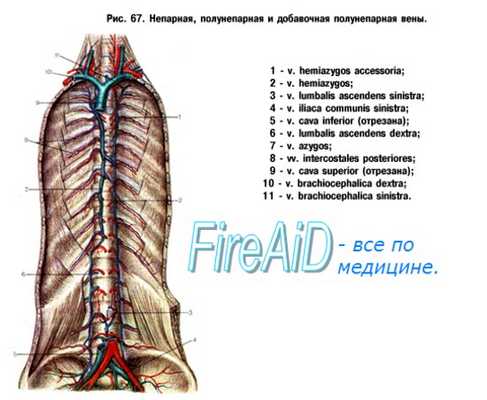
С увеличением своих размеров этот анастомоз вместе с объединенными таким образом субкардинальными венами образует большой медиальный венозный синус, называемый субкардинальным синусом. После образования этого синуса мелкие сосуды, связывающие суб- и посткардинальные вены, направляются большей частью в медиальном направлении в задние кардинальные вены.
Головной конец мезонефроса расположен рядом с печенью. Складка ткани задней стенки тела, расположенная справа от первичной дорзальной брыжейки, рано создает своего рода мостик между этими двумя органами. Эта складка называется plica cavae брыжейки. В ней, как и в любом месте растущего тела, проходит большое количество мелких сосудов.
В печени этот новый путь крови вначале проходит по извилистым мелким сосудам, вступая в конце концов в венозный синус (sinus venosus) вместе с кровью из желточно-брыжеечных вен. С увеличением объема проходящей по этому пути крови в печени постепенно образуется большой сосуд. Этот новый сосуд постепенно смещается к поверхности и в конце концов превращается в большую вену, расположенную в углублении на дорзальной стороне печени.
Эта вена составляет печеночную часть нижней полой вены. Из субкардинального синуса наиболее прямой путь к этому новому сосуду проходит через правую субкардинальную вену. Таким образом, уже у шестинедельных эмбрионов образование нижней полой вены начинается формированием ее предпочечной части, состоящей ис субкардинального синуса, части правой субкардинальной вены и новых сосудов, проходящих через брыжейку и через печень.
Особенности кровообращения плода. Плацентарное кровообращение
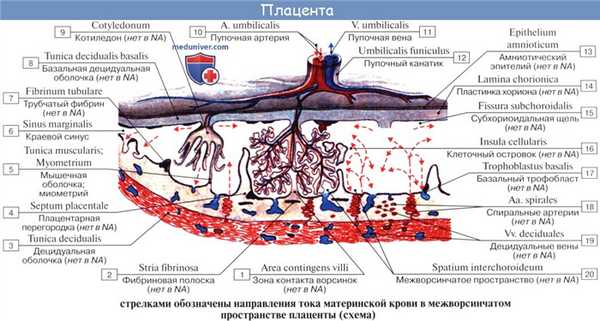
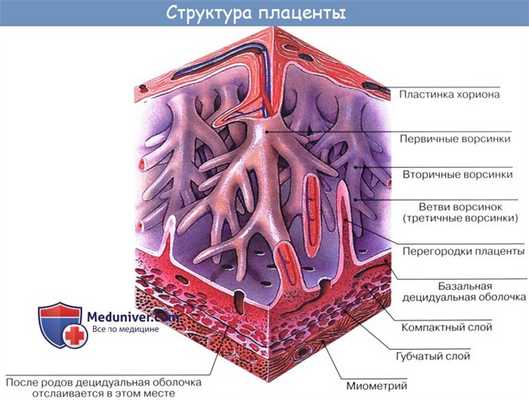
Кислород и питательные вещества доставляются плоду из крови матери при помощи плаценты — плацентарное кровообращение. Оно происходит следующим образом. Обогащенная кислородом и питательными веществами артериальная кровь поступает из плаценты матери в пупочную вену, которая входит в тело плода в области пупка и направляется вверх к печени, ложась в ее левую продольную борозду. На уровне ворот печени v. umbilicalis делится на две ветви, из которых одна тотчас впадает в воротную вену, а другая, называемая ductus venosus, дроходит по нижней поверхности печени до ее заднего края, где впадает в ствол нижней полой вены.
Тот факт, что одна из ветвей пупочной вены доставляет печени через воротную вену чистую артериальную кровь, обусловливает относительно большую величину печени; последнее обстоятельство связано с необходимой для развивающегося организма функцией кроветворения печени, которая преобладает у плода и уменьшается после рождения. Пройдя через печень, кровь по печеночным венам вливается в нижнюю полую вену.
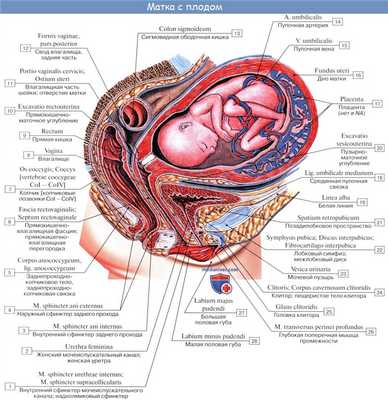
Таким образом, вся кровь из v. umbilicalis или непосредственно (через ductus venosus), или опосредованно (через печень) попадает в нижнюю полую вену, где примешивается к венозной крови, оттекающей по vena cava inferior от нижней половины тела плода.
Смешанная (артериальная и венозная) кровь по нижней полой вене течет в правое предсердие. Из правого предсердия она направляется заслонкой нижней полой вены, valvula venae cavae inferioris, через foramen ovale (расположенно в перегородке предсердий) в левое предсердие. Из левого предсердия смешанная кровь попадает в левый желудочек, затем в аорту, минуя не функционирующий еще легочный круг кровообращения.
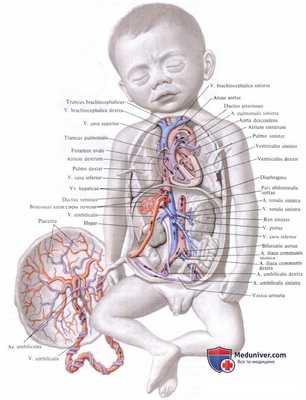
В правое предсердие впадают, кроме нижней полой вены, еще верхняя полая вена и венозный (венечный) синус сердца. Венозная кровь, поступающая в верхнюю полую вену от верхней половины тела, далее попадает в правый желудочек, а из последнего в легочный ствол. Однако, вследствие того что легкие еще не функционируют как дыхательный орган, только незначительная часть крови поступает в паренхиму легких и оттуда по легочным венам в левое предсердие. Большая часть крови из легочного ствола по ductus arteriosus переходит в нисходящую аорту и оттуда к внутренностям и нижним конечностям.
Таким образом, несмотря на то что вообще по сосудам плода течет смешанная кровь (за исключением v. umbilicalis и ductus venosus до его впадения в нижнюю полую вену), качество ее ниже места впадения ductus arteriosus значительно ухудшается. Следовательно, верхняя часть тела (голова) получает кровь, более богатую кислородом и питательными веществами. Нижняя же половина тела питается хуже, чем верхняя, и отстает в своем развитии. Этим объясняются относительно малые размеры таза и нижних конечностей новорожденного.
Акт рождения представляет скачок в развитии организма, при котором происходят коренные качественные изменения жизненно важных процессов. Развивающийся плод переходит из одной среды (полость матки с ее относительно постоянными условиями: температура, влажность и пр.) в другую (внешний мир с его меняющимися условиями), в результате чего коренным образом изменяются обмен веществ, а также способы питания и дыхания. Вместо питательных веществ, получаемых ранее через кровь, пища поступает в пищеварительный тракт, где она подвергается пищеварению и всасыванию, а кислород начинает поступать не из крови матери, а из наружного воздуха благодаря включению органов дыхания. Все это отражается и на кровообращении.
При рождении происходит резкий переход от плацентарного кровообращения к легочному. При первом вдохе и растяжении легких воздухом легочные сосуды сильно расширяются и наполняются кровью. Тогда ductus arteriosus спадается и в течение первых 8 — 10 дней облитерируется, превращаясь в ligamentum arteriosum.
Пупочные артерии зарастают в течение первых 2 — 3 дней жизни, пупочная вена — несколько позднее (6 — 7 дней). Поступление крови из правого предсердия в левое через овальное отверстие прекращается тотчас после рождения, так как левое предсердие наполняется кровью, поступающей сюда из легких, и различие в давлении крови между правым и левым предсердиями выравнивается. Закрытие овального отверстия происходит значительно позднее, чем облитерация ductus arteriosus, и часто отверстие сохраняется в течение первого года жизни, а в 1/3 случаев — всю жизнь. Описанные изменения подтверждены исследованием на живом с помощью рентгеновских лучей.
Учебное видео анатомия кровообращения у плода
N!B! На видео - 4:02 ОШИБКА: "Лёгочные вены несут артериальную кровь из лёгких в правое предсердие."
ВЕРНО: Лёгочные вены несут артериальную кровь из лёгких в ЛЕВОЕ предсердие.
На видео всё правильно, но комментатор перепутал. Другие видео уроки по данной теме находятся: Здесь
Кровообращение плода: мать и ребенок – единая система
Это — естественные шунты, «шунты во спасение» растущего плода. Без них плод оказывается нежизнеспособным, а при их преждевременном закрытии возникают тяжелейшие врожденные пороки. В хирургии врожденных пороков сердца искусственное (временное или постоянное) создание таких шунтов является одним из широко применяющихся способов лечения. Но об этом — позже.
Сброс слева направо
Когда определенный объем крови с каждым сокращением отклоняется от нормального пути и уходит из левых отделов в правые, то, естественно, возникают две проблемы: недостаток крови в большом круге и — переполнение круга малого. Большой круг при этом не страдает: быстро включаются сложные механизмы компенсации. А вот малому кругу приходится тяжелее.
Сброс справа налево и цианоз
После рождения ребенка сердце, как и при пороках со сбросом слева-направо, работает с перегрузкой, особенно его правые отделы, и мы поговорим об этом, когда будем описывать отдельные пороки. Но здесь мы хотим подчеркнуть, что само существование цианоза может быть опасным, так как недостаточное содержание кислорода в артериальной крови вызывает ее сгущение, увеличение числа эритроцитов и может привести к закупорке мелких сосудов тела, в том числе и мозга со всеми вытекающими последствиями.
Понятие о перекрестном сбросе
В некоторых ситуациях, когда дефекты в перегородках достаточно большие, а сопротивление кровотоку почти одинаковое на выходе из обоих желудочков, кровь может частично перетекать через дефект в обоих направлениях в различные фазы сердечного цикла. То есть в какой-то отрезок времени в ходе одного сокращения имеется сброс слева-направо, а в другой отрезок в ходе того же цикла, но через несколько долей секунды происходит сброс справа-налево.
В таких случаях говорят о «перекрестном сбросе», и степень недосыщения артериальной крови кислородом будет зависеть от преимущественного направления тока крови. Соответственно видимой и выраженной будет степень цианоза.
Скажем здесь, что к порокам с таким «перекрестным сбросом» относятся чаще всего очень сложные, комбинированные пороки, включающие сочетания разных нарушений развития сердца.
Препятствия кровотоку
Врожденные препятствия нормальному кровотоку обычно возникают вследствие неправильного развития в местах соединений сердечных камер друг с другом или с магистральными сосудами. Чаще всего это относится к клапанам. Сужение называют «стенозом», если оно вызвано изменением клапанов, а когда это касается аорты, то говорят о ее «коарктации».
Подробно мы разберем это ниже, но здесь хочется отметить несколько моментов, касающихся кровотока. Поскольку к восьмой неделе внутриутробной жизни плода сердце, в основном, сформировано и кровообращение уже происходит, то влияние сужения, затруднения нормальному кровотоку сказывается уже на ранних стадиях развития эмбриона. Если больше никаких дефектов нет, то желудочкам приходится работать с повышенной нагрузкой, результатом которой станет утолщение стенок, уменьшение размеров полости, недоразвитие сердечных камер. После рождения эти явления только прогрессируют и могут стать жизнеопасными уже в первые дни жизни ребенка.
Если такие препятствия сочетаются с дефектами в перегородках, то сердцу легче работать, т.к. есть другие пути для крови, в которых сопротивление меньше и поток выбирает такие пути меньшего сопротивления.
Но мы уже вплотную подошли к классификации пороков, т.е. к тому, какие пороки бывают и что при этом происходит с ребенком, справляется ли сердце с ними и каким образом.
Цитируется по книге Г. Э. Фальковский, С. М. Крупянко. Сердце ребенка. Книга для родителей о врожденных пороках сердца
Читайте также:
- Лечение синдрома Туретта. Лечение поздних дискинезий.
- Пренатальная диагностика при многоплодной беременности. Выявление монозиготной многоплодной беременности. Диагностика многоплодия.
- Лучевая диагностика артериовенозной мальформации конуса спинного мозга
- Лучевые признаки мультикистозной дисплазии почки у плода
- Микробиологическое исследование при прободных ранениях глазного яблока
