Влияние лучевой терапии на плод беременной
Добавил пользователь Дмитрий К. Обновлено: 29.01.2026
Кафедра акушерства и гинекологии Московского факультета Российского государственного медицинского университета
Кафедра акушерства и гинекологии факультета послевузовского профессионального образования врачей Московской медицинской академии им. И.М. Сеченова
Кафедра акушерства и гинекологии №2 лечебного факультета Российского национального исследовательского университета им. Н.И. Пирогова
Кафедра акушерства и гинекологии лечебного факультета Российского национального исследовательского медицинского университета им. Н.И. Пирогова Минздрава России, Москва, Россия
Химиотерапия во время беременности: возможности и риски
Журнал: Российский вестник акушера-гинеколога. 2019;19(3): 81‑85
Беременность, ассоциированная с онкопатологией, является актуальной проблемой современного акушерства. Ежегодно регистрируется от 17 до 38 новых случаев заболевания на 100 000 родов. Возможность пролонгирования беременности определяется индивидуально и зависит от срока гестации, распространенности опухолевого процесса и желания пациентки. В I триместре рекомендованы прерывание беременности и проведение стандартной комплексной терапии. Со II триместра лечебные мероприятия включают хирургическое и медикаментозное воздействие. Химиотерапия возможна и относительно безопасна после окончания периода эмбриогенеза. Схемы и дозы применяемых препаратов идентичны разработанным для небеременных пациенток. Последний курс химиотерапии должен быть завершен не позднее 3-й недели перед родоразрешением. В статье представлена информация о специфике действия химиопрепаратов и рисках, связанных с их применением на фоне беременности.
Термин «беременность, ассоциированная с онкопатологией», подразумевает обнаружение злокачественного новообразования на фоне гестации и/или в течение 1 года после родов. Впервые опухоли диагностируются в 17—38 наблюдениях на 100 000 беременных. Среди всей патологии наиболее часто встречаются рак молочной железы, рак шейки матки и лимфопролиферативные заболевания [1]. Смещение периода деторождения в сторону старшего репродуктивного возраста рассматривается в качестве ведущей причины роста частоты выявления онкологической патологии у беременных [1, 2]. Прогнозы течения болезни во многом определяются сроком беременности, при котором был поставлен диагноз. При своевременном начале терапии, как правило, прогноз не ухудшается, однако отсроченное лечение значительно снижает 5-летнюю выживаемость [1].
Согласно российским и международным рекомендациям, в I триместре показано прерывание беременности. Со II триместра возможно проведение системной химиотерапии по схемам, разработанным для небеременных пациенток [1—3].
Химиотерапия во время беременности
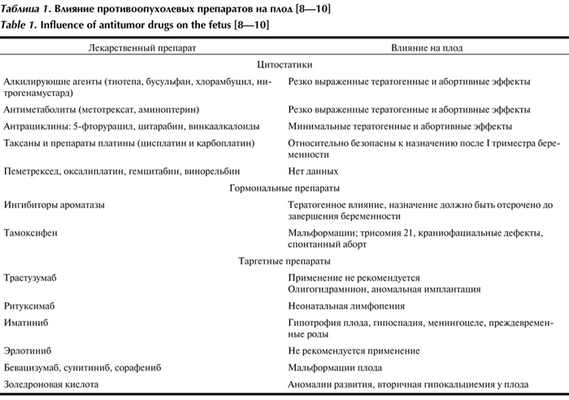
Согласно классификации FDA, все лекарственные средства, применяемые во время беременности, разделяются по категориям их безопасности. Химиотерапевтические препараты отнесены к категории X, т. е. противопоказаны в связи с эмбрио- и тератогенным воздействием. Накопленный опыт свидетельствует о том, что использование данных препаратов возможно после завершения периода эмбриогенеза. Наиболее уязвимым является интервал с 5-й по 10-ю неделю, в период эмбриогенеза, когда применение антиметаболитов и алкилирующих агентов приводит к грубым порокам развития в 16% наблюдений. Введение одного цитостатика в I триместре повышает риск развития пороков до 10%, а нескольких — до 25% [4]. После 12 нед проведения химиотерапии не повышается риск возникновения пороков развития у плода, но ассоциировано с акушерскими осложнениями (задержка роста плода, преждевременные роды, анте- и интранатальная гибель плода, подавление гемопоэтических клеток) в 27% [4—6] (табл. 1). Таблица 1. Влияние противоопухолевых препаратов на плод [8—10]
Органогенез продолжается до 10-й недели беременности, а становление функций головного мозга продолжается на протяжении всего периода гестации. Поэтому и головной, и спиной мозг остаются потенциально уязвимыми. Пока нет достаточных данных для суждения о рисках и отдаленных последствиях нейротоксичного действия внутриутробной химиотерапии [7].
Физиологические изменения, происходящие во время беременности, влияют на всасывание, распределение, метаболизм и экскрецию лекарственных средств. В связи с увеличением объема циркулирующей крови и снижением концентрации альбумина значительно изменяются процессы распределения и клиренса препаратов [6]. Повышение уровня эстрогенов и прогестерона приводит к изменению функционирования микросомальной оксидазной системы печени и скорости трансформации лекарственных средств [11, 12]. Увеличение сердечного выброса и объема крови на 50% (в основном за счет увеличения объема плазмы на 45%) приводит к росту перфузии, скорости клубочковой фильтрации в почках и скорости почечной элиминации. Появление нового третьего пространства, представленного околоплодными водами, приводит к увеличению объема распределения и снижению концентрации препаратов в системном кровотоке [6, 12]. Любое лекарственное средство, которое вводится матери, в некоторой степени может проникать через плаценту [13].
Плацента выступает в качестве биологического барьера, а также может влиять на метаболизм лекарственных средств за счет имеющихся в ее структуре ферментов. Трансплацентарный перенос любых веществ осуществляется путем пассивной диффузии, активного транспорта, облегченной диффузии, фагоцитоза или пиноцитоза [14, 15]. Трансплацентарный перенос химиотерапевтических препаратов в основном происходит путем пассивной диффузии, зависящей от градиента концентрации препарата между материнской и фетальной циркуляцией и скоростью плацентарного кровотока. Вещества с низкой молекулярной массой (500 г/моль), жирорастворимые и не связанные с белком-переносчиком, легко преодолевают плацентарный барьер [16]. На материнской поверхности плаценты экспрессируются специфические белки-транспортеры, такие как Р-гликопротеин (P-GP: MDR 1/ABCB1), белок резистентности рака молочной железы (BCRP/ABCG2), белки 1—3 и 5 множественной лекарственной резистентности (MRP 1—3 и 5/ABCC1—3 и 5), которые способствуют перемещению химиопрепаратов [14, 17].
Наиболее эффективным является еженедельное введение химиопрепарата, что позволяет снизить концентрацию лекарственного вещества в крови и риск его токсического действия. Побочные эффекты химиотерапии можно купировать за счет использования безопасных противорвотных средств, ондансетрона или метоклопрамида [18]. Противорвотные средства (прометазин, селективные блокаторы серотонина — 5-HT, антагонисты нейрокинина-1 — NK1 и дроперидол) в сочетании с дифенгидрамином или дексаметазоном используются для купирования выраженной тошноты и рвоты [1].
Проведение химиотерапии заканчивают за 3 нед до предполагаемых родов, так как препараты вызывают супрессию костного мозга у плода, повышая вероятность развития сепсиса, тяжелой анемии, кровотечения и смерти новорожденного [5].
Химиотерапия при беременности, ассоциированной с раком яичников
Схемы лечения беременных, больных раком яичников, не должны отличаться от разработанных для данной патологии. Назначается стандартная схема химиотерапии: паклитаксел с карбоплатином. Исследования, проведенные на моделях животных, показали, что таксаны не влияют на органогенез и когнитивные функции. Однако способность этих препаратов проникать через трансплацентарный барьер у человека до конца не известна [18]. Концентрация циклофосфамида в амниотической жидкости составила 25% от его уровня в материнской плазме [18]. Цисплатин накапливается в амниотической жидкости в количествах до 13%, а карбоплатин от 2,2 до 23,7% от плазменной концентрации. Доксорубицин, проникая трансплацентарно, накапливается в легких, печени и почках плода. Трансплацентарный переход паклитаксела незначителен и составляет около 5% от введенной дозы [19, 20].
Из препаратов платины при лечении рака яичников наиболее часто используют цисплатин и карбоплатин. Платиносодержащие препараты оказывают тератогенное действие и могут приводить к антенатальной гибели плода. Они легко проникают через плаценту, циркулируя в пуповинной крови плода и у новорожденного [21]. Карбоплатин является платиносодержащим препаратом второго поколения, его побочные эффекты менее выражены, в связи с чем применение препарата у беременных предпочтительно. Карбоплатин и паклитаксел во второй половине беременности могут быть использованы в терапии больных раком яичников. Стартовые дозы не отличаются от таковых вне беременности, но на фоне терапии проводится их корректировка в зависимости от показателей крови [22].
Химиотерапия при беременности, ассоциированной с раком шейки матки
Согласно рекомендациям Международного Консенсуса по «гинекологическим ракам», проведение неоадъювантной химиотерапии (НАХТ) рака шейки матки во время беременности рекомендовано [23, 24] в следующих ситуациях:
1. При IB 1-й стадии, в отсутствие метастазов в регионарных лимфатических узлах и размерах опухоли менее 2 см НАХТ возможна со II триместра.
2. При IB 1-й стадии и размерах опухоли 2—4 см НАХТ может быть назначена пациенткам, у которых отсутствуют метастазы в регионарных лимфатических узлах, либо тем больным, у которых лимфаденэктомия не была выполнена.
3. При IB2—IIB стадиях НАХТ проводится для пролонгирования беременности до периода жизнеспособности плода.
В большинстве наблюдений НАХТ включает платиносодержащие препараты: цисплатин (50—100 мг/м 2 ) в монорежиме или в комбинации с паклитакселом (175 мг/м 2 ) каждые 3 нед [25]. Эффективна также комбинация цисплатина (75 мг/м 2 ) с ифосфамидом 2 г/м 2 каждые 2 нед [26, 27]. Терапия должна быть завершена за 3 нед до предполагаемого родоразрешения.
В случае инвазивного рака шейки матки методом родоразрешения является кесарево сечение корпоральным разрезом.
Ведение беременности
В большинстве случаев на фоне химиотерапии проводится рутинное наблюдение, аналогичное таковому при физиологическом течении беременности. Дополнительными являются мониторинг за состоянием плода (кардиотокография после 33 нед беременности) и допплерометрия маточно-плацентарного кровотока (до начала курса химиотерапии и через 2 дня после него) [1, 7]. Проведение химиотерапии сочетается с угнетением красного ростка кроветворения, что сопровождается развитием анемического синдрома. Для оценки степени его выраженности и эффективности лечения проводится дополнительное исследование клинического анализа крови с оценкой уровня ферритина. На фоне и после окончания курса химиотерапии проводится биохимическое исследование крови для оценки функции печеночных ферментов.
В ряде случаев (особенно при терапии больных с лимфопролиферативными заболеваниями) целесообразно использование низкомолекулярных гепаринов под контролем показателей свертывающей системы крови.
В идеале родоразрешение должно проводиться после 37 нед. Метод определяется акушерскими показаниями и опухолевым процессом. При раке молочных желез, мочевого пузыря, лимфопролиферативных процессах возможны влагалищные роды. При инвазивном раке шейки матки проводится оперативное родоразрешение. Оно предпочтительно при наличии метастазов в трубчатых костях (риск переломов), в ЦНС (противопоказаны потуги), при раке шейки матки и вульвы [18].

После родов химиотерапия может быть начата через 7 дней. В табл. 2 суммированы Таблица 2. Акушерская тактика при ведении беременных с онкопатологией базовые положения по наблюдению беременных с онкозаболеваниями [1, 5, 7, 12, 17, 22].
Заключение
Одной из сложных и противоречивых проблем в онкологии является ведение беременных со злокачественными новообразованиями. В структуре смертности женщин репродуктивного возраста онкологические заболевания занимают второе место, а частота сочетания опухолей и беременности достигает 1:1000 [10]. Беременность теоретически может оказывать влияние на течение опухолевого процесса за счет гормональных, иммунологических и микроциркуляторных изменений. Физиологические изменения, связанные с увеличением объема циркулирующей крови, снижением уровня белков, появлением третьего пространства (околоплодные воды), могут оказывать влияние на терапевтические эффекты проводимого лечения.
Согласно Российскому законодательству, постановка диагноза злокачественного новообразования в I триместре беременности является показанием к ее прерыванию. После 14 нед, когда процессы органогенеза завершены, возможно проведение химиотерапии без риска эмбриотоксического и тератогенного действия. Выбор препаратов зависит от гистологического типа опухоли и проводится согласно разработанным нормативам для небеременных пациенток. Последний курс химиотерапии должен быть завершен не позднее чем за 3 нед перед родами для предотвращения развития у ребенка миелосупрессии и вторичных инфекционных осложнений. В случае первичного выявления заболевания после 32 нед проведение химиотерапии нецелесообразно, так как один курс лечения не окажет существенного влияния на прогноз. Сроки родоразрешения должны быть максимально приближены к доношенным (более 37 нед); раннее (34—37 нед) и очень раннее (до 34 нед) преждевременное родоразрешение проводится только по абсолютным показаниям у матери и плода.
Влияние лучевой терапии на плод беременной
Кафедра акушерства и гинекологии лечебного факультета Российского национального исследовательского медицинского университета им. Н.И. Пирогова
филиал ГБУЗ ГКБ №24 Департамента здравоохранения Москвы «Перинатальный центр», Москва, Россия
Кафедра акушерства и гинекологии лечебного факультета Российского государственного медицинского университета
Кафедра акушерства и гинекологии лечебного факультета ФГБОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России, Москва, Россия
Влияние ионизирующего излучения на плод
Цель исследования — провести систематический анализ данных, имеющихся в современной литературе, относительно рисков развития патологии плода в результате воздействия ионизирующего излучения в ходе диагностических или лечебных процедур. Материал и методы. В обзор включены данные статей по выбранной теме, опубликованные в Pubmed за последние 10 лет. Результаты. Внутриутробная радиочувствительность зависит от гестационного возраста, максимальна она в период органогенеза. Анализ данных показал, что при использовании ионизирующего излучения, доза которого не превышает 100 мГр, риск негативного влияния на плод минимален. Заключение. При беременности желательно избегать воздействия ионизирующего излучения, но в случае крайней необходимости проведения диагностических или лечебных процедур доза, полученная плодом, не должна превышать 100 мГр.
Воздействие ионизирующего излучения сопровождается увеличением риска спонтанных абортов, развития микроцефалии, задержки умственного развития и, возможно, развития онкологических заболеваний в течение жизни [1]. В связи с этим абсолютно логичным кажется, что согласно Федеральному закону «О радиационной безопасности населения» № 3-ФЗ от 09.01.96: «На период беременности и грудного вскармливания ребенка женщины должны переводиться на работу, не связанную с источниками ионизирующего излучения».
До момента нидации влияние радиации, как и других факторов, происходит по принципу «все или ничего», т. е. эмбрион или погибает, или формируется нормально. Существуют убедительные доказательства увеличения риска гибели эмбриона в предымплантационный период под действием облучения, причем при дозах менее 100 мГр частота летальных эффектов ионизирующего излучения очень мала.
Результаты многих исследований свидетельствуют о том, что внутриутробная радиочувствительность зависит от гестационного возраста с максимальной чувствительностью в период органогенеза. На основе данных, полученных на лабораторных животных, сделан вывод о наличии пороговой дозы облучения для индукции мальформаций, равной 100 мГр. Чаще всего аномалии связаны с центральной нервной системой. Суммарный риск нарушений развития плода и возникновения онкологических заболеваний в детском и юношеском возрасте при экспозиции радиации в дозе 0,1 Гр составляет приблизительно 3% (что сопоставимо с популяционными значениями). Поэтому воздействие радиации в дозе менее 0,1 Гр не может быть показанием к прерыванию беременности [2].
При анализе данных по исследованию выживших после атомных бомбардировок в отношении формирования тяжелой умственной отсталости у детей, подвергшихся внутриутробному облучению в наиболее чувствительный период внутриутробного развития (10—17 нед беременности), было показано, что порог дозы для развития такого повреждения находится на уровне как минимум 300 мГр. Облучение в дозе менее 100 мГр на уровень IQ и частоту мальформаций у ребенка однозначно не влияет [3].
Лучевая диагностика
Существовало мнение, что ионизирующее излучение уже при дозах 10 мГр может вызывать нарушение органогенеза у плода, а также увеличивать риск развития онкологических заболеваний у ребенка после рождения вплоть до подросткового возраста. Однако по результатам систематического обзора, проведенного в 2008 г., не было выявлено статистически значимой связи между пренатальным воздействием рентгеновских лучей и развитием онкологических заболеваний у ребенка (отношение рисков 0,99; 95% доверительный интервал 0,78—1,13) [4]. В Швеции в 2007 г. было проведено крупное исследование, в ходе которого были обследованы 652 ребенка, рожденных у матерей, подвергавшихся во время беременности диагностической рентгенографии. Частота лейкозов у этих детей не отличалась от таковой в контрольной группе [5].
В ходе крупного долгосрочного исследования J. Ray и соавт. [6] оценивали риск развития онкологических заболеваний у детей, подвергшихся внутриутробному воздействию ионизирующего излучения при проведении матери компьютерной томографии или радионуклидной диагностики. Статистически значимой связи между лучевой экспозицией и риском онкологических заболеваний у детей (ОШ (отношение рисков) 0,69; 95% ДИ (доверительный интервал) — 0,26—1,82) выявлено не было.
По данным Международной комиссии по радиологической защите, риск развития злокачественных новообразований равняется приблизительно одному случаю на 500 плодов, подвергшихся излучению в дозе 30 мГр. При этом пожизненный риск развития рака после внутриутробного облучения будет таким же, как и после облучения в раннем детском возрасте, т. е., по крайней мере, в 3 раза выше, чем у населения в целом [7].
Таким образом, в зависимости от возможного воздействия на плод, дозы ионизирующего излучения можно разделить следующим образом:
— до 100 мГр — безопасная для плода;
— 100—300 мГр — возможно повреждающее действие на плод;
— более 300 мГр — высока вероятность пороков развития, задержки роста и гибели плода, поэтому после воздействия такой дозы радиации в I триместре беременности следует поставить вопрос об искусственном прерывании беременности.
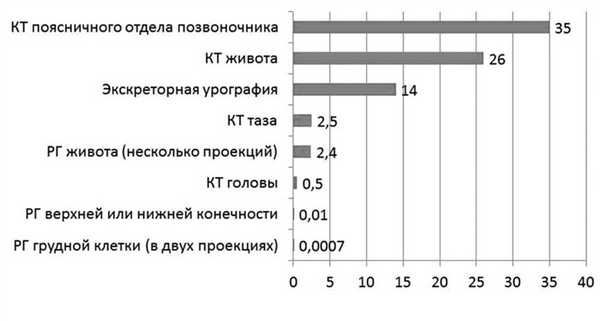
Большинство диагностических процедур, основанных на воздействии ионизирующего излучения (рентгенологическое обследование, флюорография), характеризуются дозировкой излучения менее 50 мГр (см. рисунок) Поглощаемая плодом доза ионизирующего излучения при проведении рентгенологических исследований (мГр) [8]. (например, доза для плода при рентгенографии грудной клетки составляет менее 1 мкГр, при флюорографии — 1,5 мкГр), поэтому даже при проведении нескольких рентгенологических исследований подряд вероятность неблагоприятного воздействия на плод крайне низка. Так, компьютерная томография (КТ) характеризуется довольно высокой дозой излучения (поскольку проводится серия рентгеновских снимков, излучение, сопровождающее каждый из них, суммируется). Поэтому К.Т. во время беременности должно выполняться по строгим показаниям, хотя риск для плода также невысок. Согласно современным рекомендациям, этот метод исследования имеет свою нишу при беременности. КТ рекомендуют проводить при сомнении в диагнозе острый аппендицит, подозрении на тромбоэмболию легочной артерии, при серьезных травмах, а в некоторых случаях и при необходимости уточнения строения и формы таза. При этом во всех случаях перед проведением этой процедуры с пациенткой необходимо провести беседу и информировать ее о потенциальных рисках для плода, получив с нее информированное согласие на манипуляцию [8].
Американская коллегия радиологов даже опубликовала меморандум о том, что ни одна диагностическая процедура, основанная на рентгеновском облучении, не угрожает здоровью и развитию эмбриона и плода. Несмотря на это, флюорография и рентгеновское исследование во время беременности должны проводиться только при наличии строгих показаний.
Лучевая терапия
Лучевую терапию, учитывая риск формирования пороков развития у плода, во время беременности используют редко. Дозы облучения, применяемые при лучевой терапии, составляет 30—70 Гр, что в 100—1000 раз выше, чем при диагностических процедурах. Соответственно, при невозможности отложить лучевую терапию нужно использовать методы экранирования плода. Кроме того, роль играет расстояние между зоной облучения и дном матки. Если это расстояние превышает 30 см, периферическая доза облучения для плода составит 0,04—0,2 Гр. При высоком стоянии дна матки (III триместр беременности, многоплодная беременность и т. д.) периферическая доза облучения для плода может превысить 2 Гр [11, 12].
В связи с этим риск для плода минимален при облучении опухолей, локализующихся выше диафрагмы (опухоли головы и шеи, рак молочной железы), а при раке шейки матки лучевая терапия несовместима с жизнеспособностью плода [2, 12].
В 2009 г. S. Luis и соавт. [13] провели анализ 109 случаев лучевой терапии при беременности. Средний период наблюдения за детьми составил 37 мес. Было зафиксировано 13 наблюдений неблагоприятного завершения беременности (2 самопроизвольных аборта, 6 наблюдений перинатальной гибели, 1 случай нейросенсорной тугоухости, случай затруднения в обучении и сколиоза, 1 наблюдение сочетания крипторхизма и дефекта межжелудочковой перегородки, 1 наблюдение гипоспадии, а также случай нарушения психомоторного развития).
Радиоизотопная терапия
Радиоактивные вещества даже при их однократном поступлении в организм беременной могут надолго задерживаться в нем, переходить через плацентарный барьер и быть источником облучения плода. Особенно значимо поражаются у беременной гормональная, иммунная и репродуктивная системы. Влияние на эти системы обусловлено тем, что в период гестации в организме беременной происходят значительные изменения в эндокринной системе, за счет угнетения адаптивного иммунитета смещается иммунное равновесие, а в репродуктивной системе (в матке) развивается плодное яйцо, элементы которого с различной интенсивностью и специфичностью накапливают отдельные радионуклиды.
Такие радиоактивные элементы, как 131 I, 32 P, 134 Cs излучают α-, β-, γ-лучи, обладающие различной проникающей способностью. Существуют следующие пути передачи радионуклидов: 1) гематогенный ( 131 I, 32 P, 134 Cs); 2) накопление радионуклидов в тканях плаценты с последующим воздействием на плод (трансурановые элементы); 3) параплацентарный переход через плодные оболочки и околоплодные воды (радиоактивный плутоний).
Беременность является противопоказанием к терапии радиоизотопами, за исключением случаев, когда без проведения терапии существует риск для жизни пациентки.
Некоторые радиоизотопы, включая 131 I в виде иодида и 32 Р в виде фосфата, быстро проходят через плаценту, поэтому перед проведением терапии радиоактивными препаратами следует исключить беременность. На практике, так как рак щитовидной железы обладает относительно низкой агрессивностью течения, и хирургическое, и радиоизотопное лечение можно отсрочить до родов.
На ранних сроках беременности наиболее опасным для плода является γ-излучение радиоактивного йода, скапливающегося в мочевом пузыре. Доза, которая действует на плод при радиоизотопной терапии при беременности, составляет приблизительно 50—100 мкГр на 1 МБк от введенного препарата. Дозу можно снизить, рекомендовав пациентке обильное питье и частое мочеиспускание.
В сроке более 10 нед щитовидная железа может накапливать йод, что может приводить как к аблации щитовидной железы плода, так и к индукции в дальнейшем у него рака щитовидной железы [14].
Таким образом, при беременности желательно избегать воздействия ионизирующего излучения, но в случае крайней необходимости проведения диагностических или лечебных процедур доза, полученная плодом, не должна превышать 100 мГр.
Влияние радиации на плод беременной
Первоочередная задача лучевой терапии (ЛТ) у беременных — определение ее возможного влияния на плод и новорожденного. Бесспорно, что эмбрион наиболее чувствителен к облучению; это особенно касается дифференцирующихся клеток и их высокой митотической активности. Генетические изменения или гибель эмбриональной клетки приводят к врожденным аномалиям или гибели плода.
Существует мнение, что облучение плода и женских гонад способствует развитию репродуктивных осложнений каку матери, так и ребенка.
Радиобиология
Доза, воздействующая на плод, зависит от значений дозы радиации, проникающей в наддиафрагмальные ткани. Также во время облучения головы коллиматором может происходить рассеивание. Zucali и соавт. использовали тканеэквивалентный фантом, чтобы определить дозу рассеянного излучения, которая поглощалась маткой. Доза, поглощенная дном матки, составила 1,5 % суммарной дозы. Такой же эффект возникает и при экранировании живота.
Предполагают, что доза радиации 0,01 Гр приводит к образованию 5 мутаций в каждом миллионе генов.
Большинство мутаций рецессивные, и до совпадения они не выявляются у первого и последующих поколений. Большинство генетических нарушений определяют эмпирически. Установлено, что скорость возникновения генетических мутаций удваивается, если в период от рождения до окончания репродуктивного возраста человек получает 0,25—1,5 Гр.
Значения установленных допустимых доз радиации постоянно меняются. Некоторые эксперты считают, что в первые 30 лет максимальной дозой облучения может быть 0,14 Гр; другие — 0,19 Гр или менее, включая фоновую радиацию и применяемую в медицинской практике. Превышение 2 Гр в первые 20 нед. беременности ведет к развитию врожденных аномалий плода (микроцефалия и задержка умственного развития).
Дозы, превышающие 3 Гр, увеличивают риск самопроизвольного аборта. Если женщина хочет сохранить беременность, проведение ЛТ рекомендуется отложить как минимум до середины II триместра. Доза радиации, получаемая плодом при облучении наддиафрагмальных органов во время беременности, составляет 1,2— 7,1 % суммарной дозы облучения.
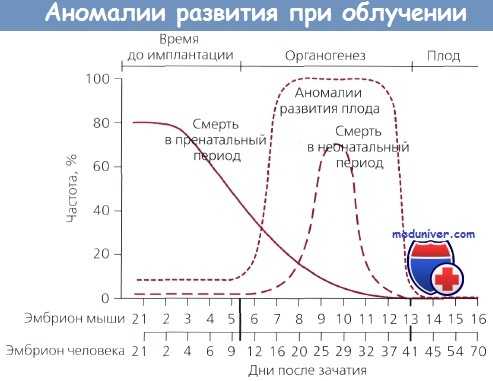
Частота аномалий развития, пренатальной и неонатальной смерти у мышей при получении дозы 2 Гр в разные периоды беременности.
На нижней шкале — эквивалентные стадии эмбриона человека по классификации Rugh.
Нарушения, вызванные облучением
Ткани эмбриона обладают различной чувствительностью к облучению. Наиболее часто облучение вызывает микроцефалию и другую патологию ЦНС, а также нарушения в строении глаза и скелета. Точное прогнозирование рисков в соответствии с дозой облучения невозможно. Любое облучение, особенно гонад, приводит к генетическим изменениям — разрывам хромосом с последующей транслокацией, потерей, делецией и нарушением сцепления хромосом.
Как правило, эффект кумулятивный; изменения прямо пропорциональны суммарной дозе. К сожалению, нет никаких пороговых значений для генетических нарушений. Даже относительно небольшая доза радиации может привести к нежелательным генетическим мутациям.
Как отмечалось ранее, значение экспозиционной дозы, приводящей к аномалиям развития плода, спорно. Hammer-Jacobsen предполагал, что доза 0,1 Гр, полученная в первые 6 нед. беременности, — пороговая величина, после которой необходим искусственный аборт. Другие авторы считают, что минимальный уровень повышается по мере увеличения срока беременности.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Влияние лучевой диагностики на плод беременной
Установлено, что диагностическая визуализация метастазов с использованием лучевой энергии и лечение злокачественных новообразований с помощью лучевой терапии (ЛТ) влекут за собой существенный риск для плода. Поэтому во время беременности у больных РМЖ рекомендуют откладывать лучевую терапию (ЛТ) до родов, не проводить исследование сторожевого узла, при использовании доз более 0,05—0,1 Гр прерывать беременность.
Эти рекомендации не основываются, однако, на достаточных знаниях о влиянии радиации на плод. Хотя при лучевой терапии (ЛТ) применяют высокие дозы радиации, наибольший риск как для основной популяции, так и для группы онкологических больных имеют диагностические процедуры. Во время I и II триместров беременности следует избегать большинства рентгенодиагностических процедур.
Сила воздействия на плод и гонады зависит от рода процедур и мер безопасности. Суммарная доза облучения составляет 0,0003 Гр на каждую рентгенограмму грудной клетки, а при ирригоскопии гонады и таз получают суммарную дозу 0,06 Гр. Вследствие большой дозы и площади облучения ирригоскопию не назначают беременным.
Международная комиссия по защите от радиоактивного излучения подготовила два доклада, посвященных облучению беременных во время диагностического обследования. Сведения о биологических эффектах пренатального облучения эмбриона и плода были получены из экспериментов на животных, данных о выживших после ядерных взрывов, данных о внутриутробном воздействии на детей рентгеновских лучей и данных о детях, подвергнутых внутриутробному облучению вследствие аварии в Чернобыле.
В таблице показаны ожидаемые последствия влияния радиации на плод; летальность, врожденные пороки, врожденное слабоумие и развитие злокачественных новообразований.
Ионизирующее излучение. Рентгеновские лучи или ионизирующая радиация при КТ создают изображение, проходя через тело. В других диагностических процедурах используются радиоактивные препараты, которые задерживаются в тканях, а затем элиминируются.
Неионизирующее излучение. При УЗИ и МРТ используется неионизирующее излучение, однако теоретически риск для плода остается. При абсорбции ультразвукового облучения тканями наблюдается тепловой эффект, а при стимулирующем движении ультразвука наблюдают механический эффект.
Как тепловой, так и механический эффект регистрируют лишь при высокоинтенсивной ультразвуковой эхографии; при диагностической ультразвуковой эхографии со стандартной мощностью отрицательных биологических эффектов не возникает. Возможное повреждение клеток при МРТ может произойти из-за экспозиции сильным статическим магнитным полем. Кроме того, радиочастоты, используемые для генерации последовательных импульсов, могут вызывать нагревание тканей.
При диагностической МРТ создаются статические магнитные поля 0,1 — 1,5 Т. Считается, что магнитные поля до 2 Т не оказывают отрицательного влияния и не дают физиологического эффекта. Вредные воздействия МРТ или отсроченные осложнения у плода не могут быть выявлены немедленно.
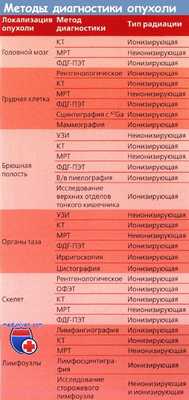
В таблице справа представлены методы диагностики злокачественных заболеваний при планировании лечения.
Ионная или неионная йодированная контрастная среда, используемая при КТ, по-видимому, безопасна для плода; однако йодированные контрастные вещества применяли лишь в исследованиях на животных. Эти вещества относятся к препаратам категории В. Во время беременности не рекомендуют использовать гадолиний, т. к. он проникает через плацентарный барьер, фильтруется почками плода и заглатывается с амниотической жидкостью.
Гадолиний — препарат категории С. Однофотонная эмиссионная КТ улучшает точность сцинтиграфии костей. МРТ — самый чувствительный метод изучения костного мозга, в то время как КТ весьма чувствительна к кортикальным изменениям. Позитронно-эмиссионная томография с 2-[фтор-18] фтор-2-дезокси-D-глюкозой все чаще используется для обнаружения метастазов. Поскольку влияние этого вещества на плод неизвестно, во время беременности эту диагностическую процедуру не проводят.
Влияние радионуклидов на плод беременной
Радиоактивный йод концентрируется в щитовидной железе плода. К 11 —12-й неделе беременности начинается синтез тироксина. Доза радиации, доставляемая 2 мкКи 131I к щитовидной железе плода, составляет 100—400 Гр. Stoffer и Hamburger провели обследование 237 женщин, которым во время беременности было введено от 10 до 150 мкКи 131 I.
У 55 больных по медицинским показаниям был проведен искусственный аборт. У остальных 182 беременных наблюдалось 2 самопроизвольных аборта, 2 мертворождения и 2 новорожденных имели абдоминальные аномалии или нарушения в строении грудной клетки. У 6 (3 %) младенцев был обнаружен гипотиреоз, при этом 4 новорожденных страдали умственной отсталостью. Во время беременности противопоказано введение 131 I.
Опасно ли рентген-исследование при беременности
Рентгенологические исследования проводятся для определения наличия каких-либо патологий, новообразований или болезней. Для этого используется направленный пучок электромагнитных волн заданной длины и частоты. Он проходит сквозь органы человека, ткани которых по-разному отражают и поглощают его.
Благодаря этой разнице можно увидеть различные аномалии. Результат отправляется на экран или записывается на специальную пленку.
При профилактическом осмотре данное обследование проводится в специальном кабинете. В случае травмированности больного оно может применяться сразу в приемном отделении, операционной или реанимации.
Влияние облучения на плод
Рентгеновское излучение в целом не всегда полезно для организма, поскольку разрушает те его клетки, которые находятся в состоянии постоянного деления. Это приводит к уничтожению или мутациям цепочек ДНК.
В организме взрослого человека таких новообразующихся клеток не много. Но у плода на ранних стадиях развития они являются основой. Поэтому для него такое обследование довольно опасно. Наиболее вероятно наличие осложнений при использовании рентгена при беременности в первом ее триместре (начальные 12 недель).
К каким проблемам может привести рентген на ранней стадии беременности?
Ввиду постепенного развития плода в каждую неделю его существования происходит формирование будущих систем организма ребенка. Поэтому получение телом матери большого количества рентгеновского излучения на этих этапах может иметь различные серьезные последствия:
- Две первых недели. Возможна гибель эмбриона, выкидыш, внематочная беременность.
- Недели третья и четвертая. Патологии на ранней стадии развития плода, выкидыш.
- Пятая-шестая недели. Нарушения развития ряда органов и систем: щитовидная, вилочковая и половые железы; иммунная, нервная, кровеносная, эндокринная системы.
- Седьмая неделя. Повреждение печени, кишечника. Нарушение обмена веществ.
- Восьмая. Патологии развития суставов и конечностей, ротовой полости.
- Девятая неделя. Повреждения дыхательной и половой системы.
- Недели десятая и одиннадцатая. Проблемы, связанные с развитием зубов. Порок сердца.
- Двенадцатая неделя. Патологии щитовидной железы, нарушения иммунитета.
После этого срока влияние излучения на плод уменьшается, но все-таки не рекомендуется делать такое исследование вплоть до окончания беременности, за исключением случаев крайней необходимости.
Рентген на ранних сроках беременности
Врачи стараются не назначать рентген беременным, потому что даже минимальный риск вреда от излучения остается всегда. Особенно он велик в первые двенадцать недель.
Наиболее опасными для плода являются такие виды анализов:
- Рентген брюшной полости
- Рентген таза и позвоночника
- Маммография
- Флюорография
- Компьютерная томография
- Изотопное сканирование
Менее опасны такие виды рентген-исследования:
- Грудной клетки (легкие, сердце)
- Головного мозга
- Конечностей
Есть ли неопасные виды обследования?
Наиболее безопасными видами рентген-исследования считаются:
В этих случаях воздействие происходит локально, поэтому и доза облучения минимальна.
Количество излучения, которое может получить плод за два месяца, регламентируется Санитарными правилами и нормами и должно составлять не более 1 миллизиверта (мЗв).
Существуют другие виды обследований, которые можно применять вместо рентгена при беременности:
И все же врачи стараются не назначать в первом триместре беременности МРТ, поскольку статистических исследований недостаточно для уточнения его безопасности в этот период.
Что делать, если без рентгена не обойтись?
Рентген беременным может быть необходим в ситуации, когда заболевание или травма угрожают жизни и здоровью матери и ребенка, и невозможно использовать иные методы диагностики. И вред от неиспользования рентгена превышает потенциальный вред от его применения.
- Если необходимо сделать исследование области, не касающейся таза, живота или позвоночника, то их необходимо экранировать свинцовыми фартуками и накладками.
- Если на раннем сроке беременности нужно сделать рентген непосредственно через плод, то врач может предложить сделать ее прерывание, чтобы избежать мутаций и выкидыша.
- Женщина может отказаться от аборта, но в таком случае она должна понимать риск, на который идет, и те патологии, которые могут появиться у плода.
Если же есть возможность отложить использование рентгена на последний триместр или послеродовое время, то необходимо так и поступить.
На самом раннем сроке женщина может не знать о возникновении беременности. Поэтому перед рентгеном рекомендуется пройти дополнительное обследование.
Читайте также:
