Влияние лучевой терапии на сосудистое сплетение желудочков головного мозга
Добавил пользователь Дмитрий К. Обновлено: 19.01.2026
Влияние лучевой терапии на сосудистое сплетение желудочков головного мозга
Разрабатывая в течение ряда лет вопросы радиационного канцерогенеза в тканях центральной нервной системы, ученые института нейрохирургии обратили внимание на закономерное развитие у подопытных животных выраженных ликвородинамических расстройств при хроническом локальном облучении головного мозга. Это обстоятельство и явилось предпосылкой для проведения настоящего исследования, целью которого являлось изучение действия инкорпорированного в головной мозг источника бета излучения на клеточные органоиды сосудистого сплетения боковых желудочков.
Материалом для электронномикроскопического исследования послужили сосудистые сплетения от 9 кроликов-самок породы шиншилла весом 1,0—1,5 кг. В качестве источника ионизирующей радиации применяли гибкие бета-аппликаторы, приготовленные на основе сульфурированного полиэтилена с изотопами Sr90 + YBU. Пластинку аппликатора (в зависимости ОТ необходимой дозы) в виде квадратов 2X2 мм вводили в теменную область мозга кроликов справа на глубину 3—4 мм.
Подопытные животные были разделены на 3 группы -по 3 в каждой. Кроликам 1-й группы аппликатор вводили из расчета 50—60, 2-й — 70—80 рад/час. Кроликам 3-й группы (контрольная) вместо аппликатора вводили такую же ПО размерам полиэтиленовую пленку. Животные находились под наблюдением в течение 6 месяцев.
По истечении срока наблюдения животных забивали декапитацией. Материал (сосудистые сплетения) для электронно-микроскопического исследования фиксировали в 2% растворе забуфереипоп осьмисвой кислоты, обезвоживали в восходящей крепости спиртах и эфирах метакриловых кислот, заливали в полимеры в соотношении 1:4 (метил- и бутил-метакрилаты соответственно).
Срезы делали па ультратоме ЛКВ-4800; подвергали их контрастированию в 1% спиртовом растворе уранилацетата.
Для сравнительного анализа полученных данных нами изучена ультраструктура нормального сосудистого сплетения; при этом проводилось сопоставление небольших участков гроздевидной (ворсинчатой) его части на уровне капилляра.
В центре ворсинки обычно залегает крупный капилляр, окруженный со всех сторон одним слоем эпителиальных клеток, имеющих кубическую или полиэдрическую форму. Высота клеток не превышает 10—12 мк. В центре клетки располагается округлое или овальной формы ядро с хорошо выраженной нуклеонемой и равномерным распределением хроматина; имеется компактное слабо выраженное ядрышко. В гиалоплазме часто наблюдаются петли лежащего группками шероховатого ретикулума, однако такая конструкция и расположение его встречаются не во всех клетках; иногда ретикулум представлен в виде четких мелких везикул.
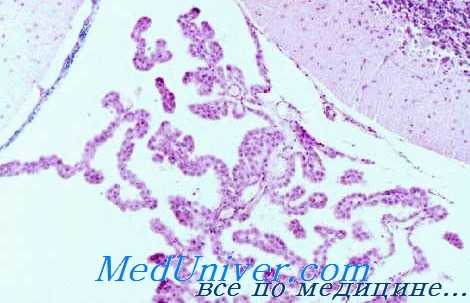
Наблюдается умеренное количество свободно лежащих рибосом. Комплекс Гольджи обычно представлен в виде уплощенных сжатых между собой пузырьков разного диаметра на поперечном срезе. Часто можно наблюдать диссеминироваппое его расположение, когда элементы комплекса группируются в 2 и даже 3 участках клетки. Обычное местоположение их — в срединной части между клеточной мембраной и ядром. Митохондрии (0,5-0,7 мк в диаметре) с довольно плотным матриксом и хорошо выраженными кристами имеют обычно удлиненную форму; длина их в 4—5 раз превышает диаметр. Располагаются они преимущественно в апикальной части клеток. Мембрана клетки, обращенная к просвету бокового желудочка, покрыта густой сетью гонких стройных микроворсинок. Иногда среди них видны единичные реснички. В отдельных клетках определяется наличие довольно крупных липидных гранул.
Согласно полученным данным, условия опыта не оказали заметного влияния на состояние капилляров, а также форму и величину расположенных вокруг них клеток.
Ультраструктурные изменения в клетках сосудистого сплетения возникают уже при облучении в дозе 50—60 рад/час. Выражаются они в следующем: ядро несколько меняет свою конфигурацию, оно хотя и остается овальным, ио линии его становятся извилистыми. Оболочка ядра менее четкая, появляются выпячивания ее наружной мембраны, образующие так называемые цистерны. Иногда возле ядра видны волокнистые структуры. Ядрышко гипертрофируется и становится более плотным. Хроматин равномерно распределен в ядре, по выглядит более рыхлым, чем в норме.
Петли эндоплазматического ретикулума несколько расходятся, теряют былую четкость рисунка; пузырьки его расширяются и превращаются в вакуоли разной формы и величины, количество рибосом на них, как и свободно лежащих в цитоплазме, заметно уменьшается,
В комплексе Гольджи наблюдается еще большая разноразмерность пузырьков, то есть одна часть чрезмерно расширяется, другая же еще больше сжимается. Пространство вокруг пего становится более плотным.
Митохондрии клеток и процессе опыта претерпевают значительные изменения. Часть митохондрий набухают, увеличиваются и становятся округлыми. Набухание сопровождается просветлением матрикса и расхождением крист но периферии. Интересен сам процесс набухания; в митохондриях появляется светлая зона (чаще в центре), которая, как бы увеличиваясь, растягивает митохондрии, придавая им шаровидную форму. Следует однако отметить, что наряду с измененнными в клетке находится много неизмененных митохондрии.
Облучение клеток сопровождается увеличением в них крупных, имеющих самую разнообразную форму липидных конгломератов, располагающихся непосредственно вблизи ядра.
Иногда микроворсинки клеточной мембраны утрачивают присущее им правильное расположение в пространстве и напоминают слои запутавшихся трубочек.
Изменения в клетках сосудистого сплетения при облучении в дозе 70-80 рад/час характеризуются большей выраженностью, но отличаются и некоторыми особенностями. В частности, в отдельных клетках появляются зоны с характерными сильно набухшими митохондриями и разрушенными кристамн; обнаруживаются структуры, напоминающие лизосомы, но с электронноплотными гранулами внутри; иногда можно видеть скопление патологически измененных митохондрий вблизи ядра. Наряду с такими грубыми деструктивными изменениями отдельных клеток, структура других клеточных элементов сплетения не претерпела каких-либо серьезных изменений.
Таким образом, бета-облучение сосудистого сплетения боковых желудочков головного мозга кроликов влечет за собой более или менее выраженные ультраструктурпые изменения и их клетках. Этот факт важен для понимания сложных патогенетических механизмов повреждающего действия ионизирующего излучения на ткани ЦНС и, в частности, на клетки сосудистого сплетения, обусловленных нарушением функционального состояния различных звеньев нервной системы.
- Вернуться в оглавление раздела "гистология"
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Радиационные поражения нервной системы
Радиационные поражения нервной системы – это группа патологий ЦНС, обусловленных воздействием различных форм ионизирующего излучения. Симптомы во многом зависят от поглощенной дозы и объема облученных тканей. В клинике могут превалировать астеновегетативный, менингеальный и интоксикационный синдромы, очаговая симптоматика, моторные и чувствительные расстройства, их комбинации. Диагностика основывается на анамнезе, результатах физикального, лабораторных, реже – аппаратных методов исследования. В ходе лечения применяются противорвотные, сосудистые, анальгетические, метаболические и гемостатические средства, плазмозаменители и препараты крови.
МКБ-10
Общие сведения
Радиационные поражения нервной системы – сравнительно редкая форма лучевой болезни (ЛБ). Низкий показатель заболеваемости обусловлен малой распространенностью потенциально опасных этиологических факторов и тем обстоятельством, что ярко выраженное поражение нервной системы возникает исключительно при сублетальных и летальных дозах облучения. На данный момент на территории бывшего СССР наиболее значимыми инцидентами, связанными с этими патологиями, являются аварии на ЧАЭС и атомных подводных лодках, непредвиденные обстоятельства при работе с радиоизотопными установками, во время которых, согласно статистическим данным, пострадало более 300 человек. Общемировой показатель находится в пределах от 20 до 200 случаев.
Причины
В основе этиологии радиационного поражения нервной системы лежит острое или хроническое воздействие ионизирующего излучения. Излучение может быть как внешним, так и внутренним – при попадании радиоактивных веществ внутрь с водой, продуктами питания или вдыхаемым воздухом, редко – путем всасывания через кожные покровы. К возможным причинам лучевого поражения ЦНС относятся:
- Непосредственная работа с радиоактивными веществами. В группу риска входят лица, трудящиеся на атомных электростанциях, в научно-исследовательских центрах и на производствах, использующих радиоактивные элементы, а также военные ученые, разрабатывающие ядерное оружие.
- Работа с медицинской аппаратурой. Включает медицинский персонал, работающий с компьютерными томографами и рентген-установками. Вероятность развития радиационного поражения ЦНС существует у врачей, проводящих лучевую терапию, и онкобольных пациентов, нуждающихся в подобном лечении.
- Пребывание в зараженной местности. В эту категорию включают людей, которые добровольно или при выполнении профессиональных обязанностей пребывают на территории с повышенным радиационным фоном – в зонах испытаний ядерного оружия, техногенных катастроф с участием радиоактивных элементов.
Механизм развития
Первичные изменения при радиационном поражении ЦНС в дозе до 50 Гр наблюдаются в синапсах, представлены «слипанием» медиаторных пузырьков, находящихся в терминальных отделах пресинаптической мембраны или в синаптической щели. Затем происходит набухание клеток нервной системы, пикноз мозжечковых зернистых клеток. В отдельных случаях эти изменения сочетаются с васкулитами, менингитами, воспалением сосудистого сплетения желудочков мозга и инфильтрацией гранулоцитами. Облучение головного мозга в дозе от 10 до 30 Гр ведет к ингибированию процессов окислительного фосфорилирования. Вероятно, это обусловлено острым недостатком АТФ, который при ЛБ расходуется на процессы репарации поврежденных ДНК.
Одномоментное облучение нервной системы в дозе, превышающей 50 Гр, оказывает прямое разрушающее воздействие на нейроны. Такая доза вызывает большое количество повреждений ядерного хроматина и избыточную активацию ферментов, отвечающих за репарацию ДНК. ДНК-лигазные реакции, протекающие в подобных условиях, характеризуются распадом АТФ до АДФ, который, в свою очередь, вместе с ферментом АДФ-трансферазой приводит к быстрому использованию всего внутриклеточного запаса НАД+. Последний в норме играет роль кофермента в процессе клеточного дыхания, распада глюкозы и обратного синтеза АТФ.
После радиационного поражения в структурах центральной нервной системы появляются признаки общего геморрагического синдрома. Морфологические характеристики процесса включают венозные застои и перерастяжения артериальных сосудов, провоцирующие выход плазмы за пределы кровеносного русла, лакунарные или обширные кровоизлияния в головной мозг. В паренхиматозных тканях ЦНС возникают воспалительные и дистрофически-некробиотические процессы. По мнению некоторых ученых, одну из ведущих ролей в развитии поражения нервной системы играет дисфункция гематоэнцефалического барьера вследствие отмирания эндотелиоцитов мозговых кровеносных сосудов.
Симптомы поражения НС
Признаки дисфункции нервной системы занимают существенную долю в симптоматике лучевой болезни только при условии одномоментного получения дозы ионизирующего излучения более 50 Гр или локального облучения области головы. В иных ситуациях они сочетаются с другими соматическими проявлениями, зависят от дозы и времени, прошедшего с момента воздействия. При ЛБ легкой и средней степени (доза – до 4 Гр) в клинической картине превалируют астенические и нервно-висцеральные симптомы. При тяжелой форме ЛБ (от 4-6 Гр и выше) в неврологическом статусе определяются общемозговые симптомы, менингеальный синдром, реже – очаговая симптоматика, нарушение координации.
Стадии
- На стадии первичной реакции у большинства больных отмечается общая слабость, повышенная утомляемость, апатия, головная боль, головокружение, бессонница, диарея, тошнота и рвота, реже – судороги. У некоторых пациентов выявляется болезненность при пальпации тригеминальных и сосудистых точек. Все вышеописанные проявления формируются в промежутке от 10 минут до 1 часа с момента поражения. Степень их выраженности и скорость возникновения напрямую определяются дозой излучения.
- Второй период – латентный или «мнимого благополучия». В нем наблюдается уменьшение интенсивности первичных симптомов без их полного исчезновения.
- Третья стадия – разгара. Она сопровождается резким усилением неврологического дефицита, формированием отека головного мозга, рассеянной симптоматикой нарушений ЦНС. Клинически сопровождается горизонтальным нистагмом, анизорефлексией, появлением патологических стопных и субкортикальных рефлексов, расстройствами функций черепно-мозговых нервов, дистонией скелетной мускулатуры, координаторными нарушениями. Зачастую этот симптомокомплекс сочетается с вегетативной дисфункцией: колебаниями артериального давления и температуры тела, гипергидрозом, гиперсаливацией.
- Последняя стадия – восстановления или стойких остаточных явлений – характеризуется крайне медленным улучшением общего состояния больного, исчезновением неврологической и интоксикационной симптоматики при сохранении вегетососудистых расстройств и астенического синдрома.
Радиационная астения
Может превалировать одна из типичных форм болезни. Радиационная астения имитирует симптомы невроза, проявляется слабостью, чрезмерной раздражительностью, утратой аппетита, тошнотой, реже – головокружением, эйфорией. В периоде разгара к ним может присоединяться гиперрефлексия, мышечная гипотония, тремор век, языка и верхних конечностей. Менингеальный синдром наблюдается у больных с тяжелыми формами лучевой болезни. При нем отмечаются нестабильные специфические симптомы Кернига и Брудзинского, гипотония скелетных мышц. Коматозная форма развивается при вовлечении в патологический процесс жизненно важных структур, отличается внезапным появлением чувства «горения» всего тела с последующей утратой сознания, сердечно-сосудистой и дыхательной недостаточностью.
Радиационная энцефалопатия
Радиационная энцефаломиелопатия может носить острый или хронический характер. В первом случае патология дебютирует атактическим синдромом, из-за чего возникает спутанность сознания, ярко выраженные менингеальные знаки. Характерная особенность – наличие очаговой симптоматики, определяющейся локализацией деструкции в ЦНС. Возможны внезапные потери сознания, многократная рвота, парезы и параличи, сочетающиеся с геморрагическим синдромом и гастроэнтероколитом. Хронический вариант этой энцефаломиелопатии может сопровождаться аналогичными симптомами, формирующимися на протяжении длительного времени.
Синдром радиационно-токсической энцефалопатии
Данная форма зачастую отмечается в период разгара и может иметь различные клинические формы. Ликвородинамическая отличается непостоянной общемозговой симптоматикой, очаговыми симптомами и когнитивными расстройствами. Гипертензионный вариант проявляется нарастающей цефалгией (в некоторых случаях – вплоть до рвоты), оболочечным синдромом, снижением рефлексов, психомоторным возбуждением. При эпилептической форме возникают приступы тонико-клонических или клонических судорог, опистотонус. Психотическая радиационная энцефалопатия характеризуется нарушением ориентации во времени и пространстве, зрительными и слуховыми галлюцинациями, кататоническим ступором.
Лучевая невралгия
Лучевая невралгия развивается при локальном поражении отдельных периферических нервов. Зачастую она комбинируется с эритематозным или буллезным дерматозом. Типичные проявления – парестезии по типу зуда, онемения, жжения и боли, носящие реактивный или спонтанный характер. Наблюдаются гипестезии, сухость кожи, локальный гипергидроз, алопеция, редко – отеки. Радиационная полиневропатия является результатом облучения нервных сплетений и сочетается с некрозом кожи, подкожной жировой клетчатки, мышц и фасций. Неврологически эта форма сопровождается трудно купируемым локальным болевым синдромом, гипестезией или анестезией, мышечными атрофиями, гипорефлексиями или арефлексиями, вегетативной дисфункцией в области иннервации пораженных нервов.
Осложнения
Через 1-2 месяца после фокального облучения головы может возникать ранняя радиационная энцефалопатия. Клинически она имитирует развитие новообразований головного мозга, после чего спонтанно регрессирует. Спустя 1-2 года после прохождения лучевой терапии может наблюдаться формирование позднего лучевого некроза. Его симптомы зачастую повторяют клинику заболевания, в связи с которым проводилась рентгенотерапия. Через 6 месяцев – 1 год вероятно появление симптомов церебральной атрофии, сопровождающейся когнитивными расстройствами, нарушением функций тазовых органов, ходьбы и другими проявлениями нормотензивной гидроцефалии.
При облучении области шеи выявляются миелопатии, проявляющиеся симптомом Лермитта, синдромом Броун-Секара. Поражение пояснично-крестцового отдела позвоночника характеризуется синдромом двигательного нейрона: фасцикуляциями, мышечными атрофиями, вялыми параличами иннервируемых областей. Отдаленными осложнениями, наблюдающимися спустя годы или десятилетия, являются дисфункции щитовидной и половых желез, гипоталамуса, новообразования ЦНС (глиомы, саркомы, шванномы, менингиомы), окклюзии артерий головного мозга. Последние становятся причинами транзиторных ишемических атак, инсультов.
Диагностика и обследование
Постановка диагноза поражения нервной системы при ЛБ проводится преимущественно на основе данных анамнеза и объективного обследования. К использованию рентгенологических методик прибегают только по жизненным показаниям, поскольку они способны усугубить течение радиационного поражения. Важнейшим аспектом является установление факта воздействия радиационного излучения на организм. Полная программа обследования включает в себя следующие пункты:
- Физикальное исследование. При общем осмотре оцениваются витальные функции, состояние кожных покровов, наличие трофических изменений и фасцикуляций, определяются мышечные атрофии, болезненность тех или иных участков тела. При изучении неврологического статуса врач акцентирует внимание на функции черепных нервов, мышечной силе и тонусе, объеме активных движений, тонусе сухожильных и периостальных рефлексов, наличии патологических рефлексов, участков гипестезии или анестезии.
- Лабораторные тесты. В общем анализе крови отмечается нейтрофильный лейкоцитоз с лимфопенией, которые сменяются лейкопенией, нейтропенией, тромбоцитопенией, анемическим синдромом, анизоцитозом и пойкилоцитозом, резким повышением СОЭ. Позднее в ОАК могут выявляться мегалоциты, мегалобласты, токсическая зернистость нейтрофилов, агранулоцитоз и панцитопения. Уровень лейкоцитов находится в прямой зависимости от тяжести лучевого поражения.
- Нейровизуализация. КТ или МРТ головного мозга, спинальных структур применяются с целью дифференциальной диагностики с другими потенциальными поражениями ЦНС при невозможности установить диагноз иным путем. Методики также информативны в случаях с атрофиями головного мозга, поскольку позволяют выявить расширение желудочков, лейкоареоз, спайки паутинной оболочки. При необходимости оценки уровня метаболизма глюкозы в ЦНС применяют ПЭТ-КТ.
Лечение радиационного поражения НС
Базовыми принципами лечения данной патологии являются раннее купирование неврологической симптоматики, профилактика вторичных осложнений, комплексность лечения с учетом стадии развития патологии. Рекомендуется использование различных терапевтических подходов в зависимости от места и времени, начиная с момента облучения. Таким образом, принято выделять следующие этапы оказания медицинской помощи:
- Доврачебная и первая медицинская помощь. Состоят из эвакуации больного из зоны радиационного загрязнения, первичной санитарной обработки пораженных участков тела, введения противорвотных и сердечно-сосудистых препаратов, анальгетиков, транквилизаторов, противосудорожных и других симптоматических средств, восстановления ОЦК.
- Медицинская стационарная помощь. Подразумевает коррекцию и дополнение лечения предыдущего этапа. На основании результатов лабораторных анализов могут назначаться антибиотики широкого спектра действия, мочегонные, гемостатики, плазмозаменители, растворы для коррекции электролитного спектра крови.
- Специализированная помощь. Проводится на протяжении всего периода лучевой болезни. С учетом состояния больного может выполняться переливание форменных элементов крови и плазмы, коррекция нарушений стволовых функций. При необходимости используются антибиотики, наркотические анальгетики, нейрометаболиты и витамины группы В.
- Период восстановления. Представлен физиотерапевтическими процедурами, направленными на устранение остаточных явлений, нормализацию кровоснабжения и метаболизма ЦНС. Включает различные виды массажа, лечебную физкультуру, магнитотерапию, санаторно-курортное лечение.
Прогноз и профилактика
Прогноз при ЛБ зависит от уровня полученной дозы, эффективности проведенного лечения и наличия у больного отягощающих факторов: артериальной гипертонии, сахарного диабета, других эндокринопатий. В тяжелых случаях при получении сверхвысоких доз развивается так называемая «смерть под лучом». Профилактика патологии основывается на полном исключении или нормализации условий облучения: соблюдении рекомендованной продолжительности рабочего дня и правил защиты (экранирование, индивидуальные дозиметры), ежегодное прохождение медицинской комиссии с оценкой пригодности к соответствующей профессиональной деятельности. В аварийных ситуациях применяется экстренная химиопрофилактика.
1. Военно-полевая и военно-морская терапия (часть 1: острая и хроническая лучевая болезнь). Учебно-методическое пособие / Эмануэль В.Л., Ловицкий С.В. – 2004.
3. Радиационные инциденты с неравномерным облучением человека / Соловьев В.Ю., Барабанова А.В., Бушманов А.Ю.// Саратовский научно-медицинский журнал – 2013 – Т.9, №4.
Глиома головного мозга
Глиома головного мозга — наиболее распространенная опухоль головного мозга, берущая свое начало из различных клеток глии. Клинические проявления глиомы зависят от ее расположения и могут включать головную боль, тошноту, вестибулярную атаксию, расстройство зрения, парезы и параличи, дизартрию, нарушения чувствительности, судорожные приступы и пр. Глиома головного мозга диагностируется по результатам МРТ головного мозга и морфологического исследования опухолевых тканей. Вспомогательное значение имеет проведение Эхо-ЭГ, ЭЭГ, ангиографии сосудов головного мозга, ЭЭГ, офтальмоскопии, исследования цереброспинальной жидкости, ПЭТ и сцинтиграфии. Общепринятыми способами лечения в отношении глиомы головного мозга являются хирургическое удаление, лучевая терапия, стереотаксическая радиохирургия и химиотерапия.
Глиома головного мозга встречается в 60% случаев опухолей головного мозга. Название «глиома» связано с тем, что опухоль развивается из глиальной ткани, окружающей нейроны головного мозга и обеспечивающей их нормальное функционирование. Глиома головного мозга представляет собой в основном первичную внутримозговую опухоль полушарий мозга. Она имеет вид розоватого, серовато-белого, реже темно-красного узла с нечеткими очертаниями. Глиома головного мозга может локализоваться в стенке желудочка мозга или в области хиазмы (глиома хиазмы). В более редких случаях глиома располагается в нервных стволах (например, глиома зрительного нерва). Прорастание глиомы головного мозга в мозговые оболочки или кости черепа наблюдается лишь в исключительных случаях.
Глиома головного мозга часто имеет округлую или веретенообразную форму, ее размер колеблется от 2-3 мм в диаметре до величины крупного яблока. В подавляющем большинстве случаев глиома головного мозга отличается медленным ростом и отсутствием метастазирования. Однако при этом она характеризуется настолько выраженным инфильтративным ростом, что границу опухоли и здоровых тканей не всегда удается найти даже при помощи микроскопа. Как правило, глиома головного мозга сопровождается дегенерацией окружающих ее нервных тканей, что зачастую приводит к несоответствию выраженности неврологического дефицита размерам опухоли.
Классификация
В соответствии с классификацией ВОЗ выделяют 4 степени злокачественности глиом головного мозга.
- К I степени относится доброкачественная медленно растущая глиома (ювенильная астроцитома, плеоморфная ксантоастроцитома, гигантоклеточная астроцитома).
- Глиома II степени злокачественности считается «пограничной». Она отличаются медленным ростом и имеет только 1 признак злокачественности, в основном клеточную атипию. Однако такая глиома может трансформироваться в глиому III и IV степени злокачественности.
- При III степени злокачественности глиома головного мозга имеет 2 из трех признаков: фигуры митозов, ядерную атипию или микропролиферацию эндотелия.
- Глиома IV степени злокачественности отличается наличием области некроза (мультиформная глиобластома).
По месту расположения глиомы классифицируются на супратенториальные и субтенториальные, т. е. находящиеся выше и ниже намета мозжечка.
Симптомы глиомы головного мозга
Подобно другим объемным образованиям глиома головного мозга может иметь разнообразные клинические проявления, зависящие от ее расположения. Чаще всего у пациентов наблюдается общемозговая симптоматика: некупируемые обычными средствами головные боли, сопровождающиеся ощущением тяжести в глазных яблоках, тошнотой и рвотой, иногда судорожными приступами. Наибольшей выраженности эти проявления достигают, если глиома головного мозга прорастает в желудочки и ликворные пути. При этом она нарушает циркуляцию цереброспинальной жидкости и ее отток, приводя к развитию гидроцефалии с повышением внутричерепного давления.
Среди очаговых симптомов глиомы головного мозга могут наблюдаться нарушения зрения, вестибулярная атаксия (системное головокружение, шаткость при ходьбе), расстройство речи, понижение мышечной силы с развитием парезов и параличей, снижение глубоких и поверхностных видов чувствительности, психические отклонения (нарушения поведения, расстройство мышления и различных видов памяти).
Диагностика
Процесс диагностики начинается с опроса пациента по поводу его жалоб и последовательности их возникновения. Неврологический осмотр при глиоме головного мозга позволяет выявить существующие нарушения чувствительности и расстройства координации, оценить мышечную силу и тонус, проверить состояние рефлексов и т. п. Отдельное внимание уделяют анализу состояния мнестической и психической сферы пациента.
Провести оценку состояния нервно-мышечного аппарата неврологу помогают такие инструментальные методы исследования как электронейрография и электромиография. Для выявления гидроцефалии и смещения серединных мозговых структур может применяться эхоэнцефалография. Если глиома головного мозга сопровождается зрительными нарушениями, то показана консультация офтальмолога и комплексное офтальмологическое обследование, включающее визиометрию, периметрию, офтальмоскопию и исследование конвергенции. При наличии судорожного синдрома проводится ЭЭГ.
Наиболее приемлемым способом диагностики глиомы головного мозга на сегодняшний день является МРТ головного мозга. При невозможности ее проведения может применяться МСКТ или КТ головного мозга, контрастная ангиография мозговых сосудов, сцинтиграфия. ПЭТ головного мозга дает сведения о метаболических процессах, по которым можно судить о скорости роста и агрессивности опухоли. Кроме того, с диагностической целью возможно проведение люмбальной пункции. При глиоме головного мозга анализ полученной цереброспинальной жидкости выявляет наличие атипичных (опухолевых) клеток.
Вышеперечисленные неинвазивные методы исследования позволяют диагностировать опухоль, однако точный диагноз глиомы головного мозга с определением ее вида и степени злокачественности можно поставить только по результатам микроскопического исследования тканей опухолевого узла, полученных при проведении оперативного вмешательства или стереотаксической биопсии.
Лечение глиомы головного мозга
Полное удаление глиомы головного мозга представляет собой практически невыполнимую задачу для нейрохирурга и возможно только в случае ее доброкачественности (I степени злокачественности по классификации ВОЗ). Это связано со свойством глиомы головного мозга значительно инфильтрировать и прорастать окружающие ее ткани. Разработка и применение в ходе нейрохирургических операций новых технологий (микрохирургии, интраоперационного картирования головного мозга, МРТ-сканирования) немного улучшило ситуацию. Однако до сих пор хирургическое лечение глиомы в большинстве случаев по сути является операцией по резекции опухоли.
Противопоказаниями к осуществлению хирургического метода лечения является нестабильное состояние здоровья пациента, наличие других злокачественных новообразований, распространение глиомы головного мозга в оба полушария или ее неоперабельная локализация.
Глиома головного мозга относится к радио- и химиочувствительным опухолям. Поэтому химио- и радиотерапия активно применяются как в случае неоперабельности глиомы, так и в качестве пред- и постоперационной терапии. Предоперационная лучевая и химиотерапия может быть проведена только после подтверждения диагноза результатами биопсии. Наряду с традиционными методами радиотерапии возможно применение стереотаксической радиохирургии, позволяющей воздействовать на опухоль при минимальном облучении окружающих тканей. Следует отметить, что лучевая и химиотерапия не могут служить заменой хирургического лечения, поскольку в центральной части глиомы головного мозга зачастую располагается участок, плохо поддающийся воздействию облучения и химиопрепаратов.
Прогноз
Глиомы головного мозга имеют преимущественно неблагоприятный прогноз. Неполное удаление опухоли приводит к ее быстрому рецидивированию и лишь продлевает жизнь пациента. Если глиома головного мозга имеет высокую степень злокачественности, то в половине случаев больные погибают в течение 1 года и только четверть из них живет дольше 2 лет. Более благоприятный прогноз имеет глиома головного мозга I степени злокачественности. В случаях, когда удается произвести ее полное удаление с минимальным послеоперационным неврологическим дефицитом, более 80% прооперированных живут дольше 5 лет.
Кровоизлияние в желудочки головного мозга ( вентрикулярная геморрагия , внутрижелудочковое кровоизлияние )
Кровоизлияние в желудочки головного мозга представляет собой одну из разновидностей острого нарушения мозгового кровообращения – наиболее распространенную патологию в неврологии. Развитию кровоизлияния в головной мозг, как правило, способствуют нелеченная стойкая артериальная гипертензия, злоупотребление алкоголем, курение, прием препаратов, нарушающих свертываемость крови. Диагноз ставится на основании сбора анамнеза жизни пациента и проведения ряда обследований (МРТ или КТ, ЭКГ). Лечение направлено на устранение отека мозга, нормализацию дыхательной функции и артериального давления.
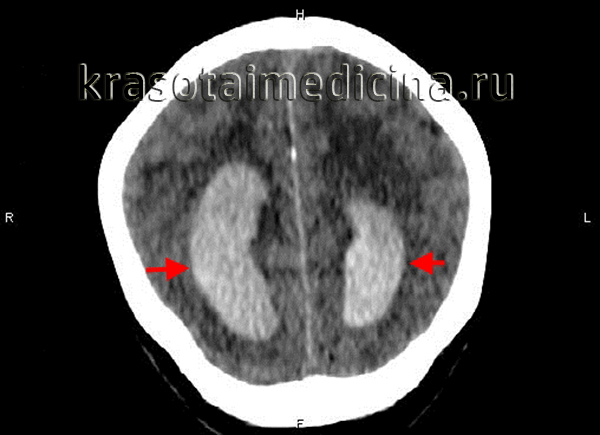
Кровоизлияние в желудочки головного мозга – это патология, которая относится к ОНМК по геморрагическому типу. Синонимами данного заболевания являются вентрикулярная геморрагия (внутрижелудочковое кровоизлияние - ВЖК), геморрагический инсульт с прорывом крови в желудочки. Данная патология занимает первое место по смертности в мире.
Согласно данным медицинской статистики, кровоизлияние в головной мозг приводит к летальному исходу в первые 2 суток в 40-60% случаев. Процентное соотношение увеличивается в течение первого года после перенесенного инсульта и достигает порядка 90%. Развитие кровоизлияния больше характерно для людей старше 50 лет, страдающих стойкой артериальной гипертензией, однако может встречаться и при других патологиях, не связанных с показателями кровяного давления.
Классификация кровоизлияний в желудочки мозга была разработана более 20 лет назад и внесена в международный классификатор болезней 10 пересмотра. Согласно МКБ-10, ВЖК подразделяют на несколько стадий: субэпендимальное кровоизлияние (СЭК), СЭК с распространением в боковые желудочки мозга, СЭК с распространением в желудочки и в вещество мозга. В клинической практике специалисты в области неврологии выделяют 3 вида внутрижелудочковых кровоизлияний: кровоизлияние в боковые желудочки, в III желудочек и в IV желудочек.
Кровоизлияние в боковой желудочек происходит из прилегающих к нему мозговых тканей и характеризуется постепенным заполнением объема боковых желудочков с распространением крови в III желудочек и далее. При большом количестве излившейся крови возникает значительное увеличение объема мозга с развитием двусторонней неврологической симптоматики. Если кровоизлияние сопровождается заполнением лишь одного бокового желудочка, оно имеет более благоприятное течение и симптоматику, напоминающую обычное паренхиматозное кровоизлияние.
Прорыв крови в III желудочек происходит из медиальных очагов паренхиматозных кровоизлияний. При этом отмечается острое развитие неврологической симптоматики, зачастую приводящее к смертельному исходу. Кровоизлияние в IV желудочек возникает из дорсального отдела ствола или мозжечка. Этот вид кровоизлияния часто имеет летальное окончание.
Кровоизлияния в желудочки мозга подразделяются на первичные и вторичные. Первичные вентрикулярные геморрагии, связанные с артериальной гипертензией или с амилоидозом церебральных сосудов, встречаются в редких случаях. По некоторым наблюдениям они составляют 1 случай из 300. Вторичные кровоизлияния обусловлены такими факторами, как бесконтрольный прием антиагрегантов и фибринолитиков, внутричерепная аневризма (локальное истончение и выпячивание стенки мозгового кровеносного сосуда с последующим прорывом), онкологические новообразования головного мозга.
Кровоизлияние в желудочки головного мозга обычно характеризуется быстро развивающимся угнетением сознания. Зачастую кома наступает в первые часы после инсульта. Лишь в случае постепенного излития крови и небольшого ее объема сознание пациента длительное время может быть сохранено и утрачивается постепенно. Как правило, кровоизлияние в желудочки сопровождается оболочечными симптомами и рвотой. Характерен вегетативный симптомокомплекс: гипергидроз и ознобоподобный тремор; бледность, а затем гиперемия лица, конечностей и туловища; первоначальное снижение температуры с быстрой сменой на гипертермию, достигающую 41—42°С.
Одним из типичных признаков внутримозгового кровоизлияния в желудочки является расстройство мышечного тонуса в виде горметонического синдрома или децеребрационной ригидности. В первом случае приступообразным образом происходит повышение мышечного тонуса пораженных конечностей. Приступ горметонии может возникнуть в ответ на внешние раздражители. При децеребрационной ригидности мышечный тонус повышен преимущественно в мышцах-разгибателях. Пациент лежит, выгнув дугой спину и запрокинув голову. Его кисти и пальцы согнуты, предплечья повернуты внутрь.
Зачастую кровоизлияние в желудочки г.м. сопровождается парезом противоположных паренхиматозному геморрагическому очагу конечностей, появлением двигательных автоматизмов в непаретичных конечностях, повышением сухожильных рефлексов, наличием патологических и отсутствием брюшных рефлексов, расстройством функционирования тазовых органов. При кровоизлиянии в III желудочек на первый план выходят расстройства дыхания и кровообращения, горметонический синдром носит двусторонний характер. Кровоизлияние в IV желудочек сопровождается икотой и нарушением глотания, спонтанные движения отсутствуют, явления горметонии слабо выражены.
При продолжающемся кровоизлиянии в желудочки из-за увеличения объема изливающейся крови, резкого повышения внутричерепного давления, нарастающего отека головного мозга и сдавления нервных центров, отвечающих за жизнеобеспечение организма, усугубляются симптомы дыхательных и сердечно-сосудистых нарушений. Происходит нарушение ритма и частоты дыхания, кратковременная первоначальная брадикардия сменяется тахикардией до 120-150 уд./мин., возникает аритмия.
В зависимости от скорости кровотечения при кровоизлиянии в желудочки происходит усугубление состояния пациента. Горметонический синдром снижается, постепенно развивается гипотония и исчезают автоматические движения, появляются перекрестные патологические рефлексы. Затем развивается полная атония и арефлексия.
Диагноз «кровоизлияние в желудочки мозга» ставится на основании системной оценки анамнеза пациента: наличие заболеваний крови, ранее перенесенные геморрагические инсульты, прием препаратов, влияющих на свертывающую систему крови и пр., острое возникновение и быстрое развитие тяжелой клинической симптоматики; данных неврологического осмотра и дополнительных исследований.
При подозрении на кровоизлияние в желудочки головного мозга пациента нужно как можно скорее доставить в больницу. Не исключено, что в машине скорой помощи ему придется проводить реанимацию. В условиях стационара для подтверждения диагноза пациенту проводят: МРТ или КТ головного мозга, анализ крови с подсчетом количества тромбоцитов, исследуют коагулограмму, осуществляют мониторинг ЭКГ и АД.
Если провести МРТ или КТ нет возможности, то пациенту делают эхо-энцефалографию, которая позволяет определить наличие смещения серединных мозговых структур. В некоторых случаях требуется проведение люмбальной пункции для дифференциации внутрижелудочковой геморрагии, при которой кровь попадает в спинномозговую жидкость, от ишемического инсульта. Более точно диагностировать кровоизлияние в желудочки головного мозга позволяет диагностическая пункция желудочка.
Лечение и профилактика
Лечение кровоизлияния в желудочки головного мозга, прежде всего, направлено на скорейшую организацию медицинской помощи и немедленное проведение базисной терапии: нормализации сердечно-легочной функции, контроля показателей артериального давления, регуляции постоянства внутренней среды организма. Кроме этого, проводится симптоматическое лечение: введение противосудорожных препаратов при необходимости, введение средств для снятия отека головного мозга и нормализации внутричерепного давления, введение противорвотных препаратов.
Четкая специфическая терапия кровоизлияния в желудочки мозга, направленная на остановку кровотечения, на сегодняшний день находится в стадии разработки. Патогенетическая терапия заключается преимущественно в поддержании оптимальных цифр АД и эвакуации излившейся крови хирургическими методами. К патогенетической можно отнести и нейропротекторную терапию: применение препаратов нейротрофического действия (гидрализатов из сыворотки телячьей крови, пирацетами, глицина), антиоксидантов (метилэтилпиридинола, мельдония, вит. Е), блокаторов кальциевых каналов (нимодипина, никардипина), медикаментов, улучшающих метаболизм (цитохрома С, инозина, L-карнитина, АТФ).
Вопрос о хирургическом лечении кровоизлияния в желудочки мозга решается в каждом конкретном случае отдельно. Эвакуация паренхиматозной гематомы и пункционная аспирация крови из желудочков позволяют снизить внутричерепную компрессию и дислокацию мозговых структур. Показанием к проведению вентрикулярного дренирования или эндоскопической эвакуации гематомы может служить медиальный инсульт с прорывом в желудочки. Хирургическое вмешательство может быть эффективно при наличии данных за аневризму или АВМ церебральных сосудов. По некоторым клиническим наблюдениям, при развитии коматозного состояния проведение оперативного лечения целесообразно лишь в первые 6-12 ч.
Помимо основного лечения особенное внимание уделяется профилактике соматических осложнений – пролежней, респираторного дистресс-синдрома, пневмонии, урогенитальной инфекции, стресс-язв.
Профилактикой развития острого нарушения кровообращения по геморрагическому типу, в т. ч. кровоизлияния в желудочки, являются: своевременное лечение артериальной гипертензии, ведение здорового образа жизни, прием лекарственных препаратов только по назначению врача, своевременное выявление и коррекция заболеваний с нарушением свертывания крови.
Лучевая терапия
при раке легких

Лучевая терапия это лечение, которое разрушает раковые клетки с помощью высокоэнергетических радиоактивных лучей. В настоящее время, благодаря развивающимся компьютерным технологиям и целевым машинам, успех лечения увеличивается, а побочные эффекты постепенно уменьшаются. Процедура может проводиться двумя способами, внешним или внутренним, но они имеют сходные эффекты. Лучевая терапия при раке легких назначается в качестве самостоятельного метода или в сочетании с химиотерапией. Сочетанный подход позволяет достичь лучших результатов.
О лучевой терапии рака легких
Лучевая терапия при мелкоклеточном раке легких
В 15 % случаев рака легких речь идет о мелкоклеточной форме заболевания, для которой характерен быстрый рост и раннее метастазирование. Пациенты обычно получают облучение опухоли вместе с химиотерапией, называемой радио-химиотерапией. Поскольку иногда метастазы образуются в головном мозге, многим больным назначается лучевая терапия головы на ранней стадии заболевания.
Только при небольших опухолях (менее 2 см) проводится операция. После хирургического вмешательства дополнительно назначается комбинированная лучевая химиотерапия. Облучение опухолевой области проводится одновременно с химиотерапией или после нее.
Лучевая терапия при немелкоклеточном раке легких
Пациенты с немелкоклеточным раком, у которых о проведении операции не может быть и речи, получают лучевую терапию. Возможна также комбинация облучения и химиотерапии, так называемая радио-химиотерапия.
На ранней стадии проводится особая форма лучевой терапии при онкологии легких – стереотаксическая, которая отличается:
небольшими дозами облучения;
воздействием на очаг в нескольких направлениях;
сохранением здоровых окружающих тканей.
У пациентов с прогрессирующим немелкоклеточным раком легких лучевая терапия используется для облегчения дискомфорта, вызванного симптомами заболевания. При локально ограниченном образовании проводится стереотаксическое облучение или радиочастотная абляция (разрушение опухолевой ткани с помощью электрической энергии) под компьютерным контролем томографии.

Как подготовиться к лучевой терапии
Многие пациенты сначала с беспокойством относятся к облучению: большие устройства, под которыми нельзя двигаться, неощутимое излучение, страх побочных эффектов – все это пугает.
У большинства больных беспокойство ослабевает в ходе лечения – преимущественно после первого сеанса. Чем лучше пациенты просвещены, тем быстрее адаптируются к новой ситуации. Поэтому рекомендуется попросить врача рассказать, как проходит лечение, какая техника используется, какие есть риски. Если страх слишком велик, то можно воспользоваться психологической поддержкой.
Перед первой процедурой облучения нужно пройти предварительные обследования:
компьютерная томография (КТ);
магнитно-резонансная томография (МРТ).
Полученные изображения передаются на калькулятор планирования. С помощью компьютерной программы врачи и радиологи вычисляют область облучения, определяют количество и размер лучевых полей. Перед фактическим облучением терапия сначала имитируется. Облучающим полем называется кусок кожи, через который лучи проникают в организм при чрескожной лучевой терапии. Поля облучения рисуются на коже водостойким карандашом или хной.
Процедура лучевой терапии при раке легких
Лежать при облучении нужно неподвижно, чтобы не «скользить»: здоровые ткани не должны затрагиваться. Пациент помещается на подвижную кушетку, после чего проводится корректировка оборудования. При необходимости используются ремни, подголовники или подлокотники. Чувствительные к радиации части тела покрываются экранирующим материалом.
Для чувствительных органов может быть достаточно отклонений от целевой области на несколько миллиметров, чтобы вызвать повреждение. Во избежание непроизвольных движений используется дополнительная фиксация. Перед облучением врачи и ассистенты еще раз внимательно проверяют, точно ли лучи ориентированы на опухоль.
требует долгой подготовки;
длится несколько минут;
не вызывает дискомфорта и боли.
Во время лечения персонал покидает комнату. Наблюдение за пациентом осуществляется через стеклянную панель. Также предусмотрен микрофон для обеспечения обратной связи больного с медицинскими работниками.
Лучевая терапия обычно проводится сеансами с ежедневным воздействием небольшой дозой радиации в течение 3-9 недель. Каждый сеанс занимает около 15 минут.
Второй метод облучения – брахитерапия, при которой используется излучение, имеющее диапазон от нескольких миллиметров до сантиметров. Поэтому опухоль нужно облучать с меньшего расстояния – при раке легких аппликаторы вводятся через трахею. При этом виде лучевой терапии аппликатор сначала помещается в полость тела, затем радионуклид вводится через шланг. Сегодня этот процесс происходит компьютеризировано.
Читайте также:
