Влияние радиации на растущую кость. Инкорпорированные радиоактивные вещества
Добавил пользователь Alex Обновлено: 22.01.2026
Костное вещество после облучения. Морфология костного вещества после облучения
Наряду с указанными нарушениями встречаются изменения в самом костном веществе. Появляется большое количество остеоцитов с признаками гибели в виде пикноза ядер, сморщивания клеток. Встречаются участки, лишенные остеоцитов. В дальнейшем некротические процессы усиливаются, приводя к очаговому омертвению кости. Развитие остеонекрозов часто встречается у людей после лучевой терапии в массивных дозах (5000 рад и более) через 6 мес—15 лет после воздействия ионизирующей радиации [Митров Г., Ангелова И. к др., 1974; Sengupta S., Prathap К., 1973; Bedwinek J., Shukovsky L., 1976]. Участки омертвевшей ткани подвергаются рассасыванию.
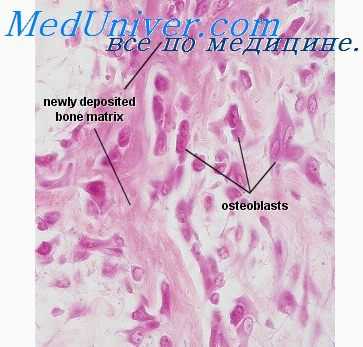
Вокруг них развивается богатая сосудами грануляционная ткань, состоящая из остеобластов, их переходных форм и фибробластов. Однако при развитии грубых нарушений в окружающей ткани и в стенках сосудов рассасывание омертвевших участков костной ткани задерживается. Наряду с рассасыванием костного вещества, как уже указывалось выше, образуется новая костная ткань, иногда имеющая вид остеоида или интенсивно обызвествленной грубоволокнистой кости. Со стороны эндоста и периоста может разрастаться несовершенная костная ткань; при чрезмерном и беспорядочном разрастании ее происходит грубое нарушение строения кости, она приобретает уродливую форму.
Возникновение участков омертвения, нарушение рассасывания, образование атипичной кости — все это приводит к глубокому изменению жизнедеятельности костной ткани и возможности перелома костей [Митрое Г., Ангелова И. н др., 1974], нарушению процесса заживления их [Grenn N. et al., 1969; Woodard H., 1970; Guzecki A., 1973]. Измененная костная ткань, особенно в участках некроза, легко инфицируется, в результате чего возникает остеомиелит [Шимановская К. Б., 1964, и др.].
В отдаленные сроки после местного облучения в больших дозах возможно возникновение костных опухолей: остеосарком недифференцированных фибросарком [Edgar M. et at., 1973].
Сведений, касающихся морфологических изменений костной ткани при общем облучении организма, как уже указывалось, сравнительно немного [Павлова М. 1L, 1961; Пешкова Е. А., 1968; Гендлер Э. М„ Пешкова Е. А., 1968; Rissanen R. et al., 1969; Furstman L., 1972]. Даже в подробных изложениях патологических исследований людей, погибших в результате взрыва атомных бомб над Хиросимой и Нагасаки, описания костной ткани не приводится.
Вместе с тем из имеющихся литературных данных видно, что после общего внешнего облучения в смертельных дозах в костной ткани возникают изменения, аналогичные развивающимся при локальном облучении. При этом наблюдаются существенные изменения в процессах внутренней перестройки кости, нарушение обычного взаимоотношения явлений разрушения и новообразования костных структур.
Как указывают некоторые авторы [Пешкова Е. А., 1968], при острой лучевой болезни процессы резорбции преобладают над пластическими. Это приводит к грубым изменениям в костной ткани, к подавлению ее функции. Уже в первые дни после массивного облучения (1800 Р) отмечается увеличение числа остеобластов, разрушение костных пластинок остеонов, стирание их границ. В дальнейшем интенсивность рассасывания костной ткани возрастает, особенно со стороны эндоста, костных канальцев и периоста [Гендлер Э. М., Пешкова Е. А., 1968].
В результате резорбции в кости образуется большое количество полостей неправильной формы с разрастанием в них малодифференцированной клеточно-волокнистой ткани.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Влияние радиации на растущую кость. Инкорпорированные радиоактивные вещества
Некроз кости после облучения. Гистохимия кости после радиационного поражения
Наряду с увеличением количества остеокластов и усилением рассасывания костного вещества можно видеть изменения в остеобластах. Последние теряют четкие контуры, ядра их приобретают неправильную форму, становятся пикнотичными. Количество клеток уменьшается. Малодифференцированные клетки камбиального слоя надкостницы также претерпевают соответствующие изменения, а сама надкостница в дальнейшем истончается.
При меньших дозах облучения (600 Р) в ранние сроки поражения может отмечаться увеличение активности камбиальных элементов с дифференцировкой их в остеобласты. Но уже в скором времени, особенно при значительных дозах облучения (800Р и выше), количество остеобластов неуклонно убывает, нарастают дистрофические изменения в них, уменьшается содержание нуклеиновых кислот, снижается активность щелочной фосфатазы, что, как известно, имеет существенное значение для жизнедеятельности костной ткани [Поляков В. А., Горбенко В. Г., Павлова М. И., 1967; Furstman L. L., 1972; Barlnikowa W., 1973].
Вскоре после облучения можно видеть изменения в нервных волокнах в виде интенсивной импрегнации серебром, варикозного утолщения и неравномерного распределения нейроплазмы. На высоте развития лучевой болезни отмечается разрушение миелнновых и безми'елиновых нервных волокон, что, естественно, приводит к нарушению иннервации костной ткани [Поляков В. А. н др., 1967].
На высоте лучевой болезни отмечаются признаки некробиотических изменений остеоцитов и уменьшение их количества за счет гибели. В результате этого в костном веществе выявляются участки, лишенные клеток. Увеличение остеокластов, наблюдаемое в ранний период лучевой болезни, сменяется снижением их количества, что приводит к нарушению рассасывания костной ткани. Вследствие этого меняется структура кости.
Местами различаются уродливые костные балки с неровными краями. Вокруг этих костных структур развивается грубоволокнистая соединительная ткань.
Как показывают гистохимические исследования, торможение и извращение внутренней перестройки сформированной кости и подавление гистогенеза растущей кости тесно связано с нарушениями фосфорно-кальциевого обмена. В ранние сроки после облучения отмечается увеличение активности щелочной фосфатазы в остеобластах. Однако в скрытом периоде и в разгар лучевой болезни активность фермента бывает низкой [Поляков В. Г. и др.. 1967; Свирская Т. А., Лнберман Н. А., 1967].
Одновременно отмечается увеличение содержания гликогена в клеточных элементах костной ткани в результате нарушения процессов расщепления данного полисахарида [Френкель Л. А., 1973] вследствие снижения активности амилазы и фосфорилазы. Это подтверждается некоторыми биохимическими данными, свидетельствующими о сохранении синтеза гликогена в костной ткани облученного организма даже лри воздействии радиации в массивных дозах.
Однако существуют и противоположные наблюдения, согласно которым в костной ткани облученного организма, наоборот, происходит уменьшение содержания гликогена [Поляков В. А, и др., 1967]. Отмечается также уменьшение сульфатированных мукополисахаридов, особенно в метафизах трубчатых костей.
Кости при острой лучевой болезни. Морфология кости после облучения
Патологическая анатомия костной системы при острой лучевой болезни освещена в литературе меньше, чем патология кости при поражении инкорпорированными радиоактивными веществами. К тому же медленное развитие структурных изменений в кости и проявление их спустя длительное время после облучения способствовало вначале неправильному представлению о малой чувствительности кости взрослого организма к действию монизирующих излучений.
Только в 20-х годах нашего столетия стало ясно, что внешнее облучение может привести к некрозу костной ткани, перелому костей, возникновению остеомиелита и злокачественных опухолей.
Большая часть сведений о состоянии костной ткани после внешнего облучения относится в основном к массивному местному воздействию рентгеновских лучей как в экспериментальных, так и в клинических условиях [Гальперин М. Д., Зайчиков И. А., 1958; Шимановская К. В. 1964; Rissanen R. et al., 1969; Sengupta S., Prathap. K., 1973; Kim J. H. et al„ 1974; Tokutumi Т., Urago A., 1976]. Тем не менее результаты таких наблюдений представляют определенное значение при изучении патологической анатомии острой лучевой болезни, поскольку при авариях и в чрезвычайной обстановке возможно неравномерное общее облучение.
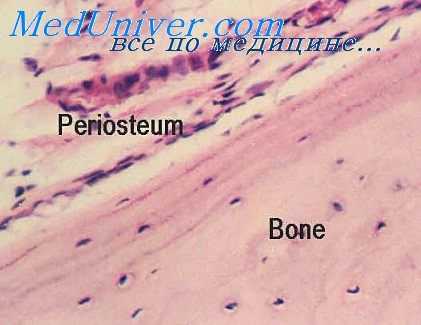
При местном облучении в сравнительно больших дозах (3000Р и более) первоначально могут отмечаться признаки усиления пролиферативлых процессов камбиальных элементов надкостницы, эндоста и околососудистой ткани костных канальцев (гаверсовых каналов), увеличение количества остеобластов, молодых остеогенных клеток и остеокластов.
Так, у животных после локального облучения в дозе 400 Р бедренной кости на 1—3-й сутки в остеобластах отмечается повышение активности щелочной фосфатазы с последующим снижением ее в более поздние сроки [Warzkiewiz M., 1973]. В дальнейшем наблюдается разрастание клеточно-волокнистой ткани вокруг костных трабекул, формирование новой костной ткани. Наряду с этим различаются явления резорбции ее. Увеличение количества остеокластов, наблюдаемое в ранние сроки поражения, приводит к более интенсивному рассасыванию костной ткани, заканчивающемуся иногда развитием остеопороза.
Вместе с тем с удлинением срока с момента местного облучения все больше проявляются признаки нарушения жизнедеятельности костной ткани. Первоначальная активная перестройка ее сменяется подавлением и извращением процесса костеобразования. При этом резко сокращается количество клеточных элементов в периосте, эндосте и околососудистой ткани костных канальцев, особенно остеобластов [Rissanen R. et al., 1968]. По краю костных структур развивается грубоволокнистая соединительная ткань. Существенные изменения наблюдаются в кровеносных сосудах. Отмечается утолщение сосудистых стенок, набухание и разволокнение коллагеновых волокон, десквамация эндотелия, явления плазморрагии.
Позднее возникают грубые деструктивные изменения, приводящие к гналинозу сосудов с облитерацией их просвета.
ИНКОРПОРИРОВАНИЕ РАДИОАКТИВНЫХ ВЕЩЕСТВ
Инкорпорирование радиоактивных веществ (лат. incorporatio включение) — проникновение радиоактивных веществ в организм.
Инкорпорирование естественных радиоактивных веществ (см.), содержащихся в небольших количествах в продуктах питания, воде и воздухе, происходит постоянно через дыхательные пути, жел.-киш. тракт и кожу. Кроме того, радиоактивные вещества попадают в организм в виде меченых соединений, широко используемых в медицине для диагностики и лечения различных заболеваний (см. Изотопы, радиоактивные), а также в процессе работы с радионуклидами. В этих случаях необходим точный расчет доз, строгое соблюдение техники безопасности, правил личной гигиены и тщательный дозиметрический контроль за содержанием радионуклидов в воздухе производственных помещений и в организме. При различных аварийных ситуациях, а также при испытаниях ядерного оружия (см.) возможно загрязнение радиоактивными веществами окружающей среды; включаясь в биол, круговорот, они проникают в организм человека. В случае военного применения ядерного оружия источником радиоактивных веществ могут быть продукты ядерного взрыва, заражающие местность и воздух в р-не взрыва и по пути движения радиоактивного облака.
Инкорпорированные радиоактивные вещества всасываются в организм и разносятся по нему током крови. Всасываемость этих веществ зависит от их физ. и хим. свойств и физиологического состояния организма. Напр., всасываемость радиоактивных аэрозолей определяется размерами их частиц: глубоко проникают в легкие частицы размером 0,5—2 мкм; частицы меньших размеров так же легко проникают в легкие, но, не задерживаясь в них, быстро выводятся с выдыхаемым воздухом; более крупные частицы задерживаются в верхних дыхательных путях. Длительность задержки радиоактивных веществ в легких определяется их локализацией и растворимостью: из носоглотки, трахеи, бронхов, легких аэрозоли быстро удаляются благодаря деятельности мерцательного эпителия; плохо растворимые вещества медленно всасываются, а следовательно, и дольше задерживаются в организме.
Характер распределения радиоактивных веществ в организме различен: сравнительно равномерно распределяются по органам и тканям окись трития, 137 Cs, 134 Cs, 95 Nb, 106 Bu, другие вещества избирательно накапливаются либо в костной ткани — так наз. остеотропные элементы ( 140 Ba, 89 Sr, 90 Sr, 226 Ra), либо в костной ткани и печени ( 144 Ce, 147 Pm, 239 Pu, 241 Am, 242 Cm, 252 Cf, 232 Th), либо в щитовидной железе ( 125 I, 131 I, 211 At).
Радиоактивные вещества выводятся из организма гл. обр. через желудочно-кишечный тракт и почки, незначительная часть — через потовые и слюнные железы. Вещества, плохо всасывающиеся в жел.-киш. тракте, выводятся с испражнениями в течение 2—5 дней после инкорпорирования. Быстро выводятся из организма 14 C, 3 H, 137 Cs, очень медленно — 90 Sr, 144 Ce, 241 Am, 244 Cm, 239 Pu, 232Th.
Инкорпорированные радиоактивные вещества, подвергаясь радиоактивному распаду, испускают а- и бета-частицы и гамма-излучение, под воздействием которых происходит внутреннее облучение организма. Продолжительность такого облучения определяется эффективным периодом полураспада (см.). При попадании в организм большого количества радиоактивных веществ может развиться лучевая болезнь (см.); при этом преимущественно поражаются те органы и ткани, в которых избирательно накапливается радионуклид. Так, при пероральном попадании и ингаляции плохо всасывающихся радионуклидов на первый план выступает патология со стороны жел.-киш. тракта и легких; остеотропные радионуклиды вызывают поражение костной ткани и костного мозга.
Первая помощь при Инкорпорировании радиоактивных веществ сводится к предупреждению дальнейшего попадания радиоактивных веществ в организм и скорейшему выведению их.
Для этих целей применяются индивидуальные средства защиты (см.). Пострадавшие удаляются из опасной зоны. Показано беззондовое и зондовое промывание желудка, прием адсорбентов, солевых слабительных, а также средств, образующих растворимые комплексные соединения с радиоактивными веществами (унитиол, пентацин, этилендиаминтетрауксусная к-та и др.), препараты кальция и ионообменные средства (лимоннокислый цирконий). Для предупреждения развития лучевой болезни могут применяться радиопротекторы (см.).
Библиография: Защита пациента при радиоизотопных исследованиях, пер. с англ., М., 1974, библиогр.; Нормы радиационной безопасности (НРБ-76), М., 1978; Осанов Д. П. и Лихтарев И. А. Дозиметрия излучений инкорпорированных радиоактивных веществ, М., 1977, библиогр.; The metabolism of compounds of plutonium and other actinides, Oxford, 1972.
Раздел 3. Биологическое действие ионизирующих излучений
Ю.А. Александров
Основы радиационной экологии
Учебное пособие. – Йошкар-Ола: Мар. гос. ун-т, 2007. – 268 с.
3.6. Радиационные поражения человека
3.6.2. Биологическое действие инкорпорированных радионуклидов
У многих радионуклидов существенная в биологическом отношении активность содержится в очень малом количестве вещества. Так, масса 50 мкКи полония-210 (доза, при поступлении которой в организм человека можно ожидать развития глубоких нарушений функций печени и почек) составляет всего 12´10 -9 г, а 1 мКи стронция-90 (ЛД 50/30 для крыс) содержится в 8 мкг этого изотопа. Даже труднорастворимые соединения радионуклидов в столь малых количествах часто оказываются в растворе в виде ионов, что значительно облегчает их проникновение через биологические барьеры, всасывание и распространение по организму.
3.6.2.1. Пути поступления радиоактивных веществ в организм
Во внутреннюю среду РВ могут попасть ингаляционно, через стенки желудочно-кишечного тракта, через травматические и ожоговые повреждения, через неповрежденную кожу. Всосавшиеся РВ через лимфу и кровь могут попасть в ткани и органы, фиксироваться в них, проникнуть внутрь клеток и связаться с внутриклеточными структурами.
Знание пути поступления радионуклида в организм весьма важно в практическом отношении. У ряда РВ характер всасывания, распределение по органам и тканям, выведение и биологическое действие существенно зависят от пути поступления.
Ингаляционное поступление радиоактивных веществ. Общая поверхность альвеол составляет около 100 м 2 , что приблизительно в 50 раз превышает поверхность кожи, и при контакте, особенно профессиональном, с аэрозолями РВ, радиоактивными газами и парами ингаляционный путь заражения является основным.
Радионуклиды, попавшие в органы дыхания, в различной степени могут задерживаться в легких и верхних дыхательных путях. На количество РВ, остающееся в органах дыхания после выдоха, влияют прежде всего аэродинамические свойства аэрозоля, зависящие от размера, плотности, формы частиц, от их влажности, гигроскопичности, растворимости и химической природы. В легких откладываются преимущественно частицы диаметром от 0,01 до 1 мкм. Имеют значение и анатомо-физиологические особенности дыхательной системы, в частности, соотношение размеров альвеолярных и бронхиальных поверхностей, минутный объем легких, частота дыхания, скорость движения воздуха по дыхательным путям.
Метаболизм радионуклидов, оставшихся после выдоха в органах дыхания, определяется следующими основными процессами:
– ретроградным выносом частиц со слизью в результате деятельности мерцательного эпителия в глотку с последующим их заглатыванием (отчасти, отхаркиванием);
– резорбцией РВ в кровь через альвеолярные мембраны с последующим отложением в органах или выведением. Резорбции подвергаются преимущественно растворимые частицы. В зависимости от их растворимости время резорбции может составлять от нескольких десятков минут до нескольких дней и даже более. Степень резорбции одного и того же радионуклида сильно зависит от химической формулы соединения, в состав которого он входит;
– фагоцитозом макрофагами нерастворимых частиц и коллоидных форм радионуклидов. Часть захвативших радионуклиды фагоцитов ретроградно удаляется в глотку и заглатывается или отхаркивается. Другая часть транспортируется лимфой и откладывается в бронхо-легочных узлах. Наибольшее практическое значение этот вид отложения имеет при ингаляционном поступлении нерастворимых или слабо растворимых соединений плутония, тория, цезия.
Около 10% радионуклидов, захваченных фагоцитами, перемещаются через альвеолярную мембрану с периодом полувыведения около нескольких дней. Небольшая часть РВ задерживается в паренхиме легких, эпителиальных клетках: период полувыведения из них составляет около 600 суток. Еще прочнее фиксация РВ в бронхо-легочных лимфатических узлах, куда они попадают с фагоцитами.
При оценке опасности ингаляционного поступления РВ учитывают лучевую нагрузку на легкие, эпителий бронхов, регионарные лимфатические узлы, на стенку желудочно-кишечного тракта, последствия резорбции, а в случае ингаляции гамма излучающих радионуклидов определенное значение может иметь и облучение других органов грудной полости.
При поступлении радионуклидов через органы дыхания их химические соединения подразделяются на три ингаляционных класса в зависимости от длительности эффективного периода полувыведения (Тэфф.) из легких. К классу «М» (медленный) отнесены соединения с Тэфф. более 100 сут., к классу «П» (промежуточный) – с Тэфф. от 10 до 100 сут. и к классу «Б» (быстрый) – с Тэфф. менее 10 суток.
Поступление радиоактивных веществ через желудочно-кишечный тракт. Желудочно-кишечный тракт – второй основной путь поступления РВ в организм. Оно может произойти как непосредственно после их попадания во внешнюю среду, так и после прохождения по биологическим цепочкам. Поражающее действие при алиментарном поступлении радиоактивных веществ связано как с лучевой нагрузкой на стенку пищеварительного тракта, так и с всасыванием РВ в кровь и лимфу.
Продвижение радионуклидов по желудочно-кишечному тракту не имеет каких-то особенностей по сравнению с нерадиоактивными веществами, содержащимися в пище. Резорбция РВ зависит от химических свойств вещества (главным образом, растворимости), физиологического состояния желудочно-кишечного тракта (рН среды, моторная функция), состава пищевого рациона. Молоко, например, способствует усилению всасывания радиоактивного стронция. Резорбция радионуклидов снижается при увеличении содержания в пище стабильных изотопов этих же элементов и наоборот.
Преимущественно через ЖКТ поступают и всасываются щелочные элементы – K, Ca, Na, Rb, Cs, I, и в меньшей степени – щелочно-земельные элементы – Sr (40-60%), Co (30%), Mg (10%), Zn (10%), Ba (5%). Трансурановые элементы и редкоземельные металлы в желудочно-кишечном тракте образую труднорастворимые соединения и поэтому степень их всасывания очень низкая – Po – 6%, Ru – 3%, U –
3-6%, Pu – 0,01%, Zr – 0,01%.
Всасывание хорошо растворимых радионуклидов происходит в основном в тонкой кишке. Значительно меньше РВ всасывается в желудке. Всасывание в толстой кишке практического значения не имеет. Наиболее интенсивно и полно резорбируются растворимые радионуклиды, находящиеся в ионной форме. Радионуклиды щелочных металлов и галоидов после попадания в желудочно-кишечный тракт практически полностью всасываются в кровь. Изотопы редкоземельных элементов, плутония, трансурановых элементов вследствие склонности их солей к гидролизу и образованию труднорастворимых и нерастворимых соединений всасываются в кишке в пределах нескольких сотых-деся-титысячных долей процента от поступившего количества. Всосавшиеся радионуклиды могут повторно и неоднократно (с желчью, кишечными соками) поступать в желудочно-кишечный тракт и дополнительно
облучать его слизистую оболочку.
Все сказанное относится и к радиоактивным продуктам, вторично попавшим в желудочно-кишечный тракт после ингаляционного
поступления.
Нерастворимые и мало растворимые гамма-излучатели облучают кишечник и другие органы брюшной полости, а бета-излучатели – только слизистую оболочку кишки, в основном до выведения радионуклидов с калом, в течение примерно 30 часов. Однако в криптах кишечника РВ могут задерживаться в течение длительного времени, формируя
высокие локальные дозы.
При нормировании поступления радионуклидов в организм с водой и пищей, так же как и при нормировании ингаляционного поступления, исходят из той предпосылки, чтобы при достижении предела годового поступления (ПГП) величина дозы, накопленной за год, равнялась величине соответствующего годового предела дозы.
Поступление радиоактивных веществ через неповрежденные кожные покровы, раневые и ожоговые поверхности. Большинство радиоактивных веществ практически не проникают через неповрежденную кожу. Исключение составляют окись трития, йод, нитрат и фторид уранила, а также полоний. Коэффициенты резорбции в этих случаях
составляют сотые и тысячные доли единицы.
Проникновение РВ через кожу зависит от площади загрязненного участка, от физико-химических свойств соединения, в состав которого они входят, растворимости в воде и липидах, рН среды, от физиологического состояния кожи. Всасывание радионуклидов повышается при повышении температуры среды вследствие расширения кровеносных и лимфатических сосудов, раскрытия сальных и потовых желез.
Требует особого внимания радиоактивное загрязнение ран в производственных и лабораторных условиях. Основную опасность в случае производственного заражения представляет резорбция высокотоксичных радионуклидов (например, полоний), которая у растворимых РВ может достигать десятков процентов от общего количества, поступившего в рану. Большие количества РВ могут поступить не только через колотые или резаные раны, но и через небольшие царапины и ссадины. Всасывание через них щелочных, щелочноземельных элементов и галоидов в 100-200 раз превышает резорбцию через неповрежденную кожу; это всасывание с поверхности раны трудно растворимых РВ (чаще всего относится и к продуктам ядерного взрыва) происходит медленнее и в значительно меньшем количестве, но все же в сотни раз интенсивнее, чем через интактную кожу. С поверхности ожогов I-II степеней продукты ядерного взрыва всасываются всего в 2-10 раз быстрее.
Проявление общего действия резорбированных продуктов ядерного взрыва с раневых и ожоговых поверхностей мало вероятно. Лишь в редких случаях возможно поступление через раны значительных количеств редкоземельных элементов.
Резорбция плохо растворимых соединений РВ в основном происходит по лимфатическим путям, в результате чего радионуклиды накапливаются в лимфатических узлах. Оттуда некоторая часть радионуклидов с фагоцитами поступает в органы ретикулоэндотелиальной системы. Последствия резорбции чаше всего связаны с избирательной тропностью тех или иных изотопов к отдельным органам (новообразования, лейкозы, другие системные заболевания крови).
В месте нахождения радионуклида в плохо растворимой форме могут возникнуть опухоли (чаще остеогенные саркомы). Имеет значение и воздействие ионизирующего излучения на течение раневого процесса. При поступлении в рану большого количества плохо резорбирующихся радионуклидов под влиянием облучения в клетках тканей раневой поверхности развиваются дегенеративные и некротические процессы, снижается способность клеток к размножению. В ранах часто развиваются гнойные, иногда анаэробные процессы. Медленно отторгаются некротизированные ткани, замедляется регенерация.
3.6.2.2. Метаболизм радиоактивных веществ, всосавшихся в кровь
В крови радионуклиды могут находиться в свободном состоянии или в составе различного рода химических соединений и комплексов. Значительная часть радионуклидов связывается протеинами. Часть радионуклидов, попавших в кровь, выводится из организма, другая часть проникает в органы и депонируется в них. Знание характера распределения, особенностей обмена и депонирования РВ, возможного их перераспределения со временем необходимо для предсказания преимущественного поражения того или другого органа, дозы облучения этого критического органа, клинических проявлений и исхода поражения.
Понятия концентрация и содержание радионуклида в органе не являются синонимами. Под концентрацией понимают удельную активность радионуклида, выражаемую в Бк/г, а содержание – это абсолютное значение активности в целом органе. Концентрация РВ в органе после однократного поступления постепенно снижается, что зависит от радиоактивного распада изотопа и его биологического выведения.
Суммарная константа уменьшения концентрации изотопа в органе (Тэфф.) представляет собой сумму констант радиоактивного распада и биологического выведения. При расчетах чаще пользуются понятием эффективного периода полувыведения – Тэфф. Он связан с периодом полураспада и периодом биологического полувыведения:
При длительном поступлении РВ в организме или в отдельном органе ежедневно накапливается определенная доля поступившего за эти сутки количества. Показателем этого накопления служит величина, называемая «кратностью накопления». Эта величина показывает, во сколько раз содержание радионуклида превышает величину его ежедневного поступления. Так, если к концу поступления РВ в организме содержится 150% от величины суточного поступления, кратность накопления составит 1,5.
Бывает, что после одноразового сравнительно массивного радиоактивного заражения поступление РВ в организм не прекращается полностью, а продолжается длительное время, но в меньших количествах. В этих случаях могут преобладать (в зависимости от уровня поступления) либо процессы депонирования в органе, либо процессы выведения из него.
3.6.2.3. Выведение радиоактивных веществ из организма
Попавшие в организм РВ могут выводиться через почки, желудочно-кишечный тракт (в том числе с желчью), легкие, а также со слюной, молоком, потом. В большинстве случаев основные количества РВ экскретируются с калом и мочой. С калом преимущественно выводятся РВ, поступившие алиментарным путем, а также и при ингаляционном заражении и вторичном заглатывании частиц, вынесенных ретроградно в глотку. Некоторые растворимые радионуклиды могут выделяться с желчью и другими пищеварительными соками и также выводиться с калом. В желудочно-кишечном тракте процессы экскреции РВ постоянно сопровождаются процессами их реабсорбции.
При выведении радионуклидов преимущественно с мочой высокая доза облучения может быть получена почками.
Выведение с выдыхаемым воздухом имеет существенное значение для трития, паров окиси трития, радона и торона, образующихся при распаде поступивших в организм радия и тория.
Динамика выведения РВ из организма описывается теми же формулами, которые приводились в предыдущем разделе при характеристике скорости уменьшения концентрации радионуклидов в отдельных органах. По содержанию РВ в выделениях можно судить о количестве их в организме как на момент определения, так и на момент поступления.
Таким образом, в обмене поступивших в организм радионуклидов можно выделить четыре основные стадии:
– образование на месте поступления первичного депо (кожа, раны, слизистые оболочки желудочно-кишечного тракта, верхних дыхательных путей);
– всасывание с мест поступления в кровь или лимфу;
– депонирование в критическом органе (образование вторичных
депо);
– выведение различными путями, в том числе и с явлениями
рециркуляции.
Продолжительность названных стадий существенно различается для различных радионуклидов и их соединений, а также для разных путей поступления РВ в организм.
Указанные положения должны учитываться при оценке клинической картины поражения и планировании лечебно-профилактических мероприятий. Особенности пространственного и временного распределения дозы определяют характер течения поражения отдельными радионуклидами, различающийся как по особенностям проявления, так и по срокам формирования эффектов. В зависимости от этого меняются и конкретные диагностические, и лечебные мероприятия в различные сроки с момента заражения, и прогностическая оценка данных радиометрических определений.
3.6.2.4. Биологическое действие радиоактивных веществ
При внутреннем радиоактивном заражении (инкорпорации радионуклидов) количество поступивших в организм радионуклидов чаще всего не может создать в течение короткого времени дозы, достаточно высокой для развития острого лучевого поражения. В этих случаях более характерно развитие хронической лучевой болезни.
При внутреннем радиоактивном заражении концепция критического органа представляется сложнее, чем при общем внешнем облучении. В этом случае прежде всего имеют значение особенности распределения радионуклидов по органам и тканям (тропность радионуклидов). Важным фактором являются значения пороговых повреждающих доз для разных тканей. По способности преимущественно накапливаться в тех или иных органах выделяют следующие основные группы радиоактивных элементов (табл. 42).
Таблица 42 – Типы распределения радиоактивных элементов в организме
Элементы 1 группы периодической системы:
Н, Li, Na, К, Rb, Cs, Ru, Cl, Br и др.
Читайте также:
