Внутриклеточные сигналы как биохимические логические цепи
Добавил пользователь Skiper Обновлено: 21.01.2026
Для каждого фактора, действующего на клетку, можно, как правило, выделить основную сигнальную систему, преимущественно определяющую характер формируемого ответа. Однако в большинстве случаев, процесс активации находится под контролем не одной, а нескольких систем внутриклеточной сигнализации, так что важным фактором формирования ответа клеток становится взаимосвязь этих систем.
Передача сигнала в клетку состоит из нескольких стадий:
- 1) взаимодействие рецептора со стимулом или сигнальной молекулой:
- 2) активация находящейся в мембране эффекторной молекулы, которая отвечает за синтез вторичных посредников (мессенджеров);
- 3) образование вторичных посредников (например, диа- цилглицерина, инозитол-1,4,5-трифосфата, оксида азота);
- 4) активация вторичными посредниками белков-мишеней или специализированных клеточных элементов, приводящих к физиологическому ответу;
- 5) исчезновение вторичного посредника.
Несмотря на огромное разнообразие стимулов, сигнальных молекул, рецепторов и процессов, сопровождающих их взаимодействие, существует всего несколько универсальных сигнальных систем, передающих при взаимодействии стимула с рецептором информацию различным клеточным органеллам и запускающих определённые физиологические процессы в клетке. Сигнальные системы являются древнейшими системами, имеющимися у животных и растений.
Механизмы передачи информации в живых системах так же универсальны, как передача генетического кода или трансформация энергии. Во всех клетках животных и растений имеются два основных пути передачи сигнала, различающихся по вторичным посредникам — аденилатциклазный и фосфоинозитидный. Эти пути передачи сигнала имеют много общего. В обоих случаях информацию от первого звена рецептора получают и передают через мембрану в цитоплазму так называемые G-белки, активирующиеся при связывании гуа- нозинтр и фосфата (GTP). G-белки активируют «усилительный» фермент на внутренней стороне мембраны, который способствует превращению молекул вещества-предшественника в молекулы вторичного посредника. Конечные стадии разных способов передачи сигналов также сходны: вторичные мессенджеры вызывают изменение структуры клеточных белков или регулируют экспрессию гена.
В аденилатциклазном пути передачи информации сигнальная молекула, например, адреналин, после взаимодействия со стимулирующим рецептором — (32-адренорецептором через G-белок активирует «усилительный» фермент аденилатцикла- зу (АС) (рис. 7.14). АС катализирует превращение АТР в циклический аденозинмонофосфат (сАМР). Она локализована па внутренней стороне клеточной мембраны. сАМР в цитоплазме взаимодействует с ферментом протеинкиназой А, которая фосфорилирует определённые белки-мишени по остаткам серина или треонина. Так, в печени протеинкиназа А фосфо- рилирует фермент фосфорилазу b (неактивная форма), которая в результате фосфорилирования превращается в активную фосфорилазу а, катализирующую процесс отщепления от гликогена глюкозы.
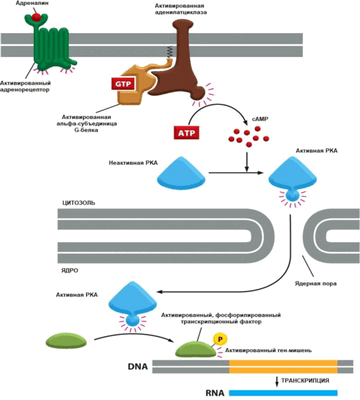
Помимо участия в контроле активности ферментов, сАМР- зависимые протеинкиназы шляются частью важного механизма регуляции экспрессии гена (рис. 7.15). Промоторы некоторых генов содержат сАМР-чувствительные элементы (CREs). Протеинкиназа А через ядерные мембраны проникает в ядро, где она фосфорилирует белок, связывающий сАМР-чувствительные элементы некоторых генов (CREB — сАМР-responsive element binding protein). В результате этого CREB становится активным фактором транскрипции для ряда специфических генов, например, участвующих в индукции синтеза белков теплового шока.
Таким образом, сАМР является вторичным посредником в передаче внешнего сигнала функциональным элементам, как в цитоплазме, так и в ядре.
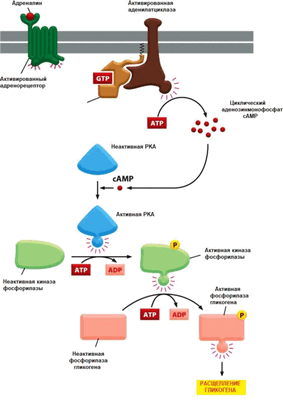
Рис. 7.14. Аденилатциклазный путь передачи сигнала (по Альберту Ъ. и др., 2015)
Ряд сигнальных молекул, например, натрийуретический фактор предсердий (вырабатывается эндотелиальными клетками и стимулирует секрецию натрия почками), вызывает увеличение уровня внутри клетки другого циклического нуклеотида - cGMP, что в свою очередь приводит к активации фермента протеинкиназы G. Образование cGMP из GTP катализируют мембраносвязанная и растворимая формы фермента гуанилатциклазы. Эффекты cGMP более специализированы по сравнению с с АМР. Они включают расслабление гладкой мускулатуры, воздействие на нервные клетки и зрение. Растворимая гуанилатциклаза активируется внутриклеточным и межклеточным мессенджером — короткоживущей мембранопроницаемой молекулой оксида азота (NO). NO играет важную роль в регуляции процессов Са“ -сигнализации и Са 2 , -гомеостаза в различных типах клеток.
Другая группа гормонов и факторов роста использует для передачи сигналов фосфоинозигидный путь. Примерами гормонов, использующих такой механизм, могут служить тиро- тропин-рилизинг гормон, гонадотропин-рилизинг гормон и фактор роста тромбоцитов.
Взаимодействие гормона с рецептором через G-белок активирует усилительный мембраносвязанный фермент фосфолипазу С (PLC) (рис. 7.16). PLC расщепляет мембранный фосфолипид фосфатидилинозитол-4,5-дифосфат (РИС) на два соединения, служащие внутриклеточными мессенджерами: водорастворимый инозитол-1,4,5-трифосфат (1Р3) и липидорастворимый диацилглицерин (DAG). С помощью 1Р3 происходит изменение проницаемости Са-каналов плазматической мембраны и вход Са 2, в клетку, а также осуществляется индуцированный 1Р3 выход кальция из эндо- и саркоплазматического ретикулума (СР), благодаря открыванию Са-каналов в этих внутриклеточных депо Са 2+ .
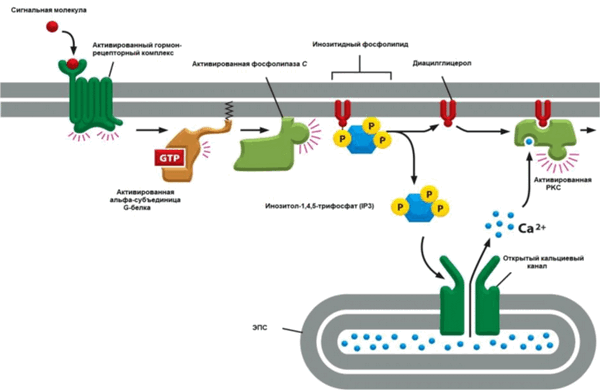
Другой вторичный мессенджер, образующийся в результате работы фосфолипазы С — DAG — активирует протеинкиназу С (РКС). Протеинкиназа С фосфорилирует по остаткам треонина и серина многие белки клетки с последующим изменением их функции. Стадия фосфорилирования белков является одним из основных механизмов регуляции клеточных процессов, поэтому в клетке существует несколько типов протеинкиназ, активирующихся с помощью различных эффекторов. К ним относятся протеинкиназа А, активатором которой является сАМР — вторичный мессенджер при стимуляции (3-рецепторов; протеинкиназа G, активируемая cGMP; Са‘ -кальмодулин-зависимая протеинкиназа и протеинкиназа С, активатором которых является DAG. Одним из эффектов DAG является фосфорилирование Са-канала плазматической мембраны, что вызывает вход кальция в клетку.
Таким образом, оба пролукта фермента фосфолипазы С- и DAG — при во ляг к повышению уровня Са 2+ в клетке.
В таблицах 7.2 и 7.3 суммированы некоторые клеточные ответы, опосредуемые сАМР и фосфолипазой С. Видно, что благодаря множеству регуляторных веществ и многообразию путей их действия достигается тонкая и многосторонняя регуляция метаболизма в пределах не только от дельной клетки, но и целого организма.
Внутриклеточные сигналы как биохимические логические цепи
• Сигнальные сети состоят из групп биохимических реакций, которые напоминают функции математической логики, интегрирующие информацию
• Для обработки информации на более высоком уровне комбинации таких логических функций объединяются в сигнальные сети
Как отмечалось в статьях на сайте, функции передачи сигналов, используемые для интеграции информации и ее направления к клеточным мишеням, удивительно напоминают функции математической логики, которые используются для проектирования индивидуальных цепей электронных компьютеров.
Действительно, существуют биологические эквиваленты практически всех функциональных компонентов, которые хорошо известны компьютерщикам и инженерам, занимающимся конструированием компьютеров и электронных контрольных приборов. Поэтому для того, чтобы понять, как функционируют пути передачи сигнала, полезно рассмотреть отдельные группы реакций в составе процесса как составляющие логической цепи, похожей на компьютерную.
Простейшим примером служит конвергенция двух процессов, ведущих к стимуляции. Если каждый из них генерирует сигнал, достаточный для того, чтобы вызвать ответ, то конвергенция представит функцию «ИЛИ». Если ни на одном из входов сигнал недостаточен, но комбинация обоих вызывает ответ, то конвергирующий путь создаст функцию «И». Цепи типа И также рассматриваются как детекторы совпадений, т. е. ответ генерируется только в том случае, когда одновременно активируются два пути стимуляции.
Функция И возникает в результате комбинации двух близких, но в количественном отношении неадекватных входных сигналов. Наоборот, для генерации ответа могут потребоваться оба механистически разных входных сигнала. Примером служит белок-мишень, который аллостерически активируется только при фосфорилировании, или же он активируется при фосфорилировании, но начинает функционировать только после своей транслокации в специфические внутриклеточные сайты.
Противоположность функции «И» представляет собой функция «НЕ». Она характеризуется тем, что один путь блокирует стимулирующий эффект другого. Во многих точках клеточных сигнальных путей существуют простые логические шлюзы.
Можно также предполагать существование конвергентного пути передачи сигнала в количественном, а не в булевом смысле, рассматривая аддитивность входных сигналов как отдельный процесс. Функция «ИЛИ», относящаяся к верхнему рисунку, может рассматриваться как аддитивный положительный входной сигнал от двух путей. Такая аддитивность может отражать способность двух рецепторов стимулировать пул особого G-белка, или способность двух протеинкиназ фосфорилировать один субстрат.
Аддитивность может приводить к положительному сигналу, как в примере выше, или к отрицательному, когда объединяются два ингибиторных входных сигнала. Ингибирование и стимуляция могут также объединяться аддитивно, давая на выходе алгебраически сбалансированный сигнал. Наоборот, множественные входные сигналы способны объединяться, давая суммарный сигнал больше или меньше аддитивного. Обсуждавшаяся выше Функция НЕТ аналогична описывающей блокаду стимуляции.Функция И описывает синергизм, при котором один входной сигнал потенцирует другой, но сам по себе дает небольшой эффект.
Даже для простой сигнальной сети характерна сложная схема обработки информации. Хорошим примером служит создание «памяти»: преобразование эффекта временного сигнала в более или менее постоянный. Системы передачи располагают множеством механизмов формирования памяти и забывания сигнала. Один из механизмов, общий для протеинкиназного пути, представляет собой цикл положительной обратной связи, и представлен в верхней части рисунка ниже. В этом цикле сигнал на входе стимулирует передатчик (Т), который, в свою очередь, активирует эффекторный белок (Е), формирующий выходной сигнал.
Если эффектор также может стимулировать передатчик, то часть начального сигнала может передаваться на передатчик. При этом передатчик может обеспечивать появление на выходе полного сигнала эффектора, даже при отсутствии входного сигнала. Как показано на рисунке ниже справа, для такой системы обычно характерно существование порогового эффекта.
Положительная опережающая связь может генерировать память другого типа, которая отмечает продолжительность входного сигнала. В таких цепях эффектору необходимы одновременные входные сигналы от рецептора и от промежуточного передатчика. Если путь передачи сигнала от рецептора через передатчик относительно медленный или же необходимо накопление значительных количеств передатчика, ответ включится только при продолжительном сигнале. Это показано на временной диграмме выходного сигнала справа.
Третий путь запоминания представляет собой разрешение одному входному сигналу контролировать обратимость второго регуляторного события. Белок WASP, который инициирует полимеризацию актина, обеспечивающую подвижность клетки и изменение ее формы, активируется при фосфорилировании и при связывании с Cdc42, который представляет собой небольшой ГТФ-связывающий белок (G). Однако фосфорилированный сайт на WASP открывается только после его связывания с Cdc42. Таким образом, для фосфорилирования требуется активированный Cdc42 и активированная протеинкиназа.
Если Cdc42 диссоциирует, фосфорилированное состояние WASP поддерживается до тех пор, пока с ним опять не свяжется другая сигнальная молекула, природа которой неизвестна. При этом снова откроется сайт для протеинфосфатазы. Как представлено на графике временной заисимости, связывание с Cdc42 приводит к активирующему эффекту, а связывание только с киназой не оказывает такого действия. Если присутствует Cdc42, то киназа может активировать WASP. Фосфо-WASP относительно устойчив к одной протеинфосфатазе (Р), однако он дефосфорилируется, если Cdc42 или другой G-белок связывается с ним и открывает сайт для фосфатазы.
Для обработки поступающей информации сигнальные сети используют простые логические функции.
Булевы функции «ИЛИ», «И» и «НЕ» (слева) соответствуют количественным взаимоотношениям между конвергирующими сигналами, представленными справа. Относительно сложный процесс обработки сигнала осуществляется с помощью простых мультибелковых модулей.
На рисунке представлены три типа сигнальных модулей (слева) и их реакция на присутствие агонистов (справа), (сверху)
В модуле положительной обратной связи белок-передатчик (Т) стимулирует эффектор (Е), который продуцирует сигнал на выходе.
Однако эффектор также стимулирует активность передатчика. В результате образуется выключатель типа «все или ничего».
При этом входной сигнал, величина которого не превышает определенного порогового значения, оказывается малоэффективным.
Однако эффективность сигнала резко возрастает, когда обратной связи с эффектором достаточно для поддержания активности передатчика, даже в отсутствие генерации постоянного входного сигнала от рецептора. (в центре)
В положительном опережающем модуле эффектор принимает сигналы от передатчика и от элементов, расположенных перед ним.
Когда стимуляция носит кратковременный характер (короткая горизонтальная полоса под графиком справа), накопления существенных количеств активного передатчика не происходит, и сигнал на выходе достигает минимальной величины.
При более продолжительной стимуляции (длинная горизонтальная полоса) на выходе получается более сильный сигнал, (внизу).
В некоторых модулях переключения двойного контроля, связывание одного регулятора (G) активирует эффектор и демаскирует другой регуляторный сайт, показанный на рис. как сайт Ser субстрата (-ОН) протеинкиназы.
Эффектор может фосфорилироваться или дефосфорилироваться только в том случае, когда он связан с G-белком.
Поэтому, как показано на рисунке справа, добавление одного G будет оказывать активирующий эффект, однако активации одной киназы (К) наблюдаться не будет.
Если киназа активна, пока она связана с белком G, то фосфорилированная форма устойчива к действию фосфатазы, если только G не связался повторно и не произошло демаскирования фосфосеринового остатка (показан на графике справа буквой Р).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Внутриклеточные сигналы и рецепторы передачи сигнала
Все клетки, от прокариот до клеток растений и животных, способны воспринимать сигналы извне и реагировать на них стереотипным образом, который позволяет им выживать, приспосабливаться и функционировать в соответствии с потребностями всего организма.
Эта реакция клеток выражается не просто в форме неких физических или химических явлений или изменений в их локальном окружении. Скорее, следут сказать, что клетка экспрессирует целый ансамбль сенсорных белков, или рецепторов, узнающих специфические внешние сигналы.
В ответ на эти сигналы рецепторы активируют разнообразные внутриклеточные регуляторные белки, которые, в свою очередь, обеспечивают адекватную реакцию клетки. Процесс узнавания внешнего сигнала и передачи соответствующей информации на внутриклеточные мишени называется преобразованием сигнала.
Клетка реагирует на все виды сигналов. Бактерии реагируют на питательные ингредиенты, токсины, тепло, холод, свет и химические сигналы, исходящие от других бактерий.
Клетки многоклеточных организмов экспрессируют рецепторы, специфичные по отношению к гормонам, нейромедиаторам, аутокринным и паракринным агентам (гормоноподобные вещества, секретируемые самой клеткой или ее окружением), к запаху и к молекулам, регулирующим рост или дифференцировку, а также к белкам, расположенным на поверхности клеток. Типичная клетка млекопитающих экспрессирует около пятидесяти различных рецепторов, которые проявляют чувствительность к разнообразным сигналам, а всего у млекопитающих экспрессируется несколько тысяч рецепторов.
Несмотря на большое разнообразие клеток и огромное количество веществ, которые они узнают, основные классы белков и процессы, участвующие в системе преобразования сигнала в клетках, достаточно консервативны.
• Рецепторы, связанные с G-белком, состоящие из семи спиралей, проходящих через мембрану. Они обеспечивают активацию гетеротримерных ГТФ-связывающих белков, которые называются G-белками. Эти белки связаны с внутренней стороной плазматической мембраны и передают сигналы на разные внутриклеточные белки.
• Протеинкиназные рецепторы часто представляют собой димеры белков, проходящих через мембрану, которые фосфорилируют внутриклеточные субстраты и, таким образом, изменяют форму и функции белков-мишеней. Эти протеинкиназы часто содержат домены, ответственные за взаимодействие с другими белками и принимающие участие в организации комплексов сигнальных белков, расположенных на внутренней поверхности плазматической мембраны.
• Фосфопротеинфосфатазы аннулируют эффект протеинкиназ, удаляя фосфатные группы.
• Прочие ферменты, молекулы которых проходят через мембрану, например, гуанилатциклаза, обладают структурой, близкой к рецепторным проте-инкиназам, однако характеризуются различными ферментативными активностями. Гуанилатциклаза катализирует превращение ГТФ в 3'5'-циклоГТФ, который участвует в распространении сигнала.
• Ионные каналы, хотя и имеют ряд отличий в деталях структуры, обычно представляют собой олигомеры субъединиц, из которых каждая состоит из нескольких трансмембранных сегментов. Эти субъединицы способны менять свою конформацию и относительное расположение, тем самым регулируя ионные потоки через центральную пору.
• Двухкомпонентные системы могут обладать трансмембранным расположением или локализуются в цитозоле. Число субъединиц у них также варьирует, но каждая двухкомпонентная система содержит гистидинкиназный домен или субъединицу, находящуюся под контролем сигнальной молекулы, и регулятор ответа, в структуре которого присутствует остаток аспарагиновой кислоты (Asp), способный фосфорилироваться.
• Некоторые рецепторы представляют собой трансмембранный каркас, который меняет конформацию или обладает способностью к олигомеризации своих доменов, расположенных с клеточной стороны. Это происходит в ответ на появление внеклеточных сигнальных молекул или лигандов. Таким образом, происходит отбор регуляторных белков, взаимодействующих между собой в определенных местах мембраны.
• Ядерные рецепторы представляют собой факторы транскрипции, часто гетеродимеры, которые находятся в цитоплазме до момента их активации агонистами, или постоянно присутствуют в ядре. Биохимические процессы, участвующие в преобразовании сигнала в разных клетках, поразительно сходны. Для обнаружения и обработки сигнала, клетки бактерий, грибов, растений и животных используют аналогичные белки и мультибелковые комплексы.
Например, у растений, грибов и в клетках животных обнаружены обладающие близкой структурой гетеротримерные G-белки и соответствующие им рецепторы, сохранившиеся в ходе эволюции. Аналогичным образом, в бактериях, грибах и у животных обнаружен 3'5'-циклический АМФ (цАМФ), представляющий собой внутриклеточную сигнальную молекулу; во всех клетках эукариот аналогичную роль играет Са2+. Во всех клетках в регуляции активности ферментов участвуют протеинкиназы и фосфопротеинфосфатазы.
Хотя основные биохимические компоненты и процессы передачи сигнала достаточно консервативны и используются многократно, они часто вовлекаются в самые разнообразные процессы и принимают участие в реализации множества различных физиологических реакций. Например, цАМФ образуется в бактериях, грибах и у млекопитающих с участием близких по свойствам ферментов, и в каждом организме белки-мишени для этого метаболита различны; так, для некоторых видов миксомицетов он является феромоном.
Часто для регуляции определенного процесса, например транскрипции, ионного транспорта, подвижности и метаболизма, клетки используют одни и те же сигнальные белки. Такие системы передачи сигнала собираются в сигнальные сети с тем, чтобы клетка могла координировать реакции на множественные сигналы с выполняемыми в данный момент функциями. В настоящее время в последовательностях отдельных процессов системы передачи сигнала, и в сети в целом, можно обнаружить присутствие элементов, характерных для компьютерных сетей.
Это усилители, логические шлюзы, контроль обратной и прямой связи, и память.
В дальнейших статьях вначале рассматриваются принципы организации клеточных систем передачи сигнала и общие вопросы стратегии, а затем обсуждаются соответствующие биохимические компоненты и процессы, а также пути конкретной реализации изложенных принципов.
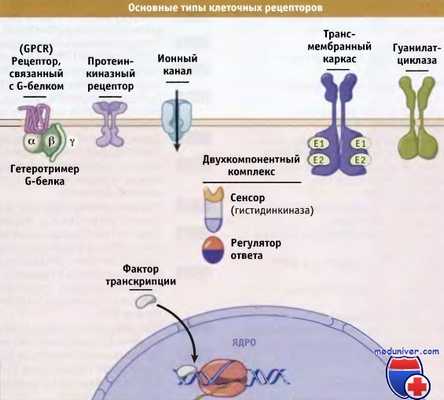
Рецепторы группируются в относительно небольшую группу семейств,
которые характеризуются общими механизмами действия и общностью структуры.
• Процессы передачи сигнала обычно являются многоступенчатыми и могут дивергировать и конвергировать
• Дивергенция обеспечивает множественность ответа на один сигнал
• Конвергенция позволяет сигналам интегрироваться и выполняет координирующую функцию
Рецепторы редко непосредственно воздействуют на внутриклеточные процессы, которые они регулируют. Обычно они запускают последовательность регуляторных процессов, в которых участвуют промежуточные белки и небольшие молекулы. За счет функционирования многоступенчатых систем передачи сигналов клетка способна их усиливать, изменять кинетику, вставлять контрольные точки, интегрировать множественные сигналы и направлять их к различным эффекторам.
Разветвленные пути передачи сигнала дают клетке возможность интегрировать множество входящих сигналов и передавать информацию в необходимые контрольные точки. Как показано на рисунке ниже, разветвление может носить конвергентный характер, когда множественные сигналы регулируют общие конечные точки, или дивергентный характер, при котором система передачи сигнала разветвляется, чем достигается контроль за несколькими процессами.
У многоклеточных, дивергентное разветвление позволяет одному гормональному рецептору инициировать в клетках и тканях определенный тип ответа. Благодаря дивергенции, рецептор обеспечивает количественно разный клеточный ответ. Этот ответ определяется усилением сигнала в на промежуточных этапах его передачи.
Также часто наблюдается конвергентное разветвление — когда для получения одинакового ответа несколько рецепторов активируют один и тот же процесс. Конвергентное разветвление позволяет интегрировать и скоординированно регулировать множественные входящие сигналы стимулирующей и ингибирующей природы в одном общем месте. Рецепторы для нескольких различных гормонов часто инициируют в одной и той же клетке-мишени появление аналогичного или перекрывающегося сигнала.
Перекрывание конвергентных и дивергентных путей передачи сигнала формирует в клетке сигнальную сеть, которая выполняет координирующую роль по отношению к множественным входным сигналам. Обычно такие пути отличаются сложностью, которая проявляется как в их количестве и разнообразии компонентов, так и в пространственном расположении циклов процессов. Сети передачи сигнала также сложно организованы в пространстве. Они могут включать компоненты, расположенные в различных местах клетки, причем рецепторы и связанные с ними белки могут располагаться в плазматической мембране, а белки, участвующие в последующих процессах передачи сигнала, могут находиться в цитоплазме или в органеллах.
Такая сложная организация необходима для того, чтобы клетка могла интегрировать и сортировать приходящие сигналы, а также одновременно регулировать несколько внутриклеточных функций.
Из-за сложности сигнальных сетей и их способности к адаптации, что иллюстрируется нижней частью рисунка ниже, трудно или даже невозможно интуитивно понять их динамику на уровне всей клетки. Организация сигнальных сетей напоминает мощные компьютеры, и чтобы разобраться в потоках информции в клетке и в их регуляции, исследователи все больше нуждаются в специфических компьютерных понятиях.
Во-первых, многие сигнальные процессы, включающие только два или три белка, функционируют так же, как обычные логические компьютерные сети (см. следующий раздел). Известные теоретические основы построения таких сетей и опыт работы с ними в электронике облегчают понимание принципов работы аналогичных биологических систем.
Можно упростить чрезвычайную сложность клеточных сигнальных сетей, если рассматривать их как состоящие из взаимодействующих сигнальных модулей, т. е. групп белков, обрабатывающих сигнал хорошо понятным способом. Клеточный сигнальный модуль аналогичен интегрированной схеме, входящей в состав электронного прибора, выполняющего определенную функцию, причем эта схема может быть использована для выполнения аналогичной функции в другом приборе. Модульная концепция помогает разобраться в количественных и качественных аспектах функционирования сигнальной сети. В дальнейшем, в этой главе мы будем рассматривать много стандартных сигнальных модулей.
В качестве примеров назовем модуль гетеротримера G-белка, каскад МАРК, рецепторы тирозинкиназы (Tyr) и связывающиеся с ними белки, а также модуль выхода/захвата ионов Са2+. В каждом случае, несмотря на многочисленные филогенетические, эволюционные и физиологические различия, понимание основных принципов функционирования этих типов модулей способствует пониманию всех их изменившихся вариантов. Наконец, важную роль играет эволюционная значимость модуля; если организовалась его архитектура, то модуль может использоваться многократно.
В случае крупномасштабных сетей мультиплексные высокопроизводительные измерения, проведенные на живых клетках, объединялись с данными кинетического моделирования с тем, чтобы иметь возможность точно и количественно выразить величину потока информации по сигнальному модулю или по всем сетям. Такие модели с достоверным и экспериментально подтвержденным набором параметров могут описывать сигнальные процессы в системах, слишком сложных для интуитивного или ad boc анализа. Они также представляют ценность в качестве тестов, поскольку с их помощью можно предсказывать результаты экспериментов и использовать это для проверки модели.
Хорошо обоснованными моделями затем можно пользоваться (с осторожностью) для того, чтобы сформулировать предположения относительно механизма функционирования системы, для которой оказалось невозможным установить набор параметров. Для более высоких уровней сложности, теоретические предпосылки и принципиальная схема устройства компьютера позволяют провести анализ сигнальных потоков в клетках на уровне системы. Используя принципы устройства компьютера для анализа больших массивов количественных данных, можно разобраться в потоке клеточной информации и выяснить, как он регулируется. Развитие количественных моделей клеточных сигнальных сетей является совершенно новой областью биологии. Эти модели помогают описывать функционирование сетей и планировать эксперименты, направленные на выяснение механизмов передачи сигналов.
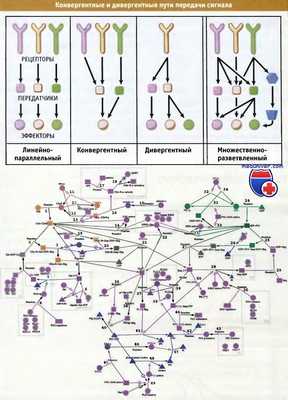
Для координации потоков информации передача сигнала может происходить путем конвергентного и дивергентного разветвления.
Представленная в верхней части диаграмма иллюстрирует, каким образом происходит сортировка информации даже в случае простой трехуровневой сети передачи сигнала.
Конвергенция и дивергенция могут происходить во многих точках, расположенных на пути передачи сигнала.
Для иллюстрации сложности получающейся картины внизу представлен небольшой участок (около 10%) сигнальной сети с участием G-белка в клетках культуры макрофагов мыши.
На схеме отсутствуют некоторые регуляторные механизмы, действующие между основными путями передачи сигнала, а также не учитывается вклад со стороны рецепторов, несопряженных с G-белком.
Внутриклеточные сигнальные пути: исключительная роль системы для организма
На сегодняшний день все еще изучаются невероятные возможности клеток, среди которых система внутриклеточной сигнализации занимает важное место.
Ответ клетки на внутренние или внешние раздражители довольно сложный. Он представляет собой так званый внутриклеточный каскад сигнальных молекул, состоящий из множества биохимических превращений. Некоторые фрагменты этой системы поддерживают выживаемость клеток, другие участвуют в апоптозе.
Понимание особенностей и механизмов функционирования сигнальных путей важно для врачей всех специальностей, в особенности для эндокринологов, иммунологов и дерматологов.
Разновидности молекул, принимающих участие в реализации сигнальных путей
Для того чтобы понимать механизмы формирования внутриклеточных путей передачи информации, необходимо разобраться, какими же бывают посредники – сигнальные молекулы.
Сигнальные молекулы – это различные химические вещества и их соединения, которые способны передавать внутри клетки сигналы из внешней и внутренней среды организма.
В настоящее время выделяют два вида сигнальных молекул: первичные и вторичные посредники.
Первичные мессенджеры, как правило, являются экстраклеточными сигналами. К ним относятся:
Вторичные мессенджеры характеризуются низкой молекулярной массой и высокой скоростью расщепления. К ним относятся:
Сигнальные молекулы по физико-химическим свойствам также делят на липофильные и липофобные.
Механизм внутриклеточной передачи сигнала: классические сигнальные пути
Существует несколько классических способов передачи сигнала между клетками, среди которых наиболее изученным является путь MAPK (mitogen activated protein kinase).
Механизм пути МАРК реализуется следующим образом: сначала происходит трансмембранная активация рецепторов клетки с помощью цитоплазматических и ядерных протеинов, что в дальнейшем воздействует на транскрипцию генов, метаболизм, пролиферацию клеток, апоптоз и другие процессы.
Сигналы от первичных мессенджеров распознаются благодаря тирозиназным рецепторам или рецепторам, связанными с G-белками, которые активируют ГТФазы семейства Ras и Rho. Протеинкиназы фосфорилируют белки-мишени и факторы транскрипции, которые определяют конкретные реакции клеток.
Повреждающие воздействия, такие как окислительный стресс, помимо разрушения компонентов клеток, усиливают экспрессию ряда сигнальных и защитных белков.
Читайте нас также в Instagram
Основные виды гуморальных регуляторных эффектов сигнальных молекул
Передача сигналов между молекулами имеет несколько вариантов путей:
опосредствованный путь передачи сигнала (мембранные рецепторы) и прямой путь рецепции (внутриклеточные рецепторы).
Клетки-мишени – это клетки, имеющие специализированные рецепторы на своей поверхности для определенного вида сигнальных молекул.
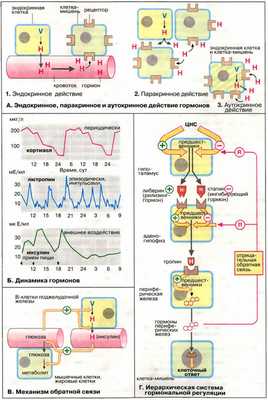
Регуляцию сигнальных молекул выполняют такие системы, как эндокринная, паракринная и аутокринная.
1. Эндокринная регуляция заключается в том, что посредники поступают к клеткам-мишеням из желудочно-воротной системы с током крови. Такой механизм характерный для большинства гормонов;
2. Паракринная регуляция осуществляется с помощью сигнальных молекул, которые вырабатываются в пределах одного органа;
3. Аутокринная регуляция характеризуется тем, что вещество оказывает влияние на ту же клетку, в которой оно образуется, тем самым изменяя ее функциональную активность.
Координацию нервной и гуморальной регуляции осуществляет гипоталамо-гипофизарная система.
Последствия гиперактивности некоторых сигнальных путей для организма
На примере постоянной активации сигнального каскада рецептора эпидермального фактора роста (EGFR) можно рассмотреть последствия данного процесса для клеток организма.
Семейство генов RAS имеют огромное значение для сигнального RAS-пути. Нормальный RAS находится преимущественно в неактивной, GDP-связанной форме. Активация RAS регулируется рецепторной тирозинкиназой EGFR.
После связывания рецепторной внеклеточной части тирозинкиназы с фактором роста происходит взаимное фосфорилирование ее внутриклеточных доменов. Образование активного комплекса RAS-GTP происходит в присутствии активирующего GTP-азу белка GAP, в сотни раз ускоряющего гидролиз. После гидролитического превращения GTP в GDP RAS снова инактивируется. Сигнал прерывается. Чтобы воспринять новый сигнал, если он еще существует вне клетки, цикл реактивации должен быть повторен.
Таким образом, каскадная последовательность реакций сигнального пути RAS действует как включатель, определяющий регуляцию генной экспрессии, требующуюся для реализации деления или дифференцировки клетки. Постоянная активация RAS-системы ведет к генным мутациям и злокачественному перерождению клеток.
Читайте также:
