Внутрипросветное шунтирование сосудов конечностей. Преимущества, недостатки
Добавил пользователь Morpheus Обновлено: 28.01.2026
ФГБОУ ВО «Курский государственный медицинский университета» Минздрава России
ОБУЗ «Городская клиническая больница скорой медицинской помощи Курска», Россия
Кафедра общей хирургии ФГБОУ ВО «Курский государственный медицинский университет» Минздрава России, Курск, Россия
Кафедра общей хирургии Курского государственного медицинского университета
Эффективность биологического протеза при бедренно-бедренном шунтировании у лиц с высоким операционным риском
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2018;(5): 86‑90
Цель ― сравнить результаты применения синтетического и биологического протезов при бедренно-бедренном шунтировании. Материал и методы. Проведен анализ результатов лечения 40 больных, страдающих критической ишемией нижних конечностей на почве атеросклеротического поражения аортоподвздошного сегмента и тяжелой соматической патологией. Пациенты были разделены на две группы по 20 человек в каждой. В 1-й группе проведено C-образное бедренно-бедренное шунтирование при помощи синтетических политетрафторэтиленового и лавсанового протезов, а во 2-й ― S-образное при помощи биологического протеза из внутренних грудных артерий быка. Результаты. Применение в качестве шунта биологического протеза позволяет в ближайшем послеоперационном периоде снизить количество ранних послеоперационных осложнений на 10%, поздних тромбозов шунта на 20%, повысить физический и психологический компоненты здоровья ― на 7,1%. Заключение. S-образное бедренно-бедренное шунтирование при помощи биологического протеза из внутренних грудных артерий быка патогенетически обосновано и эффективно.
Одной из проблем сосудистой хирургии является лечение критической ишемии нижних конечностей при поражении аортоподвздошного сегмента у больных с высоким операционно-анестезиологическим риском [1]. Пациентам этой группы невозможно выполнить прямые реконструктивные операции на аорте, а проведение непрямой реваскуляризации в сочетании с консервативной терапией приводит к потере конечности у 80―90% больных [2]. При двустороннем поражении подвздошных артерий единственной альтернативой консервативного лечения является подмышечно-бедренное шунтирование синтетическим или биологическим протезом, которое позволяет сохранить конечность у 60―70% больных [3, 4]. При одностороннем поражении подвздошной артерии выполняется операция перекрестного бедренно-бедренного шунтирования. Одним из вопросов является методика ее выполнения. В настоящее время применяются 2 варианта перекрестного шунтирования: C-образный и S-образный [5]. Наиболее часто используется технически легко выполнимый 1-й вариант, при котором анастомозы между шунтом и общими бедренными артериями накладываются на одном уровне [6]. При S-образном варианте анастомоз на функционирующей бедренной или подвздошной артерии накладывается проксимальнее дистального на нефункционирующей бедренной артерии. Единого мнения, какой вариант и в каких случаях применять, нет. Другим вопросом является выбор трансплантата для бедренно-бедренного шунтирования. «Золотым стандартом» выбора протеза для реконструкции артерий ниже пупартовой связки остается аутовена [7]. Однако сравнительный опыт применения аутовены и синтетических трансплантатов показал их одинаковую эффективность в бедренно-бедренной позиции [8]. Поэтому для бедренно-бедренного шунтирования большинство ангиохирургов используют синтетический протез, оставляя аутовену для выполнения последующих реконструктивных операций на артериях нижних конечностей [1, 2, 4―8]. Проведенные ранее экспериментальные исследования имплантации синтетического и биологического протезов на артериальную стенку показали, что биологический протез обладает большей биосовместимостью, чем синтетический [9]. Биологический протез до настоящего времени в бедренно-бедренной позиции не использовался. Поэтому представляет интерес изучение результатов его применения в качестве шунта в данной операции.
Цель исследования — сравнение результатов применения синтетического и биологического протезов при бедренно-бедренном шунтировании.
Материал и методы
Проведен анализ комплексного обследования и хирургического лечения 40 больных, с высоким операционно-анестезиологическим риском, страдающих критической ишемией одной из нижних конечностей. Среди больных мужчин ― 38, женщин ― 2. Возраст больных колебался от 62 до 82 лет. Причиной заболеваний было одностороннее атеросклеротическое поражение аортоподвздошного сегмента (синдром Лериша), кроме того, у всех больных отмечалось окклюзионно-стенотическое поражение общей и поверхностной бедренных артерий, поэтому реваскуляризация конечности проводилась путем включения в кровоток глубокой артерии бедра. Пациенты были разделены на 2 группы по 20 человек в каждой. В 1-й группе надлобковое бедренно-бедренное шунтирование проводилось с использованием синтетических протезов (политетрафторэтиленового и лавсанового), а во 2-й ― при помощи биологического протеза из внутренних грудных артерий быка. Диаметр синтетического протеза 8 мм, биологического протеза 4 мм ― дистальный конец, 6 мм ― проксимальный. Длина протезов в обеих группах колебалась в пределах 24±6 см.
Оперативное вмешательство у пациентов в 1-й группе проводили под спинномозговой анестезией. Положение больного на операционном столе на спине. Операцию начинали с выделения бедренных сосудов в паховой области. Тупым путем без дополнительного разреза формировали туннель над лоном. На функционирующей общей бедренной артерии накладывали анастомоз по типу конец синтетического протеза в бок артерии. «Носок» анастомоза располагали дистально, а «пятку» проксимально. Шунт проводили на противоположную сторону и накладывали анастомоз на нефункционирующую общую бедренную артерию аналогичным образом. При необходимости производили эндартерэктомию из общей и глубокой артерий бедра, профундопластику. Анастомозы располагались на одном уровне, и при пуске кровотока шунт принимал С-образную форму.
У больных 2-й группы технология выделения бедренных сосудов такая же, как в 1-й группе, аналогично проводилось и формирование туннеля. Затем функционирующую бедренную артерию выделяли как можно проксимальнее с обнажением дистального отдела наружной подвздошной артерии. «Носок» проксимального анастомоза располагали на наружной подвздошной артерии, а «пятку» ― на функционирующей общей бедренной артерии. Трансплантат проводили по туннелю на противоположную сторону. «Носок» дистального анастомоза располагали на глубокой артерии бедра, а «пятку» ― на общей бедренной артерии. При необходимости производили эндартерэктомию из глубокой артерии бедра. После выполнения операции проксимальный анастомоз располагался выше дистального, а шунт принимал S-образную форму. У 3 больных 2-й группы при окклюзии глубокой артерии бедра проводили перекрестное бедренно-подколенное шунтирование в первый сегмент артерии.
Диагностическая программа была традиционной и включала функциональные (реовазография, допплерография, фотоплетизмография), ультразвуковые (ангиосканирование) и рентгенологические (аортоартериография) методы исследования. Изменение интенсивности артериального кровотока после операции регистрировали по динамике реовазографического индекса (РИ) и лодыжечно-плечевого индекса (ЛПИ), а микроциркуляции ― по динамике фотоплетизмографического индекса (ФИ).
Результаты лечения оценивались на основании степени изменения клинического статуса по отношению к дооперационному периоду по шкале R. Rutherford и соавт., которая рекомендована в качестве стандарта Российским обществом ангиологов и сосудистых хирургов [10]. В соответствии с международными рекомендациями проведена оценка качества жизни больных до и через 12 мес после лечения на основании анкетного обследования пациентов с помощью опросника MOS SF-36, нормированного для сосудистых больных.

Распределение больных по характеру сопутствующей соматической патологии представлено в табл. 1, которая Таблица 1. Частота сопутствующей соматической патологии Примечание. ИБС ― ишемическая болезнь сердца. показывает, что 100% пациентов страдали тяжелыми соматическими заболеваниями. При этом у всех больных отмечались 2―3 заболевания, резко нарушавших функцию жизненно важных органов. Фракция выброса крови из левого желудочка сердца у пациентов обеих групп не имела статистически достоверных различий и колебалась в пределах 37±5%. По шкале ASA американского общества анестезиологов у всех пациентов была IV степень операционно-анестезиологического риска, препятствующая выполнению прямых реконструктивных операций на аорте.

Частота и характер поражения артерий нижних конечностей представлены в табл. 2. Таблица 2. Частота окклюзионно-стенотических изменений артерий нижних конечностей
Статистическую обработку материала проводили с использованием прикладного пакета статистических программ Statistica 6. Анализ вида распределения признака выполняли отдельно для каждой группы. Данные в выборках оценивали на нормальность распределения по методу Шапиро―Уилка. В случае нормального распределения и подтверждения равенства дисперсии определение статистической значимости различий осуществляли с помощью t-критерия Стьюдента. Полученные данные представлены в виде M±m. Для работы с распределением, отличающимся от нормального, применяли непараметрические методы статистического анализа, критерии Уилкоксона и Манна―Уитни. Результаты считали статистически значимыми при p
Результаты изучения макрогемодинамики и микроциркуляции пораженной нижней конечности до и после оперативного лечения представлены в табл. 3. Таблица 3. Динамика показателей артериального кровотока и микроциркуляции до и после оперативного лечения Примечание. РИ ― реовазографический индекс; ЛПИ ― лодыжечно-плечевой индекс; ФИ ― фотоплетизмографический индекс; * ― p
Очевидно, что синтетический и биологический протезы значительно повышают объемный и магистральный кровоток, уровень микроциркуляции в пораженной нижней конечности. Статистически достоверной разницы в показателях между группами больных не обнаружено.
В 1-й группе в раннем послеоперационном периоде у 4 (20%) больных развились следующие осложнения: у 1 (5%) ― ранний тромбоз шунта, у 3 (15%) ― инфицирование шунта. Во 2-й группе послеоперационные осложнения обнаружены у 2 (10%) больных: в обоих случаях отмечалось развитие лимфореи из ран в паховых областях. Пациент с ранним тромбозом шунта был повторно прооперирован. Восстановить кровообращение не удалось ввиду отсутствия воспринимающего сосудистого русла. Больному выполнена ампутация конечности. Массивная антибиотикотерапия и адекватное дренирование позволили купировать воспалительный парапротезный процесс у 3 пациентов с инфицированием шунтов. Лимфорея из операционных ран остановлена консервативными мероприятиями.
В 1-й группе в отдаленном послеоперационном периоде у 5 (25%) больных отмечен тромбоз синтетического протеза. После прекращения работы шунта у 1 (5%) больного критическая ишемия рецидивировала, ему выполнена высокая ампутация конечности. У остальных 4 (20%) пациентов после тромбоза шунта критическая ишемия не рецидивировала. Конечность удалось сохранить 18 (90%) больным.
Во 2-й группе в отдаленном послеоперационном периоде тромбоз биологического протеза вследствие его варикозной трансформации развился у 1 (5%) больного, и прогрессировавшая после тромбоза ишемия конечности потребовала выполнения ампутации бедра. Конечность удалось сохранить 19 (95%) больным.

Результаты оценки степени изменения клинического статуса по отношению к периоду до операции представлены в табл. 4. Таблица 4. Динамика клинического статуса больных ХОЗАНК после проведенного лечения Примечание. ХОЗАНК ― хронические облитерирующие заболевания артерий нижних конечностей; * ― р
В исследуемой группе число пациентов со значительным улучшением клинического статуса увеличилось на 15%, с умеренным улучшением ― на 5%, а со значительным ухудшением снизилось на 5%.
В течение первого года после операции умерли 4 пациента от прогрессирования тяжелых соматических заболеваний.

Результаты оценки качества жизни пациентов представлены в табл. 5, которая Таблица 5. Оценка качества жизни больных до и через 12 мес после лечения, в баллах (по шкале SF-36) Примечание. * ― р
Наложение С-образного перекрестного бедренно-бедренного шунтирования синтетическим протезом нарушает геометрию потока крови: кровоток из функционирующей бедренной артерии направляется по выпуклой дуге вначале в проксимальном направлении, а затем в дистальном в нефункционирующую бедренную артерию. Этот недостаток отрицатель-ным образом сказывается на длительности функционирования шунта. Другой недостаток применения синтетического протеза заключается в быстром развитии гиперплазии интимы в местах анастомозирования с артериями больного. Основным преимуществом S-образного бедренно-бедренного шунтирования биологическим протезом является сохранение естественной геометрии потока крови из проксимального отдела артериального русла в дистальное. Кроме того, при анастомозировании биологического протеза с артериями больного, гиперплазия интимы анастомоза развивается значительно медленнее, чем при анастомозировании синтетическим протезом. Недостатком биологического протеза является возможность развития его варикозной трансформации под действием артериального кровотока.
Вывод
Применение в качестве S-образного шунта биологического трансплантата в бедренно-бедренной позиции патогенетически обосновано, позволяет в ближайшем послеоперационном периоде снизить количество ранних послеоперационных осложнений на 10%, поздних тромбозов шунта ― на 20%, повысить физический и психологический компоненты здоровья ― на 7,1%.
Внутрипросветное шунтирование сосудов конечностей. Преимущества, недостатки
При определенных обстоятельствах восстановление артерий отступает на второй план из-за угрожающих жизни повреждений с системными проблемами (шок, гипотермия, ацидоз, коагулопатия) или нестабильностью скелета, создающей риск для линии шва.
При этом жизнеспособность конечности подвергается значительному риску, особенно при отсрочке реваскуляризации более чем на шесть часов. Этого риска можно избежать, используя пластиковые трубки, которые временно вводятся в пересеченные концы поврежденных сосудов для немедленного восстановления перфузии конечности.
При комбинированных артериальных и венозных повреждениях таким путем можно возобновить артериальный кровоток и восстановить вену. Parry et al. сообщили об успешном использовании временного шунтирования вен в качестве альтернативы перевязке и для поддержания оттока, до тех пор пока состояние пациента не позволит выполнить окончательное восстановление.
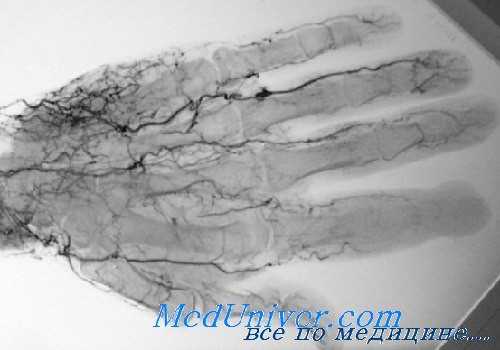
Внутрипросветные шунты также полезны при обследовании и подготовке к реимплантации для устранения продолжающейся ишемии и предотвращения повреждении тканей на время выполнения других, более неотложных мероприятий.
Шунты можно формировать из стерильных трубок от внутривенных капельных систем или использовать коммерческие, доступные в различных формах и размерах. Установка занимает несколько минут. После выделения проксимального и дистального отрезка сосуда, катетерной тромбэктомии и местной гепаринизации, шунтирующая трубка вводится в проксимальном направлении, промывается кровью, а затем проводится в дистальный сегмент сосуда и фиксируется лигатурой или сосудистой петлей. Если требуется вставочный трансплантат, то его можно надеть поверх шунта, первый анастомоз накладывается при работающем шунте, который затем можно извлечь через второй анастомоз перед наложением нескольких последних швов.
Внутрипросветные шунты минимизируют время ишемии в условиях сложных повреждений периферических сосудов у пациентов с множественными травмами, когда приоритеты лечения не позволяют немедленно выполнить окончательное восстановление сосудов. Показано, что быстрое восстановление этим методом как перфузии, так и венозного оттока улучшает выживаемость конечности при ее сочетанных скелетных, венозных и артериальных повреждениях.
Шунты также служат прекрасным средством для ограничения последствий травмы у нестабильных пациентов, когда окончательное восстановление артерий и вен невозможно, создавая желанную альтернативу перевязке с утратой конечности. Необходимо обязательно обращать внимание на оставленные шунты, убеждаясь в их проходимости путем прямого осмотра в ране, пальпации дистального пульса и определения допплеров-ского потока над интактным дистальным отделом артерии.
Опубликованы данные о сохранении проходимости до 52 часов без системной антикоагуляции. Тромбоз шунта нужно устранять немедленно путем тромбэктомии баллонным катетером и повторной установки, действий, которые могут быть легко выполнены в операционной или в палате.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Шунтирование сосудов нижних конечностей
Кроме варикозной болезни вен существует еще ряд других заболеваний, которые могут спровоцировать сужение сосуд ов ног . В результате сосуды могут сузиться до критического момента и перестанут проводить питательные вещества к тканям.
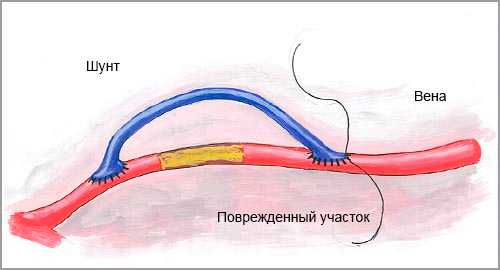
Ч тобы восстановить нормальный кровоток хирург-флеболог провод и т операцию по шунтированию сосудов. Шунт (часть сосуда) вводится в обход поврежденного участ ка вены, позволяет нормализовать кровоток в ткани и вернуть им необходимое питание.
С пособ введения шунта зависит от области повреждения сосуда. Области повреждения вен:
- Бедренная часть. В области паха делается надрез, край шунта устанавливается в брюшную аорту, вторая часть шунта подходит к здоровому участку вены на бедре.
- Бедро и подколенная часть. В этом случае разрезают участок паховой зоны и задняя сторона колена. Шунт связывает здоровую вену в бедренной части и артерию, проходящую под коленом.
- Бедренно-берцовая область. Здесь используют собственную вену, путём присоединения большой подкожной вены к артериальному кровотоку. Для этого делают небольшой надрез в области паха и голени.
- Метод этажного шунтирования. Если в области поражения все сосуды имеют частичный кровоток. Тогда врач для нормализации тока крови, внедряет шунт в здоровые участки нескольких вен.
- Область стопы. Проводится для восстановления кровообращения к пальцам ног. В качестве шунта используется часть большой подкожной вены.
Ш унты бывают двух видов:
- Биологические (натуральные) шунты. Биологическ ий шунт очень прочны й: может сдерживать поток артериальн ой крови. В медицине введение биологического шунта проводится часто , так как родные ткани организма лучше приживаются. Материал для изготовления шунта берут из подкожных бедренных вен пациента.
- Механические или синтетические шунты. Применяют при обширных поражениях сосудов. Изготавливаются из безопасных полимеров. Используются в шунтировании крупных сосудов.
Когда применяют шунтирование сосудов
Операция « Ш унтировани е сосудов нижних конечностей» применяется строго по следующим показаниям:
- Аневризмы периферической артерии (расширение сосуда вызванное поражением его стенок);
- Атеросклероз вен (отложение холестериновых бляшек на стенках сосуда);
- Хронические заболевания с поражением артерий нижних конечностей;
- Варикозная болезнь;
- Тромбозы и тромбофлебиты;
- Первичные проявления гангрены ног;
- Неэффективно медикаментозное лечение.
Не проводят шунтирование сосудов нижних конечностей, когда:
- Есть возможность провести ангиопластику;
- Больной полностью парализован;
- Плохие показатели по анализам;
- Нарушена работа отдельных органов.
Подготовка к операции по шунтированию вен нижних конечностей
Перед оперативным вмешательством пациенту следует пройти ряд подготовительных мер:
- Комплексное обследование сердечно-сосудистой системы (суженные сосуды могут быть во всех частях тела);
- Сдать общий анализ крови;
- Пройти ЭКГ и УЗИ сосудов.
Важно сразу сообщить врачу, какие лекарственные препараты вы принимаете . На основании этих данных, флеболог определит: какие препараты вам следует продолжать применять, а какие нужно исключить перед операцией.
Как проводится операция по шунтированию сосудов нижних конечностей
Хирург-флеболог проводит разрез тканей кожи в двух местах: выше и ниже пораженного участка, не затрагивая вену. Врач оценивает состояние пораженного участка и накладывает зажимы по обе стороны вены для предотвращения кровотечения. Затем хирург-флеболог делает надрез вены с одной стороны и закрепляет на ней шунт. Далее шунт проводится между мышцами и сухожилиями к месту второго надреза и закрепляется. Снимаются зажимы и оценивается состояние кровотока. Если артерия начала пульсировать, значит операция прошла успешно. Конечный этап: ушивание глубоких тканей кожи и накладывание повязки.
В зависимости от индивидуальных показаний здоровья пациента операция проводится под местным и ли общим наркозом. Проводится операция от одного до трех часов в зависимости от размеров поражённой области и расположения сосуда.
Внедрённая искусственная вена сохраняет свою работоспособность на протяжении 10 лет, при условии точного соблюдения рекомендаций врача.
Реабилитация и восстановление после шунтирования сосудов на ногах
До и после операции на сосуды пациент получает от флеболога индивидуальные рекомендации по уходу за прооперированном участком. В первый день сразу после операции пациенту необходимо:
- Накладывать холодные компрессы на прооперированный участок ног, чтобы снизить отёк.
- Но сить компрессионно е бель е для предотвращения тромбозов.
Ч ерез 2 дня после операции на сосуды пациенту рекомендуется:
- Ежедневные пешие прогулки;
- Держать приподнятыми конечности во время сна;
- Поддерживать послеоперационные раны в сухом состоянии;
- Придерживаться диетам и вести здоровый образ жизни;
- Следовать предписаниям врача.
Где проводится шунтирование сосудов
Шунтирование сосудов является эффективным способом восстановления кровотока после запущенных форм варикоза. Если у вас уже диагностирована тяжелая форма варикоза или вы хотите пройти диагностику вен, то запишитесь на приём в Флебологический центр Им. Пирогова. Наши врачи помогут вам восстановить кровообращение в венах ног.
Мы находимся по адресу: г. Москва, Гагаринский переулок, д. 37/8 (метро «Смоленская» Арбатско-Покровской линии, метро «Кропоткинская»).
Первый МГМУ им. И.М. Сеченова;
Московский НИИ педиатрии и детской хирургии
РНЦХ им. акад. Б.В. Петровского РАМН
Временное внутрипросветное шунтирование при реконструктивных операциях на брахицефальных артериях
Цель. Представить успешный опыт применения временного внутрипросветного шунтирования (ВПШ) и алгоритм безопасной установки шунта при выполнении реконструкции брахицефальных артерий в отделении кардиохирургии Первого МГМУ им. И.М. Сеченова с 2009 по 2014 г. Материал и методы. Всего выполнено 70 реконструктивных операций, на брахицефальных артериях — у 66. Временное ВПШ применено у 15 пациентов. Подробно изложен протокол для применения временного ВПШ и алгоритм безопасной установки шунта при выполнении реконструкции брахицефальных артерий. Результаты. Применение описанной техники позволило добиться хороших непосредственных результатов реконструктивных операций у 65 пациентов. Осложнений, связанных с применением временного ВПШ, и летальных исходов не отмечено. У 1 (1,5%) пациента в послеоперационном периоде развилось острое нарушение мозгового кровообращения (ОНМК) на стороне операции, временное ВПШ у этого пациента не применяли.
Уже более 60 лет для профилактики ишемического инсульта применяют хирургическое удаление атеросклеротической бляшки из бифуркации сонной артерии и устья внутренней сонной артерии (ВСА) [8].
Многочисленные исследования и опыт тысяч операций позволил сформировать показания для проведения каротидной эндартерэктомии (КЭ), определить оптимальный объем предоперационных обследований и тактику послеоперационного ведения [4, 9].
Предложено несколько вариантов операции — КЭ с пластикой заплатой, КЭ с первичным швом, эверсионная эндартерэктомия, каждый из которых имеет свои преимущества и недостатки. Неоспоримым преимуществом КЭ с применением расширяющей заплаты стали превосходные отдаленные результаты, в то время как уменьшение времени пережатия ВСА стало сильной стороной методики первичного шва «в край» и эверсионной эндартерэктомии [2].
В настоящее время при проведении КЭ применяют два основных вида анестезиологического пособия: комбинированный эндотрахеальный наркоз (КЭТН) и локальная регионарная анестезия (ЛРА).
Преимуществом ЛРА является возможность интраоперационного динамического неврологического мониторинга, в то время как сильной стороной КЭТН можно считать неограниченные возможности фармакологической защиты мозга [1, 3].
Существует несколько способов оценки толерантности головного мозга к ишемии во время пережатия ВСА на операции К.Э. Прямое измерение ретроградного давления в ВСА стало первой методикой, широко применяемой до настоящего времени. Динамический неврологический мониторинг при проведении операции в условиях ЛРА не требует специального оборудования и является «золотым стандартом» в определении интраоперационного неврологического статуса пациента. Транскраниальная допплерография скорости кровотока в средней мозговой артерии и церебральная оксиметрия расширили возможности неинвазивного интраоперационного мониторинга. Применение всех этих методик служит одной единственной цели — своевременно выявить угрозу ишемического повреждения головного мозга во время операции КЭ [6, 7, 10].
При низкой толерантности головного мозга некоторые авторы [5, 11] рекомендуют применять временное ВПШ на стороне операции, другие отказываются от него, полагаясь на скорость выполнения процедуры. Постановка ВПШ, по мнению ряда авторов, имеет потенциальную опасность — расслоение дистального отдела ВСА, материальная эмболия фрагментом бляшки.
Цель исследования — интраоперационная оценка толерантности головного мозга к ишемии и его защита при пережатии ВСА во время каротидной эндартерэктомии и непосредственные результаты каротидной эндартерэктомии в Клинике аортальной и сердечно-сосудистой хирургии с 2009 по 2014 г .
Всего выполнено 70 реконструктивных операций на брахицефальных артериях у 66 пациентов. У 11 (16,7%) пациентов выявлено билатеральное поражение — 7 пациентов прошли через этапное хирургическое лечение, а в 4 случаях выполнена симультанная билатеральная каротидная эндартерэктомия. У 5 (7,5%) пациентов при обследовании выявлена окклюзия контралатеральной ВСА (см. таблицу).
Типы выполненных в ходе исследования операций
Реконструкцию брахицефальных артерий выполняли при выявлении:
— стеноза ВСА 60% и более;
— гемодинамически значимой извитости ВСА.
Все операции выполняли в плановом порядке, после комплексного обследования, в которое в обязательном порядке входили УЗДГ БЦА, МСКТ брахицефальных артерий или прямая ангиография, исследование функции сердца (ЭКГ, ЭхоКГ, коронарография).
В клинике аортальной и сердечно-сосудистой хирургии Первого МГМУ им. И.М. Сеченова на совместной конференции сотрудников отделения анестезиологии и реанимации и кардиохирургии был выработан единый протокол анестезиологического пособия и способов определения толерантности головного мозга к ишемии при КЭ.
Все операции выполняли в условиях комбинированного эндотрахеального наркоза с внутривенным потенцированием. Для оценки коллатерального кровотока из системы контралательной ВСА и вертебробазилярного бассейна и толерантности головного мозга к пережатию ВСА мы применяем транскраниальную допплерографию. Одеваем на голову пациенту шлем и на уровне височного окна датчиком 2 МГц лоцируем среднюю мозговую артерию (СМА) на стороне операции. Пробу с пережатием проводим в условиях управляемой артериальной гипертензии при АД 150—170 мм рт.ст. Снижение средней скорости кровотока в СМА на стороне операции более чем на 50% от исходного и/или исчезновение пульсирующего характера кровотока в ней служит показанием для применения временного ВПШ.
Временное ВПШ применили в 15 (21,4%) случаях. Показанием для превентивного применения временного ВПШ у 4 (6%) пациентов стала окклюзия контралатеральной ВСА, в 11 (16,7%) случаях — снижение линейной скорости кровотока в средней мозговой артерии на стороне операции более чем на 50% от исходного и/или исчезновение пульсирующего характера кровотока в ней.
Существует несколько видов временных ВПШ. Наибольшее распространение получили две модели: Pruitt-Inahara (LeMaitre) с раздуваемыми баллонами и Т-образным портом (длинный и короткий) и обычный трубчатый шунт Flexel (LeMaitre) диаметром 2,64—4,62 мм.
У всех пациентов мы применяли шунт Pruitt-Inahara F3 с Т-образным портом. В 9 случаях использовали короткий вариант длиной 15 см, который устанавливали после удаления атеросклеротической бляшки и шунт располагали только внутри артерии. В 6 случаях мы применяли модификацию шунта длиной 31 см, дистальный и проксимальный концы располагали в ОСА и ВСА соответственно, а петлю шунта — снаружи артерии для облегчения манипуляций при удалении атеросклеротической бляшки.
К преимуществам шунта Pruitt-Inahara следует отнести:
— возможность контроля давления по T-образному порту;
— возможность применения как до удаления атеросклеротической бляшки (длинный), так и после удаления бляшки (короткий);
— малый диаметр 2,7—3,3 мм удобен для манипуляций в ране;
— отсутствие необходимости применения турникета в дистальном отделе ВСА за счет наличия раздуваемного баллона;
— баллон безопасности — сигнальное устройство, информирующее о создании избыточного давления при раздувании дистального баллона шунта, что может привести к перекрытию просвета шунта;
— простые и атравматичные манипуляции при установке и уделении шунта.
Установку временного внутрипросветного шунта мы выполняли по следующей стандартной схеме:
— пережатие ВСА, НСА, ОСА;
— эндартерэктомия из ОСА, ВСА;
— промывание ОСА физиологическим раствором и антеградным кровотоком;
— промывание ВСА физиологическим раствором и ретроградным кровотоком;
— установка проксимального конца шунта в ОСА, раздувание проксимального баллона, взятие ОСА на турникет;
— выпуск воздуха из дистального конца шунта и Т-образного порта;
— снятие зажима с ВСА, установка дистального конца шунта во ВСА и пуск кровотока, раздувание дистального баллона под контролем баллона безопасности и транскраниальной УЗДГ.
Появление пульсирующего кровотока в СМА на стороне операции после установки временного шунта свидетельствует об адекватном позиционировании и функционировании шунта.
По завершении манипуляций на ВСА, когда остается около 1,0 см артериотомии, мы удаляем временный шунт — сначала дистальный конец, затем проксимальный. Пережимаем ОСА, ретроградным кровотоком из ВСА промываем артериотомическое отверстие, пережимаем ВСА, промываем артериотомическое отверстиве физиологическим раствором. Последние 0,5 см дошиваем при снятом зажиме с ВСА, что позволяет эвакуировать воздух и возможные микроэмболы из зоны реконструкции. Далее пинцетом наискосок пережимаем устье ВСА и снимаем зажимы с НСА, верхней щитовидной артерии и ОСА. После 7—9 сокращений сердца убираем пинцет и пускаем кровоток во ВСА.
Далее через контрапертуру устанавливаем дренаж к месту реконструкции и послойно ушиваем рану. Пациента переводим для дальнейшего лечения и наблюдения в отделение реанимации.
Результаты
Всего выполнено 70 операций у 66 пациентов. Летальных исходов не было.
КЭ с пластикой ксеноперикардиальной заплатой выполнена в 48 (68,6%) случаях. У 12 (25%) пациентов, ввиду низкой толерантности головного мозга к пережатию ВСА на стороне операции, мы использовали временное ВПШ.
КЭ с первичным швом выполнена у 10 (14,3%) пациентов, у 2 (20%) применяли временное ВПШ.
Эверсионная КЭ и эверсионная КЭ с резекцией патологической извитости выполнена у 12 (17,1%) больных, временное ВПШ — в 1 (8,3%) случае.
Длительность операции составила от 55 до 165 мин (в среднем — 87±23 мин). Время пережатия ВСА — от 1 до 70 мин (в среднем — 26±10 мин). Длительность временного ВПШ — от 13 до 27 мин (в среднем — 17±3 мин).
В 6 случаях использования временного ВПШ мы устанавливали шунт непосредственно после пережатия артерий и артериотомии. Установка шунта до удаления атеросклеротической бляшки снижает время ишемии головного мозга до 1—1,5 мин, но несет потенциальную опасность материальной эмболии фрагментами бляшки и требует большей длины артериотомии ВСА для визуального контроля дистального отдела артерии.
У 9 больных мы устанавливали временный ВПШ после удаления атеросклеротической бляшки, от 5 до 10 мин и в среднем время составило 7,6±1,3 мин.
У 1 (1,5%) пациента развилось острое нарушение мозгового кровообращения (ОНМК) на стороне операции. Операцию проводили по методике КЭ с наложением первичного шва без использования временного ВПШ (толерантность головного мозга к ишемии при интраоперационном мониторинге расценена как хорошая). Пациент на 25-е сутки переведен из отделения реанимации в палату на фоне медленного регресса неврологической симптоматики с сохраниением верхнего гемипареза.
У 8 (12%) больных отмечено периферическое повреждение черепно-мозговых нервов на стороне операции, не потребовавшее специфического лечения и полностью регрессировавшее в течение 2—3 мес после операции.
В 2 случаях у пациентов в раннем послеоперационном периоде отмечена гематома шеи, не потребовавшая дополнительного лечения ввиду умеренных размеров, выраженной имбибиции тканей (отсутствие жидкой части) и отсутствия признаков пульсирующей гематомы.
Операция КЭ не относится к технически сложным вмешательствам, но требует особой тщательности в планировании и непосредственном техническом выполнении.
Большое количество методов оценки коллатерального кровотока при пережатии ВСА и отсутствие рандомизированных многоцентровых исследований свидетельствуют о малой изученности этой проблемы до настоящего времени.
Исходя из этого, хирург, планируя оперативное вмешательство на брахицефальных артериях, обычно исходит из собственного опыта и технического оснащения клиники.
Выполнение операции в условиях локальной региональной анестезии обеспечивает динамический неврологический мониторинг, является неинвазивным и не требует специального оборудования, но исключает использование методов фармакологической защиты мозга.
Измерение ретроградного давления в ВСА также не предполагает использования дополнительного оборудования, но является инвазивным методом. Существует возможность расслоения ВСА или эмболии в СМА.
Измерение скорости кровотока в СМА является неинвазивным методом, требующим наличия специального дорогостоящего оборудования и подготовленного персонала, но при его использовании можно осуществлять полноценную фармакологическую защиту мозга.
В случае проблем технического характера, возникающих интраоперационно (невозможность установить временный шунт при наличии показаний, тромбоз ВСА и т. д.), мы рекомендуем применять методы фармакологической защиты мозга — введение тиопентала натрия, блокаторов кальциевых каналов.
В настоящее время мы сначала выполняем эндартерэктомию и потом устанавливаем временный шунт, время ишемии в этом случае обычно составляет от 5 до 10 мин (в среднем — 7,6±1,3 мин).
При проведении КЭ мы также рекомендуем осуществлять постоянный мониторинг скорости кровотока в СМА, что повышает безопасность операции и позволяет выявить любые отклонения (перегиб временного шунта, материальная или газовая эмболия, гиперперфузионный синдром) во время операции и в раннем послеоперационном периоде.
При наличии любых сомнений и/или невозможности адекватно интраоперационно оценить толерантность головного мозга к ишемии мы рекомендуем проводить установку временного ВПШ.
Применение описанной техники позволило добиться хороших непосредственных результатов при проведении КЭ.
По нашему мнению, использование временного ВПШ при наличии вышеуказанных показаний является безопасным и надежным методом предупреждения ишемического повреждения головного мозга и не связано с ростом эмболических осложнений и повреждением артерий.
Ампутации при сочетанной травме артерий и костей конечности. Показания
При лечении сложной травмы одним из самых трудных вопросов остается решение о необходимости ампутации и времени проведения. Расширение современных возможностей спасения конечности привело к тому, что в считавшихся ранее обязательными для ампутации случаях проводятся длительные и энергичные усилия по реконструкции. В действительности подобные героические усилия могут нанести пациенту ущерб в отношении удлинения госпитализации и времени нетрудоспособности, а также увеличить септические осложнения, оперативные вмешательства и даже смертность. Эти исходы особенно нежелательны, если в итоге все же происходит ампутация или дисфункция конечности.
Хотя после травмы нередко сложно предугадать необходимость ампутации, встречаются повреждения настолько разрушительно тяжелые, что сразу же принимается решение о немедленной ампутации. При некоторых повреждениях очевидно, что попытки реваскуляризации бесполезны в силу масштаба травмы мягких тканей, костей и нервов или вследствие наличия других опасных для жизни повреждений.
Повреждения по типу Gustilo III-C (оскольчатый открытый перелом большеберцовой и малоберцовой кости с повреждением артерий) являются примером травмы конечности, при которой показана немедленная ампутация. Большинство сложных повреждений конечностей не столь однозначны. В этих случаях, когда крупные нервы интактны, следует выполнять немедленную реваскуляризацию с такими важными хирургическими дополнениями, как шунты, фасциотомия или неанатомическое шунтирование, скелет быстро стабилизируют либо вытяжением, либо наружным фиксатором.
Затем необходимо наблюдать конечность в течение следующих 24-48 часов, чтобы определить уровень возвращения функции и жизнеспособности тканей. Пересечение нервов нужно определять путем прямого осмотра, так как сосудистая недостаточность или повреждение мышц могут сами по себе вызвать глубокие нарушения, которые можно спутать с повреждением нервов. Если реваскуляризация не удалась, утрата тканей тяжела или усугубляется, развивается системный сепсис или травматический токсикоз, либо сохраняется глубокая неврологическая или функциональная недостаточность, то следует выполнить ампутацию. В случае улучшения можно продолжить спасение конечности, но ее нужно оценивать так же критично на каждой последующей стадии, чтобы минимизировать излишне продолжительные, затратные и безуспешные попытки.
Для объективизации этого трудного решения, осложняемого субъективностью и принятием желаемого за действительное, нередко за счет пациента, предложен ряд систем оценки. Хотя ни одна из них не продемонстрировала перспективной возможности для прогнозирования ампутации или степени функциональных нарушений, они сосредоточивают внимание на тех факторах, которые наиболее тесно коррелируют с исходом и должны рассматриваться при решении.
Главным соображением в этом решении является наличие повреждения верхней или нижней конечности, так как первая гораздо реже требует ампутации благодаря большей устойчивости к нарушениям глубокой чувствительности, двигательной функции, распределения весовой нагрузки и к несоответствию по длине; к тому же, протезирование верхней конечности менее успешно.
Недавние исследования, проанализировавшие данные проспективного Протокола оценки нижней конечности (Lower Extremity Assessment Protocol, LEAP), показали, что существует больший потенциал анатомического и функционального сохранения конечностей со сложными повреждениями, чем это следовало из вышеупомянутых критериев. Многомерный анализ показал, что повреждение мышц и мягких тканей, отсутствие подошвенной чувствительности и повреждение сосудов оказывают наибольшее воздействие на клиническое решение об ампутации конечности.
Bosse et al. показали, что при повреждении конечности, имеющем высокий риск ампутации согласно вышеперечисленным критериям, через два года отмечаются сходные исходы как после ампутации, так и после реконструкции, хотя в группе после реконструкции все же был более высокий риск осложнений, больше операций и госпитализаций.
Основу решения должна составлять клиническая оценка конкретного пациента с учетом согласованного мнения хирурга-травматолога, ортопеда, сосудистого и пластического хирурга, специалиста по реабилитации, по уходу, психолога и, что наиболее важно, пациента и его семьи. Хорошая функциональность протезов конечностей, ранний возврат к работе, меньшая продолжительность госпитализаций и меньшие затраты, а также трудоспособность после ранних ампутаций часто предпочтительнее, чем усилия по спасению, которые могут занять месяцы или годы и, все же, завершиться неудачей. Окончательной целью является как можно более быстрый возврат пациента к комфортной, независимой и плодотворной жизни.
Читайте также:
- Классификация дефектов слуховых косточек Остина и Вульштейна
- Омская геморрагическая лихорадка. Клиника и диагностика омской геморрагической лихорадки
- Лучевая диагностика множественной миеломы челюсти
- Паралич диафрагмы при пневмотораксе. Двусторонний искусственный паралич диафрагмы
- Дыхание через трахеостому. Операция на плевре при туберкулезе
