Внутривидовые различия иммуноглобулинов. Аллотипы антител
Добавил пользователь Дмитрий К. Обновлено: 27.01.2026
Природа антител. В ответ на введение антигена иммунная система вырабатывает антитела – белки, способные специфически соединяться с антигеном, вызвавшим их образование, и таким образом участвовать в иммунологических реакциях. Относятся антитела к γ-глобулинам, т. е. наименее подвижной в электрическом поле фракции белков сыворотки крови. В организме γ-гло-булины вырабатываются особыми клетками – плазмоцитами. Количество γ-глобулина в сыворотке крови составляет примерно 30% от всех белков крови (альбуминов, а-, b-глобулинов и др.). В соответствии с Международной классификацией γ-глобулины, несущие функции антител, получили название иммуноглобулинов и обозначаются символом Ig. Следовательно, антитела – это иммуноглобулины, вырабатываемые в ответ на введение антигена и способные специфически взаимодействовать с этим же антигеном.
Функции антител. Первичная функция антител состоит во взаимодействии их активных центров с комплементарными им детерминантами антигенов. Вторичная функция антител состоит в их способности:
§ связывать антиген с целью его нейтрализации и элиминации из организма, т. е. принимать участие в формировании защиты от антигена;
§ участвовать в распознавании «чужого» антигена;
§ обеспечивать кооперацию иммунокомпетентных клеток (макрофагов, Т- и В-лимфоцитов);
§ участвовать в различных формах иммунного ответа (фагоцитоз, киллерная функция, ГНТ, ГЗТ, иммунологическая толерантность, иммунологическая память).
Применение антител в медицине. Вследствие высокой специфичности и большой роли в защитных иммунных реакциях антитела используют для диагностики инфекционных и неинфекционных заболеваний, определения иммунного статуса организма, профилактики и терапии ряда инфекционных и неинфекционных болезней. Для этого существуют соответствующие иммунобиологические препараты, созданные на основе антител и имеющие целевое назначение (см. главу 10).
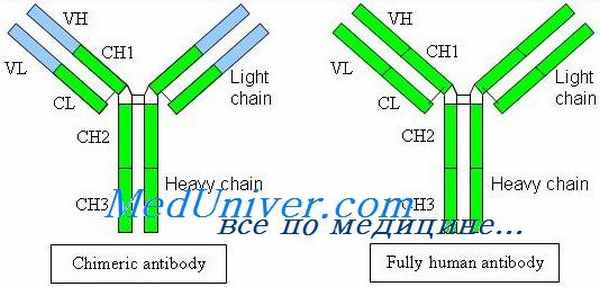
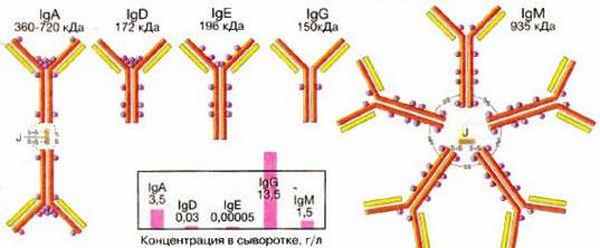
Структура антител. Белки иммуноглобулинов по химическому составу относятся к гликопротеидам, так как состоят из протеина и Сахаров; построены из 18 аминокислот. Имеют видовые отличия, связанные главным образом с набором аминокислот. Молекулярная масса иммуноглобулинов находится в пределах 150.900 кД. Их молекулы имеют цилиндрическую форму, они видны в электронном микроскопе. До 80% иммуноглобулинов имеют константу седиментации 7S; устойчивы к слабым кислотам, щелочам, нагреванию до 60ºС. Выделить иммуноглобулины из сыворотки крови можно физическими и химическими методами (электрофорез, изоэлектрическое осаждение спиртом и кислотами, высаливание, аффинная хроматография и др.). Эти методы используют в производстве при приготовлении иммунобиологических препаратов. Иммуноглобулины по структуре, антигенным и иммунобиологическим свойствам разделяются на пять классов: IgM, IgG, IgA, IgE, IgD. Иммуноглобулины М, G, А имеют подклассы. Например, IgG имеет четыре подкласса (IgG,, IgG2, IgGj, IgG4). Все классы и подклассы различаются по аминокислотной последовательности. Иммуноглобулины человека и животных сходны по строению.
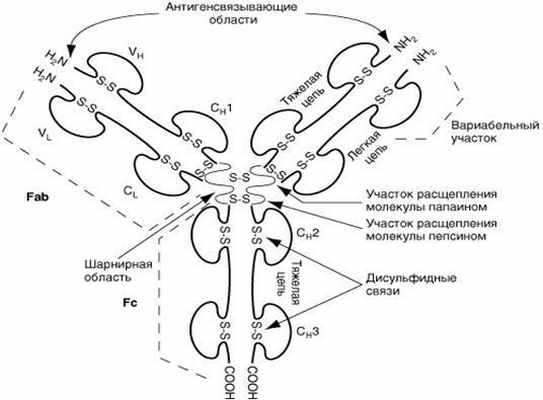
Р. Портер и Д. Эдельман установили строение молекулы иммуноглобулинов. По их данным, молекулы иммуноглобулинов всех пяти классов состоят из полипептидных цепей: двух одинаковых тяжелых цепей Н (от англ, heavy – тяжелый) и двух одинаковых легких цепей – L (от англ, light – легкий), соединенных между собой дисульфидными мостиками. Соответственно каждому классу иммуноглобулинов, т.е. М, G, А, Е, D, различают пять типов тяжелых цепей: ц (мю), у (гамма), а (альфа), е (эпсилон) и 5 (дельта), имеющих молекулярную массу в пределах 50.70 кД (содержат 420-700 аминокислотных остатков) и различающихся по антигенносте. Легкие цепи всех пяти классов являются общими и бывают двух типов: к (каппа) и х (ламбда); имеют молекулярную массу 23 кД (214.219 аминокислотных остатков). L-цепи иммуноглобулинов различных классов могут вступать в соединение (рекомбинироваться) как с гомологичными, так и с гетерологичными Н-цепями. Однако в одной и той же молекуле могут быть только идентичные L-цепи (к или А.). Как в Н-, так и в L-цепях имеется вариабельная – V (от англ-various – разный) область, в которой последовательность аминокислот непостоянна, и константная – С (от англ, constant – постоянный) область с постоянным набором аминокислот. В легких и тяжелых цепях различают NH2- и СООН-концевые группы.При обработке γ-глобулина меркаптоэтанолом разрушаются дисульфидные связи и молекула иммуноглобулина распадается на отдельные цепи полипептидов. При воздействии протеолитическим ферментом папаином иммуноглобулин расщепляется на три фрагмента: два некристаллизующихся, содержащих детерми-нантные группы к антигену и названных Fab-фрагментами І и II (от англ, fragment antigen binding – фрагменты, связывающие антиген) и один кристаллизующий Fc-фрагмент (от англ, fragment crystal!izable). FabI- и FabII-фрагменты сходны по свойствам и аминокислотному составу и отличаются от Fc-фрагмента; Fab-и Fc-фрагменты являются компактными образованиями, соединенными между собой гибкими участками Н-цепи, благодаря чему молекулы иммуноглобулина имеют гибкую структуру. Как Н-цепи, так и L-цепи имеют отдельные, линейно связанные компактные участки, названные доменами; в Н-цепи их по 4, а в L-цепи – по 2. Активные центры, или детерминанты, которые формируются в V-областях, занимают примерно 2% поверхности молекулы иммуноглобулина. В каждой молекуле имеются две детерминанты, относящиеся к гипервариабельным участкам Н-и L-цепей, т. е. каждая молекула иммуноглобулина может связать две молекулы антигена. Поэтому антитела являются двухвалентными.
Типовой структурой молекулы иммуноглобулина является IgG. Остальные классы иммуноглобулинов отличаются от IgG дополнительными элементами организации их молекул. Так, IgM представляет собой пентамер, т.е. пять молекул IgG, соединенных полипептидной цепью, обозначаемой буквой J (от англ, joining chain – строение молекулы). IgA бывает обычным, т. е. мономерным, а также ди- и тримерным. Различают IgA сывороточный и секреторный. В последнем молекула соединена с секреторным компонентом (SC), выделяемым эпителиальными клетками, что защищает IgA от разрушения ферментами. IgE обладает высокой цитофильностью, т.е. способностью присоединяться к тучным клеткам и базофилам, в результате чего клетки выделяют гистамин и гистаминоподобные вещества, вызывающие ГНТ. IgD склонен к агрегации, имеет дополнительные дисульфидные связи.
В ответ на введение любого антигена могут вырабатываться антитела всех пяти классов. Обычно вначале вырабатывается IgM, затем IgG, остальные – несколько позже. Основную массу сывороточных иммуноглобулинов (70.80 %) составляет IgG; на долю IgA приходится 10-15 %, IgM – 5.10 %, IgE – 0,002 % и IgD – около 0,2 %. Содержание иммуноглобулинов меняется с возрастом. При некоторых патологических расстройствах наблюдаются отклонения в уровне их содержания в крови. Например, концентрация IgG возрастает при инфекционных болезнях, аутоиммунных расстройствах, снижается при некоторых опухолях, агаммаглобулинемии. Содержание IgM увеличивается при многих инфекционных болезнях, снижается при некоторых имму-нодефицитных состояниях.
Синтез антител. Как уже было сказано, иммуноглобулины синтезируются плазмоцитами, которые образуются в результате дифференцировки полипотентной стволовой клетки. Плазмоцит синтезирует как неиммунный, так и иммунный γ-глобулин. Информацию о специфичности синтезируемого иммуноглобулина плаз-моциты получают от В-лимфоцитов; L- и Н-цепи синтезируются на полирибосомах плазмоцита отдельно и соединяются в единую молекулу перед выделением из клетки. Сборка молекулы иммуноглобулина из Н- и L-цепей происходит очень быстро, в течение 1 мин. Выделение иммуноглобулина из плазмоцита осуществляется путем экзоцитоза или клазматоза, т. е. отпочковывания части цитоплазмы с иммуноглобулином. Каждый плазмоцит синтезирует до 2000 молекул в секунду. Синтезированные антитела поступают в лимфу, кровь, тканевую жидкость.
Генетика антител. Иммуноглобулин, как и всякий белок, обладает антигенностью. В молекуле иммуноглобулина различают три типа антигенных детерминант: изотипические, аллотипические и идиотипические. Изотипические детерминанты (изотипы) являются видовыми, т. е. они идентичны для всех особей данного вида (например, человека, кролика, собаки). Аллотипические детерминанты (аллотипы) у одних особей данного вида имеются, у других – отсутствуют, т. е. они являются индивидуальными. Наконец, идиотипические детерминанты (идиоти-пы) присущи только молекулам антител, обладающих определенной специфичностью. Эти детерминантные различия обусловлены числом и порядком чередования аминокислот в активном центре молекулы иммуноглобулина.
Изотипические детерминанты располагаются в С-части Н- и L-цепей и служат для дифференцировки иммуноглобулинов на классы и подклассы. Аллотипические детерминанты отражают внутривидовые антигенные различия иммуноглобулинов, а идиотипические детерминанты – индивидуальные различия в строении активного центра. Следовательно, имеется огромное разнообразие иммуноглобулинов, различающихся по типу антигенных детерминант. В зависимости от изотипов существует 5 классов и множество подклассов; от аллотипов – только у Н-цепей известно до 20 разновидностей; с учетом идиотипов, т. е. строения активного центра, антитела различаются не только в классах и подклассах, но даже в аллотипах. Этим определяются множественность антител и их специфичность по отношению ко всему многообразию антигенов, существующих в природе. Число вариаций активных центров антител огромно, практически беспредельно, так как оно определяется числом Н- и L-цепей, их вариантами (аллотипами) и особенно идиотипическим разнообразием активных центров. Такое различие закреплено генетически и осуществляется в процессе формирования активных центров в зависимости от специфичности активного центра антигена. Иммуноглобулиновая молекула кодируется тремя группами генов. Одна группа кодирует Н-цепь любого класса, другая – L-цепь к-типа и третья – L-цепь Я-типа. Благодаря постоянным мутациям генов, мутациям клонов им-мунокомпетентных клеток, главным образом лимфоцитов, практически на введение любого антигена могут последовать реакция образования специфического антитела и размножение того клона лимфоцитов, который синтезирует антитела, комплементарные антигену. Следует подчеркнуть, что одна плазматическая клетка вырабатывает антитела только одной специфичности. Следовательно, в организме должно существовать множество клонов иммунокомпетентных клеток. Окончательно механизм синтеза и передачи по наследству способности выработки огромного количества специфических антител буквально к любому из многочисленных антигенов неясен. Наиболее полно этот механизм объясняют клонально-селекционная теория Ф. Бернета и теория С. Тонегавы.
Динамика антителообразования. Способность к образованию антител появляется во внутриутробном периоде у 20-недельного эмбриона; после рождения начинается собственная продукция иммуноглобулинов, которая увеличивается до наступления зрелого возраста и несколько снижается к старости. Динамика образования антител имеет различный характер в зависимости от силы антигенного воздействия (дозы антигена), частоты воздействия антигена, состояния организма и его иммунной системы. При первичном и повторном введении антигена динамика антителообразования также различна и протекает в несколько стадий. Выделяют латентную, логарифмическую, стационарную фазу и фазу снижения. В латентной фазе происходят переработка и представление антигена иммунокомпетентным клеткам, размножение клона клеток, специализированного на выработку антител к данному антигену, начинается синтез антител. В этот период антитела в крови не обнаруживаются. Во время логарифмической фазы синтезированные антитела высвобождаются из плазмоцитов и поступают в лимфу и кровь. В стационарной фазе количество антител достигает максимума и стабилизируется, затем наступает фаза снижения уровня антител. При первичном введении антигена (первичный иммунный ответ) латентная фаза составляет 3-5 сут, логарифмическая – 7-15 сут, стационарная – 15-30 сут и фаза снижения – 1-6 мес и более. Особенностью первичного иммунного ответа является то, что первоначально синтезируется IgM, а затем IgG.
В отличие от первичного иммунного ответа при вторичном введении антигена (вторичный иммунный ответ) латентный период укорочен до нескольких часов или 1-2 сут, логарифмическая фаза характеризуется быстрым нарастанием и значительно более высоким уровнем антител, который в последующих фазах длительно удерживается и медленно, иногда в течение нескольких лет, снижается. При вторичном иммунном ответе в отличие от первичного синтезируются главным образом IgG.
Такое различие динамики антителообразования при первичном и вторичном иммунном ответе объясняется тем, что после первичного введения антигена в иммунной системе формируется клон лимфоцитов, несущих иммунологическую память о данном антигене. После повторной встречи с этим же антигеном клон лимфоцитов с иммунологической памятью быстро размножается и интенсивно включает процесс антителогенеза.
Очень быстрое и энергичное антителообразование при повторной встрече с антигеном используется в практических целях при необходимости получения высоких титров антител при производстве диагностических и лечебных сывороток от иммунизированных животных, а также для экстренного создания иммунитета при вакцинации.
Виды антител. Помимо полноценных антител, обладающих специфичностью и активным участием в реакциях иммунной защиты, выделяют нормальные, или естественные, антитела и неполные антитела. К нормальным относят антитела, обнаруживаемые у людей или животных, не подвергавшихся какой-либо иммунизации. Их роль в защите не совсем ясна. К неполным антителам относятся иммуноглобулины с одним активным центром (валентностью). Эти антитела неполноценны, так как, соединяясь с антигеном, они не могут агрегировать частицы в конгломераты. У неполных антител второй центр имеется, однако он экранирован или имеет малую авидность. Для выявления неполных антител используют реакцию Кумбса. После иммунизации, даже монодетерминантным антигеном, в пуле иммуноглобулинов, синтезируемых совокупностью клеток, содержатся антитела, различающиеся между собой, т. е. сыворотки содержат поликлональные антитела. Эта гетерогенность антител обусловлена тем, что каждый плазмоцит вырабатывает только один тип, вид, класс, подкласс антител. Следовательно, каждая клетка или ее потомство, клон вырабатывают свой тип антител, получивших название моноклопальных. Принципиально моноклональные антитела можно получить искусственно, культивируя каждую антителопродуцирующую клетку, т. е. получая моноклональную культуру клеток. Однако практически это трудно осуществимо. Поэтому гибридную клетку получают путем слияния иммунного антителопродуцирующего В-лимфоцита, т. е. лимфоцита, взятого от иммунного животного и раковой миеломной клетки. Такая гибридома приобретает свойства родительских клеток, т. е. хорошо размножается на искусственных питательных средах (как и миеломная клетка) и вырабатывает антитела, специфичные для данного В-лимфоцита. Впервые гибридомы, продуцирующие моноклональные антитела, получили Д. Келлер и Ц. Мильштейн (1975). Моноклональные антитела нашли широкое применение при создании диагностических и лечебных препаратов, а также при проведении различных исследований. Способы промышленного получения моноклональных антител описаны в главе 6.
В последние годы открыт еще один вид антител – абзимы. Это антитела-катализаторы, способные в несколько тысяч раз ускорять биохимические реакции, воздействуя на промежуточные вещества реакции. Механизм их действия изучается.
4. Понятие об аллотипах, идиотипах и изотипах
Классификация иммуноглобулинов основана на существовании трех форм гетерогенности белков. Различают идиотипы, изотипы и аллотипы. Следовательно, между молекулами антител возможныизотипические, аллотипические и идиотипические различия в аминокислотной последовательности.Изотипы - это различные варианты, которые представлены в сыворотке крови каждого индивидуума пятью классами и многими подклассами иммуноглобулинов. Изотипическиеразличия. Гены изотипических вариантов антител в норме присутствуют в геноме всех представителей данного вида. Например, в геноме каждого человека имеются одновременно гены цепей, представляющих собой поэтому изотипы. Аллотипы - внутривидовые антигенные детерминанты, присутствующие на иммуноглобулинах (особенно генетические маркеры иммуноглобулинов). Многие из этих маркеров иммуноглобулинов коррелируют с изменениями в аминокислотной последовательности белка, и поэтому их можно считать маркерами первичных продуктов генов. Аллотипические различия. Они отражают генетические различия между особями одного вида, в том числе по аллелям данного локуса. Например, у человека вариант IgG3 с остатком фенилаланина в 436 позиции Идиотипы можно рассматривать как антигенные маркеры центров связывания антител, коррелирующие с первичной структурой иммуноглобулинов. Они характеризуются многочисленными вариантами в Ig-цепей. Число различных вариантов идиотипов у человека колеблется в пределах 105-107. Идиотипические различия.Существование разных идиотипов антител обусловлено различиями в аминокислотной последовательности, которые определяют специфичность антигенсвязывающего центра антител. Идивидуальные идиотипы антителобычно характерны для разных клонов В-клеток. Однако иногда у различных внеклеточных клонов идиотипы антител могут быть общими (повторяющимися).
5.Разделение иммуноглобулинов млекопитающих на классы и подклассы.
Принадлежность иммуноглобулинов к тому или иному изотипу ( классу и подклассу ) зависит от характерных особенностей строения константной (С) области Н-цепи. Разнообразие классов и подклассов иммуноглобулинов обусловлено изотипической изменчивостью их молекул.
Иммуноглобулины: классы. При сравнении аминокислотных последовательностей было показано, что существует пять основных классов тяжелых цепей, обозначаемых буквами альфа , гамма , дельта , эпсилон и мю . Эти классы тяжелых цепей соответствуют иммуноглобулинам классов: IgA , IgG , IgD , IgE и IgM . Они различаются не только по аминокислотным последовательностям, но и по антигенной специфичности. Молекулы IgD и IgE, как и молекула IgG, состоят из одной субъединицы. Молекула IgA может иметь одну, две или три субъединицы. Молекула IgM сыворотки крови содержит пять субъединиц. Поскольку в сыворотке крови каждого нормального индивидуума циркулируют иммуноглобулины, содержащие все структурные варианты константных областей тяжелых цепей, их рассматривают как изотипы. Аналогично константные области легких цепей представлены двумя изотипическими формами: каппа и лямбда; каждая из них может соединиться с любым изотипом тяжелых цепей. Так как легкие цепи в каждой молекуле антитела идентичны, иммуноглобулины содержат либо каппа, либо лямбда- тип, но никогда - оба типа цепей (кроме молекул, созданных искусственно). Подобно некоторым классам тяжелых цепей, легкие цепи типа лямбда могут быть подразделены на более мелкие подтипы на основании небольших различий в последовательностях. Класс иммуноглобулина определяется только классом входящей в его состав тяжелой цепи и не зависит от типа входящих в его состав легких цепей. Полностью зрелые плазматические клетки всегда продуцируют только один вид тяжелой цепи и один вид легкой цепи.
Иммуноглобулины: подклассы. Функциональное разнообразие иммуноглобулинов обусловлено также существованием подклассов, различающихся структурой тяжелых цепей. Антигенный анализ миеломных IgG выявил дополнительные вариации и позволил выделить четыре изотипических подкласса, кодируемых цифрами и обозначаемых как IgG1 , IgG2 , IgG3 и IgG4 . Они различаются между собой тяжелыми цепями, а именно гамма1 , гамма2 , гамма3 и гамма4. Тяжелые цепи IgG обладают значительно выраженной гомологией и имеют одинаковые участки, реагирующие со специфической антиглобулиновой сывороткой. Однако каждый тип тяжелых цепей обладает одной или несколькими дополнительными структурными особенностями, а именно, уникальными первичными последовательностями аминокислот и расположением межцепочечных дисульфидных связей. Это служит причиной различных свойств IgG, относящихся к разным подклассам. Кроме того, обнаружено и два подкласса IgA , причем IgA1 составляет 80-90% от общего количества IgA. Подкласс IgA2 необычен, поскольку у молекул этого подкласса отсутствуют дисульфидные связи между тяжелыми и легкими цепями. Структура иммуноглобулинов других классов и подклассов различается по числу и расположению дисульфидных связей между тяжелыми цепями, а также по числу ( L - H )-субъединиц в молекуле.
Внутривидовые различия иммуноглобулинов. Аллотипы антител
Внутривидовые различия иммуноглобулинов. Аллотипы антител
В 1956 г. Грубб (Grubb, 1956) обнаружил, что сыворотки части здоровых людей способны предотвращать эту агглютинацию, тогда как сыворотки других людей не обладают такой активностью. Анализ большого числа семей показал, что эти различия наследуются моногибридно. Фактор, предотвращающий агглютинацию, оказался одним из вариантов иммуноглобулина и был назван Gm. Позднее был открыт другой тормозящий фактор, неаллельный Gm, получивший название InV (Ropartz e. a., 1961). Именно так были обнаружены внутривидовые антигенные различия в строении иммуноглобулинов человека, т. е. аллотипы. Локализация аллотипических антигенных детерминант на молекуле иммуноглобулина позволили затем разбить их на две группы — Gm и InV, так как оказалось, что Gm-аллотипы локализованы на тяжелых цепях молекул иммуноглобулинов человека, а InV-аллотипы — на легких цепях.
В том же 1956 г. были обнаружены и внутривидовые различия в антигенных свойствах иммуноглобулинов кролика (Oudin, 1956). В этом случае аллотипы были обнаружены не с помощью аутоантител (агглютинаторов), а с помощью перекрестной внутривидовой иммунизации. Для этого иммуноглобулины, выделенные из сыворотки одного кролика, вводили другому кролику и, если между иммуноглобулинами этих двух животных существовали антигенные различия, то у кролика-реципиента вырабатывались антитела, специфически реагирующие с иммуноглобулинами кролика-донора. С помощью перекрестной внутривидовой иммунизации были обнаружены также и аллотипы иммуноглобулинов мыши и крысы, но здесь задача облегчалась наличием большого числа инбредных линий животных (Herzenberg, 1964; Рохлин и др., 1970).
Таким образом, основной метод обнаружения наследственных внутривидовых различий в антигенном строении иммуноглобулинов состоит в получении тем или иным способом моноспецифических антител, которые реагируют с иммуноглобулинами только некоторых (но не всех) особей в пределах данного вида. Характер наследования обнаруженных различий изучается затем с помощью обычного гибридологического анализа.
Чрезвычайно важным этапом в изучении аллотипов является локализация аллотипических детерминант на молекуле иммуноглобулина. Сама молекула иммуноглобулина состоит из двух типов цепей, и каждая полипептидная цепь, кроме того, состоит из двух частей — вариабельной и постоянной. Иммуноглобулины являются также семейством белков, состоящим из разных классов и подклассов. Именно поэтому выяснение локализации генетических маркеров на молекуле иммуноглобулина является необходимым этапом в изучении генетической регуляции биосинтеза этих белков, так как это позволяет прийти к определенным выводам о том, одни и те же или разные гены контролируют образование разных классов и подклассов, разных типов полипептидных цепей и разных частей одной полипептидной цепи.
В соответствии с характером структурной гетерогенности иммуноглобулинов генетические аспекты биосинтеза иммуноглобулинов рассмотрены вначале отдельно для постоянных и вариабельных частей легких и тяжелых полипептидных цепей, и затем дана общая схема организации генетического материала, контролирующего образование полипептидных цепей иммуноглобулинов.
- Вернуться в оглавление раздела "Физиология человека."
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Иммуноглобулины в свиноводстве
В соответствии с Международной классификацией сывороточные белки, несущие «антительную» активность и называвшиеся ранее гамма-глобулинами, получили название иммуноглобулинов и обозначаются символом Ig. Иммуноглобулины подразделяют на классы, а в пределах каждого класса на подклассы. Известно пять классов иммуноглобулинов: IgG, IgM, IgD, IgA, IgE. у отдельных классов описаны подклассы.
Структура иммуноглобулинов. Иммуноглобулины - белки с четвертичной структурой, т.е. их молекулы построены из нескольких полипептидных цепей. Молекула каждого класса состоит из четырех полипептидных цепей - двух тяжелых и двух легких, связанных между собой дисульфидными мостиками, являющимися активным центром (участок молекулы иммуноглобулина, взаимодействующий только с комплементарным участком молекулы специфического антигена). Легкие цепи (Ц - структура, общая для всех классов и подклассов. Тяжелые цепи (Н) имеют характерные структурные особенности, присущие определенному классу (подклассу). Легкие цепи подразделены на два типа: κ (каппа) и λ (лямбда). Тяжелые цепи обозначают греческими буквами γ (гамма), μ (мю), α (альфа), δ (дельта) и ε (эпсилон) - соответственно латинскому обозначению того или иного класса иммуноглобулинов: IgG, IgM, IgA и др.
В молекуле иммуноглобулина различают два вида межцепьевых связей: между одноименными тяжелыми цепями и между легкими и тяжелыми цепями. При обработке молекул папаином они расщепляются на три фрагмента: два Fab-фрагмента и один Fс-фрагмент. Fab-фрагмент обладает способностью связываться с антигеном, но не вызывает агглютинацию и преципитацию. Fс-фрагмент связывает комплемент, а также обеспечивает прикрепление Ig к Fс-рецептору клеточных мембран. При расщеплении иммуноглобулина пепсином образуется двухвалентный F(аЬ)2 фрагмент, который благодаря своей двухвалентности действует как полное антитело и обладает способностью агглютинировать или преципитировать специфические антигены.
Модели структур IgG и IgM. При электронно-микроскопическом исследовании установлено, что IgG имеет У-образную форму, а IgM - звездчатую конфигурацию со средним диаметром 30 . 35 нм.
Гетерогенность антител. Антитела, образовавшиеся при иммунном ответе организма, при всей специфичности неоднородны и отличаются друг от друга, т. е. они гетерогенны. Предполагается, что существует более 100 000 антигенов и к каждому из них синтезируется «свое» специфическое антитело. Главной основой гетерогенности (разнообразия специфичностей) антител служит уникальность их активных центров. Антитела гетерогенны по принадлежности к различным классам и подклассам, а также по физико-химическим и биологическим свойствам.
Свойства антител. Антитела, входящие в определенные классы иммуноглобулинов, обладают различными физическими, химическими, биологическими и антигенными свойствами.
Иммуноглобулины содержат три вида антигенных детерминант: изотипическ:ие, аллотипическ:ие и идиотипические. У каждого биологического вида тяжелые (5 классов) и легкие (2 типа) цепи иммуноглобулинов имеют определенные антигенные особенности. Одинаковые антигенные детерминанты для каждого представителя данного вида называют изотипическими (изотипы). Вместе с тем имеются внутривидовые различия названных цепей иммуноглобулинов - аллотипы, обусловленные генетическими особенностями организма-продуцента: их признаки генетически детерминированы. Например, у тяжелых цепей описано более 20 аллотипов. Существуют различия между разными антителами, даже если они относятся к одному классу, подклассу или аллотипу. Эти различия названы и диотипами. Они характеризуют «индивидуальность» данного иммуноглобулина в зависимости от специфичности антигена-индуктора.
Все указанные антигенные различия определяют с помощью специфических антисывороток.
Иммуноглобулин М (lgM). Молекулярная масса 950000, константа седиментации 19S, функционально валентен, первым появляется после заражения или вакцинации животного. Обладает выраженной способностью агглютинировать, преципитировать или лизировать антигены, а также связывать комплемент. Находится преимущественно в плазме крови, при инфекционных процессах количество его значительно повышается. Не участвует в аллергических реакциях и не проходит через плаценту.
Иммуноглобулин G (lgG). Наиболее изученный класс антител. Молекулярная масса 160000, константа седиментации 7S. В сьшоротке крови содержится в наиболее высокой концентрации (в среднем 12 г/л) и составляет от 70 до 85 % всех иммуноглобулинов, присутствует также в тканевых жидкостях. Двухвалентен, образует с поливалентными антигенами сетевую структуру. Вызывает преципитацию растворимых антигенов. Принимает участие в реакции агглютинации и опсонизации корпускулярных антигенов. для лизиса антигена необходимо связывание с молекулой комплемента. IgG играет ведущую роль в защите от многих вирусных и бактериaльных инфекций (оспа, бешенство, столбняк и др.), обладает выраженными свойствами нейтрализации токсинов, выдерживает нагревание при 75 ос в течение 30 мин.
Четыре подкласса IgG различают между собой по структуре тяжeлыx цепей и молекулярной массе. У крупного рогатого скота известно два подкласса: IgG 1 и IgG2. Молекулы иммуноглобулина (за исключением IgG2) способны связываться с клетками тканей и вызывать их специфическую сенсибилизацию, вследствие чего иммуноглобулин принимает участие в реакциях гиперчувствительности немедленного типа. Скорость синтеза составляет 32 мг на 1 кг массы в сутки. Концентрация его значительно повышается при различных инфекционных и аутоиммунных процессах.
Иммуноглобулины класса А (IgA) представлены двумя видами: сывороточный и секреторный. Сывороточный IgA. Молекулярная масса 170000, константа седиментации 7S, концентрация в сыворотке крови составляет 15 . 20 % общего количества иммуноглобулинов. Не обладает способностью преципитировать растворимые антигены, не связывает комплемент по классическому пути. Принимает участие в реакции нейтрализации токсинов. Термоустойчив. Синтезируется в селезенке, лимфатических узлах и в слизистых оболочках; поступает в секреты - слюну, слезную жидкость, бронхиальный секрет, молозиво.
Секреторный IgA (SIgA). Имеет добавочный структурный компонент, отсутствующий в сывороточном. Представляет собой полимер, чаще димер: молекулярная масса 380000, константа седиментации 11 S и 15S. Синтезируется в слизистых оболочках. Биологическая функция IgA заключается в основном в местной защите слизистых оболочек, например при заболеваниях желудочно-кишечного тракта или дыхательных путей. В кишечном тракте SIgA устраняет бактериальную адгезию, нейтрализует вирусы. SIgA образуется в результате ассоциации димерной формы IgA с особым белком, названным секреторным компонентом, находящимся в собственном слое слизистой оболочки. SIgA проходит базальную мембрану и проникает в эпителиальную клетку, где соединяется с секреторным компонентом, после чего происходит выход синтезированного SIgA на поверхность эпителиального покрова кишечника.
Иммуноглобулин IgD. Молекулярная масса 160000, константа седиментации 7S. Концентрация IgD в сыворотке крови человека не превышает 1 % от общего количества иммуноглобулинов. Биологическая функция его не совсем ясна. Установлено, что он является одним из основных иммуноглобулинов, входящих В состав рецепторов В-лимфоцитов, термостабилен, может активизировать комплемент по альтернативному пути, обладает антивирусной активностью, не связывается с тканями.
Иммуноглобулин Е (IgE). Впервые идентифицирован в 1966 г., идентичен антителам, ранее названным реагинами. Молекулярная масса 190000, константа седиментauии 8,5S. Концентрация в сыворотке крови составляет в среднем 0,25 мг/л. IgE термолабилен, инактивируется при 56 ос в течение 1 ч, не связывает комплемент, быстро и прочно связывается с клетками тканей, с тканевыми базофилами, принимает участие в реакции гиперчувствительности немедленного типа. У человека обусловливает атипические реакции - сенную лихорадку, крапивницу, бронхиальную астму. При аллергических заболеваниях концентрация IgE в сыворотке крови значительно увеличивается и может составлять в среднем 1,6 мг/л. Считают, что IgE играет защитную роль при гельминтозных и протозойных заболеваниях, в частности способствует усилению фагоцитарной активности макрофагов и эозинофилов.
Структура антител (иммуноглобулинов)
Иммуноглобулины составляют от 15 до 20% белков плазмы крови.
Структура антител была установлена в 1959 году одновременно Роднейем Портером (Англия, Оксфорд) и Джеральдом Эдельманом (США, Рокфеллеровский университет).
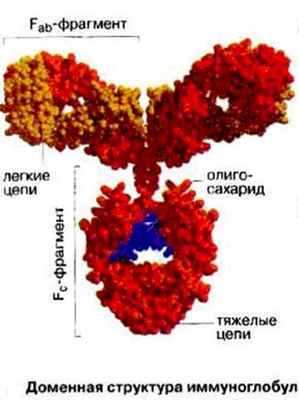
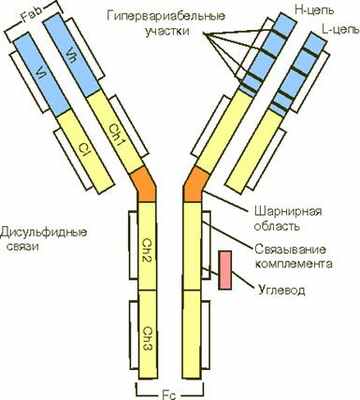
Молекула антитела (Ig G) состоит из двух тяжелых (Н, 50 0002) и двух легких (L, 20 000-25 0002) полипептидных цепей, соединенных между собой дисульфидными связями. Тяжелые цепи в антигенном отношении делятся на типы . и , подразделяя иммуноглобулины на классы M, G, A, E и D. Легкие цепи в любой из этих молекул могут быть одного из двух подклассов - ? или .
Примечание: Объектом для изучения структуры иммуноглобулинов служили миеломные белки.Миелома - род злокачественной опухоли, когда по неизвестным причинам разрастается клон плазматических клеток, синтезирующих строго одинаковые молекулы -глобулинов. То есть все плазматические клетки происходят из единственной клетки - родоначальницы клона, и именно поэтому производят совершенно идентичный моноклональный продукт: он гомогенен по классу или Ig M, или Ig G, или Ig A, легкие цепи у всех молекул одного типа - ? или .
Весь сывороточный -глобулин больного миеломой представлен единственным вариантим иммуноглобулиновых молекул. При этом легкие цепи синтезируются в избытке и выделяются в чистом виде с мочой (белки Бенс-Джонсона).
Легкие цепи содержат 214 аминокислотных остатков. Первые 107 аминокислотных остатков, начиная с N-конца полипептида, составляют вариабельный участок (V) цепи. Последовательность аминокислот этого участка различна у всех легких цепей. Вторая половина данного полипептида со 108 до 214 аминокислотного остатка практически одинакова у всех легких цепей. Это константный участок (С).
Весь сывороточный -глобулин больного миеломой представлен единственным вариантим иммуноглобулиновых молекул. При этом легкие цепи синтезируются в избытке и выделяются в чистом виде с мочой (белки Бенс-Джонсона).
Тяжелые цепи также состоят из V и C участков, то есть вариабельных и константных. Константные участки тяжелых цепей в три раза длиннее, чем легких, и представляют собой как бы три повторяющиеся линейно расположенных полипептидных отрезка по 100-110 аминокислотных остатка. Вариабельный участок включает 116 аминокислотных остатков. Всего в каждую тяжелую цепь входит около 450 аминокислот.
Всего структуру иммуноглобулинов представляют 12 доменов (2+2+4+4), молекулярная масса каждого домена примерно 12 500, откуда молекулярная масса всей молекулы Ig G должна быть 150 000. Если же тяжелая цепь состоит из 5-и доменов, как у Ig M, то молекула иммуноглобулина будет тяжелее.
Активные центры антител формируются доменами вариабельных участков. Анализ показывает, что в этом участвует от 4 до 8 аминокислотных остатков, которые относятся к так называемым гипервириабельным областям легких и тяжелых цепей. Таких областей в вариабельных участках тяжелых цепей 4. Они обозначаются как Hhv1-4.
Поскольку активный центр формируется обеими H- и L-цепями молекулы, бесконечное разнообразие специфических антител может определяться не только разнообразием вариабельных цепей, но и комбинацией сочетаний различных цепей. Например, если у одного индивидуума генетически запрограммировано 1 000 вариантов легких и 1 000 вариантов тяжелых цепей, то в разных клетках или клонах клеток сборка антитела может идти путем наработки одного из 1 000 000 возможных сочетаний.
Такое объяснение многообразия специфических антител в настоящее время наиболее принято.
Константные участки цепей ответственны за другие свойства молекулы иммуноглобулинов. В области Сн2 и Сн3 доменов располагаются соответственно участок фиксации комплемента и участок, ответственный за фиксацию антител к клеткам, например к макрофагам, тучным клеткам, лимфоцитам; Сн 4 обеспечивает связывание мономеров в сложные агрегаты.
Константные области тяжелых цепей, будучи различными у разных классов иммуноглобулинов определяют особые биологические функции каждого класса антител:
Ig M (5-10% от общего количества) могут активировать систему комплемента, выполняют функцию мембранных рецепторов: 50 000- 150 000 на одну клетку, первыми синтезируются организмом новорожденных, их содержание повышается в течение первой недели и к году (!) достигает уровня взрослых;
Ig A (10-15% от общего количества) секретируются в различные жидкости тела и обеспечивают секреторный иммунитет, синтезируются со 2-3-й недели новорожденности;
Ig E (0,2% от общего количества) прикрепляются к специфическим рецепторам на поверхности тучных клеток и базофилов и, если они связываются с антигеном, из клеток начинают высвобождаться заключенные в них биологически активные вещества, вызывая аллергические явления;
Ig D (0,2% от общего количества) функционируют почти ислючительно в качестве мембранных рецепторов для антигена;
Ig G (75% от общего количества) проявляют разнообразные виды активности, в том числе способность проникать через плацентарный барьер, передаются от матери и сохраняются в организме новорожденного в течение 3-х месяцев, обеспечивая ему естественный пассивный иммунитет; синтезируются в организме ребенка со 2-3 месяца
СL и Сн1-домены определяют аллоантигенные различия молекул атител: здесь реализуется контроль генетических систем аллотипов иммуноглобулинов человека.
Антителообразование увеличивается с развитием лимфоидной ткани, которое происходит в течение первого года жизни и заканчивается лишь к периоду половой зрелости.
Синтез иммуноглобулинов представляет собой частный случай продукции белковых тел. Особенность его состоит в том, что легкие цепи синтезируются на одних РНК-матрицах, а тяжелые - на других. Потом происходит сборка всей молекулы. По-видимому, вначале синтезируется одна пара из легкой (L) и тяжелой (Н) цепей, а затем две молекулы собираются в целую молекулу антитела. Легкие цепи обнаружены в клетке в некотором избытке. Предполагают, что они содействуют снятию тяжелых цепей с лизосом. В случае пентамерных молекул Ig M последним этапом сборки является соединение пяти мономерных молекул в единую структуру, и лишь после этого секреция из клетки.
Генетический анализ изотипов, аллотипов и идиотипов дал возможность сделать три важнейших заключения:
Полипептиды, составляющие иммуноглобулиновую молекулу, кодируются тремя не сцепленными группами аутосомных генов. Одна группа (12-ая хромосома) кодирует тяжелую цепь того или иного класса, другая (6-ая хромосома) - легкую цепь ?-типа, третья (16-ая хромосома) - легкую цепь -типа.
Каждая из трех групп генов включает в себя набор генов вариабельных областей (V-гены) и гены константной области (С-гены) полипептидных цепей.
Набор V-генов тесно сцеплен с С-генами, т.е. расположен не только на одной хромосоме, но и в непосредственной близости от них.
Примечание. В настоящее время общепризнано, что иммуноглобулины обладают антигенными свойствами. В молекулах иммуноглобулинов различают три типа антигенных детерминант (анигенные детерминанты-эпитоп - это область поверхности молекулы антигена, являющаяся в пространственном отношении комплиментарной рецепторной зоне антитела - паратопу):
изотипические детерминанты идентичные для всех особей данного вида;
аллотипические детерминанты внутривидовые, они имеются у одних особей данного вида и отсутствуют у других;
идиотипические детерминанты присущие только антителам, синтезированным данным клоном плазматических клеток.
Читайте также:
