Второстепенные защитные функции макрофагов.
Добавил пользователь Alex Обновлено: 20.01.2026
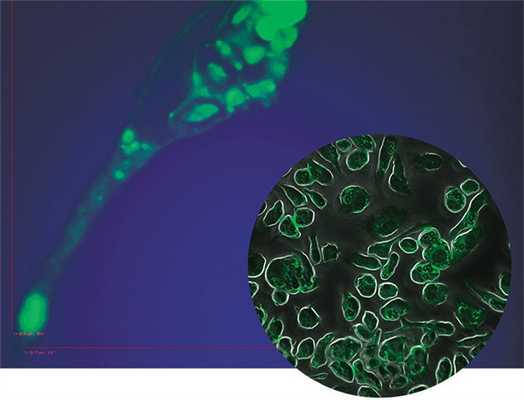
Сто тридцать лет назад замечательный русский исследователь И.И. Мечников в опытах на личинках морских звезд из Мессинского пролива сделал удивительное открытие, круто изменившее не только жизнь самого будущего Нобелевского лауреата, но и перевернувшее тогдашние представления об иммунной системе.
Втыкая в прозрачное тело личинки розовый шип, ученый обнаружил, что занозу окружают и атакуют крупные амебоидные клетки. И если чужеродное тело было небольшим, эти блуждающие клетки, которые Мечников назвал фагоцитами (от греч. пожиратель), могли полностью поглотить пришельца.
Долгие годы считалось, что фагоциты выполняют в организме функции «войск быстрого реагирования». Однако исследования последних лет показали, что благодаря своей огромной функциональной пластичности эти клетки еще и «определяют погоду» многих метаболических, иммунологических и воспалительных процессов, как в норме, так и при патологии. Это делает фагоциты перспективной мишенью при разработке стратегии лечения ряда тяжелых заболеваний человека
Подвижные клетки иммунной системы – фагоциты или макрофаги, присутствуют практически во всех тканях организма. Они осуществляют активный захват, переваривание и обезвреживание чужеродных микроорганизмов (вирусов, бактерий, одноклеточных, паразитов), а также утилизацию биологического «мусора», такого как «невостребованные» и погибшие клетки (например, «стареющие» эритроциты).
В зависимости от своего микроокружения тканевые макрофаги могут выполнять и различные специализированные функции. Например, макрофаги костной ткани – остеокласты, также занимаются выведением из кости гидроксиапатита кальция. При недостаточности этой функции развивается мраморная болезнь – кость становится чрезмерно уплотненной и при этом хрупкой.
Но самым, пожалуй, удивительным свойством макрофагов оказалась их огромная пластичность, т. е. способность изменять свою транскрипционную программу («включение» тех или иных генов) и свой облик (фенотип). Следствием этой особенности является высокая разнородность клеточной популяции макрофагов, среди которых присутствуют не только «агрессивные» клетки, встающие на защиту организма-хозяина; но и клетки с «полярной» функцией, отвечающие за процессы «мирного» восстановления поврежденных тканей.
Липидные «антенны»
Своей потенциальной «многоликостью» макрофаг обязан необычной организации генетического материала – так называемому открытому хроматину. Этот не до конца изученный вариант структуры клеточного генома обеспечивает быстрое изменение уровня экспрессии (активности) генов в ответ на различные стимулы.
Выполнение макрофагом той или иной функции зависит от характера получаемых им стимулов. Если стимул будет распознан как «чужой», то происходит активация тех генов (и соответственно функций) макрофага, которые направлены на уничтожение «пришельца». Однако макрофаг могут активировать и сигнальные молекулы самого организма, которые побуждают эту иммунную клетку участвовать в организации и регуляции обмена веществ. Так, в условиях «мирного времени», т. е. при отсутствии патогена и обусловленного им воспалительного процесса, макрофаги участвуют в регуляции экспрессии генов, отвечающих за метаболизм липидов и глюкозы, дифференцировку клеток жировой ткани.
Интеграция между взаимоисключающими «мирным» и «военным» направлениями работы макрофагов осуществляется путем изменения активности рецепторов клеточного ядра, представляющих собой особую группу регуляторных белков.
Среди этих ядерных рецепторов следует особо выделить так называемые липидные сенсоры, т. е. белки, способные взаимодействовать с липидами (например, окисленными жирными кислотами или производными холестерина) (Смирнов, 2009). Нарушение работы этих чувствительных к липидам регуляторных белков в макрофагах может быть причиной системных обменных нарушений. Например, дефицит в макрофагах одного из этих ядерных рецепторов, обозначаемых как PPAR-гамма, приводит к развитию диабета 2 типа и дисбалансу липидного и углеводного обмена во всем организме.
Клеточные метаморфозы
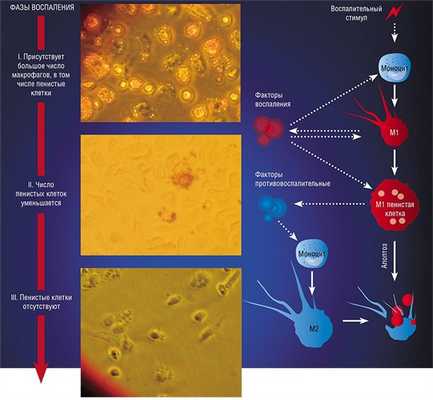
В разнородном сообществе макрофагов на основе базовых характеристик, определяющих их принципиальные функции, выделяют три основных клеточных субпопуляции: макрофаги М1, М2 и Мox, которые участвуют, соответственно, в процессах воспаления, восстановления поврежденных тканей, а также защите организма от окислительного стресса.
«Классический» макрофаг М1 формируется из клетки-предшественника (моноцита) под действием каскада внутриклеточных сигналов, запускающихся после распознавания инфекционного агента с помощью специальных рецепторов, расположенных на поверхности клетки.
Образование «пожирателя» М1 происходит в результате мощной активации генома, сопровождаемой активацией синтеза более чем сотни белков – так называемых факторов воспаления. К ним относятся ферменты, способствующие генерации свободных радикалов кислорода; белки, привлекающие в очаг воспаления другие клетки иммунной системы, а также белки, способные разрушать оболочку бактерий; воспалительные цитокины – вещества, обладающие свойствами активировать иммунные клетки и оказывать токсическое действие на остальное клеточное окружение. В клетке активируется фагоцитоз и макрофаг начинает активно разрушать и переваривать все, что встретится на его пути (Шварц, Свистельник, 2012). Так появляется очаг воспаления.
Однако уже на начальных этапах воспалительного процесса макрофаг М1 начинает активно секретировать и противовоспалительные субстанции – низкомолекулярные липидные молекулы. Эти сигналы «второго эшелона» начинают активировать вышеупомянутые липидные сенсоры в новых «рекрутах»-моноцитах, прибывающих в очаг воспаления. Внутри клетки запускается цепь событий, в результате которых активирующий сигнал поступает на определенные регуляторные участки ДНК, усиливая экспрессию генов, отвечающих за гармонизацию обмена веществ и одновременно подавляя активность «провоспалительных» (т. е. провоцирующих воспаление) генов (Душкин, 2012).

Так в результате альтернативной активации образуются макрофаги М2, которые завершают воспалительный процесс и способствуют тканевому восстановлению. Популяцию М2 макрофагов можно, в свою очередь, разделить на группы в зависимости от их специализации: уборщики мертвых клеток; клетки, участвующие в реакции приобретенного иммунитета, а также макрофаги, секретирующие факторы, которые способствуют замещению погибших тканей соединительной тканью.
Еще одна группа макрофагов – Мох, формируется в условиях так называемого окислительного стресса, когда в тканях возрастает опасность повреждения их свободными радикалами. Например, Мох составляют около трети всех макрофагов атеросклеротической бляшки. Эти иммунные клетки не только сами устойчивы к повреждающим факторам, но и участвуют в антиоксидантной защите организма(Gui et al., 2012).
Пенистый камикадзе
Одной из самых интригующих метаморфоз макрофага является его превращение в так называемую пенистую клетку. Такие клетки были обнаружены в атеросклеротических бляшках, а свое название получили из-за специфического внешнего вида: под микроскопом они напоминали мыльную пену. По сути, пенистая клетка – это тот же макрофаг М1, но переполненный жировыми включениями, преимущественно состоящими из водонерастворимых соединений холестерина и жирных кислот.
Была высказана гипотеза, ставшая общепринятой, что пенистые клетки образуются в стенке атеросклеротических сосудов в результате неконтролируемого поглощения макрофагами липопротеинов низкой плотности, переносящих «плохой» холестерин. Однако впоследствии было обнаружено, что накопление липидов и драматическое (в десятки раз!) возрастание скорости синтеза ряда липидов в макрофагах можно спровоцировать в эксперименте только лишь одним воспалением, без всякого участия липопротеинов низкой плотности (Душкин, 2012).
Это предположение подтвердилось клиническими наблюдениями: оказалось, что превращение макрофагов в пенистую клетку происходит при разнообразных заболеваниях воспалительной природы: в суставах – при ревматоидном артрите, в жировой ткани – при диабете, в почках – при острой и хронической недостаточности, в ткани мозга – при энцефалитах. Однако понадобилось около двадцати лет исследований, чтобы понять, как и зачем макрофаг при воспалении превращается в клетку, нафаршированную липидами.
Оказалось, что активация провоспалительных сигнальных путей в М1 макрофагах приводит к «выключению» тех самых липидных сенсоров, которые в нормальных условиях контролируют и нормализуют липидный обмен (Душкин, 2012). При их «выключении» клетка и начинает накапливать липиды. При этом образующиеся липидные включения представляют собой вовсе не пассивные жировые резервуары: входящие в их состав липиды обладают способностью усиливать воспалительные сигнальные каскады. Главная цель всех этих драматических изменений – любыми средствами активировать и усилить защитную функцию макрофага, направленную на уничтожение «чужих» (Melo, Drorak, 2012).
Однако высокое содержание холестерина и жирных кислот дорого обходится пенистой клетке – они стимулируют ее гибель путем апоптоза, запрограммированной клеточной смерти. На внешней поверхности мембраны таких «обреченных» клеток обнаруживается фосфолипид фосфатидилсерин, в норме расположенный внутри клетки: появление его снаружи является своеобразным «похоронным звоном». Это сигнал «съешь меня», который воспринимают М2 макрофаги. Поглощая апоптозные пенистые клетки, они начинают активно секретировать медиаторы заключительной, восстановительной стадии воспаления.
Фармакологическая мишень
Воспаление как типовой патологический процесс и ключевое участие в нем макрофагов является, в той или иной мере, важной составляющей в первую очередь инфекционных заболеваний, вызванных различными патологическими агентами, от простейших и бактерий до вирусов: хламидиальные инфекции, туберкулез, лейшманиоз, трипаносомоз и др. Вместе с тем макрофаги, как уже упоминалось выше, играют важную, если не ведущую, роль в развитии так называемых метаболических заболеваний: атеросклероза (главного виновника сердечно-сосудистых заболеваний), диабета, нейродегенеративных заболеваний мозга (болезнь Альцгеймера и Паркинсона, последствия инсультов и черепно-мозговых травм), ревматоидного артрита, а также онкологических заболеваний.
Разработать стратегию управления этими клетками при различных заболеваниях позволили современные знания о роли липидных сенсоров в формировании различных фенотипов макрофага.
Так, оказалось, что в процессе эволюции хламидии и туберкулезные палочки научились использовать липидные сенсоры макрофагов, чтобы стимулировать не опасную для них альтернативную (в М2) активацию макрофагов. Благодаря этому поглощенная макрофагом туберкулезная бактерия может, купаясь как сыр в масле в липидных включениях, спокойно дожидаться своего освобождения, а после гибели макрофага размножаться, используя содержимое погибших клеток в качестве пищи (Melo, Drorak, 2012).
Если в этом случае использовать синтетические активаторы липидных сенсоров, которые препятствуют образованию жировых включений и, соответственно, предотвращают «пенистую» трансформацию макрофага, то можно подавить рост и понизить жизнеспособность инфекционных патогенов. По крайней мере в экспериментах на животных уже удалось в разы снизить обсемененность легких мышей туберкулезными бациллами, используя стимулятор одного из липидных сенсоров или ингибитор синтеза жирных кислот (Lugo-Villarino et al., 2012).
Еще один пример – такие болезни, как инфаркт миокарда, инсульт и гангрена нижних конечностей, опаснейшие осложнения атеросклероза, к которым приводит разрыв так называемых нестабильных атеросклеротических бляшек, сопровождаемый моментальным образованием тромба и закупоркой кровеносного сосуда.
Формированию таких нестабильных атеросклеротических бляшек и способствует макрофаг М1/пенистая клетка, который продуцирует ферменты, растворяющие коллагеновое покрытие бляшки. В этом случае наиболее эффективная стратегия лечения – превращение нестабильной бляшки в стабильную, богатую коллагеном, для чего требуется трансформировать «агрессивный» макрофаг М1 в «умиротворенный» М2.
Экспериментальные данные свидетельствуют, что подобной модификации макрофага можно добиться, подавляя в нем продукцию провоспалительных факторов. Такими свойствами обладает ряд синтетических активаторов липидных сенсоров, а также природные вещества, например, куркумин – биофлавоноид, входящий в состав корня куркумы, хорошо известной индийской пряности.
Нужно добавить, что такая трансформация макрофагов актуальна при ожирении и диабете 2 типа (большая часть макрофагов жировой ткани имеет М1 фенотип), а также при лечении нейродегенеративных заболеваний мозга. В последнем случае в мозговых тканях происходит «классическая» активация макрофагов, что приводит к повреждению нейронов и накоплению токсичных веществ. Превращение М1-агрессоров в мирных дворников М2 и Mox, уничтожающих биологический «мусор», может в ближайшее время стать ведущей стратегией лечения этих заболеваний (Walace, 2012).
С воспалением неразрывно связано и раковое перерождение клеток: например, имеются все основания считать, что 90 % опухолей в печени человека возникает как следствие перенесенных инфекционных и токсических гепатитов. Поэтому с целью профилактики раковых заболеваний необходимо контролировать популяцию М1 макрофагов.
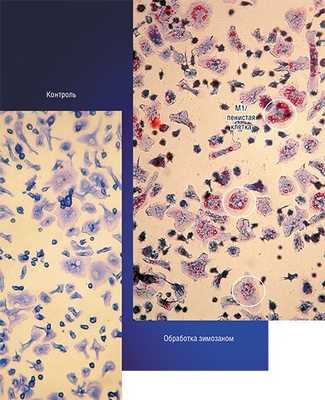
Однако не все так просто. Так, в уже сформированной опухоли макрофаги преимущественно приобретают признаки статуса М2, который содействует выживанию, размножению и распространению самих раковых клеток. Более того, такие макрофаги начинают подавлять противораковый иммунный ответ лимфоцитов. Поэтому для лечения уже образовавшихся опухолей разрабатывается другая стратегия, основанная на стимулировании у макрофагов признаков классической М1-активации (Solinas et al., 2009).
Примером такого подхода служит технология, разработанная в новосибирском Институте клинической иммунологии СО РАМН, при которой макрофаги, полученные из крови онкобольных, культивируют в присутствии стимулятора зимозана, который накапливается в клетках. Затем макрофаги вводят в опухоль, где зимозан освобождается и начинает стимулировать классическую активацию «опухолевых» макрофагов.

Сегодня становится все более очевидно, что соединения, вызывающие метаморфозы макрофагов, оказывают выраженное атеропротективное, антидиабетическое, нейропротективное действие, а также защищают ткани при аутоиммунных заболеваниях и ревматоидном артрите. Однако такие препараты, имеющиеся на сегодня в арсенале практикующего врача, – фибраты и производные тиазолидона, хотя и снижают смертность при этих тяжелых заболеваниях, но при этом имеют выраженные тяжелые побочные действия.
Эти обстоятельства стимулируют химиков и фармакологов к созданию безопасных и эффективных аналогов. За рубежом – в США, Китае, Швейцарии и Израиле уже проводятся дорогостоящие клинические испытания подобных соединений синтетического и природного происхождения. Несмотря на финансовые трудности, российские, в том числе и новосибирские, исследователи также вносят свой посильный вклад в решение этой проблемы.
Так, на кафедре химии Новосибирского государственного университета было получено безопасное соединение TS-13, стимулирующее образование Мox фагоцитов, которое обладает выраженным противовоспалительным эффектом и оказывает нейропротективное действие в экспериментальной модели болезни Паркинсона (Дюбченко и др., 2006; Зенков и др., 2009).
В Новосибирском институте органической химии им. Н. Н. Ворожцова СО РАН созданы безопасные антидиабетические и противоатеросклеротические препараты, действующие сразу на несколько факторов, благодаря которым «агрессивный» макрофаг М1 превращается в «мирный» М2 (Dikalov et al., 2011). Большой интерес вызывают и растительные препараты, получаемые из винограда, черники и других растений с помощью механохимической технологии, разработанной в Институте химии твердого тела и механохимии СО РАН (Dushkin, 2010).
С помощью финансовой поддержки государства можно в самое ближайшее время создать отечественные средства для фармакологических и генетических манипуляций с макрофагами, благодаря которым появится реальная возможность превращать эти иммунные клетки из агрессивных врагов в друзей, помогающих организму сохранить или вернуть здоровье.
Душкин М. И. Макрофаг/пенистая клетка как атрибут воспаления: механизмы образования и функциональная роль // Биохимия, 2012. T. 77. C. 419—432.
Смирнов А. Н. Липидная сигнализация в контексте атерогенеза // Биохимия. 2010. Т. 75. С. 899—919.
Шварц Я. Ш., Свистельник А. В.Функциональные фенотипы макрофагов и концепция М1-М2-поляризации. Ч. 1 Провоспалительный фенотип. // Биохимия. 2012. Т. 77. С. 312—329.
Второстепенные защитные функции макрофагов.
Функции и значение макрофагов
Активация макрофагов сопровождается усилением множества их функций. Важность поглощения и уничтожения таких внутриклеточных патогенных агентов, как Mycobacterium tuberculosis. Listeria, Leishmania, Toxoplasma, и некоторых грибов, очевидна, но макрофаги способны очищать кровь и от внеклеточных патогенных агентов, например Streptococcus pneumoniae.
Уничтожение поглощенных микроорганизмов зависит главным образом от продукции свободных радикалов (например, перекиси водорода) и оксида азота. Активированные макрофаги производят большее количество этих токсических метаболитов.
Противоопухолевая активность мононуклеарных фагоцитов изучена хуже. Она может быть и не связанной с процессом фагоцитоза. По-видимому, макрофаги уничтожают опухолевые клетки, секретируя лизосомные ферменты, оксид азота, метаболиты кислорода, цитолитические протеазы и ФНО-а. Протеолитические ферменты и цитотоксические факторы, присутствующие на мембране моноцитов, могут играть роль в отторжении опухолей.
Защитная функция моноцитов зависит от их способности проникать сквозь эндотелиальную стенку капилляров и мигрировать в очаги микробной инвазии в тканях. Хемотаксическими факторами для моноцитов служат фрагменты компонентов комплемента и хемокины, выделяемые нейтрофилами, лимфоцитами и другими клетками. Последующий фагоцитоз зависит от присутствия опсонинов (антител, комплемента, связывающих маннозу белков и белков сурфактанта), свойств поверхности микроорганизмов или опухолевых клеток и активности макрофагов.

Другие важные функции макрофагов включают уничтожение поврежденных и мертвых клеток, что способствует прекращению иммунных реакций и заживлению ран. Макрофагам, выстилающим синусоиды селезенки, принадлежит особая роль в поглощении изношенных эритроцитов. В очагах воспаления макрофаги распознают изменения фосфатидилсерина на мембране лимфоцитов и нейтрофилов, подвергающихся апоптозу, в результате чего такие клетки уничтожаются раньше, чем выделят свое токсическое содержимое в ткань.
Макрофаги — филогенетически древние клетки и в онтогенезе обнаруживаются уже на ранних стадиях развития плода, когда их функция сводится к уничтожению одних тканей по мере их замене другими. Эти клетки удаляют из организма и неорганические частицы, такие как элементы сигаретного дыма или попадающую в легочные альвеолы пыль.
Макрофаги — необходимые участники процесса индукции и реализации гуморальных и клеточных иммунных реакций. Поглощая чужеродный материал, они разрушают его и представляют на своей поверхности отдельные антигены в.виде пептидов или полисахаридов, связанных с молекулами МНС класса II. Антигенпредставляющей функцией обладают также В-лимфоциты и особенно дендритные клетки, играющие вспомогательную роль в развитии специфического иммунного ответа.
В активированных макрофагах усиливается экспрессия молекул МНС класса II и представление антигенов становится более эффективным.
Повышенная киллерная активность активированных макрофагов отчасти связана, по-видимому, с ускорением синтеза и выделения различных гидролитических ферментов и бактерицидных веществ. Известно примерно 100 различных веществ, секретируемых макрофагами. Столь высокая секреторная активность сближает эти клетки с гепатоцитами. Учитывая воздействие некоторых секретируемых веществ на другие клетки, огромное количество макрофагов и их повсеместное присутствие в тканях, систему мононуклеарных фагоцитов можно считать важнейшим эндокринным органом.
В этом можно убедиться на примере ИЛ-1. Любое воспаление или повреждение тканей стимулирует выделение ИЛ-1, главным образом, моноцитами и макрофагами. Этот интерлейкин, в свою очередь, влияет на температуру тела, сон и секрецию ИЛ-6, который вызывает продукцию белков острой фазы воспаления.
Кроме фагоцитоза, Fc-рецепторы опосредуют АЗКЦТ естественных киллеров (ЕК) или гранулоцитов (чаще - эозинофилов). На мембране ЕК экспрессированы FcyRIII (CD16) - Fc-рецепторы, распознающие IgGl и IgG3, связанные с антигенами на поверхности инфицированных клеток-мишеней, и "запускающие" цитотоксическую атаку ЕК на эти клетки-мишени. Такой вариант защиты наиболее эффективен при вирусных инфекциях, так как макрофаги неспособны захватывать ни вирусные частицы, ни их комплексы со специфическими антителами (IgG или IgA).
Защитная роль фагоцитоза макрофагами возбудителя зависит от завершенности этого процесса, т.е. от способности макрофага убить и переварить захваченный микроорганизм. Механизмы внутриклеточной микробицидности альвеолярных макрофагов отличаются более широким спектром по сравнению с моноцитами крови и другими тканевыми макрофагами. Альвеолярные макрофаги располагают кислород-зависимыми и кислород-независимыми механизмами, включая продукцию бактерицидных катионных белков. Однако микробицидность альвеолярных макрофагов резко снижается в результате перенесенной респираторной вирусной инфекции, что может облегчать распространение вторичной бактериальной инфекции.
Моноциты крови при воспалительных процессах аккумулируются в легких, где в качестве эффекторных клеток могут участвовать в первичном повреждении легочной ткани и в фиброзно-пролиферативной фазе воспалительных процессов типа респираторного дистресс-синдрома (ARDS). Заболевания этого типа (RDS) в последние годы связывают с недостаточным количеством сурфактанта в альвеолах легких. В литературе накапливаются сведения о том, что сурфактант модулирует иммунный ответ в альвеолах: он влияет на бактерицидные свойства и продукцию цитокинов альвеолярными макрофагами и моноцитами крови.
Альвеолярные макрофаги не только пребывают в микроокружении сурфактанта, но и достаточно активно захватывают его. Эффекты сурфактанта достаточно противоречивы. Отдельные его компоненты усиливают экспрессию маннозных рецепторов макрофагов. Они могут усиливать гибель внеклеточных патогенных бактерий, а для внутриклеточно паразитирующих микобактерий присутствие сурфактанта благоприятствует их захвату макрофагами, внутри которых они находят свою нишу. Повышенное содержание сурфактанта в альвеолах предрасполагает к развитию внутриклеточно паразитирующих возбудителей. Компоненты сурфактанта могут ингибировать бактерицидность макрофагов за счет повышения внутриклеточной концентрации цАМФ. Сурфактант ингибирует продукцию реактивных кислородных радикалов моноцитами макрофагами, что может служить средством защиты альвеолярного эпителия от повреждения.
Показана способность компонентов сурфактанта ингибировать продукцию провоспалительных цитокинов (TNF-a, IL-ip) моноцитами, стимулированными IFNy. Очевидно, сурфактант вносит свой вклад в баланс провоспалительных и противовоспалительных регуляторных механизмов, контролирующих воспалительный ответ в легочной ткани.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Альвеолярные макрофаги. Значение альвеолярных макрофагов при воспалении в легких.
Альвеолярные макрофаги ответственны за очищение от вдыхаемых чужеродных частиц различной природы. Взаимодействие альвеолярных макрофагов с удаляемыми частицами через определенные рецепторы определяет выраженность воспалительного ответа: от минимальной до активного воспаления с повреждением легочной ткани. Ответ альвеолярных макрофагов существенно различается в зависимости от рецепторов, задействованных при фагоцитозе частиц. Максимально выражен воспалительный ответ на захват опсонизированных частиц через Fc-peцепторы, от которых исходит сильнейший сигнал активации респираторного взрыва, секреции TNF-a и хемокинов. Опсонин-независимый фагоцитоз не сопровождается столь выраженной активацией метаболизма макрофагов. Захват неопсонизированных частиц альвеолярными макрофагами возможен через интегриновые рецепторы или через рецепторы для различных поверхностных компонентов частиц: лектиноподобные (MMR) для углеводов, рецепторы для обломков апоптотических клеток, скавенджер-рецепторы для модифицированных LDL и др. Экспрессия всех этих рецепторов регулируется провоспалительными цитокинами. Экспрессией их определяется роль альвеолярных макрофагов как барьера на пути проникновения в организм различных компонентов загрязнений воздуха (air pollutions), которые особенно опасны для людей с хроническими воспалительными заболеваниями бронхов и легких.
Особенностью альвеолярных макрофагов является слабая экспрессия CD14 по сравнению с моноцитами крови в сочетании с повышенной экспрессией особого мембранного полипептида РАМ-1. Альвеолярные макрофаги экспрессируют три класса рецепторов для Fc-фрагмента IgG: FcyRI(CD64), FcyRII(CD32), FcyRIII(CD16). Первые два из них экспрессируют и моноциты крови, а третий является особенностью альвеолярных макрофагов. Между моноцитами и альвеолярными макрофагами имеется различие и по экспрессии рецепторов для фракций комплемента. На альвеолярных макрофагах усилена экспрессия CR4 при ослабленной экспрессии CR3 и CR1. Альвеолярные макрофаги отличаются от моноцитов крови сниженной экспрессией адгезионных молекул LFA1 и отсутствием на мембране представителей семейства интегринов (VLA). По уровню экспрессии антигенов гистосовместимости МНСН альвеолярные макрофаги не уступают моноцитам крови.

Когда патогенный микроорганизм преодолевает эпителиальный барьер, в субэпителиальной соединительной ткани он встречается с макрофагом. Взаимодействие микроорганизма с макрофагом влечет за собой несколько следствий. Во-первых, микроорганизм захватывается, убивается и переваривается внутри макрофага. Этих событий может оказаться достаточно для предотвращения дальнейшего развития инфекции. Однако многие патогенные микроорганизмы в процессе эволюции паразитизма приобрели факторы стратегии, позволяющие им избегать захвата или внутриклеточной гибели и переваривания в макрофагах.Так, например, полисахаридная капсула предохраняет пневмококков и клебсиелл от взаимодействия с рецепторами макрофагов. Инфицирующая доза микроорганизмов может быть столь велика, что макрофаги не справляются с их элиминацией. Однако взаимодействие микроорганизмов с рецепторами макрофагов имеет еще одно важное следствие - индукцию продукции и секреции провоспалительных цитокинов, обеспечивающих развитие раннего воспалительного ответа на инфекцию. Кроме того, захват и переработка макрофагами возбудителя является первой фазой индукции специфического иммунного ответа на его антигены. Макрофаги относятся к профессиональным антиген-презентирующим клеткам, способным взаимодействовать с Т-лимфоцитами.
Главными антиген-презентирующими клетками в респираторном тракте считаются дендритные клетки, расположенные в паренхиме легких. Что касается роли альвеолярных макрофагов в иммунном ответе, то оценки ее весьма противоречивы. Особое внимание привлекают литературные данные о супрессирующем действии альвеолярных макрофагов на индуцированный антигеном пролиферативный ответ Т-лимфоцитов.
На мембране макрофагов экспрессированы рецепторы для многих регулирующих цитокинов, главным активирующим среди которых является IFNy. Созревание, дифференцировка и активация макрофагов зависят от ростовых факторов: GM-CSF и M-CSF. Альтернативным регулирующим цитокином для макрофагов является IL-10, который ингибирует все свойства и функции макрофагов, которые стимулирует IFNy.
Промежуточное влияние на функции макрофагов оказывают IL-4, IL-13, M-CSF и TGF-P.
Среди продуктов секреции макрофагов главное место занимают провоспалительные (IL-1, IL-6, TNF-a, IL-8, IL-12) и противовоспалительные (ILIO, TGF-P) цитокины. Макрофаги продуцируют и секретируют факторы роста для аутокринной регуляции и для регуляции других клеток (фактор роста фибробластов). Среди монокинов обнаруживаются хемокины для разных клеток. Продукты макрофагов обеспечивают адгезию лейкоцитов к эндотелию сосудов и последующую трансэндотелиальную миграцию (TNF-a, IL-8 и др.хемокины).
Макрофагальная дисфункция как гистологический субстрат опухолевых заболеваний человека

В современной медицине, располагающей огромным арсеналом лечебных средств, большое внимание уделяется стимуляции собственных защитных сил организма. Познание механизмов защитно-приспособительных реакций организма и управление ими является одной из фундаментальных проблем биологии и медицины. В настоящее время установлено, что организм человека располагает разнообразными механизмами защиты, предоставленными на клеточном, тканевом и организменном уровнях.
Особое значение представляет участие макрофагов в патогенезе столь распространенного в наше время заболевания — ВИЧ-инфекции, а также участию макрофакгической системы в противоопухолевой защите.
Данная работа имеет большой клинический интерес. Ее целью является изучить морфологическое строение и цитохимию макрофагов, исследовать их функции в организме человека, участие в различных заболеваниях, а также изучить явление дисфункции макрофагической системы.
В Бюллетене ВОЗ за 1972 авторы Langevort, Cohn, Hirsch, Furth и др. предложили термин «система мононуклеарных фагоцитов» (СМФ). Критериями принадлежности к системе они считали способность к активному пиноцитозу и иммунному фагоцитозу, способность прилипать к стеклянным поверхностям и происхождение из промоноцитов костного мозга. Таким образом, система мононуклеарных фагоцитов — это физиологическая защитная система клеток, обладающих способностью поглощать и переваривать чужеродный материал. Клетки, входящие в состав этой системы, имеют общее происхождение, характеризуются морфологическим и функциональным сходством и присутствуют во всех тканях организма. [9, с. 432–442]
Итак, макрофаг — клетка мезенхимальной природы, способная к активному захвату и перевариванию бактерий, остатков погибших клеток и других чужеродных или токсичных для организма частиц. Совокупность макрофагов организма Мечников назвал — макрофагическая система.
Морфология макрофагов
Рис. 1. Макрофаги на светооптическом уровне: 2 — макрофаг. В цитоплазме видны вакуоли и гранулы;3 — коллагеновые волокна (РВНСТ, окр. жел.гематоксилин)
Макрофаги имеют различные размеры — от 10 до 50 мкм. Их ядра бывают разной формы — округлые, неправильной формы, с инвагинациями. На пленочных препаратах рыхлой соединительной ткани макрофаги имеют довольно интенсивно окрашенное ядро. Контур цитоплазмы неровный. В цитоплазме обычно содержатся включения и, как правило, обнаруживается зернистость — фагоцитарные частицы.
Характерной чертой ультраструктуры макрофага является присутствие значительного количества микропиноцитозных пузырьков и лизосом, как первичных, так и вторичных. Первичные лизосомы представляют собой окруженные мембраной тельца значительной электронной плотности, содержащие гидролитические ферменты. [3, с. 112–139]
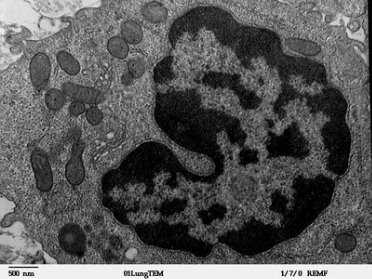
Рис. 2. Макрофаг на ультраструктурном уровне
В макрофагах обнаружены такие разнообразные ферменты, как кислая фосфатаза, липаза, эстераза различных типов, катепсин, кислая рибонуклеаза, кислая дезоксирибонуклеаза, арилсульфатаза, гиалуронидаза, лизоцим, цитохромоксидаза, пероксидаза, нафтиламидаза, ацетилглюкозаминидаза, АТФ — аза и др. Содержание ферментов в различных органах не одинаково; это связано с разной степенью окружающих раздражителей в различных органах. Уровень активности ферментов связан с уловиями окружающей среды и степенью фагоцитарной активности клетки. [7, c. 1023–1024]
Происхождение и трансформации макрофагов
О происхождении макрофагов и их дальнейших превращениях в литературе высказывались самые различные мнения. Из всех гипотез происхождения макрофагов окончательно доказанной является только гипотеза о моноцитарном их происхождении. [6,С. 485–92]
Много работ посвящено морфологии и химизму превращения моноцитов в макрофаги. Имеются критерии, позволяющие отличить промоноциты, моноциты и макрофаги друг от друга. [8,с. 2–8.]
Читайте также:
- Микрофлора полости рта. Микрофлора при кариесе зубов
- Сравнение контрастной эхокардиографии миокарда и стресс-эхокардиографии
- Кровь, плевральная жидкость, myasthenia gravis при тимомах. Рентгенологические признаки при тимомах
- Симптомы и диагностика туберкулеза уха
- Осложнения временной электрокардиостимуляции (ЭКС)
