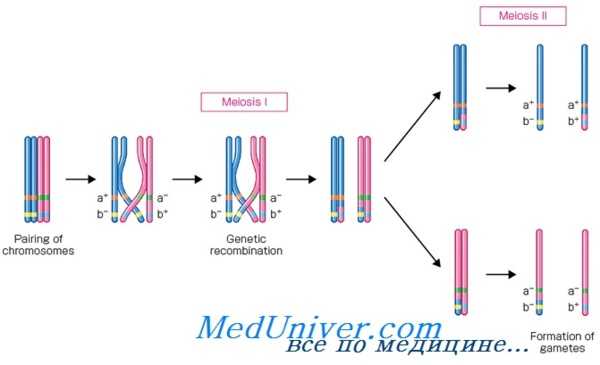
Взаимосвязь сцепления генов и частоты их рекомбинаций
Добавил пользователь Morpheus Обновлено: 25.01.2026
Современная концепция гена сконцентрировала в себе результаты вековых исследований, которые позволили наполнить менделевский наследственный фактор конкретным материальным содержанием. Термин “ген” был предложен датским генетиком В. Иогансеном в 1909 г. Методами классической генетики, в первую очередь работами Т. Моргана и его школы, было установлено, что ген является дискретной единицей наследственности, которая передается от родителей к потомству. Эта единица была в значительной степени абстрактной, т.к. физическая природа гена была неизвестна, так же как и принцип его работы. Не вызывало сомнений, что гены связаны с хромосомами, но является ли ген участком хромосомы или он каким-то образом ассоциирован с ней, на этот вопрос не мог точно ответить даже Т. Морган — автор хромосомной теории наследственности. Однако это не помешало ему и его коллегам установить важнейшие закономерности наследования и сформулировать основные генетические теории.
Один из основных постулатов классической генетики — это неделимость гена, т.е. ген рассматривался как наименьшая структурная и функциональная частица наследственности. Он является единицей мутации, рекомбинации и функции. В этих положениях отражены основные критерии аллелизма, на основании которых мутации со сходным фенотипическим эффектом могут быть отнесены к одному гену. Это — функциональный и рекомбинационный критерии. Функциональный критерий основан на том, что при наличии в гомологичных хромосомах гибрида двух мутаций, полученных от разных родителей и затрагивающих один и тот же ген, не может проявиться признак дикого типа. Этим взаимодействие разных аллелей одного гена в гибридном генотипе отличается от взаимодействия неаллельных генов, контролирующих один и тот же признак. В последнем случае гены комплементарны и в гетерозиготном состоянии обеспечивают возврат к дикому типу (см. выше лекцию “Взаимодействие генов”). Рекомбинационный критерий гласит: если мутации не рекомбинируют (внутри гена нет кроссинговера), то они аллельны. В работах школы Моргана эти критерии, по сути дела, совпадали.
В конце 20-х — начале 30-х гг. учеными А.С. Серебровским и Н.П. Дубининым были выполнены исследования, которые привели к отказу от представления о неделимости гена. Ими была описана серия индуцированных мутаций гена scute (sc), нарушающих формирование щетинок у дрозофилы. С помощью генетического анализа было установлено, что за редукцию разных групп щетинок отвечают разные участки одного и того же гена. Если у родителей эти участки не совпадают, то у гибрида создается частичная гетерозиготность (т.е. гетерозиготность по внутригенным мутациям) и мутации не проявляются. В этом случае у гибридов представлены все группы щетинок.
Частичная гетерозиготность по мутациям внутри одного гена,
приводящая к проявлению признака дикого типа.
a, b, c, d, e, f — рецессивные аллельные мутации, вызывающие редукцию разных групп щетинок,
+ — участки ДНК дикого типа.
Из результатов экспериментов был сделан важный вывод о делимости гена. Ген состоит из более мелких субъединиц, названных центрами, которые являются единицами мутации. Эти исследования были первым прорывом в область сложной структуры гена.
С 40-х гг. ХХ в., когда были установлены генетические функции ДНК, началось наполнение понятия “ген” конкретным содержанием. Однако впервые гипотеза о молекулярной природе генов и хромосом была высказана в 30-е гг. Н.К. Кольцовым и получила дальнейшее развитие в работах выдающихся ученых того времени: Н.В. Тимофеева-Ресовского, М. Дельбрюка, К. Циммера. Они разработали модель гена с позиций квантовой физики, рассматривая ген как макромолекулу с определенным чувствительным объемом, в которой при поглощении энергии происходят структурные перестройки. В результате перестроек образуются изомеры. Изомеры соответствуют аллельным генам, а переходы из одной изомерной формы в другую — мутациям. Эта модель не в полной мере выдержала проверку временем. Гены действительно оказались макромолекулами, но не белками, как предполагал Кольцов и авторы модели, а участками ДНК. Но главное значение этой модели в том, что она направила внимание ученых на раскрытие тайны строения гена, что вскоре дало положительный результат.
Большой вклад в понимание структуры и функции гена внесли Дж. Бидл и Э. Тейтум, которые впервые связали функцию гена с выработкой клеточных белков. В 1939 г. они исследовали биохимические мутанты плесневого грибка Neurospora crassa и показали, что ауксотрофные мутации (неспособность к синтезу определенных веществ) являются результатом нарушения какого-либо звена в цепи метаболизма, которое катализировалось специфическим ферментом. При этом аллельные мутации всегда затрагивали одно и то же звено. Авторы сформулировали принцип “один ген — один фермент”, согласно которому каждый ген контролирует синтез какого-либо фермента.
Позже появились работы с дрозофилой. В них доказывалась возможность рекомбинации мутаций, которые в соответствии с функциональным критерием должны были считаться аллельными (К. Оливер, М. Грин и К. Грин, Э. Льюис). Противоречие между двумя тестами породило термин “псевдоаллелизм“. Оно послужило причиной первого кризиса теории гена, выходу из которого во многом способствовала разработка нового теста на аллелизм.
Этот тест под названием цис-транс-теста был предложен Э. Льюисом. В его основу положено представление о том, что эффект от присутствия двух разных мутаций в гомологичных хромосомах гибрида зависит от их положения на хромосоме. В цис-положении мутации находятся в одной хромосоме, в транс-положении — в разных. И аллельные и неаллельные мутации в цис-положении не проявляются, т.к. они перекрываются неизмененными участками в другой гомологичной хромосоме, и поэтому гибрид несет признак дикого типа. В транс-положении, если мутации неаллельны, то они комплементируют, и гибрид также относится к дикому типу. Если же мутации аллельны, т.е. затрагивают один и тот же ген, то у гибрида при транс-положении мутаций будет мутантный фенотип. По появлению гибрида с мутантным фенотипом от скрещивания двух мутантных по одному и тому же признаку форм делают вывод о принадлежности этих мутаций к одному гену.
Окончательно убедили генетиков в сложной структуре гена результаты экспериментов С. Бензера, в которых он использовал цис-транс-тест при исследовании 2000 мутаций, затрагивающих область rII фага Т4. Мутации в этом локусе обусловливают неспособность этого фага к размножению в клетках штамма К E. coli, в геноме которых присутствует ДНК фага λ. На основе рекомбинационного критерия Бензер установил, что в состав локуса rII входит два гена — А и В, в пределах которых возникает большое количество спонтанных мутаций. Те из них, которые при объединении в одном геноме всегда комплементируют (т.е. восстанавливают способность фага к размножению), он относил к разным генам, а некомплементирующие, дающие мутантный фенотип (т.е. неспособный к размножению) — к одному. По наблюдавшейся в опыте крайне низкой частоте комплементации двух мутаций Бензер сделал вывод о возможности кроссинговера и, следовательно, рекомбинации мутаций внутри гена. Частоту рекомбинации между двумя мутациями при совместном заражении E. coli двумя мутантными штаммами Т4 Бензер использовал для картирования мутаций.
Участок хромосомы, в пределах которого обнаруживается цис-транс-эффект, Бензер предложил называть цистроном. Цистрон — это единица функции, а, следовательно, он аналогичен гену. Минимальная частота рекомбинации, полученная в опытах Бензера, равнялась 0,02%, что соответствовало расстоянию в две нуклеотидные пары. Эта единица рекомбинации была названа реконом. Единицу мутации Бензер назвал мутоном (его минимальный размер — 1 нуклеотид).
Результаты экспериментов С. Бензера показали относительность моргановских критериев аллелизма, в первую очередь рекомбинационного критерия. Исследования, проведенные на других объектах (вирусах, бактериях, грибах, водорослях, дрозофиле и высших растениях), выявили общую закономерность: в пределах одного гена может находиться множество мутаций, локализованных в разных местах гена, и внутри гена может происходить рекомбинация. Таким образом, современная концепция гена базируется на положении о сложном строении и делимости генов.
Большинство генов содержит информацию о первичной структуре специфических белков. Однако существуют гены, которые не имеют конечного белкового продукта. Они транскрибируются, но не транслируются. К ним относятся гены, кодирующие структуру двух форм РНК (рРНК и тРНК). Среди генов, кодирующих структуру белков, многие входят в систему регуляции, т.е. их белковые продукты регулируют функции других генов.
Структурная и функциональная организация генетических единиц в клетке получила название генома. У эукариот геном — это генный комплекс гаплоидного набора хромосом.
Перейти к чтению других тем книги "Генетика и селекция. Теория. Задания. Ответы":
Взаимосвязь сцепления генов и частоты их рекомбинаций
Термин «сцепление» используют для описания отклонения из независимого распределения двух локусов или, другими словами, тенденции аллелей в локусах, расположенных в одной хромосоме передаваться в мейозе вместе, как единый блок. Анализ сцепления зависит от определения частоты рекомбинации как меры того, насколько близко в хромосоме расположены друг от друга разные локусы.
Если два локуса расположены настолько близко, что Q = 0, говорят, что они тесно сцеплены; если они настолько отдалены, что Q = 0,5, они распределяются независимо и являются несцепленными.
Между двумя предельными значениями возможны различные степени сцепления. Предположим, среди потомства информативных мейозов (т.е. когда родитель гетерозиготен в обоих локусах) 80% потомков нерекомбинантные и 20% — рекомбинантные. На первый взгляд, частота рекомбинации равна 20% (Q = 0,2). Тем не менее точность этой меры зависит от размера семьи, в которой проведены измерения.
Если 20% потомства показывают рекомбинацию и 80% — нет, оценка Q = 0,2 точна, только если число потомков было достаточным, чтобы быть уверенным, что наблюдаемое соотношение 80:20 нерекомбинантных к рекомбинантным отличается от коэффициента 50:50, ожидаемого для несцепленных локусов.
Например, если вы имеете только пять детей и четверо из них оказались нерекомбинантными, а один рекомбинантным, это соотношение недостоверно отличается от результата, ожидаемого для двух несцепленных локусов. (Будете ли вы считать значимым, если при подбрасывании монеты из пяти раз четыре раза выпадет орел? Нет, поскольку четыре или даже больше выпадений орла из пяти бросков монеты могут происходить, по крайней мере иногда, чисто случайно.)
Тем не менее если наблюдается то же соотношение 80:20 после генотипирования 50 детей из нескольких семей, оно должно, несомненно, считаться отличным от 50:50, подобно тому, как вы должны найти очень необычным, если подбрасывать монету 50 раз и 40 раз выпадет орел (40 или более из 50 выпадений орла должны случаться только в одном случае из тысячи — весьма маловероятный случай!). Следовательно, для оценки точности и достоверности измерений требуется применение статистических методов. Статистический метод оценки семейных данных, метод оценки LOD (logarithm of the odds) — основа анализа сцепления.
При измерении необходимо учитывать один дополнительный эффект размера выборки. Ясно, что когда два локуса расположены очень близко, например в = 0,01 или меньше, требуется достаточно большой размер выборки, чтобы иметь шанс реально увидеть ожидаемый редкий случай рекомбинации из 100 или более потомков. В противном случае оценка окажется равной нулю.
В практических условиях величины ниже 0,01 точно измерить трудно, для этого требуются обширные массивы данных, обычно доступные лишь в очень больших исследованиях генетики человека.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Определение связи между двумя локусами генов. Выявление сцепления
Анализ сцепления — метод картирования генов, использующий семейные исследования для определения связи между двумя генами при их передаче от одного поколения другому. Для того чтобы решить, что два локуса сцеплены и, если да, то как сильно, мы основываемся на двух видах информации.
Во-первых, мы устанавливаем, значимо ли отклоняется частота рекомбинации Q между двумя локусами от 0,5; определение сцепления между двумя локусами эквивалентно выяснению того, отличается ли доля рекомбинаций между ними от 0,5 ожидаемой для несцепленных локусов.
Во-вторых, если доля рекомбинаций менее чем 0,5, нужно оценить ее наилучшим образом, поскольку это покажет, насколько тесно сцеплены локусы. В обоих случаях применяют статистический метод отношения правдоподобия. Правдоподобие — меры вероятности, шансы — отношения правдоподобия. Отношения правдоподобия рассчитывают следующим образом.
Изучают фактические семейные данные, подсчитывают число детей, имеющих рекомбинацию между локусами и, наконец, вычисляют правдоподобие (вероятность) наблюдаемого значения Q в интервале от 0 до 0,5. Затем вычисляют вторую вероятность, основанную на гипотезе, что два локуса не сцеплены, т.е. Q=0,50. Мы рассматриваем отношение правдоподобия наблюдаемых в семейных данных значений Q и правдоподобия при условии отсутствия сцепления между локусами и тем самым получаем отношение шансов:
1) Правдоподобие данных, если локусы сцеплены с некоторым коэффициентом Q
2) Правдоподобие данных, если локусы не сцеплены (Q = 0)
Вычисленные отношения шансов для значений Q обычно представляют в форме десятичных логарифмов и называют LOD-оценкой (Z) логарифма шансов (log of the odds). (Использование логарифмов позволяет объединять данные, полученные из разных семей простым сложением).
Анализ сцепления менделирующих болезней, основанный на моделях (прототипах)
• Анализ сцепления называют модельным (или параметрическим), если допускают, что существует конкретный тип наследования (аутосомно-доминантный, аутосомно-рецессивный или Х-сцепленный), объясняющий наследование признака.
• Анализ LOD-оценки допускает картирование генов, мутации в которых вызывают болезни, передающиеся по менделирующему типу.
• LOD-оценка дает:
- наилучшую оценку частоты рекомбинации (Qmax) между маркерным локусом и локусом болезни;
- оценку того, насколько хорошо подтверждается сцепление этой величиной Qmax. Величины LOD-оценки более 3 считают надежным подтверждением.
• Сцепление с конкретным значением Qmax локуса гена болезни и маркера с известной физической позицией подразумевает, что локус гена болезни должен располагаться около маркера.
Отношение шансов важно в двух смыслах. Во-первых, оно обеспечивает статистически правильный метод для использования семейных данных при оценке частоты рекомбинации между локусами. Дело в том, что статистическая теория гласит, что величина, дающая наибольшую величину Z, фактически, наилучшая оценка доли рекомбинации, которую можно сделать, основываясь на имеющихся данных. Эта величина называется Qmax. Если Q отличается от 0,50, мы получаем подтверждение сцепления.
Тем не менее хотя Qmax — наилучшая оценка Q, насколько она хороша? Отношение шансов отвечает и на этот вопрос, поскольку, гем выше велигина Z, тем лугше оценка Qmax. Положительные величины Z (шансы >1) при данной Q указывают, чтобы два локуса сцеплены, тогда как отрицательные (шансы <1), предполагают, что сцепление менее вероятно, чем возможность, что два локуса не сцеплены.
Принято считать, что комбинированная оценка LOD +3 или больше (эквивалентно шансам выше, гем 1000:1 в пользу сцепления), является оконгателъным подтверждением, что два локуса сцеплены.
Картирование генов анализом сцепления предоставляет возможность локализовать важные для медицины гены, руководствуясь наследованием болезни и наследованием аллелей в полиморфных маркерах, если локус болезни и локус полиморфного маркера сцеплены. Вернемся к семье, показанной на рисунке. Мать имеет аутосомно-доминантную форму пигментного ретинита. Есть десятки других форм этой болезни, многие из них картированы в специфических местах в пределах генома и гены которых известны.
Мы не знаем, которую из форм пигментного ретинита имеет мать. Она также гетерозиготна по двум локусам в хромосоме 7 (один в 7р14 и один в дистальном конце длинного плеча). Можно видеть, что в этой семье передача мутантного аллеля (D) неизменно «следовала» за аллелем В в локусе маркера 2 от первого поколения второму. Все три потомка с болезнью (по-видимому, унаследовавшие материнский мутантный аллель D в локусе RP), также унаследовали аллель В в локусе маркера 2. Все потомство, унаследовавшее материнский нормальный аллель d, унаследовало b аллель и не имеет пигментного ретинита. В то же время ген пигментного ретинита не имеет тенденции следовать за аллелем в локусе маркера 1.
Вероятно, мы получили бы Q как «истинную» долю рекомбинации между локусом пигментного ретинита и локусом 2, если бы у нас было неограниченное число потомков. С этой точки зрения, Q можно рассматривать как вероятность того, что рекомбинация происходит между двумя локусами в каждом мейозе. Поскольку рекомбинация или происходит, или нет, вероятность рекомбинации, равная Q, и вероятность отсутствия рекомбинации должны в сумме давать единицу. Следовательно, вероятность, что рекомбинация не происходит, равна Q-1. Фактически, есть только шесть потомков без рекомбинации.
Поскольку каждый мейоз является независимым случаем, мы перемножаем вероятности рекомбинации (Q) или отсутствия рекомбинации (Q-1) для каждого ребенка. Вероятность наблюдения ни одного ребенка с рекомбинацией и шестерых без рекомбинации между пигментным ретинитом и маркером локуса 2, таким образом, равна Q°х(1-Q)6. Оценка LOD между локусами пигментного ретинита и маркером 2, равна:
Максимальная величина Z равна 1,81, встречающаяся, когда Q=0, и предполагает, но не уверенно, наличие сцепления, поскольку значение Z — положительное, но меньше 3.
Объединение информации LOD-оценки из разных семей
Таким же образом, каждый мейоз в семье, производящей нерекомбинантное или рекомбинантное потомство — независимый случай, так же независимы и мейозы, происходящие в других семьях. Следовательно, мы можем перемножить вероятности в числителе и знаменателе отношений правдоподобия отдельных семей. Аналогичное, но более удобное вычисление — сложить десятичные логарифмы (log10) всех вычисленных отношений правдоподобия, формируя общую Z-оценку для всех семей.
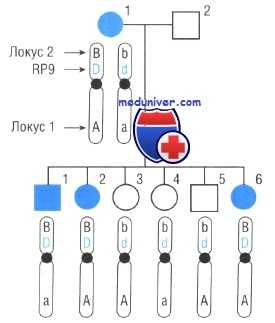
Родословная наследования пигментного ретинита
В случае пигментного ретинита на рисунке, предположим, что изучались две других семьи и в одной не обнаружена рекомбинация между локусом 2 и пигментным ретинитом у четырех детей, а в третьей нет рекомбинации у пяти детей. Для каждой семьи рассчитаны индивидуальные LOD-оценки, затем сложенные вместе. В этом случае, можно было бы говорить, что ген пигментного ретинита в этой группе семей сцеплен с локусом 2.
Поскольку хромосомная позиция полиморфного локуса 2 известна — 7р14, пигментный ретинит в этой семье может картироваться в области вокруг 7р14, рядом с локусом RP9, уже определенным для одной из форм аутосомно-доминантного пигментного ретинита.
Если некоторые анализируемые семьи имеют пигментный ретинит из-за мутаций в другом локу-се, оценки LOD между семьями будут расходиться: некоторые будут показывать небольшую положительную, другие — резко отрицательную оценку. Можно все еще складывать Z-оценки вместе, но результат даст быстрый спад в общей LOD-оценке. Таким образом, при анализе сцепления, включающем более одной семьи, не заподозренная гетерогенность локуса может скрывать сцепление, существующее в подмножестве семей.
Взаимодействие между генами
Генотип человека – тысячи различных признаков – размещается всего в 46 хромосомах. Это означает, что каждая хромосома содержит множество генов. Законы Менделя справедливы только для генов, локализованных в разных хромосомах.
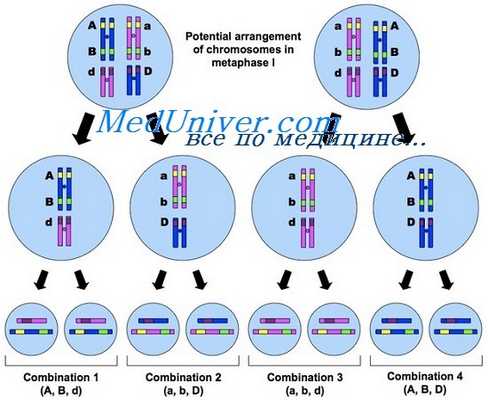
Гены, находящиеся в одной хромосоме, называются сцепленными . Все гены, относящиеся к одной группе сцепления, входят в одну хромосому и при образовании гамет наследуются вместе. Количество генов в различных группах сцепления (то есть в различных хромосомах) может отличаться друг от друга. При дигибридном скрещивании сцепленные гены, как правило, не подчиняются законам Менделя. С другой стороны, полное сцепление случается достаточно редко, и в потомстве обычно бывают представлены все четыре фенотипа. Таким образом, и в этом случае при дигибридном скрещивании образуются новые сочетания признаков – рекомбинантные фенотипы. Итак, если особи с новыми генными комбинациями встречаются в потомстве реже, чем особи с родительскими фенотипами, то это верный признак сцепленности соответствующих генов. Появление рекомбинантных сочетаний у аллелей называется кроссинговером ( перекрестом ).
Исследования генетиков начала XX века показали, что кроссинговер имеет место в результате разрыва и рекомбинации гомологичных хромосом и происходит практически между всеми хромосомами. Частота рекомбинаций определяется по формуле , где – количество рекомбинантов, – общее количество потомков. В то же время частота рекомбинаций определяет число рекомбинаций, происходящих при образовании гамет.
Частота рекомбинаций генов показывает относительное расположение сцепленных генов в хромосоме: чем дальше друг от друга находятся гены, тем выше частота рекомбинации. Это обстоятельство используется при составлении генетических карт . Условное «расстояние» между локусами (местоположениями в хромосоме) двух генов считается прямо пропорциональным частоте рекомбинации. Взаимное расположение (последовательность) локусов трёх и более генов определяется методом триангуляции . При этом сначала берутся гены с наименьшей частотой рекомбинации. Далее выбирают следующую по величине частоту рекомбинации и указывают два возможных положения нового гена; одно из этих положений будет отсеяно на следующем шаге, когда берётся третья частота.
В реальных экспериментах генетические карты могут искажаться благодаря двойному кроссинговеру , когда рекомбинация происходит одновременно в двух точках. Двойной кроссинговер особенно характерен для генов, локусы которых разделены большими расстояниями.
Существуют и более сложные механизмы взаимодействия между генами. Так, каждый признак может контролироваться не двумя, а тремя и более аллелями. Примером подобных множественных аллелей является наследование групп крови у человека. Три аллеля гена группы крови обозначаются буквами A, B и O. Аллели A и B являются доминантными, а аллель O рецессивен им обоим. В результате у человека могут наблюдаться четыре различные группы крови.
| |||||||||||||||||||