Замыкающие сосуды. Сосудистые анастомозы
Добавил пользователь Евгений Кузнецов Обновлено: 27.01.2026
Анализ 11 случаев ГПА позволил выделить общие патоморфологические особенности этого системного васкулита. В основе его клинических проявлений лежит пролиферативно-деструктивный ангиит с преимущественным поражением сосудов микроциркуляторного русла, а также развитием в их стенках и периваскулярно гранулем, склонных к некрозу.
Частота вовлечения различных сосудистых бассейнов при ГПА не одинакова. Наиболее типичная локализация васкулита — сосуды верхних дыхательных путей, легких и почек. При патоморфологическом исследовании диагностированы значительные изменения в системе бронхиальных и легочных артерий и вен. В патологический процесс были вовлечены капилляры, артериолы, артерии мышечного типа и в меньшей степени венулы, вены.
Развивался и прогрессировал генерализованный деструктивно-продуктивный панангиит, тромбоваскулит с поражением всех слоев стенок сосудов. Процесс начинался в сосудах малого калибра, разной степени интенсивности — от мукоидного отека до фибриноидных изменений. В большинстве случаев отмечался сегментарный (см. рисунок, а) или циркулярный фибриноидный некроз сосудистой стенки. Пролиферативные изменения проявлялись развитием интра- и периваскулярно гранулем полиморфного клеточного состава. Гранулематозный процесс не имел какого-либо закономерного порядка размещения клеточных элементов. Клетки расположены хаотично и представлены типичными для этого системного васкулита гигантскими многоядерными формами двух типов: клетки Пирогова—Лангханса и клетки «инородных» тел, местами образующие симпласты. Также присутствуют эпителиоидные клетки, лимфоциты, плазмоциты, нейтрофильные и эозинофильные лейкоциты, фибробласты. Внутри- и экстравазальное образование гранулем сопровождалось их некрозом, что является характерным признаком ГПА (см. рисунок, б). В части сосудов просвет полностью или частично перекрыт фибриновыми тромбами, в других наблюдался незавершенный процесс тромбогенеза в виде агрегации, сладж-синдрома форменных элементов крови. Обтурация артериального русла фибриновыми тромбами, агрегатами эритроцитов и тромбоцитов приводила к резкому нарушению гемомикроциркуляции в верхних дыхательных путях и легких. Сосуды с признаками атонии, дистонии. Это приводило к аневризматическому выпячиванию стенок артерий, дилатации просвета капилляров. Наблюдались отек и десквамация эндотелия. Степень выраженности патоморфологических проявлений преобразований в сосудах зависела от длительности заболевания. При остром и подостром течении болезни наблюдались деструктивно-продуктивные изменения. Их эволюция в случаях хронического течения или регрессии гранулематозного процесса под влиянием лечения приводила к более или менее резкому утолщению стенок сосудов за счет склероза и гиалиноза (см. рисунок, в). Наблюдалась пролиферация эндотелиоцитов и гладких миоцитов, приводящая к разрастанию интимы и перекалибровке сосудов с уменьшением их просвета, местами к полной его обтурации (см. рисунок, б, в). Появлялись также артериовенозные анастомозы по типу замыкающих артерий. Указанные изменения приводят к редукции микроциркуляторного русла легких, уменьшению общей площади функционирующих легочных капилляров. Структурная перестройка в сосудах малого круга кровообращения и бронхиальных артериях играет особую роль в возникновении легочной гипертензии, недостаточности правого желудочка сердца. Итак, патоморфологическая картина поражения сосудов в случаях длительного течения заболевания характеризуется сочетанием деструктивно-пролиферативных изменений с репаративными и адаптативными процессами.
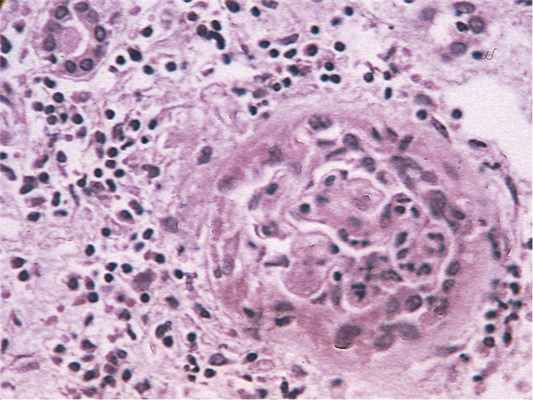
Патогистологические преобразования в сосудах различных органов при гранулематозе с полиангиитом. а — артериола миокарда, сегментарный фибриноидный некроз стенки; б — артерия мелкого калибра легких, пролиферация интимы с сужением просвета, зона некроза; в — артерия среднего калибра легких, гиперплазия и склероз интимы; г — почка, фибриноидный некроз и склероз клубочка почки, перигломерулярная полиморфная инфильтрация; д — субэпикардиальная артерия, фибриноидный некроз, периваскулярная инфильтрация; а, г, д — окраска гематоксилином и эозином, ×40; б, в — окраска трихромом по Массону, ×20.
Патоморфологические изменения в сосудах верхних дыхательных путей. Поражение дыхательной системы при ГПА отличается полиморфизмом клинических проявлений. Диффузный деструктивно-пролиферативный панангиит в системе бронхиальных, легочных мелких артерий и вен является причиной тяжелых циркуляторных нарушений и смертельных осложнений. У всех умерших в начале болезни преобладала патология верхних дыхательных путей — рецидивирующий некротический ринит и синусит с гнойно-кровянистыми выделениями из носа. По мере прогрессирования заболевания в процесс вовлекались гортань, трахея, бронхи.
Патоморфологические изменения в сосудах легких. В стадии развернутой клинической картины поражались легкие. Характерным вариантом патологии легких было наличие внутри- и внесосудистых гранулем с последующим их некрозом, секвестрацией и образованием каверн. Деструкция сосудистой стенки приводила к арозивным легочным кровотечениям, асфиксии, гиповолемическому шоку и становилась причиной летального исхода. Обтурация сосудистого просвета тромбами обусловливала возникновение геморрагических инфарктов легких. Выраженные нарушения микро- и макроциркуляции создавали благоприятные условия для присоединения инфекции и развития пневмонии, абсцессов легких. Как следствие прогрессирующих изменений в верхних дыхательных путях и легких развивались острое легочное сердце, легочно-сердечная недостаточность. Эта вторичная патология и занимала ведущее место в причине летальности при ГПА.
Патоморфологические изменения в сосудах почек. Патогистологические изменения различной степени выраженности выявлены в сосудах почек всех умерших от ГПА. Типичным вариантом поражения почечных сосудов является васкулит микроциркуляторного русла, а именно капилляров клубочка — гломерулит. Структурные изменения в почечных клубочках были разнообразны и зависели от характера протекания и продолжительности заболевания. В случаях острого течения преобладали деструктивно-пролиферативные процессы. Их начальным проявлением был мембранозный гломерулонефрит в виде утолщения и расщепления базальной мембраны гломерулярных капилляров. При прогрессировании развивался сегментарный или тотальный фибриноидный некроз капиллярных петель (см. рисунок, г). В интра- и экстракапиллярном пространстве клубочков находили фибринозно-геморрагический экссудат. Указанные изменения сочетались с образованием «полулуний» из клеток, расположенных в капсуле Боумена. Основа их — пролиферирующие нефроэпителиальные клетки. Тяжесть гломерулита при ГПА находилась в прямой зависимости от количества клубочков, в которых формируются «полулуния». В просвете капилляров наблюдали тромбы. При хроническом течении деструктивно-пролиферативные изменения сочетались с сегментарным или диффузным гломерулосклерозом, атрофией и гиалинозом клубочков. Патология гломерулярного аппарата является неспецифической и наблюдается также при других васкулитах, протекающих с гломерулонефритом. В артериолах, внутриорганных артериях почек мелкого и среднего калибра наблюдали все виды альтеративных изменений от мукоидного отека, плазматического пропитывания до тотального фибриноидного некроза. Просвет части сосудов сужен в связи с формированием тромбов, иногда до полного прекращения кровотока. Кроме глубоких деструктивных изменений в сосудах, наблюдались пролиферативные процессы. Типичный патоморфологический признак ГПА — внутрисосудистые некротизирующие гранулемы. В их клеточный состав входят гигантские многоядерные клетки типа Пирогова—Лангханса и клетки типа «инородных» тел. Кроме сосудистой стенки, «любимое» место локализации гранулематозного воспаления в почках — интерстициальное пространство вокруг почечных клубочков. Некроз гранулем приводил к деструкции интактных до этого сосудов. В случаях длительного течения болезни (на фоне интенсивной терапии) развивался внутрисосудистый и периваскулярный склероз. При этом сосуды, в частности приносящие артериолы, были с резко утолщенными стенками, иногда до полного закрытия просвета за счет продуктивных изменений. Во внутренней и внешней эластичной мембране обнаружена мультипликация волокон и их фрагментация. Вены и венулы почек дилатированны. Деструктивно-пролиферативные изменения в них выражены в меньшей степени, чем в артериях. Воспалительный процесс в гемомикроциркуляторном русле, артериях мелкого и среднего калибра приводил к недостаточности кровоснабжения почек и обусловливал развитие ишемии, а затем и нефросклероза. В двух случаях (больные в возрасте 16 и 23 лет) расстройства гемомикроциркуляции настолько выражены, что привели к множественным ишемическим инфарктам. Гемодинамические изменения в почечной паренхиме создавали благоприятный фон для возникновения микроабсцессов, чаще они формировались в зонах некротизирующего гранулематозного воспаления. В зависимости от степени выраженности патоморфологических изменений в клубочках и внутриорганных почечных артериях непременным клиническим проявлением патологии почек были разные нефрологические синдромы — от бессимптомной протеинурии, гематурии до быстропрогрессирующей почечной недостаточности. У большей части пациентов наблюдался мочевой синдром с микрогематурией, протеинурией (она не превышала 2—3 г/сут). У некоторых больных поражение почек приводило к быстропрогрессирующей почечной недостаточности. Своеобразной особенностью почечной патологии была редкость артериальной гипертензии и выраженного отечного синдрома. Во всех случаях финалом гломерулита становилась почечная недостаточность — одна из частых непосредственных причин смерти при ГПА.
Патоморфологические изменения в сосудах сердца. Поражение сердца и его коронарного русла наблюдали у всех умерших от ГПА. Наиболее выраженные нарушения выявлены в микроциркуляторном русле — в артериолах, капиллярах и в меньшей степени — в венулах. Коронарные сосуды отличались «мозаичной» патогистологической картиной, среди них были как острые, так и хронические преобразования. Острые представлены широким спектром изменений от мукоидного отека до фибриноидного некроза, с циркулярным поражением всех слоев сосудистой стенки (см. рисунок, а, д). Деструктивные процессы сопровождались пролиферативной реакцией в стенке сосудов и периваскулярном пространстве. Просвет части сосудов заполнен агрегатами тромбоцитов, эритроцитов и тромбами, местами до полной обтурации и прекращения кровотока. Наряду с этим у умерших с длительным течением заболевания, диагностировали хронические изменения в виде гиперплазии интимы, склероза, гиалиноза стенки сосудов, что в части наблюдений сопровождалось резким сужением и перекалибровкой сосудов. В некоторых зонах выявлена полная организация обтурирующих тромбов с их реканализацией и образованием «многоствольных» сосудов. Отмечено также появление мелких артерий «замыкающего» типа, артериовенозных анастомозов, что, с одной стороны, является компенсаторными механизмами, направленными на улучшение кровообращения, а с другой — еще более ухудшает микроциркуляцию в миокарде, поскольку обусловливает регрессию капиллярного кровотока. У трех умерших выявлено сочетание патоморфологических изменений сосудов, характерных для ГПА, с атеросклеротическим поражением интимы коронарных артерий и аорты. В двух наблюдениях указанные проявления наблюдали у мужчины и женщины, возраст которых (74 и 63 года) позволяет предположить наличие атеросклероза, ни этиологически, ни патогенетически не связанного с васкулитом. В другом случае артериосклероз коронарных артерий выявлен у больной ГПА в возрасте 35 лет (профессиональная принадлежность — машинист). Молодой возраст, женский пол, а также длительное течение заболевания (17 мес) свидетельствуют в пользу артериосклероза, пусковым механизмом которого мог стать васкулит коронарных артерий.
Генерализованный деструктивно-пролиферативный ангиит микроциркуляторного русла сердца вызывал патологические изменения в миокарде. Нарушение кровоснабжения сердечной мышцы в связи с обтурацией просвета сосудов тромбом или его сужение за счет склеротических и гиперпластических процессов приводило в свою очередь к некрозу кардиомиоцитов, очаговому и диффузному миокардиосклерозу. В интерстициальном пространстве миокарда выявлено гранулематозное воспаление, которое несколько отличалось от такового в легких и почках. Клеточный состав гранулем представлен лимфоцитами, гистиоцитами, плазматическими и эпителиоидными клетками, сегментоядерными лейкоцитами. Гигантские многоядерные клетки встречались редко. В соединительной ткани миокарда наблюдали резко выраженный мукоидный отек, очаговую деструкцию соединительной ткани. Сердце умерших в большей части наблюдений напоминало «дряблый мешок» с резко дилатированными камерами. В части случаев при патологоанатомическом исследовании выявляли на секции экссудативный или фибринозный перикардит, а также множественные точечные геморрагии в эпикарде. Следствием описанных изменений было развитие сердечной недостаточности, которая при ГПА имеет сложный генез и возникает как за счет патологии легких, так и непосредственного поражения сердца.
Патоморфологические изменения в сосудах печени. Патогистологические исследования сосудов печени позволили выявить характерные для ГПА изменения у всех умерших. Наблюдалось поражение междольковых артерий, вен и внутридольковых синусоидальных сосудов. Стенки их отечные, разрыхленные с явлениями плазморрагий и фибриноидного некроза. В ряде препаратов выявлены тромбы. Экссудативно-деструктивные изменения сопровождались пролиферативной реакцией. Интраваскулярно и вне сосудов по ходу портальных трактов определяли гранулемы с зонами некроза. Их клеточный состав представлен лимфоцитами, гистиоцитами, плазмоцитами, нейтрофильными и эозинофильными лейкоцитами. Особенностью гранулематозного воспаления в печени было отсутствие типичных для ГПА гигантских многоядерных клеток. Кроме острых нарушений, в случаях длительного течения заболевания выявляли хронические сосудистые изменения. Пролиферация эндотелия с циркулярной гиперплазией интимы, склероз, гиалиноз в мелких артериях и артериолах приводили к значительному сужению просвета сосудов вплоть до их полной облитерации. Наблюдали значительный периваскулярный склероз. Указанные сосудистые изменения приводили к последующей патологии паренхимы печени. Наиболее тяжелое поражение наблюдалось в одном случае и проявлялось жировой дистрофией с множественными некрозами печени и печеночной недостаточностью. Гепатаргия возникла в финале длительного четырехлетнего течения ГПА у 30-летнего мужчины на фоне развернутой клинической картины с поражением легких и почек, легочно-сердечной и почечной недостаточности. Данный случай не является типичным для ГПА, что побудило к поиску дополнительных причин тяжелого поражения печени. Из катамнеза стало известно, что в течение четырех лет болезни умерший принимал большое количество медикаментов, среди которых антибиотики (стрептомицин, левомицетин, эритромицин, мономицин), глюкокортикоиды (преднизолон) и нестероидные противовоспалительные препараты (аспирин). Каждый из них в отдельности или в сочетании (полипрагмазия) мог вызвать токсическое поражение печени с возникновением некроза паренхимы органа.
Патоморфологические изменения в сосудах пищеварительной системы. Наиболее распространенным вариантом патологических изменений был деструктивно-продуктивный ангиит сосудов полости рта с формированием типичных гранулем, их последующим некрозом, образованием язв в области языка, мягкого и твердого неба, небных дужек, миндалин, слизистой оболочки щек. У части пациентов как следствие этих изменений развивалась деструкция костной ткани и перфорация твердого неба. Васкулит сосудов желудочно-кишечного тракта стал причиной летального исхода больной ГПА 63 лет. Вследствие поражения микроциркуляторного русла двенадцатиперстной кишки возникли четыре язвенных дефекта. Они проникли через всю толщу стенки до серозной оболочки, вызвали аррозию сосудов и смертельное кровотечение. Кроме процесса в двенадцатиперстной кишке, некротические изменения слизистой оболочки были на протяжении всего тонкого кишечника. При гистологическом исследовании выявлен генерализованный деструктивно-продуктивный ангиит, тромбоваскулит с поражением сосудов верхних дыхательных путей, легких и тонкого кишечника. У других умерших наблюдались кровоизлияния в слизистую оболочку пищевода, желудка, кишечника.
Заключение
Наиболее характерным местом локализации патологических изменений при ГПА является микроциркуляторное русло верхних дыхательных путей, легких и почек. Сочетанное поражение легких и почек с развитием легочно-сердечной и почечной недостаточности — наиболее частая причина смерти при ГПА. Следует обратить внимание на частое вовлечение в патологический процесс сосудов сердца, печени и желудочно-кишечного тракта. Сосудистые изменения этих органов при ГПА менее известны, но представляют большой интерес как для клиницистов, так и для патологоанатомов, так как обусловливают особенности клинической картины заболевания и приводят к развитию ряда смертельных осложнений.
К вопросу о морфологии и физиологии органных сосудов в судебно-медицинском аспекте
К вопросу о морфологии и физиологии органных сосудов в судебно-медицинском аспекте. Митяева Н.А., Науменко В.Г. Суд.-мед. эксперт., 1976, № 2, с. 40.
Описано строение артерий запирательного типа, сосудистых анастомозов, клапанов и капиллярной сети; показано их функциональное значение в органном кровообращении.
библиографическое описание:
К вопросу о морфологии и физиологии органных сосудов в судебно-медицинском аспекте / Митяева Н.А., Науменко В.Г. // Судебно-медицинская экспертиза. — М., 1976. — №2. — С. 40-44.
код для вставки на форум:
Особенности морфологии и физиологии органно-тканевого кровообращения во многом связаны с наличием так называемых приспособительных сосудистых образований.
В настоящей работе мы приводим сведения о замыкающих артериях, сосудистых анастомозах, клапанах и капиллярах, состояние которых необходимо учитывать при диагностике травмы, асфиксии, кровопотери и других экстремальных состояний.
Замыкающие сосуды обнаружены в артериальном русле всех органов и тканей. Замыкающими артериями их назвал А.В. Рывкинд (1948), запирательными — Науек (1953), а запирательными или толстостенными — Verloop (1948). На серии срезов можно видеть, что обычная артериальная ветвь внезапно теряет характерные черты строения стенки, просвет сосуда оказывается как бы заключенным в муфту из мощного слоя клеток. Мышечные клетки крупные, с прозрачной протоплазмой и округлым ядром, содержащим небольшое количество хроматина. Они часто приобретают полигональную форму, что вместе с прозрачностью цитоплазмы придает им сходство с эпителиальными клетками, поэтому их называют эпителиоидно-модифицированными клетками (Schumacher, 1938). Между мышечными клетками обнаруживается обилие тонких эластических волокон (в более крупных сосудах имеется еще наружная эластическая мембрана). Круговые мышечные волокна на этом участке чаще отсутствуют или слабо выражены; адвентиций отчетливый.
Наряду с типичными формами замыкающих артерий существуют их варианты. Например, в легких (А. В. Рывкинд, 1948; Verloop, 1948) и матке (Merkel, 1941) можно обнаружить сосуды, имеющие два слоя продольных мышечных волокон (внутренний и наружный), разделенных циркулярно расположенными мышечными клетками.
Участие артерий замыкающего типа в кровообращении весьма характерно для механической травмы, при этом оно имеет свои закономерности, помогающие определить время, прошедшее от момента травмы до наступления смерти. Артерии замыкающего типа входят в состав сосудистых анастомозов, в том числе артерио-венозных (А—В). Под термином А—В-анастомоз понимается соединение между артериальными и венозными сосудами [1] . В этом случае замыкающие артерии в определенном месте открываются в вены. По существу они являются артериальным сегментом анастомоза. Анастомозы могут быть простыми — короткими, с небольшим количеством эпителиоидно-модифицированных клеток, и сложными в виде клубочков с большим количеством такого же типа клеток, так называемые гломусы (Sherman).
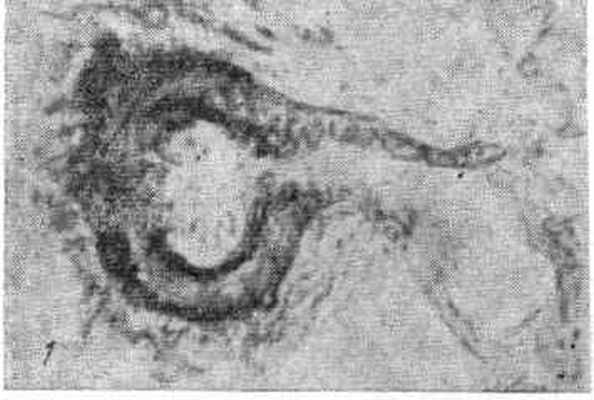
Рис. 1. Артерио-венозный анастомоз в легком.
Окраска фукселин-резорцином. Ув. ×400.
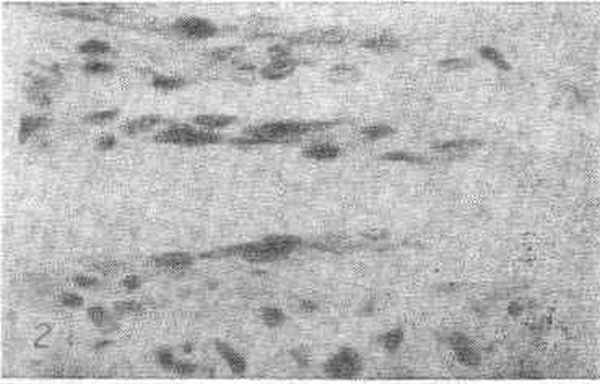
Рис. 2. Клапан по ходу вены в плевре.
Окраска гематоксилин-эозином. Ув. ×200.
Венозый сегмент А—В-анастомоза заметно отличается от обычных венозных сосудов соответствующего калибра. Это тонкостенный сосуд типа синусоида. Вблизи соустья он имеет элементы эпителиоидного типа, затем утрачивает их и стенка становится тонкой. Далее сосуд превращается в мелкую вену с обычной стенкой (рис. 1). Само соустье может располагаться в стенке замыкающей артерии или быть ее продолжением, его просвет по сравнению с просветом артериального и венозного отрезков почти щелевидный.
Экспериментальные и секционные данные показали, что А—В-анастомозы имеются не во всех органах и тканях. Так, в легких они располагаются только в стенках бронхов, перибронхиальной клетчатке и плевре (Merkel, 1941), а в веществе головного мозга и скелетной мускулатуре их нет (В. И. Козлов, 1972).
Во всех органах и тканях существуют анастомозы между мелкими артериями (А—А), между артериолами (Ал—Ал), между артериолами и венулами (Ал—Вл), между венулами (Вл—Вл) и между венами (В—В).
В венозных анастомозах в отличие от артериальных не выявлены структурные приспособления для активной регуляции кровотока.
Участие сосудистых анастомозов в ответной реакции на экстремальные воздействия наблюдается при странгуляционной асфиксии, что важно для ее диагностики.
К специализированным сосудистым образованиям венозного русла относятся клапаны. Они находятся на месте перехода крупных венул в мелкие вены (Ueoka, 1937), в венах толщиной 0,1—0,5 мк, где сосуд оказывается ампулообразно расширенным (устьевые клапаны). Клапаны имеются и по ходу более крупных вен. Их основу составляет волокнистая соединительная ткань — тонкая складка внутренней оболочки вены, покрытая эндотелием (рис. 2). Со стороны просвета сосуда эндотелий располагается продольно оси сосуда, а со стороны стенки — поперечно. В клапане имеются эластические волокна на стороне, обращенной к просвету, коллагеновые — на противоположной стороне, а у основания клапана находят мышечные волокна.
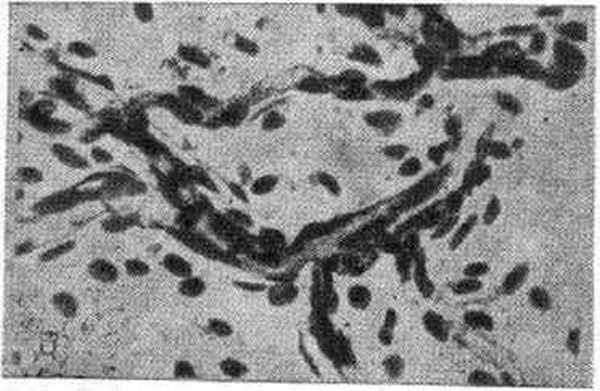
Рис. 3. Мелкоячеистая сеть капилляров в околопочечной соединительной ткани.
Импрегнация серебром по Компасу. Ув. Х600.
Рис. 4. Петлевидная сеть капилляров в коже спины.
Окраска по Шпнльмейеру. Ув. Х150.
Капиллярная сеть в различных органах и тканях разнообразна по плотности, рисунку ветвления (рис. 3 и 4) и диаметру сосудистых просветов (В.Г. Елисеев, 1963; Zweifach, 1954), что зависит от морфофункциональных особенностей тканей органов. В условиях физиологического покоя до 50% капилляров не функционируют, просвет их сужен, но не закрыт, он проходим только для плазмы (плазматические капилляры). Их считают переходной формой между функционирующими и нефункционирующими капиллярами (Г.И. Мчедлишвили, 1958). В органах и тканях имеются капилляры двух видов — очень тонкие, обеспечивающие питание органа, и магистральные, которые образуют анастомозы между артериолами и венулами и поддерживают механизм кровотока.
Регуляция кровотока в капиллярах определяется состоянием проксимального отрезка сосудистого русла и активной функцией самих капилляров. Krogh (1922) связывал механизм капиллярного кровотока с сократительной способностью перицитов. Это мнение разделяет Г.И. Мчедлишвили (1958). Перициты — клетки соединительнотканного происхождения, имеющие тончайшие отростки, которые они могут втягивать, при этом протоплазматическое тело утолщается. Существует мнение, что в пре- и посткапиллярах наблюдается постепенный переход от перицитов к мышечным клеткам. Установлена также способность эндотелиальных клеток набухать, за счет чего просвет капилляров может почти полностью закрываться (Д.А. Жданов, 1964; В.В. Куприянов, 1969; В.Н. Левин, 1970). Полагают, что набухание эндотелиальных клеток и «сокращение» перицитов происходит под влиянием гистамина и других медиаторов, которые появляются в тканях при нарушении кислотно-щелочного равновесия вследствие изменения функции. Кроме того, вокруг капилляров в строме обнаружены так называемые аргирофильные нити и кольца, которые, как предполагают, также способны суживать просвет (М. М. Александровская, 1955; Г. Г. Аминова, 1972).
Филогенетически сначала возникло общее кровообращение, затем — местное, в том числе капиллярное, которое появляется только с развитием тканей. Без капиллярного кровообращения нет и разделения на венозную и артериальную кровь. В онтогенезе сосудистая система также претерпевает ряд превращений, «отражая функциональные основы жизнедеятельности на различных этапах развития индивидуума» (И.В. Давыдовский, 1961). У новорожденных во многих органах и тканях имеется рассыпной тип сосудистого питания, когда широкие тонкостенные сосуды диффузно пронизывают паренхиму органа. Затем постепенно сосудистые стенки и ветви становятся более оформленными и сосуды располагаются менее густо. В дальнейшем сосудов становится еще меньше, появляется крупноствольный тип васкуляризации. В то же время у плодов количество артериальных ветвей, снабжающих кровью, в частности, трахею и бронхи, превосходит число аналогичных ветвей у детей; у них наблюдаются добавочные аркадообразные коллатерали, особенно вокруг желез подслизистого слоя (В.В. Куприянов, 1969).
В отношении А—В-анастомозов и артерий запирательного типа существует мнение, что у новорожденных они отсутствуют, но появляются вскоре после рождения (В.В. Рывкинд, 1948; И.В. Давыдовский, 1961). По нашим данным, А—В-анастомозы в легких формируются внутриутробно, а в функцию включаются с началом внеутробного дыхания не только у доношенных, но и у недоношенных. Они обеспечивают кровоток из сосудов большого круга в малый.
Клапаны начинают формироваться внутриутробно (В. Н. Пономаренко, 1965, и др.), и у новорожденных, и у детей первых месяцев жизни можно обнаружить уже полностью сформированные створки (см. рис. 2). Другие описанные ранее специализированные устройства в одних органах оказываются сформированными уже у плода и обнаруживаются при рождении, например артериальные «подушечки», «почки», замыкающие артерии в легких, «мышечные валики» в пупочных сосудах; в других органах появляются после рождения в ходе дифференцировки типа васкуляризации.
Специализированные сосудистые структуры — сосудистые анастомозы и клапаны — представляют собой функциональные приспособления системы местного, регионарного кровообращения. Анастомозирующие участки сосудистой сети — непостоянные пути кровотока. Они включаются временно в связи с функциональными потребностями ткани, выполняя роль шлюзов. Включаясь в кровоток при раскрытии сосудистого просвета запирательных артерий, они в одних случаях (А — В) обеспечивают внекапиллярный кровоток, который происходит в 3—5 раз быстрее капиллярного (В.В. Куприянов, 1969; В.И. Козлов, 1972), в других (А—А) — включение в кровообращение обособленных сегментов сосудистого русла, не функционировавших до этого. А—А- и Ал—Ал-анастомозы приводят к слиянию двух потоков крови, снижая давление в дистальных отделах сосудистого русла [3] .
При закрытии просвета анастомозов (А—В, А—А) возникает обратное состояние. Анастомозы между венулами и мелкими венами, не имея запирательных устройств, не обеспечивают активной регуляции кровотока, они лишь дублируют путь оттока крови (В.И. Козлов, 1972).
Экспериментальные данные показывают, что артериальные анастомозы на уровне микроциркуляторной системы обнаруживаются не во всех органах и тканях, в частности их нет в скелетной мускулатуре. По-видимому, эти специализированные устройства имеются в тех органах и тканях, где сегментарная обособленность микроциркуляции обеспечивает непрерывную работу органа. У человека она, например, сегментарна в легких, париетальной плевре, брюшине. Каждый сегмент подобен другому и имеет артериолы, прекапилляры, капилляры, посткапилляры, венулы и Ал—Вл и другие соустья, т. е. все сосудистые компоненты местного кровотока (В. И. Козлов, 1972). Сегменты сосудистого русла, с одной стороны, представляют собой относительно изолированные фрагменты гемодинамической системы, и кровообращение в них определяется местными (органными) условиями метаболизма, а с другой – оно подчинено состоянию гемодинамики в целом. Приспособительные устройства типа замыкающих сосудов, раскрывая просвет, обеспечивают включение в кровообращение, а закрываясь — выключение из него целого участка — сегмента сосудистого русла. [2]
Замыкающие сосуды, как и другие приспособительные устройства, в некоторых органах имеются вне связи с сосудистыми анастомозами, при этом они служат для выполнения особых функций. Так, в пупочном канатике при его перерезке происходит сокращение кольцевой и продольной мускулатуры и полное закрытие просвета артерий, что препятствует потере крови; то же наблюдается в артериях матки после отделения плаценты. Таким образом, запирательные артерии в пупочном канатике и матке являются жизненно важными, охранительными приспособлениями. Влияние на организм в целом имеют запирательные устройства в венах надпочечников, где они регулируют отток адреналина.
Клапаны на уровне венулы — вены препятствуют обратному току крови; считают, что в момент кровотока на них действует присасывающая сила струи и их свободные концы стремятся к центру сосуда.
Приспособительные сосудистые механизмы используются организмом не всегда и не только целесообразно. Их реакция может быть на определенном этапе полезна, а затем становится фактором дальнейшего нарушения кровообращения. Так, за счет запирательных устройств при общем нарушении кровообращения может возникать венозный застой. Венозный застой постоянно сопутствует различным видам острой смерти, и при его оценке как проявления особенностей танатогенеза целесообразно учитывать состояние клапанного аппарата.
Формой адаптации сосудистой системы к потребностям тканей являются также различные состояния капилляров — их сокращение или расширение; помимо того, при повышенной функции в кровоток включаются почти все сосуды, а при пониженной в кровообращении участвует лишь минимальное их количество, необходимое для поддержания общего кровотока. При выключении из кровообращения части капилляров циркуляция осуществляется преимущественно по анастомозам.
Материалы о морфофункциональных особенностях на уровне органно-тканевого кровообращения будут изложены в следующей статье.
[1] Danesino (1948), Balestrazzi (1950), Sherman (1963) и другие авторы относят артерио-венозные анастомозы к прекапиллярным коммуникациям любого диаметра. А. В. Рывкинд, Verloop, Hayek, изучая легкие, находили их в сосудах диаметром не более 400 мк. Наш опыт исследования показывает правоту тех и других авторов; различия в их данных можно объяснить объектами (органами) исследования.
[2] С.И. Елизаровский и соавт. (1972), основываясь на результатах эксперимента, считают, что артериолярные соустья в условиях стрессовой ситуации суживают свой просвет не более чем на 10—20% исходного диаметра. По их мнению, эти сосуды выполняют роль связующего звена между артериальной и венозной системой, а не активного регулятора кровотока.
похожие статьи
Оценка возможности образования повреждений при проведении реанимационных мероприятий / Бадяев В.В., Шульга И.П. // Избранные вопросы судебно-медицинской экспертизы. — Хабаровск, 2021. — №20. — С. 15-17.
Замыкающие сосуды. Сосудистые анастомозы
Замыкающие сосуды. Сосудистые анастомозы
Они имеются во всех органах и тканях. Па серии срезов можно видеть, что артериальная ветвь внезапно теряет характерные черты строения стенки, просвет сосуда оказывается как бы заключенным в муфту из более или менее мощного слоя клеток. Мышечные клетки крупные, с прозрачной цитоплазмой и округлым ядром, содержащим небольшое количество хроматина. Они часто приобретают полигональную форму, что вместе с прозрачностью цитоплазмы придает им сходством эпителиальными клетками (эпителиоидные). Между мышечными клетками обнаруживают обилие тонких эластических волокон (в более крупных сосудах имеется еще наружная эластическая мембрана) Круговые мышечные волокна на этом участке чаще отсутствуют или слабо выражены, адвентнций отчетливый.
Наряду с типичными формами замыкающих артерии существуют их варианты. Например, в легких и матке можно обнаружить сосуды, имеющие два слоя продольных мышечных волокон (внутренний и наружный), разделенных циркулярно расположенными мышечными клетками Артерии замыкающего типа входят в состав артериовепозных анастомозов.
Различают анастомозы артериовенозные (А—В), между мелкими артериями (А—А), между артериолами (Ал—Ал), между артериолами и венулами (Ал—Вл), между вепулами (Вл—Вл) и между венами (В—В).
Артериальным сегментом А—В-анастомоза является замыкающая артерия, венозный сегмент заметно отличается от обычных венозных сосудов соитвстсгвующего калибра. Это тонкостенный сосуд типа синусоида, вблизи соустья он имеет элементы эпителиоидного типа, затем утрачивает их и стенка становится тонкой. Далее сосуд превращается в мелкую вену с обычной стенкой. Само соустье может располагаться в стенке замыкающей артерии или быть ее продолжением, его просвет по сравнению с просветом артериального и венозного отрезков почти щелевидный.
Экспериментальные данные и данные вскрытия показывают, что А—В-анастомозы имеются не во всех органах и тканях. Так, в легких они располагаются только в стенках бронхов, перибронхиальной клетчатке и плевре. В веществе головного мозга и скелетной мускулатуре их пег.
В венозных анастомозах в отличие от артериальных не выявлены приспособления для активной регуляции кровотока.
Клапаны находят на месте перехода крупных венул в мелкие вены толщиной 0,1—0,5 мкм. Здесь сосуд нередко оказывается ампулообразно расширенным (устьевые клапаны). Клапаны имеются и по ходу более крупных вен. Их основу составляет волокнистая соединительная ткань—тонкая складка внутренней оболочки вены, покрытая эндотелием. Со стороны просвета сосуда эндотелий располагается продольно оси сосуда, а со стороны стенки — поперечно. В клапане имеются пластические волокна на стороне, обращенной к просвету, коллагеновые — на противоположной стороне, а у основания клапана находятся мышечные волокна.
Во всех органах и тканях имеются капилляры двух видов — очень тонкие, обеспечивающие питание органа, и магистральные, которые образуют анастомозы между артериолами и венулами и поддерживают уровень кровотока. Капилляры разнообразны по плотности, рисунку ветвления, диаметру просветов, что зависит от морфофункциональных особенностей ткани и органа. В норме около 50% капилляров не функционирует, просвет их сужен, но не закрыт, он проходим только для плазмы (плазматические капилляры).
Регуляция кровотока в капиллярах определяется состоянием проксимального отрезка сосудистого русла и активной функцией самих капилляров. Механизм капиллярного кровотока связывают с сократительной способностью перицитов — клеток соединительнотканного происхождения, имеющих тончайшие отростки, которые могут втягиваться при утолщения протоплазматического тела.
Существует мнение, что в пре- и посткапиллярах наблюдается постепенный переход от перицитов к мышечным клеткам. Установлена также способность эндотелиальных клеток набухать, за счет чею просвет капилляров может почти полностью закрываться. Полагают, что набухание эндотелиальных клеток и сокращение перицитов происходит под влиянием гистамина и других медиаторов, которые появляются в тканях при нарушении кислотно-щелочного состояния, вследствие изменения функции. Кроме того, вокруг капилляров в строме обнаружены так называемые аргирофильные нити и кольца, которые, как предполагают, также способны суживать просвет.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Артериоло-венулярные анастомозы
АВА или шунты – вид сосудов микроциркуляторного русла, по которым кровь попадает из артериол в венулы, минуя капилляры. Все АВА делят на истинные (типичные) и атипичные (полушунты). Типичные анастомозы подразделяют на простые и сложные. В простых анастомозах отсутствуют сократительные элементы, и кровоток в них регулируется за счет сфинктера, расположенного в артериолах в месте отхождения анастомоза. В сложных анастомозах в стенке присутствуют сократительные элементы. Сложные анастомозы подразделяются на анастомозы гломусного типа и анастомозы типа замыкающих артерий. В последних во внутренней оболочке расположены продольно гладкие миоциты, при сокращении которых в просвет анастомоза выбухает подушечка и закрывает его. В анастомозах типа гломуса (клубочка в стенке присутствуют эпителиоидные Е-клетки, способные насасывать воду, увеличиваться в размерах и и закрывать просвет анастомоза. В полушунтах в стенке отсутствуют сократительные элементы, ширина их просвета не регулируется, в них может заьрасываться венозная кровь из венул, поэтому в полушунтах, в отличие от шунтов течет смешанная кровь.
Гистофизиология сердца
Сердце – мышечный орган, который вследствие ритмических сокращений обеспечивает циркуляцию крови в сосудистой системе. Оно вырабатывает также гормон – предсердный натрийуретический фактор, препятствующий обратной реабсорбции натрия и воды из первичной мочи, что ведет к уменьшению объема циркулирующей жидкости и падению АД. В состав стенки сердца входят три оболочки: 1) внутренняя – эндокард, 2) средняя – миокард, 3) наружная – эпикард.
Развитие сердца
Сердце развивается из двух источников: миокард и эпикард образуются из миоэпикардиальных пластинок – части висцерального листка спланхнотома, а эндокард образуется из мезенхимы, формирующей под миоэпикардиальными пластинками две мезенхимные трубки. Две части – мезодермальная и мезенхимная – соединяются вместе, образуя сердце, состоящее из трех оболочек.
Строение сердца
В состав эндокарда входит четыре слоя:
эндотелий, расположенный на базальной мембране;
субэндотелиальный слой – РВСТ;
мышечно-эластический слой, содержащий гладкомышечные клетки и эластические волокна;
наружный соединительнотканный слой – РВСТ.
Эндокард образует дубликаторы – клапаны сердца, представленные плотной соединительной тканью, покрытой эндотелием. Кровеносные сосуды в эндокарде находятся только в наружном соединительнотканном слое, поэтому его питание осуществляется в основном путем диффузии веществ из крови, находящейся в полостях сердца.
Миокард – самая мощная оболочка сердца, представленная поперечно-полосатой мышечной тканью, структурно-функциональной единицей которой являются кардиомиоциты – рабочие (сократительные), проводящие и секреторные (вырабатывают натрийуретический фактор).
Эпикард – представлен мезотелием, под которым располагается РВСТ. Эпикард – висцеральный листок сердечной сумки (перикарда).
Проводящая система сердца
Эту систему формируют проводящие или атипичные кардиомиоциты трех видов: 1) Р-клетки (пейсмекерные); 2) промежуточные клетки (переходные) и клетки – волокна Пуркинье
Переходные клетки локализуются в атрио-вентрикулярном узле проводящей системы сердца. По размерам занимают промежуточное положение между Р-клетками и волокнами Пуркинье. Переходные клетки имеют вытянутую форму. Миофибриллы более развиты, чем в Р-клетках, ориентированы параллельно друг другу вдоль длиной оси клетки, но не всегда. Функциональное значение значение переходных клеток состоит в передаче возбуждения от Р-клеток к клеткам пучка Гисса и рабочим сократительным кардиомиоцитам.
Волокна Пуркинье – самые крупные клетки проводящей системы сердца (диаметром 15 мкм и более) В центральной части располагается круглое или овальное ядро. В околоядерной саркоплазме находятся многочисленные гранулы гликогена. Немногочисленные миофибриллы расположены хаотично. Функция клеток – волокон Пуркинье заключается в передаче возбуждения с переходных клеток к рабочим кардиомиоцитам желудочков.
Артериовенозные анастомозы
Между артериальным и венозным отделами сосудистой системы существуют анастомозы различных типов (рис. 1.11), которые функционируют как на уровне микрососудов, так и в проксимально расположенных участках сосудистого русла. Артериовенозные анастомозы обеспечивают перераспределение потоков крови, минуя капиллярную сеть, между сосудами, которые относятся преимущественно к терминальному кровеносному руслу и существенно отличаются по перфузионному давлению. В физиологических условиях они участвуют в регуляции кровенаполнения соответствующих органов при изменениях функциональной нагрузки, при патологии, например при ангиоспазме травматического или воспалительного характера, воздействии термических, химических или механических факторов, при онкологической патологии или АГ.
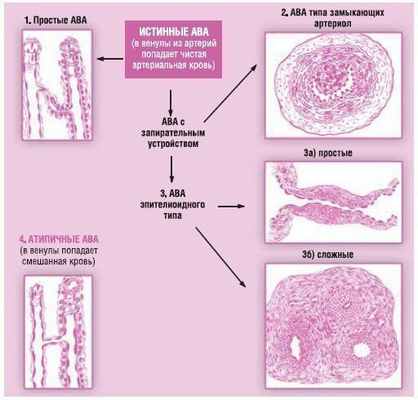
Рис. 1.11. Артериоловенулярные анастомозы (АВА): 1) простые АВА: в стенке анастомоза строение артериолы непосредственно сменяется строением венулы; 2) АВА типа замыкающих артериол: в субэндотелиальном слое — валики, образованные продольно-расположенными миоцитами. При сокращении последних анастомоз закрывается; 3а) АВА эпителиоидного типа (простые): в средней оболочке анастомоза — овальные светлые клетки, похожие на эпителиальные; 3б) АВА эпителиоидного типа (сложные): артериола и венула связаны сразу несколькими анастомозами эпителиоидного типа, которые заключены в единую со единительнотканную капсулу; 4) атипичные АВА (полушунты): между артериолой и венулой — короткий сосуд капиллярного типа, поэтому в венулу попадает не артериальная, а смешанная кровь
В зависимости от строения, артериовенозные анастомозы подразделяют на включающие эпителиоподобные мышечные элементы и построенные по типу замыкающих артерий. В последнем случае ширина просвета контролируется продольно-ориентированными гладкомышечными клетками, образующими в субэндотелиальной зоне на границе с внутренней эластической мембраной скопления с мощным эластическим каркасом. Сокращение этих гладкомышечных клеток способно приводить к полному перекрытию сосудистого просвета. Анастомозы такого типа отмечают в коже пальцев, диафрагме, брыжейке, плевре, легких и других органах. По строению анастомозы с эпителиоподобными элементами подразделяются на простые, которые отходят от артерии почти под прямым углом и впадают в соответствующую вену, и клубочковые, распадающиеся на несколько вторичных ветвей и иногда заканчивающиеся в различных венозных сосудах.
Артериальные и венозные сегменты анастомозов неодинаковы по структуре. Эти особенности лучше прослеживаются в простых анастомозах данного типа, в артериальном сегменте которых под тонкой внутренней оболочкой, состоящей из эндотелиоцитов, тонкого субэндотелиального слоя и внутренней эластической мембраны располагаются пучки гладкомышечных клеток медии, продольные — внутренние и циркулярные — внешние. Благодаря хорошо развитому продольному мышечному слою медии, при ее сокращении на внутренней поверхности сосуда образуются складки, способные закрывать просвет. Клетки этого слоя имеют ряд особенностей: они короче обычных миоцитов, имеют просветленную цитоплазму, овоидные, а не, как обычно, палочковидные ядра. По мере приближения к вене просвет анастомоза становится шире, стенка тоньше, а гладкомышечные клетки — более округлыми; в их светлой гомогенной цитоплазме появляется мелкая базофильная зернистость. Стенки артериовенозных анастомозов обладают способностью спонтанно сокращаться, однако ритм этих сокращений может корригироваться нейрогуморальными факторами регионального и системного происхождения.
В.В. Братусь, А.С. Гавриш "Структура и функции сердечено-сосудистой системы"
Читайте также:
