Анеуплоидии и анеусомии в раковых клетках. Диагностика
Добавил пользователь Alex Обновлено: 02.02.2026
Анеуплоидией называют изменение кариотипа, когда число хромосом некратно гаплоидному набору. Это приводит к нарушению эмбрионального развития, является частой причиной самопроизвольных выкидышей, может вызывать некоторые наследственные синдромы.
Причины анеуплоидии
Изменение кариотипа вызывают нарушения сегрегации хромосом в митозе или мейозе. В случае если гомологичные хромосомы одной или нескольких пар в анафазе I мейоза не расходятся, то развивается врожденная анеуплоидия.
Если половая клетка с лишней или недостающей хромосомой сливается с нормальной гаплоидной гаметой, то образовавшаяся зигота несет клетки с нечетным количеством хромосом. Зигота, имеющая число хромосом, меньше нормального диплоидного набора, обычно не развивается. Плодное яйцо с лишними хромосомами способно к развитию, но в большинстве случаев развитие сопровождается серьезными аномалиями.
Формы нарушения
По типу вовлеченных хромосом различают анеуплоидию половых хромосом и аутосомную. Первая характеризуется более мягкими фенотипическими проявлениями.
Выделяют также такие формы, как моносомия — отсутствие в диплоидном организме одной хромосомы, нуллисомия — отсутствие двух гомологичных хромосом, трисомия — наличие дополнительной хромосомы. Нарушения в сфере половых хромосом могут иметь формы тетрасомии и пентасомии (встречаются крайне редко).

Синдромы, связанные с анеуплоидией
Моносомия по Х-хромосоме является причиной синдрома Шерешевского-Тернера. Таким нарушением страдают исключительно женщины. Они имеют нормальное интеллектуальное развитие и ведут полноценный образ жизни, однако для больных характерны бесплодие, пороки развития внутренних органов и другие внешние признаки хромосомной патологии.
Жизнеспособная форма трисомии возможна только по хромосоме 21, однако она приводит к развитию синдрома Дауна. Трисомия по хромосоме 13 является причиной синдрома Патау, по хромосоме 18 — синдрома Эдвардса. Они характеризуются ранней постнатальной смертностью.
Трисомии половых хромосом встречаются чаще. Одной из форм подобного типа анеуплоидии является синдром Клайнфельтера. Для него характерно наличие мужской Y-хромосомы при одной или двух лишних Х-хромосомах. Страдающие синдромом Клайнфельтера вследствие анеуплоидии — мужчины, имеющие некоторые женские вторичные половые признаки. Обычно они бесплодны и имеют низкий уровень интеллектуального развития.
Синдром трипло-X является такой формой анеуплоидии, при которой у женщины присутствует лишняя Х-хромосома. В основном больные имеют нормальное физическое и психическое развитие, хромосомные аномалии у них выявляются, как правило, случайно. При синдроме трипло-X анеуплоидия не приводит к аномалиям полового развития, однако повышен риск спонтанных выкидышей и хромосомных патологий у потомства. Лишь у некоторых женщин присутствуют нарушения репродуктивной функции.
Лишняя Y-хромосома у мужчин является синдромом, при котором анеуплоидия развивается вследствие слияния нормальной яйцеклетки со сперматозоидом, являющимся носителем второй Y-хромосомы. Патология выявляется случайно, обычно носители не знают о ее наличии. Для таких мужчин характерен более высокий рост, небольшие нарушения координации движений, у половины из них имеются трудности с обучением, нарушения речи и письма.
Диагностика анеуплоидий
Риск рождения ребенка с хромосомной аномалией даже у полностью здоровых родителей составляет 5 %. Поэтому так важно выявить возможные аномалии, в т. ч. анеуплоидии, вызывающие наследственные синдромы, на раннем сроке беременности.
Заранее оценить риски помогают скрининговые тесты и УЗИ. Они не дают точной информации о наличии хромосомной патологии, но позволяют выявить беременных группы риска. Наиболее точный диагноз помогает установить неинвазивный пренатальный тест (НИПТ).
В медико-генетическом центре «Геномед» вы можете пройти такое исследование. НИПТ позволяет диагностировать анеуплоидии, в т. ч. трисомии, моносомии, численные аномалии половых хромосом. Точность исследования достигает 99 %. Благодаря тесту можно исключить наличие у будущего ребенка таких заболеваний, как синдромы Дауна, Эдвардса, Патау, Тернера и т. д.
Для того чтобы провести НИПТ и обнаружить/исключить анеуплоидии, достаточно 15 мл венозной крови будущей матери. Это позволяет избежать инвазивных методов пренатальной диагностики, которые грозят осложнениями.
НИПТ в медико-генетическом центре «Геномед» с высокой достоверностью определяет анеуплоидии, поскольку основан на особом алгоритме обработки сигналов. Он позволяет сравнивать и обнаруживать отличия материнской ДНК, присутствующие в плазме/лейкомассе, с ДНК плода, находящейся только в плазме.
Как анеуплоидия раковых клеток снижает эффективность химиотерапии и что с этим делать?
Новость
Раковые клетки легких
Anne Weston, EM STP, The Francis Crick Institute/Science Photo Library
Авторы
Редакторы
Статья на конкурс «Био/Мол/Текст»: Лечение рака — сложный многоступенчатый процесс, на успешность которого влияет множество факторов. Их изучение необходимо для того, чтобы определить наиболее действенные методы борьбы с онкологическими заболеваниями. При этом механизмы устойчивости иногда срабатывают довольно парадоксальным, на первый взгляд, образом. Так, анеуплоидия характерна для большинства раковых клеток и снижает эффективность химиотерапии. При этом анеуплоидные клетки проходят клеточный цикл куда медленнее, чем эуплоидные, а значит, опухоль растет не так активно. Новое исследование объясняет механизмы этой резистентности и на их основе предлагает способы повысить эффективность терапии.

Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2020/2021.
Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
В этой статье мы расскажем об исследовании [1], которое подтвердило, что устойчивость (резистентность) раковых клеток к воздействию распространенных препаратов химиотерапии напрямую связана с анеуплоидией — ситуацией, при которой число хромосом отклоняется от нормального: их больше или меньше, чем в диплоидном наборе. Состояние, при котором одна хромосома отсутствует, называется моносомией, если есть одна лишняя хромосома — трисомией (рис. 1), если две — тетрасомией и т.д.
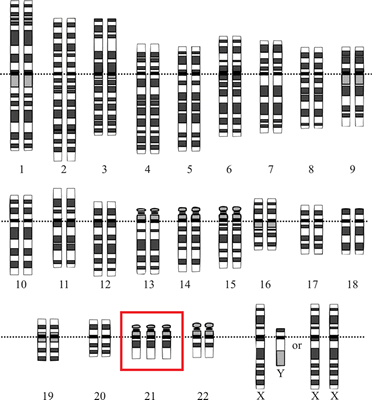
Рисунок 1. Хромосомный набор человека с синдромом Дауна — одного из самых известных проявлений анеуплоидии с трисомией по 21 хромосоме
National Human Genome Research Institute, Human Genome Project
Из-за нарушений процесса деления раковых клеток хромосомы между дочерними клетками часто распределяются аномально. Поэтому анеуплоидия характерна для 90% злокачественных образований и служит маркером рака (рис. 2) [2]. Несмотря на то, что подобные нарушения замедляют рост опухоли, обнаружение анеуплоидии ухудшает прогноз для больного с онкологией. Так, исследование итальянских ученых, проведенное в конце 80-х годов XX века, показало, что в три раза больше пациентов выживает, если клетки опухоли имеют нормальный набор хромосом [3]. Но почему? Как состояние, которое мешает благополучному развитию клетки, оказывается в итоге преимуществом для опухоли?
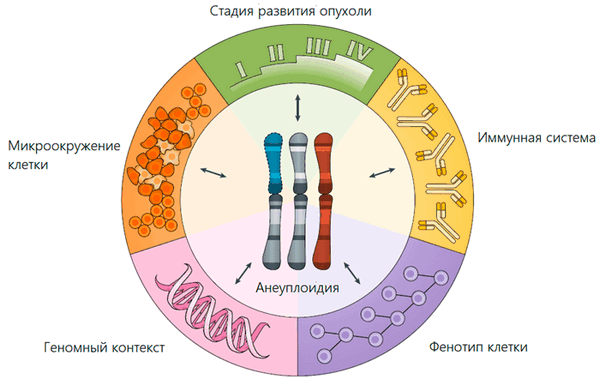
Рисунок 2. Основные факторы, определяющие адаптивную ценность анеуплоидии (то же справедливо и в обратную сторону)
Чтобы это выяснить, международный коллектив исследователей из Университета Тель-Авива, Массачусетского технологического института, Гарвардского университета и ряда других исследовательских центров США изучал, как ведут себя раковые клетки с разным набором хромосом при воздействии на них двух наиболее распространенных препаратов для химиотерапии: паклитаксела и цисплатина. Эти лекарства останавливают развитие опухоли, но имеют разные механизмы действия.
Паклитаксел (как и другие препараты из группы таксанов) влияет на сборку микротрубочек — структур внутреннего скелета клетки (см. рис. 7). Микротрубочки выполняют разные функции, в том числе формируют центриоли и веретено деления, которые разводят хромосомы к противоположным полюсам клетки во время ее деления. Паклитаксел стимулирует формирование микротрубочек, связываясь с молекулами β-тубулина — части димерного тубулина — белка, из которого построены микротрубочки. Но микротрубочки должны постоянно перестраиваться (удлиняться и укорачиваться на разных концах) за счет полимеризации тубулина или распада его полимера. А паклитаксел как раз блокирует этот распад, стабилизируя микротрубочки и предотвращая их реорганизацию. Это мешает расхождению хромосом и делает невозможным митоз — деление клетки на две генетически идентичные копии. Продолжительная задержка на этапе деления ведет к гибели клетки или возвращает ее обратно в фазу покоя. Так паклитаксел не позволяет клеткам делиться, мешая росту опухоли.
Цисплатин, в свою очередь, имеет в составе атомы платины, которые связываются с основаниями ДНК, повреждая ее. Если во время S-фазы (от англ. synthesis — «синтез») клеточного цикла, когда ДНК реплицируется — то есть на ее основе формируются две дочерних копии, — обнаружатся ее повреждения, то репликация остановится. А так как без удвоения молекулы ДНК клетка делиться не может, то в результате цисплатин предотвращает деление клеток и рост опухоли (см. рис. 7).
Итак, оба препарата нарушают клеточный цикл, но на разных его этапах. Однако при анеуплоидии механизм действия цитостатиков (таких как цисплатин и паклитаксел), предотвращающий деление клетки, не срабатывает, и опухоль благополучно растет. Почему так происходит? Авторы исследования полагают, что ключевую роль играют два фактора: замедленный рост и отложенное деление клеток с аномальным набором хромосом.
Клетки с анеуплоидией, как правило, делятся реже, чем эуплоидные (с нормальным хромосомным набором), за счет удлиненной интерфазы клеточного цикла [5], [6], которую клетка проходит между делениями (рис. 3). Точнее, затягиваются первые два этапа интерфазы: G1 (от англ. gap — «промежуток») и S, на которые приходятся многие процессы, связанные с ростом клетки. Эта задержка вызвана множественными характерными для анеуплоидии нарушениями в работе генов, влекущими за собой неправильную укладку белков, последующие нарушения их обмена и вытекающие из этого сбои в функционировании клетки — протеотоксический стресс, и нестабильность генома из-за изменений в клеточном обмене веществ. Казалось бы, медленное разрастание опухоли должно облегчать борьбу с онкологическим заболеванием, однако выходит наоборот — удлиненные фазы G1 и S связаны с бо́льшей устойчивостью клеток к препаратам.
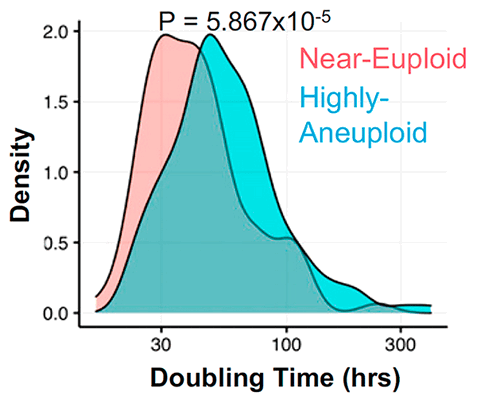
Рисунок 3. Гистограмма, иллюстрирующая, что время удвоения (doubling time) для анеуплоидных клеток выше, чем для эуплоидных. Построена на основе данных из базы Cancer Cell Line Encyclopedia (CCLE).
После воздействия на клетки цисплатином или паклитакселом ученые подсчитали количество выживших: клетки с трисомией при добавлении обоих препаратов выживали чаще, чем эуплоидные: примерно на 20-40% (рис. 4а) для цисплатина и на 10-30% для паклитаксела (рис. 4б).
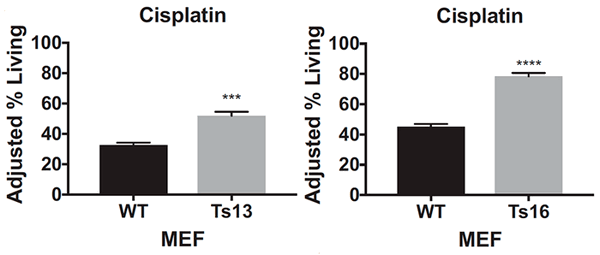
Рисунок 4а. Процент выживших клеток после воздействия цисплатином (cisplatin) на эмбриональные фибробласты мышей (MEF) с нормальным хромосомным набором (WT) и с трисомией по 13-й (Ts13) и 16-й (Ts16) хромосомам. ** — P
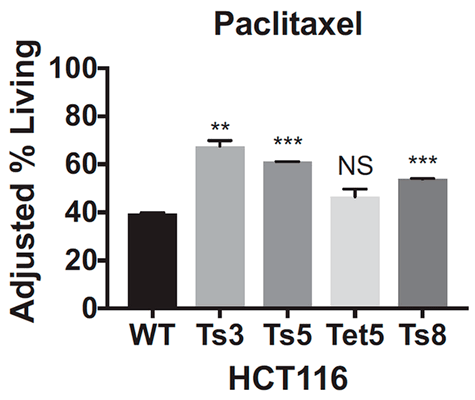
Из этих данных ученые сделали вывод, что, во-первых, оба препарата оказываются неэффективными для клеток с трисомией, а во-вторых, резистентность возникает независимо от того, по какой хромосоме анеуплоидия. Ученые также посмотрели, как ведут себя раковые клетки толстой кишки с тетрасомией по 5-й хромосоме, однако результаты, полученные на этой клеточной линии, не были статистически значимыми. К сожалению, авторы исследования никак это не прокомментировали и больше клеточные линии с анеуплоидией типов, отличных от трисомии, не проверяли, поэтому как ведут себя клетки с моносомией или тетрасомией пока неизвестно. Будем надеяться, что исследования в этой области появятся в недалеком будущем.
Уже на этом этапе изучения можно предположить, что случаи трисомии по разным хромосомам должны объединять некоторые общие нарушения, вызванные анеуплоидией, которые помогают им противостоять воздействию препарата. Такой потенциальной точкой пересечения ученые посчитали изменения в длительности клеточного цикла в виде задержки фаз G1 и S.
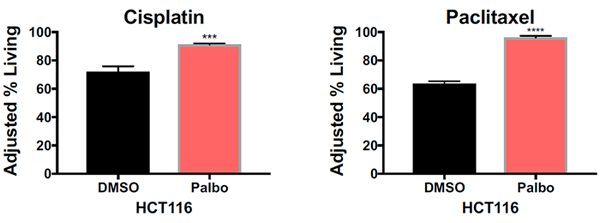
Рисунок 5. Процент выживших клеток после воздействия на псевдодиплоидные раковые клетки толстой кишки (HCT116) сначала растворителем диметилсульфоксидом (DMSO) или палбоциклибом (Palbo), а затем цисплатином (Cisplatin) или паклитакселом (Paclitaxel). *** — P
Кроме того, ученые проверили, насколько эффективно другие препараты для химиотерапии, работающие за счет вмешательства в клеточный цикл, воздействуют на различные линии раковых клеток человека в зависимости от степени их анеуплоидности (по данным Cancer Cell Line Encyclopedia). Они обнаружили, что к 29 препаратам из 34 рассмотренных анеуплоидные клетки оказывались более устойчивыми, чем эуплоидные, причем в 21 случае анеуплоидии сопутствовало замедленное деление клеток (рис. 6).
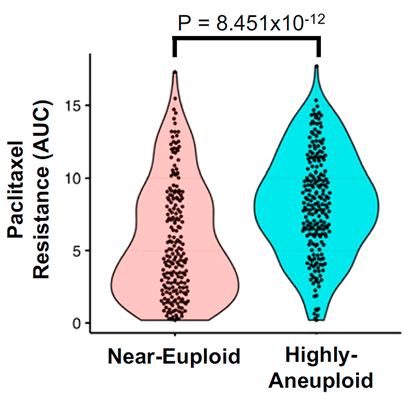
Рисунок 6. Связь между чувствительностью к паклитакселу и степенью анеуплоидности для клеточных линий. Данные взяты из базы Cancer Cell Line Encyclopedia (CCLE).
Связь между анеуплоидностью и резистентностью к цисплатину оказалась статистически незначимой, так как во всех случаях в качестве растворителя использовался диметилсульфоксид, который согласно исследованиям снижает эффективность препаратов на основе платины [9].
Таким образом, исследования подтвердили, что анеуплоидия увеличивает резистентность к очень разным по принципу действия препаратам за счет одного из своих главных последствий — замедления клеточного цикла, вызванного удлиненными фазами G1 и S. Какими механизмами это может быть вызвано?
В случае с паклитакселом все достаточно просто. Этот препарат не дает хромосомам разойтись: он предотвращает образование веретена деления, тем самым убивая клетку. Однако если она застревает в G1-фазе, то она просто не доходит до той стадии клеточного цикла, когда препарат начинает действовать, и поэтому не умирает (рис. 7). Те клетки, чей процесс деления оказывается отложенным, выживают во время терапии, а затем, после того как препарат выводится из организма, могут делиться дальше.
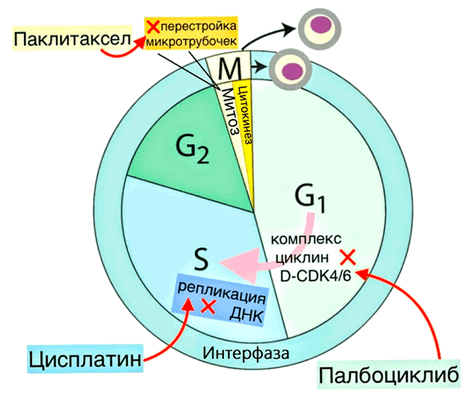
Рисунок 7. Схема клеточного цикла с указанием, в какие моменты обсуждаемые в статье препараты нарушают его работу. М-фаза включает в себя митоз и цитокинез (разделение двух дочерних клеток). Интерфаза — G1-фазу (происходит рост клетки, увеличивается количество органелл), S-фазу (репликация ДНК) и G2-фазу (рост клетки и подготовка к делению, устранение поломок в ДНК). Для перехода из G1-фазы в S-фазу в клетке должен собраться комплекс D-CDK4/6 из белков циклина D и четвертой и шестой циклинзависимых киназ (CDK4 и CDK6 от cell division protein kinase). Палбоциклиб ингибирует эти киназы, поэтому из-за его воздействия клетка уходит в фазу покоя G0, то есть не делится, — так препарат мешает росту опухоли. Цисплатин, нарушая структуру ДНК, останавливает клеточный цикл на S-фазе. Паклитаксел мешает перестройкам микротрубочек, нарушая работу веретена деления, из-за чего не происходит расхождение хромосом, и деление клетки задерживается: она либо возвращается в интерфазу, либо погибает.
С цисплатином все немного сложнее — он повреждает структуру ДНК вне зависимости от стадии клеточного цикла, однако эти повреждения оказываются критичны только во время S-фазы, когда происходит репликация ДНК. На первый взгляд, механизм резистентности может быть таким же, как в случае с паклитакселом: клетка просто не успевает дойти до нужной стадии цикла. Но авторы исследования полагают, что свою роль может играть и другой механизм. Так как цисплатин проникает в клетку за счет пассивной диффузии, то снижение потребления вещества клеткой с отложенной G1-фазой или повышение его оттока из нее приводят к уменьшению платиновых аддуктов в составе ДНК клетки, а соответственно к уменьшению повреждений. Однако для полного понимания того, как эти механизмы работают для цисплатина, необходимы дополнительные исследования.
Важно, что анеуплоидия помимо замедленного деления вызывает еще множество других последствий, которые могут повышать резистентность. Например, за счет нестабильности генома у таких клеток больше шансов приобрести мутации, которые помогут им приспособиться к неблагоприятным условиям. То, как еще анеуплоидия влияет на раковые клетки, пока что мало изучено. Несмотря на сделанный человечеством большой шаг на пути к пониманию того, как эффективно бороться с болезнью, это лишь один из множества шагов, которые нам только предстоит пройти.
Ядерный матриархат, LLPS-революция и анеуплоидия

Обзор
рисунок автора статьи
Автор
Статья на конкурс «Био/Мол/Текст»: Сегодня проблемы репродукции являются одними из самых обсуждаемых в мире. Но что мы знаем о молекулярной кухне процессов оо- и эмбриогенеза? Ученые из лаборатории морфологии клетки Института цитологии РАН попытались разобраться в закономерностях перестроек хроматина, протекающих в ядрах ооцитов и ранних эмбрионов млекопитающих, и предложили возможные эпигенетические механизмы регуляции данных процессов. Мне, в свою очередь, удалось заглянуть в закулисье и лично пообщаться с авторами статьи. Здесь я не просто хочу поделиться опытом коллег, предупреждающих о возможных трудностях в изучении данной темы. Я хочу объяснить, почему это настолько заинтересовало даже меня, молекулярного онколога, совершенно незнакомого с данной областью исследования.

Такие разные конфигурации
Ирина и Дмитрий Боголюбовы из Института цитологии РАН исследовали закономерности перестроек хроматина в ядрах ооцитов и ранних эмбрионов млекопитающих) и предложили возможные эпигенетические механизмы регуляции этих перестроек (рис. 1) [1], [2]. Но давайте обо всем поговорим по порядку, а вместе с тем послушаем мнение и самих авторов исследования.
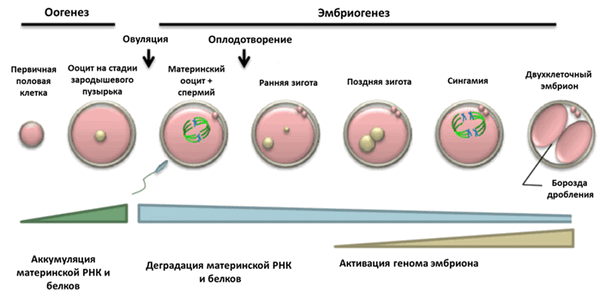
Рисунок 1. Основные стадии раннего развития.
Оогенез и эмбриогенез — это непрерывные, сменяющие друг друга процессы; происходящие в это время преобразования хроматина ооцита предопределяют дальнейшее развитие зиготы после оплодотворения. У некоторых млекопитающих, включая человека, на завершающей стадии развития ооцита перераспределение хроматина в ядре совпадает с преобразованием ядрышка в так называемые атипичные ядрышки или ядрышкоподобные тела (ЯПТ) . Образовавшиеся ЯПТ начинают созывать к себе повсеместно конденсирующийся хроматин, который постепенно окружает ЯПТ по типу «кольца», или, по-научному, хроматин переходит из NSN-состояния (non-surrounded nucleolus) в SN-состояние (surrounded nucleolus) (рис. 2). Почему атипичные ядрышки являются центрообразующей единицей для хроматина, вам не ответит даже самый опытный цитолог. Но давайте поговорим обо всем этом подробно.
ЯПТ (nucleolus-like body, NLB) — особенная ядерная структура, представляющая собой хромосомы, собранные вокруг центрального тела, состоящего преимущественно из фибриллярных белков (ламинов типа А и В). Точный состав центрального тела ЯПТ остается неизвестен [3].
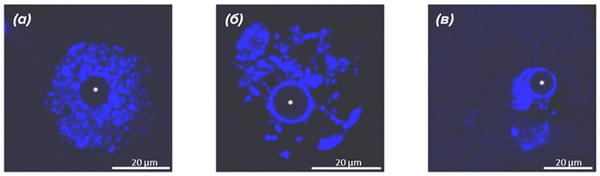
Рисунок 2. Различная конфигурация хроматина в мышиных ооцитах.
(а) — NSN-состояние;
(б) — раннее SN-состояние;
(в) — SN-состояние.
Первым, кто решил разобраться в хроматиновом безобразии, был Молсби Уиллетт Блэкман. Еще в 1901 г. Блэкман работал с хилоподами, правда, не с ооцитами, а со спермацитами (в которых происходят схожие с ооцитами процессы), и наблюдал конденсацию хроматина в ограниченном пространстве ядра на стадии диплотены профазы мейоза [4]. Данному явлению Блэкман дал название «кариосфера», и спорить с ним никто не стал. «Раз никто не спорит, — подумал Блэкман, — можно ввести в историю еще один термин — „кариосома“». Так кариосомой начали обозначать частный подтип кариосферы, когда гетерохроматиновые агрегаты не связаны с какими-либо экстрахроматиновыми включениями. Другой подтип кариосферы — те же самые гетерохроматиновые агрегаты, но уже окруженные внешней капсулой. Данному варианту был гордо присвоен термин «типичная кариосфера». Однако у млекопитающих, которые интересуют биологов больше всего, все совершенно иначе. Поэтому далее мы будем рассматривать процессы оогенеза и эмбриогенеза в контексте именно млекопитающих модельных объектов.
У человека, как и у мыши, хромосомный материал располагается вне экстрахромосомного элемента (тех самых ЯПТ). В таком случае принято говорить «инвертированная кариосфера» (рис. 3) [5].
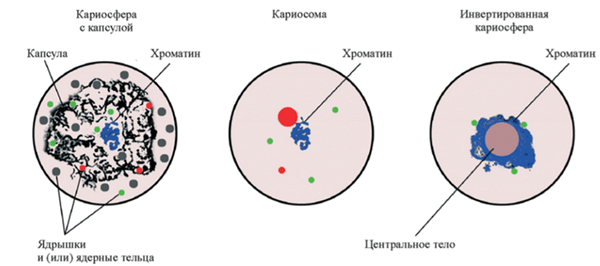
Рисунок 3. Основные типы кариосфер.
С терминологией немного разобрались. Вернемся к морфодинамике. В оогенезе, по мере перехода хроматина из NSN- в SN-состояние происходит инактивация транскрипционной активности ядра, и это очень важный параметр для дальнейшего завершения деления, созревания и осуществления правильного мейоза. Забегая вперед, можно сказать, что на начальных стадиях эмбриогенеза организация хроматина в зиготе морфологически поразительно похожа на таковую в ооцитах на поздних стадиях развития. За исключением того, что случается «рекапитуляция» транскрипционной активности, и она начинает волнообразно нарастать. Но редкая птица долетит до середины Днепра! Проблема заключается в том, что, если мы возьмем фолликулы одинакового размера в яичнике человека или мыши, то в них будут встречаться как SN-, так и NSN-ооциты, с постепенным увеличением процента SN-ооцитов в поздних антральных (готовых к овуляции) фолликулах. Тем не менее, какой-то процент NSN-ооцитов останется. Такие ооциты даже способны к оплодотворению, но развитие получившихся из них эмбрионов останавливается на двухклеточной стадии. Значимость перехода NSN—SN была подтверждена сравнением транскриптомных профилей: уровни мРНК большого набора генов, кодирующих материнские факторы, необходимые для расщепления и развития эмбриона, повышаются именно в SN-ооцитах. В связи с этим встает важный вопрос об отборе качественных ооцитов (например, для ЭКО), поскольку довольно трудно провести сегрегацию между SN- и NSN-ооцитами, полученными из антральных фолликулов одного размера. А размер для специалистов ЭКО имеет значение (как критерий оценки качества, разумеется).
Хорошо, с ооцитами стало понятнее. А у эмбрионов как обстоят дела?
Как уже говорилось ранее, морфологические картины, отражающие изменения конфигурации гетерохроматина в раннем эмбриогенезе, на первый взгляд, напоминают таковые в оогенезе. После оплодотворения ядро ооцита «разбирается», и в зиготе происходит формирование материнского и отцовского пронуклеусов de novo. В этом ведущую роль играют регуляторные белки материнского происхождения. На ранних стадиях эмбриогенеза тельца-предшественники ядрышек или ТПЯ (аналоги ЯПТ) служат платформой для формирования общего хроматинового ландшафта зиготы. Вокруг ТПЯ и ЯПТ конденсируется хроматин, образуя своеобразное гетерохроматиновое кольцо, содержащее области центромер и перицентромер. Именно пространственное расположение определенных гетерохроматиновых участков определяет дальнейшие стадии дробления зиготы (рис. 4).

Рисунок 4. Организация хроматина в ранних эмбрионах мышей, развивающихся in vivo.
(а) — зигота: mPN — материнский пронуклеус; pPN — отцовский пронуклеус; вокруг ТПЯ видны гетерохроматиновые кольца;
(б) — двухклеточная стадия: PB — полярное тело; на этом этапе начинают формироваться хромоцентры;
(в) — четырехклеточная стадия: видны многочисленные хромоцентры; гетерохроматиновые кольца вокруг некоторых ТПЯ начинают исчезать;
(г) — морула.
Мощным инструментом в изучении структуры гетерохроматина в ооцитах и зиготах млекопитающих является так называемая «энуклеоляция» — микрохирургическое удаление ЯПТ из ооцитов мыши и ТПЯ из пронуклеусов зигот. Так, было установлено, что ТПЯ/ЯПТ незаменимы для регуляции MaSat и MiSat вскоре после оплодотворения и служат основной структурой, организующей гетерохроматин в ооцитах и зиготах мышей.
MaSat (major satellite DNA, перицентромерный мажорный сателлит) и MiSat (minor satellite DNA, центромерный минорный сателлит) — повторяющиеся участки некодирующей ДНК, образующие тандемные повторы. Различия, главным образом, заключаются в количестве повторяющихся нуклеотидных мономеров и их локализации [6].
Состав самих ЯПТ (как и ТПЯ) пока остается малоизученным. Все дело в том, что на морфологическом уровне компактизация фибриллярных волокон атипичных ядрышек настолько плотная, что не все антитела, использующиеся в традиционных методах выявления белков-мишеней (например, вестерн-блот и иммуноцитохимический анализ), физически могут «достать» свою мишень [7]. Однако доподлинно известно, что ЯПТ и ТПЯ формируются схожим, весьма необычным, образом [8]. «Сейчас в биологии происходит настоящая LLPS-революция (LLPS: liquid-liquid phase separation) [9], т.е. изучается процесс формирования биомакромолекулярных конденсатов, возникающих в результате разделения жидких фаз. Сборка, разборка атипичных ядрышек и телец-предшественников ядрышек, как и протекание дальнейших процессов реорганизации хроматина также определяется законами фазового перехода», — комментирует доктор биологических наук, один из авторов обозреваемой статьи, Дмитрий Сергеевич Боголюбов.
Если все так сложно реализуется уже на уровне макромолекулярных комплексов — что уж говорить про геномный уровень?
Тут правильнее сказать — эпигеномный. В оогенезе и раннем развитии млекопитающих функциональная активность хроматина в значительной степени регулируется уникальным эпигенетическим ландшафтом. В его создании принимают участие следующие процессы [10]:
- пострепликационные модификации ДНК;
- посттрансляционные модификации ДНК-связывающих белков;
- АТФ-зависимое ремоделирование нуклеосом.
Казалось бы, ключевые эпигенетические игроки проанализированы и хорошо изучены. Однако полногеномных исследований с разрешением до одной клетки (single-cell sequencing), позволяющих установить корреляцию между SN- и NSN-состояниями хроматина, на данный момент не так уж много [11], [12]. Еще бы, ведь энуклеоляция с последующим анализом ядра каждой отдельной клетки — задачи не из легких.
Поскольку на поздних стадиях оогенеза происходит инактивация транскрипционной активности ядра, логично предположить, что в районах активно транскрибирующихся генов появляется определенный стоп-сигнал для транскрипционных или хроматин-ремодулирующих факторов, который всем своим видом провозглашает, что сейчас не время для транскрипции. Метилирование ДНК, которое изменяет сайты связывания ряда факторов транскрипции, является таким стоп-сигналом. Метильные группы обнаруживаются в динуклеотидах CpG, которые часто присутствуют в богатых CpG областях генома, называемых CpG-островками. В ооцитах, взятых из примордиальных (зародышевых) фолликулов, ДНК практически не метилирована по сравнению с ооцитами, присутствующими в антральных фолликулах, которые демонстрируют примерно 40% глобального метилирования ДНК. Кроме того, метилирование ДНК «конкурирует» с метилированием гистонов. Например, гистон H3 должен быть триметилирован по лизину 36 (H3K36me3), но не должен быть ди- или триметилирован по лизину 4 (H3K4me2/me3) и лизину 9 (H3K9me2) в областях, предназначенных для метилирования ДНК. Но стоит только часам пробить полночь, а оплодотворению случиться, как несущаяся карета метилирования генома превращается в тыкву деметилирование. Деметилироваться отцовскому и материнскому геномам помогают ДНК-метилтрансферазы DNMT3a и DNMT, опосредующие присутствие и отсутствие метильных групп на 5-метилцитозинах (5mC) и 5-гидроксиметилцитозинах (5hmC). После такого глобального сброса настроек ДНК в зиготе уже метилируется de novo; запускается процесс дробления.
В то время как с самой ДНК все просто (либо метилирована, либо нет), от разнообразия ковалентных гистоновых модификаций, определяющих гистоновый код, голова идет кругом. Здесь нужно пояснить, что гистоновый код — это посттрансляционные модификации определенных аминокислотных остатков гистонов на N-терминальном конце, например, ацетилирование, метилирование, фосфорилирование, убиквитинирование или рибозилирование. Гистоновые модификации необходимы для привлечения хроматин-ремодулирующих белков и, как следствие, для поддержания определенного состояния хроматина. Следует учитывать, что гистоновые модификации довольно видоспецифичны. Тем не менее, общей тенденцией для репрограммирования хроматина как в ооцитах, так и в зиготах млекопитающих, является метилирование гистона Н3 (H3K4me2, H3K4me3, H3K9me2 и H3K9me3) и ацетилирование гистонов Н3 и Н4 (H3K9ac, H3K18ac, H4K5ac и H4K12ac). К примеру, репрезентативными метками «активного» состояния хроматина является наличие паттернов распределения Н3К4me3 и H4K5ac, в то время как за «спящее» состояние хроматина отвечают Н3K27me3 и H3K9me3.
Посттрансляционные модификации гистонов — это, конечно, хорошо. Но только если есть, что модифицировать. Некоторые постоянные или коровые гистоны имеют своих дублеров — вариантные гистоны, замещающие коровые в составе нуклеосом. К примеру, отсутствие материнского гистонового варианта Н3—Н3.3 в зиготе приводит к нарушению репрограммирования и подавлению ключевых генов плюрипотентности [13]. Кроме того, присутствие Н3.3 и гистонового варианта Н1—Н1foo необходимо для замещения протаминов и сборки отцовского пронуклеуса. Вот такие вот они нужные и важные. Не важнее только, пожалуй, варианты гистона Н2A. Например, H2A.Z участвует в активации транскрипции и эпигенетической памяти, H2A.X играет центральную роль в ответе на повреждение ДНК, а MacroH2.A предположительно участвует в инактивации Х-хромосомы.
Помимо всего вышеперечисленного, ни один NSN-SN переход не обходится без участия дополнительных негистоновых белков, а присутствие некоторых даже является критически необходимым. Например, PCBP1 (poly(rC)-binding protein 1) играет ключевую роль в установлении транскрипционно-неактивного состояния хроматина во время формирования кариосферы. Мутации в гене одного из хроматин-ремоделирующих белков, ATRX (α-thalassemia/mental retardation X-linked protein), приводят к нестабильности перицентромерного хроматина и резкому возрастанию числа анеуплоидных ооцитов и эмбрионов. Белок DPPA3 (developmental pluripotency-associated protein 3), как и PCBP1, способствует репрессии транскрипции. Не дремлют и активируемые MAPK (mitogen-activated proteinkinase) сигнальные каскады, регулирующие NSN-SN переход при участии гормонов.
Несмотря на значительный прогресс в понимании молекулярных механизмов перестроек хроматина на поздних стадиях оогенеза и ранних стадиях эмбриогенеза, цельное видение регуляции таких сложных процессов еще не сформировано. Однако актуальность исследования не оставляет сомнений в том, что игра стоит свеч. «С фундаментальной точки зрения, изучение таких уникальных объектов поможет лучше понять законы организации клеточного ядра в целом, — говорит другой автор статьи, доктор биологических наук, Боголюбова Ирина Олеговна. — С прикладной — любые данные о преобразовании ядра в оогенезе позволяют увидеть слабые места уже в эмбриогенезе».
Неинвазивная диагностика анеуплоидий у плода: от идеи к продукту

Яблоня без яблок бесполезна. Без ствола и ветвей яблоня будет без яблок, то есть бесполезна. Яблоня без корней нежизнеспособна.
Статья на конкурс «Био/Мол/Текст»: Генетические заболевания в разной степени ухудшают качество и продолжительность жизни человека. Иногда их можно и не заметить, если повезет не встретиться с триггером, запускающим каскад поломок в организме. А какие-то генетические нарушения неизбежно приводят к боли, страданиям и смерти. Некоторые из них протекают настолько тяжело, что считаются медицинскими показаниями к искусственному прерыванию беременности. Такие состояния можно детектировать неинвазивно на ранних сроках, что создает основу для этически очень непростого, но осознанного решения родителей о прекращении или продолжении беременности. Число подобных анализов с каждым годом растет, на высококонкурентном рынке соревнуются несколько компаний. В этой заметке рассмотрим способ, применяемый фирмой Natera. При этом важно понимать, что высокотехнологичный коммерческий продукт вырастает из результатов фундаментальных исследований, которые на первый взгляд практической пользы не несут, а лишь удовлетворяют любопытство увлеченных людей.
Эта работа опубликована в номинации «Академия & Бизнес» конкурса «Био/Мол/Текст»-2020/2021.
У всех увлеченных людей есть потребность в удовлетворении своего любопытства. Некоторым из нас везет — это можно делать в рабочее время за счёт денег налогоплательщиков или потребителей. На первый взгляд такой процесс с непредсказуемым результатом может показаться неэффективным расходом ресурсов. Но это не так. Технологические прорывы возникают только тогда, когда кто-то рискует, дает волю своей фантазии и начинает использовать ресурсы неожиданным образом. При этом если результат Его Величества Эксперимента известен заранее, то это уже не эксперимент, а копирование чужой идеи. Замечу, что творческую деятельность сложно выполнять по приказу. «Иванов, до 31 числа жду от тебя пять озарений», — звучит смешно, но реально. Бóльшая часть научных открытий никакой прямой пользу обществу не несет. Фундаментальная наука создает основу для прикладной; конечный результат — статья в рецензируемом научном журнале, то есть идея с зафиксированным приоритетом. Прикладная же наука скорее использует эти статьи в попытке найти им применение; конечный результат — патент, то есть защищенный от копирования вариант использования идеи. Патенты могут быть востребованы бизнесом для создания коммерчески доступных продуктов, которые удовлетворяют нужды потребителей и приумножают вложенный капитал. Получается пирамида «ворох идей → горсть применений → щепотка продуктов». Не идеально, но ничего эффективнее нет — только так идеи становятся коммерчески доступными продуктами [1]. В этой заметке рассмотрим один из успешных примеров, (слегка) изменивших мир.
А в чем проблема?
В 2004 году моя сестра родила сына с синдромом Дауна. Ребенка не стало через шесть дней после рождения. Это был опустошающий опыт для всей нашей семьи. Я основал компанию Natera, потому что верю, что все семьи заслуживают доступа к технологиям, которые предлагают раннее обнаружение генетических заболеваний.
Мэтью Рабинович,
основатель компании Natera.
Качество и продолжительность жизни зависит от генетических особенностей индивидуума и давления внешней среды. Некоторые генетические нарушения могут настолько сильно ухудшить физическое, душевное и социальное благополучие человека, что считаются медицинскими показаниями к искусственному прерыванию беременности.
В ядре человеческой клетки в норме 23 пары хромосом. Одну хромосому из каждой такой пары мы получаем от папы, а вторую — от мамы. А потом передаем своим детям 23 хромосомы, скомпонованные из отцовских и материнских хромосом. А второй родитель добавляет другой перемешанный вариант 23 хромосом. В результате встречи двух гамет (сперматозоида и яйцеклетки) может образоваться эмбрион с 23 парами хромосом. Но иногда что-то идет не так, и у нового организма общее число хромосом отличается от 46-и. Такое нарушение называют анеуплоидией (строго говоря, это «некратное увеличение набора хромосом»). В самых тяжелых случаях эмбрион в принципе не будет развиваться, имплантации не произойдет — и женщина даже не заметит признаков не начавшейся беременности [2]. Иногда беременность наступит, но преждевременно прервется — произойдет выкидыш [3]. А при некоторых анеуплоидиях (например, синдроме Дауна) эмбрион разовьется, и беременность может завершиться родами. Часть родителей отказывается от детей с особенностями развития, часть посвящает себя уходу за ребенком. Современные методы позволяют диагностировать анеуплоидии на ранних стадиях развития плода, что, повторюсь, является медицинским показанием к искусственному прерыванию беременности. Результат такого анализа может стать основой для этически очень непростого, но осознанного решения родителей о прекращении или продолжении беременности. Отмечу, что синдром Дауна — далеко не единственный результат анеуплоидий. Также, например, возможно развитие синдромов Эдвардса, Патау и других генетических отклонений от условной нормы.
Как диагностировать анеуплоидии?
Достоверно диагностировать анеуплоидию можно только определив число хромосом в геноме плода. Но как безопасно получить биоматериал? Человеческий эмбрион развивается в амниотической полости. Этот мешок окружен плодными оболочками, внутренняя часть которых называется амнионом. Кстати говоря, в русском языке есть выражение «в рубашке родился». Такой «рубашкой» (рис. 1) называют неразорвавшиеся во время родов плодные оболочки. Эмбрион плавает в околоплодных водах (амниотической жидкости), в которой есть отмершие клетки плода. В результате анализа генома этих клеток можно посчитать число хромосом нового организма.
Рисунок 1. «В рубашке родился»!
Амниотическую жидкость для анализа получают в результате амниоцентеза. Такая инвазивная процедура заключается в проколе амниотической оболочки и заборе околоплодных вод для анализа. Надо отметить, что амниоцентез может провоцировать выкидыши. Вероятность такого неблагополучного исхода беременности составляет примерно 30 случаев на 10 000 процедур [4]. Существуют и другие способы инвазивной пренатальной диагностики с сопоставимыми рисками. При этом в среднем из 10 000 новорожденных 13 появляются на свет с синдромом Дауна [5]. Это значит, что, грубо говоря, инвазивная диагностика скорее приведет к выкидышу, чем выявит анеуплоидии плода.
Как неинвазивно диагностировать анеуплоидии?
В 1969 году в крови беременной женщины обнаружили клетки, содержащие Y-хромосомы [6]. В результате родов на свет появился мальчик. Таким образом, стало понятно, что клетки плода могут находиться в крови беременной женщины. Тем не менее таких клеток мало, что затрудняет разработку рутинных диагностических тестов [7]. Затем в 1997 году фетальную (от лат. fetus — плод) ДНК обнаружили в плазме крови беременных женщин [8]. Отмечу, что плазма — это жидкая бесклеточная фракция крови, в которой взвешены форменные элементы, то есть клетки крови. Таким образом, в результате такой малоинвазивной процедуры, как забор крови беременной женщины, можно исследовать ДНК плода. Тем не менее существующий на начало 2000-х годов уровень развития технологий не предполагал рутинного решения для диагностики анеуплоидий [9].
А причем тут высокопроизводительное секвенирование?
Иногда в результате творчества научных сотрудников и преобразования возникших идей в коммерчески доступный продукт мир меняется. В 2005 году произошла революция. Компания 454 Life Sciences стала продавать первый прибор для высокопроизводительного секвенирования [10]. Этот подход был основан на идее, опубликованной в 1998 году [11]. Затем в конкурентной борьбе технология-пионер проиграла другим методам [12]. Сейчас чаще всего используют секвенаторы производства компаний Illumina и Thermo Fisher Scientific [13]. Эти технологии не идеальны — исходные нуклеиновые кислоты служат матрицей для создания новых фрагментов ДНК. То есть на подготовительном этапе возможны искажения, вклад которых сложно оценить. Иначе говоря, происходит косвенное секвенирование — идентифицируют не исходные последовательности, а производные от исходных. Недавно появились способы прямого секвенирования нуклеиновых кислот — технологии компаний Oxford Nanopore [14] и Pacific Biosciences [13] позволяют секвенировать нуклеиновые кислоты без посредников.
Но всё это не важно. Мир поменялся — стало возможным одновременно секвенировать много нуклеотидных последовательностей, что на несколько порядков удешевило ряд исследований. Например, секвенирование генома человека при помощи метода, описанного в конце 1970-х годов [15], стоило несколько миллиардов долларов в конце 1990-х — начале 2000-х годов. Сейчас же получение аналогичных данных обойдется в несколько сотен долларов. Неинвазивная диагностика анеуплоидий, по сути, стала возможной благодаря этой технологической революции.
Исследование фетальной ДНК из свободной от клеток фракции крови, то есть плазмы, стало доступным за счет появления методов высокопроизводительного секвенирования. Существуют разные способы выполнения такого анализа. Запатентованный компанией Natera метод вошел в широкую клиническую практику [16]. Для исследования внеклеточную ДНК выделяют из плазмы крови беременной женщины. Затем некоторые фрагменты этой ДНК амплифицируют и секвенируют. Параллельно то же самое делают с геномной ДНК мамы и папы. В результате получают массивы данных высокопроизводительного секвенирования, в которых зашифрована информация о десятках тысяч однонуклеотидных полиморфизмов (ОНП). Эти большие данные обрабатывают при помощи соответствующего алгоритма [17].
Что такое однонуклеотидный полиморфизм?
В норме нуклеотидные последовательности одного человеческого организма продублированы. Мы получаем 23 хромосомы от мамы и 23 хромосомы от папы. Это значит, что каждая позиция генома существует в двух вариантах, или аллелях. При этом некоторые позиции генома у разных людей не совпадают, то есть полиморфны. А бывает, что и у одного человека на двух аллелях в одной и той же позиции разные нуклеотиды. Если один нуклеотид не совпадает, а окружающие его соседние нуклеотиды совпадают, то это однонуклеотидный полиморфизм (ОНП). Например, у Маши в 231 позиции гена qwerty на обоих аллелях расположен нуклеотид G (дезоксигуанозин-5′-монофосфат). А у Пети в этой же позиции на одной аллели G, а на второй C. Значит, для Маши и Пети эта позиция полиморфна. И для одного Пети, кстати, тоже полиморфна. А теперь представьте, что рассматриваем всю человеческую популяцию — тогда таких ОНП наберется довольно много.
В методе NATERA рассматривают только два самых частых варианта ОНП. Для упрощения обозначим первый вариант ОНП символом «А», а второй — символом «В». Если секвенировать один человеческий организм, то возможно три варианта сочетаний ОНП из двух хромосом: АА, АВ и ВВ. Для каждого ОНП измеряют частоту встречаемости ОНП «А», то есть фракцию «А». Для сочетания АА это значение будет равно 100%, для сочетания АВ — 50%, а для сочетания ВВ — 0%. Теперь усложним задачу — пусть в образце есть ДНК из двух разных организмов. Тогда, если в обоих организмах ОНП присутствует в одинаковом варианте АА, то частота А составит 100%. Но возможна и такая ситуация, что в одном организме есть сочетание АА (на двух хромосомах одинаковый ОНП — «А»), а в другом — АВ (на одной хромосоме ОНП «А», а на второй — «В»). Тогда общая фракция «А» будет меньше 100%. Это значение зависит от соотношения между количеством ДНК разных организмов в образце. Если материнской ДНК 99%, а фетальной — 1%, то разница будет незаметна для человеческого глаза. А если материнской ДНК 50%, и фетальной ДНК тоже 50%, то частота «А» в смеси составит 75%. И так далее — возможны разные сочетания вариантов АА, АВ, ВВ из двух разных организмов. Подобную ситуацию можно проиллюстрировать графиком (рис. 2 и 3). Исследуемые ОНП располагают по абсциссе согласно месту локализации в геноме, фракции «А» для каждого ОНП откладывают по ординате. Если оба организма содержат нормальное число хромосом, то получится что-то подобное рисунку 2. Вклад фетальной ДНК приводит к распределению точек в отдельные кластеры-отпечатки, которые можно использовать для определения числа копий хромосомы.
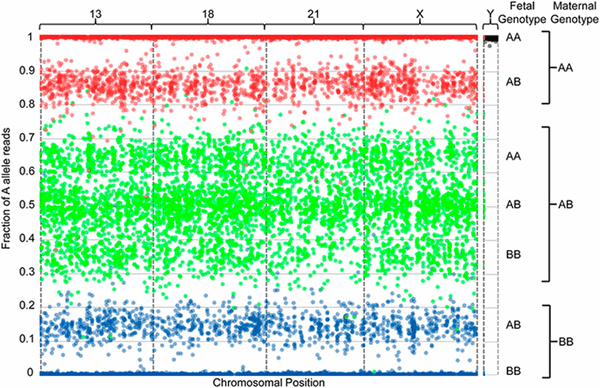
Рисунок 2. Визуализация результатов секвенирования внеклеточной ДНК плазмы крови беременной женщины. В методе NATERA рассматриваются такие ОНП, для которых возможны два варианта нуклеотидов. Для упрощения первый вариант ОНП обозначают символом «А», а второй — символом «В». Доля фетальной ДНК в образце составила 28,1%. На оси абсцисс расположены все ОНП согласно позиции в хромосоме. Название хромосом указано над графиком. Каждая точка представляет собой один ОНП, где точное положение по оси Y отображает совместную фракцию «А» материнской и фетальной ДНК. Точки красного цвета соответствуют сочетанию вариантов АА у матери на двух хромосомах, синего — сочетанию ВВ, зеленого — сочетанию АВ. В образце следов анеуплоидии нет. Также отсутствуют ОНП, принадлежащие Y-хромосоме, то есть плод — женского пола.
А теперь представим ситуацию, когда одна из хромосом плода продублирована. Тогда получится что-то подобное рисунку 3.
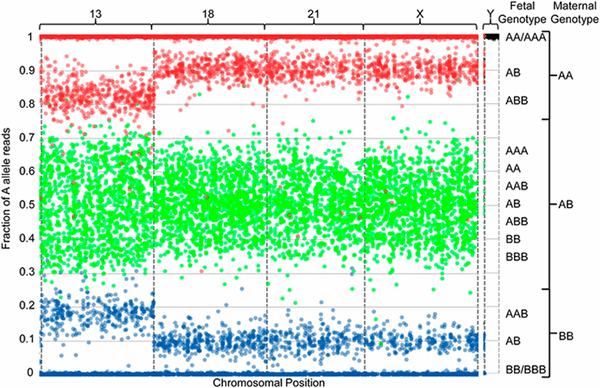
Рисунок 3. Визуализация результатов секвенирования внеклеточной ДНК плазмы крови беременной женщины. Доля фетальной ДНК в образце составила 19,2%. Описание этого рисунка аналогично предыдущему.
А что с коммерциализацией?
Сейчас услугой компании Natera воспользовались более двух миллионов беременных женщин из нескольких десятков стран. Стоимость анализа составляет сотни долларов, что доступно для значимой части целевой аудитории продукта. Число проводимых тестов с каждым годом растет, то есть рынок далек от насыщения. Запатентованная технология неинвазивного выявления анеуплоидий у плода во время беременности — одна из двух основных приносящих доход продуктов компании Natera. За первые три месяца 2020 года общий доход компании составил 94 миллиона долларов, валовая прибыль — 49 миллионов долларов. То есть эта динамично развивающаяся компания удовлетворяет запросы всё большего числа потребителей за счет превращения воздушных идей научных сотрудников в приземленный материальный продукт.
Заключение
Эта заметка — краткая справка по одному из способов неинвазивной диагностики анеуплоидий у плода. Но сколько фундаментальных и прикладных исследований понадобилось, чтобы из идей-фантазий получилось что-то материальное? Много. Знали ли авторы этих работ, что получится в результате? Не знали. Сколько было неудачных попыток превращения идей в коммерческий продукт? Неизвестно. Для успеха скорее необходима плодотворная среда, в которой комфортно сосуществуют фантазеры и жесткие прагматики. Для каких-то работ исход сложно предсказать, нужно включать фантазию и не бояться ошибаться. Но чем четче очертания конечного результата, тем проще привлечь капитал, которым рискуют в надежде приумножить. Сухой расчет необходим для оценки необходимых вложений и вероятных доходов. Чем приземленнее такой расчет, тем меньше рисков потерять привлеченный капитал и тем больше вероятность ситуации Win-Win для всех причастных.
Анеуплоидия: у женщин в возрасте высокие шансы родить ребенка с паталогией

Анеуплоидия — генетический сбой, при котором клетки содержат не кратное гаплоидному набору (более или менее 46) число хромосом. Сюда, например, относится синдром Дауна. Ученые узнали, почему у женщин в возрасте больше шансов родить ребенка с анеуплодией.

За последнее столетие достижения медицины улучшили качество и продолжительность жизни человека, но продолжительность детородного периода у женщин остается неизменной. Ученые знают, что запас ооцитов ограничен и формируется до рождения, а качество половых клеток постепенно снижается с возрастом, что приводит к сложностям с зачатием и увеличению связанных с возрастом анеуплоидий.
Несмотря на высокие риски родить ребенка с патологиями, женщины чаще задерживаются с рождением первого ребенка, получая в итоге выкидыши и беременности с плодом, имеющим серьезные врожденные патологии .
Ученые выяснили, почему у возрастных пар чаще рождаются дети с генетическими патологиями. Обзор исследований был опубликован в научном журнале “Тенденции в клеточной биологии».
Человеческие хромосомы «слабее»
«За день до овуляции, ооциты (женские половые клетки) начинают делиться. В идеале зрелые яйцеклетки. содержат полный набор из 23 хромосом, но этот процесс может проходить с ошибками, особенно в половых клетках людей в возрасте. Результат неправильного числа хромосом — генетические нарушения, такие как синдром Дауна, и выкидыши. Начиная исследования, мы хотели понять, что контролирует сегрегацию хромосом, когда яйцеклетка развивается, и где происходят сбои, приводящие к неправильному числу хромосом», — говорит Мелина Шух, директор департамента мейоза института биофизической химии в Германии.
Человеческие ооциты содержат пакет ДНК матери в 46 хромосомах. Когда они делятся (процесс называется мейоз) — все 46 хромосом собираются вдоль средней линии ооцита и вытягиваются в двух направлениях, после этого происходит ряд метаморфоз результат которых — яйцеклетка с 23 хромосомами. Ученые анализировали мейоз в животных и человеческих клетках, в результате чего выяснилось, что по сравнению с животными яйцеклетками, человеческие ооциты не могут в полной мере контролировать правильность распределения и прикрепления хромосом до сегрегации, так, как это происходит у животных. Это приводит к появлению яйцеклеток, которые получили слишком мало или слишком много (22 или 24) хромосомы — состояние, известное как анеуплоидия. Т.е. получается, что анеуплодия — это ошибка, сбой в программе, а не целенаправленный процесс.
Исследователи также обнаружили, что связи человеческих хромосом часто нестабильны, поэтому они могут перестраиваться во время мейоза, который может длиться целый день, что значительно больше, чем у других млекопитающих.
Чем старше женщина, тем выше шанс генетических патологий
Исследованию подверглись половые клетки женщин разных возрастов. Подтвердилось, что у женщин от 35 лет риск генетических изменений у плода всегда выше. Возрастные причины анеуплоидии в большей степени связаны с ухудшением структуры хромосом. «Мы обнаружили, что у женщин в возрасте хромосомы могут изменяться еще до мейза, что связано с ослаблением их структуры, кроме этого, с возрастом разрушаются и участки, где образуются новые связи (кинетохоры), что приводит к ошибкам сегрегации хромосом», — говорят специалисты. Они подтверждают, что посещение генетика для возрастных пар — мероприятие не для галочки.
Как бороться с анеуплодием: пренатальная диагностика, ЭКО, тест Принетекс
На данный момент не существует способа терапевтического лечения яйцеклеток с хромосомными аномалиями, ученые доказали, что это у многих женщин это возрастное явление. Да и нужно ли насильственным путем перестраивать хромосомы — вопрос спорный. Но это не значит, что женщина в возрасте должна отказаться от беременности. Современная медицина предлагает сразу несколько методов выявления хромосомных патологий у плода. Плюс можно забеременеть с помощью вспомогательных репродуктивных технологий, в том числе и использующих донорские половые клетки.
Что касается тестов, то врачи рекомендуют беременным женщинам проходить скрининги, достоверно определяющие, есть ли у плода такие нарушения. Первичный этап — неинвазивные методы диагностики беременных — УЗИ и анализы венозной крови ( пренатальный скрининг ), которые могут выявлять определенные параметры, свойственные анеуплоидии.
Если такие риски обнаружены, женщины могут обратиться для прохождения инвазивной диагностики (в этом случае проводится биопсия). Также можно сделать тест Пренетикс (ДНК ребенка выделяется из материнской крови).
Отдельно стоит рассказать про тест Prenetix. Этот инновационный метод считается лучшим для выявления анеуплодий, так как он использует в качестве материала для исследования венозную кровь будущей мамы, взятую обычным способом. Беременной женщине не нужно терпеть неприятные ощущения, связанные с биопсией и другими манипуляциями. Пройти тестирование можно в 10 недель беременности. Точность теста Пренетикс превышает 99%, но стоит он очень дорого.
Что касается ЭКО, то здесь вопрос возрастных анеуплодий решается с помощью преимплантационной генетической диагностики (ПГД). Генетический анализ исключает подсадку эмбрионов с генетическими нарушениями.
«Конечно, для многих пар ЭКО — эмоционально сложная задача, но все-таки сегодня именно ВРТ реальный выход из ситуации», — говорит ученый Мелина Шух. — «Также я хочу добавить, что в нашем исследовании есть положительный аспект. Мы узнали, что у многих женщин в возрасте «за 40» все-таки остаются яйцеклетки без каких-либо отклонений».
Где делают пренатальную диагностику на анеуплодии в Санкт-Петербурге
Сдать генетические анализы и пройти пренатальное обследование при беременности можно в СПБ в специализированной клинике Диана. Здесь выполняются все виды анализов и УЗИ. Скрининги беременных проводятся на новейшем аппарате экспертного уровня в форматах 3Д и 4Д. Диск выдается на руки. Расшифровку проводит врач высшей категории. К генетическим анализам прикладывается заключение генетика.
Читайте также:
- Рак желудка: причины, симптомы и лечение
- Х-сцепленная врожденная глухота: клиника и эпидемиология
- КТ и МРТ признаки болезней позвоночника
- Редкие причины системного головокружения: болезнь Меньера, инфаркт лабиринта, лабиринтит, интоксикация
- Анатомия: Статический анализатор. Ядро анализатора импульсов от внутренних органов
