Болезнь Паркинсона как причина старческого головокружения - клиника, диагностика
Добавил пользователь Владимир З. Обновлено: 21.01.2026
Головокружение и постуральная неустойчивость — одни из частых жалоб пациентов с болезнью Паркинсона. Так, спустя 2 года с момента установления диагноза неустойчивость регистрируется у трети пациентов, через 10 лет — у 71%, через 15 лет — у 92% [Kim S.D. et al., 2013]. Расстройства равновесия не только представляют непосредственную опасность, провоцируя травмы и повреждения, но и имеют самые неблагоприятные психологические последствия, вызывая страх перед новыми падениями, ограничивая тем самым социальную активность больного, провоцируя изоляцию и снижая качество жизни пациентов, страдающих болезнью Паркинсона.
Постуральная неустойчивость при болезни Паркинсона во многом обусловлена повреждением базальных ганглиев и, связанными с этим, расстройствами мышечного тонуса и движений. Вместе с тем, в последние годы стали появляться данные о наличии у пациентов, страдающих болезнью Паркинсона, вестибулярных расстройств.
Вестибулярные расстройства могут усугублять неустойчивость, которая также возникают в результате нарушения функции центрального или периферического отделов вестибулярного аппарата. Так, вестибулярная система и особенно вестибулярные ядра в стволе мозга играют решающую роль в интеграции множественной сенсорной информации (то есть визуального, проприоцептивного и вестибулярного сенсорного ввода). Согласованная деятельность этих систем позволяет сохранять равновесие и устойчивость.
В процессе нашего исследования планируется выявить клинические особенности вестибулярных расстройств у пациентов с болезнью Паркинсона, оценить их влияние на постуральную устойчивость и равновесие, разработать алгоритм выявления вестибулярных нарушений при болезни Паркинсона.
Вестибулярные расстройства при цервикальной дистонии становятся все более дискутируемой темой научных исследований последних лет. С одной стороны, появляется немало данных о наличии расстройств равновесия, нарушений ходьбы и головокружения у пациентов с цервикальной дистонией, однако частота встречаемости этих нарушений, степень выраженности и особенности их течения остаются до сих пор малоизученными. Результаты имеющихся исследований в этой области весьма неоднозначны. Так, в одних работах сообщается, что по данным некоторых объективных исследований вестибулярной функции у пациентов со спастической кривошеей четких расстройств не выявляется (Joke De Pauw et al., 2017). В то же время в ходе других исследований отмечена значительно более высокая встречаемость вестибулярных расстройств (Sally M. Rosengren et al., 2010), нарушений равновесия, ходьбы и страха падений (Christopher Barr et al., 2017; J. De Pauw et al., 2018) у пациентов с цервикальной дистонией по сравнению с контрольной группой.
В патогенезе сенсорного дефицита при цервикальной дистонии важное значение имеет нарушение сенсомоторной интеграции, вызванное ухудшением проприоцепции шейных мышц. Известно, что вестибулярная система и особенно вестибулярные ядра в стволе мозга и их центральные связи играют решающую роль в интеграции множественной сенсорной информации (вестибулярной, зрительной и проприоцептивной). Исходя из этого, можно предположить, что одной из причин нарушения равновесия, постуральной неустойчивости и головокружения у пациентов с цервикальной дистонией может выступать нарушение функции центрального или периферического отдела вестибулярной системы.
В процессе данного исследования планируется определить клинические особенности вестибулярных расстройств у пациентов с цервикальной дистонией, изучить их влияние на равновесие и постуральную устойчивость, разработать алгоритм выявления вестибулярных нарушений при цервикальной дистонии, а также составить программу вестибулярной реабилитации, которая смогла бы улучшить равновесие и предупредить падения пациентов, страдающих этим заболеванием.
Болезнь Паркинсона как причина старческого головокружения - клиника, диагностика
Изучение клинических особенностей вестибулярных нарушений у пациентов с болезнью Паркинсона (БП) и разработка способов их коррекции.
МАТЕРИАЛ И МЕТОДЫ
В исследование включены 90 пациентов с БП, которые были разделены две группы. Основная группа — 60 пациентов с БП и вестибулярными симптомами (ВС), группа сравнения — 30 пациентов с БП без ВС. Всем пациентам проводились клинико-неврологическое обследование, оценка когнитивных функций, аффективных и вегетативных нарушений, а также нейровестибулярное исследование.
РЕЗУЛЬТАТЫ
В ряде случаев жалобы на головокружение у обследуемых пациентов были вызваны сопутствующими заболеваниями вестибулярной системы. Среди остальных пациентов с БП, предъявляющих жалобы на головокружение, достоверно чаще, чем в группе сравнения, обнаруживались признаки нарушения центральных механизмов управления взором, отолитовой дисфункции, тревожного расстройства и нарушений зрительно-пространственных функций. Добавление вестибулярной реабилитации к комплексному лечению пациентов с БП, предъявляющих жалобы на головокружение, способствовало уменьшению постуральной неустойчивости и снижению риска падений.
ЗАКЛЮЧЕНИЕ
Вестибулярные нарушения достоверно чаще встречаются у пациентов с БП с жалобами на головокружение. Своевременное выявление этих нарушений возможно при помощи нейровестибулярного исследования, а для их коррекции к комплексному лечению целесообразно добавлять индивидуально подобранную вестибулярную гимнастику.
ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России, Москва, Россия
Кафедра неврологии ГБОУ "Российская медицинская академия последипломного образования", Москва;
Центр экстрапирамидных заболеваний, Москва
Российская медицинская академия последипломного образования
Вестибулярные нарушения при болезни Паркинсона
Рассматриваются причины головокружения и роль вестибулярной дисфункции в структуре неустойчивости у пациентов с болезнью Паркинсона (БП). Современные исследования, проведенные с использованием методов нейровестибулярного обследования, позволяют предположить развитие как периферической, так и центральной вестибулярной дисфункции при БП.
Традиционно считалось, что при болезни Паркинсона (БП) не затрагивается вестибулярная система. Тем не менее пациенты с БП годами жалуются на головокружение и неустойчивость. Так, спустя 2 года с момента установления диагноза БП неустойчивость отмечается у 1/3 пациентов, через 10 лет — у 71%, через 15 лет — у 92% [1]. В основе этих жалоб могут лежать как явления, свойственные самому паркинсонизму (гипокинезия, ригидность, постуральные нарушения), так и расстройства, связанные с фронтостриарными системами и аффективными нарушениями [2—5]. Расстройства равновесия не только ограничивают повседневную активность и снижают качество жизни пациентов с БП, но и существенно повышают риск падений, чреватых опасными травмами [6]. Ежегодно примерно у 70% пациентов с БП отмечаются эпизоды падений [7], около 50% из них повторяются [8—10].
Важная роль в поддержании равновесия и предотвращении падений принадлежит вестибулярной системе. Совместно со зрительной и проприоцептивной системами она обеспечивает афферентную информацию о положении тела в пространстве, движении и соотношении тела с окружающей его обстановкой, что необходимо для поддержания равновесия и постурального контроля. Несмотря на тесные связи вестибулярной системы с различными подкорковыми структурами, а также участие дофаминергических систем в передаче вестибулярной информации на уровне вестибулярных ядер ствола мозга, роль вестибулярной системы в развитии постуральной неустойчивости при БП изучена мало [11, 12]. Отчасти это обусловлено объективными причинами. Выявить вестибулярную дисфункцию у пациентов с БП достаточно трудно, поскольку моторные проявления болезни (ригидность, гипокинезия), а также некоторые немоторные симптомы заболевания могут затруднять интерпретацию результатов инструментального обследования состояния вестибулярной системы.
Между тем уточнение роли вестибулярных нарушений в развитии неустойчивости у пациентов с БП имеет не только важное теоретическое, но и практическое значение, поскольку может способствовать оптимизации лечения постуральных нарушений у этих пациентов.
К настоящему времени накоплены данные, свидетельствующие о возможной роли вестибулярной системы в развитии неустойчивости и падений у пациентов с Б.П. Так, распространенность периферических вестибулярных нарушений при БП изучалась P. Mota и соавт. [13]. Обследовав 30 пациентов с БП при помощи комплекса нейровестибулярных тестов, включающих электронистагмографию и калорическую пробу, авторы в 93,3% случаев выявили периферическую вестибулопатию. Причем у 30% больных изменения были двусторонними (двусторонняя вестибулопатия). Результаты другого исследования [14] показали, что периферическая вестибулярная дисфункция коррелирует с возрастом пациентов с Б.П. Это обстоятельство можно объяснить неизбежным сокращением в пожилом возрасте количества нейронов как в периферическом отделе вестибулярной системы, так и в области вестибулярных ядер, усугубляющим возможные вестибулярные нарушения, вызванные Б.П. По данным разных авторов [15—17], с возрастом уменьшается число волосковых клеток в ампулярных рецепторах и макуле, сокращается количество нейронов в вестибулярном ганглии, снижается кровоснабжение лабиринта, понижаются компенсаторные способности вестибулоокулярного и вестибулоспинального рефлексов. W. Reichert и соавт. [18], обследуя пациентов с БП при помощи битермального калорического теста, выявляли вестибулярные нарушения в 2/3 случаев. Из них у 50% пациентов была обнаружена двусторонняя вестибулярная гипорефлексия, у остальных 50% — арефлексия. Кроме того, авторы провели прямую зависимость между постуральной неустойчивостью и периферической вестибулярной дисфункцией. В исследовании M. Bassetto и соавт. [19] состояние вестибулярной системы оценивалось при помощи электронистагмографии. После обследования 30 пациентов с БП оказалось, что вестибулярные расстройства присутствуют в 83% случаев. При этом преимущественно определялись как одно-, так и двусторонние периферические нарушения. Кроме того, периферические вестибулярные нарушения при БП выявлялись в еще одном исследовании [20] небольшой группы пациентов. Однако включенные в это исследование больные принимали антихолинергические средства, что могло сказаться на результатах.
Особенно распространенными периферические вестибулярные расстройства оказались в группе больных БП с «боковым наклоном туловища» [21]. В исследовании принимали участие 22 пациента с БП: 11 — с «боковым наклоном туловища» и 11 — без этих особенностей. Проводились видеонистагмография с исследованием спонтанного и позиционного нистагма, калорическая проба, вибрационный тест. В результате обследования выяснилось, что у всех пациентов с «боковым наклоном туловища» имеются разной степени выраженности периферические вестибулярные расстройства. Вестибулярная гипорефлексия выявлялась на стороне, ипсилатеральной наклону туловища, и контралатеральной стороне с более выраженными симптомами паркинсонизма. В контрольной группе вестибулярные нарушения также наблюдались, однако значительно реже: лишь у 4 из 11 пациентов. Кроме того, было отмечено нарушение восприятия субъективной зрительной вертикали, что, впрочем, могло быть как причиной, так и следствием наклона туловища в сторону.
Хотя в большинстве исследований при БП обнаруживались признаки вестибулярной гипорефлексии, в одной работе [22], напротив, были найдены симптомы, характерные для вестибулярной гиперрефлексии.
Еще одним сравнительно частым проявлением периферической вестибулярной дисфункции при БП является доброкачественное пароксизмальное позиционное головокружение (ДППГ) [23]. При обследовании 305 пациентов с разными стадиями БП у 16 (5,2%) было выявлено ДППГ. Всем больным БП с ДППГ проводились лечебные репозиционные маневры, эффективность которых не уступала таковой при лечении пациентов с ДППГ без БП и составляла 92%. Кроме того, это исследование показало, что на головокружение жалуются почти 49% пациентов с Б.П. Однако самой частой причиной головокружения оказалась все же не вестибулярная дисфункция, а ортостатическая гипотензия, которая выявлялась у 38% пациентов [23].
Склонность пациентов с БП к развитию ДППГ была замечена и другими учеными. Например, L. Yilmaz и соавт. [24] пришли к выводу, что к ДППГ приводит гипокинезия, свойственная пациентам с БП. M. Strupp и соавт. [25] также считают, что к ДППГ приводит снижение подвижности пациентов с БП и, возможно, вызванная заболеванием необходимость оставаться в постели.
Обследование пациентов с БП при помощи компьютерной стабилометрии с системой виртуальной реальности подтвердило снижение постуральной устойчивости у этих пациентов и позволило предположить, что выявленные нарушения могут быть обусловлены не столько вестибулярными расстройствами как таковыми, сколько нарушением процессов адаптации. В условиях искаженной проприоцептивной информации пациенты оказываются неспособными более эффективно использовать сигналы от вестибулярной системы и теряют равновесие. Причем выявленные изменения не зависят от стадии заболевания [26, 27].
Предположение о нарушении механизмов центральной обработки информации, полученной от вестибулярных рецепторов у больных БП, было высказано и в исследовании Y. Huh и соавт. [28]. Авторы, оценивая походку пациентов с БП при помощи специальных систем на основе виртуальной реальности, показали, что механизмы центральной обработки вестибулярных сигналов были скомпрометированы у пациентов с застываниями при ходьбе и не нарушены у больных без застываний.
Разработка и внедрение в практику новых методов исследования вестибулярной системы, в частности вестибулярных вызванных миогенных потенциалов (ВВМП), позволило обследовать отолитовую часть вестибулярной системы. ВВМП дают возможность оценить состояние вестибулоцервикального (точнее, саккулоцервикального) рефлекса. Основной проводящий путь ВВМП начинается в макуле сферического мешочка, затем последовательно проводится по нейронам вестибулярного ганглия Скарпа, нижнего вестибулярного нерва, латерального вестибулярного ядра, медиального вестибулоспинального тракта и заканчивается в мышцах шеи, в том числе грудиноключично-сосцевидной [29].
Изменения ВВМП при БП было продемонстрировано в нескольких исследованиях [30—32]. Причем выявленные изменения коррелировали со степенью выраженности ригидности и гипокинезии на контралатеральной нарушенному вестибулоцервикальному рефлексу стороне и со степенью выраженности дискинезии на ипсилатеральной стороне. Эти данные позволяют предположить нарушение отолитовых систем, а также связей между вестибулярными ядрами у пациентов с БП.
Выявленные F. Gandor и соавт. [33] нарушения субъективной зрительной вертикали у пациентов с БП подтверждают возможное нарушение механизмов центральной обработки информации от отолитовых рецепторов при этом заболевании, поскольку восприятие вертикали обеспечивается непосредственно отолитовой системой [34].
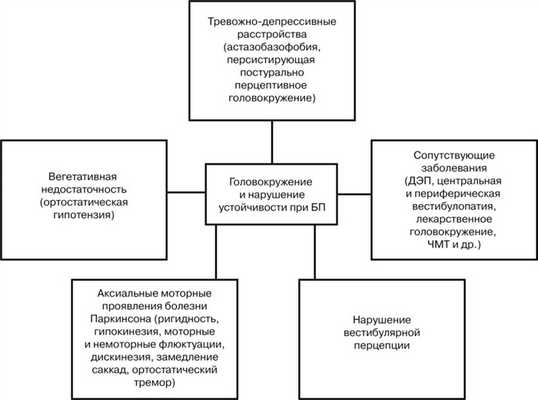
Таким образом, накопленные к настоящему времени данные позволяют предположить развитие как периферической, так и центральной вестибулярной дисфункции при Б.П. Конкретные механизмы этих нарушений пока не известны. Можно лишь предположить, что в их основе лежит повреждение дофаминергических систем, влияющее на передачу и обработку информации от периферических вестибулярных рецепторов на уровне вестибулярных ядер ствола мозга и их связей с подкорковыми структурами мозга. В обобщенном виде возможные причины головокружений и нарушения устойчивости при БП представлены на рисунке. Возможные причины головокружения и нарушения устойчивости у пациентов с БП.
Особенности и характер вестибулярных нарушений при БП нуждаются в дальнейших исследованиях, так же как и их вклад в развитие постуральных нарушений у этих пациентов. Тем не менее существующие на сегодняшний день данные о нарушениях вестибулярной системы при БП позволяют рекомендовать включение в комплексное лечение больных упражнений вестибулярной гимнастики, направленных как на тренировку вестибулоокулярного и вестибулоспинального рефлексов, так и на коррекцию восприятия вертикали. Наиболее эффективными терапевтическими подходами могут быть упражнения, основанные на биологической обратной связи. Однако роль и целесообразность вестибулярной реабилитации в комплексном лечении пациентов с БП нуждаются в дальнейших исследованиях.
Болезнь Паркинсона - симптомы и лечение
Что такое болезнь Паркинсона? Причины возникновения, диагностику и методы лечения разберем в статье доктора Поляковой Татьяны Акимовны, невролога со стажем в 13 лет.
Над статьей доктора Поляковой Татьяны Акимовны работали литературный редактор Елена Бережная , научный редактор Сергей Федосов
Определение болезни. Причины заболевания
Болезнь Паркинсона — это одно из самых распространенных нейродегенеративных заболеваний, поражающее преимущественно дофамин-продуцирующие (дофаминергические) нейроны в определенной области мозга, называемой чёрной субстанцией с накоплением в клетках белка альфа-синуклеина и особых внутриклеточных включений (телец Леви). Это заболевание — самая частая причина синдрома паркинсонизма (80% всех случаев). Распространенность болезни Паркинсона составляет около 140 (120-180) случаев на 100 000 населения. [1] Заболевание чаще всего проявляет себя после 50 лет, однако нередки случаи дебюта болезни и в более раннем возрасте (с 16 лет). Мужчины страдают немного чаще женщин.
Причина остается в значительной степени неизвестной. Предполагается, что на возникновение заболевания влияют генетические факторы, внешняя среда (возможное воздействие различных токсинов), процессы старения. Генетические факторы имеют доминирующее значение при раннем развитии болезни Паркинсона. Молодые пациенты с этим заболеванием и с семейной историей болезни с большей вероятностью переносят гены, связанные с болезнью Паркинсона, такие, как SNCA, PARK2, PINK1 и LRRK2. В одном из последних исследований показано, что 65% людей с ранним началом болезни Паркинсона в возрасте до 20 лет и 32% людей с началом от 20 до 30 лет имели генетическую мутацию, которая, как полагают, увеличивает риск развития болезни Паркинсона. [2]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы болезни Паркинсона
Многие симптомы болезни Паркинсона не связаны с движением. Немоторные («невидимые симптомы») болезни Паркинсона распространены и могут влиять на повседневную жизнь больше, чем более очевидные трудности с движением. Они могут включать:
- нарушение обоняния;
- расстройства сна;
- когнитивные симптомы (снижение памяти, легкомысленность);
- запор;
- расстройства мочеиспускания;
- повышенное потоотделение;
- сексуальную дисфункцию;
- усталость;
- боль (особенно в конечностях);
- покалывание;
- беспокойство и депрессию. [3]
В начале заболевания нередко ставится неверный диагноз — плечелопаточный периартрит, проявляющийся болью и напряжением в мышцах руки и спины.
Синдром паркинсонизма является основным клиническим проявлением болезни Паркинсона, его симптомы: [1]
- замедленность всех движений;
- истощаемость быстрых повторяющихся движений в руках и ногах;
- скованность мышц (мышечная ригидность);
- дрожание рук и ног (но почти никогда — головы), наиболее выражено в покое;
- неустойчивость при ходьбе;
- укорочение длины шага и шарканье при ходьбе, топтание на месте, застывания при ходьбе, отсутствие cодружественных движений руками при ходьбе.
Вначале симптомы возникают только с одной стороны тела, но постепенно приобретают двусторонний характер. Симптомы остаются выраженными на той стороне, где возникли в начале заболевания. Симптомы на другой стороне тела часто не становятся такими же тяжелыми, как симптомы на начальной стороне. Движения становятся все более замедленными (основной симптом паркинсонизма). Симптомы заболевания колеблются в течения дня и зависят от многих факторов.
Патогенез болезни Паркинсона
Болезнь Паркинсона относится к группе синуклеинопатий, так как избыточное накопление в нейронах альфа-синуклеина приводит к их гибели. Повышенный уровень альфа-синуклеина может быть следствием нарушения внутриклеточной системы клиренса белков, осуществляемого лизосомамии и протеосомами. У пациентов обнаружено нарушение функционирования указанной системы, среди причин которого указывают старение, окислительный стресс, действие воспаления, токсины окружающей среды. Клетки гибнут предположительно из-за активации генетически запрограмированного механизма (апоптоза). [4]
Классификация и стадии развития болезни Паркинсона
Болезнь Паркинсона классифицируется по форме, стадии и темпу прогрессирования заболевания.
В зависимости от преобладания в клинической картине того или иного симптома выделяют следующие формы: [1]
1. Смешанная (акинетико-ригидная-дрожательная) форма характеризуется наличием всех трёх основных симптомов в разном соотношении.
2. Акинетико-ригидная форма характеризуется выраженными признаками гипокинезии и ригидности, к которым обычно рано присоединяются нарушения ходьбы и постуральная неустойчивость, при этом тремор покоя отсутствует или выражен минимально.
3. Дрожательная форма характеризуется доминированием в клинической картине тремора покоя, признаки гипокинезии уходят на второй план.

Для характеристики стадий Болезни Паркинсона используется шкала Хен-Яра, 1967:
- на 1-й стадии акинезия, ригидность и тремор выявляются в конечностях с одной стороны (гемипаркинсонизм);
- на 2-й стадии симптоматика становится двусторонней;
- на 3-й стадии присоединяется постуральная неустойчивость, но сохраняется способность к самостоятельному передвижению;
- на 4-й стадии симптомы паркинсонизма резко ограничивают двигательную активность;
- на 5-й стадии в результате дальнейшего прогрессирования заболевания больной оказывается прикованным к постели.
Выделяют три варианта темпа прогрессирования заболевания:
- При быстром смена стадий заболевания от первой к третьей занимает 2 года или менее.
- При умеренном — от 2 до 5 лет.
- При медленном — более 5 лет.
Осложнения болезни Паркинсона
Болезнь Паркинсона — не смертельное заболевание. Человек умирает с ним, а не от него. Однако поскольку симптомы ухудшаются, они могут вызвать инциденты, которые приводят к смерти. Например, в сложных случаях затруднение глотания может привести к тому, что пациенты начнут аспирировать пищу в легкие, что приведет к пневмонии или другим легочным осложнениям. Потеря равновесия может привести к падению, которое, в свою очередь, может привести к серьезным травмам или смерти. Серьезность этих инцидентов во многом зависит от возраста пациента, общего состояния здоровья и стадии заболевания.
На более поздних стадиях заболевания проявляются более выраженные симптомы болезни Паркинсона: дискинезия (непроизвольные движения или подергивание частей тела, которые могут возникнуть в результате длительного использования леводопы, застывания (внезапное отсутствие возможности двигаться) или семенящая походка (короткие, почти бегущие шаги, которые как будто ускоряются сами по себе).
Следует помнить, что болезнь Паркинсона очень индивидуальна по своему течению и у каждого протекает по своему сценарию.
Диагностика болезни Паркинсона
Паркинсонизм относится к числу тех расстройств, которые можно диагностировать на расстоянии, особенно при развёрнутой картине заболевания. Однако диагностировать болезнь Паркинсона на ранней стадии сложно. Ранняя и точная диагностика заболевания очень важна для разработки лучших стратегий лечения и поддержания высокого качества жизни как можно дольше. В практике возможна недооценка или переоценка болезни Паркинсона. Невролог, специализирующийся на расстройствах движения сможет поставить наиболее точный диагноз. Первоначальная оценка проводится на основе анамнеза, неврологического обследования с использованием специальных тестов для оценки симптомов заболевания. Неврологическое обследование включает в себя оценку координации, ходьбы и мелких моторных задач, оценку нейропсихологического статуса.
Практика получения второго мнения в значительной степени зависит от личного выбора пациента. Но имейте в виду, что болезнь Паркинсона часто трудно диагностировать точно, особенно когда симптомы незначительно выражены. Простейшего диагностического теста нет, и примерно 25% диагнозов болезни Паркинсона неверны. Болезнь Паркинсона начинается с мало видимых симптомов, поэтому многие врачи, которые не обучены в сфере двигательных расстройств, не могут поставить точный диагноз. На самом деле даже лучшие неврологи могут ошибаться. Если врач не имеет особого опыта в этой области, то необходимо консультироваться со специалистом по расстройствам движения. Хороший невролог поймет ваше желание подтвердить диагноз. Второе мнение может помочь принять своевременно правильные решения относительно диагноза и терапии.
Лечение болезни Паркинсона
Несмотря на то, что излечения болезни Паркинсона не существует, есть множество методов, которые могут позволить вести полноценную и продуктивную жизнь на многие годы вперед. Многие симптомы могут облегчаться лекарствами, хотя со временем они могут утратить свою эффективность и вызвать нежелательные побочные эффекты (например, непроизвольные движения, известные как дискинезия).
Существует несколько методов лечения, замедляющих появление моторных симптомов и улучшающих двигательные функции. Все эти методы лечения предназначены для увеличения количества дофамина в головном мозге либо путем его замещения, либо продления эффекта дофамина путем ингибирования его распада. Исследования показали, что терапия на ранней стадии может задержать развитие двигательных симптомов, тем самым улучшая качество жизни. [5]
На характер и эффективность лечения влияет ряд факторов:
- выраженность функционального дефицита;
- возраст больного;
- когнитивные и другие немоторные нарушения;
- индивидуальная чувствительность к препаратам;
- фармакоэкономические соображения.
Задача терапии при болезни Паркинсона — восстановить нарушенные двигательные функции и поддержать оптимальную мобильность в течение максимально длительного периода времени, сведя к минимуму риск побочных действий препаратов. [1]
Существуют также хирургические вмешательства, такие, как глубокая стимуляция мозга, подразумевающая имплантацию электродов в мозг. Из-за рисков, присущих этому типу лечения, большинство пациентов исключают данный метод лечения до тех пор, пока лекарства, которые они принимают, больше не дают им значимого облегчения. Обычно этот метод лечения проводится у пациентов с длительностью заболевания от четырех лет, получающих эффект от лекарств, но имеющих моторные осложнения, такие, как: значительное «отключение» (периоды, когда лекарство плохо работает и симптомы возвращаются) и/или дискинезии (неконтролируемые, непроизвольные движения). Глубокая стимуляция мозга лучше всего работает в отношении таких симптомов, как: скованность, медлительность и тремор, не работает с целью коррекции устойчивости, застывания при ходьбе и немоторных симптомах. Данное лечение может даже усугубить проблемы с памятью, поэтому хирургия не рекомендуется для людей с когнитивными расстройствами. [6]
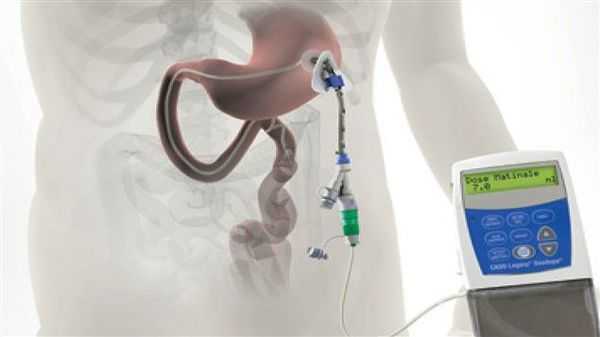
Различные новые способы введения леводопы открывают дополнительные возможности терапии. Сегодня используется интестинальный (кишечный) дуодопа-гель, который уменьшает ежедневные периоды «выключения» и дискинезию у пациентов с прогрессирующей болезнью Паркинсона благодаря постоянному неимпульсному режиму введения препарата. [7]
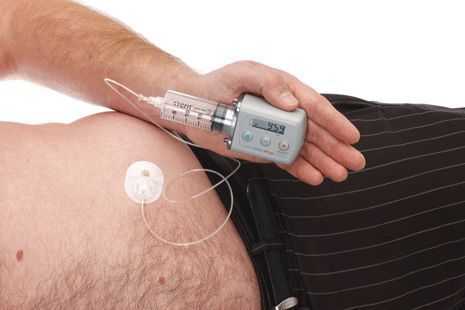
Исследуется альтернативный подход, использование допаминовых продуцирующих клеток, полученных из стволовых клеток. Хотя терапия стволовыми клетками имеет большой потенциал, требуется больше исследований, прежде чем такие клетки могут стать инструментом в лечении болезни Паркинсона. [8] [9]
По мере прогрессирования болезни Паркинсона возможности хранения и буферизации дофамина в мозге становятся все более скомпрометированными, сужая терапевтическое окно для терапии и приводя к колебаниям двигательной системы человека. Апоморфин в виде помпы доставляет подкожную инфузию в течение дня для лечения флуктуаций (феномены «ON-OFF») у пациентов с болезнью Паркинсона, которые недостаточно контролируются пероральным антипаркинсоническими препаратами. Эта система используется постоянно, чтобы обеспечить мозг непрерывной стимуляцией.
При болезни Паркинсона очень полезна физическая нагрузка. Если дважды в неделю по 1-2 часа выполнять упражнения, то можно замедлить развитие заболевания: походка, осанка и когнитивные способности будут ухудшаться гораздо медленнее [12] .
Прогноз. Профилактика
Болезнь Паркинсона уникальна для каждого человека, никто не может предсказать, какие симптомы появятся и когда именно. Существуют общее сходство картины прогрессирования болезни, но нет никакой гарантии, что то, что наблюдается у одного, будет у всех с аналогичным диагнозом. Некоторые люди оказываются в инвалидных колясках; другие все еще участвуют в марафонах. Некоторые не могут застегнуть ожерелье, в то время как другие делают ожерелья вручную.
Пациент может сделать всё, чтобы активно повлиять на течение болезни Паркинсона и, по крайней мере, на одну очень вескую причину: ухудшение симптомов часто значительно медленнее у тех, кто проявляет позитивную и активную позицию по отношению к своему состоянию, чем те, кто этого не делает. В первую очередь рекомендуется найти врача, которому доверит пациент, и который будет сотрудничать по развивающемуся плану лечения. Снижение стресса обязательно — стресс ухудшает каждый симптом болезни Паркинсона. Рекомендуются занятия образовательного направления: рисование, пение, чтение стихов, рукоделие, изучение языков, путешествия, работа в коллективе, занятия общественной деятельностью.
К сожалению, даже если адекватно подобрать медикаментозную терапию, это не гарантирует того, что клетки перестанут гибнуть при болезни Паркинсона. Терапия должна быть направлена на создание благоприятных условий для двигательной активности с учётом индивидуальных особенностей клинической картины заболевания. Как показывают результаты многочисленных исследований, профессиональная двигательная реабилитация является необходимым условием для замедления прогрессирования заболевания и улучшения его прогноза. На сегодняшний день по данным клинических исследований показана эффективность реабилитационной программы по протоколам LSVT LOUD, LSVT BIG, теоретическая основа которых сводится к развитию нейропластичности вещества мозга. Она направлена на коррекцию дрожания, ходьбы, постуры, равновесия, мышечного тонуса и речи. [10]
Реабилитационные методики должны быть направленные не только на поддержание сохранившихся двигательных способностей, но и выработку новых навыков, которые бы помогали человеку с болезнью Паркинсона преодолевать ограниченность его физических возможностей, чему способствует программа танцевально-двигательной терапии при болезни Паркинсона, работающая более чем в 100 сообществах по всему миру, включая Россию. Танцевальная терапия позволяет частично решить конкретные проблемы болезни Паркинсона: потеря равновесия, ухудшение координации, шаркающая походка, тремор, застывания, социальная изоляция, депрессия и повышенный уровень тревожности.
Согласно американскому исследованию с участием 52 больных болезнью Паркинсона, регулярная практика аргентинского танца уменьшает симптомы болезни, улучшает баланс и улучшает выполнение сложных движений при болезни Паркинсона. [11]
Российская медицинская академия последипломного образования;
Центр экстрапирамидных заболеваний, Москва
НИИ скорой помощи им. Н.В. Склифосовского, Москва
Ночные симптомы болезни Паркинсона и подходы к их коррекции
Журнал: Журнал неврологии и психиатрии им. С.С. Корсакова. 2013;113(12): 62‑66
Кулуа Т.К., Федорова Н.В. Ночные симптомы болезни Паркинсона и подходы к их коррекции. Журнал неврологии и психиатрии им. С.С. Корсакова. 2013;113(12):62‑66.
Kulua TK, Fedorova NV. Nocturnal symptoms of Parkinson's disease and approaches to their correction. Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. 2013;113(12):62‑66. (In Russ.).
В исследование были включены 73 пациента с болезнью Паркинсона (БП). Они были разделены на 2 группы в зависимости от наличия (53 больных) или отсутствия (20 больных) ночных симптомов заболевания. В контрольную группу вошли 10 здоровых. Наиболее часто у пациентов с ночными симптомами встречались никтурия (71,8%), аффективные нарушения (52,4%), акинезия (41,7%) и крампи (30,15%). Эти симптомы были более выраженными при акинетико-ригидной форме БП, большей тяжести и прогредиентности заболевания. При использовании для коррекции ночных симптомов сталево было отмечено его выраженное терапевтическое действие.
Болезнь Паркинсона (БП) - это «болезнь 24 часов» и симптомы, проявляющиеся в ночное время, т.е. с момента, когда больной отправляется ко сну и до момента, когда больной просыпается и встает с постели, являются неотъемлемой частью клинической картины заболевания [4]. Фактически у всех пациентов с БП выявляются симптомы, проявляющиеся в ночное время, приводящие к нарушению сна и значительно ухудшающие качество жизни [4, 6, 14]. Среди них выделяют моторные и немоторные симптомы [6, 18, 19].
К моторным ночным симптомам относятся ночные акинезия и акатизия, крампи, ночная дистония, синдром беспокойных ног (СБН), периодические движения конечностями и психомоторное возбуждение во сне. Акинезия (гипокинезия) представляет собой снижение спонтанной двигательной активности и выявляется у 65% больных БП [6, 14, 18]. У некоторых больных в вечернее и ночное время возникает чувство беспокойства, заставляющее их совершать движения (ночная акатизия). Акатизия нередко возникает у больных с моторными флуктуациями, вызванными длительным приемом леводопы, часто - во время прекращения действия очередной дозы, либо в период начала и прекращения ее действия (разновидность двухфазной дискинезии) [6, 18].
У 20% больных БП ночью возникают крампи - болезненные непроизвольные мышечные спазмы, чаще в мышцах голеней и стоп, реже - в двуглавой мышце плеча или разгибателях пальцев кисти, продолжающиеся от нескольких секунд до нескольких минут. В большинстве случаев крампи наблюдаются в покое; они могут быть спровоцированы интенсивной физической нагрузкой, приемом алкоголя, недостатком сна, курением, переохлаждением или перегреванием, нарушением водно-электролитного баланса [6, 18].
У 10% больных БП выявляется ночная миоклония - кратковременные мышечные подергивания, обычно во время медленного сна на фоне длительного лечения леводопой, чаще у больных с дневными дискинезиями [18].
Синдром беспокойных ног (СБН) характеризуется неприятными ощущениями в нижних конечностях в покое в вечернее и ночное время, вынуждающим больного совершать устраняющие их движения и приводящие к нарушению сна. СБН выявляется у 6,3-19,5% пациентов с БП [4, 18]. Нарушения сна при СБН усугубляют периодические движения конечностями (ПДК), которые возникают во сне у 80% больных с СБН во время фазы медленного сна. Преимущественно вовлекаются нижние конечности, возникают разгибание большого пальца, тыльное сгибание стопы и голени. В отличие от миоклоний, ПДК продолжаются более длительное время (от 0,5 до 5 с), могут быть односторонними и ритмично повторяются каждые 4-90 с. Отмечаются обычно в первой половине ночи, нарастают с возрастом. В легких случаях ни больные, ни их родственники не подозревают о наличии ПДК, и они могут быть выявлены только с помощью полисомнографии. В тяжелых случаях ПДК не прекращаются всю ночь и могут быть причиной частых пробуждений [3, 20, 21].
Ночные лекарственные дискинезии относятся к моторным симптомам БП. Чаще они представлены хореиформным гиперкинезом, оромандибулярной дискинезией, реже - миоклонией, тиками. Ночная дистония периода выключения часто бывает болезненной и значительно нарушает сон.
Двигательная активность во время фазы сна с быстрым движением глазных яблок (БДГ) выявляется примерно у 20% больных. Психомоторное возбуждение во сне с БДГ может проявляться сноговорением, криком, стонами, элементарными или более сложными движениями конечностей и туловища, иногда весьма активными и чреватыми опасностью травмы больного или лежащего рядом с ним родственника. Иногда симптом появляется за несколько месяцев или лет до основных моторных симптомов БП и может рассматриваться как первый признак заболевания [6, 18].
Немоторные ночные симптомы представлены нарушениями сна, вегетативными нарушениями, аффективными и психотическими расстройствами. Нарушения сна - один из наиболее значимых немоторных симптомов БП. Фактически все пациенты с БП страдают от различных видов таких нарушений (трудность засыпания, поверхностный сон с частыми ночными пробуждениями, раннее пробуждение и тесно связанная с ними чрезмерная дневная сонливость). В 1817 г. Д. Паркинсон отметил, что нарушения сна являются важным компонентом дрожательного паралича. Чаще всего дневная сонливость вызывается нарушениями ночного сна, в свою очередь расстраивая ночной сон и замыкая порочный круг. Дневная сонливость у пациентов с БП может быть вызвана приемом лекарственных препаратов, депрессией, апноэ сна, прогрессированием самого заболевания.
Кроме основных двигательных нарушений при БП встречаются вегетативные расстройства, более выраженные на поздних стадиях заболевания, наряду с двигательными, когнитивными и аффективным нарушениями являющиеся неотъемлемой частью клинической картины заболевания. При этом они никогда не выходят на первый план в клинической картине, хотя на поздних стадиях заболевания обычно достаточно выражены. К ним относятся нарушения моторики кишечника с тенденцией к запорам, импотенция, ортостатическая гипотензия, себоррея, потеря массы тела, болевые ощущения, панические атаки, гипергидроз, нарушения мочеиспускания. Вегетативные расстройства в ночное время представлены нарушением мочеиспускания (никтурия, ночное недержание мочи), гипергидрозом и паническими атаками ночи. Наиболее социально дезадаптирующим вегетативным расстройством является нарушение мочеиспускания, которое развивается при прогрессировании БП в 60-80% случаев и в основном представлено синдромом гиперактивного мочевого пузыря. Панические атаки - психовегетативные пароксизмы, чаще возникающие на фоне выраженных тревожных расстройств и характеризующиеся психическими, вегетативными и соматическими симптомами, включая страх смерти, одышку, профузный пот, боли в груди, головокружение, тахикардию, ознобоподобный тремор. Панические атаки сна имеют относительно меньшую продолжительность, выраженные фобические и психосенсорные проявления и преимущественно характеризуются редкими пароксизмами. Больные с паническими атаками сна отличаются более выраженной тревожностью, ухудшением качества жизни и избыточной вегетативной активацией по показателям частоты сердечных сокращений, величины систолического артериального давления, частоты дыхания и кожно-гальванической активности.
Аффективные расстройства у больных БП проявляются в виде депрессии, апатии, реже - маниакального синдрома. Одним из самых частых их вариантов является депрессия, которая выявляется на любой стадии БП, но в 30% случаев предшествует ее первым двигательным проявлениям. У значительной части больных БП наблюдаются повышенная тревожность, раздражительность, эмоциональная лабильность и негативизм.
Психические расстройства также возможны на любой стадии БП, в 50-60% случаев на поздних стадиях развиваются спонтанно, но чаще бывают связаны с действием противопаркинсонических средств, при назначении нового препарата, либо при повышении дозы или изменении схемы приема ранее назначенного средства. Спектр психических расстройств, наблюдаемых при БП, весьма широк и он может включать и психотические состояния с галлюцинациями, иллюзиями, бредом и делирием. Своеобразным эквивалентом психотических расстройств являются яркие устрашающие сновидения и ночные кошмары, которые нередко предшествуют более явным психотическим нарушениям или сопровождают их.
В течение последних нескольких десятилетий для лечения больных БП применяются двухкомпонентные препараты, содержащие леводопу и ингибитор периферической ДОФА-декарбоксилазы (ДДК), вызывающий торможение периферического декарбоксилирования леводопы. С 2003 г. для лечения БП применяется трехкомпонентный препарат - сталево, содержащий леводопу, карбидопу и ингибитор катехол-О-метилтрансферазы энтакапон [2] (табл. 1).
Основными причинами развития моторных флюктуаций, в том числе ночной акинезии при БП, являются колебания концентрации леводопы в плазме крови из-за короткого периода полужизни двухкомпонентных препаратов (леводопа/ингибитор ДДК), что в свою очередь ассоциируется с пульсирующей нефизиологической стимуляцией дофаминовых рецепторов.
Применение трехкомпонентного препарата леводопы нового поколения - сталево (леводопа/карбидопа/энтакапон) позволяет создать более равномерную концентрацию леводопы в плазме крови, что обеспечивает более постоянную, близкую к физиологическим условиям стимуляцию дофаминовых рецепторов.
К преимуществам препарата сталево можно отнести более высокую биодоступность леводопы, удлинение периода полужизни леводопы в крови до 85%, более стабильную и высокую концентрация леводопы в крови, удлинение продолжительности действия каждой принятой дозы леводопы. Леводопа в составе сталево лишается своего главного недостатка - короткого периода полужизни в плазме, который предопределяет пульсирующую стимуляцию дофаминовых рецепторов полосатого тела. Таким образом, комбинация леводопы с карбидопой и энтакапоном, входящая в состав сталево, может обеспечивать более физиологичную тоническую активацию дофаминовых рецепторов [13, 15].
Фармакокинетическое исследование биодоступности однократной дозы 200 мг трехкомпонентной формы леводопы/карбидопы/энтакапона, принятой перед сном, показало, что концентрация леводопы в плазме крови была более стабильной после приема трехкомпонентного препарата, чем после приема 200 мг леводопы с постепенным высвобождением лекарственного средства [12].
Задачей настоящего исследования являлось изучение эффективности нового трехкомпонентного препарата леводопы сталево в коррекции ночных моторных симптомов заболевания при приеме однократной вечерней дозы.
В Центре экстрапирамидных заболеваний были обследованы 73 пациента с БП.
В процессе исследования пациенты с БП были распределены на две группы. В основную группу вошли 53 больных БП с ночными симптомами, группу сравнения составили 20 больных БП без симптомов, проявляющихся в ночное время. Для изучения частоты и характера ночных симптомов была выбрана контрольная группа из 10 практически здоровых людей соответствующего возраста. Все три группы были сопоставимы по полу и возрасту. В группе исследования коррекция ночных симптомов БП была максимально индивидуализирована. У каждого пациента определялся спектр ночных симптомов и, в зависимости от их характера, проводилась коррекция дофаминергической терапии с использованием трехкомпонентного препарата леводопы сталево; 63 больным БП с ночными симптомами вечерний прием леводопы заменялся на сталево в дозе, эквивалентной той дозе леводопы, которую пациент принимал в составе двухкомпонентного препарата. Пациенты принимали сталево однократно перед сном на протяжении 3 мес.
В основной группе преобладали пациенты со степенью тяжести заболевания 3-3,5 балла и акинетико-ригидной формой БП, а в группе сравнения - со степенью тяжести 2-2,5 балла и смешанной формой заболевания. Степень тяжести БП определялась по модифицированной шкале Хена-Яра [10]; двигательные нарушения - с помощью количественной шкалы UPDRS (III часть) [7]. Динамика повседневной активности оценивалась с использованием шкал Schwab and England и UPDRS (II часть). Выраженность аффективных нарушений определялась с помощью шкал оценки тревоги [9] и депрессии Гамильтона [8].
Качество жизни больных БП изучалось с помощью опросника состояния качества жизни больных БП PDQ - 39 [16, 17]. Оценка нарушений сна проводилась с помощью шкалы сна при болезни Паркинсона [5] и шкалы сонливости Epworth [1, 11]. Выраженность ночных симптомов оценивалась по шкале комплексной оценки факторов, нарушающих сон при БП, разработанной на кафедре неврологии Российской медицинской академии последипломного образования, в Центре экстрапирамидных заболеваний. В целях более объективной оценки характера и степени выраженности моторных, немоторных и фармакологических факторов, нарушающих сон при БП, а также определения эффективности противопаркинсонической терапии была разработана Шкала комплексной оценки факторов, нарушающих сон при БП, позволяющая оценить 16 наиболее часто встречающихся моторных, немоторных и фармакологических факторов (осложнения неадекватной фармакотерапии).
К моторным факторам были отнесены ночная акинезия, частота встречаемости которой составила 41,7%, крампи - 30,1%, ночная акатизия - 7,7%, СБН - 5,8%, ПДК - 3,8%. Немоторные факторы включали никтурию, которая выявлялась у 71,8%, аффективные расстройства - 52,4%, ночное недержание мочи - 23,3% и гипергидроз - 8,7%, а также панические атаки ночи - 0,9%. К фармакологическим факторам были отнесены чрезмерная дневная сонливость, частота встречаемости которой составила 62,2%, мышечная дистония - 23,3% и психотические расстройства, такие как ночные кошмары - 20,3%, галлюцинации - 8,7%, психомоторное возбуждение во сне - 8,7%, иллюзии восприятия - 3,8%. У одного и того же пациента обычно наблюдалось сочетание нескольких ночных симптомов БП.
Пациенты, включенные в исследование, не подвергались круглосуточному наблюдению медицинского персонала и полисомнографическому контролю во время ночного сна. Тщательный опрос пациентов, родственников, ухаживающего персонала, спящих в одной комнате с больным, а также использование современных шкал позволили получить объективные данные.
Статистический анализ проводился с использованием программного пакета Statistica 6.
Результаты и обсуждение
После коррекции ночных моторных симптомов БП в группе исследования отмечалось достоверное уменьшение их выраженности (p<0,05), определяемой по шкале комплексной оценки факторов, нарушающих сон при БП (табл. 2).
Динамика выраженности нарушений сна в основной группе до и после коррекции ночных симптомов представлена в табл. 3.
Таким образом, выявлено статистически достоверное уменьшение выраженности ночных симптомов БП, в том числе нарушений сна в основной группе после их коррекции (p<0,0001). Улучшение наблюдалось у 28,4% больных.
Выраженность дневной сонливости по шкале Epworth в основной группе после коррекции ночных симптомов БП уменьшилась с 9,3±3,9 до 7,2±2,6 балла (p<0,001).
Выраженность эмоциональных нарушений по шкалам депрессии и тревоги Гамильтона после коррекции ночных моторных симптомов БП уменьшилась на 28% (табл. 4).
По опроснику качества жизни PDQ-39 после коррекции ночных симптомов БП также наблюдалась положительная динамика показателей качества жизни у пациентов основной группы. Так, до коррекции оценка по PDQ-39 составляла 67,4±24,4 балла, после коррекции - 51,3±27,1 балла (улучшение на 24%, p<0,001).
Таким образом, в основной группе больных БП после коррекции ночных моторных симптомов трехкомпонентным препаратом сталево отмечалось достоверное улучшение показателей качества жизни по данным опросника качества жизни PDQ-39 (p<0,001), позволяющее сделать вывод, что ночные симптомы значительно ухудшают качество жизни пациентов с БП.
Таким образом, результаты исследования свидетельствуют о необходимости диагностики, оценки степени выраженности и комплексного лечения широкого спектра ночных симптомов, встречающихся у больных БП, что позволяет существенно улучшить показатели качества жизни и повседневной активности. Выраженность ночных симптомов зависит от клинической формы, степени тяжести и темпа прогрессирования БП. Ночные симптомы чаще всего проявлялись на развернутых стадиях БП и на 6-9-м году заболевания. Среди больных БП с акинетико-ригидной формой заболевания и более быстрым темпом прогрессирования ночные симптомы встречаются значительно чаще и наиболее выражены. Наличие в клинической картине БП ночных симптомов значительно увеличивает степень выраженности эмоциональных нарушений.
Широкий спектр ночных симптомов и их комбинаций у пациентов с БП требует индивидуального подхода к проведению корригирующей терапии. Назначение однократно перед сном трехкомпонентного препарата сталево на протяжении 3 мес пациентам с ночными симптомами БП приводило к статистически значимому уменьшению их выраженности, что позволяло значительно уменьшить эмоциональные расстройства, а также улучшить показатели повседневной активности и качества жизни больных БП.
Читайте также:
- Протезирование зубов мостовидными протезами. Изготовление, плюсы, минусы мостовидных протезов
- Дермоид конъюнктивы: признаки, гистология, лечение, прогноз
- Синдром Швахмана-Даймонда. Метафизариая хондродисплазия тип Мак-Кьюсика и гликогеноз
- Фазы жизнедеятельности при гинекологической операции. Метаболические нарушения после операции
- Жалобы на двоение в глазах. Ограничение движений глаза
