Диффузно-тензорная томография головного мозга - принципы, возможности
Добавил пользователь Алексей Ф. Обновлено: 21.01.2026
Диффузионная МРТ всего тела - разновидность ядерно-магнитной томографии, с помощью которой врач может детально изучить внутренние органы и структуры на клеточном уровне. Процедура не обеспечивает настолько высокой точности визуализации, как это дает прицельное исследование определенного участка тела, однако дает возможность обнаружить первичные и вторичные опухоли любой локализации. Диффузное МРТ обычно применяется в качестве дополнительной диагностической процедуры к традиционной магнитно-резонансной томографии. С его помощью врач может обнаружить самые незначительные изменения в исследуемом органе и поставить точный диагноз на ранних стадиях, когда прогнозы на успешное излечение максимально благоприятные.
Что такое диффузное МРТ
Диффузно-взвешенное МРТ предполагает использование определенных последовательностей магнитно-резонансной томографии, а также специального программного обеспечения, генерирующего изображение из поступающих данных, которые используют диффузию молекул воды для создания контрастного усиления в томографических изображениях.
Молекулы в живом организме находятся в беспрерывном движении, проникая сквозь мембраны клеток и обратно. Такой процесс перемещения и называется диффузией. Нормальный клеточный обмен молекулами воды имеет существенные отличия по сравнению с патологическим. При наличии любых изменения порядок диффузии нарушается. Клетки отдают воду медленнее, чем поглощают, в результате чего они увеличиваются в размерах и деформируются. Бывают и обратные ситуации - клетки отдают больше молекул воды, чем поглощают.
МРТ диффузия фиксирует показатели обмена молекулами воды в клетках различных тканей. врач-диагност сравнивает полученные результаты с нормой и на основании этих данных составляет протокол МРТ исследования, где фиксируются все нарушения и отклонения.
Что показывает МРТ-диффузия всего тела?
Чаще всего МРТ трактография применяется при острой ишемии головного мозга. МРТ диффузия головного мозга позволяет визуализировать ишемический некроз при инфаркте головного мозга. Изменение визуализируется как цитотоксический отек, проявляющийся в виде высокого сигнала МРТ-диффузии в течение нескольких минут после артериальной окклюзии.
Еще одна медицинская область применения МРТ-диффузии - онкология. Злокачественные новообразования в большинстве случаев являются высококлеточными. Они обеспечивают ограниченную диффузию воды, поэтому характеризуются относительно высокой интенсивностью сигнала МРТ. Такой вид ядерно-магнитной томографии часто используется для обнаружения, а также определения стадии опухолей. Процедура информативна при отслеживании реакции злокачественных клеток на лечение на протяжении определенного периода.
Другие области применения технологии:
- дифференциальная диагностика миелинопатий;
- прогноз постгипоксических поражений ЦНС;
- патологии ЛОР-органов: холестеатомы, паратонзиллярные абсцессы и пр.;
- болезни пищеварительного тракта воспалительной этиологии;
- очаговые поражения паренхиматозных органов.
Трактография спинного мозга назначается при наличии таких показаний:
- подозрение на первичные и метастатические опухоли;
- тяжелые травмы со смещением;
- инфаркт спинного мозга;
- аномалии развития сосудов;
- наследственные миелопатии;
- дегенеративно-дистрофические процессы;
- спондилез и пр.
Если на снимках томографии визуализируются участки, которые не соответствуют параметрам нормы, проводится повторное МРТ, с помощью которого врач сможет более летально изучить патологическую зону.
Диффузно - тензорное МРТ
Диффузно тензорное МРТ - единственный неинвазивный метод, с помощью которого врач может прижизненно изучить микроструктуру белого вещества головного мозга, а также количественно оценить полученные данные. С помощью диффузно-тензорного МРТ диагностируются такие нейродегенеративные патологии:
- рассеянный склероз;
- болезнь Альцгеймера;
- болезнь Паркинсона;
- эпилепсия.
Благодаря тензорной МРТ обнаруживаются изменения белого вещества головного мозга, которые не видны на изображениях традиционной магнитно-резонансной томографии.
Подготовка к диффузионной МРТ всего тела
Магнитно-резонансная диффузия головного мозга и других внутренних органов не требует специальной подготовки. За 1 - 2 дня до процедуры необходимо лишь отказаться от продуктов, способствующих обильному газообразованию. К таким относятся:
- бобовые;
- белокочанная капуста;
- жирные, жареные, копченые блюда;
- картофель;
- сырые овощи и фрукты;
- молочные и кисломолочные продукты;
- газированные напитки.
Также в этот период желательно воздержаться от употребления алкоголя. Специалисты центра «Патеро Клиник» рекомендуют проходить томографию натощак. Если на руках у пациента есть результаты ранее проведенных исследований, таких как УЗИ, рентгенография, желательно взять заключение с собой, чтобы врач-диагност смог сопоставить полученные данные.
Как проходит исследование
Перед диагностикой необходимо снять с себя все предметы, украшения, аксессуары, изготовленные из металла:
- украшения;
- заколки;
- очки, часы;
- съемный слуховой аппарат, зубные протезы;
- электронные устройства, в том числе и мобильный телефон.
Если в организме пациента есть протез, необходимо взять с собой документы, в которых указана вся информация о материале изделия.
Этапы проведения процедуры:
- Предварительная консультация у врача-диагноста, которых детально объяснит ход процедуры, ответит на все интересующие вопросы, исключит противопоказания.
- Если ограничения к исследованию отсутствуют, пациент в сопровождении медицинского персонала проходит в диагностический кабинет, где ему предлагается лечь на передвижной стол-платформу. Во время сканирования необходимо обеспечить полную неподвижность тела. для этого голова и конечности пациента фиксируются специальными ремнями.
- По завершении подготовительного этапа по команде диагноста стол медленно перемещается в тоннель томографа, где начинается послойное сканирование определенного участка. Работа томографа сопровождается звуковыми эффектами, поэтому пациент не должен переживать, если услышит щелчки и гул. В случае психоэмоционального перевозбуждения врач посоветует прибегнуть к медикаментозной седации.
- По окончании сканирования платформа выдвигается из капсулы томографа. На этом этапе диагностика завершена. Врач-диагност приступает к изучению полученных снимков и расшифровке результатов.
Результаты диффузионной МРТ
В результате сканирования в режиме диффузии получается большое количество изображений в трех взаимноперпендикулярных проекциях. Специалист детально изучает готовые снимки, сравнивая полученные показатели с параметрами здоровых тканей.
В завершении расшифровки составляется протокол МРТ головного мозга или других исследуемых органов. Заключение и диск с фотографиями выдаются пациенту на руки. Далее необходимо показать протокол МРТ врачу, который дал направление на диагностику. Если пациент обратился в клинику по собственному желанию, врач-диагност озвучит предварительный диагноз и объяснит, что делать дальше.
Сравнение с альтернативными методами исследования
Самым приближенным методом, который по своей сути похож на диффузионное МРТ является позитронно-эмиссионная томография, предусматривающая введение радионуклидного вещества, которое концентрируется в тканях, пораженных злокачественным процессом. Однако при ПЭТ-КТ на пациента оказывается лучевая нагрузка, которая при МРТ полностью отсутствует.
По сравнению с ПЭТ-КТ у диффузионной МРТ есть ряд других преимуществ:
- отсутствие необходимости введения посторонних препаратов;
- сравнительно небольшая стоимость;
- возможность выполнения сканирования в условиях свободного дыхания;
- получение подробной информации об исследуемом органе за один сеанс;
- возможность прибегать к процедуре необходимое количество раз.
Стоимость диффузной МРТ
Диффузионное тензорное изображение мозга
Широкий спектр МР-контрастных механизмов делает магнитно - резонасную томографию ( MRI) одним из самых мощных и гибких средств визуализации диагностики в центральной нервной системе. Измерение ослабления сигнала от диффузии воды является наиболее важным контрастным приемом. В частности, изображение тензора диффузии (DTI) можно использовать для отображения и характеристики трехмерной диффузии воды в зависимости от пространственного расположения волокон. Тензор диффузии описывает величину, степень анизотропии и ориентацию диффузионной анизотропии. Оценки структур связности белого вещества в мозге из трактов белого вещества могут быть получены с использованием диффузионной анизотропии и основных направлений диффузии. Приложения DTI быстро растут, потому что этот метод очень чувствителен к изменениям на клеточном и микроструктурном уровне. Новые последовательности импульсов и схемы кодирования тензора диффузии постоянно разрабатываются для улучшения пространственного разрешения и точности и уменьшения артефактов в измерениях диффузионного тензора.
Диффузионное тензорное изображение (DTI) является перспективным методом нейровизуализации мозга , которое проводится для характеристики микроструктурных изменений, диагностики и контроля эффективности терапии неврологических и психических расстройств. Тензор диффузии можно использовать для характеристики величины, анизотропии и ориентации волокон мозга. Общими параметрами DTI являются: средняя диффузия (MD), фракционная анизотропия (FA), радиальная диффузия (Dr) и осевая диффузия (Da). Эти параметры позволяют оценить разные характеристики волокон белого вещства мозга . FA очень чувствителен к изменениям микроструктуры, но не очень специфична к типу изменений (например, радиальному или осевому).
Диффузия воды в биологических тканях происходит внутри, снаружи, вокруг и через клеточные структуры. Распространение воды обусловлено прежде всего случайными тепловыми флуктуациями. Поведение воды далее модулируется взаимодействием с клеточными мембранами, субклеточными структурами и органеллами. Клеточные мембраны препятствуют диффузии воды, заставляя воду принимать более извилистые пути, тем самым уменьшая среднее квадратическое смещение.
Диффузионная извилистость и соответствующая кажущаяся диффузность могут быть увеличены либо за счет клеточного набухания, либо вследствие увеличенной клеточной плотностью. И наоборот, некроз, который приводит к разрушению клеточных мембран, уменьшает извилистость и увеличивает кажущуюся диффузность. Внутриклеточная вода имеет тенденцию быть более ограниченной клеточными мембранами.
В волокнистых тканях, включая белое вещество, диффузия воды происходит относительно беспрепятственно в направлении, параллельном ориентации волокна. И наоборот, диффузия воды сильно ограничена и затруднена в направлениях, перпендикулярных волокнам. Таким образом, диффузия в волокнистых тканях анизотропна. В экспериментах по ранней диффузионной визуализации использовались измерения параллельных ( D || ) и перпендикулярных ( D ⊥ ) диффузионных компонентов для характеристики диффузионной анизотропии. Применение тензора диффузии для описания анизотропного диффузионного поведения было введено P. Basser et al. (1994) В этой элегантной модели диффузия описывается многомерным нормальным распределением.
Наиболее распространенным методом диффузионно-взвешенной визуализации (DWI) является импульсная последовательность импульсного градиента, спин. эха (PGSE) с однократным считыванием эхо-планарного изображения (EPI). Простейшая конфигурация этой последовательности импульсов использует пару больших градиентных импульсов, расположенных с обеих сторон 180 ° -фокусирующего импульса. Первый градиентный импульс дефазирует намагниченность по образцу (или воксель при визуализации); а второй импульс - перефазирует намагниченность. Сигналы МРТ пропорциональны сумме компонентов намагниченности от всех молекул воды в вокселе. Таким образом, фазовая дисперсия от диффузии приведет к затуханию сигнала. Искажение изображения из-за неоднородностей магнитного поля приводит к тому, что анатомия мозга проявляется в нелинейном искажении в направлении фазового кодирования. Эти эффекты могут быть особенно серьезными в областях, расположенных вблизи границ кости / воздуха / мозга, таких как основание черепа, префронтальные области и нижняя височная доля вблизи слухового канала. К сожалению, почти все опубликованные исследования DW-EPI не используют коррекции искажений.
Существует ряд соображений, которые следует учитывать при составлении протокола тензора диффузии. Выбор протокола усложняется широким спектром параметров последовательности импульсов, которые необходимо настроить. Оптимальное диффузионно-взвешивающее (также называемое b-значением) для мозга составляет примерно от 700 до 1300 с / мм 2 с b-значением 1000 с / мм 2 и считается наиболее распространенным. Выбор количества направлений кодирования зависит от доступности наборов направлений кодирования, требуемого времени сканирования и максимального количества изображений, которые могут быть получены в серии. Измерения диффузионной анизотропии, как правило, весьма чувствительны к шуму изображения, что также может привести к смещениям в оценках анизотропии. Точность парматров DTI может быть улучшена путем увеличения количества направлений кодирования или увеличения количества средних значений. К сожалению, это увеличивает время сканирования для сбора данных DTI. Очевидно, что SNR изображения можно улучшить, используя более крупные воксели, хотя это увеличит частичное усреднение объема тканей, что может привести к ошибкам в соответствии с моделью диффузионного тензора. Конкретные параметры протокола будут зависеть от приложения. Для многих обычных клинических применений (скрининг мозга, инсульт, опухоли головного мозга) довольно небольшое пространственное разрешение может использоваться с небольшим количеством направлений кодирования.
Ориентация основного вектора тензора диффузии обычно предполагается параллельной локальным пучкам белого вещества. Эти диаграммы направленности могут быть просто визуализированы с использованием цветовых карт, представляющих основное направление собственного вектора . Эти цветовые карты очень полезны для исследования организации белого вещества в головном мозге и для идентификации основных участков белого вещества в 2D-средах. Еще один подход к оценке схем соединения белого вещества в 3D - это использование тракта по белому веществу, которое следует за когерентными пространственными структурами в основных собственных векторах поля диффузионного тензора. Модели белого вещества оцениваются путем запуска в определенном месте (также называемого «точкой семян»), оценивая направление распространения (часто определяемое как основной собственный вектор) и перемещая на небольшое расстояние в этом направлении (называемое интеграцией трактов). Затем направление тракта пересматривается и берется другой небольшой шаг, и так далее, пока тракт не закончится. Тракты могут быть ограничены использованием одной или нескольких областей, представляющих интерес. Большинство алгоритмов используют основной собственный вектор для оценки касательной траектории для пучка волокон белого вещества, хотя также были разработаны методы трассировки, основанные на полном поле тензора диффузии. Используя эти методы, алгоритмы трактографии способны генерировать анатомически правдоподобные оценки траекторий белого вещества в мозге человека. Методы трактографии были использованы для генерации анатомически правдоподобных реконструкций путей основных проекционных путей (например, кортико - спинального тракта, ), межполушарных путей (например, мозолистого тела, передней комиссуры) и ассоциациативных путей (например, дугообразный фасцикул, нижний продольный фасцикул и т. д.). На сегодняшний день первичными приложениями трактографии являются визуализация траекторий белого вещества (WМ) в 3D (особенно в отношении патологии мозга) и сегментация конкретных областей мозга.
Однако интерпретация изменений в измеренном тензоре диффузии является сложной и должна выполняться с осторожностью. Во многих исследованиях основное внимание уделяется диффузионной анизотропии (обычно мера FA), которой может быть недостаточно, чтобы охарактеризовать изменения ткани. Например, невропатология белого вещества (WM) часто приводит к уменьшению анизотропии, что может быть результатом либо увеличенной радиальной (перпендикулярной) диффузии, либо уменьшенной осевой (параллельной) диффузии. Измерения MD или следа могут помочь лучше понять, как изменяется тензор диффузии. В качестве альтернативы, в более поздних исследованиях начали изучать измерения как собственных значений, так и радиальной и осевой диффузий непосредственно для получения более конкретной информации о тензоре диффузии/
При отсутствии другой информации FA является высокочувствительным, но довольно неспецифическим биомаркером неврологических и психических расстройств и микроструктурной архитектуры. Это создает проблемы для интерпретации измерений DTI при диагностических и терапевтических задачах. Многие исследования предполагают, что FA является маркером так называемой целостности белого вещества. Результаты могут быть интерпретированы с большей специфичностью. Например, демиелинизация может привести к увеличению радиальной диффузии с минимальным влиянием на осевую диффузию.
Магнитно-резонансная томография с диффузионным тензором (DTI)
Магнитно-резонансная томография с диффузионным тензором (DTI) - относительно новая технология, используемая для визуализации белого вещества мозга.
Тензор диффузии первоначально был предложен для использования при магнитно-резонансной томографии (МРТ, MRI) в работах Питера Бассера ( Peter Basser) в 1994 году. До DTI диффузионная МРТ развивалась из исследований в диффузионном ядерном магнитном резонансе. До введения модели тензора диффузии для измерения анизотропной диффузии необходимо было определить ориентацию аксонов в образце ткани, поэтому можно было сканировать только фиксированные образцы. Внедрение модели тензора диффузии впервые позволило получить вращательно-инвариантное описание формы диффузии воды. Инвариантность к вращению имеет здесь решающее значение, поскольку она позволила применить метод DTI к сложной анатомии волоконных путей в мозге человека, однако, тензор диффузии не в состоянии полностью описать пересечение волоконных трактов.
Популярность DTI была огромной. Эта техника визуализации была применена к огромному разнообразию нейрофизиологических исследований разных неврологических и психических расстройств, включая шизофрению , травматическое повреждение головного мозга , рассеянный склероз , аутизм , процессы развития мозга и его старения. Были проведены анатомические исследования, касающиеся, например, структуры сети речи, асимметрии белого вещества у близнецов и братьев и сестер, местоположения, асимметрии и изменчивости волоконных трактов. Недавние исследования попытались смоделировать человеческое «соединение», проанализировав структурную и функциональную связь мозга, измеренную DTI и функциональной МРТ. DTI также применяется для планирования нейрохирургических операций и навигации. Добавление предоперационной DTI к нейронавигации было показано в большом исследовании с целью уточнения границ резекции и выживаемости опухоли и снижения неврологических расстройств.
DTI - чувствительный зонд клеточной структуры, который работает путем измерения диффузии молекул воды. Измеряемая величина представляет собой коэффициент диффузии или константу пропорциональности, которая связывает диффузионный поток с градиентом концентрации и имеет свои единицы измерения.
В отличие от диффузии в стакане чистой воды, которая была бы одинаковой во всех направлениях (изотропная), диффузия, измеренная в ткани, изменяется в зависимости от направления (анизотропная). Измеренная макроскопическая диффузионная анизотропия обусловлена микроскопической неоднородностью тканей . В белом веществе мозга диффузионная анизотропия обусловлена прежде всего клеточными мембранами с некоторым вкладом от миелинизации и упаковки аксонов. Анизотропная диффузия может указывать на основную ориентацию ткани.
Тензор диффузии (DT) описывает диффузию молекул воды с использованием гауссовой модели. Технически он пропорционален ковариационной матрице трехмерного гауссова распределения, которая моделирует смещения молекул. DT представляет собой 3 × 3 симметричную положительно определенную матрицу, и эти свойства матрицы означают, что она имеет 3 ортогональных (взаимно перпендикулярных) собственных вектора и три положительных собственных значения. Основной собственный вектор тензора диффузии указывает на основное направление диффузии (направление самой быстрой диффузии). В анизотропных волокнистых тканях основной собственный вектор также определяет ось волоконного тракта ткани и, следовательно, три ортогональных собственных вектора можно рассматривать как локальную систему координат волокон. Для измерения диффузии с использованием МРТ градиенты магнитного поля используются для создания изображения, которое сенсибилизируется к диффузии в определенном направлении. Повторяя этот процесс диффузионного взвешивания в нескольких направлениях, можно оценить трехмерную диффузионную модель (тензор). В упрощенных выражениях диффузионная визуализация работает путем введения дополнительных градиентных импульсов, эффект которых «отменяет» для стационарных молекул воды и вызывает случайный сдвиг фазы для молекул, которые диффундируют. Из-за их случайной фазы сигнал от рассеивающих молекул теряется. Эта потеря сигнала создает более темные воксели (объемные пиксели). Это означает, что волокна белого вещества, параллельные направлению градиента, будут темными в диффузионно-взвешенном изображении для этого направления.
DTI обычно отображается путем уплотнения информации, содержащейся в тензоре, на одно число (скаляр) или на 4 числа (чтобы дать цвет R, G, B и значение яркости). Тензор диффузии можно также рассматривать с помощью глифов, представляющих собой небольшие трехмерные представления основного собственного вектора или целого тензора. Наконец, DTI часто просматривается путем оценки хода участков белого вещества через мозг через процесс, называемый трактографией.
Для трактографии предложено много методов, и результаты будут сильно различаться в зависимости от выбранного метода. Наиболее распространенным подходом является упрощенная трактография, которая тесно связана с более ранним методом визуализации тензорных полей, известных как гипертонические линии. Этот метод вырабатывается как выходные дискретные кривые или траектории, которые также называются «трактами», «волокнами», «следами». Несколько вычислительных методов могут быть использованы для выполнения базовой рационализации тракта. К ним относятся метод Эйлера (по собственному вектору или касательной для фиксированного размера шага), второй порядок Рунге-Кутта (также известный как метод средней точки, где тангенс соблюдается на полшага, затем вычисляется новая касательная в середине интервал и используемый для выполнения полного шага) и четвертый порядок Рунге-Кутта (где при каждом шаге используется взвешенное среднее из четырех оцененных касательных к кривой) . Обработка данных DTI для отображения интересующего оптического тракта (ов) требует экспертных знаний или автоматического алгоритма. После выполнения упрощенной трактографии представляющие интерес траектории волокна могут быть интерактивно выбраны путем «виртуального рассечения», где области включения / исключения определены и используются для выбора траекторий. Также были разработаны автоматизированные методы сегментации трактата на основе атласа, которые используют предварительные знания для выбора траекторий.
В дополнение к упрощенной трактографии существует много других методов . Несколько отобранных примеров включают вероятностную трактовку, которая выводит преимущества или вероятности соединения , методы оптимизации, которые используют теорию графов или физические модели, методы развития региона и эволюции волнового фронта , трактографирование с использованием передовых моделей для и методы метаанализа трактографии, которые выполняют кластеризацию или установку более сложных моделей трактов.
Методы трактографии могут приводить к ложноположительным и ложноотрицательным результатам , однако важно отметить, что клинические валидации рациональной трактографии продемонстрировали точную реконструкцию (истинные положительные результаты). Конечные точки тракта, особенно кортикоспинального или моторного тракта, сравнивались с электрокортикальной стимуляцией в нейрохирургии с хорошим соответствием.
Измеренные диффузионные эффекты усредняются по вокселю (трехмерный пиксель), что усложняет биофизическую интерпретацию тензора диффузии. Например, в научных исследованиях FA часто интерпретируется как «целостность белого вещества», однако многие факторы (например, гибель клеток, изменение миелинизации, увеличение внеклеточной или внутриклеточной воды и т. д.) могут вызывать изменения в FA. Чтобы дать представление о сложности человеческого мозга и размерах / временных масштабах эксперимента по диффузионной визуализации, перечисляет соответствующие количества, такие как количество нейронов в головном мозге (10 11 ) и расстояние, на котором вода диффундирует во время эксперимента по визуализации (1-15 мкм, расстояние, аналогичное диаметру аксона).
Значительная часть WM-вокселей в мозге содержит множественные пучки волокон, ориентированные в разных направлениях, где модель тензора диффузии не является надежной.
Новые диффузионные модели, сканирующие парадигмы и методы анализа постоянно разрабатываются для диффузионной МРТ. Диффузионное изображение с высоким угловым разрешением (HARDI) включает методы, которые получают данные диффузии с использованием более чем 6 направлений диффузии (например, 32 или выше). Эти методы обычно используют более высокое значение b, чем стандартное значение 1000 для DTI и / или несколько значений b (несколько «оболочек» данных). Предлагались модели диффузии, выходящие за пределы DTI, для извлечения важных биомаркеров, таких как компартментализация и диаметром аксона. Предложено расширить модели тензора более высокого ранга, чтобы расширить DTI. Было показано, что использование множественных пар диффузионных градиентов (двойной импульсной полевой диффузионной МРТ) повышает чувствительность к малым масштабам. Диффузионный анализ МРТ был полезен при внедрении новых методов трактографии, созданы многие типы атласов белого вещества, усовершенствованны методы количественной оценки результатов исследований и новые скалярные меры.
Диффузионно-тензорное сканирование головного мозга
Диффузионно тензорное сканирование головного мозга − это способ визуализации головного мозга с использованием магнитно-резонансного томографа. Метод разработан в середине 90-х годов прошлого столетия.
Основные понятия:
Диффузия − процесс движения ионов в живых клетках или тканях. Она ограничивается препятствиями, например, стенками клеток или нейронными трактами (белые волокна головного мозга).
Анизотропия − направленность диффузии воды.
Тензор диффузии − элемент диффузионно-тензорной томографии. Представляет собой описание диффузии в трехмерном изображении.
Трактография − метод визуализации хода нервных трактов, в результате которого получается изображение проводящих путей белого вещества.
Воксель − пространственный элемент, имеющий числовое значение.
Получение изображения
Диффузионно-тензорное изображение получается при измерении диффузии воды в каждом пространственном участке (вокселе). На основании изображения формируется матрица, содержащая 3 числовых значения и 3 вектора, описывающих направление диффузии воды в выбранном участке тканей. Диффузионно-тензорная томография визуализирует структурные связи между отделами и зонами головного мозга, отображает строение белого вещества головного мозга (аксонов нейронов, собранных в пучки).
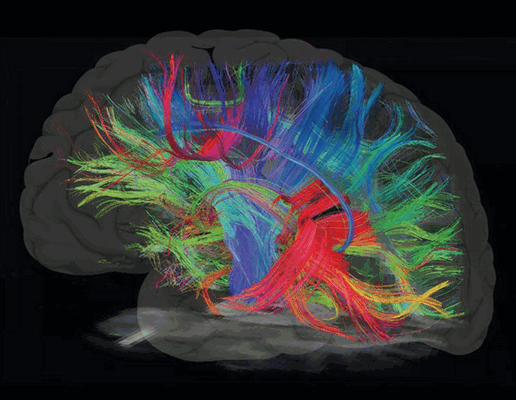
Проводящие пути головного мозга
Показания к исследованию
Показаниями к диффузионно-тензорному исследованию являются:
● подозрения на опухоли, черепно-мозговую травму;
● демиелинизирующие заболевания;
● ишемические повреждения тканей головного мозга, подозрение на инсульт;
● врожденные аномалии головного мозга;
● рассеянный склероз.
Использование диффузионно-тензорного сканирования в психиатрической практике
Конечно, в рутинной практике психиатрии диффузно-тензорное сканирование не используется, но для врача-психиатра важно знать, какие связи между зонами головного мозга пострадали, и механизмы их повреждения: ишемический, демиелинизирующий, воспаление. Эти данные помогают диагностировать психическое заболевание,
выбрать и назначить лечение, направленное на причину и патогенез заболевания, определить прогноз и сроки терапии.
Диффузно-тензорное изображение позволяет точно поставить диагноз при:
● обсессивно-компульсивном расстройстве;
● болезни Альцгеймера и других видах старческого слабоумия (деменции);
● шизофрении;
● расстройствах аутистического спектра;
● депрессивных расстройствах;
● биполярном аффективном расстройстве. И ряде других заболеваний, где нужно оценить состояние белого вещества головного мозга.
При исследовании используются магнитно-резонансные томографы, имеющие силу поля 1,5-3 Тесла. Изображение получают с помощью специализированного программного обеспечения. В результате получаются векторные карты, где направление диффузии молекул воды имеет свой цвет:
1. Красный: вода движется “вправо-влево”.
2. Зеленый - “вперед-назад”.
3. Синий- “вверх-вниз”.
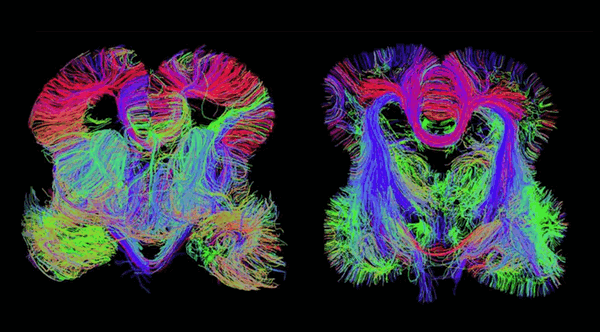
В клинике доктора медицинских наук В.Л. Минутко в основе лечения лежат объективные критерии диагностики психических заболеваний. Диагноз ставится не только на основе жалоб, расспросов родственников, оценки с помощью специальных шкал, но и с помощью лабораторных и инструментальных методов, в том числе и диффузно-тензорного сканирования, которое позволяет исследовать участки белого вещества и структурно-функциональные отношения между зонами головного мозга.
Объективизация диагностики приводят к лучшим результатам лечения, чем синдромальная диагностика и назначение препарата методом проб и ошибок.
Следует отметить, что диффузионно-тензорная томография доступна в научных учреждениях, но не доступна в бюджетной сфере медицины и не входит в стандарты обследования психических больных, но допустим в нейрохирургии, трактография помогает минимизировать риски оперативного вмешательства, облегчает предоперационное планирование, помогает прояснить сдавливает ли опухоль соседнюю ткань, или повреждает белое вещество головного мозга.
А будущее психиатрии за объективизацией постановки диагноза, в том числе и с помощью диффузионно-тензорной томографии.
Также, Вам могут быть интересны следующие статьи нашего сайта:
Диффузно-тензорная томография головного мозга - принципы, возможности
ФГБУ "Научно-исследовательский институт глазных болезней" РАМН, Москва
ФГБНУ «НИИ глазных болезней», ул. Россолимо, 11, А, Б, Москва, Российская Федерация, 119021
Институт клинической кардиологии им. А.Л. Мясникова ФГБУ «НМИЦ кардиологии» Минздрава России, Москва, Россия
Диффузионно-тензорная магнитно-резонансная томография в диагностике нейродегенеративных изменений зрительного пути при глаукоме
Журнал: Вестник офтальмологии. 2015;131(2): 59‑63
Цель — изучение с помощью диффузионно-тензорной магнитно-резонансной томографии (ДТ МРТ) состояния зрительного пути у пациентов с глаукомой. Материал и методы. ДТ МРТ была проведена 16 пациентам: 12 — с диагнозом первичной открытоугольной глаукомы различных стадий (основная группа) и 4 пациентам без офтальмологической патологии (контрольная группа). Для оценки состояния наружного коленчатого тела (НКТ) и зрительной лучистости использовали параметры фракционной анизотропии (ФА) и продольной изменчивости фракционной анизотропии (ΔФA), определяемые с помощью оригинальной программы «Анализатор фракционной анизотропии». Всем пациентам также выполняли оптическую когерентную томографию (ОКТ) сетчатки и зрительного нерва, ретинотомографию зрительного нерва (HRT) и статическую автоматическую периметрию (САП) на аппарате Humphrey. Результаты. Выявлено достоверное снижение параметра ФА у пациентов с глаукомой по сравнению с аналогичным параметром в группе контроля (медианы значений 0,74 и 0,77 соответственно, р
Глаукома — одна из наиболее важных медико-социальных проблем офтальмологии. В России доля глаукомы в нозологической структуре слепоты и слабовидения возросла за 5 лет с 14 до 29% [1]. Столь угрожающая статистика свидетельствует о серьезных трудностях, связанных с пониманием природы глаукомы, а следовательно с диагностикой и лечением этого заболевания.
Ключевым моментом развития глаукомной оптической нейропатии является гибель ганглиозных клеток сетчатки (ГКС) и их аксонов под действием повышенного внутриглазного давления [2]. Около 70% волокон зрительного тракта, формируя ретиногеникулярные пути, заканчиваются в наружном коленчатом теле (НКТ). Таким образом, можно предположить, что НКТ и первичная зрительная кора также вовлечены в патологический процесс. По данным литературы и результатам наших собственных исследований, при глаукоме маркеры нейродегенерации обнаруживаются в центральных отделах зрительного анализатора [3—6].
In vivo атрофию зрительных путей можно диагностировать с помощью магнитно-резонансной томографии (МРТ). В литературе приводятся данные об уменьшении диаметра ретробульбарной части зрительного нерва у пациентов с глаукомой [7—8]. Также описаны атрофические изменения НКТ [9], уменьшение плотности серого вещества мозга в затылочной области, коррелирующее с результатами статической периметрии [10].
Оценить состояние ретробульбарной части зрительного нерва, зрительной лучистости, НКТ и зрительной коры у пациентов с глаукомой стало возможным с появлением методики диффузионно-тензорной магнитно-резонансной томографии (ДТ МРТ). Этот метод нашел широкое применение в диагностике рассеянного склероза [11, 12], инсультов различной локализации [13], болезни Альцгеймера [14]. Основан он на измерении величины и направления диффузии молекул воды в веществе мозга. ДТ МРТ позволяет провести количественную оценку состояния проводящих путей головного мозга, а также создать их трехмерную реконструкцию, обнаружить и определить повреждение волокон белого вещества. Основным параметром, получаемым при ДТ МРТ, является фракционная анизотропия (ФА) — величина, отражающая «направленную» организацию структур головного мозга и их целостность [12].
Исследуя зрительный нерв методом ДТ МРТ в эксперименте на крысах в 2007 г., Е. Hui показал уменьшение ФА в случае с глаукомой [15]. Примечательно, что гистологическое исследование подтвердило уменьшение количества аксонов ГКС в зрительном нерве в препаратах пораженного глаза. По данным современной литературы, при проведении ДТ МРТ у пациентов с глаукомой по сравнению с результатами в группе контроля отмечено уменьшение параметра ФА в области зрительного нерва, НКТ и зрительной лучистости [16—20]. В работе F. Garaci [18] была установлена обратная корреляция параметра ФА и стадии глаукомы. В исследовании G. Michelson [19] доказана достоверная корреляция толщины перипапиллярных нервных волокон и Ф.А. Таким образом, изменение индексов ДТ МРТ у пациентов с глаукомой может свидетельствовать об аксональной дегенерации на уровне центральной нервной системы (ЦНС) и атрофии проводящих путей зрительного анализатора.
Однако на настоящий момент нет убедительных данных о соответствии изменений в ЦНС, определяемых с помощью МРТ, структурным и функциональным изменениям сетчатки и зрительного нерва у больных с глаукомой.
Цель настоящей работы — изучение нейродегенеративных изменений НКТ и зрительной лучистости при глаукоме с помощью метода ДТ МРТ.
Материал и методы
В клиническое исследование вошли 16 пациентов в возрасте от 61 до 78 лет (средний возраст 72 года), которые были разделены на 2 группы по нозологическому принципу. В основную группу включены 12 пациентов с первичной открытоугольной глаукомой (ПОУГ) различных стадий, в группу контроля — 4 пациента без офтальмологической патологии. Клинико-демографическая характеристика пациентов представлена в табл. 1. МРТ выполняли на магнитно-резонансном томографе Magnetom Avanto («Siemens», Германия) с величиной индукции магнитного поля 1,5 Тл.
Таблица 1. Клинико-демографическая характеристика пациентов, обследуемых при помощи ДТ МРТ
Все стандартные исследования проводили в аксиальной и сагиттальной плоскостях с толщиной срезов 5 мм и межсрезовым интервалом 1,5 мм. Обследование головного мозга включало в себя как стандартные (T1, T2, MPR), так и специальные режимы (диффузионно-взвешенные изображения с построением карт дифузионно-тензорной трактографии). Полученные данные переносили на рабочую станцию Syngo Siemens, где на сгенерированных картах фракционной анизотропии у каждого больного вручную были выделены симметричные области интереса, соответствующие расположению НКТ и зрительной лучистости. Полученные таким методом значения ФА при трехкратном выделении у одного пациента имели сильный разброс. Учитывая небольшую группу исследования и недостоверность получаемых данных, перед нами встала задача разработки метода объективной оценки ФА у пациентов с ПОУГ.
В НИИ глазных болезней была разработана собственная программа по обработке данных ДТ МРТ «Анализатор фракционной анизотропии». Программа автоматически по характеру вокселей в аксиальной проекции распознает зону, имеющую преимущественно дорсовентральную направленность. Исследователь грубо задает границы протяженности исследуемого объекта. После этого программа выделяет ряд профилей, поперечных к исследуемой структуре (X1, X2, X3 … Xn), и находит в каждом профиле воксель с максимальным значением абсолютной анизотропии. Совокупность выявленных в каждом профиле вокселей используется для статистического описания ФА всего объекта.
В конечном итоге значения ФА и ΔФA, определяемые в трех срезах (12, 13 и 14) для НКТ и зрительной лучистости каждого из полушарий, заносили в таблицу Microsoft Exel 2010 и проводили статистическую обработку.
Всем пациентам выполняли статическую автоматическую периметрию (САП) на анализаторе полей зрения Humphrey Visual Field Analyzer II (HFA II) 750 i («Carl Zeiss», Германия) по пороговым программам 30−2 и 60−4. Морфометрические параметры зрительного нерва вычисляли с помощью лазерной сканирующей ретинотомографии на аппарате HRT III. Также выполняли оптическую когерентную томографию (ОКТ) сетчатки и зрительного нерва на аппарате RTVue — 100 («Optovue», США), используя протоколы MM5, GCC, ONH и RNFL.
Статистический анализ и оценку получаемых результатов проводили с помощью программы Statistica 8.0. При сравнении двух независимых групп по количественному признаку использовали U-критерий Манна—Уитни. Взаимосвязи между показателями оценивали с помощью рангового анализа корреляции двух признаков по Спирмену.
Результаты и обсуждение
С использованием разработанной нами программы «Анализатор фракционной анизотропии» были вычислены 2 параметра: ФА и изменчивость ФА (ΔФA) для правого и левого НКТ и зрительной лучистости в трех срезах (12, 13 и 14). Уменьшение Ф.А. и увеличение ΔФA расценивали как критерии нарушения целостности проводящих путей вследствие нарушения аксонального транспорта.
При статистической обработке полученных данных было выявлено достоверное снижение ФА в нижнем срезе (ФA 14) у пациентов с глаукомой по сравнению с аналогичным показателем в группе контроля (медианы значений 0,74 и 0,77 соответственно, р
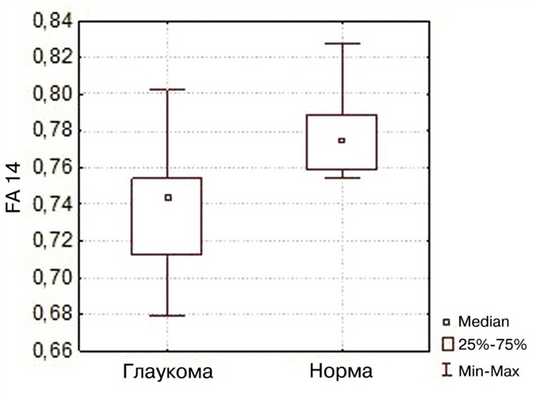
Сравнение параметра фракционной анизотропии НКТ и зрительной лучистости (нижний срез) в группе с ПОУГ и группе контроля.
Был произведен попарный корреляционный анализ во всех срезах раздельно для каждого глаза. В качестве весового параметра, показывающего среднюю значимость связей, были взяты средние абсолютные значения корреляции по Пирсону для структур мозга со всеми морфометрическими параметрами. При сопоставлении результатов ДТ МРТ и данных офтальмологического обследования (статическая периметрия, HRT, ОКТ) нами была выявлена следующая закономерность: ФA и ΔФA, измеренные в среднем срезе каждого из полушарий (ФА 13 и ΔФA 13), коррелировали с показателями ипсилатерального глаза; ФA и ΔФA, измеренные в нижнем срезе каждого из полушарий (ФA 14 и ΔФA 14), коррелировали с показателями контралатерального глаза. Обнаруженные закономерности позволили нам говорить о топографии перекрещенных и неперекрещенных волокон зрительного тракта в НКТ и зрительной лучистости по результатам ДТ МРТ и ожидать соответствующей взаимосвязи морфофункциональных, морфометрических параметров сетчатки и зрительного нерва и параметров ДТ МРТ.
При проведении корреляционного анализа Спирмена была установлена средняя и сильная значимая корреляция ΔФA 14 и стадии глаукомы, средней толщины комплекса ГКС (GCC Average), индексов FLV и GLV, толщины перипапиллярных нервных волокон (RNFL Average) (по данным ОКТ), площади НРП (по данным HRT), индексов MD и PSD (по данным САП). Результаты приведены в табл. 2 и 3 для правого и левого глаза соответственно.
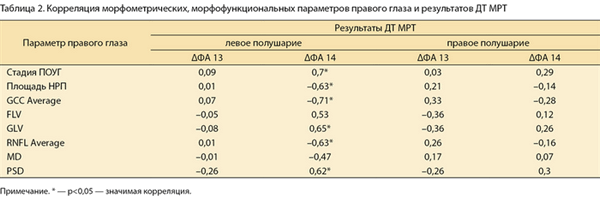
Таблица 2. Корреляция морфометрических, морфофункциональных параметров правого глаза и результатов ДТ МРТ Примечание. * — р
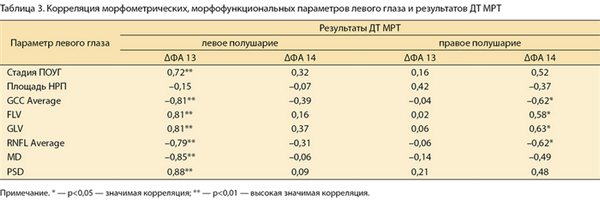
Таблица 3. Корреляция морфометрических, морфофункциональных параметров левого глаза и результатов ДТ МРТ Примечание. * — р
Таким образом, можно говорить о статистически достоверной связи параметра ΔФА, определяемого с помощью ДТ МРТ, и морфометрических, морфофункциональных параметров, определяемых с помощью HRT, ОКТ и САП при глаукоме. Высокая корреляция между параметром ΔФA и стадией глаукомы свидетельствует о распространении нейродегенеративного процесса на зрительные центры при прогрессировании заболевания.
Заключение
Снижение ФА наружного коленчатого тела и зрительной лучистости у пациентов с глаукомой можно расценивать как показатель аксональной дегенерации на уровне зрительных центров. Полученные нами высокая и средняя корреляции продольной изменчивости ФА и морфометрических, морфофункциональных параметров сетчатки и зрительного нерва служат подтверждением взаимосвязи изменений, происходящих на уровне глаза, и изменений, регистрируемых в зрительных центрах. Таким образом, с помощью ДТ МРТ in vivo можно определить распространение нейродегенеративного процесса на структуры ЦНС при прогрессировании глаукомы.
Читайте также:
