Доступ и ход операции портокавального шунтирования бок в бок
Добавил пользователь Алексей Ф. Обновлено: 22.01.2026
РНЦХ им. акад. Б.В. Петровского РАМН
Первый МГМУ им. И.М. Сеченова;
Московский НИИ педиатрии и детской хирургии
клиника аортальной и сердечно-сосудистой хирургии Первого Московского государственного медицинского университета им. И.М. Сеченова, Москва, Россия
Маммарокоронарное и аутовенозное подключично-коронарное шунтирование из левосторонней торакотомии
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2016;(4): 4‑10
История хирургической реваскуляризации миокарда началась с маммарокоронарного шунтирования из левосторонней торакотомии, т. е. с методики, известной в наши дни как MIDCABG (Minimally Invasive Direct Coronary Artery Bypass Grafting) [3, 4].
В названии MIDCABG практически полностью представлены технические особенности метода - миниинвазивный доступ и наложение анастомоза под контролем зрения, выполнение операции как на работающем сердце, так и с применением искусственного кровообращения.
В настоящее время именно маммарокоронарный анастомоз с передней межжелудочковой ветви (ПМЖВ) считается «золотым стандартом» и показателем высочайшего качества проведения операции прямой реваскуляризации миокарда.
Маммарокоронарное шунтирование при изолированном поражении ПМЖВ является операцией выбора ввиду того, что стентирование ее проксимального отдела при однососудистом поражении не всегда технически возможно и имеет несколько худшие отдаленные результаты [2].
Немаловажным фактором, способным уменьшить количество послеоперационных осложнений после маммарокоронарного шунтирования, является возможность выполнения этой операции из левосторонней торакотомии, без распиливания грудины, без нарушения каркасной функции грудной клетки и риска несостоятельности шва грудины, а самое главное, без искусственного кровообращения [1].
При выполнении маммарокоронарного шунтирования из левосторонней торакотомии мы соблюдаем все необходимые условия для наложения качественного анастомоза - используем оптическое увеличение, вакуумный или компрессионный стабилизатор миокарда и формируем анастомоз под контролем зрения [2].
Таким образом, из минимального разреза и без искусственного кровообращения возможно выполнить реваскуляризацию миокарда с хорошим непосредственным и отдаленным результатом как первично, так и у пациентов с дисфункцией наложенного ранее шунта к ПМЖВ [5, 7, 8].
С учетом возрастающего интереса к гибридным вмешательствам маммарокоронарное шунтирование из левосторонней торакотомии может быть одним из этапов такого лечения. Например, первым этапом пациенту выполняем маммарокоронарный анастомоз из левосторонней торакотомии с последующим стентированием коронарной артерии другого бассейна, стентированием аорты или проведением имплантации транскатетерного аортального клапана [6].
Показания к маммарокоронарному шунтированию из левосторонней торакотомии:
1. Хроническая окклюзия ПМЖВ.
2. Стеноз проксимального отдела ПМЖВ более 75%, не пригодный для ангиопластики со стентированием.
3. Двухсосудистое поражение: стеноз ПМЖВ более 75% с непротяженным локальным сужением (более 65%) огибающей или правой коронарной артерии.
4. Многососудистое поражение со стенозом проксимального отдела ПМЖВ более 75% и диффузным дистальным поражением других коронарных бассейнов.
Оптимальным для выполнения маммарокоронарного шунтирования из левосторонней торакотомии, по нашему мнению, является следующее:
1. Проксимальная окклюзия или критический стеноз ПМЖВ и/или диагональной ветви (ДВ).
2. Диаметр ПМЖВ не менее 1,75-2,00 мм, без кальциноза и дистального поражения.
3. Сохранная насосная функция сердца без больших рубцовых поражений передней стенки, верхушки и межжелудочковой перегородки.
4. Заболевания, при которых имеются противопоказания к срединной стернотомии, - тяжелый сахарный диабет, тяжелое течение хронической обструктивной болезни легких (ХОБЛ), выраженное ожирение.
1. Воспалительные заболевания левого легкого и плевры.
2. Сомнительное состояние ПМЖВ - кальциноз, глубокое интрамиокардиальное расположение, малый диаметр.
3. Атеросклероз подключичных артерий со стенозированием в первом сегменте 50% и более.
4. Окклюзия подвздошных артерий с крупными коллатералями из системы внутренней грудной артерии (ВГА).
Количество дистальных анастомозов при операции из левосторонней торакотомии обычно не превышает 1-2, хотя некоторые авторы сообщали о секвенциальном шунтировании 3 коронарных артерий.
Техника операции. Пациента укладываем на правый бок с валиком под левой половиной грудной клетки под углом около 45°, левую руку, согнутую в локтевом суставе, фиксируем над головой пациента.
Мы рекомендуем оставить обработанным левый треугольник Скарпы для подключения периферического искусственного кровообращения и/или проведения внутрибаллонной аортальной контрпульсации в случае необходимости. У пациентов крайне высокого риска допустима превентивная постановка интродьюсеров в бедренные сосуды или выполнение операции в условиях параллельного периферического искусственного кровообращения.
Учитывая ограниченный размер хирургического доступа, следует предусмотреть возможность использования наружного дефибриллятора или дефибриллятора с одним наружным электродом.
После обработки грудной клетки пациента операционное поле заклеиваем хирургической пленкой с обязательной визуализацией ключицы, грудины, яремной вырезки, эпигастральной области и передней подмышечной линии.
В зависимости от конституциональных особенностей пациента и предполагаемого места наложения дистального анастомоза выполняем переднюю торакотомию в четвертом или пятом межреберье длиной от 7 до 10 см, медиальный край разреза начинаем по парастернальной линии.
При выполнении торакотомии следует избегать излишней травматизации тканей. Для дополнительного расширения доступа в случае необходимости можно аккуратно отсечь хрящевую часть V и/или VI ребра от грудины. Существует несколько модификаций специальных ретракторов для мобилизации внутренней грудной артерии (ВГА) из торакотомного доступа, но можно с успехом использовать обычный малый торакальный расширитель.
Однолегочная интубация может оказаться необходимой при выраженной эмфиземе, но обычно этого не требуется.
Применение налобного света с мощной лампой крайне желательно при мобилизации левой ВГА из левосторонней торакотомии. Для манипуляций при ее мобилизации могут потребоваться инструменты длиной 25-30 см.
Легкое отводим тупфером латерально и вниз, после чего визуализируем левую ВГА. Ее мобилизацию удобнее сначала провести в каудальном, а затем в краниальном направлении на протяжении от шестого-седьмого межреберья до подключичной артерии по методике полной скелетизации.
После введения полной дозы гепарина (300 ЕД/кг) производим клипирование и отсечение ВГА в дистальном направлении и ее дилатацию 2% раствором папаверина (1 мл в 30 мл 0,9% раствора натрия хлорида) c помощью шприца с ограничением давления до 100 мм рт.ст.
Следующим этапом оцениваем гемостаз и проводим визуальный контроль для выявления возможных дефектов ВГА (травма, отслоение интимы, гематомы). На короткое время снимаем зажим с проксимального конца ВГА и вводим 3-5 мл 2% раствора папаверина в подключичную артерию. Убедившись в хорошей пульсации, наличии удовлетворительного свободного кровотока и качественного гемостаза, клипируем дистальный конец ВГА. Эту артерию с целью профилактики ее спазма накрываем салфеткой, пропитанной 2% раствором папаверина, которую сохраняем до микрохирургического этапа операции.
Перикард вскрываем в продольном направлении медиальнее прохождения левого диафрагмального нерва, предварительно удалив жировые подвески. Края перикарда прошиваем швами-держалками, обычно по 3 на каждую сторону. Проводим ревизию сердца и выбираем оптимальное место для наложения дистального анастомоза ВГА с ПМЖВ.
В случае необходимости есть возможность немного улучшить экспозицию ПМЖВ, для этого следует произвести тракцию в дистальном и проксимальном направлении за швы-держалки, проведенные под ПМЖВ.
Место наложения дистального анастомоза с ПМЖВ фиксируем вакуумным или компрессионным стабилизатором миокарда. Артериотомию выполняем скальпелем с лезвием № 11, далее расширяем разрез до необходимого размера микрохирургическими ножницами.
Обязательно проверяем проходимость артерии бужом в дистальном направлении. В случае появления признаков ишемии миокарда или нарушения ритма сердца немедленно осуществляем установку временного внутрипросветного шунта максимально возможного диаметра. По стандартной методике накладываем маммарокоронарный анастомоз нитью пролен 8/0 (рис. 1).
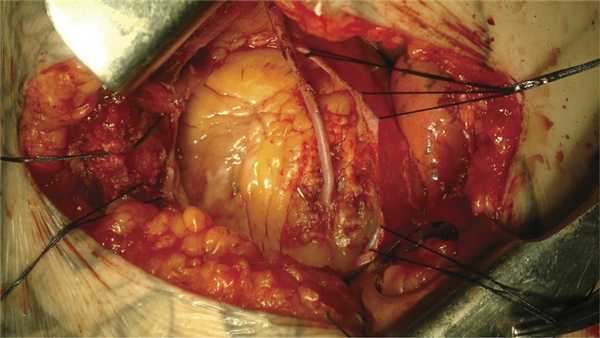
Рис. 1. Интраоперационная фотография. Конечный вид после операции маммарокоронарного шунтирования из левосторонней торакотомии (MIDCABG).
При планировании маммарокоронарного шунтирования ДВ и ПМЖВ следует сначала наложить анастомоз бок в бок с ДВ, а затем анастомоз конец в бок с ПМЖВ.
После пуска кровотока проводим контроль гемостаза и инородных тел, в обязательном порядке подшиваем 2 электрода к левому желудочку.
Нейтрализацию гепарина протамином применяем выборочно. Устанавливаем один или два дренажа в левую плевральную полость - в задний костодиафрагмальный синус по средней подмышечной линии и/или к верхушке гемиторакса по среднеключичной линии. Послойно и герметично ушиваем рану грудной клетки, для сведения ребер используем 2-3 полиспасных шва нитью 1 или 0.
После перевода пациента в отделение реанимации дренажи подключаем на аспирацию, выполняем рентгенографию органов грудной клетки.
В случае, если позволяет гемодинамика, для профилактики спазма ВГА мы применяем интраоперационное внутривенное медленное введение блокаторов медленных кальциевых каналов.
В послеоперационном периоде в обязательном порядке определяем время свертывания крови; если оно меньше 8 мин, назначаем введение гепарина по 2500 ЕД каждые 4 ч.
Сразу после перевода пациента на самостоятельное дыхание и экстубации даем ему 150 мг клопидогреля, 100 мг ацетилсалициловой кислоты и блокатор медленных кальциевых каналов.
Существует еще один вариант реваскуляризации ПМЖВ и/или ДВ из левосторонней торакотомии - аутовенозное подключично-коронарное шунтирование из левосторонней торакотомии (LAST - Left Anterior Small Thoracotomy). Мы рекомендуем помнить о ней и использовать при дисфункции маммарокоронарного анастомоза после ранее проведенной реваскуляризации миокарда с сохранным дистальным руслом ПМЖВ у пациентов, которым по различным причинам невозможно использовать ВГА (повреждение ВГА при мобилизации, лучевое поражение и т. д.), и у больных, которым нежелательно выполнять срединную стернотомию (тяжелый сахарный диабет, тяжелое течение ХОБЛ, выраженное ожирение и т. д.).
При подключично-коронарном шунтировании аутовену необходимой длины сначала анастомозируем с подключичной артерией, доступ к которой выполняем на 1 см ниже ключицы по среднеключичной линии.
Подключичная артерия лежит в рыхлом клетчаточном пространстве сразу под ключичной порцией большой грудной мышцы. Артерию берем на две держалки и аккуратно подтягиваем вверх; книзу и кзади от подключичной артерии пальпируем межреберье и делаем коагулятором канал шириной около 1 см для последующего проведения шунта в плевральную полость.
После введения полной дозы гепарина (300 ЕД/кг) подключичную артерию пережимаем атравматическими зажимами в дистальном и проксимальном направлении, выполняем артериотомию по нижней стенке скальпелем с лезвием № 11, далее заводим в просвет стандартный перфоратор аорты диаметром 4-5 мм.
По стандартной методике формируем анастомоз конец в бок с аутовеной под углом около 90°. Проводим шунт в плевральную полость под контролем зрения и по возможности предупреждаем перегиб и перекрут последнего. Дальнейший ход операции не отличается от стандартного (рис. 2).
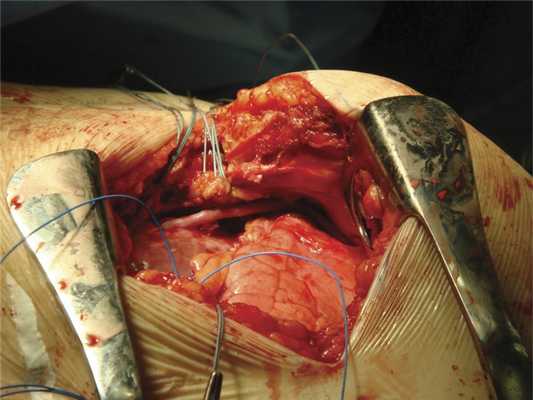
Рис. 2. Интраоперационная фотография. Конечный вид после операции аутовенозного подключично-коронарного шунтирования (LAST).
Выполнение операции из левосторонней торакотомии требует от хирурга аккуратности и прецизионности. Выполнять такие операции следует хирургу, имеющему достаточный опыт проведения прямой реваскуляризации миокарда без искусственного кровообращения.
Маммарокоронарное шунтирование из левосторонней торакотомии сочетает в себе все положительные качества прямой реваскуляризации миокарда - хорошие отдаленные результаты, возможность выполнения при бифуркационных стенозах и выраженной ангуляции коронарного сосуда.
Исключение искусственного кровообращения, потенциальной возможности нестабильности грудины и небольшой разрез делают MIDCABG и LAST крайне привлекательными методиками для пациента и врача.
Использование временного интракоронарного шунтирования при наложении дистального анастомоза с ПМЖВ не обязательно, но желательно ввиду особенностей манипуляций в ограниченном пространстве хирургического доступа.
При возникновении любого состояния, угрожающего жизни пациента (нарушение ритма, неконтролируемое кровотечение, интрамиокардиальный ход проксимальной и средней трети ПМЖВ и/или невозможность закончить операцию из торакотомии) хирург должен иметь четкий алгоритм действий. При планировании операций из левосторонней торакотомии всегда надо учитывать ограничения этой методики и быть готовым к конверсии доступа (к срединной стернотомии) и/или переходу на искусственное кровообращение.
Соблюдая показания и выполняя операцию по представленной методике, можно добиться хороших результатов даже у очень тяжелой категории пациентов с хронической обструктивной болезнью легких, эмфиземой, бронхиальной астмой, тяжелым течением сахарного диабета и диффузным поражением коронарных артерий бассейна огибающей и правой коронарной артерий.
Портокавальное шунтирование

На сегодняшний день заболевания печени входят в десятку наиболее распространённых причин смертности среди населения по всей планете. Среди них - цирроз печени, который может быть спровоцирован как алкогольной зависимостью, так и вирусной этиологией, нарушениями в работе жёлчного пузыря, а также длительным приёмом некоторых видов медикаментов. Кроме того, широко распространено паразитарное поражение органа, вирусные заболевания, из-за которых происходит повреждение паренхимы печени, воспаления и опухоли в структурах тканей органа.
Возникающая на поздних стадиях болезни, портальная гипертензия считается одним из наиболее тяжёлых осложнений цирроза. Её характеризует увеличение давления в портальной вене органа, из-за чего кровь не может нормально циркулировать через печень, а в пищеварительном тракте открываются смертельно опасные для больного кровотечения.
Портокавальное шунтирование считается достаточно эффективным методом лечения портальной гипертензии у пациентов с заболеваниями печени.
Портальная гипертензия: механизм развития, опасность патологии
Гипертензия в портальной вене - синдром, который формируется на фоне нарушения кровообращения и повышения кровяного давления в полости воротной вены печени. Его локализация может диагностироваться на уровне больших вен портальной области, нижней полой вены, печёночных вен, а также капилляров.
Этиология формирования синдрома очень широка. Изначально причиной его развития становится обширное поражение паренхимы печени из-за различных заболеваний - вирусных гепатитов, цирроза различных типов, доброкачественных и злокачественных опухолей, значительной паразитарной инвазии, опухолей холедоха и новообразований в печёночном жёлчном протоке, желчнокаменной болезни, рака головки поджелудочной железы. Также влияние на появление гипертензии может оказывать отравление гепатотропными ядами, например, отравление грибами.
То есть, сама по себе портальная гипертензия не является болезнью - она формируется как совокупность признаков и состояний, как синдром на фоне заболеваний, вызывающих разрушение тканей печени.
Пациенты с диагностированным тромбозом, врождённой атрезией, стенозом портальной вены, синдромом Бадда-Киари, конструктивным перикардитом находятся в зоне риска развития синдрома портальной гипертензии.
Существуют также случаи, когда появление гипертензии связано с перенесенными обширными ожогами, сепсисом, травмами и операциями.
Симптоматика может различаться на разных стадиях развития патологии. На начальном этапе пациент сталкивается с такими проявлениями;
- повышенный метеоризм;
- расстройства стула;
- тошнота и отсутствие аппетита;
- боли в эпигастрии и области правого подреберья;
- потеря веса;
- желтушность кожи и слизистых;
- повышенная утомляемость.

У некоторых поражённых отмечается увеличение селезёнки, которое проходит после перенесённых желудочно-кишечных кровотечений.
Устойчивость асцита к проводимой медикаментозной терапии может быть ещё одним признаком наличия у пациента портальной гипертензии.
Наиболее опасные признаки патологии, которые свидетельствуют о тяжёлом состоянии больного - обширные кровотечения из патологически изменённых вен желудка, кишечника, пищевода. Такие кровотечения быстро приводят к постгеморрагической анемии, и могут становиться причиной ранений слизистой желудочно-кишечного тракта.
При первом желудочно-кишечном кровотечении погибает примерно половина поражённых. Из тех, кто пережил кровотечение, у 60% больных в течение первого года случается рецидив, которого большинство из них не переживёт.
Особенности диагностирования и лечения патологии
Определение развития патологии возможно по совокупности данных клинической картины и анамнеза больного. Доктор обращает внимание на наличие асцита, геморроя, извитых заметных сосудов в области пупка, околопупочной грыжи.
Лабораторная диагностика включает в себя сдачу общего анализа мочи и крови, биохимии крови, антител к вирусам гепатита. Кроме того, лечащий врач назначает различные рентгенографические методы обследования:
- портографию;
- кавографию;
- ангиографию;
- целиакографию.
В обязательном порядке больному назначается ультразвуковое исследование органов брюшной полости, эзофагоскопия. В крайних случаях прибегают к биопсии тканей печени для гистологического исследования.
Методы лечения терапевтического характера могут быть эффективны только при функциональных изменениях внутрипечёночной гемодинамики. Если у больного отмечается острое развитие кровотечений, ему назначаются процедуры склерозирования или эндоскопического лигирования стенок сосудов.
Однако в тяжёлых случаях все эти мероприятия оказываются неэффективными, поэтому пациенту назначается осуществление шунтирования:
- портокавального “конец в конец”;
- портокавального “бок в бок”;
- портокавальное “конец в бок”;
- шунтирования Н-образным шунтом.
Показания и противопоказания к осуществлению шунтирования печени
Операция по шунтированию сосудов органа является тяжёлой для пациента, учитывая, что, в большинстве случаев, его общее состояние может оцениваться как опасное для жизни. Показаниями к шунтированию печени являются:
- варикозное кровотечение из поражённых сосудов, которые ведут кровь от желудка, пищевода и кишечника в сторону печени;
- портальная гастропатия, которая представляет собой венозный застой в стенках желудка, провоцирующий появление кровотечений;
- асцит и гидроторакс: скопление жидкости в брюшной полости и области грудной клетки;
- синдром Бадда-Киари: тромбоз печёночных вен на уровне их впадения в нижнюю полую вену, из-за которого нарушается отток крови из печени.
Причём кровотечение пищеварительного тракта, хотя и является прямым показанием к осуществлению операции, считается запоздалым проявлением портальной гипертензии, когда, даже при условии успешно проведённой операции, есть большая вероятность летального исхода для больного. Поэтому медики рекомендуют проводить шунтирование в так называемом “холодном” периоде - то есть до того, как начнётся кровотечение, угрожающее жизни поражённого.
Противопоказаниями являются такие факторы как наличие постсинусоидального блока в печени, и расширение диаметра венул в портальных триадах - такие состояния дают крайне негативные прогнозы для больного.
Как подготовиться к шунтированию
Мероприятия по подготовке, в первую очередь, требуют сдачи общих анализов крови и мочи, биохимического исследования крови, коагулограммы и других лабораторных показателей. Кроме того, хирургу потребуется вся актуальная информация по обследованиям вроде УЗИ, эндоскопии и прочих.
За 2-3 суток необходимо начать придерживаться бесшлаковой диеты, то есть отказаться от продуктов, способствующих усилению образования газов в кишечнике.
Проведение операции возможно только строго натощак, поэтому за 12 часов до её начала пациенту запрещено есть и пить, курить, жевать жевательную резинку.
Перед сном необходимо поставить очистительную клизму и принять таблетку слабительного, чтобы очистить кишечник.
Приём любых медикаментов за 14 дней до даты операции должен быть согласован с лечащим врачом.
Осуществление операции портокавального шунтирования
Впервые такая процедура была в экспериментальном виде осуществлена в 1877 году - тогда в качестве подопытных выступали собаки. До сих пор шунтирование признаётся одним из наиболее эффективных способов продления жизни больным с портальной гипертензией, не считая трансплантации органа.
На сегодняшний день, большинству поражённых с болезнями печени, осложнением которых является портальная гипертензия и кровотечения, назначается склеротерапия или перевязка варикозных узлов. Если же разрушение органа зашло слишком далеко, больным назначается трансплантация печени.
Ещё один способ лечения - трансъюгулярное внутрипечёночное портосистемное шунтирование, которое исключило необходимость экстренных хирургических вмешательств. Следует отметить, что такая процедура не предназначена для создания длительно проходимых шунтов, однако она даёт возможность взять под контроль состояние портальной гипертензии, и эффект её сохраняется в течение длительного времени.
Той группе больных, у кого печень, несмотря на заболевание, ещё сохранила некоторые резервы, из-за чего им не показана трансплантация органа. Именно им может проводиться прямое портокавальное шунтирование.
Шунты методом “бок в бок” формируется быстро и с малой кровопотерей. Такой тип процедуры не применяется для больных с асцитом, который показывает резистентность к медикаментозной терапии. Если же у пациента асцит отсутствует, и при этом выявлен ретроградный кровоток по полости воротной вены, портокавальный шунт имеет некоторые преимущества.
Шунтирование “конец в бок” может стать причиной развития печёночной энцефалопатии, хотя после шунтирования “бок в бок” это осложнение проявляется несколько чаще. Такой шунт можно применять при асците, который не поддаётся другим видам терапии. Он способствует понижению давления в брыжеечных венах, при этом воротная вена играет роль пути оттока крови от печени.
Шунт, осуществляемый по технике “бок в бок” более сложен в исполнении. Часто для сопоставления нижней полой и воротной вен необходимо проводить частичную резекцию хвоста печени. Он предпочтителен для пациентов, у которых диагностирован синдром Бадда-Киари, однако, из-за гипертрофирования хвостатой доли печени при синдроме, его тяжело выполнить.
Н-образный шунт считается наиболее современным. Его формируют за счёт интерпозиции сосудистого протеза между нижней полой и воротной венами. Учитывая небольшой диаметр просвета шунта, он работает селективно, и сохраняет центробежный кровоток в сторону печени по воротной вене. При этом давление в портальной системе медленно снижается, что способствует предупреждению кровотечений из варикозных вен пищевода.
Возможным осложнением Н-образного шунта является ранний тромбоз, однако, в таких случаях успешна практика осуществления тромболитической терапии посредством установки катетеров. Их внедряют чрескожным способом в воротную или нижнюю полую вену.
Установка шунта даёт возможность понизить давление в печёночной и воротной венах, а также усилить кровоток в печёночной артерии.
Операция проводится только в соответствующим образом оборудованной операционной, в условиях стационара, и требует соблюдения всех правил асептики.
После любого типа шунтирования, кроме мезокавального, осуществление трансплантации органа значительно затрудняется.
Прогнозы эффективности операции
Портокавальное шунтирование снижает вероятность развития асцита и бактериального перитонита, однако опасно появлением печёночной энцефалопатии.
Риск летального исхода после операции колеблется от 5 до 50% вероятности, в зависимости от исходного состояния больного.
Нередко, в процессе операции на воротной вене, которая поражена патологическим процессом, шунт закрывается, что приводит к смерти оперируемого в результате печёночной недостаточности.
Если портокавальный анастомоз, наложенным способом “конец в бок”, функционирует нормально, это даёт возможность предотвратить возможное кровотечение из вен в стенках пищевода или желудка.
Шунтирование способствует уменьшению размера селезёнки, а также сужению варикозно расширенных вен.
Неселективные шунты снижают не только портальное давление, но и печёночный кровоток, из-за чего существенно ухудшается функционирование печени.
Частым осложнением после операции является развитие желтухи, отёк лодыжек, печеночная энцефалопатия.
Портокавальное шунтирование - один из способов спасти жизнь больного с обширными и запущенными поражениями печени, особенно если осуществить трансплантацию органа нет возможности. Однако нельзя переоценивать возможности медиков - нередко операция назначается, когда пациент уже находится в наиболее тяжёлом состоянии, когда никто не может гарантировать, что он выживет, поэтому шунтирование рекомендуется проводить в “холодный” период, до развития острых кровотечений в пищеводе, желудке, кишечнике.
Операция внутрипечёночного портосистемного шунтирования
Показанием для проведения внутрипеченочного портосистемного шунтирования является портальная гипертензия, для которой характерно устойчиво повышенное кровяного давление в воротной вене. Воротная вена является основным каналом доставки крови от кишечника к печени.
Если портальную гипертензию не лечить, развиваются тяжёлые осложнения, связанные с варикозным расширением вен органов пищеварения, а также печёночная энцефалопатия (наиболее опасное осложнение, при котором угнетаются нормальные функции печени).
Следствием высокого портального давления также становится увеличение селезёнки в размерах. Возникает высокий риск кровотечений из расширенных вен, проходящих в желудке и пищеводе.
Наиболее современная и эффективная методика лечения портальной гипертензии - трансъюгулярное внутрипеченочное портосистемное шунтирование. Возможности медицинских технологий позволяют проводить такую операцию эндоскопически. Суть лечения заключается в создании сосуда (шунта), проходящего через печень и соединяющего воротную вену с одним из трёх соединяющих печень с сердцем сосудов. Поддержание просвета имплантированного сосуда в открытом состоянии обеспечивается помещением в него стента. В результате шунт принимает на себя часть кровяного потока. Некоторый объём крови, постоянно «сбрасываемый» через имплантат обеспечивает эффект декомпрессии всей портальной системы, снижая кровяное давление в воротной вене. Риск кровотечений и варикоза существенно снижается.
2. Показания и противопоказания к внутрипечёночному портосистемному шунтированию
- острые кровотечения пищевода и желудка, связанные с варикозным расширением вен, не устраняемым терапевтически и не поддающимся другим методам лечения;
- профилактика при высоком риске кровотечений на фоне варикоза вен желудка и пищевода;
- портальная гастропатия (застой венозной крови в стенках желудка, угрожающий кровотечениями);
- гепаторенальный синдром;
- синдром Бадда-Киари (образование тромба в одной из вен, проходящих от печени к сердцу);
- рефрактерный асцит (скопление жидкости в брюшной полости);
- профилактическая хирургия после трансплантации печени при угрозе развития портальной гипертензии.
Ограничением к проведению портосистемного шунтирования могут стать тяжёлые печёночные нарушения, которые могут усугубиться после имплантации шунта. Кроме того, следует учитывать, что попадание продуктов метаболизма, из кишечника в общее кровяное русло, минуя печень, может вызвать специфическое поражение нервной системы - портосистемную энцефалопатию. Врач тщательно взвешивает и опирается на анамнестические сведения, оценивая существующую склонность к проявлениям энцефалопатии. Иногда побочный эффект от занесения в кровь неотфильтрованных печенью токсических веществ можно усранить посредством диеты или перестановкой стента.
Детям портосистемное шунтирование проводится, в основном, после пересадки печени. При этом возникают определённые трудности и риски, связанные с последующим ростом и изменением объёма перекачиваемой крови.
- инфекционные заболевания в острой стадии;
- нарушения функции почек, сердечной деятельности;
- тяжёлые системные и психические заболевания.
Эти ограничения относительны, поэтому при наличии указанных обстоятельств в каждом конкретном случае решение о проведении операции принимается на медицинском консилиуме.
3. Техника проведения и риски операции внутрипеченочного портосистемного шунтирования
Современное медицинское оборудование позволяет проводить шунтирование печени малоинвазивно. Все манипуляции производятся под контролем мониторинга эндоскопически. Тем не менее, операционная должна быть укомплектована и готова к проведению экстренных реанимационный мероприятий, поскольку любые вмешательства на печени несут риск кровотечений, и других стремительно развивающихся осложнений.
При необходимости (сопутствующих патологиях или трудностях оперативного доступа) шунтирование проводится путём открытой полостной операции. Такой подход удлиняет восстановительный период, но может быть оправдан в ряде случаев.
Аортокоронарное шунтирование. Виды шунтирования. Где сделать шунтирование сосудов?
Операция шунтирования сосудов сердца может быть проведена для лечения сердечно-сосудистых заболеваний в тех случаях, когда коронарные артерии заблокированы. Операция шунтирования дает возможность обеспечить нормальное кровоснабжение сердца.
Во время шунтирования коронарных артерий, или аортокоронарного шунтирования (АКШ) кровеносный сосуд удаляется или пересаживается с другого участка тела в область сужения сосудов, восстанавливая хороший кровоток. Сосуды для пересадки могут быть взяты из груди, ног или рук (подробнее мы расскажем об этом дальше). Это не опасно, потому что в эти органы кровь поступает по многим другим сосудам. Оперирующий хирург решит, из какой области лучше взять сосуд для трансплантации, в зависимости от размера, расположения и степени блокировки коронарных артерий пациента.
На самом деле, аортокоронарное шунтирование - не такая редкая операция. И она действительно дает хорошие результаты.
2. Какие артерии используются для шунтирования сосудов сердца?
Есть несколько типов артерий, используемых для шунтирования сердца:
- Внутренние грудные артерии - самый распространенный вариант. Исследования показали самые лучшие долгосрочные результаты трансплантации грудных артерий при шунтировании сосудов. Эти артерии находятся в грудной клетке и доступ к ним возможен через основной разрез, который делается для самой операции шунтирования. Во время пересадки артерии-трансплантаты присоединяются к коронарной артерии ниже места ее закупорки.
- Подкожные вены на ноге сначала берутся из ноги, а затем присоединяются к коронарной артерии ниже места закупорки. Предварительная операция для получения сосуда-трансплантата может быть малоинвазивной, что дает возможность обойтись минимумом рубцов и быстро восстановиться после хирургического вмешательства.
- Лучевые артерии. В нижней части плеча расположены две артерии - локтевая и лучевая. У большинства людей нормальный кровоток обеспечивается через локтевую артерию, и удаление лучевой артерии не повлечет за собой никаких побочных эффектов. Поэтому ее можно использовать в качестве трансплантата. Но возможность удаления лучевой артерии проверяется перед операцией. Например, если у пациента есть некоторые заболевания (синдром Рейно, кистевой туннельный синдром, болезненность пальцев на холоде), такой тип шунтирования не рекомендуется. Чтобы добраться до артерии, делается разрез в предплечье. Иногда после операции появляется онемение в запястье, но обычно оно постепенно проходит.
- Желудочно-сальниковая артерия желудка и нижняя эпигастральная артерия редко используются для шунтирования, но иногда такое встречается.
Сама операция коронарного шунтирования может быть выполнена методом традиционной хирургии или малоинвазивно. Исходя из состояния здоровья каждого пациента врач определит, возможно ли малоинвазивное шунтирование сосудов в данном случае.
3. Как делается традиционная операция шунтирования сосудов?
Во время операции шунтирования сердца хирург делает разрез по центру грудины, чтобы получить прямой доступ к сердцу пациента. Разумеется, операция проводится под общим наркозом. Во время нее пациент подключается к аппарату, искусственно поддерживающему кровообращение по всему телу. Сердце останавливается, и затем хирург выполняет процедуру трансплантации сосуда. Как правило, остановка сердца длится примерно 30-90 минут в течение всех 4-5 часов операции. После шунтирования разрез в грудной клетке закрывается.
Существует технология проведения операции шунтирования на бьющемся сердце. Т.е. его остановка вообще не требуется, а аппараты искусственного сердца и вентиляции легких не используются. Эта процедура сложнее и требует высокотехнологичного оснащения операционной, но и она с успехом проводится в наших клиниках. Современная медицина позволяет прооперировать все коронарные артерии этим методом. Такая технология может быть эффективна для пациентов, которые могут иметь повышенный риск осложнений из-за применения аппаратов искусственного поддержания работы сердца и легких. Например, тех, кто имеет серьезную кальцификацию (отложение бляшек) аорты, стеноз сонной артерии, инсульт, транзиторные ишемические атаки, проблемы с легкими и почками.
4. Что такое малоинвазивное шунтирование сердца?
Во время малоинвазивной операции шунтирования сосудов хирург выполняет операцию через небольшой разрез в груди. Этот вариант шунтирования, к примеру, подходят для пациентов, которым нужна трансплантация левой внутренней грудной артерии к левой передней нисходящей артерии. В некоторых случаях операцию шунтирования на закрытой грудной клетке проводят с использованием роботизированной техники. В этом случае хирургам достаточно сделать совсем маленький разрез.
Преимущества малоинвазивного шунтирования очевидны - делается небольшой разрез, а значит, останется и маленький шрам на грудной клетке. Сокращается и период послеоперационного пребывания в больнице. Обычно требуется 3 дня вместо 5-6 дней после традиционного шунтирования. Восстановление происходит быстрее и легче. Кроме того, при малоинвазивном шунтировании обычно бывает меньшее кровотечение, ниже риск инфицирования, пациент испытывает меньшие болевые ощущения.
Доступ и ход операции портокавального шунтирования бок в бок
Больница Центросоюза Российской Федерации, Москва, кафедра эндоскопической хирургии ФДПО ФГБОУ ВО «МГМСУ им. А.И. Евдокимова» Минздрава России, Москва, Россия
Кафедра эндоскопической хирургии факультета последипломного образования Московского государственного медико-стоматологического университета
кафедра эндоскопической хирургии ФПДО МГМСУ
Современные представления о хирургических методах лечения больных с варикозно-расширенными венами пищевода и желудка
Журнал: Эндоскопическая хирургия. 2016;22(5): 43‑48
На сегодняшний день кровотечение из варикозно-расширенных вен пищевода и желудка у больных циррозом печени — главная причина летального исхода и самое грозное осложнение портальной гипертензии. В связи с этим необходимость своевременного лечения и проведение профилактики данного заболевания являются основным показанием к хирургическому вмешательству.
Варикозное расширение вен пищевода и желудка встречается у 90% больных циррозом печени, в 35% случаев оно осложняется кровотечениями. В механизме развития варикозной трансформации вен пищевода и желудка важную роль играет затруднение оттока крови по воротной вене, в результате чего формируются 4 основные группы портокавальных анастомозов: 1) гастроэзофагеальные; 2) забрюшинные; 3) между левой ветвью воротной вены и сосудами передней брюшной стенки; 4) между прямокишечным сплетением и нижней полой веной. Но для клиницистов наиболее важен гастроэзофагеальный коллатеральный путь, предопределяющий основное направление хирургического лечения портальной гипертензии [1].
Важно помнить, что хирургические методы лечения портальной гипертензии имеют паллиативный характер, они не направлены на лечение основного заболевания. Их цель — профилактика и ликвидация одного из серьезных симптомов портальной гипертензии — кровотечения из варикозно-расширенных вен пищевода и желудка. Единственный радикальный метод лечения портальной гипертензии у больных циррозом печени на сегодняшний день — трансплантация печени.
Существует 3 подхода к предупреждению кровотечений из варикозно-расширенных вен пищевода и желудка [1].
Вторым подходом в предупреждении кровотечений из варикозно-расширенных вен пищевода и желудка является декомпрессия портальной системы с помощью формирования сосудистых портокавальных анастомозов (дистальный спленоренальный анастомоз, проксимальный спленоренальный анастомоз, Н-спленоренальный анастомоз), а также эндоваскулярный способ формирования шунта — операция TIPS (Transjugular intrahepatic portosystemic shunt, трансъюгулярное внутрипеченочное портосистемное шунтирование) [1].
Существуют 3 вида открытых сосудистых операций по формированию портокавальных шунтов: 1) тотальное шунтирование; 2) парциальное шунтирование; 3) селективное шунтирование [4].
При тотальном шунтировании формируется портокавальный анастомоз большого диаметра (15—25 мм) между нижней полой и воротной, селезеночной или верхней брыжеечными венами. Наиболее распространенная операция при этом — проксимальный спленоренальный анастомоз (анастомоз между селезеночной и левой почечной веной конец в бок) в сочетании со спленэктомией. Одним из условий для формирования шунта является длина селезеночной вены не менее 4—6 см. При выполнении данной операции могут быть получены удовлетворительные результаты, однако летальность составляет 10—35%, энцефалопатия развивается у 3,5—28% больных, возможно развитие послеоперационного панкреатита, а рецидивы кровотечений возникают у 10—27% в связи с тромбозом анастомоза и неполной декомпрессией бассейна воротной вены [2, 5].
При селективном шунтировании происходит избирательная декомпрессия селезеночного и гастроэзофагеального бассейнов. При данном типе шунтирования формируется дистальный спленоренальный анастомоз (операция W. Warren). В литературе имеются работы с описанием данной операции, выполненной лапароскопическим доступом [6]. Селезеночную вену мобилизуют по всему периметру с целью сохранения разобщенности желудочно-селезеночного и брыжеечного бассейнов, однако это чревато повреждением поджелудочной железы и развитием послеоперационного панкреатита, который приводит к тромбозу анастомоза и рецидиву кровотечения из варикозных вен. Сохранение воротного кровотока позволяет снизить частоту развития острой печеночной недостаточности и энцефалопатии в раннем послеоперационном периоде. Поэтому данная операция характеризуется более высокой эффективностью и меньшим процентом осложнений, чем при тотальном шунтировании [5, 7].
При парциальном портокавальном шунтировании формируют анастомоз бок в бок или Н-типа малого диаметра (8—15 мм), выполняемые с использованием любого сосуда портальной системы, кроме воротной вены. При данном типе операции формируется Н-спленоренальный анастомоз, который считается лучшим из всех парциальных портокавальных анастомозов, так как именно в этом случае происходит декомпрессия портальной системы (на 25% интраоперационно снижается давление в портальной вене), а также сохраняется редуцированный кровоток для поддержания функции печени [5, 8].
Операция TIPS впервые разработана J. Rosch в 1969 г. в эксперименте на животных [9]. Впервые в клинической практике операцию TIPS в современном виде выполнил G. Richter в 1998 г. [10]. Данная операция заключается в малоинвазивном способе снижения портального давления путем создания внутрипеченочного соустья между крупными печеночными венами и ветвями воротной вены при помощи чрескожной имплантации металлического стента. Основные показания для данного вмешательства — безуспешность консервативного и эндоскопического методов лечения кровотечений из варикозно-расширенных вен пищевода и желудка, асцит, рефрактерный к диуретической терапии, синдром Budd—Chiari. Одним из серьезных осложнений данной операции являются стенозирование и тромбоз шунта, приводящие к рецидивам кровотечений [11, 12].
Третий подход в профилактике кровотечений из варикозно-расширенных вен пищевода и желудка заключается в разобщении портокавальных связей с помощью хирургических операций, в том числе и малоинвазивных, в целях уменьшения притока крови к варикозно-расширенным венам кардиоэзофагеальной области. К этим операциям относятся деваскуляризация пищевода и желудка, транссекция пищевода и желудка, прошивание варикозных узлов желудка и нижней трети пищевода, резекция пищевода и желудка. К малоинвазивным вмешательствам относятся эндоскопическое склерозирование и лигирование варикозно-расширенных вен пищевода и желудка, эндоваскулярные операции (редукция селезеночного кровотока, редукция печеночного кровотока, эмболизация кардиальных вен желудка, операция BRTO (Balloon-occluded Retrograde Transvenous Obliteration) — ретроградная окклюзия варикозных вен желудка и пищевода) [1].
Впервые оперативное вмешательство по поводу деваскуляризации желудка и нижней трети пищевода в сочетании со спленэктомией выполнил С. Henschen в 1938 г. Классической операцией данного типа является операция M. Hassab (1967), которая заключается в обширной деваскуляризации желудка и нижнего отдела пищевода, включая наддиафрагмальные вены, в сочетании со спленэктомией [2]. Y. Ni и соавт. [13] сравнили широко использующуюся методику деваскуляризации пищевода желудка в сочетании со спленэктомией и без таковой. Для исследования были отобраны 55 пациентов с синдромом портальной гипертензии: 27 из них выполнена деваскуляризация желудка и нижней трети пищевода без спленэктомии (группа А) и 28 пациентам выполнялась данная операция в сочетании со спленэктомией (группа В). Таким образом, портальное давление было снижено на 20% в послеоперационном периоде в обеих группах. Частота возникновения тромбоза в портальной вене в группе, А была значительно ниже, чем в группе В (р=0,032). Частота развития рецидивов кровотечения из вен пищевода и желудка в период послеоперационного наблюдения 1 и 3 года в группе, А составляла 0 и 4,5%, в группе В — 0 и 8,7% соответственно (р=0,631). Таким образом, было доказано, что частота осложнений и возникновение тромбоза в воротной вене у пациентов, оперированных без спленэктомии, ниже, чем у пациентов, оперированных в сочетании со спленэктомией. Однако в настоящее время данная операция чаще всего сочетается с эндоскопическим лигированием варикозно-расширенных вен пищевода, а также без спленэктомии [14].
Операцию транссекции пищевода и желудка впервые предложил N. Tanner (1949), который выполнил транссекцию желудка в поперечном направлении, тем самым разъединив систему воротной вены и верхней полой вены с целью ликвидации кровотечения из варикозно-расширенных вен пищевода и желудка у больных с портальной гипертензией. Суть операции заключается в мобилизации нижнего отдела пищевода и кардии желудка, перевязке левой желудочной артерии и вены через торакоабдоминальный доступ в седьмом и восьмом межреберье слева. Желудок пересекают на 5 см ниже кардии и вновь сшивают. Однако анализ отдаленных результатов операции показал ее неэффективность в связи с рецидивами кровотечений вследствие реваскуляризации в зоне транссекции. В научной литературе описаны работы, в которых данная операция выполнялась лапароскопическим доступом [15, 16]. В 1973 г. М. Sugiura и S. Futagawa разработали комбинированную операцию азигопортального разобщения, которая представляла собой трансторакальную транссекцию пищевода, спленэктомию, деваскуляризацию абдоминального отдела пищевода и верхнего отдела желудка, селективную проксимальную ваготомию и пилоропластику. Спленэктомию, пилоропластику, деваскуляризацию желудка, селективную проксимальную ваготомию выполняют из абдоминального доступа, обширную параэзофагеальную деваскуляризацию до уровня нижних легочных вен и транссекцию пищевода до уровня пищеводного отверстия диафрагмы — из торакального доступа. Данная операция в последнее время претерпела различные модификации (А.А. Шалимов, В.И. Оноприев, О.С. Васнев), в том числе с использованием лапароскопической техники, и аппаратной транссекции пищевода с помощью EEA-stapler, и получила широкое распространение в мире.
Методику прошивания варикозно-расширенных вен пищевода впервые предложил Берем в 1949 г. в случаях экстренного оперативного вмешательства при кровотечениях из вен пищевода. Он прошивал расширенные вены пищевода отдельными узловыми швами и вводил в просвет вен между наложенными лигатурами раствор глюкозы с целью тромбообразования в них. Крайль в 1950 г. прошивал варикозно-расширенные вены пищевода непрерывным кетгутовым швом. Позднее эта операция получила название «операция Берема—Крайля», при этом какие-либо вмешательства на варикозно-расширенных венах желудка не производились. Результаты данной операции показали, что кровотечения могут повторяться как в ближайшем, так и в отдаленном послеоперационном периоде, причем чаще всего (в 40—70% случаев) источником кровотечения являлся разрыв варикозных узлов кардиального отдела желудка. Кроме того, основной причиной смерти при операции Берема—Крайля были несостоятельность швов пищевода с последующим развитием медиастинита и эмпиемы плевры, а также декомпенсация функции печени, приводившие к летальному исходу в 30—70% случаев [1]. В 1967 г. М.Д. Пациора предложила прошивать варикозные узлы желудка и нижней трети пищевода через трансабдоминальную гастротомию в проксимальном отделе желудка в косопоперечном направлении [4, 17]. Суть данной операции заключается в прошивании всех варикозных узлов в кардиальном отделе желудка, а затем прошивании варикозных узлов нижней трети пищевода, в результате чего значительно снижается приток крови к венам пищевода. Данная операция менее травматична, чем операция Берема—Крайля, с низкой частотой летальности, рецидивов кровотечения и осложнений (7,6—15,4%). Однако с развитием малоинвазивных оперативных вмешательств (эндоскопическое лигирование) значимость выполнения полостной операции на варикозно-расширенных венах пищевода снизилась [18—20].
Говоря о пищеводно-желудочных резекциях, следует отметить, что эти операции являются операциями резерва для тех больных, кто ранее многократно был оперирован по поводу рецидива кровотечений из вен пищевода и желудка. Одна из таких операций — частичная эзофагогастрэктомия с инвагинацией пищеводно-желудочного анастомоза по способу К.Н. Цацаниди. Также применяются различные модификации данной операции с интерпозицией сегмента толстой или тонкой кишки. Однако данная операция применяется лишь в исключительных случаях ввиду большого количества осложнений (30—40%), таких как агастральная астения тяжелой формы и рецидивы кровотечения из эрозий культи желудка в послеоперационном периоде [18, 21].
На сегодняшний день малоинвазивные вмешательства — более перспективные методы остановки и профилактики кровотечений из варикозно-расширенных венах пищевода и желудка. Эндоскопическое склерозирование вен пищевода впервые выполнили С. Crafoord и Р. Frenckner в 1939 г. При этой методике интравазально либо паравазально с помощью иглы, проведенной через инструментальный канал эндоскопа, вводят склерозанты (производные жирных кислот — натрия морруат, синтетические вещества — этоксисклерол, тромбовар, а также этиловый спирт, фенол, гистоакрил) в целях образования рубцовой ткани и тромбоза сосудов данной области. Эффективность методики составляет 70—90% [19, 22, 23]. Однако данная операция характеризуется большим количеством осложнений, таких как изъязвления слизистой оболочки пищевода (14%), стриктуры пищевода, плевральные осложнения (9%), субфебрильная температура (6,4%), некроз слизистой пищевода и его перфорация (6,25%), перикардиты (0,4%) [2]. Наиболее частое (65%) и серьезное осложнение — стойкая дисфагия пищевода на фоне выраженных рубцовых стриктур, возникновение которых зависит от количества инъекций и введенного склерозанта [24]. В связи с этим многие клиницисты в последнее время отдают предпочтение эндоскопическому лигированию варикозно-расширенных вен пищевода. Впервые эндоскопическое лигирование варикозно-расширенных вен пищевода выполнил G. Stiegmann в 1986 г., применив латексные кольца. Данную операцию выполняют с помощью многозарядного лигатора фирмы «Wilson-Cook» при лигировании вен пищевода или нейлоновой петли фирмы «Olympus» — при необходимости лигирования вен желудка. Эндоскоп с фиксированным на конце колпачком проводится к выбранному варикозному узлу. Лигирование начинают с кардиоэзофагеального перехода чуть выше зубчатой линии в шахматном порядке по спирали. После аспирации варикозного узла в цилиндр более чем на половину его высоты сбрасывают лигирующее кольцо. Через 6—7 сут начинается отторжение некротизированных узлов, на месте которых образуются поверхностные язвы. Язвы заживают в течение 3 нед, на их месте образуются рубцы без стенозирования просвета пищевода. Наиболее частыми осложнениями данной операции являются аллергическая реакция на латекс, боли при глотании в первые дни, кровотечения из поверхностных язв на фоне отторжения некротизированных узлов. Эта методика позволяет остановить продолжающееся кровотечение в 78—95% случаев, однако рецидив кровотечения отмечается у 28—35% пациентов [25]. Методика эндоскопического лигирования варикозно-расширенных вен пищевода и желудка оказалась более эффективной операцией при кровотечениях из вен пищевода, а также как способ профилактики, чем эндоскопическое склерозирование варикозных вен, так как при лигировании вен отмечалось снижение количества рецидивов кровотечения на 20% и снижение летальности на 15% [26—28].
Осложнения после обширных хирургических вмешательств предписывают отказаться от формирования прямых портокавальных анастомозов в пользу эндоваскулярных методов лечения. Одной из первых эндоваскулярных операций стала чрескожная чреспеченочная эмболизация кардиальных вен желудка, впервые разработанная А. Lunderquist в 1974 г. Данная операция заключается в эмболизации левой желудочной вены и коротких вен желудка посредством металлических спиралей «Гиантурко» и других эмболизирующих средств [29]. В 1986 г. В.А. Черкасов рекомендовал выполнять одномоментно эмболизацию селезеночной артерии и кардиальных вен желудка (левая желудочная вена, короткие вены желудка) [30]. Данная манипуляция эффективна при кровотечениях из варикозно-расширенных вен желудка, а недостаток заключается в быстрой реканализации тромбированных коллатералей, в результате чего возможны рецидивы кровотечения.
Эндоваскулярная эмболизация селезеночной артерии впервые успешно выполнена F. Madson в 1973 г., однако анализ данной методики выявил большое количество осложнений, таких как абсцесс селезенки, бактериальный перитонит, тромбоз воротной вены [31]. В связи с этим Spigos и соавт. в 1979 г. предложили частичную эмболизацию селезеночной артерии, которая применяется по сей день [32]. Одним из основных показаний к данной операции является панцитопения, вызванная тем, что после эмболизации ветвей селезеночной артерии возникают участки инфарктов и некрозов, которые уменьшают депонирование лейкоцитов и тромбоцитов в селезенке, что соответственно приводит к их увеличению в периферической крови.
Операцию BRTO (Balloon-occluded Retrograde Transvenous Obliteration, баллон-ассистированная ретроградная трансвенозная окклюзия) впервые выполнили H. Kanagawa и F. Chikamori независимо друг от друга в 1996 г. [33, 34]. Суть операции заключается в эндоваскулярном перекрытии из антеградного трансфеморального доступа просвета спленоренального шунта окклюзионным баллон-катетером и введении жидкого склерозанта в варикозные узлы желудка [2]. В последние годы выработаны модификации данной операции: катетеризация через бедренную, левую почечную вены и естественный гастроренальный анастомоз — эмболизация варикозных вен желудка [35, 36]; катетеризация через притоки левого брахиоцефального венозного ствола или непарной вены левой перикардио-диафрагмальной вены [36]. Положительные результаты данной операции отмечены в 84—100% случаев. Осложнения встречаются в 5% случаев, среди них — тромбоз воротной вены, легочная эмболия и почечная недостаточность; рецидив кровотечения регистрируется с частотой до 9%; средний уровень выживаемости составляет 90, 75, 68 и 55% через 1, 2, 3 года и 7 лет соответственно [35, 36].
С учетом вышесказанного проблема портальной гипертензии и ее осложнений остается одной из самых сложных областей абдоминальной патологии, несмотря на большое количество существующих видов оперативных вмешательств. Однако все эти операции не радикальны. Все открытые хирургические оперативные вмешательства (деваскуляризирующие операции и операции с формированием портокавальных анастомозов) слишком травматичны, не всегда переносятся больными и не решают проблемы высокого портального давления радикально, в связи с чем остается высоким риск рецидива кровотечения. Эндоваскулярные методы лечения (в частности, операции TIPS, BRTO), а также эндоскопические малоинвазивные вмешательства высокоэффективны, поскольку результаты именно этих операций в последние годы дают надежную гарантию профилактики кровотечения из варикозно-расширенных вен пищевода и желудка.
Читайте также:
