Этапы и техника бедренной эмболэктомии (удаления эмбола из бедренной артерии)
Добавил пользователь Евгений Кузнецов Обновлено: 21.01.2026
Кафедра факультетской хирургии им. С.И. Спасокукоцкого Российского государственного медицинского университета им. Н.И. Пирогова, Москва
ФГБОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России, Москва, Россия
Кафедра факультетской хирургии №1 лечебного факультета РНИМУ им. Н.И. Пирогова, Москва, Россия
Хирургические вмешательства при остром тромбозе бедренной вены
Журнал: Флебология. 2010;4(2): 13‑16
Бычкова Т.В., Андрияшкин В.В., Золотухин И.А., Леонтьев С.Г., Кириенко А.И. Хирургические вмешательства при остром тромбозе бедренной вены. Флебология. 2010;4(2):13‑16.
Bychkova TV, Andriiashkin VV, Zolotukhin IA, Leont'ev SG, Kirienko AI. Surgical interventions in cases of femoral vein thrombosis. Flebologiya. 2010;4(2):13‑16. (In Russ.).
Работа основана на результатах обследования и хирургического лечения 475 пациентов с острым тромбозом бедренной вены. Проведен анализ данных в группах больных с тромбозом глубоких вен и локализацией проксимальной части тромба в поверхностной бедренной, общей бедренной венах, а также с сафенофеморальным тромбозом. Представлены ближайшие и отдаленные результаты хирургических вмешательств на бедренной вене. Показана эффективность и надежность прямых вмешательств с целью профилактики тромбоэмболии легочной артерии.
Проблема предотвращения массивной тромбоэмболии легочной артерии (ТЭЛА) у больных с острыми венозными тромбозами остается одной из наиболее актуальных в современной медицине 1. Риск развития ТЭЛА особенно высок у пациентов с флотирующим тромбом, т.е. имеющим лишь одну точку фиксации в своем дистальном отделе. При этом проксимальная часть тромба свободно располагается в токе крови, совершая колебательные движения в такт изменениям венозного давления. При кашле, натуживании, подъеме с постели, ходьбе, когда происходит кратковременное изменение направления движения венозной крови, флотирующий тромб легко отрывается от своего основания и мигрирует в легочное артериальное русло.
Для профилактики подобного исхода у больных с проксимальной локализацией тромбоза обычно выполняют имплантацию кава-фильтра и пликацию нижней полой вены. Эти методы достаточно надежно предотвращают ТЭЛА, но обладают некоторыми существенными недостатками, среди которых наиболее существенным можно назвать угрозу развития острой окклюзии нижней полой вены с последующим формированием тяжелой хронической венозной недостаточности обеих нижних конечностей. У пациентов с тромбозом подвздошных вен или нижней полой вены ввиду отсутствия других вариантов эффективных и относительно безопасных методов хирургической профилактики ТЭЛА с возможными негативными последствиями пликации полой вены или имплантации кава-фильтров приходится мириться.
Ситуация представляется совсем иной, если речь идет об эмболоопасных тромбозах бедренной вены (ТБВ), которые составляют 25-35% в структуре тромботических поражений глубоких вен. Длина таких тромбов колеблется от 3-5 до 15-20 см и более, и именно они примерно в 1 /3 случаев являются источником развития массивной ТЭЛА [2, 4]. Вместе с тем бедренный венозный сегмент доступен для прямых хирургических вмешательств, позволяющих добиться предотвращения легочной эмболии без риска развития синдрома нижней полой вены в отдаленном периоде.
Другая обширная группа пациентов, нуждающихся во вмешательствах на бедренной вене, - больные с восходящим тромбофлебитом большой подкожной вены (БПВ). При отсутствии своевременного лечения или его неэффективности тромбоз подкожной вены может через сафенофеморальное соустье распространиться на глубокую венозную систему [5, 6]. Верхушка такого тромба, располагаясь в бедренной вене, обычно носит флотирующий характер, что требует проведения не только операции Троянова-Тренделенбурга, но и тромбэктомии из глубокой вены.
Цель настоящей работы - обобщение опыта применения прямых хирургических вмешательств у больных с ТБВ.
Материал и методы
С 2000 по 2006 г. в клинике факультетской хирургии провели хирургические вмешательства 475 больным с эмболоопасным ТБВ. У 184 (38,7%) пациентов флотирующий тромб сформировался в результате восходящего тромбофлебита БПВ с переходом верхушки тромба на общую бедренную вену. В 291 (61,3%) случае патологический процесс исходно локализовался в глубоком венозном русле, тромботическое поражение бедренной вены стало следствием восходящего распространения тромбоза из берцовых и подколенной вен.
В группе больных с сафенофеморальными тромбозами преобладали женщины - 132 (71,7%). Возраст больных колебался от 22 до 86 лет (средний возраст 65,4 года), 52,0% пациентов были старше 60 лет. В 94,2% наблюдений сафенофеморальный тромбоз развился на фоне варикозной болезни нижних конечностей. У 5,8% пациентов тромбофлебит сформировался без видимой причины в визуально неизмененных венах. У 3 (1,6%) больных с сафенофеморальным тромбозом при поступлении обнаружена ТЭЛА, подтвержденная инструментальными методами исследования.
Среди больных с первичным ТБВ, напротив, преобладали мужчины 195 (67,0%). Число пациентов старше 60 лет составило лишь 70 (24,1%). Давность флеботромбоза (от клинической манифестации заболевания до госпитализации в стационар) более 10 сут отмечена у 41,3% пациентов. Число пациентов с диагностированной ТЭЛА было почти в 10 раз больше (17,2%) в сравнении с группой больных с сафенофеморальным тромбозом.
Всем больным с целью уточнения диагноза и определения тактики лечения выполнили ультразвуковое ангиосканирование (УЗАС) венозной системы обеих нижних конечностей. Для уточнения объема поражения легочного артериального русла 30 больным провели ангиопульмонографию, 19 - радионуклидную сцинтиграфию легких.
Результаты и обсуждение
В группе больных с сафенофеморальным тромбозом протяженность флотирующей в бедренной вене верхушки тромба составила от 0,5 до 7,0 см, в 5 случаях проксимальная часть тромба распространялась выше паховой связки, на наружную подвздошную вену. Кроме того, с помощью УЗАС в 38 (20,7%) наблюдениях был обнаружен симультанный окклюзивный тромбоз глубоких вен голени пораженной конечности, в 10 (5,4%) - тромбофлебит малой подкожной вены. На контралатеральной конечности глубокие вены были тромбированы у 10 (5,4%) пациентов, тромбофлебит малой подкожной вены выявили у 2 (1,1%), восходящий тромбофлебит БПВ, потребовавший кроссэктомии, - у 11 (6,0%). Таким образом, при сафенофеморальном тромбозе сочетанное дистальное поражение глубоких вен на обеих нижних конечностях выявили у 26,1% пациентов, а тромбофлебит подкожных вен - у 12,5%.
При обнаружении флотирующей проксимальной части тромба длиной не более 3,0 см (в бедренной вене) выполняли кроссэктомию и тромбэктомию без наложения страховочного турникета на глубокую вену. Даже при неблагоприятном развитии событий и фрагментации тромба в момент его удаления, подобный объем тромботических масс не приведет к массивной ТЭЛА. В связи с этим довольно травматичное расширение объема операции для наложения турникета проксимальнее тромба не считали необходимым. Доступ к сафенофеморальному соустью осуществляли по Червякову или по Бруннеру. После его выделения перевязывали приустьевые притоки и обнажали переднюю стенку бедренной вены выше соустья в пределах раны. На передней стенке БПВ производили продольную флеботомию, и на высоте пробы Вальсальвы окончатым зажимом удаляли верхушку тромба из общей бедренной вены (ОБВ). Такой вариант вмешательства выполнили у 154 (83,7%) больных.
В 30 (16,3%) случаях проксимальная часть тромба имела длину от 3 до 7 см и в 5 (2,7%) - распространялась на наружную подвздошную вену. В 3 наблюдениях выполнили тромбэктомию катетером Фогарти в условиях проксимальной блокады кровотока им же, в 2 - блокаду кровотока осуществляли путем наложения турникета на наружную подвздошную вену, выделенную внебрюшинным доступом Пирогова в паховой области. В остальных 25 случаях турникет накладывали на ОБВ выше тромба. После тромбэктомии при получении хорошего ретроградного кровотока производили приустьевое лигирование БПВ.
При флотирующих тромбозах бедренной вены характер оперативного вмешательства зависел от уровня расположения проксимальной части. В поверхностной бедренной вене (ПБВ) тромб локализовался у 169 больных, его свободная (флотирующая) часть имела длину от 4 до 25 см и была расположена не выше места впадения глубокой вены бедра. Этим больным произвели перевязку ПБВ тотчас дистальнее места впадения глубокой вены бедра (полная проходимость которой служит обязательным условием для выполнения данного вмешательства).
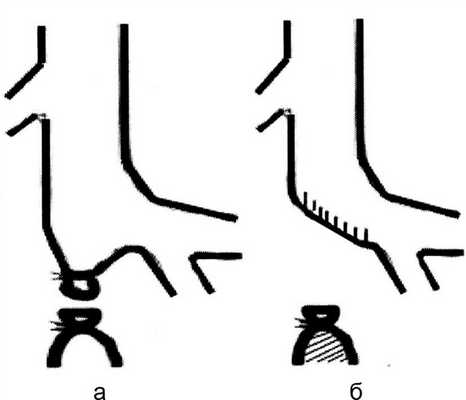
В тех случаях, когда ПБВ в пределах раны была с явлениями флебита, ее пересекали, а дистальный и проксимальный участки сосуда лигировали (рис. 1, а) Рисунок 1. Схема операции лигирования поверхностной бедренной вены. либо проксимальный отдел ушивали непрерывным швом во избежание образования «слепого мешка» (рис. 1, б).
На ОБВ тромбоз распространялся у 122 больных, протяженность флотирующей части тромба колебалась от 4 до 20 см. Первым этапом выполняли тромбэктомию. После наложения турникетов на ОБВ выше проксимальной части тромба, на поверхностную бедренную и глубокую вену бедра производили продольную флеботомию, тотчас дистальнее устья последней. Окончатым зажимом (93 наблюдения) или баллонным катетером (19) удаляли флотирующую верхушку тромба. Получив хороший ретроградный кровоток из ОБВ, поверхностную пересекали и обрабатывали культю одним из перечисленных способов. В последние годы в качестве лигатур использовали рассасывающиеся нити.
От тромбэктомии из дистальных отделов ПБВ в большинстве случаев воздерживались в связи со значительной давностью заболевания, явлениями флебита и плотной фиксацией тромботических масс к стенкам вены.
В послеоперационном периоде больным проводили антикоагулянтную терапию, контрольное УЗАС выполняли через 5-7 дней.
Летальных исходов, клинических проявлений ТЭЛА в послеоперационном периоде не было.

У пациентов с сафенофеморальным тромбозом в послеоперационном периоде в 6 (3,3%) наблюдениях развился рецидив тромботического поражения бедренной вены (табл. 1). В 2 случаях потребовалась имплантация кава-фильтра, 1 больному провели реолитическую тромбэктомию.
Среди больных, которым было выполнено лигирование ПБВ по поводу ее тромбоза, тромбоз ОБВ выше наложенной лигатуры выявлен у 10,1% пациентов. Это потребовало у 9 больных имплантации кава-фильтра, 1 пациенту провели реолитическую тромбэктомию.
Наиболее высокая частота рецидивов тромбоза (18,9%) отмечена среди больных, которым выполняли тромбэктомию из ОБВ. Очевидно, что это связано с более выраженными и распространенными по ходу магистральной вены явлениями флебита, которые мы наблюдали интраоперационно. Парциальную окклюзию нижней полой вены с помощью фильтрующего устройства в этой подгруппе провели у 3 больных.
Общехирургические осложнения наблюдали во всех подгруппах. После операций по поводу сафенофеморального тромбоза у 4 (2,2 %) пациентов развилась гематома послеоперационной раны, у 3 (1,6%) - длительная (до 1 мес) лимфорея. У больных с исходной локализацией проксимальной части тромба в ПБВ и ОБВ гематомы выявили у 27 (16,0%) и 22 (18,0%), длительную лимфорею у 8 (4,7%) и 7 (5,7%) соответственно. У 1 больного в последней подгруппе развилось нагноение послеоперационной раны.
Анализ отдаленных результатов лечения ТБВ провели у 104 больных (61 женщина, 43 мужчины) в сроки от 1 года до 8 лет после госпитализации. Анализировали частоту рецидива венозного тромбоза и ТЭЛА, развитие и тяжесть посттромботической болезни нижних конечностей. Состояние глубокого венозного русла изучали с помощью УЗАС.
Ретромбозы глубоких вен нижних конечностей в отдаленном периоде выявили у 17 (16,7%) больных. Примечательно, что на оперированной конечности рецидив тромбоза развился всего у 7 (6,9%) пациентов, тогда как у 10 (9,8%) тромботическое поражение глубоких вен зафиксировали на контралатеральной конечности, венозное русло которой было интактно во время первого эпизода тромбоза. Варикотромбофлебит развился у 10 (9,8%) пациентов, из них у 5 - на противоположной нижней конечности. Таким образом, тромботическое поражение глубоких и подкожных вен контрлатеральной конечности, по-видимому, было обусловлено системными изменениями гемостаза.
Проведен анализ выраженности проявлений хронической венозной недостаточности у оперированных больных с использованием клинического раздела классификации СЕАР. Чаще всего выявляли симптоматику, относящуюся к классу С3 - у 29 (28,4%) больных. Класс С2 наблюдали у 21 (20,6%) больного, С4 - у 10 (9,8%), С5 - у 4 (3,9%). Ни у одного пациента на момент осмотра не было открытой трофической язвы (класс С6). Следует отметить, что у значительной части пациентов выраженность клинической симптоматики была минимальной - у 21 (20,6%) больного зафиксировали класс С1. Более того, у 18 (17,6%) больных, перенесших вмешательство на глубоких венах, объективных признаков поражения венозной системы обнаружить не удалось (класс С0).
Для уточнения характера посттромботических изменений, выявления особенностей процесса реканализации у больных с ТБВ мы провели ультразвуковые исследования венозного русла. К сожалению, процесс реканализации практически всегда сопровождается разрушением клапанов глубоких вен. Тем не менее восстановление просвета пораженного сосуда, даже не полное, в отдаленном периоде приводит к меньшим проявлениям венозного застоя, чем при хронической окклюзии. Состояние глубоких вен изучили у 61 пациента, имевшего исходно поражение глубокого венозного русла (табл. 2).
Обсуждая вопрос о гемодинамическом влиянии перевязки ПБВ на течение отдаленного послеоперационного периода, следует затронуть вопрос о технических особенностях данной операции. Стремление хирургов совместить на первый взгляд несовместимое (надежно предотвратить миграцию тромба из бедренной вены в легочное русло и в то же время сохранить ее проходимость в отдаленном периоде) заставляет искать новые подходы к оперативному лечению ТБВ. По нашему мнению, наиболее полно этим противоречивым хирургическим задачам отвечает перевязка ПБВ в месте ее слияния с глубокой веной бедра синтетической рассасывающейся нитью. В связи с этим мы решили изучить состояние бедренной вены в месте ее лигирования такой нитью у 43 пациентов, перенесших подобное вмешательство (табл. 3).
Данные УЗАС показали, что почти у половины больных (46,5%) произошло полное восстановление просвета вены в месте наложения лигатуры (рис. 2, а), Рисунок 2. Ультразвуковая сканограмма. а - полное восстановление просвета ПБВ (1); визуализируются разрушенные клапаны (2). у 37,2% - частичное восстановление просвета (рис. 2, б). Рисунок 2. Ультразвуковая сканограмма. б - частичное восстановление просвета в месте лигирования ПБВ (стрелка).
Лишь у 16,2% больных, перенесших лигирование ПБВ рассасывающейся нитью, сформировалась хроническая окклюзия сосуда.
Таким образом, анализ непосредственных и отдаленных результатов хирургических вмешательств по поводу эмболоопасных тромбозов ПБВ и ОБВ показывает, что они надежно предотвращают легочную эмболию и не вызывают выраженных нарушений регионарной флебогемодинамики в посттромботическом периоде. Это позволяет рекомендовать внедрение данных операций в широкую клиническую практику.
Выводы
1. При сафенофеморальном тромбозе тромбэктомия из ОБВ с последующей кроссэктомией является доступным и надежным методом профилактики ТЭЛА и предотвращения тромботического поражения глубоких вен.
2. При эмболоопасном тромбозе бедренной вены перевязка ПБВ тотчас дистальнее впадения глубокой вены бедра, дополненная при необходимости тромбэктомией из ОБВ, служит эффективным методом хирургической профилактики ТЭЛА.
3. Лигирование ПБВ синтетической рассасывающейся нитью не препятствует восстановлению проходимости сосуда в отдаленном периоде.
4. Хирургические вмешательства на бедренной вене при эмболоопасном ее тромбозе не приводят к выраженным проявлениям хронической венозной недостаточности в отдаленном послеоперационном периоде.
Эмболэктомия по Fogarty
Когда речь идет о хирургическом лечении эмболии, то это чаще всего касается эмболии сосудов конечностей. Эмболэктомия, которую называют также «аппендэктомией» хирургов-ангиологов, должна производиться и хирургами общего профиля.
Диагноз эмболии сосудов конечностей в целом не является таким уж сложным. Симптомы развиваются мгновенно. Совершенно здоровый до того человек (у которого, само собой разумеется, имелась причина, вызвавшая возникновение эмболии) ощущает вдруг неожиданную острую боль в пострадавшей конечности. Эта боль возникает одновременно с эмболизацией. Артериальное кровообращение в этой конечности блокируется. Действие самого эмбола, вызывающее определенную реакцию окружающих тканей, а также ишемия и сопровождающие ее боли ведут к спазму сосудов. Конечность очень быстро приобретает трупную бледность. Стаз в подкожных венах вызывает характерную цианотичную венозную окраску, получившую название мраморной. Вслед за прекращением кровотока быстро развиваются функциональные ишемические нарушения. Эти нарушения сначала проявляются частичной потерей чувствительности и выпадением, а затем и полным отсутствием движений. Дистальная часть конечности постепенно становится холодной, ее объем сначала не изменен, а затем несколько уменьшается.
Артериальная эмболия должна дифференцироваться прежде от острой закупорки глубоких вен (phlegmasia coerulea dolens и синдром Paget-Schroetter). В различии механизмов происхождения этих двух процессов заложено различие их симптоматики. При эмболии приток крови блокируется, кровь оттекает от конечности, которая становится бледной и холодной. При закупорке глубоких вен страдает отток крови, в конечность продолжает поступать («накачиваться») артериальная кровь. Конечность становится отечной, увеличивается ее объем. На периферии сдавливается артериальное русло кровообращения. Таким образом, нарушение артериального кровообращения в данном случае только вторичное. Необходимо дифференцировать эмболию от острого артериального тромбоза, что часто сопряжено со значительными затруднениями. О тромбозе следует думать, если речь идет о пожилом больном, клиническая картина болезни носит подострый характер, а в анамнезе фигурирует атеросклероз или дисбазия. В случае серьезных подозрений относительно тромбоза показана ангиография, поскольку попытка «эмболэктомии», может оказаться безуспешной.
Цель производимой эмболэктомии заключается не только в сохранении конечности, но, восстанавливая кровообращение, нужно в полной мере сохранить функцию конечности.
Воздержаться от операции и приступать к консервативному лечению приходится в тех случаях,
а) когда общее состояние больного настолько тяжелое, что даже небольшое вмешательство может стать непереносимым (здесь следует заметить, что автору все же удалось у многих больных произвести успешную эмболэктомию через несколько часов после возникновения свежего инфаркта миокарда);
б) когда одновременно возникает массивная эмболия сосудов головного мозга с разрушением его вещества;
в) когда периферический и коллатеральный кровоток после возникновения эмболии не нарушен.
Для оценки жизнеспособности тканей конечности могут служить следующие симптомы: распространенный некроз, деструкция кожи на большой площади, выраженная ригидность мышц с мышечной контрактурой, в особенности, когда имеется септическое состояние. Все это делает эмболэктомию бесперспективной, так как конечность при этом не может быть спасена.
Опыт показывает, что эмбол почти всегда застревает в том месте, где сосуд дает бифуркационное ответвление или сужение. Таким образом, типичной локализацией для оседания эмболов являются следующие места на верхней конечности: пространство между лестничными мышцами, место деления плечевой артерии с отхождением глубокой плечевой артерии, место деления на лучевую и локтевую артерии; на нижней конечности места оседания эмболов находятся: на бифуркации брюшной части аорты, у места деления подвздошных артерий, наружной и внутренней, у места отхождения от бедренной артерии глубокой артерии бедра, у выхода из мышечного пространства отводящих мышц, где находится место разветвления на переднюю и заднюю большеберцовые артерии.
В настоящее время, когда производится непрямая эмболэктомия, точная локализация эмбола не имеет того значения, как во времена, когда производилась прямая эмболэктомия. Любой эмбол может быть достигнут и удален из определенных типичных участков.
Локализацию эмбола можно определить без особых трудностей путем обычных физикальных методов исследования. Если на одной из бедренных артерий пульсация может пальпироваться, а на другой она отсутствует, то тогда речь идет об эмболии подвздошной артерии.
Когда же отсутствует пульсация обеих бедренных артерий, то речь может идти об эмболе, который в виде наездника оседлал бифуркацию брюшной части аорты. Чувствительность в таком случае отсутствует уже на бедре. Если пульсация бедренной артерии сохранена, однако конечность ниже колена холодная, а на стопе нарушены чувствительность и движения, то речь идет о закупорке эмболом бедренной артерии и глубокой артерии бедра. Если эмбол закупоривает только поверхностную бедренную артерию, а глубокая артерия бедра свободна, то чувствительность и движения отсутствуют только на периферии. Обычно уровень закупорки эмболом располагается на один сегмент выше, чем характеризующие эту закупорку симптомы.
Техника операции
Оперативное вмешательство производится почти исключительно с применением катетера с баллончиком по методике Fogarty. Для облегчения выделения значительно фиксированного эмбола при поздних операциях может быть применена проволочная петля.
Катетер fogarty состоит из синтетической трубки длиною 80 см и диаметром 1-3 мм, на закругленном конце которого находится небольшой раздуваемый резиновый баллон. Его противоположный конец надевается на шприц, при помощи которого баллончик может быть раздут до необходимой величины.
Эмболэктомия сосудов верхних конечностей
Эмболэктомия сосудов верхних конечностей может быть беспрепятственно произведена под местной анестезией. На верхних конечностях эмболэктомия производится из следующих доступов.
Плечо больного, лежащего на операционном столе, укладывается на второй узкий столик. После предварительного обкладывания и местного обезболивания производится продольный разрез длиною около 8 см между внутренним мыщелком плечевой кости и средней линией плеча по продолжению средней борозды двухглавой мышцы. Кубитальная артерия проходит в сопровождении двух плечевых вен под растяжением сухожилия двухглавой мышцы. Это сухожилие двухглавой мышцы хорошо пальпируется и по нему можно легко определить правильное направление. Здесь, вблизи, сбоку от медиального мыщелка проходит срединный нерв. В виде одного из редко встречаемых вариантов строения можно видеть высокое деление кубитальной артерии, тогда в этом месте находят лучевую и локтевую артерии вместо одной локтевой. Артерия выделяется максимально на протяжении 4 см от его окружающих тканей и берется на «держалку». Выше деления артерии на лучевую и локтевую производится поперечная артериотомия примерно на 1/3 ширины сосуда.
На плече применяется наиболее тонкий размер катетера Fogarty. Сначала его вводят вверх по направлению подключичной артерии. Проводя катетер, можно ощутить, когда он проходит место, где располагается эмбол, некоторое препятствие. После удаления из катетера мандрена, придающего ему ригидность, раздувают резиновый баллон до тех пор, пока он не начинает слегка фиксировать катетер в просвете сосуда. Теперь можно начинать его извлечение, при котором раздутый баллон выталкивает за собой эмбол вместе с наслоившимся на него тромбом. Хирург этим инструментом работает подобно тому, как трубочист работает, очищая от сажи дымоходы. Очищая таким образом сосуд от эмбола, необходимо соблюдать следующее условие: сосуд постепенно сужается по направлению книзу, поэтому давление баллончика катетера должно несколько уменьшаться по направлению книзу, так как слишком большое его растяжение в сужающемся сосуде может повредить интиму, а это поврежденное место в дальнейшем может служить основанием для повторной закупорки (образование тромба, отслойка интимы) сосуда.
Необходимо следить за тем, чтобы катетер не разорвал дальше произведенный на артерии разрез. Кроме этого, большой ошибкой является, когда вследствие небрежно произведенного вмешательства вместе с катетером извлекается поврежденный и вырванный участок интимы.
За успешным удалением эмбола следует пульсирующее кровотечение. Следующим этапом катетеризации является прохождение сосудистого русла в дистальном направлении, вплоть до его конца. Зонд при его проведении в дистальном направлении обычно сразу же попадает в лучевую артерию, являющуюся по своему направлению как бы продолжением кубитальной. Легким надавливанием пальца по ходу сосуда можно переместить катетер в локтевую артерию. Если катетер возвращается без тромботических масс и восстанавливается хороший кровоток, то это является признаком для окончания катетеризации.
Разрез артерии закрывается непрерывным матрацным швом. При достаточно надежном затягивании нити при наложении узла создается надежный герметизм.
Эмболэктомия сосудов нижних конечностей
Для проведения эмболэктомии на нижних конечностях выделяется общая бедренная артерия под Пупартовой связкой. Больного укладывают на операционном столе на спину, под бедро подводится жесткая плоская подушечка, при помощи которой операционное поле хорошо приподнимается. Прохождение артерии соответстует линии Кена, соединяющей середину Пупартовой связки с медиальным мыщелком бедра.
Эмболэктомия из бедренной артерии с помощью катетера Фогарти
Несколько выше Пупартовой связки по проекции сосуда производится разрез длиною 10-12 см. При выделении сосуда необходимо дойти до места отхождения глубокой артерии бедра, ее следует иметь на всякий случай в поле зрения. На «держалки» берется бедренная артерия центральнее и дистальнее отхождения глубокой артерии бедра. Зажим можно наложить только в том случае, когда сосуд пульсирует под пальцами. Центральнее от отхождения глубокой артерии бедра и близко от этого места производится продольная артериотомия. При необходимости через это отверстие можно пройти катетером и в глубокую артерию бедра.
В случаях, когда определена эмболия бифуркации аорты, одновременно выделяются обе бедренные артерии. Через одну из бедренных артерий вводится катетер, а на другую накладывается зажим.
Сначала удаляются эмболы из центрального участка сосудистого русла, а когда восстанавливается пульсация, сосуд промывают пульсирующим током крови. Затем в дистальном направлении проходят катетером с раздуваемым баллончиком через поверхностную и глубокую бедренные артерии. После чего с этой стороны накладывается на сосуд зажим, и, если возникла необходимость, катетеризацию производят таким же образом на другой стороне. Перед зашиванием отверстий в сосудах вновь производят их промывание кровью. Таким повторным промыванием могут быть отмыты оставшиеся на бифуркации аорты или занесенные с другой стороны сгустки крови. Они могут находиться и в области, отжатой зажимами.
Разрез сосуда должен по возможности зашиваться простым непрерывным швом.
Эмболэктомия является одной из наиболее результативных и эффективных операций на сосудах. Эта операция связана с очень небольшим вмешательством, не причиняющим особой нагрузки для больного. В случае удачи хороший результат операции становится сразу же очевидным: отсутствовавший до этого пульс становится отчетливо пальпируемым, состояние больного улучшается, внешний вид конечности и ее функция тоже улучшаются и вскоре нормализуются.
8.2. Хирургическое лечение артериальных эмболий.
Для лечения АЭ конечностей и бифуркации аорты в настоящее время применяется операция эмболэктомия, которую можно считать радикальным методом лечения. Применяют 2 метода эмболэктомии: 1) прямая эмболэктомия с обнажением участка острой окклюзии артерии в легко доступных для выделения сегментах - бифуркации общей бедренной, плечевой артерий, реже - подколенной артерий; 2) непрямая эмболэктомия, выполняется при острой окклюзии магистральных артерий в сегментах, труднодоступных для выделения (бифуркация общей подвздошной артерии, аорты, при локализации эмбола в поверхностной бедренной артерии над входом в гунтеров канал, в плечевой артерии на плече и т.д.), производится с помощью баллонного катетара Фогарти (тонкий диаметром до 2-2,5 мм эластический зонд с раздувающимся на конце латексным баллончиком).
При производстве обоих видов эмболэктомий наиболее типичными являются доступы: в верхней трети бедра ниже паховой связки с обнажением бифуркации общей бедренной артерии, в верхней трети предплечья ниже локтевого сгиба с обнажением бифуркации плечевой артерии, в в/3 голени по задней поверхности ниже подколенной ямки.
После выполнения прямой или непрямой эмболэктомии накладывают шов артерии (чаще всего по Каррелю) если производилась поперечная артериотомия, после продольной артериотомии во избежание стенозирования и послеоперационного тромбоза - закрытие артериотомного отверстия путем вшивания «заплаты» из аутовены (сегмента большой подкожной вены).
При отсутствии баллонного катетера для выполнения непрямой эмболэктомии можно использовать полиэтиленовые катетеры разного диаметра для отсасывания эмбола.
Для удаления дистального продоженного тромба или дистальных «этажных» эмболов может быть применен метод «ретроградного вымывания» (на нижней конечности путем выделения за внутренней лодыжкой и катетеризации задней большеберцовой артерии, на верхней - лучевой артерии).
Все виды эмболэктомий производятся под местным обезболиванием, что позволяет их выполнять без особого риска даже у тяжелых больных.
В послеоперационном периоде - антикоагулянтная терапия (гепарин, лучше - НМГ), дезагреганты, гемокоррекция (для профилактики послеоперационного тромбоза), лечение основного заболевания, решение вопроса о возможности его радикальной коррекции для профилактики возможного рецидива АЭ.
Необходимо отметить, что и в этой области ургентной сосудистой хирургии внедряются малоинвазивные операции - выполнение чрескожной аспирационной эмболэктомии.
8.3. Лечение острых артериальных тромбозов.
Консервативная терапия показана: 1) при легкой степени острой ишемии тканей конечности, 2) в качестве пробной терапии при среднетяжелой степени ишемии, 3) когда тяжесть больного не позволяет произвести операцию несмотря на имеющиеся показания к ней, 4) при отказе больного от операции, 5) при острых тромбозах периферических артерий небольшого диаметра (голени и предплечья).
Задачи консервативного лечения: лизис тромба - восстановление кровотока в тромбированной артерии, профилактика роста и распространения тромба, улучшение кровообращения и тканевого метаболизма в зоне острой ишемии, улучшение функции жизненно важных органов, профилактика прогрессирования основного заболевания (атеросклероза).
Патогенетически обоснованной терапией при ОАТ является тромболитическая и антикоагулянтная терапия, направленные на восстановление проходимости окклюзированной артерии, на борьбу с ростом и распространением продолженного тромбоза, тем самым - на улучшение кровообращения и тканевого метаболизма в пораженной конечности.
Тромболитические препараты обладают высоким лизирующим эффектом, либо непосредственно воздействуя на тромб, либо активизируя собственную фибринолитическую систему больного, являясь активаторами проактиваторов неактивного плазминогена (фибринолизина) и блокируя действие ингибиторов фибринолиза.
Началу тромболитической терапии положил отечественный препарат «фибринолизин», который вводился внутривенно в суточной дозе 20 000-100 000 ЕД на изотоническом растворе хлорида натрия с обязательным добавлением гепарина (10 000 ЕД на каждые 20 000 ЕД фибринолизина) за 3-4 часа на протяжении 2-3 суток. От него быстро отказались в связи с малой эффективностью (слабо активировал фибринолиз, не вызывал лизис тромба, в то же время приводил к гиперкоагуляции и повышению агрегации тромбоцитов, быстро инактивировался в организме антиплазмином).
Значительно более эффективным оказался тромболитический препарат «стрептокиназа» («стрептаза» - ФРГ) - высокоочищенный белок, продуцируемый активно растущим -гемолитическим стрептококком группы С, обладающий свойствами активатора проактиватора плазминогена и вызывающий лизис тромба (т.е.“непрямой” тромболитик).
В связи с имеющимися практически у всех людей в крови антистрептококковыми антителами, тромболитическую терапию этими препаратами начинают с внутривенного введения начальной «инактивирующей» дозы 250 000 ЕД на 300 мл физиологического раствора или 5% раствора глюкозы в течение 30-40 мин, после чего проводится непрерывная внутривенная капельная инфузия лечебной дозы препарата, которая может достигать 1 500 000 - 3 000 000 ЕД препарата (скорость инфузии - 750 000 ЕД за 8 часов), проводится под ангиографическим контролем, с последующим переходом на гепаринотерапию.
Чтобы избежать основного осложнения тромболитической терапии - различных кровотечений, необходим тщательный лабораторный контроль за состоянием системы гемокоагуляции: исследование каждые 8 часов показателей коагулограммы: времени свертывания крови, концентрации фибриногена А, тромбинового времени, фибринолитической активности крови.
При возникновении геморрагических осложнений (кровоточивость ран, микро- и макрогематурия, показатели коагулограммы) - временно приостанавливают введение тромболитика, как антидотную терапию используют введение фибриногена, 5% раствора -амино-капроновой кислоты, 1% раствора хлористого кальция, нативной или свежезамороженной плазмы, 1% раствора амбена, в особо тяжелых случаях используют прямое переливание крови. После прекращения манифестации геморрагии продолжают тромболитическую терапию до получения терапевтического эффекта, но более медленным введением препарата.
Для уменьшения токсических и антигенных воздействий тромболитика применяют гормональные (преднизолон и др.) и десенсебилизирующие (супрастин, тавегил, пипольфен и др.) препараты.
Другие препараты этой группы - кабикиназа (Швеция), стрептодеказа, стрептолиаза (СССР), в последние годы - целиаза (СССР, в настоящее время не производится).
Естественный эндогенный физиологический активатор плазминогена - урокиназа получается из мочи человека и выгодно отличается от предыдущих препаратов отсутствием токсических и антигенных свойств, но в связи с трудностями получения и высокой себестоимостью имеет ограниченное применение (суточная доза - от 200 000 до 2 700 000 ЕД).
Повышение эффективности тромболизиса связано с созданием в 90 х годах ХХ века нового фибринспецифического тромболитического препарата - синтетического тканевого активатора плазминогена актилизе (действующее вещество - альтеплаза), затем метализе, ретеплаза, тенектеплза (группа “прямых” тромболитиков).
Антикоагулянтная терапия, на которую переходят после окончания тромболитической, обладая антитромботическим действием (ингибирует тромбокиназу и инактивирует тромбин), вызывает снижение коагуляционного потенциала крови, препятствует формированию и росту продолженного тромба, закупорке коллатералей, обладает спазмолитическим действием и снижает вязкость крови, но не растворяет образовавшийся тромб и не ликвидирует эмбол (хотя проходимость сосуда может частично восстанавливаться за счет последующей ретракции сгустка в условиях гипокоагуляции крови).
Антикоагулянтную терапию, как правило, начинают назначением прямого антикоагулянта - гепарина, который вводится только парэнтерально, оптимально внутривенно, по 5000-10000 ед (1-2 мл) через каждые 3-4 часа (т.к. за это время выводится из организма), суточная лечебная доза составляет от 40 000 до 80 000 ед (в зависимости от калибра окклюзированного сосуда); курс лечения гепарином - до 5 суток с постепенным снижением дозы и последующим переходом на непрямые антикоагулянты.
Гепарин, как и тромболитики, может вызвать геморрагические осложнения (хотя это отмечается относительно редко в связи с тем, что он не кумулируется в печени). Поэтому при его примененении также требуется тщательный лабораторный контроль: ежедневное исследование основных показателей коагулограммы (основной контрольный показатель - время свертывания крови по Ли-Уайту, которое для эффективной терапии удлиняется до 20-30 мин), и микроскопия мочи на предмет выявления микрогематурии.
При появлении признаков передозировки (кровоточивость ран, микро- и макрогематурия, показатели коагулограммы) - пропускают 1-2 введения гепарина, применяют в качестве антидота раствор протамин-хлорида или протамин-сульфата (внутривенно 5-10 мл на физрастворе), затем продолжают гепаринотерапию сниженными дозами. Недопустимо резко прекращать гепаринотерапию, т.к. возможно развитие противоположного осложнения - т.н. «рикошетного эффекта», когда после внезапной отмены гепарина резко возрастает свертываемость крови и может развиться ретромбоз.
В последние годы гепарин успешно заменяется низкомолекулярными гепаринами (НМГ- продуктами фракционирования гепарина) - фраксипарином (по 30 мг - 0,3 мл в шприце - 2-3 раза в сутки), клексаном (эноксапарином - по 20-40-80 мг - 0,2-0,4-0,8 мл в шприце - 2-3 раза в сутки); эти препараты вводятся только подкожно в области передней брюшной стенки.
После окончания курса гепаринотерапии переходят на непрямые антикоагулянты - неодикумарин (пелентан), фенилин, синкумар, омефин, варфарин., которые обладают, помимо используемого антитромботического свойства, отрицательными эффектами: крайне вариабильной к ним чувствительностью различных больных (у некоторых - повышенная, когда даже от обычных доз и при кратковременном применении развивается кровотечение, у других - выраженная толерантность, когда даже повышенные дозы имеют незначительный эффект), способностью кумулироваться в печени и при продолжительном применении вызывать массивные кровотечения.
В связи с этим каждому больному лечебную дозу непрямого антикоагулянта необходимо подбирать индивидуально, начиная со стандартной дозировки (по 1 таблетке 3 раза в день), а затем, ежедневно проверяя уровень протромбинового индекса, подобрать такую дозу, которая будет поддерживать этот показатель коагулограммы на необходимом для лечебного эффекта уровне - 35-40 % . Чтобы избежать опасной кумуляции препарата, курс лечения должен составлять не более 7-10 дней.
Правила терапии непрямыми антикоагулянтами такие же, как и прямыми: они могут давать аналогичные осложнения - геморрагии (при передозировке или длительном применении), «рикошетный эффект» (при внезапном прекращении применения), а в связи с указанными выше особенностями (различная к ним чувствительность, способность к кумуляции) эти осложнения бывают более непредсказуемыми. Поэтому необходим очень тщательный лабораторный контроль: после подбора дозы каждые 3 дня исследуется основной контрольный показатель коагулограммы для непрямых антикоагулянтов - протромбиновый индекс (который не должен снижаться ниже терапевтического уровня 35-40 %) и производится микроскопия мочи на предмет микрогематурии, а к концу курса - постепенное снижение дозы до минимальной (0,5 табл. 1-2 раза в день).
Необходимо помнить правило перехода от прямого к непрямому антикоагулянту : непрямые антикоагулянты имеют еще одну особенность, связанную с механизмом действия - при введении в организм они снижают свертываемость не сразу, а через определенное время (чаще это 12-24 часа), в связи с чем существует правило «перекреста», которое заключается в том, что в день начала терапии непрямым антикоагулянтом еще в течение суток продолжают введение прямого антикоагулянта в минимальной дозе, отменяя его на следующие сутки от начала применения непрямого антикоагулянта.
При появлении признаков передозировки непрямого антикоагулянта (кровоточивость ран, микро- и макрогематурия, показатели коагулограммы) - пропускают 1-2 введения препарата, применяют в качестве антидота 1% раствор викасола (внутривенно 5-10 мл), затем продолжают лечение сниженными дозами. Недопустимо резко прекращать введение непрямого антикоагулянта, поскольку как и при гепаринотерапи, возможно развитие противоположного осложнения - т.н. «рикошетного эффекта», когда после внезапной отмены препарата резко возрастает свертываемость крови и может развиться ретромбоз.
В настоящее время предложены новые стандарты тромболитической и антикоагулянтной терапии позволяющее улучшить ближайшие и отдаленные результаты “системного” тромболизиса путем совершенствования т.н. адъювантной антикоагулянтной и антиагрегантной терапии, применяемой одновременно с тромболитиками.
Предпосылкой для использования антикоагулянтов при проведении тромболитической терапии (т.н. антикоагуянтное “сопровождение” тромболизиса) является освобождение в ходе фибринолиза тромбина из тромба, что приводит к усугублению претромботического состояния и повышает риск ретромбоза на поверхности нестабильной бляшки.
Для повышения клинической эффективности тромболитической терапии доказано преимущество применения низкомолекулярных гепаринов (НМГ), в основном эноксипарина (клексана), по сравнению с нефракционированным гепарином (НФГ) причем не только при использовании фибринспецифических тромболитиков, но и при применении стрептокиназы.
Доказана целесообразность пролангированной (до 7 - 8 суток) антикоагулянтной терапии эноксипарином или прямым антикоагулянтом нового класса арикстрой (фондапаринукс - синтетический селективный ингибитор фактора Х-а).
В комплексную консервативную терапию включают гемокорректоры, дезагреганты (ацетилсалициловая кислота, клопидогрел (плавикс), тиклопидин), спазмолитики, сердечные гликозиды, антиаритмические препараты (по показаниям), проводят коррекцию кислотно-щелочного состояния, мероприятия по нормализации функции почек (при ее нарушении).
Консервативная терапия применяется как самостоятельный метод лечения и является обязательным дополнением к оперативному лечению.
В хирургическом лечении ОАТ конечностей используются следующие восстановительные операции: «идеальная» тромбэктомия (редко) или сочетание ее с эндартерэктомией, эндартерэктомия с аутовенозной пластикой, эндартерэктомия методом «выворачивания» с последующей реимплантацией аутотрансплантата (при тромбозе бифуркации аорты), резекция артерии с протезированием и постоянное обходное шунтирование (в области бифуркации аорты и подвздошных артерий - синтетическими протезами, на конечности - аутовеной). Операции выполняются под общим обезболиванием.
В случае контрактуры мышц голени при острых артериальных нарушениях кровобращения (и при эмболиях и при тромбозах) с целью уменьшения опасности развития грозных постишемических расстройств рекомендуется, наряду с удалением тромба-эмбола и продолженного тромба, произвести флеботомию сопутствующей магистральной вены с кровопусканием и ревизией ее баллонным катетером для удаления токсических продуктов распада и тромбов, промывание по системе артерия-вена, либо проведение региональной перфузии конечности. При развившемся отеке мышц с целью декомпрессии и улучшения кровотока в мышцах показана также широкая фасциотомия.
При развитии IV степени острой ишемии - стадии гангрены как при АЭ, так и при ОАТ показана ампутация конечности. При выборе уровня ампутации необходимо помнить, что ишемическое поражение мышц обычно выражено в большей степени и более проксимально, чем кожи. Иногда целесообразно ампутацию дополнять эмболэктомией, что позволяет снизить уровень ампутации конечности.
6. Профилактика эмболий и острых тромбозов артерий конечностей заключается в радикальной хирургической коррекции эмбологенных заболеваний (выполнение комиссуротомии при митральном стенозе, иссечение постинфарктной аневризмы сердца, резекция аневризмы аорты) и хронических окклюзирующих заболеваний артерий кнечностей (выполнение реконструктивных операций). В случаях, когда тяжесть общего состояния или возраст больных не позволяют произвести эти вмешательства, показана пожизненная антикоагулянтная терапия препаратами непрямого рядя с индивидуальным подбором дозы, при которой протромбиновый индекс не превышал бы 60 % (чаще всего используется варфарин).
7. Принципы проведения экспертизы нетрудоспособности и диспансеризации. Больные с синдромом ОАН конечностей должны находиться под диспансерным наблюдением. Два раза в год, а по показаниям и чаще должны быть осмотрены семейным доктором и сосудистым хирургом. Обязательно необходимо контролировать показатели коагулограммы. При необходимости сосудистый хирург назначает УЗИ магистральных артерий конечностей.
Читайте также:
- География микробной колонизации полости рта. Микробы слизистой рта.
- Пример удаления опухоли радужки при частичной иридэктомии
- Лечение и прогноз расстройств личности
- Изменения в давлении ликвора. Внечерепные процессы с головной болью.
- Случай успешного лечения ишемии ног на фоне коронавирусной инфекции
