Генетика хронического миелолейкоза. Механизмы развития лейкоза
Добавил пользователь Валентин П. Обновлено: 01.02.2026
(хронический гранулоцитарный лейкоз, хронический миелоцитарный лейкоз, хронический миелолейкоз)
, MD, PhD, University of Maryland;
, MD, University of Maryland
Last full review/revision December 2018 by Ashkan Emadi, MD, PhD; Jennie York Law, MD
Патофизиология
Филадельфийская (Ph) хромосома присутствует в 90-95% случаев хронического миелоидного лейкоза. Ph хромосома является продуктом взаимной транслокации между хромосомами 9 и 22, t(9;22). Во время этой транслокации часть хромосомы 9, которая содержит онкоген ABL, транслоцируется на хромосому 22 и соединяется с геном BCR. Химерный гибридный ген BCR-ABL отвечает за производство онкопротеина тирозинкиназы bcr-abl.
Онкопротеин bcr-abl обладает неконтролируемой тирозинкиназной активностью, которая нарушает процесс регуляции клеточной пролиферации, снижает «прилипание» лейкозных клеток к строме костного мозга и защищает лейкозные клетки от естественной запрограммированной гибели клеток (апоптоза).
ХМЛ развивается вследствие гиперпродукции всех клеток миелоидной линии дифференцировки аномальной плюрипотентной гемопоэтической клеткой-предшественницей, которая происходит, главным образом, в костном мозге, но также и в экстрамедуллярных очагах (селезенка, печень). Хотя преобладает продукция гранулоцитов, опухолевый клон включает в себя также эритроциты, мегакариоциты, моноциты и даже иногда Т-клетки и В-клетки. Нормальные стволовые клетки сохраняются и могут активизироваться после лекарственной супрессии опухолевого клона.
Без лечения ХМЛ проходит 3 фазы:
Хроническая фаза: Начальный индолентный период, который может продолжаться в течение 5-6 лет
Фаза акселерации: Отсутствие эффекта от терапии, прогрессирующая тромбоцитопения или тромбоцитоз, персистирующая или прогрессирующая спленомегалия, клональная эволюция, увеличение количества базофилов в крови, увеличение количества бластов в крови или костном мозге (до 19%)
Бластный криз: Аккумуляция бластов в экстрамедуллярных очагах (например, костях, ЦНС, лимфатических узлах, коже), количество бластов в крови или костном мозге ≥ 20%
Бластный криз приводит к стремительному развитию осложнений, сходных с осложнениями при остром лейкозе, таких как сепсис и кровотечения. У некоторых больных хроническая фаза непосредственно переходит в фазу бластного криза.
Клинические проявления
Около 85% пациентов с ХМЛ находятся в хронической фазе. Течение часто бессимптомное на ранних стадиях с постепенным нарастанием неспецифических симптомов (например, утомляемость, слабость, потеря аппетита, снижение массы тела, ночные приливы, ощущение полноты в животе, особенно в верхнем левом квадранте, подагрический артрит, симптомы лейкостаза, такие как шум в ушах, ступор и крапивница), которые и являются поводом к началу обследования.
Бледность, кровоточивость, лимфаденопатия в дебюте заболевания встречаются редко, однако в 60-70% случаев наблюдается умеренная или даже выраженная спленомегалия. При прогрессировании заболевания нарастает спленомегалия, возникают бледность и кровоточивость. Лихорадка, выраженная лимфаденопатия и макулопапулезная кожная сыпь свидетельствуют о неблагоприятном течении заболевания.
Диагностика
Исследование образца костного мозга
Цитогенетическое исследование (Ph-хромосома)
Исследование мазка периферической крови обычно позволяет дифференцировать ХМЛ от лейкоцитоза иной этиологии. При ХМЛ в мазке периферической крови обычно выявляются незрелые гранулоциты, а также абсолютная эозинофилия и базофилия. Тем не менее, у пациентов с количеством лейкоцитов ≤ 50 000/мкл, а у некоторых даже с большим количеством, незрелые гранулоциты могут быть не замечены.
Исследование костного мозга должно выполняться для оценки кариотипа, клеточности и распространенности миелофиброза.
Диагноз подтверждается обнаружением Ph-хромосомы в образцах, изучаемых путем цитогенетических или молекулярных исследований. Классическая Ph цитогенетическая аномалия отсутствует у 5% пациентов, но с помощью флуоресцентной гибридизации на месте (FISH) или полимеразной цепной реакцией с обратной транскрипцией (ОТ-ПЦР) можно подтвердить диагноз.
В фазе обострения ХМЛ, обычно развиваются анемия и тромбоцитопения. Может увеличиваться количество базофилов, нарушается созревание гранулоцитов. Может нарастать доля незрелых клеток. В костном мозге развивается миелофиброз и могут присутствовать сидеробласты. Эволюция опухолевого клона сопровождается развитием нового аномального кариотипа, часто определяется дополнительная хромосома 8 или изохромосома 17q [i(17q)].
Дальнейшее прогрессирование заболевания может привести к развитию бластного криза с появлением миелобластов (у 60% больных), лимфобластов (30%), мегакариобластов (10%) и, редко, эритробластов. У 80% больных развиваются дополнительные хромосомные нарушения.
Прогноз
При применении ингибиторов тирозинкиназы 5-летняя общая выживаемость больных, которым диагноз был поставлен в хронической фазе заболевания, составляет > 90%. До начала применения ингибиторов тирозинкиназы, даже с проведением лечения, в первые 2 года после установления диагноза умирало 5-10% больных и затем - 10-15% ежегодно. Медиана продолжительности жизни была 4-7 лет. Большинство (90%) больных погибает в фазу обострения или во время бластного криза. Медиана продолжительности жизни после бластного криза составляет 3-6 мес. или больше, в случае достижения ремиссии.
Лечение
Иногда трансплантация аллогенных гемопоэтических стволовых клеток
Тактика лечения хронического миелолейкоза зависит от стадии заболевания. Ингибиторы тирозинкиназы (например, иматиниб, нилотиниб, дазатиниб, бозутиниб, понатиниб) не являются лечебными, но они чрезвычайно эффективны во время бессимптомной хронической фазы и являются препаратами выбора во время начальной стадии лечения у пациентов на данной фазе. Ингибиторы тирозинкиназы также применяются иногда во время ускоренной фазы и во время бластного криза. Аллогенная трансплантация гемопоэтических стволовых клеток предназначена для пациентов с фазой акселлерации или бластной фазой ХМЛ или пациентов с заболеванием, резистентным к доступным ингибиторам тирозинкиназы.
За исключением случаев, когда успешно применяется трансплантация гемопоэтических стволовых клеток, эффективность лечения не доказана. Однако ингибиторы тирозинкиназы повышают выживаемость. У отдельных больных возможно прекращение приема ингибиторов тирозинкиназы, при этом ремиссия может сохраняться. Возможная продолжительность ремиссии в таком случае до сих пор не определена.
Ингибиторы тирозинкиназы угнетают онкоген BCR-ABL, который отвечает за индукцию ХМЛ. Эти лекарства высокоэффективны для достижения полной гематологической и цитогенетической ремиссии при Ph-позитивном ХМЛ (Ph+ ХМЛ) и значительно превосходят по эффективности другие режимы лекарственной терапии (например, интерферон с или без цитарабина).
Ответ на лечение ИТК является наиболее важным прогностическим фактором для пациентов с ХМЛ. Ответ пациента на лечение оценивается в начале исследования, а затем через 3 месяца, 6 месяцев и 1 год. Ответ может быть оценен с помощью либо молекулярного теста (измерение белка BCR-ABL), либо цитогенетического теста (измерение Ph+ клеточной хромосомы), но при возможности рекомендуют провести оба теста. Основной молекулярный ответ определяется по генетическому маркеру BCR-ABL крови
В редких случаях в качестве паллиативного средства при ХМЛ используются другие препараты. Эти препараты включают гидроксимочевину, бусульфан и рекомбинантный интерферон или пегилированный интерферон. Основное преимущество гидроксимочевины - уменьшение спленомегалии и аденопатии, а также контроль опухолевой нагрузки, что позволяет снизить вероятность развития тумор-лизис синдрома и подагры. Скорее всего, ни один из этих препаратов не продлевает жизнь.
Аллогенная трансплантация стволовых клеток, из-за токсичности и воздействия ингибиторов тирозинкиназы, используется выборочно. Трансплантация предназначена для пациентов с ускоренной или бластной фазой ХМЛ, устойчивым к ингибиторам BCR-ABL. Трансплантация может способствовать излечению.
Основные положения
В большинстве случаев хронический миелолейкоз (ХМЛ) вызывается хромосомной транслокацией с образованием Филадельфийской хромосомы.
Исследование мазка периферической крови (незрелые гранулоциты, абсолютная эозинофилия и базофилия) обычно позволяет дифференцировать ХМЛ от лейкоцитоза иной этиологии (например, лейкоцитоз из-за инфекции).
Применение ингибиторов тирозинкиназы является очень эффективным методом лечения, повышает выживаемость и даже может привести к излечению.
Трансплантация гемопоэтических стволовых клеток может помочь в лечении и является эффективной у больных, не отвечающих на лечение ингибиторыми тирозинкиназы, и у больных в фазе обострения или бластного криза.
Хронический миелолейкоз
Хронический миелолейкоз - это злокачественное миелопролиферативное заболевание, характеризующееся преимущественным поражением гранулоцитарного ростка. Может долгое время протекать бессимптомно. Проявляется склонностью к субфебрилитету, ощущением полноты в животе, частыми инфекциями и увеличением селезенки. Наблюдаются анемия и изменение уровня тромбоцитов, сопровождающиеся слабостью, бледностью и повышенной кровоточивостью. На заключительной стадии развиваются лихорадка, лимфоаденопатия и кожная сыпь. Диагноз устанавливается с учетом анамнеза, клинической картины и данных лабораторных исследований. Лечение - химиотерапия, радиотерапия, пересадка костного мозга.
МКБ-10

Общие сведения
Хронический миелолейкоз - онкологическое заболевание, возникающее в результате хромосомной мутации с поражением полипотентных стволовых клеток и последующей неконтролируемой пролиферацией зрелых гранулоцитов. Составляет 15% от общего количества гемобластозов у взрослых и 9% от общего числа лейкозов во всех возрастных группах. Обычно развивается после 30 лет, пик заболеваемости хроническим миелолейкозом приходится на возраст 45-55 лет. Дети до 10 лет страдают исключительно редко.
Хронический миелолейкоз одинаково распространен у женщин и у мужчин. Из-за бессимптомного или малосимптомного течения может становиться случайной находкой при исследовании анализа крови, взятого в связи с другим заболеванием или во время профилактического осмотра. У части больных хронический миелолейкоз выявляется на заключительных стадиях, что ограничивает возможности терапии и ухудшает показатели выживаемости. Лечение проводят специалисты в области онкологии и гематологии.
Причины
Хронический миелолейкоз считается первым заболеванием, при котором достоверно установлена связь между развитием патологии и определенным генетическим нарушением. В 95% случаев подтвержденной причиной хронического миелолейкоза является хромосомная транслокация, известная как «филадельфийская хромосома». Суть транслокации заключается во взаимной замене участков 9 и 22 хромосом. В результате такой замены формируется устойчивая открытая рамка считывания. Образование рамки вызывает ускорение деления клеток и подавляет механизм восстановления ДНК, что увеличивает вероятность возникновения других генетических аномалий.
В числе возможных факторов, способствующих появлению филадельфийской хромосомы у больных хроническим миелолейкозом, называют ионизирующее облучение и контакт с некоторыми химическими соединениями.
Патогенез
Итогом мутации становится усиленная пролиферация полипотентных стволовых клеток. При хроническом миелолейкозе пролиферируют преимущественно зрелые гранулоциты, но аномальный клон включает в себя и другие клетки крови: эритроциты, моноциты, мегакариоциты, реже - В- и Т-лифоциты. Обычные гемопоэтические клетки при этом не исчезают и после подавления аномального клона могут служить основой для нормальной пролиферации кровяных клеток. Для хронического миелолейкоза характерно стадийное течение.
- При первой, хронической (неактивной) фазе отмечается постепенное усугубление патологических изменений при сохранении удовлетворительного общего состояния.
- Во второй фазе хронического миелолейкоза - фазе акселерации изменения становятся явными, развиваются прогрессирующие анемия и тромбоцитопения.
- Заключительной стадией хронического миелолейкоза является бластный криз, сопровождающийся быстрой экстрамедуллярной пролиферацией бластных клеток.
Источником бластов становятся лимфатические узлы, кости, кожа, ЦНС и т. д. В фазе бластного криза состояние больного хроническим миелолейкозом резко ухудшается, развиваются тяжелые осложнения, завершающиеся гибелью больного. У некоторых пациентов фаза акселерации отсутствует, хроническая фаза сразу сменяется бластным кризом.
Симптомы хронического миелолейкоза
Клиническая картина определяется стадией заболевания. Хроническая фаза в среднем продолжается 2-3 года, в некоторых случаях - до 10 лет. Для этой фазы хронического миелолейкоза характерно бессимптомное течение или постепенное появление «легких» симптомов: слабости, некоторого недомогания, снижения трудоспособности и чувства переполнения живота. При объективном осмотре больного хроническим миелолейкозом может обнаруживаться увеличение селезенки. По анализам крови выявляется повышение количества гранулоцитов до 50-200 тыс./мкл при бессимптомном течении заболевания и до 200-1000 тыс./мкл при «легких» признаках.
На начальных стадиях хронического миелолейкоза возможно некоторое снижение уровня гемоглобина. В последующем развивается нормохромная нормоцитарная анемия. При исследовании мазка крови пациентов с хроническим миелолейкозом отмечается преобладание молодых форм гранулоцитов: миелоцитов, промиелоцитов, миелобластов. Наблюдаются отклонения от нормального уровня зернистости в ту или иную сторону (обильная или очень скудная). Цитоплазма клеток незрелая, базофильная. Определяется анизоцитоз. При отсутствии лечения хроническая фаза переходит в фазу акселерации.
О начале фазы акселерации может свидетельствовать как изменение лабораторных показателей, так и ухудшение состояния пациентов. Возможно нарастание слабости, увеличение печени и прогрессирующее увеличение селезенки. У больных хроническим миелолейкозом выявляются клинические признаки анемии и тромбоцитопении или тробоцитоза: бледность, быстрая утомляемость, головокружения, петехии, кровоизлияния, повышенная кровоточивость. Несмотря на проводимое лечение, в крови пациентов с хроническим миелолейкозом постепенно увеличивается количество лейкоцитов. При этом отмечается возрастание уровня метамиелоцитов и миелоцитов, возможно появление единичных бластных клеток.
Бластный криз сопровождается резким ухудшением состояния больного хроническим миелолейкозом. Возникают новые хромосомные аномалии, моноклоновое новообразование трансформируется в поликлоновое. Отмечается нарастание клеточного атипизма при угнетении нормальных ростков кроветворения. Наблюдаются ярко выраженные анемия и тромбоцитопения. Суммарное количество бластов и промиелоцитов в периферической крови составляет более 30%, в костном мозге - более 50%. Пациенты с хроническим миелолейкозом теряют вес и аппетит. Возникают экстрамедуллярные очаги незрелых клеток (хлоромы). Развиваются кровотечения и тяжелые инфекционные осложнения.
Диагноз устанавливается на основании клинической картины и результатов лабораторных исследований. Первое подозрение на хронический миелолейкоз часто возникает при повышении уровня гранулоцитов в общем анализе крови, назначенном в порядке профилактического осмотра или обследования в связи с другим заболеванием. Для уточнения диагноза могут использоваться данные гистологического исследования материала, полученного при стернальной пункции костного мозга, однако окончательный диагноз «хронический миелолейкоз» выставляется при выявлении филадельфийской хромосомы при помощи ПЦР, флюоресцентной гибридизации или цитогенетического исследования.
Вопрос о возможности постановки диагноза хронический миелолейкоз при отсутствии филадельфийской хромосомы остается дискутабельным. Многие исследователи считают, что подобные случаи могут объясняться комплексными хромосомными нарушениями, из-за которых выявление данной транслокации становится затруднительным. В ряде случаев филадельфийскую хромосому можно обнаружить при использовании ПЦР с обратной транскрипцией. При отрицательных результатах исследования и нетипичном течении заболевания обычно говорят не о хроническом миелолейкозе, а о недифференцированном миелопролиферативном/миелодиспластическом расстройстве.
Лечение хронического миелолейкоза
Тактику лечения определяют в зависимости от фазы заболевания и выраженности клинических проявлений. В хронической фазе при бессимптомном течении и слабо выраженных лабораторных изменениях ограничиваются общеукрепляющими мероприятиями. Больным хроническим миелолейкозом рекомендуют соблюдать режим труда и отдыха, принимать пищу, богатую витаминами и т. д. Лечение может включать:
- Монохимиотерапию. При повышении уровня лейкоцитов используют бусульфан. После нормализации лабораторных показателей и уменьшения селезенки пациентам с хроническим миелолейкозом назначают поддерживающую терапию или курсовое лечение бусульфаном. При бластных кризах осуществляют лечение гидроксикарбамидом.
- Радиотерапию. Облучение обычно используют при лейкоцитозе в сочетании со спленомегалией. При снижении уровня лейкоцитов делают паузу продолжительностью не менее месяца, а затем переходят на поддерживающую терапию бусульфаном. Радиотерапию также назначают при хлоромах.
- Полихимиотерапию. В прогрессирующей фазе хронического миелолейкоза возможно использование одного химиопрепарата или полихимиотерапии. Применяют митобронитол, гексафосфамид или хлорэтиламиноурацил. Как и в хронической фазе, проводят интенсивную терапию до стабилизации лабораторных показателей, в последующем переходят на поддерживающие дозы. Курсы полиохимиотерапии при хроническом миелолейкозе повторяют 3-4 раза в год.
- Гемокоррекцию. При неэффективности терапии используют лейкоцитаферез. При выраженной тромбоцитопении, анемии выполняют переливания тромбоконцентрата и эритроцитарной массы.
- ТКМ.Пересадку костного мозга проводят в первой фазе хронического миелолейкоза. Продолжительной ремиссии удается достичь у 70% пациентов.
- Удаление селезенки. При наличии показаний осуществляют спленэктомию. Экстренная спленэктомия показана при разрыве или угрозе разрыва селезенки, плановая - при гемолитических кризах, «блуждающей» селезенке, рецидивирующих периспленитах и резко выраженной спленомегалии, сопровождающейся нарушением функций органов брюшной полости.
Прогноз при хроническом миелолейкозе зависит от множества факторов, определяющим из которых является момент начала лечения (в хронической фазе, фазе активации или в период бластного криза). В качестве неблагоприятных прогностических признаков хронического миелолейкоза рассматривают значительное увеличение печени и селезенки (печень выступает из-под края реберной дуги на 6 и более см, селезенка - на 15 и более см), лейкоцитоз свыше 100x10 9 /л, тромбоцитопению менее 150x10 9 /л, тромбоцитоз более 500х10 9 /л, повышение уровня бластных клеток в периферической крови до 1% и более, повышение суммарного уровня промиелоцитов и бластных клеток в периферической крови до 30% и более.
Вероятность неблагоприятного исхода при хроническом миелолейкозе возрастает по мере увеличения количества признаков. Причиной гибели становятся инфекционные осложнения или тяжелые геморрагии. Средняя продолжительность жизни пациентов с хроническим миелолейкозом составляет 2,5 года, однако при своевременном начале терапии и благоприятном течении заболевания этот показатель может увеличиваться до нескольких десятков лет.
Хронический лейкоз
Хронический лейкоз - это первичное опухолевое заболевание системы кроветворения, субстратом которого выступают зрелые и созревающие клетки миелоидного или лимфоидного ряда. Различные формы хронического лейкоза протекают с преобладанием интоксикационного (слабость, артралгии, оссалгии, анорексия, похудание), тромбогеморрагического (кровоточивость, тромбозы различной локализации), лимфопролиферативного синдромов (увеличение лимфоузов, спленомегалия и др.). Решающее значение в диагностике хронического лейкоза принадлежит исследованию ОАК, биоптатов костного мозга и лимфоузлов. Лечение хронических лейкозов проводится методами химиотерапии, лучевой терапии, иммунотерапии, возможна трансплантация костного мозга.



Хронический лейкоз - хронические лимфопролиферативные и миелопролиферативные заболевания, характеризующиеся избыточным увеличением количества кроветворных клеток, сохраняющих способность к дифференцировке. В отличие от острых лейкозов, при которых происходит пролиферация низкодифференцированных гемопоэтических клеток, при хронических лейкозах опухолевый субстрат представлен созревающими или зрелыми клетками. Для всех типов хронических лейкозов характерна длительная стадия доброкачественной моноклоновой опухоли.
Хронические лейкозы поражают преимущественно взрослых в возрасте 40-50 лет; мужчины болеют чаще. На долю хронического лимфоидного лейкоза приходится около 30% случаев, хронического миелоидного лейкоза - 20% всех форм лейкемии. Хронический лимфолейкоз в гематологии диагностируется в 2 раза чаще, чем хронический миелолейкоз. Лейкозы у детей протекают в хроническом варианте крайне редко - в 1-2% случаев.

Истинные причины, приводящие к развитию хронического лейкоза, неизвестны. В настоящее время наибольшее признание получила вирусно-генетическая теория гемобластозов. Согласно данной гипотезе, некоторые виды вирусов (в числе которых - вирус Эбштейна-Барр, ретровирусы и др.) способны проникать в незрелые кроветворные клетки и вызывать их беспрепятственное деление.
Не подвергается сомнению и роль наследственности в происхождении лейкозов, поскольку доподлинно известно, что заболевание нередко носит семейный характер. Кроме этого, хронический миелолейкоз в 95% случаев ассоциирован с аномалией 22-й хромосомы (филадельфийской или Рh-хромосомы), фрагмент длинного плеча которой транслоцирован на 9-ю хромосому.
Факторы риска
Наиболее значимыми предрасполагающими факторами к различным видам и формам хронических лейкозов выступают воздействия на организм:
- высоких доз радиации;
- рентгеновского облучения;
- производственных химических вредностей (лаков, красок и др.);
- лекарственных препаратов (солей золота, антибиотиков, цитостатиков);
- длительный стаж курения.
Риск развития хронического лимфоцитарного лейкоза повышается при длительном контакте с гербицидами и пестицидами, а хронического миелоидного лейкоза - при радиационном облучении.
В патогенезе хронического лимфолейкоза значимая роль принадлежит иммунологическим механизмам - об этом свидетельствует его частое сочетание с аутоиммунной гемолитической анемией и тромбоцитопенией, коллагенозами. Вместе с тем, у большинства больных хроническими лейкозами причинно значимых факторов выявить не удается.
Классификация
В зависимости от происхождения и клеточного субстрата опухоли хронические лейкозы делятся на:
- Лимфоцитарные: хронический лимфолейкоз, болезнь Сезари (лимфоматоз кожи), волосатоклеточный лейкоз, парапротеинемические гемобластозы (миеломная болезнь, макроглобулинемия Вальденстрема, болезни легких цепей, болезни тяжелых цепей).
- Миелоцитарные (гранулоцитарные): хронический миелолейкоз, эритремия, истинная полицитемия, хронический эритромиелоз и др.
- Моноцитарные: хронический моноцитарный лейкоз и гистиоцитозы.
В своем развитии опухолевый процесс при хроническом лейкозе проходит две стадии: моноклоновую (доброкачественную) и поликлоновую (злокачественную). Течение хронического лейкоза условно подразделяется на 3 стадии: начальную, развернутую и терминальную.

Симптомы хронического лейкоза
Хронический миелоидный лейкоз
В начальном периоде хронического миелолейкоза клинические проявления отсутствуют или неспецифичны, гематологические изменения выявляются случайно при исследовании крови. В доклиническом периоде возможно нарастание слабости, адинамии, потливости, субфебрилитета, болей в левом подреберье.
Переход хронического миелоидного лейкоза в развернутую стадию знаменуется прогрессирующей гиперплазией селезенки и печени, анорексией, похуданием, выраженными болями в костях и артралгиями. Характерно образование лейкемических инфильтратов на коже, слизистых полости рта (лейкемический периодонтит), ЖКТ. Геморрагический синдром проявляется гематурией, меноррагией, метроррагией, кровотечениями после экстракции зубов, кровавыми поносами. В случае присоединения вторичной инфекции (пневмонии, туберкулеза, сепсиса и др.) температурная кривая приобретает гектический характер.
Терминальная стадия хронического миелоидного лейкоза протекает с резким обострением всех симптомов и выраженной интоксикацией. В этот период может развиваться плохо поддающееся терапии и угрожающее жизни состояние - бластный криз, когда из-за резкого увеличения количества бластных клеток течение заболевания становится похожим на острый лейкоз. Для бластного криза характерна агрессивная симптоматика: лейкемиды кожи, тяжелые кровотечения, вторичные инфекции, высокая температура, возможен разрыв селезенки.
Хронический лимфолейкоз
Долгое время единственным признаком хронического лимфолейкоза может быть лимфоцитоз до 40-50%, незначительное увеличение одной-двух групп лимфоузлов. В развернутый период лимфаденит принимает генерализованную форму: увеличиваются не только периферические, но и медиастинальные, мезентериальные, забрюшинные узлы. Возникает сплено- и гепатомегалия; возможно сдавление холедоха увеличенными лимфатическими узлами с развитием желтухи, а также верхней полой вены с развитием отеков шеи, лица, рук (синдром ВПВ). Беспокоят упорные оссалгии, кожный зуд, рецидивирующие инфекции.
Тяжесть общего состояния больных хроническим лимфоидным лейкозом обусловлена прогрессированием интоксикации (слабость, потливость, лихорадка, анорексия) и анемического синдрома (головокружение, одышка, сердцебиение, обморочные состояния).
Терминальная стадия хронического лимфоидного лейкоза характеризуется присоединением геморрагического и иммунодефицитного синдромов. В этот период развивается тяжелая интоксикация, возникают кровоизлияния под кожу и слизистые, носовые, десневые, маточные кровотечения.
Осложнения
Иммунодефицит, обусловленный неспособностью функционально незрелых лейкоцитов выполнять свои защитные функции, проявляется синдромом инфекционных осложнений. У больных хроническим лимфолейкозом часты легочные инфекции (бронхиты, бактериальные пневмонии, туберкулезные плевриты), грибковые поражения кожи и слизистых, абсцессы и флегмоны мягких тканей, пиелонефриты, герпетическая инфекция, сепсис.
Нарастают дистрофические изменения внутренних органов, кахексия, почечная недостаточность. Летальный исход при хроническом лимфоидном лейкозе наступает от тяжелых инфекционно-септических осложнений, кровотечений, анемии, истощения. Возможна трансформация хронического лимфолейкоза в острый лейкоз или лимфосаркому (неходжкинскую лимфому).
Предполагаемый диагноз устанавливается на основании анализа гемограммы, с результатами которой пациент должен быть немедленно направлен к врачу-гематологу. Для подтверждения диагноза проводится:
- Общий анализ крови. Типичные для хронического миелоидного лейкоза изменения включают: анемию, присутствие единичных миелобластов и гранулоцитов на разной стадии дифференцировки; в период бластного криза количество бластных клеток увеличивается более чем на 20%. При хроническом лимфолейкозе определяющими гематологическими признаками выступают выраженный лейкоцитоз и лимфоцитоз, наличие лимфобластов и клеток Боткина-Гумпрехта.
- Пункции и биопсии. С целью определения морфологии опухолевого субстрата показано выполнение стернальной пункции, трепанобиопсии, биопсии лимфоузлов. В пунктате костного мозга при хроническом миелолейкозе увеличено количество миелокариоцитов за счет незрелых клеток гранулоцитарного ряда; в трепанобиоптате определяется замещение жировой ткани миелоидной. При хроническом лимфоидном лейкозе миелограмма характеризуется резким усилением лимфоцитарной метаплазии.
- Инструментальные исследования. Для оценки выраженности лимфопролиферативного синдрома применяются УЗИ лимфатических узлов, селезенки, рентгенография грудной клетки, лимфосцинтиграфия, МСКТ брюшной полости и ряд других.
Лечение хронического лейкоза
На ранней доклинической стадии лечение неэффективно, поэтому больные подлежат динамическому наблюдению. Общережимные мероприятия предполагают исключение физических перегрузок, стрессов, инсоляции, электропроцедур и теплолечения; полноценное витаминизированное питание, длительные прогулки на свежем воздухе.
В развернутом периоде миелолейкоза назначается химиотерапевтическое лечение (бусульфан, митобронитол, гидроксимочевина и др.), при выраженной спленомегалии проводится облучение селезенки. Подобная тактика, хоть и не приводит к полному излечению, но существенно тормозит прогрессирование болезни и позволяет отсрочить наступление бластного криза. Кроме медикаментозной терапии, при хроническом миелоцитарном лейкозе используются процедуры лейкафереза. В ряде случаев излечение достигается с помощью трансплантации костного мозга.
При переходе хронического миелолейкоза в терминальную стадию назначается высокодозная полихимиотерапия. В среднем после установления диагноза больные хроническим миелолейкозом живут 3-5 лет, в отдельных случаях - 10-15 лет. Также проводится цитостатическая терапия (хлорбутин, циклофосфамид), иногда в сочетании со стероидной терапией, облучением лимфоузлов, селезенки, кожи. При значительном увеличении селезенки выполняется спленэктомия. Применяется трансплантация стволовых клеток, однако ее эффективность еще требует подтверждения.

Продолжительность жизни больных хроническим лимфоидным лейкозом может составлять от 2-3 лет (при тяжелых, неуклонно прогрессирующих формах) до 20-25 лет (при относительно благоприятном течении).
Механизм формирования филадельфийской хромосомы и ее роль в развитии хронического миелоидного лейкоза

Филадельфийская хромосома (Ph-chromosome) является наиболее частой цитогенетической аномалией, обнаруживающейся в зрелых В-клетках пациентов с хроническим миелоидным лейкозом (ХМЛ), причем встречаемость этой мутации растет с возрастом, у детей выявляясь в 5 %, а у взрослых — в 50-90 %, достигая максимума у больных в возрасте 35-50 лет [1].
В данном обзоре обобщены результаты работ, опубликованных в системе PubMed и посвященных механизму формирования данной генетической аномалии, а также кратко приведены последствия ее возникновения.
Ключевые слова: филадельфийская хромосома, транслокация, хронический миелолейкоз
Филадельфийская хромосома была открыта в 1960 г учеными из Университета Пенсильвании в Филадельфии (за что и была так названа), в 1973 г в работе Rowley [цит. по 2] было доказано, что она образуется именно путем транслокации. Так, у всех пациентов с ХМЛ в исследовании была обнаружена дополнительная последовательность на длинном плече 9 хромосомы. Это позволило предположить, что Ph-хромосома получается путем переноса части 22ой хромосомы на 9ую (а не простой делеции 22ой хромосомы, как думали изначально) [2].
Транслокация приводит к тому, что участок с онкогеном c-abl, кодирующим тирозинкиназу, переносится к специфическому участку разрыва на 22 хромосоме (breakpoint cluster region — bcr), вместе с тем индуцируя перенос 3'-части гена Абельсона (Abl) с 9ой хромосомы на 22ую вблизи 5'-конца такого же участка bcr [3]. Наиболее важная часть всего процесса — перестановка гена Abl на 22 хромосому рядом с геном bcr и образование химерного гена BCR-ABL [4].
Доказательство и основание переноса гена abl на 22ую хромосому приводятся ниже по работе [5]. Последовательность человеческого гена c-abl имеет гомологию с трансформирующим компонентом вируса мышиного лейкоза Абельсона (A-MuLV). Это ретровирус, имеющий геном в виде одноцепочечной РНК и способный встраиваться в геном клетки-хозяина путем образования ДНК с помощью обратной транскриптазы. Основной продукт A-MuLV -гена — полипротеин р120 gag - abl , обладающий тирозинкиназной активностью (как и продукт химерного человеческого гена). Таким образом, можно говорить о трансформирующей и «транслоцирующей» способности самого гена, возможно, объясняющихся внедрением части вирусного генома в человеческий.
Что касается переноса именно между этими двумя хромосомами, здесь все не так однозначно. Одним из методов диагностики ХМЛ является автоматизированное кариотипирование клеток в стадии метафазы [6], на которой и выявляются атипичные хромосомы (см. Рис.1). Это дает основание полагать, что именно на стадии метафазы, когда хромосомы выстраиваются в экваториальной плоскости клетки, обеспечивается такое взаимное расположение 9ой и 22ой хромосомы, что возникает предпосылка к обмену их участками.
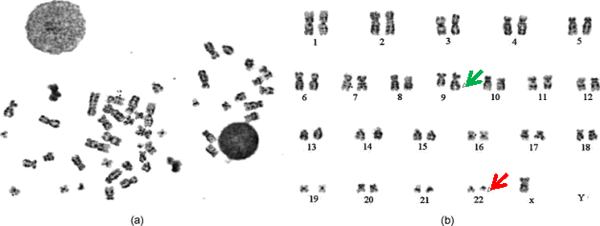
Рис. 1. а) Анализируемая клетка в метафазу и b) ее кариотип. Зеленая стрелка — удлиненная 9ая хромосома, красная стрелка — укороченная 22ая хромосома (Филадельфийская). Иллюстрация из [6] с изменениями.
Нормальный продукт гена BCR — цитозольный фосфопротеин массой 160кДа (р160 BCR ), функция которого не до конца определена. Известно, что первый экзон гена BCR кодирует серин/треонин-киназную активность этого белка, N-концевой домен которого отвечает за формирование димерной структуры, а С-конец обладает ГТФ-азной активностью. Также р160 BCR может быть вовлечен в каскад Ras путем фосфорилирования по тирозину в 177 положении, который таким образом становится способным связывать один из адаптерных белков этого пути [4].
Нормальный продукт гена ABL — тирозинкиназа массой 145 кДа (р145 ABL ), участвующая в процессах клеточного деления, дифференцировки, адгезии и ответа на стрессовые воздействия. С-конец отвечает за связывание с ДНК, а также имеет сайт связывания с актином. На N-конце белка находится три Src-домена: SH3, SH2, SH1. SH3- и SH2-домены регулирующие, а SH1-домен отвечает за наличие функции тирозинкиназы. Мутации в SH2-домене ослабляют связывание фосфотирозина, что приводит к снижению функции белка. SH3-домен имеет депрессорное значение, поэтому именно его удаление превращает белок в онкопротеин, т к его тирозинкиназная активность сильно возрастает [4].
Филадельфийская транслокация дает 3 новых продукта: p190 BCR - ABL , p210 BCR - ABL , p230 BCR - ABL , в каждом из которых нормальные последовательности р145 ABL и р160 BCR соединены голова-к-хвосту [4]. Именно изоформы p210 BCR - ABL обладают повышенной тирозинкиназной активностью и играют огромную роль в развитии хронического миелолейкоза.
Существует 2 изоформы p210 BCR - ABL : b2a2 и b3a2, различающиеся между собой на 25 аминокислот, кодируемых экзоном b3. На настоящий момент нет данных о том, как изоформенный состав связан с различными проявлениями ХМЛ [7].
Конечный продукт химерного гена представляет собой тетрамер, олигомеризация также стимулирует тирозинкиназную активность химерного белка [4].
Как уже было сказано, главный момент всех перестановок — сближение фрагментов ABL и BCR, поэтому в итоге не очень важно, как именно это сближение было достигнуто. Все вышеперечисленные варианты ведут к неконтролируемому функционированию мутантного продукта, что приводит к стимуляции многих путей клеточной прогрессии, но в особенности — гемопоэтического — поражаются стволовые клетки костного мозга. В результате наблюдается избыточная продукция незрелых клеток миелоидного ряда с неконденсированным хроматином — промиелоцитов, которые «давят» все остальные ростки в костном мозге, вытесняют жировую ткань, эритроциты, тромбоциты и т. д. (доля миелоидной ткани в межбалочных пространствах костного мозга может достигать 95-100 %).
Интересно, что несмотря на то, что у пациентов с ХМЛ также может наблюдаться миелофиброз (замещение гемопоэтической ткани костного мозга фиброзной), химерный ген обнаруживается только в клетках гемопоэтической ткани красного костного мозга, и не обнаруживается в фибробластах, что говорит о том, что фиброз является вторичным процессом, не связанным с мутацией напрямую [8].
В результате действия химерного белка нарушаются пути регуляции клеточного цикла, увеличивается пролиферация клеток, их чувствительность к факторам роста, а к проапоптотическим сигналам снижается, так же, как и снижается адгезивная способность к компонентам стромы костного мозга. Все это приводит к тому, что мутантные клетки имеют преимущество в делении (т. к. не чувствительны к апоптозу и быстрее делятся) и вытесняют здоровые клоны, а также выходят в кровь (из-за потери адгезивности) [9]
Почему же эти мутации затрагивают именно гемопоэтические клетки? Возможно, дело в том, что гемопоэтические и стромальные клетки происходят от разных предшественников. В эксперименте [10] было доказано, что стромальные клетки (адипоциты, фибробласты, эндотелиальные клетки и т. п.) и гемопоэтические — это две разные линии. Соответственно, и потенциал генетических изменений у них разный. И, конечно, имеет значение, что данные клетки относятся к быстро делящимся (все ростки включают регулярно обновляемые клетки). Чем быстрее клетки должны обновляться, тем раньше станут заметны их нарушения.
Исходя из этих данных, можно объяснить симптомы ХМЛ. Усталость, истощение, лихорадка являются прямым следствием воспалительных процессов, которые сопровождают любую опухоль; геморрагии отражают тромбоцитопению; боль в костях является следствием неконтролируемой пролиферации клеток в костном мозге; гепато- и спленомегалия, а также лимфаденопатия объясняются заселением этих органов бластными формами; неврологические симптомы возникают вследствие метастазов в головной и спинной мозг. Смерть больных наступает от инфекционных процессов или геморрагического синдрома [11].
7. Wang X., Zheng B., Li S., Mulvihill J. J., Chen X., Liu H. Automated identification of abnormal metaphase chromosome cells for the detection of chronic myeloid leukemia using microscopic images. J Biomed Opt., 2010; 15(4)046026, doi: 10.1117/1.3476336
8. Melo JV, The molecular biology of chronic myeloid leukaemia.Leukemia, 1996; 10(5): 751. PMID: 8656667
Основные термины (генерируются автоматически): костный мозг, BCR, ABL, клетка, филадельфийская хромосома, химерный ген, хромосома, гемопоэтическая ткань, нормальный продукт гена, химерный белок.
Миелолейкоз

Миелолейкоз относится к группе миелопролиферативных злокачественных заболеваний крови с патологическим делением нескольких или единственной группы кровяных телец. Пролиферация означает процесс, когда увеличивается количество клеток, а в медицине это определяется как разрастание тканей за счет аномального деления клеток в организме. Клетка-клон попадает в костный мозг, другие органы, происходит ее деление и вытеснение тканей, осуществляющих жизненно важные функции. Хронический миелолейкоз (ХМЛ) является редким заболеванием, встречается лишь один случай на 100 тысяч человек, и в основном это происходит со взрослыми людьми, пик болезней приходится на возраст 45-55 лет. Диагностировать миелолейкоз достаточно трудно, поскольку долгое время он протекает без каких-либо симптомов, или они незначительны. Часто эта разновидность онкологического заболевания выявляется при аналитических исследованиях крови.

Цены на услуги
| Наименование услуги | Цена (руб.) |
|---|---|
| Первичная консультация гематолога | 2200 |
| Повторная консультация гематолога | 1800 |
Причины развития хронического миелолейкоза
Ученые склоняются к тому, что главная среди причин миелолейкоза - наличие транслокации хромосом, то есть когда участки 9-й и 22-й хромосом меняются местами. В результате присоединения онкогена ABL из 9-й хромосомы к гену BCR в 22-й образуется гибридный ген, который служит источником онкогенного белка. Он и защищает опухолевые клетки от гибели, они попадают в кровяное русло, достаточно быстро развивается заболевание.
Называется такая мутация хромосомы филадельфийской по месту ее открытия американскими учеными в начале 60-х годов прошлого века. Способствует появлению этой аномалии облучение ионизирующего типа и контакт с химическими веществами (антрациклины, эпиподофилотоксины), но по причинам образования этого изменения в кариотипе человека у ученых нет единого мнения. 95 процентов случаев болезни связаны с наличием в кариотипе филадельфийской хромосомы и формирования из-за этого открытой рамки считывания устойчивого типа, что и является причиной миелолейкоза. Вероятность его увеличивается при синдроме Блума и анемии Фанкони.
Механизм зарождения хронического миелолейкоза связан с генетикой, и характеризуется образованием BCR - ABL гена при филадельфийской транслокации хромосом. Образование такого гена является предшественником последующей болезни. При этом кодируется белок химерного типа, который значительно увеличивает тирозинкиназную активность. Его участки активируются, начинается процесс увеличения клеточного деления, приводящий к болезни. В основном числе случаев появляется патология гранулоцитарного ростка, но бывают, что поражаются и другие гемопоэтические ростки - лейкоцитов, моноцитов…
Начинается все без симптомов для человека, и если причина не выявлена, эффективное лечение не проведено, то в конечном итоге происходит развитие болезни, что приводит к самой тяжелой стадии бластному кризу при миелолейкозе, схожему с острой формой лейкоза, выживаемость при котором небольшая.
Признаки хронического миелолейкоза
Наличие признаков хронического миелолейкоза зависят от стадии болезни:

Коварство такого вида рака крови состоит в трудности диагностики на начальной стадии, при которой ярко выраженных признаков течения болезни нет. Стоит внимательно относиться к своему здоровью и регулярно заниматься профилактикой возникновения ХМЛ. В медицинском центре “Вера в НАС” есть все возможности для проведения качественных лабораторных исследований, позволяющих выявить болезнь на ранних стадиях.
Решающее значение для выявления хронического миелолейкоза дают показатели крови. Об этом более подробно будет рассказано ниже. Для диагностики применяются следующие анализы:
- полный клинический анализ крови, позволяющий дать объективную картину по количеству лейкоцитов, эритроцитов, тромбоцитов и выявить отклонения от нормы, что служит толчком для дальнейших исследований;
- биохимический анализ крови при хроническом миелолейкозе, дающий картину по патологическим изменениям в почках и печени;
- генетические тесты с целью обнаружения “филадельфийской” хромосомы, позволяющие с высокой степенью вероятности диагностировать миелоидный лейкоз. Это цитогенетика, флюоресцентная in situ гибридизация, полимеразная цепная реакция, позволяющая безошибочно обнаружить BCR - ABL ген и другие;
- визуализационные методы - КТ, МРТ, УЗИ, которые впрямую не диагностируют ХМЛ и ОМЛ (острый миелолейкоз), но указывают на увеличения кроветворного органа - селезенки и печени, что также является признаками этой болезни;
- аспирация и биопсия костного мозга, когда берутся образцы кусочков костей и костного мозга на предмет исследования лейкозных клеток.
Современные методы диагностики позволяют безошибочно выявить болезнь, при эффективном лечении возможно приостановить ее прогрессирование.
Стадии миелолейкоза
В процессе классификации болезни выделяют три стадии миелолейкоза:
- Хроническая или доклиническая. Несмотря на отсутствие ярко выраженных симптомов, до 85 процентов больных выявляются именно на этом этапе развития заболевания. В общем анализе крови увеличиваются гранулоциты (лейкоциты), и это становится толчком для последующих шагов по исследованиям.
- Акселераторная фаза миелолейкоза. Здесь возникает характерная для хронического миелолейкоза картина крови: количество базофилов в периферийной крови превышает 20 процентов, появляются от 10 до 19 процентов бластов в костном мозге или крови, тромбицитоз, повышение содержание лейкоцитов, причем они могут удваиваться каждые пять дней вне зависимости от применяемой терапии. “Белые” клетки крови стремительно нарастают, что и характерно для миелоидных типов лейкозов, к которым относится ХМЛ.
- Бластный криз. Критерием хронического миелолейкоза при его перерастании в эту самую опасную стадию развития болезни является количество бластов в крови или костном мозге, и когда оно переваливает за 20 процентов, то это наступление критической фазы заболевания, которое приводит к смертельному исходу и почти не поддается терапевтическим методам лечения. При биопсии на этой стадии обнаруживают значительные группы бластов в костном мозге, развивается хлорома, клиническая картина состояния больного стремительно ухудшается. Выживаемость на данной стадии для больных является незначительной, и срок жизни не превышает нескольких месяцев.
Поскольку чаще всего болезнь выявляется на первой стадии, то никаким приговором диагноз не является, главное понимать, что это за заболевание - миелолейкоз - через какие стадии оно проходит, и как лечится. В значительном числе случаев удается достичь продолжительной ремиссии, важно только не упускать драгоценное время, чаще бывать у врача, хотя бы раз в год или чаще сдавать общий анализ крови, а также анализ на лейкоцитарную формулу крови. В ней присутствует пять типов лейкоцитов (нейтрофилы, лимфоциты, базофилы, эозинофилы, моноциты), особое внимание стоит уделить базофилам. В любом случае все шаги следует согласовывать с врачом, и в медицинском центре “Вера в НАС” есть квалифицированные и грамотные специалисты по ряду основных медицинских направлений. Здесь проходят качественную диагностику и получают полноценные консультации.

Для лечения миелолейкоза применяется как терапевтические так и хирургические методы, связанные с пересадкой костного мозга. Для терапии используются следующие препараты:
- бусульфан и гидреа приостанавливают увеличение лейкоцитов в крови;
- альфа-интерферон иногда в сочетании с цитарабином в ряде случаев замедляет клинику миелолейкоза;
- современное медикаментозное средство гливек (другое название - иматиниб) позволяет продлить жизнь больным более эффективно, его прием гораздо легче переносится. Обычно его назначают сразу после постановки диагноза;
- если иматиниб не переносится больными или терапия с ним не дает результатов, то назначают спрайсел или препарат тасигна, которые также хорошо помогают пациентам.
На стадии бластного криза перечисленные выше лекарства вряд ли окажут помощь, там их применяют по возможности и в разных комбинациях и используют терапию по аналогии с индукцией при остром течении лейкоза.
Кроме этого, на ранних стадиях болезни рекомендуют циторедуктивную и цитостатическую терапию, для того чтобы уменьшить массу возникшей опухоли. Лекарственные виды воздействия на организм больного являются основными на основных стадиях течения болезни. В составе комплексного лечения есть и вспомогательные процедуры. Когда ухудшившееся кроветворение вследствие развития заболевания и высокого уровня лейкоцитов и вязкости крови оказывают серьезное влияние на кровоснабжение жизненно важных органов, применяется лейкаферез или отделение и удаление белых кровяных клеток. Накопление лейкоцитов после процедуры уменьшается.
Применяется также лучевая терапия, которая ставит своей целью разрушить лейкозные клетки при помощи ионизированного облучения. Такое облучение содействует возникновению филадельфийской хромосомы и бывает причиной возникновения ХМЛ, но когда болезнь уже возникла, лучевая терапия способствует уменьшения симптомов. Ее применяют и перед пересадкой костного мозга. Кроме того, применяют трансплантацию стволовых клеток от самого пациента или имеющихся доноров. Это позволяет лучше переносить интенсивную химиотерапию и довольно быстро достичь продолжительной ремиссии в целом ряде наблюдаемых случаев.
Отдельно следует сказать о радикальном способе лечения - пересадке костного мозга. Часть клеток с генетическими изменениями, вызывающие ХЛМ, несмотря на интенсивное терапевтическое лечение, сохраняются чаще всего в костном мозге, хотя и не дают тяжелой клинической картины. Это так называемая минимальная остаточная болезнь, и чтобы искоренить ее, нужно идти на кардинальные меры, чтобы добиться полной ремиссии. К этому как раз и ведет пересадка костного мозга, которая связана с высоким риском для пациента в связи с возможным отторжением трансплантата организмом хозяина. Там есть другие проблемы, связанные с химиотерапией, угрозой инфекций, но если вести речь о полном выздоровлении, то трансплантация костного мозга от донора при успешном проведении процедуры его зачастую дает. Чаще такая операция проводится для молодых пациентов с наличием родственного донора, в этом случае риски снижаются, а вероятность полного выздоровления увеличивается.
Но и терапевтическая схема лечения доказала свою высокую эффективность, она намного продлевает жизнь пациентам, в ряде случаев дает нормальные условия на протяжении продолжительного периода времени. Чем раньше диагностируется ХЛМ, чем раньше его обнаружила система здравоохранения и сам человек - тем легче его лечить и продлевать жизнь больному.
Течение не всегда поддается точному прогнозу. Примерно пять процентов случаев диагностируют уже на третьей стадии, и бывает так, что у этих больных и селезенка сильно не увеличена, и лейкоцитоз не очень значительный, а картина характерна для бластного криза. Просто в данном случае хроническая стадия была до крайности быстротечной, и быстро наступила терминальная фаза.
В целом врачи выделяют следующие факторы, влияющие на прогноз при хроническом миелолейкозе:
- возраст пациента;
- количество клеток-бластов;
- ответ организма на лекарственную терапию и другие факторы.
Самая длительная продолжительность жизни при постановке такого диагноза на данный момент составляет 30 лет. Важно, что период жизни больных резко увеличился в последнее время из-за появления новых препаратов. Только до 5 процентов больных до последнего десятилетия жили дольше 10 лет при постановке диагноза ХМЛ. Но сейчас нередки случаи продления жизни до 15-20 лет.
Очень важно начать лечение как можно раньше! Дело в том, что если болезнь переходит в стадию акселерации, то срок жизни больного обычно - 1-1.5 года, а при его тяжелом состоянии и бластном кризе этот период измеряется уже несколькими месяцами. Нужно знать, что по исследованиям, проводимым до появления современных препаратов типа иматиниба, медианным прогнозом продолжительности жизни больных ХЛМ с момента постановки диагноза был 44-51 месяц. Сейчас срок вырос, как и количество пациентов с длительной ремиссией.
В любом случае все это средние значения по многим исследованиям, и какие-либо прогностические моменты по течению болезни того или иного пациента высказываются только лечащим врачом. Все это сугубо индивидуально, зависит от стадии болезни, возраста, особенностей организма и многих других факторов.
Профилактика миелолейкоза
Поскольку до конца не понятен механизм появления “филадельфийской” хромосомы в организме человека и не выявлены факторы, на это влияющие, то специфических методов профилактики именно этой, к счастью редко встречающейся болезни, не существует.
Важной задачей являются регулярные визиты к врачу с целью своевременной диагностики коварной болезни. Нужно делать общие анализы крови, позволяющие в первом приближении распознать хронический миелолейкоз на ранней стадии, и принять незамедлительные меры по лечению. Если появляются малейшие сомнения, прежде всего по количеству лейкоцитов - проконсультируйтесь с врачом! Возможно, что потребуется анализ лейкоцитарной формулы, какие-то другие исследования, которые позволят диагностировать ХМЛ и назначить эффективное лечение. Все это безболезненно и быстро, зато вы будете спокойны, что кроветворная система у вас в порядке.
Хорошие возможности для диагностики и лечения созданы в медицинском центре “Вера в НАС”, где быстро и качественно проведут необходимые лабораторные исследования, грамотно проконсультируют по возникающим проблемам, отправят в случае необходимости к профильным специалистам.
Отличными методами профилактики любых онкологических заболеваний, в том числе и ХМЛ и ОМЛ, является здоровый образ жизни, занятия спортом, хорошее питание, соблюдение рационального режима труда и отдыха. Не всегда удается уделять этому времени, но профилактическое значение ЗОЖ трудно переоценить!
Читайте также:
