Генная терапия рака - возможности
Добавил пользователь Skiper Обновлено: 21.01.2026
Трансфекция клеток
Для начала стоит ввести определения некоторых терминов. Транспорт генов осуществляется благодаря вектору - это молекула ДНК, используемая как «транспортное средство» для искусственного переноса генетической информации в клетку. Выделяют множество разновидностей векторов: плазмидные, вирусные, а также космиды, фазмиды, искусственные хромосомы и т.д. Принципиально важно, что векторы (в частности, плазмидные) обладают характерными для них свойствами: 1. Точка начала репликации (ori) - последовательность нуклеотидов, с которой начинается удвоение ДНК. Если векторная ДНК не сможет удваиваться (реплицироваться), то необходимый лечебный эффект не будет достигнут, потому что она просто быстро расщепится внутриклеточными ферментами-нуклеазами, а из-за недостатка матриц будет в итоге образовано гораздо меньше молекул белка. Следует отметить, что эти точки специфичны для каждого биологического вида, то есть если векторную ДНК предполагается получать путём её размножения в культуре бактерий (а не просто химическим синтезом, что обычно гораздо дороже), то потребуются отдельно две точки начала репликации - для человека и для бактерий; 2. Сайты рестрикции - специфические короткие последовательности (чаще палиндромные), которые узнаются специальными ферментами (эндонуклеазы рестрикции) и разрезаются ими определённым образом - с образованием «липких концов». Эти сайты необходимы для того, чтобы сшить векторную ДНК (которая, по сути, является «болванкой») с нужными терапевтическими генами в единую молекулу. Такая сшитая из двух или нескольких частей молекула зовётся «рекомбинантной»; 3. Понятно, что нам желательно бы получить миллионы копий рекомбинантной молекулы ДНК. Опять-таки, если мы имеем дело с культурой клеток бактерий, то далее эту ДНК нужно выделить. Проблема заключается в том, что далеко не все бактерии проглотят нужную нам молекулу, некоторые не станут этого делать. Чтобы эти две группы всё-таки различить, в векторную ДНК вставляют селективные маркёры - участки устойчивости к определённым химическим веществам; теперь если в среду добавить эти самые вещества, то выживут только те, которые обладают устойчивостью к ним, а остальные погибнут. Все эти три составляющие можно наблюдать и в самой первой искусственно синтезированной плазмиде: Сам процесс внедрения плазмидного вектора в определённые клетки называется трансфекцией. Плазмида - это довольно короткая и обычно кольцевая молекула ДНК, которая находится в цитоплазме бактериальной клетки. Плазмиды не связаны с бактериальной хромосомой, они могут реплицироваться независимо от нее, могут выбрасываться бактерией в окружающую среду или, наоборот, поглощаться (процесс поглощения - трансформация). С помощью плазмид бактерии могут обмениваться генетической информацией, например, передавать устойчивость к определённым антибиотикам. Плазмиды существуют в бактериях в естественных условиях. Но никто не может помешать исследователю искусственно синтезировать плазмиду, которая будет обладать нужными для него свойствами, вшить в нее ген-вставку и внедрить в клетку. В одну и ту же плазмиду можно вшивать разные вставки .
Методы генной терапии
Существует два основных подхода, различающиеся природой клеток-мишеней: 1. Фетальная, при которой чужеродную ДНК вводят в зиготу (оплодотворённую яйцеклетку) или эмбрион на ранней стадии развития; при этом ожидается, что введённый материал попадёт во все клетки реципиента (и даже в половые клетки, обеспечив тем самым передачу следующему поколению). В нашей стране она фактически запрещена ; 2. Соматическая, при которой генетический материал вводят уже родившемуся в неполовые клетки и он не передаётся половым клеткам. Генная терапия in vivo основана на прямом введении клонированных (размноженных) и определенным образом упакованных последовательностей ДНК в определённые ткани больного. Особенно перспективным для лечения генных болезней in vivo представляется введение генов с помощью аэрозольных или инъецируемых вакцин. Аэрозольная генотерапия разрабатывается, как правило, для лечения лёгочных заболеваний (муковисцидоз, рак лёгких). Разработке программы генной терапии предшествует много этапов. Это и тщательный анализ тканеспецифической экспрессии соответствующего гена (т. е., синтеза на матрице гена какого-то белка в определённой ткани), и идентификация первичного биохимического дефекта, и исследование структуры, функции и внутриклеточного распределения его белкового продукта, а также биохимический анализ патологического процесса. Все эти данные учитываются при составлении соответствующего медицинского протокола.
Прямая доставка и клеточные носители терапевтических генов
Существует множество методов внедрения чужеродной ДНК в эукариотическую клетку: некоторые зависят от физической обработки (электропорация, магнетофекция и т.д.), другие - от применения химических материалов или биологических частиц (например, вирусов), которые используются как переносчики. Сразу стоит оговориться, что обычно комбинируются химические и физические методы (например, электропорация + окутывание ДНК липосомами). Прямые методы 1. Трансфекция на химической основе может быть классифицирована на несколько видов: с использованием вещества циклодекстрина, полимеров, липосом или наночастиц (с или без химической или вирусной функционализации, т.е. модификации поверхности): а) Один из самых дешевых методов - использование фосфата кальция. Он повышает эффективность включения ДНК в клетки в 10-100 раз. ДНК образует с кальцием прочный комплекс, что обеспечивает его эффективное поглощение. Недостаток - ядра достигает всего около 1 - 10% ДНК. Метод используется in vitro для переноса ДНК в клетки человека: б) Применение сильноразветвленных органических молекул - дендример, для связывания ДНК и переноса её в клетку: в) Очень эффективным методом для трансфекции ДНК является внедрение её через липосомы - малые, окруженные мембраной тельца, которые могут сливаться с клеточной цитоплазматической мембраной (ЦПМ), представляющая собой двойной слой из липидов. Для эукариотических клеток трансфекция производится эффективнее с применением катионных липосом, потому что клетки к ним более чувствительны. Процесс имеет своё название - липофекция. Этот метод сегодня считается одним из самых безопасных. Липосомы нетоксичны и неиммуногенны. Однако, эффективность переноса генов с помощью липосом ограничена, поскольку внесенная ими ДНК в клетках обычно сразу же захватывается лизосомами и разрушается. Введение ДНК в клетки человека с помощью липосом сегодня является главным при терапии in vivo: г) Еще один метод - использование катионных полимеров, таких как диэтиламиноэтил-декстран или полиэтиленимин. Отрицательно заряженные молекулы ДНК связываются с положительно заряженными поликатионами, и этот комплекс далее проникает в клетку путём эндоцитоза. ДЭАЭ-декстран изменяет физические свойства плазматической мембраны и стимулирует поглощение этого комплекса клеткой. Главный недостаток метода заключается в том, что ДЭАЭ-декстран в высоких концентрациях токсичен. Метод не получил распространения в генотерапии; д) С помощью гистонов и других ядерных белков . Эти белки, содержащие много положительно заряженных аминокислот (Lys, Arg), в естественных условиях помогают компактно уложить длинную цепь ДНК в сравнительно небольшое ядро клетки. 2. Физические методы: а) Электропорация - очень популярный метод; мгновенное повышение проницаемости мембраны достигается за счет того, что клетки подвергаются коротким воздействиям интенсивного электрического поля. Показано, что в оптимальных условиях количество трансформантов может достигать 80% выживших клеток. На человеке на сегодняшний день не используется. б) «Cell squeezing» - метод, изобретенный в 2013 г. Он позволяет доставить молекулы в клетки путём "мягкого сдавливания" клеточной мембраны. Метод исключает возможность токсичности или неправильного попадания по мишени, так как он не зависит от внешних материалов или электрических полей; в) Сонопорация - метод искусственного переноса чужеродных ДНК в клетки с помощью воздействия на них ультразвуком, вызывающим открывание пор в клеточной мембране; г) Оптическая трансфекция - метод, при котором производится крошечное отверстие в мембране (около 1 мкм в диаметре) при использовании сильносфокусированного лазера; д) Гидродинамическая трансфекция - метод доставки генетических конструкций, белков и т.д. путем контролируемого повышения давления в капиллярах и межклеточной жидкости, что вызывает кратковременное повышение проницаемости клеточных мембран и образование в них временных пор. Осуществляется быстрой инъекцией в ткань, доставка при этом является неспецифичной. Эффективность доставки для скелетной мышцы - от 22 до 60% ; е) Микроинъекция ДНК - введение в ядро клетки животных с помощью тонких стеклянных микротрубочек (d=0,1-0,5 мкм). Недостаток - сложность метода, высока вероятность разрушения ядра либо ДНК; можно трансформировать ограниченное число клеток. Не используется для человека. 3. Методы на основе частиц. а) Прямой подход к трансфекции - генная пушка, при этом ДНК сцепляют в наночастицу с инертными твердыми веществами (чаще золото, вольфрам), которая затем «выстреливает» направленно в ядра клеток-мишеней. Этот метод применяется in vitro и in vivo для введения генов, в частности, в клетки мышечных тканей, например при таком заболевании, как миодистрофия Дюшена. Размеры частиц золота - 1-3 мкм. б) Магнитофекция - метод, использующий силы магнетизма для доставки ДНК в клетки-мишени. Сначала нуклеиновые кислоты (НК) ассоциируются с магнитными наночастицами, а далее, под действием магнитного поля, частицы загоняются в клетку. Эффективность почти 100%-ная, отмечена явная нетоксичность. Уже через 10-15 мин частицы регистрируются в клетке - это гораздо быстрее других методик. в) Импалефекция (impalefection; "impalement", букв. "сажание на кол" + "infection") - метод доставки с применением наноматериалов, таких как углеродные нанотрубки и нановолокна. При этом клетки буквально протыкаются подстилкой из нанофибрилл . Приставка «нано» применяется для обозначения их очень маленьких размеров (в пределах миллиардных долей метра). Отдельно стоит выделить такой метод, как РНК-трансфекция: в клетку доставляется не ДНК, а молекулы РНК - их «преёмники» в цепи биосинтеза белка; при этом активизируются специальные белки, разрезающие РНК на короткие фрагменты -- т.н. малые интерферирующих РНК (миРНК). Эти фрагменты связываются с другими белками и, в конце концов, это приводит к угнетению экспрессии клеткой соответствующих генов. Таким образом можно заблокировать в клетке действие тех генов, которые потенциально на данный момент приносят больше вреда, чем пользы. Широкое применение РНК-трансфекция нашла, в частности, в онкологии. Основные принципы доставки генов с использованием плазмидных векторов рассмотрены. Теперь можно перейти к рассмотрению вирусных методов. Вирусы - это неклеточные формы жизни, чаще всего представляющие собой молекулу нуклеиновой кислоты (ДНК или РНК), обёрнутой в белковую оболочку. Если вырезать из генетического материала вируса все те последовательности, которые вызывают возникновение заболеваний, то весь вирус также можно успешно превратить в «транспортное средство» для нашего гена. Процесс внедрения ДНК в клетку, опосредованное вирусом, называется трансдукцией. На практике чаще всего используют ретровирусы, аденовирусы и аденоассоциированные вирусы (AAV). Для начала стоит разобраться, каким должен быть идеальный кандидат для трансдукции среди вирусов. Критерии таковы, что он должен быть: • стабилен; • ёмок, то есть вмещать достаточное количество ДНК; • инертным в отношении метаболических путей клетки; • точным - в идеале, должен встраивать свой геном в конкретный локус генома ядра хозяина и др. В реальной жизни очень сложно скомбинировать хотя бы несколько пунктов, так что обычно выбор происходит при рассмотрении каждого индивидуального случая в отдельности. Из всех трёх перечисленных наиболее используемых вирусов самыми безопасными и одновременно самыми точными являются AAV. Их почти что единственный недостаток - сравнительно малая ёмкость (ок. 4800 п.н.), которая, однако, оказывается достаточной для многих генов . Помимо перечисленных методов достаточно часто генная терапия применяется в комбинации с клеточной: при этом сначала в питательную среду высаживают культуру определённых клеток человека, после этого тем или иным способом внедряют в клетки нужные гены, некоторое время культивируют и снова пересаживают в организм хозяина. В результате клеткам можно вернуть их нормальные свойства. Так, к примеру, модифицировали белые клетки крови человека (лейкоциты) при лейкемии:
Судьба гена после его попадания в клетку
Так как с вирусными векторами всё более-менее ясно в силу их свойства более эффективно доставлять гены до конечной цели - ядра, то остановимся на судьбе плазмидного вектора. На данном этапе мы добились того, что ДНК прошла первый большой барьер - цитоплазматическую мембрану клетки. Далее, в комплексе с другими веществами, оболочкой или без, ей необходимо достигнуть клеточного ядра, чтобы специальный фермент - РНК-полимераза - синтезировала молекулу информационной РНК (иРНК) на матрице ДНК (этот процесс называется транскрипция). Только после этого иРНК выйдет в цитоплазму, образует комплекс с рибосомами и согласно генетическому коду синтезируется полипептид - например, фактор роста сосудов (VEGF), который начнёт выполнять определённую терапевтическую функцию (в данном случае - запустит процесс образования ветвлений сосудов в ткани, подверженной ишемии). Что касается экспрессии введенных генов в требуемом типе клеток, то эта задача решается с помощью регуляторных элементов транскрипции. Ткань, в которой происходит экспрессия, часто определяется комбинацией специфичного для этой ткани энхансера(«усиливающей» последовательности) с определенным промотором (последовательность нуклеотидов, с которой РНК-полимераза начинает синтез), который может быть индуцируемым . Известно, что активность генов можно модулировать in vivo внешними сигналами, а так как энхансеры могут работать с любым геном, то в вектора можно вводить еще инсуляторы, которые помогают энхансеру работать независимо от его положения и могут вести себя как функциональные барьеры между генами. Каждый энхансер содержит набор участков связывания активирующих или супрессирующих белковых факторов . С помощью промоторов можно также регулировать уровень экспрессии генов. Например, есть металлотионеиновые или температурочувствительные промоторы; промоторы, управляемые гормонами. Экспрессия гена зависит от его положения в геноме. В большинстве случаев существующие вирусные методы приводят лишь к случайному встраиванию гена в геном. Чтобы исключить такую зависимость, при конструировании векторов снабжают ген известными нуклеотидными последовательностями, которые позволяют гену экспрессироваться независимо от места его встраивания в геном. Наиболее простой путь регуляции экспрессии трансгена - это обеспечение его индикаторным промотором, который чувствителен к физиологическому сигналу, такому, как выделение глюкозы или гипоксия. Такие «эндогенные» контролирующие системы могут быть полезны в некоторых ситуациях, таких, как осуществление глюкозозависимого контроля продукции инсулина. Более надежны и универсальны «экзогенные» системы контроля, когда экспрессия гена контролируется фармакологически введением маленькой лекарственной молекулы. В настоящее время известны 4 основные системы контроля - регулируемые тетрациклином (Tet), стероидом насекомых, экдизоном или его аналогами, антипрогестиновым препаратом майфпристоном (RU486) и химическими димеризаторами, такими, как рапамицин и его аналоги. Все они включают лекарственно зависимое привлечение домена активации транскрипции к основному промотору, ведущему нужный ген, но отличаются по механизмам этого привлечения .
Заключение
Обзор данных позволяет прийти к заключению, что, несмотря на усилия многих лабораторий мира, все уже известные и испытанные in vivoи in vitro векторные системы далеки от совершенства . Если проблема доставки чужеродной ДНК in vitro практически решена, а ее доставка в клетки-мишени разных тканей in vivo успешно решается (главным образом путем создания конструкций, несущих рецепторные белки, в том числе и антигены, специфичные для тех или иных тканей), то другие характеристики существующих векторных систем - стабильность интеграции, регулируемая экспрессия, безопасность - все еще нуждаются в серьезных доработках. Прежде всего, это касается стабильности интеграции. До настоящего времени интеграция в геном достигалась только при использовании ретровирусных либо аденоассоциированных векторов. Повысить эффективность стабильной интеграции можно путем совершенствования генных конструкций типа рецептор-опосредованных систем либо путем создания достаточно стабильных эписомных векторов (то есть ДНК-структур, способных к длительному пребыванию внутри ядер). В последнее время особое внимание уделяется созданию векторов на базе искусственных хромосом млекопитающих. Благодаря наличию основных структурных элементов обычных хромосом такие мини-хромосомы длительно удерживаются в клетках и способны нести полноразмерные (геномные) гены и их естественные регуляторные элементы, которые необходимы для правильной работы гена, в нужной ткани и в должное время. Генная и клеточная терапия открывает блестящие перспективы для восстановления утраченных клеток и тканей и генно-инженерного конструирования органов, что, несомненно, существенно расширит арсенал методов для медико-биологических исследований и создаст новые возможности для сохранения и продления жизни человека .
На пути к безопасной химиотерапии

Новость
«Доспехи» из чертополоха: новая стратегия защиты печени от побочных эффектов лекарств.
рисунок автора статьи
Автор
Редакторы
Статья на конкурс «Био/Мол/Текст»: На протяжении последних 50 лет химиотерапия, несмотря на серьёзные побочные эффекты, остаётся главным способом лечения рака. Значительный урон при этом наносится клеткам печени — гепатоцитам, в связи с чем понятие «гепатотоксичность» до недавнего времени было практически неотделимо от химиотерапии. Результаты новых исследований указывают на возможность сменить эту парадигму и сделать лечение рака гораздо более безопасным. Рассказываем о новом подходе, предложенном в 2020 году коллективом российских и американских учёных.

Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Своя работа» конкурса «Био/Мол/Текст»-2020/2021.
Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Лекарства из «чёрного ящика»
Приём некоторых лекарственных препаратов, включая противораковые, нередко сопровождается тяжелыми побочными эффектами. Зачастую врачи вынуждены приостанавливать назначенный пациенту курс химиотерапии из-за серьёзной нагрузки на печень, что может в конечном итоге привести к непоправимым последствиям , 1.
Из-за отсутствия лучшей альтернативы приходится использовать лекарства, балансирующие на тонкой грани между терапевтическим эффектом и колоссальным ущербом для организма. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов FDA (Food and Drug Administration) выделило такие препараты в отдельный список под названием black box warning (англ. — предупреждение: «чёрный ящик»). Эта маркировка означает предельно допустимый риск, которому подвергается пациент при приёме лекарства. Препараты из «чёрного ящика» могут привести к значительным или даже опасным для жизни побочным эффектам. Среди таких лекарств — дакарбазин, флутамид и гемтузумаб, на которых присутствует маркировка FDA с предупреждением о гепатотоксичности , [7].
Лекарственная гепатотоксичность — это появление структурно-функциональных поражений печени, вызванных приёмом фармацевтических препаратов.
Противораковые средства на основе дакарбазина широко используются в клинической практике для лечения злокачественной меланомы, саркомы мягких тканей, классической лимфомы Ходжкина и неходжкинской лимфомы [8]. Однако, несмотря на высокую терапевтическую эффективность, данные многочисленных исследований свидетельствуют о тяжёлых гепатотоксических побочных эффектах дакарбазина [4], 9. При этом наибольший урон печени наносят активные формы кислорода — свободные радикалы, которые вырабатываются в ответ на приём противоракового лекарства [10].
Новая стратегия защиты печени
На базе Государственного университета Южной Дакоты российско-американский коллектив учёных разработал стратегию по защите печени от негативного влияния противораковых препаратов. Предложенный подход, не нарушая эффективности химиотерапии, позволяет значительно снизить показатели гепатотоксичности, при этом морфология печени остается близкой к нормальной. Успешность разработки была подтверждена в ходе экспериментов на животных. Результаты этого исследования опубликованы в журнале Frontiers in Bioengineering and Biotechnology [11]. Кроме того, новая стратегия по снижению побочных эффектов гепатотоксичных лекарств была защищена патентом.
В чём новизна?
Существующие в настоящее время методы защиты печени от гепатотоксичных лекарств предполагают продолжительный приём таблеток, содержащих молекулы-протекторы. Одним из наиболее часто используемых гепатопротекторов с доказанной клинической эффективностью является силимарин или его активный компонент - силибинин. Это вещество, полученное из семян расторопши (чертополоха), активирует антиоксидантные клеточные механизмы, напрямую нейтрализует свободные радикалы, препятствует провоспалительной активации макрофагов печени, вызванной приёмом лекарств.
Важно отметить, что фармакокинетика лекарств-гепатопротекторов, включая силибинин, далека от идеальной. Вводимые перорально, они очень быстро выводятся из организма, и лишь небольшая их часть достигает печени, что не позволяет в полной мере запустить защитные процессы. К тому же при таком подходе часть протекторных агентов может попадать в опухоль и оказывать нежелательное воздействие на ход противораковой терапии. Стандартный внутривенный способ введения этих молекул в свободном виде практически неосуществим из-за их низкой растворимости в воде.
Фармакокинетика — совокупность процессов, происходящих с лекарством после его попадания в организм: всасывание, распределение, метаболизм и выведение.
Чтобы преодолеть вышеуказанные ограничения, учёные разработали новую стратегию высокоэффективной доставки силибинина в печень путем его внутривенного введения в наноинкапсулированном виде. Препарат предназначен для использования перед началом химиотерапии в качестве превентивного средства. За счёт применения полимерных нанокапсул в качестве носителя гепатопротектор за короткое время и в достаточном количестве накапливается в тканях печени и запускает в них каскад реакций, благодаря которым активируются механизмы антиоксидантной защиты клеток. Таким образом, препарат позволяет эффективно «подготовить» печень к встрече с цитотоксическим противораковым лекарством.
Новый препарат стал результатом совместной работы химиков и специалистов по биомедицинской инженерии. Его активным компонентом является силибинин, а носителем служат нанокапсулы из полилактид-ко-гликолида — безопасного биоразлагаемого полимера (рис. 1). Разработанный метод инкапсуляции позволил получить однородные по размеру наночастицы с высоким содержанием силибинина (его массовая доля составила 15%). Одним из достоинств данного препарата является то, что активный компонент медленно выделяется из нанокапсул, что обеспечивает его повышенную концентрацию в тканях печени в течение продолжительного времени.
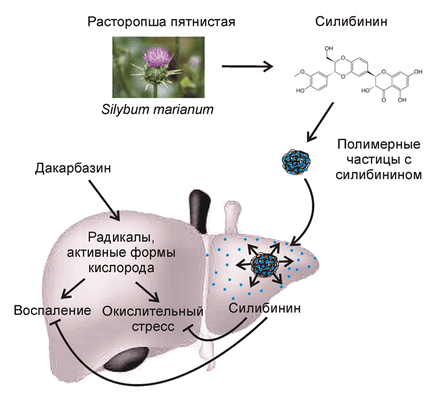
Рисунок 1. Препарат на основе силибинина и полимерных наночастиц для защиты печени от побочных эффектов противоракового лекарства (дакарбазина).
Превратить недостатки полимеров в достоинства
Любопытно, что классическим «недостатком» полимерных носителей для адресной доставки лекарств обычно считается их быстрое накопление в печени. Это серьёзно ограничивает возможности терапии с использованием полимерных носителей, т.к. в идеале они должны достигать очага поражения, минуя здоровые ткани и органы, в особенности — печень. Но в данном случае задача адресной доставки была совсем иной. Необходимо было обеспечить попадание молекулы-протектора именно в печень, и учёные превратили ключевой «недостаток» полимерных носителей в ощутимое преимущество.
Стоит отметить, что использование нанокапсул снижает риск локализации гепатопротектора в опухоли, что неизбежно при пероральном приеме таблеток. Таким образом, удаётся избежать возможного нежелательного воздействия этих молекул на эффективность противораковой терапии.
За счёт своей гидрофобной природы полимерные нанокапсулы после внутривенного введения быстро накапливаются в печени. Оказываясь в крови, эти частицы подвергаются опсонизации , после чего они становятся «узнаваемыми» для макрофагов печени и сразу же поглощаются ими. В данной работе наночастицы полилактид-ко-гликолида накапливались в печени уже в первый час после внутривенного введения. Используемый полимер после поглощения макрофагами подвергается гидролитической деградации до лактата и гликолевой кислоты, а высвобождающийся силибинин распространяется между соседними клетками печени.
Опсонизация — процесс адсорбции опсонинов (специальных белков) на поверхности инородных частиц, который стимулирует и облегчает их фагоцитоз.
Испытания на животных
В качестве противоопухолевого препарата, от которого нужно защищать печень, исследователи выбрали дакарбазин. Его часто используют для лечения злокачественных опухолей меланомы. К сожалению, несмотря на высокую терапевтическую эффективность, многочисленные исследования сообщают о гепатотоксических побочных эффектах лекарства, которые зачастую вынуждают прекращать терапию [4], [9]. В клинической практике наблюдались случаи острой печёночной недостаточности, веноокклюзионной болезни печени и даже смерти в течение нескольких дней после приёма дакарбазина.
В ходе доклинических испытаний животные с раковыми опухолями подвергались химиотерапии путём системного введения дакарбазина. Часть мышей проходила предварительную «подготовку», получая разработанный учёными препарат для защиты печени. Исследователи подобрали оптимальный временной интервал между введением протектора и дакарбазина, позволяющий получить наилучший защитный эффект. У животных, прошедших стандартную химиотерапию, были обнаружены признаки серьёзного повреждения печени — некроз сосудистого эндотелия, вакуолизация и некроз гепатоцитов. А морфология печени мышей, предварительно получавших протектор на основе нанокапсул и силибинина, была близка к нормальной (рис. 2).
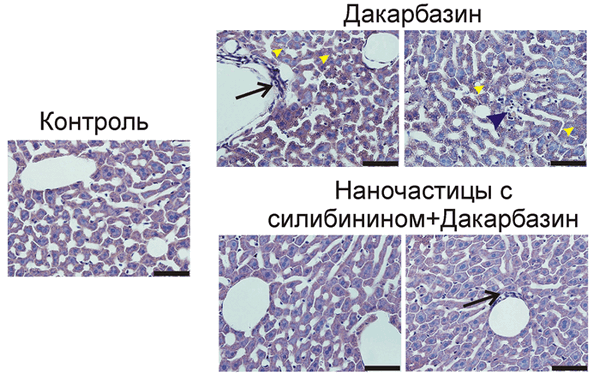
Рисунок 2. Морфология печени мышей, подвергавшихся воздействию дакарбазина и нового гепатопротектора. Контроль (нормальная морфология); дакарбазин (признаки повреждения печени); наночастицы с силибинином + дакарбазин (нормальная морфология, признаки повреждения отсутствуют). О некрозе гепатоцитов свидетельствует скопление лейкоцитов, поглощающих остатки погибших клеток (синяя стрелка). О некрозе сосудистого эндотелия свидетельствует скопление лейкоцитов в области эндотелия (чёрная стрелка). О вакуолизации свидетельствует наличие внутриклеточных пузырьков в гепатоцитах (жёлтые стрелки). Срезы окрашены гематоксилином и эозином.
Выбор оптимальных условий
Одним из механизмов действия силибинина является активация транскрипционного фактора Nrf2, который, в свою очередь, запускает в клетках экспрессию антиоксидантных ферментов, ферментов, восстанавливающих редокс-потенциал, и ферментов, способствующих деактивации свободных радикалов. Перед тем, как определиться с интервалом между введением протектора и дакарбазина, учёные поставили эксперимент, в котором определили, спустя какое время после однократного внутривенного введения протектора экспрессия этих ферментов в печени достигает максимальных значений. Именно это время соответствует наилучшей «подготовленности» клеток к встрече с цитотоксическим лекарством. Оно и было выбрано для дальнейших экспериментов в качестве интервала между введением протектора и дакарбазина (24 часа).
«Возможно, благодаря новой разработке удастся снять ограничения с широкого ряда лекарственных препаратов, использование которых лимитируется их гепатотоксичностью. Презентация наших работ в Бостоне на конференции CRS (Controlled Release Society) вызвала интерес со стороны фармацевтических компаний. Возможно, этот интерес перерастёт в проведение клинических испытаний», — отметил руководитель лаборатории, профессор Государственного университета Южной Дакоты Джошуа Рейнеке.
Все составные части разработанного препарата являются биосовместимыми и уже применяются в медицинской практике, что повышает шансы на ускоренный путь нового лекарства к клиническому использованию.
Генная терапия на поток: уже второй препарат от рака одобрен в США

Препарат, одобренный для клинического использования в США, использует технологию «настройки» иммунитета пациента против опухолевых клеток. Он заметно дешевле первого препарата такого рода. Станут ли лекарства для генной терапии панацеей от рака?
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (Food and Drug Administration, FDA) одобрило использование нового препарата генной терапии для лечения лимфомы. Об этом сообщает агентство Reuters.
Разработкой нового препарата Yescarta занималась корпорация Gilead Science. При этом лекарство для полного курса лечения стоит $350 000, что дешевле средства Kymriah компании Novartis, который пациентам обойдется в $475 000. Препарат предназначен для лечения B-клеточной лимфомы, которая тяжело поддается другим видам терапии. Лечение, как указывают производители, позволит «перепрограммировать» иммунные клетки человека так, чтобы они распознавали и боролись со злокачественными клетками.
Первый препарат генной терапии, Kymriah компании Novartis, борющийся с онкологическими заболеваниями, был одобрен FDA в августе 2017 года. Он был разработан для лечения острого лимфобластного лейкоза. При этом создатели Kymriah обещают взять деньги только с тех пациентов, которые достигнут прогресса в лечении в первый месяц. В Gilead Science подобных обещаний не дают. Как Kymriah, так и Yescarta пациентам потребуется ввести один раз.
Первый препарат и следующая революция
Юрий Дейгин, вице-президент Фонда «Наука за продление жизни», ранее объяснял Forbes, что рынок генной терапии имеет все шансы стать самым быстрорастущим рынком в мире в ближайшие 10 лет. Перспективы, которые человеку открывают генетические манипуляции, мотивируют компании «Большой Фармы» не только проводить собственные исследования, но и активно скупать наиболее многообещающие компании.
Novartis, как отмечал Дейгин, может положить начало широкому внедрению генной терапии в мировую клиническую практику. В случае с этой компанией американское ведомство одобрило терапию генномодифицированными лимфоцитами (CAR-T) для лечения пациентов в возрасте от 3 до 25 лет. Лечение помогает достигнуть ремиссии, а в некоторых случаях даже победить заболевание. СМИ назвали это событие «новой эрой медицины» — человечество при помощи генетических манипуляций постепенно справляется с неизлечимыми ранее заболеваниями. Кроме того, этот случай стал первым, когда такой препарат вышел на рынок США.
Технология CAR-T, которую используют обе терапии, заключается в «настройке» иммунитета пациента против опухолевых клеток, несущих на поверхности определенные маркеры. У больного берут T-лимфоциты, а затем при помощи безвредного вирусного вектора включают в геном этих клеток кассету, кодирующую химерный антигенный рецептор (CAR) против белков на поверхности злокачественных клеток. После этого клетки вводят обратно в кровь пациента, где они работают «по-новому».
«Следующая революция в регуляторном отношении FDA к генной терапии ожидается уже скоро: внутренние эксперты единогласно рекомендовали FDA одобрить уже «настоящую» (то есть введение пациенту носителя с геном) генную терапию против врожденного заболевания», — прогнозирует вице-президент фонда «Наука за продление жизни». Комментируя ценообразование на подобные препараты, Дейгин поясняет, что цена такой терапии обусловлена стоимостью производства препарата в гораздо меньшей мере, чем необходимостью окупить сотни миллионов долларов, потраченные на разработку. В то же время, по его мнению, со временем стоимость лекарств будет снижаться, «особенно после истечения срока патентов».
Сигнал для рынка
Руководитель онкологического направления биомедицинского холдинга «Атлас» Влад Милейко в беседе с Forbes отмечает, что значимым в этой истории становится появление процедуры стандартизации таких сложных технологий. «Это сигнал для индустрии и инвесторов, что у самых передовых продуктов теперь точно будет рынок, не имеющий регуляторных барьеров», — говорит он. При этом, по мнению собеседника Forbes, дальнейшего радикального снижения цен на такие препараты не будет до тех пор, пока речь идет о редактировании собственных (аутологичных) клеток пациента. «Это означает, что нельзя организовать массовое фармпроизводство, это всегда будет «пошив на заказ», — поясняет Милейко. Кроме того, по его словам, малое количество больных, которым нужны такие технологии, делает рынок слишком узким.
«Безусловно, это одна из перспективных технологий для лечения, которая наряду с другими методами прецизионной (точной) онкологии и молекулярного тестирования поможет в недалеком будущем сделать рак просто хроническим заболеванием, а не одной из причин смертности в мире. В профессиональной среде вопрос звучит именно о такой смене статуса онкологических заболеваний: сложно ожидать, что мы избавимся от них, как в свое время от оспы», — рассуждает представитель «Атласа».
Валерий Ильинский, генетик, основатель и генеральный директор Genotek, указывает, что революция произошла в момент разработки технологии. Сейчас же идет закономерный процесс регистрации технологии, которая доказала свою эффективность в ходе клинических испытаний. Собеседник Forbes подчеркивает, что кроме уже одобренных технологий на разных стадиях испытаний находится больше десятка аналогичных решений. «Я думаю, что одобрение таких технологий регулятором в США будет происходить каждый несколько месяцев», — прогнозирует Ильинский. Сравнивать цены, по его словам, сложно, поскольку не до конца известно, что именно будет включено в каждую услугу и технологию. «Я думаю, что мы будем видеть на рынке появление разных технологий с ценами и еще ниже, и гораздо выше. Но вряд ли в ближайшее время появится технология на основе генной терапии с ценой ниже $100 000», — полагает собеседник Forbes.
Основатель Genotek подчеркивает, что решения на основе генной терапии являются последним шагом — когда никакая другая терапия в борьбе с раком пациенту не помогает. «Я думаю, что это закономерное развитие стратегии лечения — сначала пациента пытаются лечить недорогими и эффективными препаратами, а если он не реагирует — применяют более дорогие, более опасные методы, но которые могут дать шанс. Генная терапия сейчас — последняя надежда для пациентов, не отвечающих на существующую терапию, однако это не значит, что не появится каких-то новых решений, позволяющих помочь пациентам, которым даже генная терапия не помогла (а такие, конечно же, есть)», — объясняет он.
Дейгин уточняет, что именно терапия CAR-T — локальное решение для 10% типов рака, хотя и прорывное. По его словам, для 90% раков (т.н. солидных опухолей) такая терапия пока не столь эффективна, хотя и существуют обнадеживающие данные. Таким образом, пока чрезвычайно рано говорить о победе над раком, заключает собеседник Forbes.
Перспективы в России
Подобные разработки ведутся и в России, но не так активно, как за рубежом. «Есть даже закон о клеточных технологиях, который потенциально позволяет такие технологии регистрировать и применять в медицине», — рассказывает Ильинский. По его прогнозам, аналогичные подходы появятся в России в ближайшие пару лет. В то же время собеседник Forbes отмечает, что интерес фармацевтических компаний сводится в возможности продавать те или иные продукты и услуги. «В США (где население почти в два раза больше, чем в России) многие страховые компании готовы оплачивать такие дорогие решения, чего нельзя сказать о России. Экономические соображения играют в этом заметную роль, хотя почти никогда и не обсуждаются публично», — заключает он.
Милейко соглашается с коллегой, что подобные проекты в России есть: этим направлением на уровне стартапов у нас занимаются несколько команд. При этом инвестиции в такие проекты в десятки раз ниже успешных компаний за рубежом, говорит он. Российские стартапы в этой области, по словам руководителя онкологического направления биомедицинского холдинга «Атлас», привлекают десятки миллионов рублей, когда международные стартапы «поднимают сегодня сотни миллионов долларов».
«Все они, как правило, находятся на базе нескольких крупных НИИ, так как для осуществления их деятельности требуется очень дорогая инфраструктура (лаборатории, чистые клеточные производства). Один из таких проектов базируется на НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой СПбГМУ им. акад. И. П. Павлова и уже получил поддержку «Сколково». Но в целом перспективы такой дорогостоящей технологии именно в российском здравоохранении весьма туманны. Поэтому скорее всего их решения ориентированы на международные рынки», — признает собеседник Forbes.
Ильинский замечает, что ученым вряд ли когда-либо удастся создать совершенный препарат для лечения рака, поскольку он включает огромное множество разных заболеваний различной природы. Эффективность терапии также сильно зависит от индивидуальных особенностей пациента. В то же время, по словам основателя Genotek, ситуация меняется по мере изучения этого заболевания. «Если приводить исторические аналогии, то в прошлом веке почти 100 млн человек умерли от обычного гриппа, а сегодня это уже гораздо менее страшное заболевание, потому что профилактика и терапия достаточно совершенны, чтобы не доводить до смертельного исхода. Но и смертельные случаи редко, да случаются. Такое же развитие можно ожидать и с раком — лет 50 назад эффективной терапии от рака не существовало, сейчас некоторые вида рака можно эффективно профилактировать и лечить, а лет через 50 ученые создадут еще десятки технологий, которые в сумме с имеющимися помогут достичь смертности от рака на уровне смертности от гриппа», — надеется ученый.
Клинический случай: впервые одобрена генная терапия для лечения рака

Рынок генной терапии имеет все шансы стать самым быстрорастущим рынком в мире в ближайшие 10 лет. Перспективы, которые открывают генетические манипуляции мотивируют представителей Большой Фармы не только вести собственные исследования, но и активно скупать наиболее многообещающие компании.
Фармгигант Novartis, судя по всему, может положить начало широкому внедрению генной терапии в мировую клиническую практику: управление по санитарному надзору за качеством пищевых продуктов и медикаментов (Food and Drug Administration, FDA) одобрило использование генной терапии для пациентов в возрасте от 3 до 25 лет, страдающих острым лимфобластным лейкозом.
Лечение помогает достигнуть ремиссии, а в некоторых случаях даже победить заболевание. СМИ уже справедливо окрестили это событие «новой эрой медицины» — человечество при помощи генетических манипуляций постепенно справляется с неизлечимыми ранее заболеваниями.
Вспомним, что привело к началу «новой эры» и посмотрим, куда движется один из самых многообещающих рынков.
С чего всё начиналось
Примерно 15 лет назад учёным удалось «прочитать» геном и наконец-то получить доступ к «исходному коду» человеческого организма, который хранит в себе все необходимые данные о нём, а главное — контролирует его жизнь и смерть. Ещё несколько лет потребовалось на то, чтобы осмыслить полученные знания и постепенно начать транслировать их в область практического применения: сначала в диагностическую, а затем и в клиническую практику.
За последние 100 лет справляться с возбудителями различных заболеваний, вроде вирусов и бактерий, наука научилась довольно хорошо — спасибо вакцинам и антибиотикам, — но недуги, вызванные мутациями в генах, долгое время считались неизлечимыми. Поэтому расшифровка более 3 млрд пар нуклеотидов открыла поистине неограниченные перспективы для развития «медицины будущего» — в первую очередь превентивной генетической терапии, а, в идеале, медицины полностью персонализированной.
Рыночные эксперты предрекают этим областям бурный рост: рынок генной терапии рака прогнозируется в $4 млрд к 2024 году, рынок генной терапии в целом — в $11 млрд к 2025, а прогнозы для всей персонализированной медицины ещё более оптимистичны: от $149 млрд в 2020 году до $2,5 трлн к 2022.
Первыми плодами расшифровки человеческого генома стало усовершенствование диагностики врожденных заболеваний или предрасположенности к ним (многие вспомнят случай с геном BRCA1 и Анджелиной Джоли). На этом фоне начал стремительно развиваться рынок так называемой «потребительской генетики» — ожидается, что к 2020 году он вырастет до $12 млрд.
Генетические тесты дают пациенту возможность провести анализ и найти «плохие гены» в своём организме или, наоборот, возрадоваться их отсутствию. Изначально довольно дорогое удовольствие ($999-2500) становилось всё более доступным по мере уменьшения стоимости секвенирования. Например, цена комплексного исследования, которое предлагает сегодня один из лидеров мирового рынка, компания 23andMe, составляет $199. В России цены несколько выше: от 20 000 до 30 000 рублей.
Помимо этого, реальностью становится таргетная терапия, которая особенно важна не только для наследственных заболеваний, но и для сердечно-сосудистых и инфекционных болезней, а также онкологии — ведущих причин смерти по всему миру. Генетические манипуляции позволяют ввести пациенту «хорошие» гены, чтобы компенсировать проблемы, вызванные халтурной работой генов «плохих» — например, как в случае с гемофилией, а в будущем позволят и «ремонтировать» или полностью удалять вредоносные гены — например, те, что вызывают нейродегенеративную болезнь Гентингтона. Пока генная терапия занимает на фармацевтическом рынке весьма скромное место, но её доля обязательно будет неуклонно расти.
Конечно, остаётся множество проблем, которые требуют решения: это и высокий риск иммунных реакций, высокая стоимость терапии и, быть может, даже этические вопросы, связанные с внесением изменений в человеческий организм на генетическом уровне. Однако подобные манипуляции — шанс для пациентов, болезни которых либо признаны неизлечимыми, либо не поддаются эффективной терапии при помощи существующих лекарств, а также новое оружие в борьбе против старения, дающее человечеству надежду на здоровое долголетие на совершенно ином уровне, а рынку — новые, куда более многообещающие пути для развития.
Первые победы
Упомянутая в самом начале разработка специалистов Novartis — настоящий прорыв последнего времени. Компания первой на рынке продемонстрировала действенную терапию одной из разновидностей острого лимфобластного лейкоза — В-клеточного типа, который является самой распространённой формой рака, развивающейся в детском и юношеском возрасте.
В основе созданной терапии — технология химерных антигенных рецепторов CAR-T (chimeric antigen receptor, CAR). Трансгенные Т-лимофциты, «оснащённые» этими рецепторами, способны распознавать злокачественные клетки, а затем и уничтожать — в этом им помогает сконструированный особым образом рецептор, «натасканный» на раковые клетки пациента. Именно он приводит Т-лимофицит в действие при контакте с нужной клеткой. Таким образом CAR-T терапия позволяет использовать уже имеющийся у всех нас эффективный антираковый механизм — иммунную систему — для борьбы с онкологическими процессами.
Клинические испытания показали впечатляющие результаты: 83% пациентов, которым не помогла химиотерапия, смогли достичь частичной или полной ремиссии спустя три месяца после начала лечения CAR-T терапией. Спустя год 79% пациентов были живы. Ранее только от 16% до 30% больных этой формой рака имели шанс на спасение.
Стоимость первой в США генной терапии составляет почти $475 000. Одобрение FDA имеет огромное значение не только для Novartis, но и для других компаний, работающих в той же области, например, Kite Pharma Inc, Juno Therapeutics Inc и Bluebird Bio Inc, которые разрабатывают препараты с похожим принципом действия. Эксперты отмечают, что одобрение FDA почти всегда означает приток инвестиций: это закономерно повлечет за собой совершенствование методов лечения и снижение их стоимости, что делает победу над раком всё более и более реальной.
Ещё до успеха Novartis впечатляющие прорывы в «войне» против генов были достигнуты в сфере наследственных заболеваний.
Несколько лет назад настоящим событием на фармацевтическом рынке стало появление Glybera — самого дорогого в мире средства генной терапии, направленной против крайне редко встречающегося дефицита липопротеинлипазы, который приводит к смерти из-за того, что кровеносные сосуды закупориваются жиром. Правда, редкость этого заболевания вкупе с высокой стоимостью терапии ($1 млн) привели к тому, что компания-производитель отказалась продлевать своё регистрационное удостоверение — с 2012 года лишь один пациент прошёл курс лечения; к счастью, успешно. И, несмотря на то, что с коммерческой точки зрения Glybera провалилась, первый удар по генетическим заболеваниям был нанесён.
Поражение терпит и гемофилия. Не так давно американские учёные отчитались о результатах испытаний нового препарата SPK-FIX для лечения гемофилии В-типа — они стали самыми успешными за всю историю борьбы с этим заболеванием. Это стало итогом партнёрства Pfizer и Spark Therapeutics, которое началось в 2014 году, когда фармгигант начинал расширять своё присутствие на рынке генной терапии. Конечно, клиническое применение требует более масштабных дополнительных исследований, но вряд ли для этого возникнут какие-либо препятствия, тем более, что Pfizer намерена активно продолжать свою экспансию.
В мае этого года компания объявила о начале сотрудничества с Sangamo Therapeutics, цель которого — создание генной терапии гемофилии А-типа. На эти цели Pfizer потратит свыше $500 млн: $70 млн фармгигант выплатит Sangamo авансом, и готова инвестировать ещё $300 млн в исследования, коммерциализацию и производство ключевого препарата Sangamo SB-525, а также $175 млн в разработку других лекарства против гемофилии А, если таковые появятся.
Годом ранее Pfizer приобрела стартап Bamboo Therapeutics за $700 млн, который специализировался на создании генной терапии заболеваний, связанных с поражением нервно-мышечной центральной нервной системы — в том числе мышечной дистрофии Дюшенна (МДД).
Она диагностируется преимущественно у мальчиков в возрасте 3-5 лет: поначалу она проявляется в затруднённых движениях, к 10 годам больной уже не может ходить, а к 20-22 годам умирает.
Виной всему — мутация гена дистрофина, который находится в Х-хромосоме. В «догеномную» эпоху терапия могла лишь незначительно облегчить страдания пациента, но генная терапия открывает для людей, страдающих от этого врожденного заболевания, новые перспективы на полноценную, здоровую жизнь.
Пожалуй, главный удар по МДД и другим наследственным заболеваниям готовится нанести CRISPR/Cas9, который уже помог полностью избавить от этого недуга мышей.
Молекулярные ножницы
О технологии CRISPR/Cas9 говорят уже не первый год — этот недорогой, удобный и эффективный инструмент для редактирования ДНК имеет все шансы для широкого внедрения в клиническую практику. Потенциально, он может помочь в борьбе против практически любых заболеваний от наследственных до тех, что пока ещё остаются неизлечимыми (рак, ВИЧ, болезнь Альцгеймера): грубо говоря, «молекулярные ножницы» могут вырезать «плохие» гены или заменить их на нужные.
Именно так использовала CRISPR/Cas9 против мышечной дистрофии Дюшенна команда Вашингтонского университета: специальная молекула РНК указала белковым «ножницам» Cas9 какой именно участок гена им нужно скорректировать и как, что ими и было сделано. Целью специалистов был 53-й экзон (кодирующая белок область гена) из 79 экзонов гена DMD, несущий в себе так называемую нонсенс-мутацию. При такой мутации в гене образуется участок последовательности, который преждевременно останавливает синтез белка. Данный экзон находится в «очаге мутаций» — участке гена, в котором возникает наибольшее количество дефектов (примерно 60%), приводящих к развитию болезни Дюшенна.
Также стоит отметить успешное применение CRISPR для редактирования человеческих эмбрионов — в начале августа группы Миталипова из Орегонского университета и Бельмонте из Института Солка опубликовали статью, в которой описали процесс исправления генетической мутации в человеческих зародышах.
Перспективность CRISPR/Cas9 была довольно быстро отмечена инвесторами: в один из CRISPR-стартапов вложился даже Билл Гейтс. Речь идёт о компании Editas Medicine, которая привлекла $120 млн, а в феврале 2016 года успешно вышла на IPO, реализовав акций на $94 млн. Её конкуренты также довольно успешны: в мае стартап Intellia Therapeutics в ходе IPO привлек свыше $100 млн, а CRISPR Therapeutics получила $56 млн. Капитализация каждой компании превышает $500 млн и, судя по всему, будет только расти.
Неудивительно, что CRISPR так вдохновляет специалистов по всему миру. Знаменитый гарвардский генетик Джордж Чёрч (George Church), например, планирует с его помощью воссоздать мамонта, а также подойти вплотную к разгадке процессов старения организма. По мысли учёного, генетические манипуляции позволят взломать заложенную в наших генах программу старения и сделать, наконец, реальностью, древнюю мечту человечества о вечной молодости.
Гены vs молодость
Чёрч не одинок в своих намерениях победить старение. В необходимости такой борьбы в целом убеждены геронтологи по всему миру. Старение рассматривается как патологический процесс и первопричина возрастозависимых заболеваний, в числе которых, помимо рака и сердечно-сосудистых заболеваний, ещё и, например, болезнь Альцгеймера — неизлечимая на сегодняшний день эпидемия ближайшего будущего. Победа над старением представляется следующим, и всё более реальным шагом развития генной терапии.
Большинство специалистов объясняют этот процесс постепенным износом организма, накоплением с возрастом различных «поломок» в силу его несовершенства. В основном, борьба на этом «фронте» ведётся симптоматическая — специалисты пытаются устранить отдельные признаки старения.
Например, Мария Бласко (María Blasco) из испанского Национального онкологического научного центра (Centro Nacional de Investigaciones Oncologicas, CNIO) попытались «омолодить» мышей, «достраивая» короткие теломеры (участки на концах хромосом). Ей удалось продлить как среднюю продолжительность жизни, так и максимальную, причем сразу в двух группах («взрослой» и «старой»): одна получила инъекции гена теломеразы (TERT, TERT-терапию) в возрасте 420 дней (увеличение медианной выживаемости на 24% и увеличение на 13% максимальной продолжительности жизни), а другая — в возрасте 720 дней (увеличение медианной выживаемости на 20% и увеличение максимальной продолжительности жизни на 13%).
Правда, в более масштабные клинические исследования это пока не переросло — инвесторы сомневается в коммерческом успехе такого подхода. Впрочем, это не остановило американку Элизабет Перриш, CEO биотехнологической компании BioViva, которая решила опробовать теломеразную терапию на себе, не дожидаясь завершения необходимых для этого испытаний. В Колумбии ей были введены две генные терапии: ген теломеразы hTERT и ген фоллистатина FS (предназначенный для ингибирования миостатина и предотвращения потери мышечной массы с возрастом). О результатах этого смелого эксперимента говорить пока рано, но доверия на рынке, насколько можно судить, он пока не получил — инвесторы отнеслись к нему весьма скептически.
Об этом свидетельствуют и неудачи Майкла Фоссела, профессора клинической медицины Университета штата Мичиган и СЕО компании Telocyte, который безуспешно пытается привлечь инвестиции для испытаний того же самого «теломеразного подхода» к лечению болезни Альцгеймера. Он одним из первых заговорил о том, что, возможно, не бета-амилоид или тау-белок, а старение является первопричиной возникновения болезни.
История борьбы с болезнью Альцгеймера говорит в пользу этого предположения. Фармгиганты раз за разом терпят поражение, и в период с 2002 по 2012 год лишь один из 244 кандидатов на лекарство от болезни Альцгеймера получил одобрение FDA и пополнил ряды ингибиторов ацетилхолинэстеразы — безопасных, но малоэффективных.
Взлом программы
Многие специалисты рассматривают старение не как набор случайных поломок, а как программу, зашифрованную в ДНК. Помимо уже упомянутого Джорджа Чёрча (George Church), такого подхода придерживаются и академик РАН Владимир Скулачев, и глава компании Gero Пётр Федичев.
Эта программа начинает действовать ещё с момента полового созревания и медленно, но неумолимо приводит к смерти. Причём это достаточно регламентированный процесс. У каждого вида наблюдается четкий лимит жизни, который ему отпущен. У мыши, например, — это, в среднем, 2,5 года, у человека — примерно 80 лет. При этом есть другие грызуны, живущие в разы или даже на порядок дольше мышей — например, белки или знаменитый голый землекоп.
Главный вопрос заключается в том, можно ли старение отключить или хотя бы замедлить. Возможно, ответить на этот вопрос поможет революционная технология, обращающая клеточное развитие вспять, которую открыл Синъя Яманака, профессор Института передовых медицинских наук в Университете Киото: он установил, что индукция совместной экспрессии четырёх факторов транскрипции (Oct4, Sox2, Klf4 и c-Myc, а все вместе — OSKM, или факторы Яманаки), которые тесно связаны с основными этапами жизненного цикла клетки, превращает соматические клетки обратно в плюрипотентные. За это поистине революционное открытие в 2012 году Яманака получил Нобелевскую премию.
Используя прорыв Яманаки, группа учёных из Института Солка под руководством Хуана Карлоса Исписуа Бельмонте (Juan Carlos Izpisua Belmonte) попыталась применить этот природный механизм обнуления биологических часов для продления жизни взрослых животных. И не ошиблась. При помощи факторов Яманаки им удалось подтвердить гипотезу о возможности отката «эпигенетических часов», то есть омоложения клеток, и увеличить среднюю продолжительность жизни быстростареющим мышам на 33%-50% по сравнению с различными контрольными группами.
У мышей, получавших терапию, наблюдалось снижение всех критических маркеров старения: и маркеров сенесцентных клеток p16Ink4a и бета-галактозидазы, и маркера двухцепочных разрывов ДНК gamma-H2AX, и металлопротеиназ, и интерлейкина-6, и так далее. Более того, у мышей снижались митохондриальные активные формы кислорода, и удлинялись теломеры. Кстати, удлинение теломер было независимо подтверждено уже упомянутой выше группой Марии Бласко — она тоже присоединилась к изучению факторов Яманаки и в январе 2017 опубликовала свои результаты.
По сути, все кусочки паззла борьбы со старением, за которыми гонится множество существующих терапий (сенолитики, теломераза и т.п.), могут быть собраны воедино при помощи одной лишь генетической манипуляции — как и должно быть при запрограммированности старения.
Это открытие не осталось незамеченным, в том числе и перспективными игроками рынка. Например, еще в декабре 2016, сразу после выхода публикации Бельмонте, к нему дважды лично приезжал Нед Дэвид (Nathaniel David), глава знаменитого стартапа Unity Biotechnology, разрабатывающего средства для борьбы с атеросклерозом, а в перспективе и другими возрастозависимыми заболеваниями при помощи уничтожения сенесцентных (или дряхлых) клеток. Не так давно компания получила на эти цели $116 млн от таких инвесторов, как Питер Тиль и Джефф Безос. А в марте 2017 Дэвид и Бельмонте обсуждали потенциальные следующие шаги. Так что, вполне возможно, что калифорнийские инвесторы весьма скоро разглядят в прорыве Бельмонте коммерческий потенциал.
Перспективы
Генная терапия, несмотря на относительную молодость, уже доказала свою эффективность в борьбе против генетических дефектов. Лечение непобедимых ранее заболеваний — это, пожалуй, лишь вопрос времени, а борьба со старением и, соответственно, радикальное продление жизни — следующий логичный шаг, который, в свете достижений группы Бельмонте, представляется вполне реальным. Так что компании, которые работают в этом направлении могут стать весьма ценным активом для инвесторов.
К сожалению, эффективных стратегий для достижения значительного — хотя бы на 15% — продления человеческой жизни на сегодняшний день никто предложить не смог. Не оправдало надежд голодание, не слишком эффективными показали себя и так любимые геронтологами метформин и рапамицин (на мышах или собаках), как и остальные «геропротекторы».
Поэтому если в ближайшее время не случится кардинального перелома в поисках радикального продления жизни, наши близкие просто не доживут до того момента, когда механизмы старения будут разгаданы, и наука наконец сможет его остановить. Возможно, генная терапия и, в частности, путь, предложенный Бельмонте, станут таким переломом. Но для того чтобы он случился в ближайшие 20 лет, а не 50, очень многим людям нужно поторопиться — и ученым, и инвесторам, и политикам. А задача общества — их поторапливать.
Читайте также:
