Гигантские клетки костного мозга эмбриона. Дериваты дуг аорты плода
Добавил пользователь Владимир З. Обновлено: 01.02.2026
Атрезия аорты - тяжелый врожденный (часто - сочетанный) порок сердца, который заключается в закрытии устья восходящей части аорты. Обычно сочетается со следующими пороками:
- гипоплазия аорты;
- гипоплазия или атрезия левого желудочка;
- атрeзия или выраженный стеноз митрального клапана;
- открытый артериальный проток;
- дефект межпредсердной перегородки.
Причинами атрезии аорты могут быть врожденные или приобретенные факторы затруднения выхода крови из левого желудочка.
Порок относится к 1 категории тяжести, выявление его во время беременности позволяет ставить вопрос о ее прерывании.
Этиология и патогенез
Вследствие того, что дуга аорты состоит из трех сегментов, имеющих различное эмбриональное происхождение, возможен перерыв дуги аорты в различных местах с различной частотой.
В редких случаях длительного функционирования открытого артериального протока сохраняется удовлетворительная гемодинамика во всех отделах туловища. Но между системным и легочным кровотоком присутствует динамическая конкуренция и при увеличении легочного кровотока наблюдается снижение периферического кровоснабжения. С другой стороны, постоянный высокий легочный кровоток (из-за сброса крови через септальные дефекты) приводит к явлениям застойной сердечной недостаточности.
Эпидемиология
Атрезия аорты встречается с частотой от 0,5 до 7,8 % среди всех врожденных пороков сердца. У новорожденных с пороками сердца эта аномалия является одной из самых частых причин смерти - 25%. Порок чаще встречается у мальчиков.
Факторы и группы риска
Факторы риска, влияющие на формирование врожденных пороков сердца у плода
Семейные факторы риска:
- наличие детей с врожденными пороками сердца (ВПС);
- наличие ВПС у отца или ближайших родственников;
- наследственные заболевания в семье.
Клиническая картина
Клинические критерии диагностики
кожа землисто-серая, снижение двигательной активности, одышка в покое, учащенное дыхание, втяжение уступчивых мест грудной клетки, влажные хрипы в легких, синеватый цвет кожи (цианоз), сердечная недостаточность, увеличение печени, отеки
Cимптомы, течение
Сразу после рождения у ребенка отмечаются следующие симптомы:
- бледно-серый цвет кожных покровов;
- адинамия;
- выраженная одышка - до 80-100 дыхательных движений в минуту (тахипноэ) с втяжением уступчивых мест грудной клетки;
- влажные хрипы в легких (как проявление левожелудочковой недостаточности).
Ведущий симптом врожденной атрезии аорты - прогрессирующая сердечная недостаточность.
Печень, как правило, значительно увеличена. У трети детей в терминальной стадии развивается отечный синдром.
Важный клинико-диагностический критерий - слабый, едва ощутимый пульс на ногах и руках в сочетании с усиленным сердечным толчком и видимой эпигастральной пульсацией. Систолическое артериальное давление не превышает 60- 80 мм рт. ст.
Аускультативная картина неспецифична, возможно выявление приглушения тонов сердца, небольшого систолического шума.
Диагностика
Наличие врожденных пороков сердца возможно установить внутриутробно при проведении УЗИ.
При атрезии дуги аорты сразу после рождения у ребенка может развиться яркая картина заболевания, не дающая усомниться в диагнозе. Для уточнения диагноза проводят следующие исследования: электрокардиография, рентгенография органов грудной клетки, эхокардиография, ретроградная аортография.
1. Эхокардиография.
Фетальная ЭхоКГ: внутриутробная диагностика перерыва дуги аорты (как и изолированной коарктации аорты) представляет значительные трудности. Косвенные признаки порока - асимметрия желудочков с преобладанием правых отделов и уменьшение скорости кровотока в восходящей аорте.
2. Электрокардиография. У новорожденных сохраняется отклонение электрической оси сердца вправо. При длительном существовании порока развивается левожелудочковая или бивентрикулярная гипертрофия.
3. Рентгенография грудной клетки. У новорожденных рентгенологическая картина может быть не изменена. Тень сердца умеренно расширена, сосудистый пучок часто узкий в результате отсутствия тимуса (при синдроме DiGeorge). По мере снижения общего легочного сопротивления легочный рисунок усиливается по артериальному руслу. При развитии сердечной недостаточности возникают симптомы венозного застоя и отека легких.
Осложнения
При переходе к постнатальному типу кровообращения у большинства больных развивается критическая сердечная недостаточность, которая приводит к быстрой гибели новорожденных.
Лечение
Основной метод лечения новорожденных с перерывом дуги аорты - инфузия простагландинов группы Е для поддержания проходимости открытого артериального протока. Одновременно следует поддерживать адекватный внутрисосудистый объем крови и корригировать анемию.
Для поддержания сердечного выброса применяют инотропные препараты. Наиболее часто - используют допамин (4-6 мкг/кг/мин.), оказывающий дополнительное положительное действие на почечную функцию, которая страдает при перерыве дуги аорты.
Следует избегать высоких доз препарата, так как это может вызвать увеличение периферического сопротивления и смещение объема крови в легкие.
В некоторых случаях приходится прибегать к искусственной вентиляции легких, которая осуществляется в режиме, исключающем гипервентиляцию, и без добавления кислорода. Такие меры требуются для предотвращения закрытия открытого артериального протока или избыточного легочного кровотока.
Не рекомендуется стремиться к повышению системного S02 более 75-85%.
Необходимы постоянный контроль и коррекция метаболического ацидоза .
При наличии сопутствующего синдрома DiGeorge требуется периодическая проверка уровня кальция; переливание цитратной крови таким больным может быть опасным.
Прогноз
Смертность на 1-й неделе жизни составляет 71%, а к 6 месяцам - практически 100%.
После хирургического вмешательства летальность составляет 20-60%, продолжительность последующей жизни также невелика.
Профилактика
Профилактика возникновения врожденных пороков сердца (ВПС) очень сложна и в большинстве случаев сводится к медико-генетическому консультированию и разъяснительной работе среди людей, относящихся к группе повышенного риска заболевания. К примеру, в случае, когда 3 человека, состоящие в прямом родстве, имеют ВПС, вероятность появления следующего случая составляет 65-100% и беременность не рекомендуется. Нежелателен брак между двумя людьми с ВПС. Помимо этого необходимо тщательное наблюдение и исследование женщин, имевших контакт с вирусом краснухи или имеющих сопутствующую патологию, которая может привести к развитию ВПС.
Профилактика неблагоприятного развития ВПС:
- своевременное выявление порока;
- обеспечение надлежащего ухода за ребенком с ВПС;
- определение оптимального метода коррекции порока (чаще всего, это хирургическая коррекция).
Обеспечение необходимого ухода является важной составляющей в лечении ВПС и профилактике неблагоприятного развития, так как около половины случаев смерти детей до 1-го года во многом обуславливаются недостаточно адекватным и грамотным уходом за больным ребенком.
Специальное лечение ВПС, (в том числе, кардиохирургическое) должно проводиться в наиболее оптимальные сроки, а не немедленно по выявлению порока, и не в самые ранние сроки. Исключение составляют только критические случаи угрозы жизни ребенка. Оптимальные сроки зависят от естественного развития соответствующего порока и от возможностей кардиохирургического отделения.
Профилактика осложнений ВПС определяется характером осложнений.
Грозным осложнением ВПС является инфекционный эндокардит Инфекционный эндокардит - это инфекционное полипозно-язвенное воспаление эндокарда, сопровождающееся образованием вегетаций на клапанах или подклапанных структурах, их деструкцией, нарушением функции и формированием недостаточности клапана
Подробно , который может осложнить любой вид порока и может появиться уже в дошкольном возрасте.
Рекомендуется ограничить назначение антибиотикопрофилактики инфекционного эндокардита группам пациентов с наибольшей вероятностью развития инфекционного эндокардита:
1. Пациенты после протезирования клапана сердца.
2. Инфекционный эндoкардит в анамнезе.
3. Пациенты со следующими врожденными пороками:
- "синие" пороки, без предшествующей хирургической коррекции или с остаточными дефектами, паллиативными шунтами или кондуитами;
- пороки после хирургической коррекции с применением искусственных материалов до 6 месяцев (до тех пор, пока не произошла эндотелизация);
- если после операции на сердце или чрескожной коррекции есть остаточный дефект в месте имплантации искусственного материала или устройства.
Тетрада Фалло: понятие, течение, диагностика, коррекция, прогноз
Уже само название заболевания говорит, что своим появлением оно обязано не одному, а сразу четырем дефектам, которые определяют состояние человека : тетрада Фалло - это врожденный порок сердца, в котором сочетаются 4 аномалии:
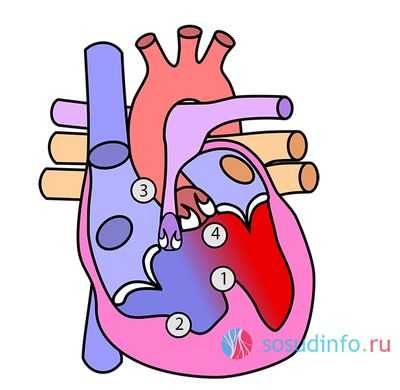
- Дефект перегородки между желудочками сердца, обычно отсутствует мембранозная часть перегородки. По протяженности данный дефект достаточно большой.
- Увеличение объема правого желудочка.
- Сужение просвета легочного ствола.
- Смещение аорты вправо (декстропозиция), вплоть до состояния, когда она частично или даже полностью отходит от правого желудочка.
В основном, тетраду Фалло связывают с детским возрастом, это вполне объяснимо: болезнь врожденная, а продолжительность жизни зависит от степени сердечной недостаточности, которая формируется в результате патологических изменений. Не факт, что человек может рассчитывать жить долго и счастливо - до преклонного возраста такие “синие” люди не доживают, и, более того, нередко погибают в течение грудного периода, если оперативное вмешательство по каким-либо причинам откладывается. Кроме этого, тетраде Фалло может сопутствовать пятая аномалия развития сердца, которая превращает ее уже в пентаду Фалло - дефект межпредсердной перегородки.
Нарушения кровообращения при тетраде Фалло
Тетрада Фалло относится к так называемым “синим”, или цианотическим порокам. Дефект в перегородке между желудочками сердца приводит к изменению потока крови, в результате чего в большой круг кровообращения поступает кровь, не приносящая тканям достаточно кислорода и те, в свою очередь, начинают испытывать голодание.
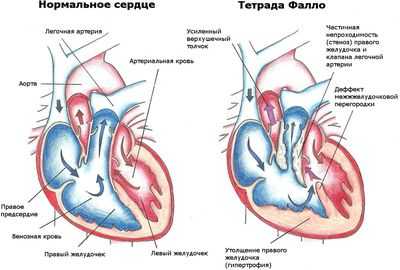
За счет нарастающей гипоксии кожа пациента приобретает цианотичный (синюшный) оттенок, поэтому данный порок называют “синим”. Ситуация при тетраде Фалло усугубляется наличием сужения в области легочного ствола. Это приводит к тому, что сквозь суженное отверстие легочной артерии не может уйти достаточный объем венозной крови в легкие, поэтому значительное ее количество остается в правом желудочке и в венозной части большого круга кровообращения (поэтому больные синеют). Этот механизм венозного застоя, помимо снижения оксигенации крови в легких, способствует довольно быстрому прогрессированию ХСН (хронической сердечной недостаточности), которая проявляется:

цианоз при тетраде Фалло
- Усугублением цианоза;
- Нарушением метаболизма в тканях;
- Скоплением жидкости в полостях;
- Наличием отеков.
С целью недопущения подобного развития событий больному показано кардиохирургическое лечение (радикальная или паллиативная хирургия).
Видео: тетрада Фалло - медицинская анимация
Симптомы заболевания
Ввиду того, что болезнь проявляется довольно рано, в статье мы будем делать упор на детский возраст, начиная с рождения. Основные проявления тетрады Фалло обусловлены нарастанием ХСН, хотя у таких малышей не исключается и развитие острой сердечной недостаточности (аритмия, одышка, беспокойство, отказ от груди). Внешний вид ребенка во многом зависит от выраженности сужения легочного ствола, а также от протяженности дефекта в перегородке. Чем больше эти нарушения, тем быстрее развивается клиническая картина.Внешний вид ребенка во многом зависит от выраженности сужения легочного ствола, а также от протяженности дефекта в перегородке. Чем больше эти нарушения, тем быстрее развивается клиническая картина.

В среднем, первые проявления начинаются с 4 недели жизни ребенка. Основные симптомы:
- Синюшная окраска кожных покровов у ребенка в первое время появляется при плаче, сосании, затем цианоз может сохраняться даже в покое. Сначала появляется синюшность только носогубного треугольника, кончиков пальцев, ушей (акроцианоз), затем по мере прогрессирования гипоксии возможно развитие тотального цианоза.
- Ребенок отстает в физическом развитии (позже начинает держать головку, садиться, ползать).
- Утолщение концевых фаланг пальцев в виде “барабанных палочек”.
- Ногти становятся уплощенными и круглыми.
- Грудная клетка уплощена, в редких случаях происходит формирование “сердечного горба”.
- Снижение мышечной массы.
- Неправильный рост зубов (широкие промежутки между зубами), быстро развивается кариес.
- Деформация позвоночника (сколиоз).
- Развивается плоскостопие.
- Характерной особенностью является появление цианотических приступов, во время которых у ребенка происходит:
- дыхание становится более частым (до 80 вдохов в минуту) и глубоким;
- кожа становится синюшно-фиолетовой;
- резко расширяются зрачки;
- появляется одышка;
- характерна слабость, вплоть до потери сознания в результате развития гипоксической комы;
- возможно появление мышечных судорог.
типичные зоны цианоза
Дети постарше во время приступов стремятся присесть на корточки, так как это положение немного облегчает их состояние. В среднем, подобный приступ длится от 20 секунд до 5 минут. Однако, после него дети жалуются на выраженную слабость. В тяжелых случаях подобный приступ может привести к инсульту или даже смерти.
Алгоритм действий при появлении приступа
- Нужно помочь присесть ребенку “на корточки”, либо принять “колено-локтевое” положение. Такая позиция способствует уменьшению венозного притока крови от нижней части туловища к сердцу, а следовательно снижается нагрузка на сердечную мышцу.
- Подача кислорода через кислородную маску со скоростью 6-7 л/мин.
- Внутривенное введение бета-блокаторов (например, “Пропранолол” в расчете 0,01 мг/кг массы тела) устраняет тахикардию.
- Введение опиоидных анальгетиков (“Морфин”) способствует уменьшению чувствительности дыхательного центра к гипоксии, уменьшению частоты дыхательных движений.
- Если приступ не купируется в течение 30 минут, возможно потребуется проведение операции в экстренном порядке.
Важно! Нельзя применять во время приступа препараты, усиливающие сокращения сердца (кардиотоники, сердечные гликозиды)! Действие этих препаратов приводит к увеличению сократительной способности правого желудочка, что влечет за собой дополнительный сброс крови через дефект в перегородке. А это значит, что в большой круг кровообращения попадает венозная кровь, практически не содержащая кислород, что приводит к нарастанию гипоксии. Так возникает “порочный круг”.
На основании каких исследований ставится диагноз “тетрада Фалло”?
- При выслушивании сердца выявляется: ослабление II тона, во втором межреберье слева определяется грубый, “скребущий” шум.
- По данным электрокардиографии можно выявить ЭКГ-признаки увеличения правых отделов сердца, а также сдвиг оси сердца вправо.
- Наиболее информативным является УЗИ сердца, при котором можно выявить дефект в межжелудочковой перегородке и смещение аорты. Благодаря допплерографии можно детально изучить кровоток в сердце: сброс крови из правого желудочка в левый, а также затруднение поступления крови в легочной ствол.
фрагмент ЭКГ при тетраде Фалло
При наличии у пациента тетрады Фалло, важно запомнить одно просто правило: операция показана всем (без исключения!) пациентам с данным пороком сердца.
Основной метод лечения данного порока сердца - только хирургический. Наиболее оптимальным возрастом для операции считается 3-5 месяцев. Лучше всего выполнять оперативное вмешательство в плановом порядке.
Возможны ситуации, когда может потребоваться экстренная операция в более раннем возрасте:
- Частые приступы.
- Появление синюшности кожи, одышки, учащения сердцебиения в покое.
- Выраженное отставание физического развития.
Обычно, в экстренном порядке проводится так называемая паллиативная операция. Во время не создается искусственный шунт (соединение) между аортой и легочным стволом. Данное вмешательство позволяет временно окрепнуть пациенту до проведения сложной, многокомпонентной и длительной операции, направленной на устранение всех дефектов при тетраде Фалло.
Как проводится операция?
Учитывая сочетание четырех аномалий в данном пороке сердца, оперативное вмешательство при данной патологии относится к особо сложным в кардиохирургии.
- Под общим наркозом проводится рассечение грудной клетки по передней линии.
- После обеспечения доступа к сердцу подключается аппарат искусственного кровообращения.
- Проводится разрез сердечной мышцы со стороны правого желудочка таким образом, чтобы не задеть коронарные артерии.
- Из полости правого желудочка осуществляется доступ к легочному стволу, проводится рассечение суженного отверстия, пластика клапанов.
- Следующим этапом является закрытие дефекта межжелудочковой перегородки с использованием синтетического гипоаллергенного (дакрон) или биологического (из ткани сердечной сумки - перикарда) материала. Эта часть операции достаточно сложная, так как анатомический дефект перегородки расположен близко к водителю сердечного ритма.
- После успешного завершения предыдущих этапов стенка правого желудочка ушивается, восстанавливается кровообращение.
Данная операция проводится исключительно в высокоспециализированных кардиохирургических центрах, где накоплен соответствующий опыт по ведению таких пациентов.
Возможные осложнения и прогноз
Наиболее частыми осложнениями после операции являются:
- Сохранение сужения легочного ствола (при недостаточном рассечении клапана).
- При травмировании волокон, проводящих возбуждение в сердечной мышце, возможно развитие различных аритмий.
Однако, при хирургическом лечении, выполненном детям до 5 лет, у подавляющего большинства детей (90%) при повторном обследовании в возрасте 14 лет не выявляется каких-либо признаков отставания в развитии от своих сверстников.
Более того, 80% прооперированных детей ведут обычный образ жизни, практически ничем не отличающийся от их сверстников, помимо ограничений в избыточной физической нагрузке. Доказано, чем раньше проведена радикальная операция по устранению данного порока, тем быстрее ребенок восстанавливается, догоняет в развитии своих сверстников.
Показано ли при заболевании оформление группы инвалидности?
Всем пациентам до проведения радикальной операции на сердце, а также 2 года после операции показано оформление инвалидности, после чего проводится переосвидетельствование.
При определении группы инвалидности большое значение имеют следующие показатели:
- Есть ли нарушение кровообращения после операции.
- Сохраняется ли стеноз легочной артерии.
- Эффективность хирургического лечения и есть ли осложнения после операции.
Можно ли диагностировать тетраду Фалло внутриутробно?
Диагностика данного порока сердца напрямую зависит от квалификации специалиста, выполняющего ультразвуковую диагностику в период беременности, а также от уровня аппарата УЗИ.
При выполнении УЗИ экспертного класса у специалиста высокой категории тетрада Фалло выявляется в 95% случаев в сроке до 22 недель, в третьем триместре беременности данный порок диагностируют практически в 100% случаев.
Кроме того, немаловажным фактором является генетическое исследование, так называемые “генетические двойки и тройки”, которые в качестве скрининга выполняются всем беременным на сроках 15-18 недель. Доказано, что тетрада Фалло в 30% случаев сочетается с другими аномалиями, чаще всего хромосомными болезнями (синдром Дауна, Эдвардса, Патау и др.).
Что делать, если во время беременности у плода обнаружена данная патология?
При обнаружении данного порока сердца в сочетании с серьезной хромосомной аномалией, сопровождающейся грубыми нарушениями психического развития, женщине предлагают прерывание беременности по медицинским показаниям.
Если выявлен только порок сердца, то собирается консилиум: врач акушеры-гинекологи, кардиологи, кардиохирурги, неонатологи, а также беременная женщина. На данном консилиуме женщине подробно объясняется: чем опасна данная патология для ребенка, какие могут быть последствия, а также возможности и методы хирургического лечения.
Несмотря на многокомпонентность тетрады Фалло, данный порок сердца относится к операбельным, то есть он подвергается хирургической коррекции. Данное заболевание не является приговором для ребенка.Современный уровень медицины позволяет в 90% случаев значительно улучшить качество жизни пациента благодаря проведению сложной, многоэтапной операции.
В настоящее время кардиохирурги практически не применяют паллиативные операции, лишь временно улучшающие состояние пациента. Приоритетным направлением является радикальная операция, проведенная в раннем детстве (до года). Этот подход позволяет нормализовать общее физическое развитие, избежать формирования стойких деформаций в организме, что значительно повышает качество жизни.
Правая дуга аорты (правосторонняя) у плода: причины, диагностика, прогноз и лечение
Правая дуга аорты у плода является врожденным пороком сердца, который может возникать изолированно или сочетаться с другими, порой тяжелыми, пороками. В любом, случае, при формировании правой дуги возникают нарушения нормального развития сердца плода.
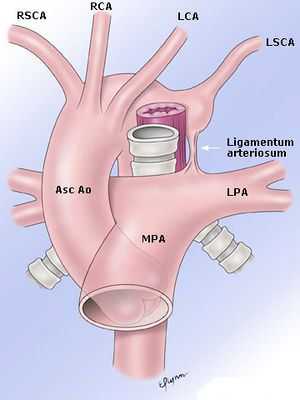
Аорта является крупнейшим сосудом в организме человека, функцией которого является продвижение крови от сердца к другим артериальным стволам, вплоть до артерий и капилляров всего организма.
Филогенетически развитие аорты претерпевает сложные изменения в процессе эволюции. Так, формирование аорты как целостного сосуда, происходит только у позвоночных животных, в частности, у рыб (двухкамерное сердце), амфибий (двухкамерное сердце с неполной перегородкой), рептилий (трехкамерное сердце), птиц и млекопитающих (четырехкамерное сердце). Тем не менее, у всех позвоночных имеется аорта, в которую происходит отток артериальной крови, смешанной с венозной, или полностью артериальной крови.
В процессе индивидуального развития эмбриона (онтогенеза) формирование аорты претерпевает столь же сложные изменения, как и само сердце. Начиная с первых двух недель развития эмбриона, происходит усиленное сближение артериального ствола и венозного синуса, расположенных в шейной части эмбриона, впоследствии мигрировавших медиальнее, в сторону будущей грудной полости. Артериальный ствол дает начало не только двум желудочкам впоследствии, но и шести жаберным (артериальным) дугам (по шесть с каждой стороны), которые по мере развития, в течение 3-4-х недель, формируются следующим образом:
- первая и вторая аортальные дуги редуцированы,
- третья дуга дает начало внутренним сонным артериям, питающим головной мозг,
- четвертая дуга дает начало дуге аорты и так называемой «правой» части,
- пятая дуга редуцируется,
- шестая дуга дает начало легочному стволу и артериальному (Боталлову) протоку.
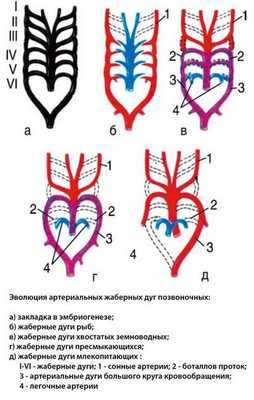
Полностью четырехкамерным, с четким разделением сердечных сосудов на аорту и легочной ствол, сердце становится к шестой неделе развития. У эмбриона сроком 6 недель имеется полностью сформированное, сокращающееся сердце с крупными сосудами.
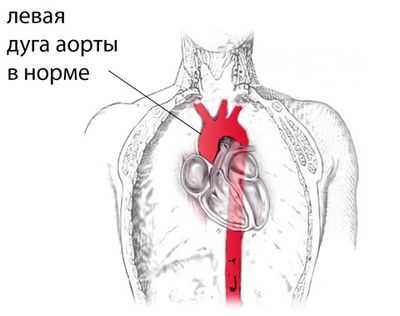
После формирования аорты и других внутренних органов, топография сосуда выглядит следующим образом. В норме левая дуга аорты начинается от луковицы аорты в ее восходящей части, которая, в свою очередь, берет начало от левого желудочка. То есть, восходящая часть аорты переходит в дугу приблизительно на уровне второго ребра слева, а дуга огибает левый главный бронх, направляясь кзади и влево. Самая верхняя часть дуги аорты проецируется на яремную вырезку прямо над верхней частью грудины. Дуга аорты направляется книзу вплоть до четвёртого ребра, располагаясь левее позвоночника, а затем переходит в нисходящую часть аорты.
В том случае, когда дуга аорты «поворачивает» не в левую сторону, а в правую, из-за сбоя в закладке сосудов человека из жаберных дуг эмбриона, говорят о правосторонней дуге аорты. При этом дуга аорты перекидывается через правый главный бронх, а не через левый, как должно быть в норме.
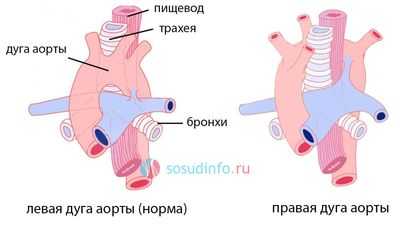
Почему возникает порок?
Любой порок развития формируется у плода в том случае, если на женщину во время беременности оказывают влияние негативные факторы окружающей среды - табакокурение, алкоголизм, наркомания, экология и неблагоприятный радиационный фон. Однако, немаловажную роль в развитии сердца у ребенка играют генетические (наследственные) факторы, а также имеющиеся хронические заболевания у матери или перенесенный инфекционные заболевания, особенно на ранних сроках беременности (грипп, герпетическая инфекция, ветрянка, краснуха, корь, токсоплазмоз и многие другие).
Но, в любом случае, при влиянии каких-либо из этих факторов на женщину на ранних сроках беременности нарушаются нормальные, сформированные в ходе эволюции, процессы онтогенеза (индивидуального развития) сердца и аорты.
Так, в частности, особенно уязвимым для сердца плода является срок беременности приблизительно 2-6 недель, так как именно в это время происходит формирование аорты.
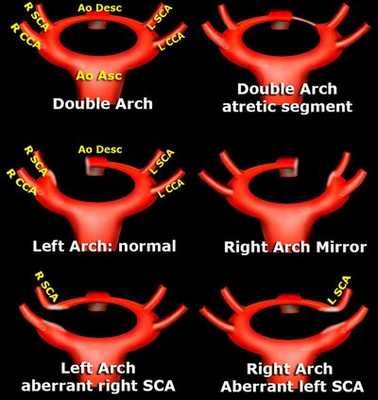
Классификация правосторонней дуги аорты
вариант правой дуги аорты с образованием сосудистого кольца
В зависимости от анатомии аномалии протока, выделяют:
- Правую дугу аорты без образования сосудистого кольца, когда артериальная связка (заросший артериальный, или Боталлов, проток, как и должно быть в норме после родов) располагается позади пищевода и трахеи,
- Правую дугу аорты с образованием сосудистого кольца, кода артериальная связка, или открытый артериальный проток, располагаются слева трахеи и пищевода, как бы окружая их.
- Также как отдельную сходную форму выделяют двойную дугу аорты - в таком случае сосудистое кольцо образуется не соединительной связкой, а притоком сосуда.
Рисунок: разнообразие вариантов нетипичного строения дуги аорты
В зависимости от того, были ли повреждены еще какие-либо структуры сердца при его формировании, выделяют следующие типы порока:
- Изолированный тип порока, без других аномалий развития (в таком случае если правосторонняя аорта не сочетается с характерным в ряде случаев для неё синдромом Ди Джорджи - прогноз максимально благоприятен);
- В сочетании с декстрапозицией (зеркальным, правым расположением сердца и магистральных сосудов, в том числе и аорты), (что также обычно не опасно),
- В сочетании с более серьезным пороком сердца - в частности тетрадой Фалло (декстрапозицией аорты, дефектом межжелудочковой перегородки, стенозом легочного ствола, гипертрофией правого желудочка).
Тетрада Фалло, сочетающаяся с правой дугой - неблагоприятный вариант развития
Как распознать порок?
Диагностика порока не представляет собой затруднений еще в период вынашивания плода. Особенно это касается тех случаев, когда правая дуга аорты сочетается с другими, более тяжелыми аномалиями развития сердца. Тем не менее, для подтверждения диагноза, беременную женщину неоднократно обследуют, в том числе и на ультразвуковых аппаратах экспертного класса, собирают консилиум из врачей генетиков, кардиологов и кардиохирургов с принятием решения о прогнозах и возможности родоразрешения в условиях специализированного перинатального центра. Это обусловлено тем, что при некоторых видах пороков, сочетающихся с правой дугой аорты, новорожденному ребенку может потребоваться операция на сердце сразу же после родоразрешения.
Относительно клинических проявлений правой дуги аорты, следует упомянуть о том, что изолированный порок может никак себя не проявлять, лишь иногда сопровождаясь частой навязчивой икотой у ребенка. В случае сочетания с тетрадой Фалло, которая сопровождает порок в ряде случаев, клинические проявления ярко выражены и проявляются в первые сутки после родов, такие, как нарастающая легочно-сердечная недостаточность с выраженным цианозом (посинение кожи) у младенца. Именно поэтому тетраду Фалло относят к «синим» порокам сердца.
На каком скрининге видно порок у беременных?
Установить диагноз правосторонней дуги аорты можно уже на первом скрининге, то есть в 12-13 недель беременности. Более точные сведения о состоянии сердца плода возможно получить на втором и на третьем скрининговых ультразвуковых исследованиях (20 и 30 недель беременности).
Дополнительно уточнить отсутствие связи формирования правосторонней аорты с тяжелыми генетическими мутациями может анализ ДНК плода. В таком случае обычно проводится забор материала ворсин хориона или амниотической жидкости через прокол. В первую очередь исключается синдром Ди Джорджи.
В том случае, если правая дуга аорты является изолированной, и не сопровождается какими-либо клиническими проявлениями после рождения ребенка, порок оперативного лечения не требует. Достаточно лишь ежемесячного осмотра у детского кардиолога с регулярным (раз в полгода - раз в год) проведением УЗИ сердца.
При сочетании с другими пороками развития сердца тип оперативного вмешательства выбирается исходя из типа пороков. Так, при тетраде Фалло показана операция на первом году жизни ребенка, проводящаяся поэтапно. На первом этапе осуществляют паллиативное (вспомогательное) наложение шунтов между аортой и легочным стволом для улучшения притока крови в малый круг кровообращения. На втором этапе осуществляется операция на открытом сердце с применением аппарата искусственного кровообращения (АИК) с целью устранения стеноза легочного ствола.
Кроме хирургического, со вспомогательной целью назначаются кардиотропные препараты, способные замедлить прогрессирование хронической сердечной недостаточности (ингибиторы АПФ, мочегонные и др).
Прогноз при изолированной правосторонней дуге аорты благоприятен, так как в большинстве случаев даже не требуется хирургического вмешательства. Так что в целом можно сказать, что изолированная правая дуга аорты не опасна для жизни ребенка.
При сочетанных типах дело обстоит гораздо сложнее, так как прогноз определяется видом сопутствующего порока сердца. Например, при тетраде Фалло прогноз без лечения крайне неблагоприятен, непрооперированные дети с таким заболеванием обычно погибают на первом году жизни. После хирургического вмешательства продолжительность и качество жизни возрастают, а прогноз становится более благоприятным.
Двойная дуга аорты ( Сосудистое кольцо аорты )
Двойная дуга аорты — это врожденная аномалия развития, при которой формируется полное сосудистое кольцо, состоящее из правой и левой дуг аорты. Патологическое состояние в основном проявляется в раннем детском возрасте. Типичные симптомы: шумное дыхание с периодами апноэ, срыгивания и отказ от кормления, частые инфекционные заболевания респираторного тракта. Для диагностики двойной дуги аорты используют инструментальные исследования — МСКТ-ангиографию, ЭхоКГ, бронхоскопию. При сосудистой аномалии применяется радикальное оперативное лечение — резекция участка дуги и пластика аорты.
МКБ-10

Общие сведения
Двойная дуга аорты (ДДА) входит в группу патологий под названием «сосудистые кольца и петли», частота которых составляет около 1% от всех врожденных сердечно-сосудистых аномалий. ДДА занимает первое место среди всех сосудистых пороков — удельный вес заболевания составляет 42%. В 20-30% случаев двойная аортальная дуга комбинируется с другими пороками развития — тетрадой Фалло, открытым артериальным протоком (ОАП). Статистически значимых различий в половой или расовой принадлежности пациентов не выявлено.
Причины
- Физические воздействия. Наиболее значимым для сердечно-сосудистых пороков является радиационное излучение, особенно при его длительном воздействии на организм беременной женщины. В группу риска входят беременные, проживающие в местности с повышенным радиационным фоном.
- Химические реагенты. Чаще всего неблагоприятное воздействие обусловлено употреблением алкоголя, курением, применением токсических или наркотических веществ. Формирование двойной дуги возможно, когда мать в период беременности принимает тератогенные лекарства (эстрогены, ретиноиды, химиопрепараты).
- Биологические агенты. Аномалии со стороны сердечно-сосудистой системы ребенка встречаются при инфицировании возбудителями TORCH-комплекса (краснуха, цитомегаловирус, токсоплазмоз и др.). Поражение плода возможно, даже если у беременной нет клинических проявлений заболевания.
Патогенез
Формирование аортального порока происходит на 4-5 неделе эмбриогенеза. В основе двойной сосудистой аномалии лежат нарушения развития и дифференцировки жаберных дуг — хрящевых пластинок, которые служат источником для образования подъязычной кости, гортани и трахеи, сосудов. Из IV, V и VI жаберных дуг формируются артерии, расположенные в грудной полости. При патологиях эмбриогенеза формируется аномальное аортальное кольцо, сдавливающее трахею с пищеводом.
Классификация
По морфофункциональному принципу ДДА подразделяют на 3 варианта: доминантная правая дуга (в 70% случаев), доминантная левая дуга (20%) и сбалансированная форма, когда обе сосудистые ветви развиты одинаково. Существует другая классификация сосудистой аномалии, основанная на функциональной способности аортальных дуг. По этому принципу в современной кардиологии выделяют несколько типов и подтипов порока:
- Тип I. Характерно хорошее функционирование обеих дуг аорты, гемодинамика длительное время остается нормальной.
- Тип II. Одна из аортальных дуг хорошо функционирует (чаще правая), а вторая подвергается атрезии (заращению) на определенном участке.
- Подтип А. Атрезированный участок расположен между артериальной связкой и нисходящим отделом аорты.
- Подтип В. Атрезия в промежутке от подключичной артерии до артериальной связки.
- Подтип С. Атрезия участка двойной аортальной дуги, расположенной между общей сонной и подключичной артериями.
- Подтип D. Атрезия локализована между восходящей аортой и общей сонной артерией.
Симптомы
Клинические проявления двойной дуги обусловлены нарушением вентиляции воздуха через трахею и нарушением прохождения пищи по пищеводу. В большинстве случает первые симптомы аномалии проявляются сразу после рождения ребенка либо в раннем детстве. Начальные признаки наличия двойной дуги аорты — шумное учащенное дыхание, эпизоды рефлекторного апноэ. У младенцев наблюдаются частые срыгивания. В время кормления бывает синюшность кожи вокруг губ.
У детей около года и старше выявляются затруднения при глотании твердых продуктов, отказ от еды. Периодически возникают приступы кашля, сочетающиеся с периоральным цианозом. Одышка беспокоит как при физических нагрузках, так и в покое. Для больных с двойной аортальной дугой типичны частые респираторные заболевания (трахеиты, бронхиты), которые имеют затяжное течение и тяжело купируются медикаментами.
В редких случаях аномалия проявляется у старших детей, подростков или взрослых. Пациенты ощущают препятствия во время глотания твердой пищи, чувство «застревания» еды в пищеводе. После еды часто ощущаются боли и распирание в грудной клетке, иногда бывает рвота неизмененной пищей. Дыхание становится шумным, появляются хрипы, которые слышны на расстоянии. Характерна приступообразная одышка, усиливающаяся при небольшой физической нагрузке.
При двойной дуге аорты нарушается работа дыхательной, сердечно-сосудистой и пищеварительной систем. Сдавление трахеи и бронхов провоцирует хроническое воспаление слизистой, сопровождающееся кашлем и выделением мокроты. При длительной персистенции бронхита происходит необратимый фиброз стенок дыхательных путей. Из-за снижения проходимости пищевода дети медленно набирают вес, отстают в физическом развитии.
Патологическое сосудистое кольцо нарушает гемодинамику в крупных артериях и венах. Происходит утолщение аортальной стенки, повышается ее ригидность, что создает благоприятные условия для раннего начала артериальной гипертензии. В области незрелых стенок двойной сосудистой дуги зачастую формируются аневризмы, которые могут спонтанно разрываться. Иногда наступает внезапная смерть от острых кардиологических или пульмональных осложнений.
Для ДДА характерно сходство клинических симптомов с бронхопульмональными и эзофагеальными заболеваниями, что требует от врача проведения дифференциальной диагностики. С учетом возраста обследованием больного занимается неонатолог, педиатр или терапевт-кардиолог. При физикальном исследовании выслушивается жесткое дыхание, хрипы в легких, патологические сердечные шумы. Для постановки диагноза проводятся инструментальные диагностические методы:
- МСКТ-ангиография. Мультиспиральная компьютерная ангиография аорты и магистральных сосудов рекомендована для получения трехмерного изображения, на котором четко видна двойная сосудистая дуга. С помощью МСКТ измеряют диаметр аорты на разных уровнях, обнаруживают участки атрезии.
- Эхокардиография. УЗИ сердца выполняется для исключения сопутствующих кардиальных пороков и оценки кровотока. Признаков органической патологии сердца в случае двойной дуги нет. При длительном существовании аномалии наблюдается снижение сердечного выброса, дискоординация сократимости миокарда.
- Бронхоскопия. Инвазивное эндоскопическое исследование дыхательных органов выявляет щелевидное сужение трахеи на участке бифуркации, а также признаки хронического воспалительного процесса в бронхах. Используется для дифференцировки ДДА с бронхолегочными болезнями.
- Дополнительные методы. ЭКГ регистрируется для оценки работы проводящей системы сердца, диагностики аритмий или блокады ножки пучка Гиса. На рентгенографии ОГК визуализируются расширенные и неструктурные корни легких, поля повышенной пневматизации легочной ткани.

КТ сердца. Двойная дуга аорты. Стрелками указаны правая и левая дуги аорты примерно одинакового размера.
Лечение двойной дуги аорты
Консервативная терапия
Медикаментозное лечение ДДА показано для коррекции витальных функций на этапе предоперационной подготовки. Если определяется осложненное течение двойной дуги аорты, назначают патогенетическую терапию — антибиотики, глюкокортикоиды, бронходилататоры. При серьезных дыхательных нарушениях требуется перевод пациента в реанимационное отделение, обеспечение кислородной поддержки.
Хирургическое лечение
Оперативное вмешательство — единственный способ радикального лечения двойной дуги аорты. Операцию планируют в максимально ранние сроки после выявления ДДА, пока не наступили необратимые изменения в трахее или пищеводе. Кардиохирургическая тактика предполагает резекцию одной дуги аорты (чаще левой) с последующей пластикой ее стенки. После операции нормализуется гемодинамика и исчезает компрессия соседних органов.
Прогноз и профилактика
Результаты хирургической коррекции двойной дуги аорты удовлетворительные: частота послеоперационных осложнений сведена к минимуму, после устранения компрессии состояние больных резко улучшается. При ранней диагностике и коррекции порока прогноз для жизни и здоровья благоприятный. Профилактика включает устранение тератогенных влияний у беременных женщин, пренатальную УЗ-диагностику.
1. Двойная дуга аорты у детей/ С.А. Котов, А.А. Свободов, В.С. Разумовский, Н.Т. Сирия// Детские болезни сердца и сосудов. — 2018.
2. Двойная дуга аорты с формированием сосудистого кольца и развитием синдрома компрессии трахеи и пищевода: особенности клинической картины, диагностики и хирургической тактики/ В.С. Аракелян, Н.А. Гидаспов, П.П. Куличков, Г.Б. Тачиева, О.И. Шишкина// Грудная и сердечно-сосудистая хирургия. — 2016.
3. Аномалии дуги аорты, образующие сосудистое кольцо: клиника, диагностика и методы хирургической коррекции. Автореферат диссертации/ С.Н. Беседин. - 1991.
4. Врожденные сосудистые кольца/ Раад Таммо, Т.А. Ялынская, Н.В. Рокицкая, Л.В. Рокицкая, Е.Б. Ершова// Лучевая диагностика, лучевая терапия. — 2010.
Современные подходы к изучению плодового фенотипа в эру генетического ультразвука
Медико-генетическое отделение Московского областного НИИ акушерства и гинекологии, Москва.
Курс пренатальной диагностики, ФГБОУ ДПО РМАПО Минздрава России, Москва.
УЗИ сканер RS80
Эталон новых стандартов! Беспрецедентная четкость, разрешение, сверхбыстрая обработка данных, а также исчерпывающий набор современных ультразвуковых технологий для решения самых сложных задач диагностики.
Настоящая работа посвящена изучению плодового фенотипа при ультразвуковом исследовании в различные сроки беременности при помощи новейших технологий Samsung, оптимизирующих диагностику многих врожденных пороков развития, аномалий, нарушений строения, особенностей развития с оценкой значимости отдельных ультразвуковых патологических маркеров в качестве потенциальных признаков генетических синдромов и ассоциаций.
Одной из ведущих причин детской и младенческой смертности являются врожденные пороки развития (ВПР), среди которых в 20% случаев встречаются множественные ВПР (МВПР) с установленной частотой 1:250 новорожденных [1]. Особое значение в профилактике МВПР имеет пренатальная диагностика - современный и высокоэффективный метод диспансеризации плода, направленный на своевременное выявление патологии, впоследствии определяющий выбор адекватной акушерской тактики при данной беременности и специфических мер профилактики болезни в данной семье в дальнейшем [2]. Современные ее возможности позволяют из комплекса патологических нарушений у плода выделить достоверно значимые ультразвуковые маркеры для постановки диагноза генетических синдромов различной этиологии. Сегодня пренатальная синдромология активно развивается, как в плане расширения спектра возможных лабораторных исследований, так и описания значимых, ключевых, таргетных ультразвуковых признаков многих наследственных синдромов различного происхождения.
Группа МВПР включает сотни нозологических форм, различных по этиологии, фенотипическим проявлениям и прогнозу. В силу огромной гетерогенности МВПР представляют собой сложную проблему для постановки окончательного диагноза. Основными этиологическими факторами, приводящими к возникновению синдромов с множественными пороками развития, являются генные, хромосомные мутации и действие на плод неблагоприятных факторов внешней среды [3, 4].
Любые наследственные или врожденные генетические болезни являются результатом повреждения генетической информации на геномном, хромосомном или генном уровне. В 60% всех случаев МВПР встречаются хромосомные синдромы, достаточно широко изученные и хорошо диагностируемые. Для лабораторной диагностики этих повреждений разработаны разнообразные и хорошо известные методы: цитогенетический, молекулярно-цитогенетический и молекулярно-генетический. МВПР нехромосомного генеза встречаются в 40% случаев. Среди них выделяют синдромы, ассоциации и неклассифицированные комплексы. Применительно к нехромосомным синдромам цитогенетическое исследование позволяет лишь отвергнуть хромосомную природу данного комплекса пороков развития, но не установить диагноз.
Сегодня имеется определенное количество публикаций о выявлении некоторых синдромов и ассоциаций при пренатальной эхографии [6, 7]. Однако дородовая идентификация нозологических форм нехромосомных синдромов пока не вошла в рутинную практику врачей в области пренатальной диагностики и носит случайный характер. В литературе отсутствуют четкие рекомендации о системном подходе к диагностике наследственных синдромов различной этиологии, нет диагностических алгоритмов и определенных схем взаимодействия врачей ультразвуковой пренатальной диагностики, генетиков, акушеров-гинекологов.
Использование эхографии делает возможным пренатальное выявление не менее 80% врожденных дефектов во II, III триместрах беременности и свыше 50% значимых нарушений анатомии плода уже в I триместре начиная со сроков 11-12 нед. Весь комплекс диагностированных пороков развития и различных микроаномалий в совокупности составляет фенотипический спектр синдрома, который состоит из «ядерных» (главных, ключевых) признаков и дополнительных аномалий, наличие которых не является обязательным для диагностики клинической нозологии синдрома.
Революцией в пренатальной ультразвуковой диагностике явилось появление объемной эхографии, которая, обладая такими качествами, как неинвазивность, безопасность и возможность многократного применения у одной пациентки, имеет высокую информативность в исследовании анатомии плода и изучении его фенотипа. При применении различных режимов объемной эхографии абсолютно очевидно их преимущество по сравнению с обычным сканированием. Детально можно изучить лицо плода (рис. 1-4) в различные сроки беременности, начиная со сроков первого пренатального скрининга в 11-14 нед, конечности плода, причем не только их наличие и положение (рис. 5, 6), но и состояние и количество пальцев (рис. 7-9) как на руках, так и на ногах. Также можно изучить позвонки плода (рис. 10), состояние твердого нёба (рис. 11, 12), строение наружного уха (ушной раковины) (рис. 13), состояние основных швов черепа и родничков, исключая их преждевременное закрытие при кранисиностозах (рис. 14, 15).
Читайте также:
- Гипофосфатазия. Гипоплазия левых отделов сердца
- Поперечная блокада сердца в послеоперационном периоде. Острый печеночно-почечный синдром
- Дисфункция континентного резервуара по Коку
- Техника тенодеза бицепса при дегенеративном повреждении верхних отделов суставной губы плечевого сустава (SLAP)
- Техника, этапы операции при повреждении шейного отдела пищевода
