Иммуноэлектрофорез. Методика иммуноэлектрофореза. Принципы иммуноэлектрофореза. Значение иммуноэлектрофореза.
Добавил пользователь Владимир З. Обновлено: 21.01.2026
Иммуноэлектрофоретический анализ представляет собой сочетание электрофореза в агаровом геле с иммунодиффузией. Существуют различные варианты иммуноэлектрофореза. Иммуноэлектрофорез (ИЭФ) впервые описан Грабар и Уильямс в 1953 г. В 1955 г. Шейдеггер предложил микромодификацию этого метода, применив обычные предметные стекла.
Принцип ИЭФ состоит в следующем. Вначале проводят электрофоретическое разделение белков (антигенов) в забуференном геле агара; после снятия напряжения вдоль направления движения белков в электрическом поле в геле вырезают канавку, в которую вносят преципитирующую иммунную сыворотку. Антиген и антисыворотка диффундируют в геле навстречу друг другу, и в месте их взаимодействия возникают дугообразные линии преципитации, число, положение и форма которых дают представление о составе исходной смеси антигенов.
С помощью данного метода в клинической иммунологии полуколичественно определяют концентрацию иммуноглобулинов различных классов, идентифицируют миеломные белки. Также ИЭФ используется при диагностике иммунодефицитных состояний. Метод незаменим в последовательном наблюдении за процессом очистки белковых препаратов. Его часто используют также для контроля подлинности и чистоты этих препаратов.
Для разделения сложной смеси антигенов используют двухмерный (перекрестный) электрофорез. Метод включает два этапа. На первом этапе белки диффундируют под влиянием электрического поля в агарозном геле, содержащем антитела. На втором этапе пластину поворочивают на 90 о и подвергают повторный разгонке в направлении, перпендикулярном первому. Таким образом удается количественно охарактеризовать каждый из антигенов смеси. Этот метод, в частности, применяют для оценки степени конверсии белка системы комплемента С3 в инактивированную форму С3с в сыворотке больных СКВ или синовиальной жидкости больных ревматоидным артритом.
ИММУНОЭЛЕКТРОФОРЕЗ
Иммуноэлектрофорез (лат. immunis свободный, избавленный от чего-либо + электрофорез) — метод электрофоретического разделения антигенов (или антител) в геле с последующим их проявлением посредством преципитации соответствующими антителами (или антигенами).
Иммуноэлектрофорез позволяет получать разнообразную информацию об отдельных компонентах сложной смеси антигенов без предварительного выделения этих компонентов в чистом виде, в т. ч. определять общее число антигенов в смеси; их относительную электрофоретическую подвижность, биохимические или энзимологические характеристики; количественное содержание каждого антигена; наличие в смеси искомого антигена; производить сравнение двух или более антигенных систем и др.
Возможности Иммуноэлектрофореза в характеристике антител ограничены, т. к. антитела различной специфичности, но относящиеся к одному классу иммуноглобулинов, имеют одинаковую или очень близкую электрофоретическую подвижность. С помощью И. можно установить, к какой электрофоретической фракции иммуноглобулинов — гамма-1 или гамма-2 — относятся исследуемые антитела. В остальном анализ антител с помощью И. не имеет каких-либо преимуществ перед их анализом методами диффузии в геле (см. Иммунодиффузия).
Наиболее широко применяемый вариант И., предложенный в 1953 г. Грабаром и Уилльямсом (P. G rabar, С. Williams), представляет собой сочетание двух отдельных методов — метода электрофоретического разделения антигенов в агаровом геле и метода встречной двумерной иммунодиффузии. Принцип первого метода основан на неодинаковой электрофоретической подвижности антигенов, обусловленной тем, что при значении pH, соответствующем условиям опыта, различные антигены будут отличаться друг от друга величиной заряда их молекул. Т. к. Изоэлектрическая точка большинства антигенов лежит в кислой области значений pH, то электрофорез обычно проводят в щелочных буферных системах, в которых антигены передвигаются с различной скоростью к аноду и к концу электрофореза занимают положения на разном расстоянии от исходной позиции.
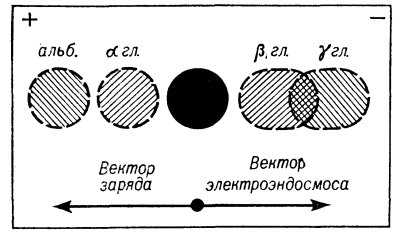
Рис. 1. Схема электрофоретического разделения белков сыворотки в агаровом геле: в лунку (черный кружок), вырезанную в центре агаровой пластинки (ограничена рамкой), приготовленной на буферном растворе, помещена сыворотка крови; ее компоненты передвигаются к аноду (+) или к катоду (—) в зависимости от величины вектора их заряда и вектора эндосмоса; при простом электрофорезе в агаре компоненты сыворотки разделяются на четыре основные фракции (антигены)— альбумин (альб.) и α-глобулины (α-гл.), которые передвигаются к аноду, так как имеют высокий отрицательный заряд; γ-глобулины (γ-гл.) и β-глобулины (β-гл.), которые передвигаются к катоду, так как положительный вектор эндосмоса превышает вектор заряда.
Однако при использовании для электрофореза агарового геля на подвижность антигенов в электрическом поле оказывает сильное влияние так наз. электроэндосмос. Он обусловлен тем, что агар в щелочных условиях имеет отрицательный заряд, вследствие чего вблизи стенок капилляров агаровой губки скапливаются положительные ионы буфера, занимающие тем больший объем внутри капилляров, чем меньше диаметр последних и, следовательно, чем больше концентрация агарового геля. В электрическом поле эти ионы передвигаются к катоду, увлекая за собой жидкую фазу и находящиеся в ней молекулы антигенов. Т. о., в агаровом геле подвижность макромолекул определяется, с одной стороны, вектором заряда, двигающим молекулы антигена к аноду, а с другой — вектором электроэндосмоса, направленным в противоположную сторону, к катоду. Результирующая этих двух векторов будет определять скорость и направление движения антигенов в агаре. Так, напр., при электрофорезе сывороточных белков в агаре (ионная сила буфера 0,025, pH 8,6) альбумин и альфа-глобулины, имеющие высокий отрицательный заряд, передвигаются к аноду, тогда как бета- и гамма-глобулины, несмотря на отрицательный заряд их молекул, передвигаются к катоду, т. к. вектор электроэндосмоса превышает вектор заряда (рис. 1).
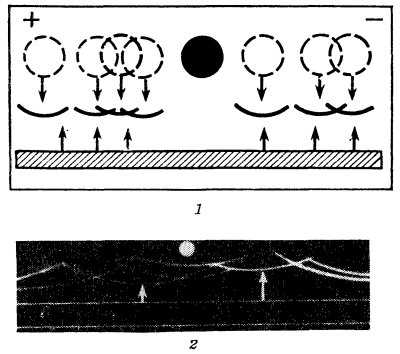
Рис. 2. Схема и пример иммуноэлектрофореза: 1 — схема формирования дуг преципитата при встречной диффузии в агаре антител и электрофоретически разделенных антигенов; разделенные антигены (обозначены пунктиром) диффундируют в агаре (направление диффузии указано стрелками); черный кружок — лунка с сывороткой крови; навстречу им диффундируют антитела иммунной сыворотки (направление диффузии указано стрелками). налитой в траншею после электрофореза антигенов; в местах встречи антигенов и антител образуется преципитат (осадок, выпадающий в агаре в результате соединения антигена с антителом) в форме дуг; 2 — пример иммуноэлектрофореграммы (белый кружок — лунка, стрелками указаны дуги преципитата, белая двойная полоса — траншея).
Метод встречной иммунодиффузии, применяемый на втором этапе Иммуноэлектрофореза, основан на формировании внутри прозрачного геля видимого преципитата, образуемого в процессе встречной диффузии молекул антигена и добавленных после электрофореза молекул антител. Для осуществления встречной диффузии в агаровой пластинке вырезают траншею, к-рая располагается параллельно направлению движения антигенов и на некотором расстоянии от них (рис. 2). В траншею вносят иммунную сыворотку к исследуемым антигенам, после чего пластинку оставляют во влажной камере на сутки или более. За это время антитела сыворотки диффундируют из траншеи, а антигены — из мест, которые они заняли после электрофореза. В местах встречи образуется преципитат в виде дуги, форма и положение к-рой будут зависеть от количественного соотношения данного антигена и соответствующих антител и от его природы. Т. о., высокая разрешающая способность И., отличающая его от всех других методов Иммунохимического анализа, объясняется не только различной электрофоретической подвижностью и константой диффузии антигенов, но и неодинаковым отношением антиген/антитело для всех пар исследуемой системы. Чувствительность описанного варианта И. довольно высокая и позволяет определить антиген при его концентрации порядка 10 мкг/мл.
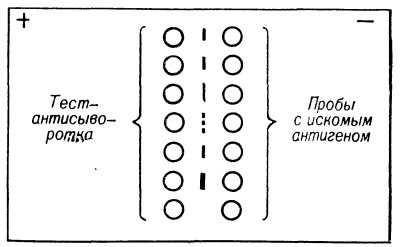
Рис. 3. Схема иммуноосмофореза с моноспецифической сывороткой, содержащей антитела к искомому антигену (антиген с анодной подвижностью): образуемый преципитат (в центре рисунка) обусловлен встречным электрофоретическим движением антигенов к аноду, а антител к катоду; метод позволяет получить быстрый ответ о наличии искомого антигена в большом количестве исследуемых проб.
В лабораторной практике часто используется другой вариант И., который в литературе часто называют иммуноосмофорезом или встречным электрофорезом. Разрешающая способность этого метода значительно ниже, и основная цель, с к-рой он применяется, заключается в получении быстрого ответа о наличии искомого антигена в большом количестве исследуемых проб с помощью моноспецифической сыворотки, содержащей антитела к этому антигену. В тех случаях, когда искомый антиген при электрофорезе в агаре передвигается к аноду, вся постановка иммуноосмофореза проводится на агаровой пластинке (рис. 3). С помощью штампа вырезают два ряда лунок (по числу исследуемых проб) диам. 2— 3 мм, расположенных друг против друга на расстоянии 3 —10 мм. Ряд лунок со стороны анода заполняют иммунной сывороткой, а лунки со стороны катода — исследуемыми пробами. Вследствие слабого заряда молекулы антител за счет электроэндосмоса будут передвигаться к катоду навстречу искомому антигену, имеющему анодную подвижность. В месте встречи образуется полоса преципитата, указывающая на присутствие антигена в исследуемой пробе. Анализ ста и более проб различного материала на присутствие искомого антигена может быть проведен с помощью иммуноосмофореза менее чем за 1 час.
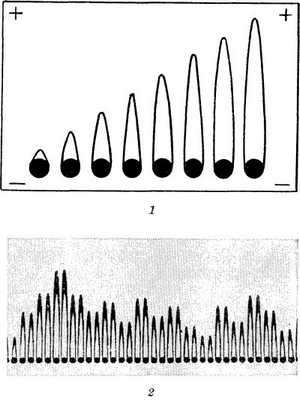
Рис. 4. Схема и пример электрофореграммы при рокет-иммуноэлектрофорезе (площадь пика при постоянной концентрации антител тест-сыворотки пропорциональна концентрации искомого антигена): 1 — схема электрофореграммы, рамкой ограничена среда, состоящая из смеси агарозы с тест-антисывороткой; черные кружочки— лунки с пробами, содержащими искомый антиген в возрастающей (слева направо) концентрации; от лунок поднимаются соответствующие пики преципитата; 2 — пример рокет-иммуноэлектрофореграммы (черные кружочки — лунки с пробами, от которых поднимаются пики преципитата).
Разработаны варианты Иммуноэлектрофореза, позволяющие получать количественную характеристику для каждого компонента исследуемой системы. Наиболее простые из них — рокет-иммуноэлектрофорез (англ. rocket ракета) и кросс-иммуноэлектрофоpез. Принцип этих методов заключается в том, что электрофоретическое движение антигенов происходит в геле агарозы, смешанном с иммунной сывороткой. Рокет-иммуноэлектрофорез позволяет исследовать одновременно большое число проб и дает информацию не только о наличии искомого антигена в пробе, но и о его количестве, что придает методу большую ценность для клин, исследований. Для его постановки на стекло наливают смесь агарозы с иммунной сывороткой (лучше моноспецифической) в предварительно подобранном соотношении и затем в геле со стороны катода вырезают ряд лунок, заполняемых исследуемыми пробами. При условиях электрофореза, позволяющих антигену медленно передвигаться в агарозном геле с иммунной сывороткой, формируется преципитат в форме ракеты (рис. 4). Площадь пика при постоянной концентрации антител пропорциональна количеству антигена в пробе. При наличии референс-антигена может быть построена калибровочная кривая, по к-рой легко определять количество искомого антигена в каждой пробе по высоте сформированного пика преципитата.
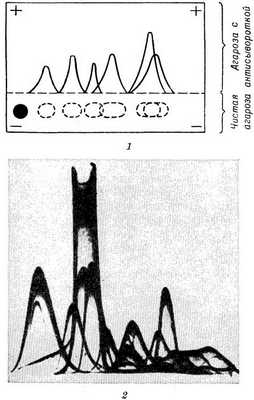
Рис. 5. Схема и пример электрофореграммы при кросс-иммуноэлектрофорезе: 1 — схема: пластинку агарозы с электрофоретически разделенными антигенами соединяют с пластиной из агарозы, содержащей антисыворотку; в результате реакции иммунопреципитации на втором этапе электрофореза получаются соответствующие пики преципитатов, дающие возможность определить количество любого антигена, входящего в состав исследуемой пробы; черный кружок — лунка с исследуемым веществом; 2— пример сформированных преципитатов при кросс-иммуноэлектрофорезе.
Кросс-иммуноэлектрофорез отличается от рокет-иммуноэлектрофореза тем, что позволяет проводить учет тех же характеристик одновременно на нескольких компонентах исследуемой пробы, если она представляет собой сложную антигенную смесь. Исследуемую пробу сначала подвергают простому электрофорезу в агарозном геле без сыворотки. После этого полосу геля, содержащую разделенные электрофорезом антигены, вырезают и помещают на краю более широкой стеклянной пластины, заполняя оставшуюся площадь этой пластины смесью агарозы с антисывороткой. Стекло с гелем помещают в прибор для электрофореза так, чтобы направление тока было перпендикулярно направлению первого электрофореза, а заключенные в агарозе антигены располагались со стороны катода. Антигены, передвигаясь в агарозе с антисывороткой, формируют преципитат также в форме пика, но с более широким основанием за счет большей площади, занимаемой каждым антигеном в агарозе после первого простого электрофореза (рис. 5). Т. к. различные компоненты исследуемой пробы, обладая разной электрофоретической подвижностью, заняли после первого электрофореза неодинаковые позиции относительно исходной точки, то и образуемые впоследствии пики преципитата никогда полностью не накладываются друг на друга и, следовательно, могут быть четко дифференцированы. Этому способствует также различная высота пиков, обусловленная неодинаковой концентрацией антигенов, входящих в состав пробы. По сравнению с другими методами иммунохимии кросс-иммуноэлектрофорез обладает наибольшей разрешающей способностью. Количественная характеристика каждого антигена также определяется по калибровочной кривой, построенной по референс-антигену, однако определение идет не по высоте пика, а по занимаемой им площади. Чувствительность обоих рассмотренных здесь вариантов количественного И. для большинства антигенов составляет 0,5—1 мкг/мл. В тех случаях, когда рокет-иммуноэлектрофорез или кросс-иммуноэлектрофорез используются для анализа антигенов с подвижностью гамма-глобулинов или для изучения самих иммуноглобулинов, применяют предварительные методы обработки этих макромолекул, позволяющие изменить их изоэлектрическую точку путем увеличения заряда молекул. Широко применяется для этой цели реакция карбамилирования, снижающая изоэлектрическую точку иммуноглобулинов до pH 5,0.
Описанные здесь в общих чертах основные типы Иммуноэлектрофореза не исчерпывают всего многообразия встречающихся в литературе вариантов этого метода. Возможности этих вариантов при правильном их применении необычайно широки и позволяют получать на незначительном по количеству материале богатую информацию об исследуемых антигенах. Все более совершенствуются те варианты И., где используется изотопная метка. Эти новые методы позволяют проводить анализ материала в объеме нескольких микролитров и количественно определять искомый антиген, даже если его содержание в пробе составляет 50—100 пикограмм.
Библиография: Грабар П. и Буртэн П. Иммуноэлектрофоретический анализ, пер. с франц., М., 1963; Иммунохимический анализ, под ред. Л. А. Зильбера, М., 1968; Руководство по количественному иммуноэлектрофорезу (методы и применение), под ред. Н. Аксельсена и др., пер. с англ., М., 1977, библиогр.; Lalirell С. В. Electroimmuno assay, Scand. J. clin. Lab. Invest., Suppl. 29, v. 124, p. 21, 1972, bibliogr.
Электроиммунный анализ
Метод впервые был предложен Лореллом в 1966 г. Гель агарозы, содержащий антисыворотку, распределяют равномерным слоем по плоской поверхности. Препарат, содержащий антиген вносят в различных разведениях в серию последовательных лунок в геле. Из лунок под воздействием постоянного электрического тока антигены мигрируют в слой агарозы, где они взаимодействуют с иммуноглобулинами. В результате этого взаимодействия образуются преципитаты АГ-АТ, приобретающие вытянутую, заостренную форму, напоминающую ракету. Отсюда другое название метода - ракетный иммуноэлектрофорез. Длина зоны преципитации при прочих равных условиях (концентрация геля, концентрация антисыворотки в геле, толщина слоя геля, режим электрофореза) находится в прямой зависимости от концентрации антигена. ЭИА используют для количественного определения белков в жидкостях организма.
Встречный электрофорез
Принцип встречного электрофореза применил в 1969 г. Бедарида для обнаружения преципитатов АГ-АТ. Иммунопреципитация происходит в слое носителя, причем в отличие от метода Ухтерлони контакт антигена с антителом происходит не вследствие свободной диффузии, а под влиянием постоянного электрического поля. Белки представляют собой амфолиты; ввиду различий аминокислотного состава они могут мигрировать в щелочной среде с разной скоростью и в разных направлениях (анодном, катодном). Если антиген и соответствующая преципитирующая антисыворотка мигрируют в разных направлениях, становится возможным их движение друг навстречу другу в слое геля или на ацетатцеллюлозной пленке. Преципитация наблюдается между стартовыми лунками обоих компонентов в течение 30-180 мин в зависимости от приложенного напряжения. Встречный иммуноэлектрофорез (ВИЭФ) предназаначен для обнаружения и индентификации преципитирующих систем АГ-АТ при условии, что антиген обладает электрофоретической подвижностью, отличной от той, которой обладают иммуноглобулины. ВИЭФ используют для индентификации антигенов вирусного гепатита В, антител к Aspergillus при бронхолегочном аспергилизе, антител к N.meningitidis, антител к ДНК при СКВ.
В данную группу объединены методы, конечный этап разделения которых основан на специфической реакции связывания антигена пробы с антителом добавляемой в носитель сыворотки, что позволяет определить состав исходной смеси антигенов. Существует несколько десятков модификаций иммуноэлектрофореза. Рассмотрим некоторые из них.
Классический иммуноэлектрофорез. На 1-м этапе производят разде-
ление белков в забуференном агаровом или агарозном геле, а затем латерально, параллельно разделенным компонентам прорезают щели, которые заполняют антисывороткой. Выдерживают в течение некоторого времени для диффузии компонентов (обычно ночь). Взаимодействие антигенантитело обнаруживается по дугам преципитации (рисунок 4.14). Метод позволяет выявить антигенный состав сложной смеси белков и идентифицировать отдельные компоненты смеси с помощью моноспецифических антисывороток. В клинике используется для типирования парапротеинов сыворотки и выявления белков Бенс-Джонса. Недостаток метода — отсутствие возможности количественного анализа.
Иммуноэлектрофорез - характеристика, виды реакции, оценка результатов.
Метод иммуноэлектрофореза, с помощью которого какой-либо антиген, например образец сыворотки, подвергается электрофоретическому разделению на составляющие его компоненты перед взаимодействием с антителами в геле для получения полос преципитации.
Иммуноэлектрофоретический анализ представляет собой сочетание электрофореза в агаровом геле с иммунодиффузией. Существуют различные варианты иммуноэлектрофореза.
Виды:
Встречный иммуноэлектрофорез может примен для опред антигенов, мигрирующих в агаре к положительнозаряж электроду. Его применяют для идентификации антигенов вируса гепатита В и соответствующих антител, антител к ДНК при системной красной волчанке, аутоантител к растворимым ядерным антигенам при коллагенозах, а также антител (преципитинов) к Aspergillus при аллергическом бронхолегочном аспергиллезе.
Ракетный электрофорез-это колич метод, предусматривающий внесение антигена в гель, содерж антитела. Линия преципитации имеет форму ракеты , длина которой определяется концентрацией антигена. Как и встречный электрофорез, это-быстрый метод, но и здесь антиген должен перемещаться к положительно заряженному электроду. Таким образом, ракетный электрофорез подходит для белков, например альбумина, трансферрина и церулоплазмина, в то время как концентрацию иммуноглобулинов обычно определяют методом простой радиальной иммунодиффузии.
Один из наиболее удачных вариантов ракетного электрофореза - двухмерный или перекрестный иммуноэлектрофорез Лорелла. При этом на первом этапе смесь антигенов электрофоретически разделяют в геле агарозы.Затем разделенные белки вновь заставляют диффундировать в геле под влиянием электрического поля в другом
Методы иммуноэлектрофореза для проведения количественного определения антигенов. Принцип метода и его назначение.
· Метод, основанный на принципе простой иммунодиффузии, при которой углубления для антигенов и антител примыкают непосредственно друг к другу. Антиген, находящийся в одной части геля, диффундирует в другую, содержащую антитела, и на границе этих двух частей образуется линия преципитации. Первичная зона преципитации растворяется затем в избытке антигена, продолжающего поступать благодаря диффузии в ту часть геля, где находятся антитела. Растворимые комплексы антигенантитело вновь преципитируют при реакции с антителами в прилежащей зоне геля. Описанная последовательность событий — преципитация, растворение и повторная преципитация — создает впечатление, что преципитат движется. Путь, пройденный передним краем преципитата за тот или иной период времени, может служить мерой для определения концентрации антигенов. При этом в качестве стандартов необходимо использовать образцы с известной концентрацией антигена. При количественном иммуноэлектрофорезе для проведения простой иммунодиффузии разделенных компонентов в геле вырезают широкую канавку, непосредственно примыкающую к лунке с антигеном и заполняют ее агаровым золем, содержащим антитела в относительно низкой концентрации. После того как в геле, содержащем антитела, образуются преципитаты, измеряют расстояние, на которое переместился их передний край.
· По методу, предложенному Альфонсо, точно измеренный объем раствора антигена подвергают электрофорезу. Затем пластинки оставляют на некоторое время, чтобы дать материалу, разделившемуся при электрофорезе, диффундировать, после чего гель дважды в течение 1 ч покрывают антисывороткой (4—5 мкл/см2 ). Образуются зоны преципитации круглой или овальной формы. Количество антигена рассчитывают по величине поперечного диаметра этих зон.
Читайте также:
