Инфузионно-трансфузионная терапия в послеоперационном периоде ранений - принципы
Добавил пользователь Владимир З. Обновлено: 02.02.2026
В военных лечебных учреждениях инфузионно-трансфузионная терапия (ИТТ) применяется как важная составная часть комплексных лечебных мероприятий, направленных на устранение патофизиологических сдвигов, обусловленных заболеванием (травмой, отравлением), на профилактику их осложнений.
Для определения характера и степени тяжести патофизиологических нарушений, требующих коррекции с помощью ИТТ, наряду с общеклиническими признаками используют лабораторные и инструментальные методы исследования. Особое внимание следует уделять выявлению: величины кровопотери, гипоальбуминемии, вида и степени тяжести обезвоживания, нарушений кислотно-основного состояния, электролитного состава, функций сердечно-сосудистой, дыхательной и пищеварительной систем, а также почек. Учитывают эффект лечебных мероприятий, выполненных на этапе оказания первой врачебной медицинской помощи. На основании полученных данных определяют последовательность и способы коррекции имеющихся нарушений.
Объем и содержание ИТТ предопределяются главным образом величиной кровопотери, ее темпом и временем, прошедшим с момента травмы. Ориентировочную величину кровопотери определяют по характеру и локализации травмы, клиническим и лабораторным данным.
При кровопотере до 1,0 л (20% ОЦК) показана инфузия кровезамещающих растворов общим объемом 2,0-2,5 л в сутки. При кровопотере до 2,0 л (30 - 40% ОЦК) возмещение дефицита ОЦК проводится за счет гемокомпонентов и кровезаменителей в соотношении 1:1 общим объемом до 3,5-4,0 л в сутки. При кровопотере, превышающей 2,0 л (40% ОЦК), потребность в гемотрансфузиях увеличивается, а общий объем вводимой жидкости должен превышать 4,0 л.
В большинстве случаев показанием к переливанию переносчиков газов крови при острой анемии вследствие массивной кровопотери является потеря 20 - 30% ОЦК и более, сопровождающаяся снижением содержания гемоглобина ниже 70 - 80 г/л и гематокрита ниже 25% и возникновением циркуляторных нарушений. Трансфузии эритроцитосодержащих гемокомпонентов должны сопровождаться переливанием свежезамороженной плазмы.
При продолжающемся кровотечении программу ИТТ реализуют в два этапа: на первом (до окончательной остановки кровотечения) используют кровезаменители и кровь с целью поддержания гемодинамики на безопасном для жизни больного (раненого) уровне, регидратации интерстиция. На втором этапе (после окончательной остановки кровотечения) осуществляют коррекцию дефицита эритроцитов, нарушений гемостаза, восстанавливают концентрацию плазменных белков и т.д.
Содержание инфузионно-трансфузионного обеспечения оперативного вмешательства зависит от исходного состояния оперируемого, величины операционной кровопотери, травматичности и продолжительности операции.
Поддерживающая инфузионная терапия при операциях с минимальной кровопотерей и потерей жидкости составляет 2 мл/кг/ч, заместительная (неосложненные операции) — 4 мл/кг/ч. Инфузионная терапия при умеренной хирургической травме (лапаротомия, аппендэктомия, грыжесечение, торакотомия) планируется из расчета 6 мл/кг/ч, а при значительной (резекция желудка, кишечника, радикальная мастэктомия и др.) - 8 мл/кг/ч.
Для поддержания устойчивого периферического кровообращения показаны инфузии реологически активных сред (реополиглюкин 0,5-0,8 л), 10 % раствора альбумина (до 0,3 л), электролитных растворов и 5-10 % растворов глюкозы.
При отсутствии противопоказаний необходимо собрать излившуюся кровь и произвести ее реинфузию. Если у раненого в исходном состоянии не было анемии, а кровопотеря не превышает 1 л для больного средней массы тела, гемотрансфузии не всегда показаны. Лицам с исходной постгеморрагической анемией для возмещения операционной кровопотери более 0,5 л необходимо перелить количество донорской крови или эритроцитосодержащих сред, равное величине операционной кровопотери. При длительных травматичных операциях, потребовавших инфузии больших объемов растворов, показан тщательный мониторинг систем кровообращения и дыхания, водно-электролитного баланса, при необходимости - введение диуретиков.
В послеоперационном периоде содержание инфузионно-трансфузионной терапии предопределяется необходимостью поддержания устойчивой гемодинамики, борьбы с гиповолемией, анемией, гипопротеинемией и нарушениями водно-электролитного баланса, а также необходимостью дополнительного парентерального питания. Достижение лечебного эффекта обеспечивается прежде всего использованием кровезаменителей в сочетании с кардиотоническими средствами (0,5-1,0 мл 0,06 % раствора коргликона), эуфиллином (10—20 мл 2,4 % раствора), комплексом витаминов С, В12 В1, В6.
При нарушениях энтерального питания, а также после продолжительных травматичных операций назначают 10-25 % растворы глюкозы с калием (10-20 мл 8 % раствора калия хлорида) и инсулином (1 МЕ на 3—4 г глюкозы) параллельно с аминокислотными смесями; жировые эмульсии. При продолжении потери эритроцитов и плазменных белков показаны повторные гемотрансфузии в количестве, близком к объему потерянной крови, а также переливания плазмы (альбумина) по 0,25-0,4 л.
В первые-вторые сутки после операции обычно требуется переливание 1,5 - 4 л растворов и крови. За это время уровень гематокрита должен быть стабилизирован на цифрах 0,33—0,35 л/л.
Программа инфузионной терапии должна быть строго индивидуальной, т.е. рассчитанной на конкретного пациента. Во время ее проведения необходимо осуществлять клинический контроль изменений функциональных показателей, отражающих состояние сознания, параметров системной гемодинамики и внешнего дыхания, работу желудочно-кишечного тракта, почек и других органов.
Эффективность ИТТ оценивают по степени ликвидации основных патофизиологических нарушений (восстановление сознания, нормализация окраски кожи и слизистых, тургора кожи, снижение температурного градиента, урежение пульса, нормализация систолического и диастолического АД, подъем центрального венозного давления, восстановление диуреза и др.).
Осложнения ИТТ. При переливании крови гемолитические реакции могут быть немедленными или поздними. Немедленные реакции обычно возникают из-за групповой несовместимости. Их наиболее частая причина - ошибка при определении группы крови больного или донора. Наиболее тяжелые реакции (гемотрансфузионный шок) возникают, когда введены первые 50-100 мл препарата. Тяжелые реакции на гемотрансфузию могут привести к смерти реципиента, поскольку они вызывают внутрисосудистый гемолиз, коагулопатию, шок, почечную и дыхательную недостаточность. Реакцию на переливание иногда распознать трудно, особенно при бессознательном состоянии пациента. Основные ее признаки - впервые выявленная одышка, лихорадка, боли в костях и диффузное кровотечение. В этих случаях надо прежде всего прекратить переливание. По показаниям следует применить инфузию жидкости и вазопрессоры для поддержания перфузии жизненно важных органов. Чтобы предотвратить осаждение свободного гемоглобина в почечных канальцах и последующую острую почечную недостаточность, целесообразно ввести внутривенно бикарбонат натрия для ощелачивания мочи. Салуретики и осмотические мочегонные агенты также могут быть полезны: они поддерживают выведение мочи и предотвращают почечную недостаточность. Донорская кровь и кровь из системы должны быть возвращены в трансфузиологическое отделение (станцию, банк крови) с соблюдением правил асептики. Одновременно туда же передаются образцы свернувшейся крови реципиента, а также его кровь с добавлением консерванта и несколько миллилитров мочи.
Необходимо учитывать происходящие в консервированной крови и эритроцитарной массе так называемые повреждения при хранении. Изменение в результате этого качества крови и жизнеспособности отдельных клеток в конечном итоге снижает ее лечебную эффективность: уменьшается рН, возникает гемолиз, повышается концентрация ионов калия, аммиака, разрушаются тромбоциты и лейкоциты, образуются микроагрегаты из клеточных элементов. Изменение ферментных систем в красных клетках и плазме приводит к инактивации факторов коагуляции.
В консервированной крови к 21-му или 35 дню хранения (в зависимости от применяемых гемоконсервантов) остаются жизнеспособными 70-80% эритроцитов, тромбоциты теряют свои свойства значительно раньше, а гранулоциты не способны к фагоцитозу уже через 24-48 ч после заготовки крови от донора.
В 1 мл консервированной цитратом крови содержится в 1-й день около 200, а при двухнедельном хранении - около 20000 агрегатов и сгустков фибрина диаметром до 200 мкм. Следовательно, при переливании 1 л крови в сосудистое русло больного будет инфузировано 200000 сгустков, а длительно хранившейся крови - около 20 млн. Первый капиллярный фильтр на пути этих взвесей - легкие, которые и страдают при этом в первую очередь.
Неоправданные переливания цельной крови не только неэффективны, но и нередко представляют определенную опасность: больной помимо эритроцитов получает ненужные и нежелательные для него лейкоциты, тромбоциты, белки, антигены и т.д., что может явиться причиной посттрансфузионных реакций. Все это небезразлично для него в последующей жизни (при повторных беременностях, при необходимости продолжительной гемотерапии и пр.), так как может явиться причиной тяжелых посттрансфузионных реакций. Помимо этого при использовании цельной крови нельзя забывать о риске заражения гепатитом А, В, С, Д и другими вирусными заболеваниями - трансфузионным мононуклеозом и т.д., СПИДом.
Осложнения инфузионно-трансфузионной терапии могут быть обусловлены: а) непосредственно методом проведения; б) техническими погрешностями; в) особенностями действия инфузионных растворов; г) недоучетом особенностей функционального состояния пациента.
Метод инфузии сам по себе чреват следующими осложнениями. Во-первых, при внутривенных инфузиях чаще всего страдает сосудистая стенка, что провоцирует тромбообразование, особенно при продолжительных вливаниях в одну вену. При катетеризации вен (в том числе центральных) инородное тело (катетер) в сосудистом русле уже через 30-40 мин покрывается пленкой фибрина, а это приводит к образованию эмболов, способных отрываться и мигрировать в легочные сосуды. Во-вторых, при внутриартериальных вливаниях непосредственно раздражаются сосудистые рецепторы, что способствует возникновению ангиоспазма и нарушению кровообращения в дистальных отделах конечностей. В-третьих, при использовании внутрикостного метода нарушается структура губчатого вещества кости. В последующем происходит склерозирование и нарушение ее трофики, а в дальнейшем - асептические некрозы и гнойно-септические осложнения.
К техническим погрешностям следует отнести повреждения или разрыв сосудов при грубом манипулировании иглой или инструментами, кровотечение, образование гематом, возникновение пневмо-, гемо- или гидроторакса, воздушной эмболии, тампонады сердца, "уплывание" катетера, нагноение.
Состав и физико-химические свойства инфузионных препаратов также могут служить причиной возникновения некоторых осложнений. Практически все кровезаменители имеют кислую реакцию, что при длительных вливаниях обусловливает развитие асептических флебитов (пример: глюкозированные растворы, подкисляемые соляной кислотой с целью исключения карамелизации глюкозы во время стерилизации). Сосудистая стенка повреждается также в связи с гиперосмоляльностью вводимых растворов. Когда осмоляльность превышает 600 мосмоль/л, флебит возникает уже на вторые сутки после начала инфузии.
Нередким осложнением инфузионной терапии является гипергидратация больного ("утопление") пациента.
Инфузионно-трансфузионная терапия в послеоперационном периоде ранений - принципы
Несмотря на достижения современной медицины, некомпенсированная кровопотеря остается ведущей причиной смерти пациентов при абдоминальной травме [1, 11, 15, 16]. Тактика компенсации кровопотери заключается в немедленной остановке кровотечения, возмещении объема циркулирующей крови и транспорта кислорода.
Цель исследования - сравнить эффективность интраоперационной трансфузии донорских и собственных эритроцитов у больных с заболеваниями и травмами, сопровождающимися кровопотерей более 70% объема циркулирующей крови.
Материал и методы

Проведен ретроспективный анализ течения анестезии и результатов лечения 91 больного с травмами и заболеваниями, осложнившимися внутрибрюшным кровотечением в объеме более 4 л (табл. 1). Все больные оперированы в экстренном порядке для остановки кровотечения. Анестезия была стандартной (кетамин, фентанил, нимбекс в рекомендованных дозах). Искусственную вентиляцию легких проводили в режиме нормовентиляции воздушно-кислородной смесью (FiO 2 1,0). Интраоперационная инфузионно-трансфузионная терапия (ИТТ) включала коллоидные и кристаллоидные среды, свежезамороженную плазму, донорские эритроциты (ДЭ) и аутоэритроциты (АЭ), получаемые с помощью интраоперационной аппаратной реинфузии излившейся крови на непрерывной аутотрансфузионной системе CATS (Fresenius). Тактика ИТТ строилась на определении объема кровопотери и различалась на этапах хирургического вмешательства. До остановки кровотечения преимущественно использовали растворы под контролем показателей гемодинамики (соотношение коллоидов и кристаллоидов 2:1). Показанием к трансфузии ДЭ до остановки кровотечения был уровень гемоглобина менее 90 г/л. Для поддержки гемодинамики при неэффективности высокого темпа инфузии назначали симпатомиметики (дофамин в дозе от 2 мкг/кг·мин, адреналин в дозе от 0,1 мкг/кг·мин). Утраченные эритроциты и факторы свертывания крови компенсировали во время остановки кровотечения, продолжая после осуществления хирургического гемостаза. Коррекцию электролитных нарушений и метаболических расстройств осуществляли на протяжении всего вмешательства.
В зависимости от использованных трансфузионных сред всех больных разделили на 2 группы. В 1-ю группу включили 14 больных (9 мужчин и 5 женщин), у которых преимущественно использовали ДЭ (более 60% общего объема гемотрансфузии). Тяжесть травмы по шкале ISS 54,5±3,4 балла. Средний возраст больных 47±4,9 года. Дефицит глобулярного объема 55,9±4,1%. Во 2-ю группу включили 77 человек (73 мужчины и 4 женщины), у которых преимущественно использовали АЭ, возвращенные с помощью аппаратной реинфузии (более 60% общего объема гемотрансфузии). Тяжесть травмы по шкале ISS 44,1±3,2 балла. Средний возраст больных 43±2,1 года. Дефицит эритроцитов 56,9±1,9%. По возрасту, тяжести травмы, объему учтенной кровопотери, дефициту эритроцитов различия в группах были статистически незначимы.
Непосредственные результаты интраоперационной гемотрансфузии оценивали по показателям красной крови (Hb, Ht), содержанию кислорода в артериальной (СаO 2 ) и смешанной венозной (CvO 2 ) крови, насыщению гемоглобина смешанной венозной крови кислородом (SvO 2 ), коэффициенту экстракции кислорода тканями (O 2 ER) и динамике содержания лактата (Lac). Анализировали летальность - госпитальную, интраоперационную и послеоперационную.
Статистическую обработку материала проводили с помощью статистического пакета IBM SPSS Statistics 19 (IBM Inc., USA). Определяли средние величины (M), среднее квадратичное отклонение (σ), стандартную ошибку средней величины (s). Для межгруппового сравнения использовали критерии Манна-Уитни, Крускала-Уоллиса, Фридмана, Вилкоксона. Взаимосвязь между переменными определяли с помощью критерия (χ 2 ), отношения шансов (ОШ), коэффициентов корреляции Пирсона (R), Кендалла (τ) и Спирмена (ρ). Данные представлены в виде M±s. В качестве порогового уровня статистической значимости принято p=0,05.
Результаты и обсуждение
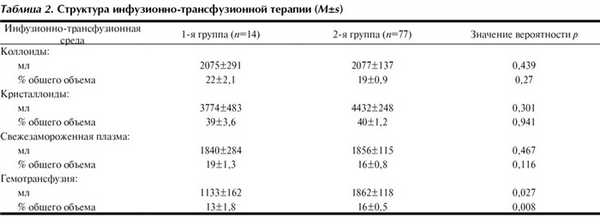
В 1-й группе за время операции (182±19 мин) больным введено 9503±1056 мл инфузионных и трансфузионных сред. До хирургической остановки кровотечения (через 124±11 мин от начала операции) было перелито 75±6,7% общего объема ИТТ. Всего за время операции за счет ДЭ и АЭ было возвращено 54,4±13,1% утраченных эритроцитов. Во 2-й группе за 180±8,5 мин операции объем ИТТ составил 11 258±547 мл, в том числе до хирургического гемостаза (через 141±9 мин) использовано 83±2,1% всего интраоперационного объема ИТТ. За время хирургического вмешательства возвращено 72,5± 4,4% утраченных эритроцитов. Различия в объемах и структуре инфузионной терапии между группами были статистически незначимыми, структура ИТТ представлена в табл. 2. Существовало статистически значимое различие абсолютных объемов гемотрансфузии между группами. Так, объем сред, содержащих эритроциты, был значимо меньше в 1-й группе (р=0,008), следовательно, при преимущественном использовании ДЭ удавалось возвратить меньше эритроцитов, чем при сочетанном применении АЭ и ДЭ.
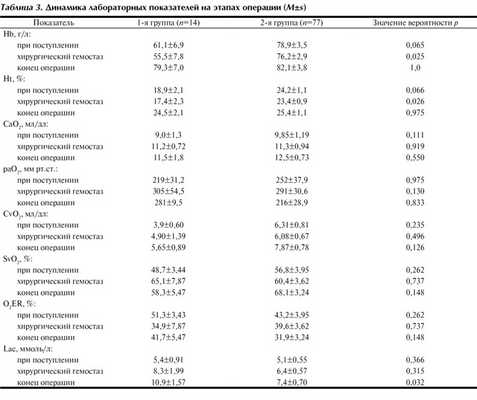
Уровни Hb и Ht часто используют как контрольные показатели при оценке результатов гемотрансфузии. Мы выявили статистически значимое повышение Hb и Ht после гемотрансфузии в каждой группе (табл. 3), однако эти показатели были значительно ниже референтных. Также имелись обратные связи между приростом показателей Hb и Ht после гемотрансфузии и объемом использованных сред, содержащих эритроциты, - для Hb τ= -0,285 (р=0,002), для Ht τ= -0,256 (р=0,001). Существовала обратная связь между объемом ИТТ и уровнями Hb в конце операции (τ= -0,225, р=0,004) и Ht в конце операции (τ= -0,221, р=0,004). При объемной инфузии, необходимой для восполнения объема циркулирующей крови и поддержки, вследствие гемодилюции мнимо повышается потребность в гемотрансфузии (коэффициент частной корреляции с поправкой на объем кровопотери R=0,529, р<0,0001).
Гемотрансфузия в первую очередь направлена на компенсацию утраченных переносчиков кислорода и соответственно после нее должно увеличиваться СаO 2 . Однако в обеих группах мы не выявили достоверной динамики СаO 2 после гемотрансфузии (см. табл. 2). К тому же корреляции между СаO 2 в конце хирургического вмешательства и объемом и качеством возвращенных эритроцитов были статистически незначимы. Соответственно интраоперационная гемотрансфузия не сопровождалась немедленным увеличением СаO 2 , и гемические нарушения транспорта кислорода сохранялись и непосредственно после гемотрансфузии.
Центральное место в патофизиологии любых критических состояний занимает кислородный долг, напрямую влияющий на выживание больных и развитие осложнений. В клинике его определяют по косвенным признакам - CvO 2 , SvO 2 , Lac, O 2 ER. На всех этапах исследования в обеих группах CvO 2 было ниже нормальных показателей, значимо не различаясь между группами и на этапах вмешательства в пределах группы (см. табл. 2). Из всех корреляций между CvO 2 и характеристиками ИТТ статистическую значимость имела только связь со степенью компенсации кровопотери (процент возвращенных эритроцитов по сравнению с утраченными) - τ=0,223 (р=0,038).
SvO 2 также значимо не различалось между группами и в пределах каждой группы на этапах исследования. Его средние значения оставались сниженными и зависели от объема гемотрансфузии (τ=0,197, р=0,046) и объема ИТТ (τ= -0,197, р=0,046).
O 2 ER превышал должные значения на всех этапах исследования. В 1-й группе он изменялся незначимо. Во 2-й группе прослеживалась тенденция к нормализации O 2 ER после ИТТ (см. табл. 2), когда он снизился на 26,2% (р>0,05). В конце операции O 2 ER в обеих группах превышал нормальные значения и зависел от дефицита эритроцитов (τ=0,205, р=0,04), объема интраоперационной ИТТ (τ=0,197, р=0,046) и степени компенсации утраченных эритроцитов, выраженной в процентах (τ= -0,197, р=0,046).
Итак, интраоперационная трансфузия больших объемов АЭ и ДЭ и возмещение объема циркулирующей крови не приводили к немедленному восстановлению гемического компонента транспорта кислорода и компенсации кислородного долга.
При анализе показателей летальности мы обнаружили значимые различия между группами. Так, в 1-й группе умерли 12 (85,7%), во 2-й - 45 (58,4%) больных (р=0,039). Интраоперационная летальность между группами не различалась. В 1-й группе на операционном столе умерли 5 (35,7%), во 2-й - 28 (36,4%) больных. Послеоперационная летальность была значимо ниже во 2-й группе. В 1-й группе перенесли вмешательство и умерли в послеоперационном периоде 7 (50%) человек (в 1-е сутки - 21,4%, позже 3 сут - 28,6%), во 2-й группе - 17 (22%) больных (в 1-е сутки - 14,3%, на 2-3-и сутки - 1,3%, позднее 3 сут - 6,4%) (р=0,018).
Статистически значимые различия в летальности между группами также отразились на отношении шансов (ОШ) выжить («выжил/умер»). В 1-й группе этот показатель составил 0,403 (95% доверительный интервал - ДИ=0,183-0,885; р=0,011), во 2-й группе - 1,385 (95% ДИ=1,101-1,741). Следовательно, преимущественно интраоперационная трансфузия ДЭ повышает риск летального исхода в послеоперационном периоде.
Безусловно, интраоперационные факторы, влияющие на летальность при острой кровопотере, нуждаются в дальнейшем изучении, в том числе необходим детальный анализ особенностей интраоперационной ИТТ.
Таким образом, при преимущественно интраоперационном использовании аутоэритроцитов для компенсации кровопотери более 70% объема циркулирующей крови снижается госпитальная и послеоперационная летальность.
При максимальном интраоперационном применении аутокрови происходит меньшее накопление лактата к концу операции.
При острой кровопотере более 70% объема циркулирующей крови интраоперационная гемотрансфузия аутоэритроцитов и донорских эритроцитов в любых соотношениях не сопровождается немедленным повышением показателей гемоглобина и гематокрита, нормализацией кислородного баланса (содержания кислорода в артериальной и смешанной венозной крови, насыщения гемоглобина смешанной венозной крови кислородом, коэффициента экстракции кислорода).
Инфузионная терапия коллоидными плазмозамещающими растворами.

Кровопотеря - скорее, правило, нежели исключение при тяжелых травмах, любых оперативных вмешательствах, в травматологии и ортопедии, при остром или хроническом заболевании. В патогенезе развития синдрома острой кровопотери принято выделять три основных фактора:
1) уменьшение объема циркулирующей крови (ОЦК) - это критический фактор для поддержания стабильной гемодинамики и системы транспорта кислорода в организме) ;
2) изменение сосудистого тонуса;
3) снижение работоспособности сердца.
В ответ на острую кровопотерю в организме больного развивается комплекс ответных компенсаторно-защитных реакций универсального характера. Патогенетическая роль гиповолемии в развитии тяжелых нарушений гомеостаза предопределяет значение своевременной и адекватной коррекции волемических нарушений и ее влияние на исходы лечения больных отделений реанимации. Невозможно представить высокий уровень медицинской помощи тяжело больному пациенту без проведения инфузионной терапии.
Различные растворы для инфузий используются на всех этапах оказания медицинской помощи: от догоспитального до отделения интенсивной терапии и реанимации. Вместе с тем эффективность инфузионной терапии во многом зависит от фармакологических свойств препарата и патогенетически обоснованной программы.
Острая кровопотеря приводит к выбросу надпочечниками катехоламинов, вызывающих спазм периферических сосудов и уменьшение объема сосудистого русла, что частично компенсирует возникший дефицит ОЦК. Централизация кровообращения позволяет временно сохранить кровоток в жизненно важных органах и обеспечить поддержание жизни при критических состояниях. Однако впоследствии этот компенсаторный механизм может стать причиной развития тяжелых осложнений острой кровопотери. Спазм периферических сосудов вызывает серьезные расстройства кровообращения в микроциркуляторном русле; это в свою очередь приводит к возникновению гипоксемии и гипоксии, накоплению недоокисленных продуктов метаболизма и развитию ацидоза, что и обусловливает наиболее тяжелые проявления геморрагического шока.
Острая кровопотеря остается главным показанием к проведению интенсивной терапии, направленной прежде всего на восстановление системной гемодинамики. Патогенетическая роль снижения ОЦК в развитии тяжелых нарушений гомеостаза предопределяет значение своевременной и адекватной коррекции волемических нарушений на исходы лечения больных с острой массивной кровопотерей. В этой связи инфузионно-трансфузионной терапии принадлежит ведущая роль в восстановлении и поддержании адекватного гемодинамическим запросам ОЦК, нормализации реологических свойств крови и водно-электролитного баланса.
По современным представлениям, эффективная инфузионная терапия включает следующие этапы:
I этап - восполнение объема циркулирующей крови (ОЦК) и интерстициальной дегидратации;
II этап - коррекция дисгидрий, дезинтоксикация, коррекция водно-электролитных нарушений;
III этап - энергетически-пластическое обеспечение.
Задача первого уровня решается на догоспитальном этапе или в начальном периоде инфузионно-трансфузионной терапии в стационаре. Она состоит в предельно быстром восстановлении ОЦК и дальнейшем поддержании его на уровне, предупреждающем остановку «пустого» сердца (устранение критической гиповолемии). Чем значительнее кровопотеря и глубина шока, тем острее потребность в большой объемной инфузии.
Поддержание циркуляторного гомеостаза во время операции - одна из важнейших задач анестезиологии. Довольно эффективным методом ОЦК при острой кровопотере может быть изо- или гиперволемическая гемодилюция синтетическими плазмозаменителями [1].
Появление в клинической трансфузиологии плазмозаменителей на основе гидроксиэтилкрахмала (ГЭК) сделало возможным повысить эффективность инфузионно-трансфузионной терапии, так как эти препараты при внутривенном введении не вызывают выброса гистамина [2], мало влияют на свертывающую и антисвертывающую систему крови, практически не вызывают аллергических реакций и не нарушают иммунные реакции [3].
Синтетические коллоидные плазмозамещающие препараты делятся:
· на производные желатина;
· декстраны - среднемолекулярные с мол. массой 60-70 кДа, низкомолекулярные с мол. массой 40 кДа;
· производные гидроксиэтилированного крахмала (ГЭК) - высокомолекулярные с мол. массой 450 кДа; среднемолекулярные с мол. массой около 200 кДа; среднемолекулярные с мол. массой 130 кДа.
Желатин - это денатурированный белок, выделяемый из коллагена, основная часть которого выводится почками, небольшая доля расщепляется пептидазами или удаляется через кишечник. Внутривенное введение раствора желатина приводит к увеличению диуреза, но не вызывает нарушений функции почек даже при повторном введении. Плазмозамещающие средства на основе желатина оказывают относительно слабое влияние на систему гемостаза; имеют ограниченную продолжительность объемного действия, что обусловлено их молекулярной массой.
Декстран - водорастворимый высокомолекулярный полисахарид. Плазмозаменители на его основе делят на низкомолекулярные декстраны 175 % продолжительностью 3-4 часа и среднемолекулярные декстраны с объемным эффектом до 130 % продолжительностью 4-6 часов. Практическое использование показало, что препараты на основе декстрана оказывают значительное отрицательное воздействие на систему гемостаза, так как, обладая «обволакивающим» действием, декстран блокирует адгезивные свойства тромбоцитов и снижает функциональную активность свертывающих факторов. При этом уменьшается активность факторов II, V и VIII. Ограниченный диурез и быстрое выделение почками фракции декстрана с мол. массой 40 кДа вызывает значительное повышение вязкости мочи, в результате чего происходит резкое снижение гломерулярной фильтрации вплоть до анурии («декстрановая почка»). Часто наблюдаемые анафилактические реакции возникают вследствие того, что в организме практически всех людей есть антитела к бактериальным полисахаридам. Эти антитела взаимодействуют с введенными декстранами и активируют систему комплемента, которая в свою очередь приводит к выбросу вазоактивных медиаторов.
Плазмозамещающие средства на основе ГЭК интенсивно применяются в реанимации, на этапах лечения больных с геморрагическим, травматическим, септическим и ожоговым шоками, когда имеют место выраженный дефицит ОЦК, снижение сердечного выброса и нарушение транспорта кислорода.
Инфузионные растворы на основе ГЭК производятся путем частичного гидролиза амилопектина, входящего в состав кукурузного или картофельного крахмала, до заданных параметров молекулярной массы с последующим гидроксиэтилированием. Основными параметрами, отражающими физико-химические свойства препаратов на основе ГЭК, являются молекулярная масса, молекулярное замещение, степень замещения. Величина молекулярного замещения является основным показателем, отражающим время циркуляции ГЭК в сосудистом русле. Период полувыведения препарата со степенью замещения 0, 7 составляет около двух суток, при степени замещения 0, 6 - 10 часов, а при степени замещения 0, 4-0, 55 - еще меньше. Молекулярная масса различных растворов ГЭК представлена, например, такими препаратами, как Рефортан 6 % со средней молекулярной массой 200 кД, молекулярным замещением 0, 5, осмолярностью 300 мОсм/л, коллоидно-осмотическим давлением (КОД) 28 мм рт. ст. и рН раствора 4, 0-7, 0; Стабизол 6 % со средней молекулярной массой 450 кД, молекулярным замещением 0, 7 осмолярностью 300 мОсм/л, КОД 18 мм рт. ст. и рН раствора 4, 0-7. Чем меньше молекулярная масса и молекулярное замещение, тем меньше время циркуляции препарата в плазме. Данное обстоятельство следует учитывать при выборе конкретного препарата на основе ГЭК для проведения целенаправленной инфузионной терапии. Одной из причин длительной задержки ГЭК в сосудистом русле считается его способность образовывать комплекс с амилазой, вследствие чего получается соединение с большей относительной молекулярной массой. Характерно, что осмолярность растворов ГЭК составляет в среднем 300-309 мОсм/л, а значения КОД для 10 % и 6 % растворов крахмала равны 68 и 36 мм рт. ст. соответственно, что в целом делает эти растворы более предпочтительными для возмещения дефицита ОЦК.
В последнее время вызывает значительный интерес группа препаратов для так называемой малообъемной реанимации. Это комбинированные препараты на основе 7, 5 % гипертонического раствора натрия хлорида и коллоидных препаратов - гидроксиэтилкрахмала или декстрана. При однократном внутривенном струйном введении гипертонический раствор натрия хлорида увеличивает ОЦК путем перемещения интерстициальной жидкости в сосудистое русло. Немедленный волемический эффект (не менее 300 %) продолжается не более 30-60 минут, снижаясь до 20 % первоначального. Введение коллоидов в гипертонический раствор натрия хлорида удлиняет продолжительность волемического эффекта.
В настоящее время достаточно большое внимание уделяется изучению влияния различных плазмозамещающих растворов на гемодинамику, компенсацию волемических нарушений, показатели системы гемостаза при проведении инфузионной коррекции острой гиповолемии при различных критических состояниях.
Клиническое исследование, проведенное с целью оценки эффективности коллоидных плазмозамещающих растворов на основе декстрана и гидроксиэтилкрахмала в коррекции синдрома острой гиповолемии у пострадавших с тяжелой сочетанной травмой, сопровождающейся травматическим шоком, продемонстрировало высокую эффективность применения плазмозаменителей на основе ГЭК в сравнении с декстраном полиглюкином.
Хотя стабилизация гемодинамических, волемических и гемоконцентрационных показателей у всех пострадавших начиная с первых суток оказания хирургической помощи и интенсивной терапии была однонаправлена и не носила критического характера, “цена” достижения их адекватного уровня в исследуемых группах была различной. При использовании полиглюкина объем и сроки инфузий СМП, гемотрансфузий были в 1, 5-2 раза больше, чем при применении коллоидных растворов 6 % и 10 % Рефортана, что значительно повышает риск осложнений инфузионно-трансфузионной терапии и увеличивает материальные затраты. Это обусловлено выявленными при исследовании позитивными свойствами ГЭК улучшать перфузию тканей, увеличивать доставку и потребление кислорода тканями, обеспечивать стойкий волемический эффект (волемический эффект Стабизола 6 % и Рефортана 6 % составляет 100 %, Рефортана 10 % - 140 %; продолжительность объемного действия соответственно 3-4 и 5-6 ч; КОД - 28 мм рт. ст. ; суточная доза Стабизола 6 % составляет 20 мл/кг, Рефортана 6 % - 33 мл/кг, Рефортана 10 % - 20 мл/кг). Все это не только повышает безопасность инфузионной терапии, включающей растворы ГЭК, но и расширяет возможности реализации больших объемов с высокой скоростью введения, особенно показанной при неотложных состояниях и в экстремальных условиях [4].
Эффективность коллоидных плазмозамещающих растворов на основе декстрана и ГЭК в коррекции синдрома острой гиповолемии подтверждена у 127 тяжело пострадавших (возраст от 22 до 57 лет). Частота 1, 2 и 3-й степени тяжести шока составила 10, 30 и 50 % соответственно. Тяжесть состояния пострадавших по APACHE II - 19-21 балл.
Величина общей кровопотери, включая травму и оперативное вмешательство, у всех обследованных пострадавших составила в среднем 38, 5 ± 1, 9 % ОЦК (29, 2 ± 3, 7 мл/кг). Объем ИТТ превышал объем кровопотери в 2-2, 5 раза. Методы исследования включали оценку гемодинамического профиля, объема циркулирующей крови, гемоконцентрационных показателей, кислородно-транспортной функции крови, показателей гемостаза.
В зависимости от состава программы ИТТ пострадавшие были рандомизированы на две группы. Контрольную группу составили 63 больных. Программа ИТТ, с учетом операционного периода, в первые сутки включала полиглюкин 971, 4 ± 80, 7 мл (23, 9 % от общего объема), растворы кристаллоидов 2060, 5 ± 55, 4 мл (53, 2 %), эритроцитную массу 833, 4 ± 67, 3 мл (22, 9 %). В последующие 2-3 суток послеоперационного периода объем инфузий полиглюкина в среднем составил 784, 3 ± 53, 9 мл в сутки, эритроцитной массы - 875, 5 ± 49, 3 мл в сутки (3-4 дозы). Соотношение эритроцитной массы, коллоидов и кристаллоидов - 1: 1: 2.
Во 2-й группе (основная - 65 больных) инфузионно-трансфузионную терапию проводили в первые сутки (включая интраоперационную инфузию) с применением 10 % раствора ГЭК (Рефортан ГЭК 10%) 1245, 5 ± 52, 5 мл (32, 4 % от общего объема ИТТ), растворов кристаллоидов 1755, 8 ± 80, 8 мл (46, 3 %), эритроцитной массы 505, 1 ± 48, 3 мл (13, 9 %). В последующем на 2-3 сутки объем инфузий 6 % ГЭК (Рефортан ГЭК 6%) составил 987, 8 ± 65, 8 мл в сутки, эритроцитной массы - 369, 7 ± 84, 3 мл в сутки (1-2 дозы). Соотношение эритроцитной массы, коллоидов и кристаллоидов - 1: 2: 3.
В обеих группах с 5-х по 7-е сутки использование синтетических коллоидов осуществлялось по показаниям. Как правило, со 2-3 суток в программу инфузионной терапии включали растворы для парентерального питания. Как показал анализ показателей гемодинамики, во всех исследуемых группах артериальное давление (АД) и частота сердечных сокращений (ЧСС) изменялись в первые часы после травмы. Так, АД снижалось до 80-90/50-60 мм рт. ст. , а ЧСС возрастала до 120-130 уд. в минуту. После окончания операции и на всех этапах исследования эти показатели быстрее восстанавливались во второй группе по сравнению с первой. Начиная с первых суток послеоперационного периода в группе 2 показатели гемодинамики стабилизировались в пределах 115-120/70-80 мм рт. ст. , пульс 84-86 уд. в минуту. В то же время у пострадавших группы 1 нормализация показателей гемодинамики происходила медленнее. Так, АД оставалось в пределах 100-110/60-65 мм рт. ст, ЧСС - 100-110 в минуту до 3-х суток и только к 5-7 суткам достигало уровня 117-120/70-75 мм рт. ст. при урежении ЧСС до 84-86 уд.
Известно, что величина кровопотери, в равной мере дефицит ОЦК и нарушения гемодинамики не имеют между собой четкой корреляционной зависимости в силу компенсаторных возможностей организма. Артериальное давление начинает снижаться при потерях более 20-25 % ОЦК. Следовательно, стабилизация гемодинамических показателей в более короткие сроки у пострадавших 2-й группы по сравнению с 1-й группой дает возможность оценить степень компенсации кровообращения у тяжело пострадавших при имеющемся волемическом состоянии, а значит, в определенной степени судить об адекватности, эффективности и преимуществах инфузионной терапии ГЭК.
Результаты исследований ОЦК и ее компонентов показали, что в первые часы после травмы у всех обследованных пострадавших дефицит ОЦК составил 19-21% как за счет ГО (42-43 %), так и ОП (5-7 %). При этом показатели гемоглобина были в пределах 80-90 г/л, гематокрита - 29-30 %, количество эритроцитов на уровне 3, 02-3, 15 × 1012/л. (табл. 1, 2).
В первые сутки после операции на фоне проводимой ИТТ в группе 2 отмечено повышение ОЦК до 64-67 мл/кг, ГО - до 23-26 мл/кг, гемоглобина - до 110-120 г/л, гематокрит увеличился до 34-37 %, а количество эритроцитов - до 3, 11-3, 42 × 1012/л. В последующем было выявлено постепенное увеличение волемических и концентрационных показателей к 7 суткам: ОЦК до 67-68мл/кг, ГО - 25-26мл/кг, гемоглобина - 115-121 г/л, гематокрита - 35-37 %, количества эритроцитов - 3, 54-3, 67 × 1012/л (р
В группе 1 в первые сутки после операции также отмечено повышение ОЦК до 64- 66 мл/кг, ГО - 24-25 мл/кг, гемоглобина - 106-116 г/л, гематокрит увеличился до 33, 5-34, 8 %, а количество эритроцитов - до 3, 49-3, 56 × 1012/л.
Таким образом, полученные нами результаты свидетельствуют, что в послеоперационном периоде на фоне избранной тактики возмещения кровопотери изменения ОЦК и ГО носили однонаправленный характер. Однако в поэтапном уменьшении их дефицита между группами имеются определенные различия. Если к 7-м суткам в группе 2 дефицит ОЦК не превышал 10 %, а ГО - 17 %, то в группе 1 эти показатели были равны соответственно 14 % (ОЦК) и 20 % (ГО). Отмеченные особенности в группе 2 со стороны ОЦК и ГО прослеживаются и при сравнении показателей гемоглобина, гематокрита, количества эритроцитов. Можно предположить, что ИТТ в 1 группе была неадекватна как по объему, так и по составу. Однако, анализируя проведенную инфузионно-трансфузионную терапию, видно, что в обеих группах объем кровопотери восполнен с превышением в 2-2, 5 раза. Кроме того, в течение 7 суток после операции объем инфузий эритроцитной массы, белковых препаратов, плазмы в группе 1превышал таковые в группе 2 в 1, 5-2 раза. Вместе с тем, волемические и гемоконцентрационные показатели у пострадавших группы 1оставались ниже, чем в группе 2 даже на 7 сутки.
Кроме этого, известна способность коллоидных плазмозамещающих растворов снижать общий белок после переливания рефортана на 25, 8 %. Восполнение операционной кровопотери Стабизолом при брюшнополостных операциях в объеме 16-20 % к ОЦК вызывает достоверное. Влияние Рефортана на свертывающую систему крови во время операции и через 24 часа после ее окончания представлена в табл. 4.
Проведенное рандомизированное исследование по оценке эффективности коррекции синдрома острой гиповолемии у реаниматологических больных синтетическими коллоидными растворами продемонстрировало высокую эффективность применения плазмозаменителей на основе гидроксиэтилкрахмала в сравнении с принятым на табельном оснащении декстраном. При его использовании объем и сроки инфузий свежезамороженной плазмы, гемотрансфузий были в 1, 5-2 раза больше, чем при применении коллоидных растворов, что значительно повышает риск осложнений инфузионно-трансфузионной терапии и увеличивает материальные затраты. Это обусловлено, выявленными при исследовании, позитивными свойствами гидроксиэтилкрахмала улучшать перфузию тканей, увеличивать доставку и потребление кислорода тканями, обеспечивать стойкий волемический эффект.
Разработка и производство новых инфузионных растворов на основе ГЭК дало новые возможности оптимизировать инфузионную терапию у больных в критических состояниях и создали выгодную альтернативу компонентам крови. Коллоидные плазмозамещающие препараты на основе ГЭК в изотоническом растворе хлорида натрия Рефортан и Стабизол обладают выраженным гемодинамическим эффектом, поддерживают среднединамическое артериальное давление, сохраняя при этом нормодинамический тип кровообращения. Инфузия этих препаратов в объеме 15-20 мл/кг массы тела существенно не влияет на показатели свертывающей и антисвертывающей системы крови. Все это не только повышает безопасность инфузионной терапии, включающей растворы ГЭК, но и расширяет возможности реализации больших объемов с высокой скоростью введения, особенно показанной при неотложных состояниях и в экстремальных условиях.
2. Asskali F. , Fix F. U. , Hoos J. , Fo rster H. , Dudziak R. Histaminfreisetzug nach i. v. Applikation von Hydroxyethylsta rke unter Verwendungeines empfind-lichen und spezifischen Nachweises bei Probanden und Patienten // Der Anaesthesist. 1987. Bd. 36. S. 243.
3. Maurer P. H. , Berardinelli B. Immunologic studies with hydroxyethyl-starch (HES). A proposed plasma expander // Transfusion. 1986. V. 8. P. 265. 4. Шестопалов А. Е. , Пасько В. Г. Объемзамещающая терапия острой кровопотери
у пострадавших с тяжелой сочетанной травмой // Трудный пациент. 2005. № 4. С. 7-11.
Стратегия заместительной терапии острой кровопотери. Часть II
В результате клинических исследований по использованию гипертонического раствора натрия хлорида в объеме от 100 до 400 мл была доказана его эффективность для временной стабилизации макро- и микроциркуляции, отмечено значительное повышение АД, сердечного выброса, восстановлении диуреза, свидетельствовавшего об улучшении периферического кровообращения. Данные работы легли в основу «малообъемной заместительной терапии» («small volume resuscitation»), чрезвычайно популярной на Западе, а 7, 5% гипертонический раствор натрия хлорида стали называть не иначе как «оживляющий» раствор (Bellamy, 1984). Действительно, инфузия 7, 5% гипертонического раствора натрия хлорида в дозе 4 мл/кг способна в кратчайшие сроки эффективно увеличить ОЦК, улучшить реологические свойства крови, стабилизировать системную гемодинамику и сердечный выброс. По данным Vassar M. , et al. (1990) переливание 250 мл 7, 5% раствора NaCl повышает внутрисосудистый объем примерно на 1 л. Однако, к сожалению, описанные положительные эффекты непродолжительны. Гемодинамический эффект начинается уже через 10 минут после инфузии и достигает максимума к 2-3 часу. Затем после того, как осмотическое давление крови вследствие разведения нормализуется, перешедшая в сосудистое русло жидкость вновь устремляется в интерстициальное пространство подобно гипотоническому по отношению к тканевой жидкости раствору и дефицит ОЦК резко нарастает. В случае продолжительного догоспитального этапа возможно повторное введение гипертонического раствора в той же дозировке (4 мл/кг). Принимая во внимание нестойкий гемодинамический эффект гипертонического раствора, с целью пролонгации периода внутрисосудистой циркуляции было предложено создание препаратов комбинированного действия на основе гипертонического раствора и препаратов декстрана, учитывая их длительный период внутрисосудистой циркуляции и стойкий гемодинамический эффект. Создаются и постоянно улучшаются комбинированные препараты для «малообъемной заместительной терапии», сочетающие в себе все преимущества гиперосмолярного гиперонкотического плазмозаменителя гемодинамического действия. Целесообразным представляется сочетание гипертонического раствора натрия хлорида и препаратов на основе гидроксиэтилкрахмала. Так, в России создан препарат Гемостабил (7, 5% раствор натрия хлорида + 10% раствор реополиглюкина). Проведенные клинические исследования показали его высокую эффективность при острой массивной кровопотере у различных категорий пациентов (Ярочкин В. С. , 2004).
Обсуждая «малообъемную заместительную терапию» как частный вид инфузионной терапии, следует обратить внимание на целесообразность и необходимость массивной инфузионной терапии на догоспитальном этапе. Различными авторами указывается, что попытки «чрезмерно активного» восстановления объема циркулирующей крови при неостановленном кровотечении чреваты его усилением и сопровождаются меньшим процентом выживамости. N. Bickell et al. (1994) при анализе 598 клинических случаев огнестрельных ранений грудной клетки с продолжающимся кровотечением приводит данные о достоверно более высоком уровне летальности у той категории больных, которым на догоспитальном этапе проводилась массивная объемная инфузионная терапия. Таким образом, введение больших количеств жидкости при неконтролируемом кровотечении ведет к ухудшению прогноза. Искусство врача заключается в способности удержаться от массивных инфузий в период неостановленного кровотечения и возможности «балансировать на грани» переносимой гипотонии. Всё вышеуказанное как нельзя лучше относится к кровотечениям из верхних отделов желудочно-кишечного тракта, когда часто до момента проведения экстренной эзофагогастродуоденоскопии трудно определить характер язвенного кровотечения: состоявшееся или продолжающееся.
Коррекция острого постгеморрагического ДВС-синдрома.
При определении тактики заместительной терапии острой кровопотери важное место занимает оценка, своевременная диагностика возникающих расстройств гемокоагуляции и их патогенетическая коррекция. Наличие длительного локального кровотечения, к примеру, из гастродуоденальной язвы, будет сопровождаться гиперкоагуляционным синдромом, а массивная кровопотеря практически всегда приводит к развитию ДВС - синдрома. Гиперкоагуляционный синдром и ДВС синдром, отличаясь друг от друга как патогенетически, так и по клиническим и лабораторным признакам, тем не менее, в современной трансфузиологии рассматриваются вместе потому, что, по сути, являются различными степенями нарушения гемокоагуляции при острой кровопотере. Доказано, что гиперкоагуляционный синдром в течение короткого времени может перейти в процесс системного микротромбирования, знаменующий собой начало ДВС - синдрома. И наоборот, после купированного ДВС-синдрома, «по умолчанию» ещё длительное время нарушения гемокоагуляции трактуются как гиперкоагуляционный синдром и при определенных обстоятельствах (падение АД, рецидив гастродуоденальной язвенной геморрагии) достаточно быстро приводят к повторному возникновению диссеминированного внутрисосудистого свертывания крови. ДВС-синдром - процесс системного диссеминированного микротромбирования, приводящий к блокаде микроциркуляторного русла и коагулопатии потребления с диффузной кровоточивостью, что в конечном итоге приводит к повреждению органов и тканей, неизбежно приводя организм полиорганной недостаточности. По данным З. С. Баркагана, летальность при ДВС синдроме достигает 30-50%.
Критериями диагностики гиперкоагуляционного синдрома являются: 1) лабораторные данные (укорочение активированного частичного тромбопластинового времени (АЧТВ), активированного времени рекальцификации (АВР), удлинение фибринолиза (увеличение времени лизиса эулобулинового сгустка), нормальный уровень фибриногена крови, отрицательный этаноловый тест) и 2) клинические проявления (отсутствие признаков тромбозов, кровь при пункции вены быстро тромбирует иглу; в пробирке сгусток образуется, но рыхлый).
К основным признакам гиперкоагуляционной фазы синдрома ДВС относятся: 1) лабораторные данные (укорочение АЧТВ и АВР, тромбоцитопения, гипофибриногенемия, положительный этаноловый тест, повышение уровня фибрин-мономерных комплексов, увеличение времени лизиса эуглобулинового сгустка) и 2) клинические проявления (признаки тромбозов, явления полиорганной, в первую очередь, дыхательной недостаточности, олигоурия; сгусток в пробирке образуется, но нестойкий).
Гипокоагуляционная фаза синдрома ДВС может быть верифицирована при наличии: 1) лабораторных признаков потребления факторов свертывания ( удлинение АЧТВ, АВР, тромбоцитопения, гипо- и афибриногенемия, резкое повышение уровня фибрин-мономерных комплексов, положительный этаноловый тест), ускорение фибринолиза (укорочение времени лизиса эуглобулинового сгустка) и 2) клинических проявлений: диффузно геморрагический диатез (кровоточивость гематомно-петехиального типа), полиорганная недостаточность; сгусток в пробирке не образуется.
Принципы лечения гиперкоагуляционного синдрома при желудочно-кишечном кровотечении сводятся к адекватной заместительной терапии и обязательно включают трансфузию свежезамороженной плазмы в дозе не менее 15 - 20 мл/кг (как правило, не менее 1 л). В контексте язвенной геморрагии профилактика синдрома ДВС заключается также в достижении стабильного локального гемостаза, поскольку доказанным фактом является переход гиперкоагуляционного синдрома в гиперкоагуляционную фазу ДВС синдрома при возникновении рецидива язвенного кровотечения.
Лечение ДВС-синдрома и его последствий - это, прежде всего, трансфузия больших доз свежезамороженной плазмы (СЗП) из расчета 15-20 мл на 1 кг массы тела. Нередко возникает потребность в трансфузии нескольких литров свежезамороженной плазмы. Трансфузией СЗП достигается: 1) коррекция гемостаза возмещением компонентов, поддерживающих антитромботический потенциал крови (антитромбина III, плазминогена, протеина С, физиологических антиагрегантов), 2) восстановление антипротеазной активности плазмы. Оптимальным способом применения СЗП после её согревания является струйное введение в первоначальной дозе 600-800 мл под прикрытием гепарина: в начале каждой инфузии вводят 2500-5000 ЕД гепарина с целью активации вводимого с плазмой антитромбина III и предупреждения её свертывания циркулирующим тромбином. По мнению З. С. Баркагана, G. Wollf, медленные капельные вливания плазмы малоэффективны. Рекомендуется использование в комплексе терапии ДВС-синдрома, особенно гипокоагуляционной его фазы, препаратов с антипротеазной активностью (гордокс). При развитии ДВС-синдрома необходимо в динамике несколько раз в сутки проводить лабораторный анализ основных параметров коагулограммы с целью коррекции терапии.
Интересно мнение А. И. Воробьева относительно возможности и целесообразности при наличии клинико-лабораторных признаков ДВС-синдрома трансфузии донорских эритроцитов: «Введение донорских эритроцитов до купирования ДВС-синдрома крайне нежелательно, так как введенные эритроциты лишь усиливают диссеминированное микротромбирование, ещё более замедляя кровоток, ухудшают оксигенацию тканей. В итоге, введение донорских эритроцитов, по сути, лишь ещё более утяжеляет течение ДВС синдрома». В этой связи становится понятной ситуация, описанная С. М. Бова в его классической монографии «Профузные язвенные кровотечения» (1967): «…замечено, что возобновляющееся желудочное кровотечение после трансфузии крови нередко бывает массивным и, следовательно, более опасным». Именно развитие ДВС-синдрома на фоне рецидива язвенного кровотечения становится фатальным, что подтверждается высоким уровнем летальности, достигающим 70%.
Исследования, проведенные в нашей клинике, позволили выявить нарушение системы гемокоагуляции у 89% больных, впоследствии подвергнутых оперативному лечению по поводу острой гастродуоденальной язвенной геморрагии, при этом у 71, 4% пациентов показатели системы гемокоагуляции соответствовали лабораторным признакам гиперкоагуляционного синдрома. Практически у каждого пятого пациента с III степенью кровопотери выявлялись признаки синдрома ДВС, в частности гиперкоагуляционной его фазы. У всех пациентов, поступивших в больницу с клинической картиной геморрагического шока, выявлены клинико-лабораторные признаки гиперкоагуляционной фазы ДВС-синдрома.
Особый интерес представляют изменения параметров гемокоагуляции при рецидиве язвенной геморрагии. Все случаи рецидива кровотечения отмечены на фоне имевших место нарушений системы гемокоагуляции при поступлении. Так, в 53, 6% случаях рецидив ОГДЯК отмечен при лабораторных признаках гиперкоагуляционного синдрома на фоне III степени кровопотери. У этих больных возникновение рецидивного язвенного кровотечения сопровождалось прогрессирующими нарушениями в системе гемокоагуляции с развитием клинико-лабораторных признаков гиперкоагуляционной фазы ДВС-синдрома. В 46, 4% случаев развитие рецидива ОГДЯК отмечено на фоне имевшегося исходно синдрома ДВС, в частности его гиперкоагуляционной фазы. Рецидивная геморрагия на фоне имевшегося синдрома ДВС характеризуется катастрофическими патофизиологическими нарушениями системы гемостаза, в первую очередь, развитием гипокоагуляционной фазы синдрома ДВС (коагулопатии потребления). Возникновение рецидивного язвенного кровотечения на фоне имевшегося исходно синдрома ДВС (гиперкоагуляционной фазы) с трансформацией в коагулопатию потребления привело к резкому увеличению числа летальных исходов у больных в послеоперационном периоде. Таким образом, развитие рецидива ОГДЯК на фоне имеющегося исходно синдрома ДВС приводит к увеличению уровня послеоперационной летальности в несколько раз по сравнению уровнем соответствующей летальности при рецидиве на фоне гиперкоагуляционного синдрома. Данный факт позволяет рассматривать синдром ДВС в качестве одного из важнейших факторов развития неблагоприятных исходов при ОГДЯК, а единственно возможный на сегодняшний день метод его коррекции - трансфузию СЗП в адекватных дозах - одним из важнейших компонентов заместительной терапии.
Стратегия заместительной терапии острой кровопотери.
Стратегия заместительной терапии включает в себя определение «количества» - адекватного для компенсации волемических расстройств объема инфузий и «качества» - соотношения различных инфузионно-трансфузионных сред. Решающим критерием для определения как «количества», так и «качества» заместительной терапии является степень кровопотери. На программу заместительной терапии, безусловно, оказывают влияние и такие факторы, как возраст больного, наличие и характер сопутствующей патологии, т. е. исходная степень чувствительности к циркуляторной и гемической гипоксии. Следует помнить, что организм человека более чувствителен к нарушениям системного и капиллярного объемного кровотока, чем к анемии. Поэтому первоочередной задачей при лечении острой кровопотери является устранение гиповолемии и устранение дефицита ОЦК, которое проводится параллельно с окончательным гемостазом.
Общепризнанной является начало заместительной терапии с инфузий коллоидно-кристаллоидных растворов, преследующей своей целью компенсацию дефицита ОЦК и стабилизацию гемодинамики. Одновременно с этим, необходимо проводить коррекцию нарушений гемокоагуляции путем трансфузии свежезамороженной плазмы. Лишь при стабилизации состояния, улучшении центрального и периферического кровотока, появлении диуреза, свидетельствующего о восстановлении как центральной, так и периферической гемопрфузии, но одновременно сохраняющихся явлениях кислородной недостаточности (на основании артерио-венозной разницы по кислороду, сатурации крови и уровня гематокрита и эритроцитов) следует решать вопрос о целесообразности трансфузии донорских эритроцитов. Анализ литературных данных (Брюсов П. Г. , Вербицкий В. Г. , Воробьев А. И. , Зильбер А. П. ) и опыт клиники в лечения больных с кровопотерей различной этиологии позволили нам представить алгоритм заместительной терапии в зависимости от степени кровопотери (таблица 1. ). Согласно алгоритму трансфузия донорских эритроцитов не показана при I и II степенях кровопотери. Доля эритроцитарной массы при III и IV степенях кровопотери должна составлять не более 20% и 25% соответственно. В то же время необходимость в трансфузии СЗП возникает уже при II степени кровопотери и доля её возрастает при более тяжелых степенях кровопотери. Из коллоидных растворов предпочтительным является использование в равных долях 6% и 10% растворов гидроксиэтилкрахмала, а также реополиглюкина. Использование раствора реополиглюкина при язвенных гастродуоденальных кровотечениях ещё совсем недавно считалось противопоказанным, ввиду его реологической активности, улучшении регионального кровотока, что рассматривалось как неблагоприятный фактор в возникновении рецидивной геморрагии. Однако, проведенными в клинике исследованиями показано, что в основе рецидивной геморрагии лежит локальное микротромбирование с формированием ишемического некроза в периульцерозной зоне. Согласно этой концепции, улучшение микроциркуляции любыми способами, в том числе благодаря инфузии реологических активных плазмозаменителей является перспективным и содержит в себе, возможно, один из путей снижения частоты рецидивов язвенных кровотечений.
Читайте также:
