Калиевые каналы мембраны клетки
Добавил пользователь Евгений Кузнецов Обновлено: 01.02.2026
Никорандил - антиангинальный препарат из группы активаторов калиевых каналов. Его особенностью является двойственный механизм действия, включающий в себя эффекты, обусловленные открытием АТФ-зависимых калиевых каналов, и нитратоподобное действие. Кроме того, никорандил воспроизводит эффект ишемического прекондиционирования - адаптации миокарда к повторным эпизодам ишемии. В крупных многоцентровых исследованиях была продемонстрирована способность никорандила уменьшать число неблагоприятных исходов у пациентов со стабильной стенокардией. Никорандил эффективен также при нестабильной стенокардии, остром инфаркте миокарда, острой сердечной недостаточности, у пациентов, перенесших чрескожное коронарное вмешательство. Уникальность никорандила заключается в том, что он в отличие от b-блокаторов, антагонистов кальция и нитратов не только оказывает антиангинальное действие, но и влияет на прогноз стабильной ишемической болезни сердца. Ключевые слова: активатор калиевых каналов, ишемическое прекондиционирование, ишемическая болезнь сердца, стенокардия напряжения, инфаркт миокарда, никорандил.
В настоящее время достигнуты существенные успехи как в консервативном, так и в хирургическом лечении ишемической болезни сердца (ИБС), однако она остается основной причиной смертности в большинстве стран мира. В нашей стране смертность от болезней системы кровообращения составляет 57% от всех случаев смертности населения и существенно опережает другие ее причины (новообразования, травмы и т.д.) [1]. При этом около 50% смертей от заболеваний сердечно-сосудистой системы приходится на долю ИБС [1]. Стабильная стенокардия напряжения является наиболее распространенной формой ИБС: она диагностируется более чем у 1/3 пациентов с этим заболеванием. Частота стенокардии резко увеличивается с возрастом [1].
В рекомендациях Европейского общества кардиологов отмечается, что стратегия лечения стабильной стенокардии (СС) должна включать в себя два компонента: повышение качества жизни пациента и улучшение прогноза заболевания [2]. К средствам, улучшающим качество жизни пациента, относят антиангинальные препараты: b-блокаторы, пролонгированные антагонисты кальция, нитраты, блокаторы If-каналов синусового узла. Эти препараты оказывают антиишемическое действие за счет снижения потребности миокарда в кислороде или улучшения его кровоснабжения. Основным их клиническим эффектом является уменьшение частоты и интенсивности приступов стенокардии, благодаря чему повышается толерантность к физической нагрузке и существенно улучшается самочувствие пациента.
Доказанной эффективностью в отношении прогноза СС обладают антиагреганты и статины; у пациентов с артериальной гипертензией, хронической сердечной недостаточностью (ХСН), сахарным диабетом или перенесенным инфарктом миокарда на прогноз влияют также ингибиторы ангиотензинпревращающего фермента. b-блокаторы улучшают прогноз СС только у пациентов, перенесших инфаркт миокарда, и при ИБС, осложненной ХСН [1, 3].
В последнее время возрастает интерес к препаратам для лечения СС с принципиально новым механизмом действия - активаторам калиевых каналов. Наиболее широко известным лекарственным средством этой группы является никорандил. Отличительное свойство никорандила -двойственный механизм действия, который связан с особенностью его химической структуры. Наличие в составе молекулы никорандила остатка амида никотиновой кислоты (фрагмента витамина РР) обеспечивает его влияние на АТФ-зависимые калиевые каналы, а благодаря нитратной группе реализуется нитратоподобный эффект [4]. Активация калиевых каналов приводит к гиперполяризации клеточной мембраны, что вызывает снижение поступления кальция внутрь клетки и, как следствие, дилатацию артериол [5]. Нитратоподобный эффект связан с увеличением продукции оксида азота, который обеспечивает венозную вазодилатацию и расширение крупных коронарных сосудов [6, 7]. Таким образом, никорандил снижает пред- и постнагрузку на миокард, не повышая его потребности в кислороде и не оказывая влияния на частоту сердечных сокращений, системное артериальное давление, сократимость миокарда [7, 8]. Важным компонентом действия никорандила является его кардиопротекторный эффект, связанный с феноменом ишемического прекондиционирования (адаптации миокарда к повторным эпизодам ишемии) [9]. Реализация этого феномена под действием никорандила обусловлена активацией АТФ-зависимых калиевых каналов митохондрий, которая предотвращает избыточное сокращение кардиомиоцитов при восстановлении перфузии миокарда после эпизода ишемии [10]. Моделирование эффекта ишемического прекондиционирования приобретает первостепенное значение при подготовке больного ИБС к хирургическому вмешательству (чрескожные коронарные вмешательства, аортокоронарное шунтирование), а также при лечении нестабильной стенокардии.
В клинических исследованиях с применением никорандила установлена его эффективность в терапии ИБС и выявлен ряд преимуществ перед традиционно используемыми антиангинальными средствами.
В исследование IONA (Impact Of Nicorandil in Angina) было включено 5126 пациентов, страдающих СС (мужчины 45 лет и старше, женщины 55 лет и старше), с высоким риском развития неблагоприятных событий [11]. В качестве базисной терапии ИБС пациенты получали нитраты, пролонгированные антагонисты кальция, b-блокаторы, антиагреганты, статины; в дополнение к этой терапии им назначался никорандил в дозе 10 мг 2 раза в сутки (n = 2565) или плацебо (n = 2561). Спустя 2 нед после начала терапии никорандилом его дозировку повышали до 20 мг 2 раза в сутки. Длительность наблюдения составила 1-3 года (медиана 1,6 года). Первичная конечная точка исследования определялась как совокупность смерти от ИБС, нефатального инфаркта миокарда и внеплановой госпитализации, обусловленной стенокардитическими болями [12].
Терапия никорандилом привела к статистически значимому снижению частоты событий первичной конечной точки в сравнении с показателем группы плацебо (13,1 и 15,5% соответственно, отношение рисков (ОР) 0,83, р = 0,014). Относительное снижение риска составило 17%. Острый коронарный синдром (смерть от ИБС, нефатальный инфаркт миокарда или нестабильная стенокардия) развился у 6,1% пациентов группы никорандила и у 7,5% пациентов группы плацебо (p = 0,028, ОР 0,79). Суммарная частота кардиоваскулярных событий в группе никорандила была значимо ниже, чем в группе плацебо (14,7 и 17,0% соответственно, p = 0,027). При включении в первичную конечную точку смерти от всех причин, а не только от ИБС, преимущества никорандила перед плацебо сохранялись (14,9 и 17,3% соответственно, p = 0,021, ОР 0,85). Анализ событий вторичной конечной точки (совокупность смерти от ИБС и нефатального инфаркта миокарда) не показал различий между группами никорандила и плацебо. Кроме того, пациенты были разделены на подгруппы в зависимости от пола, возраста, статуса курения, ранее принимаемых антиангинальных препаратов и их количества, наличия сахарного диабета, артериальной гипертензии, инфаркта миокарда и коронарной реваскуляризации в анамнезе. При анализе частоты событий первичной конечной точки в этих подгруппах было выявлено, что никорандил сохраняет эффективность вне зависимости от перечисленных факторов.
Таким образом, в исследовании IONA была убедительно продемонстрирована эффективность никорандила в улучшении прогноза ИБС. Следует отметить, что в исследованиях со схожим дизайном, в которых изучалось влияние на прогноз ИБС пролонгированных антагонистов кальция (ACTION) и ивабрадина (BEAUTIFUL), не было выявлено влияния этих препаратов на частоту событий первичной конечной точки при добавлении к терапии ИБС [13, 14]. Можно сказать, что IONA - первое исследование, в котором была продемонстрирована эффективность антиангинального препарата в отношении прогноза ИБС.
Влияние никорандила на частоту неблагоприятных событий у пациентов с ИБС оценивалось и в японском исследовании JCAD (Japanese Coronary Artery Disease) [15]. Это исследование выполнялось по методу случай-контроль, критерием включения в него являлся органический стеноз крупных коронарных артерий не менее 75%. Из 13812 пациентов с ИБС было отобрано 2558 пациентов, ранее принимавших никорандил, в группу контроля вошло такое же число лиц, не получавших данный препарат. Пациенты исследованных групп не различались по тяжести ИБС. Первичная конечная точка определялась как смерть от любой причины, вторичными конечными точками были кардиальная смерть, фатальный и нефатальный инфаркт миокарда, церебральная и сосудистая смерть, смерть от других причин, все события, кардиальные события, застойная сердечная недостаточность, внебольничная остановка дыхания и кровообращения. Среднесуточная дозировка никорандила составила 15 ± 5 мг, средняя длительность наблюдения - 2,7 года.
Важно упомянуть, что в рамках исследования JCAD оценивалась эффективность никорандила в подгруппе пациентов, получавших пероральные сахароснижающие препараты из группы сульфонилмочевины (глибенкламид, гликлазид, глимепирид). Эти лекарственные средства блокируют АТФ-зависимые калиевые каналы, в связи с чем потенциально способны нивелировать эффекты никорандила, обусловленные активацией калиевых каналов (кардиопротективный и артериолодилатирующий). В исследовании IONA подобный анализ не проводился, так как прием производных сульфонилмочевины являлся одним из критериев исключения, в то время как в исследовании JCAD эти лекарственные средства получали 29% пациентов с сахарным диабетом. Частота общей смертности среди пациентов, получавших производные сульфонилмочевины, имела тенденцию к снижению в группе никорандила, хотя и не достигала статистической достоверности (p = 0,0719), т.е. прием производных сульфонилмочевины не ухудшал эффективность никорандила. Данный факт можно объяснить тем, что никорандил и производные сульфонилмочевины имеют сродство к различным типам калиевых каналов [16, 17].
Антиаритмический эффект никорандила заслуживает отдельного внимания. В теории активация калиевых каналов укорачивает потенциал действия и эффективный рефрактерный период, тем самым повышая вероятность возникновения аритмий [19]. Однако на практике была продемонстрирована способность никорандила снижать частоту развития аритмий, что также связано с моделированием феномена ишемического прекондиционирования [20].
S. Kasama et al. оценивали эффективность длительной терапии никорандилом у пациентов с первым инфарктом миокарда [24]. В исследование было включено 52 пациента, никорандил вводился болюсно в дозе 4 мг сразу после подтверждения диагноза инфаркта миокарда. Всем больным выполнялось чрескожное коронарное вмешательство, затем проводилась внутривенная инфузия никорандила длительностью не менее 48 ч. После выписки 26 пациентов продолжили прием никорандила в дозе 15 мг/сут, остальные 26 получали плацебо. Спустя 3 нед и 6 мес после чрескожного коронарного вмешательства всем пациентам выполнялась сцинтиграфия, по результатам которой в группе никорандила отмечалось значимое улучшение ряда параметров, отражающих активность симпатических нервов сердца и ремоделирование левого желудочка (ЛЖ) (суммарный показатель дефекта, отношение сердце/средостение и др.). Полученные данные позволили сделать заключение, что длительный прием никорандила предпочтительнее короткого курса терапии у лиц с инфарктом миокарда, перенесших чрескожное коронарное вмешательство.
K. Iwakura et al. выполнили метаанализ, посвященный оценке эффективности никорандила у пациентов с острым инфарктом миокарда [25]. Было проанализировано 17 рандомизированных исследований (15 проспективных и 2 ретроспективных), выполненных в период с 1998 по 2007 г Суммарное число обследованных пациентов составило 1982, никорандил назначался внутривенно или интракоронарно перед выполнением коронарной реперфузии либо в момент ее проведения. Длительность введения никорандила в различных исследованиях варьировала от 3 до 72 ч, дозировка составляла 1-12 мг при болюсном введении и 2-8 мг/ч при инфузионной терапии.
Данные предположения получили подтверждение в более позднем исследовании Y. Sakata et al., которые проанализировали влияние перорального приема никорандила на жесткие конечные точки у пациентов, перенесших инфаркт миокарда [26]. В исследование было включено 1846 пациентов, госпитализированных в течение 24 ч с момента развития инфаркта миокарда, перенесших чрескожное коронарное вмешательство и выписанных из стационара. После выписки 535 из них получали никорандил, 1311 - не получали (контрольная группа). Применение никорандила существенно уменьшило общую смертность: в группе приема препарата она была на 43% ниже, чем в контрольной группе (2,4 и 4,2% соответственно, р = 0,0358).
Никорандил продемонстрировал эффективность и при острой сердечной недостаточности [27]. Из 402 пациентов, доставленных в стационар по поводу этого клинического состояния, 78 получали никорандил, 324 составили группу контроля. Препарат назначался болюсно в дозе 0,1-0,2 мг/кг, затем в виде непрерывной инфузии на срок не менее 3 сут (средняя длительность введения 4,4 ± 1,2 сут). Уже спустя 30 дней наблюдения частота летальных исходов и повторных госпитализаций по поводу сердечной недостаточности оказалась значимо более низкой в группе никорандила (2,6 и 10,8% соответственно, р = 0,0238), это преимущество никорандила сохранялось и по прошествии 6 мес наблюдения (9,0 и 23,2% соответственно, р = 0,0053). Внутривенное введение никорандила было одним из значимых прогностических факторов, определяющих частоту смертности и повторных госпитализаций по поводу сердечной недостаточности, наряду с такими факторами, как возраст, систолическое артериальное давление, уровень креатинина, III-IV функциональный класс (ФК) ХСН по NYHA. Бессобытийная выживаемость в группе никорандила была значимо выше, чем в группе контроля (р = 0,006).
В ряде исследований был выявлен ангиопротективный эффект никорандила. M. Sekiya et al. продемонстрировали, что применение никорандила у больных ИБС препятствует увеличению толщины комплекса интимамедиа и улучшает потокзависимую дилатацию плечевой артерии, в то время как изосорбида динитрат не обладает подобными эффектами [28]. У пациентов, не страдающих ИБС, но имеющих факторы риска развития сердечно-сосудистых заболеваний, никорандил также улучшал потокзависимую дилатацию плечевой артерии; кроме того, его применение привело к значимому снижению концентрации маркеров атеросклероза (модифицированных малондиальдегидом липопротеидов низкой плотности и высокочувствительного С-реактивного белка) [29]. Имеются данные о том, что никорандил стимулирует фибринолиз у больных ИБС за счет снижения концентрации ингибитора тканевого активатора плазминогена I типа [30]. Таким образом, применение никорандила может снижать риск коронарного тромбоза у пациентов с ИБС, что является еще одним механизмом улучшения прогноза заболевания.
Отметим также отечественные исследования никорандила. Ж.М. Сизова и соавт. изучали антиангинальную эффективность и безопасность никорандила у пациентов, страдающих СС ФК [31]. В исследовании приняли участие 30 больных ИБС. В течение первых 2 нед все пациенты получали в качестве базисной терапии амлодипин в дозе 10 мг 1 раз в сутки и использовали никорандил только для купирования приступов стенокардии. На втором этапе исследования 15 пациентов продолжили прием амлодипина, остальные 15 были переведены на терапию никорандилом в дозе 20 мг 3 раза в сутки. Оценка эффективности препаратов проводилась через 4 и 12 нед лечения. В обеих группах в эти сроки отмечалось статистически значимое снижение частоты приступов стенокардии. В то же время длительность приступов стенокардии в группе никорандила значимо снизилась уже к концу 4-й недели, тогда как в группе амлодипина она достоверно уменьшилась только к 12-й неделе. Сходная динамика была отмечена и при анализе толерантности к физической нагрузке: в группе никорандила она повысилась уже через 4 нед терапии, а в группе амлодипина - лишь спустя 12 нед. В обеих группах отмечалось уменьшение количества эпизодов ишемии миокарда и улучшение показателей вопросника общего здоровья. В исследовании оценивалась и переносимость никорандила, которая была хорошей у большинства пациентов (80%); побочные эффекты в виде тошноты, головной боли, головокружения развились лишь у 3 пациентов и не потребовали отмены препарата. Было продемонстрировано, что никорандил эффективен как для купирования приступов стенокардии, так и в качестве средства базисной терапии ИБС.
Л.Ю. Бадриддинова и соавт. обследовали 50 больных со стабильной стенокардией напряжения III ФК [32]. В дополнение к стандартной антиангинальной терапии пациентам назначался никорандил в дозе 20 мг 2 раза в сутки либо амлодипин в дозе 10 мг 1 раз в сутки, длительность наблюдения составила 3 мес. Применение никорандила на 24,6% снизило частоту приступов стенокардии, на 24,6% повысило пороговую мощность физической нагрузки, уменьшило частоту и продолжительность эпизодов ишемии, а также величину максимальной депрессии сегмента ST по данным холтеровского мониторирования ЭКГ.
В большинстве исследований с применением никорандила, продолжавшихся в течение 3 лет и более, отмечалась его хорошая переносимость [33, 34]. В обзоре 20 проспективных контролируемых исследований выявлено, что число побочных эффектов на фоне приема никорандила сравнимо с таковым при терапии нитратами, b-блокаторами, антагонистами кальция, однако никорандил в отличие от антагонистов кальция не влияет на уровень артериального давления и частоту сердечных сокращений [35]. Наиболее частые побочные эффекты никорандила - головная боль (3,5-9,5%) и головокружение (0,65%) [33, 36]. Для снижения вероятности развития нежелательных явлений целесообразно начинать терапию низкими дозами никорандила с последующим титрованием под контролем переносимости препарата [37].
Никорандил продемонстрировал высокую эффективность и при нестабильных состояниях (нестабильная стенокардия, в том числе вариантная, острый инфаркт миокарда, острая сердечная недостаточность). Назначение препарата до и после кардиохирургических манипуляций облегчает течение послеоперационного периода и улучшает прогноз заболевания. С недавних пор в Японии никорандил применяется не только для лечения СС, но и в терапии острой сердечной недостаточности, в том числе острой декомпенсации ХСН [40]. Стоит ожидать, что дальнейшие исследования никорандила позволят существенно расширить список показаний к его применению и в нашей стране.
Список литературы
Калиевые каналы клеток проводящей системы сердца и рабочего миокарда: структурно-функциональные особенности, патофизиологическое и клиническое значение
Важнейшую роль в процессах реполяризации сердца играют калиевые каналы, генерирующие различные токи. Замедление реполяризации посредством блокирования калиевых каналов приводит к увеличению продолжительности рефрактерных периодов возбудимых тканей сердца и является основным механизмом действия антиаритмических препаратов III класса. При этом излишнее неравномерное замедление реполяризации может способствовать электрической неоднородности тканей и развитию опасных для жизни аритмий (полиморфной желудочковой тахикардии типа torsade de pointes). В обзоре представлены сведения о структуре, функции и свойствах калиевых каналов клеток проводящей системы сердца и сократительного миокарда. Освещены их физиологическая роль и участие в патологических процессах, в том числе при врожденных синдромах, связанных с возникновением опасных для жизни аритмий. Представлены дальнейшие перспективы развития данного направления.
Ритмичную работу сердца обеспечивает взаимосвязь последовательных процессов сокращения и расслабления, которые напрямую сопряжены с генерацией и распространением возбуждения и последующей рефрактерностью возбудимых тканей. Распространение потенциала действия (ПД) по проводящей системе и сократительному миокарду вызывает последовательное сокращение всех отделов сердца [1].
ПД имеет фазы — деполяризации и реполяризации. В фазу деполяризации мембранный потенциал достигает максимального значения, а во время фаз реполяризации происходит его постепенный возврат к уровню потенциала покоя. Именно в это время реализуется электромеханическое сопряжение, необходимое для сокращения миокарда, вот почему совокупная длительность фаз реполяризации должна быть достаточно продолжительной.
Важнейшую роль в процессах реполяризации и поддержании потенциала покоя на постоянном уровне играют токи ионов калия. Удлинение реполяризации увеличивает рефрактерность возбудимой ткани. На этом основано антиаритмическое действие препаратов III класса (блокаторов калиевых каналов). В то же время неравномерное замедление реполяризации может способствовать электрической неоднородности тканей и развитию опасных для жизни аритмий (полиморфной желудочковой тахикардии типа torsade de pointes — TdP) [2, 3].
В зависимости от способа активации и количества трансмембранных доменов, калиевые каналы подразделяют следующим образом:
- потенциалзависимые калиевые каналы (voltage gated — Kv);
- калиевые каналы аномального входящего выпрямления (inward rectifier Kir);
- механочувствительные двупоровые калиевые каналы (2 pore domain — K2P);
- активируемые кальцием калиевые каналы (calcium-activated — KCa; в данном обзоре не рассмотрены, поскольку функционально-активные KCa не представлены на поверхности кардиомиоцитов человека и не участвуют в процессах деполяризации и реполяризации) [4].
Потенциалзависимые калиевые каналы (Kv)
Kv — самое многочисленное семейство калиевых каналов. Все Kv состоят из четырех α-субъединиц. Тетрамеры могут быть образованы четырьмя одинаковыми α-субъединицами (гомотетрамеры) или состоять из четырех разных α-субъединиц (гетеротетрамеры). На работу тетрамеров α-субъединиц существенное влияние могут оказывать вспомогательные β-, γи D-субъединицы, расположенные в цитоплазме клеток и изменяющие кинетику канала. Некоторые белки способны повышать экспрессию калиевых каналов на мембранах и изменять функции их α-субъединиц. Точное определение канала, обеспечивающего тот или иной ионный ток в кардиомиоцитах, всегда крайне затруднено [5].
В зависимости от своих временны'х параметров и вольтажных характеристик Kv могут быть разделены на 2 большие группы.
- Каналы, генерирующие кратковременный выходящий ток (transient outward — Ito), регистрируемый в самом начале реполяризации.
- Каналы, генерирующие токи замедленного выпрямления (IK).
В зависимости от времени нарастания и продолжительности выделяют очень быстрые (ultra rapid — IKur), быстрые (rapid — IKr) и медленные (slow — IKs) токи замедленного выпрямления. Калиевые токи замедленного выпрямления присутствуют в течение всех фаз реполяризации, наибольший их вклад приходится на более поздние ее этапы [6].
Калиевые каналы, генерирующие кратковременный выходящий ток (Ito). Ito регистрируется в самом начале реполяризации (фаза 1 ПД) в течение непродолжительного времени. Он оказывает существенное влияние на ток ионов кальция (ICa,L) и, соответственно, на электромеханическое сопряжение и сократимость миокарда, а также на калиевые токи замедленного выпрямления. В результате сложных взаимодействий между ионными токами изменения Ito могут непредсказуемо влиять на продолжительность ПД и определять предрасположенность к возникновению аритмий [7].
При детальном исследовании биофизических характеристик тока Ito было отмечено, что он состоит из двух компонентов, различающихся по скорости восстановления соответствующих им ионных каналов, — быстрого (fast — Ito,f) и медленного (slow — Ito,s). Эти токи тканеспецифичны. Ito,f в миокарде желудочков обнаруживают преимущественно в субэпикардиальных отделах, он соответствует фазе начальной быстрой реполяризации и определяет характерную форму кривой ПД (спайк и плато — spike and dome). В правом желудочке ток Ito,f выражен сильнее, чем в левом [8].
Каналы, генерирующие ток Ito, являются гомотетрамерами. В сердце человека в образовании каналов Ito,s участвуют α-субъединицы Kv1.4, а каналы Ito,f формируют α-субъединицы Kv4.2 и Kv4.3 [9].
Экспрессию каналов Ito и их активность регулируют добавочные субъединицы, к которым относят β-субъединицы, KChIP (Kv channel interacting proteins — белок, взаимодействующий с потенциалзависимыми калиевыми каналами), фриквенин (frequenin), KChAP (Kv channel associated protein — белок, связанный с потенциалзависимыми калиевыми каналами), а также вспомогательные субъединицы MinK (Minimum K+) и MiRP (MinK related peptides — пептиды, подобные MinK) [10].
Калиевый канал in silico
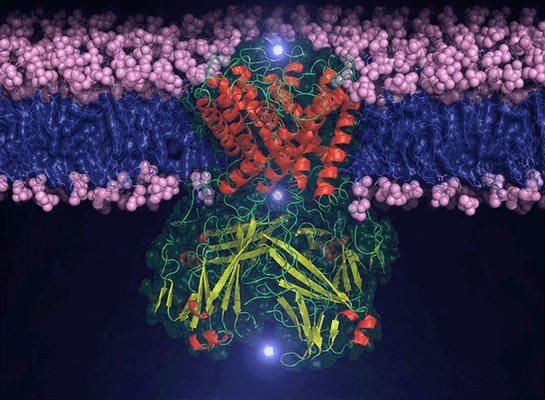
Новость
изображение одного из бактериальных K+-каналов: Tim Nugent
Автор
Редакторы
Несмотря на то, что за несколько десятилетий существования метода моделирования молекулярной динамики (МД) сущность подхода практически не поменялась, совершенствование алгоритмов и взрывное развитие компьютерных мощностей позволяет достигать все новых рубежей. Американские исследователи провели моделирование МД потенциал-чувствительного калиевого канала, в результате чего удалось в деталях проследить процесс активации / инактивации этого белка, «рассмотрев» подробности, ранее известные лишь гипотетически.
В основе работы возбудимых тканей — а это не только нервы, но и мышцы, и железы, — лежат ионные каналы, встроенные в плазматическую мембрану клетки и способные в ответ на определенные воздействия открываться и, наоборот, закрываться, пропуская определенные ионы или блокируя их проход. Живые клетки всегда имеют трансмембранный (ТМ) электростатический потенциал [1], лежащий в основе массы жизненно-важных процессов — от синтеза АТФ и рецепции до проведения нервного импульса. «За открытия, касающиеся ионных механизмов, участвующих в возбуждении и торможении <. >нервной клетки», британские физиологи Алан Ходжкин и Андре Хаксли получили в 1963 году Нобелевскую премию по физиологии и медицине. Однако молекулярные механизмы открытой ими потенциал-зависимой регуляции проницаемости мембраны для ионов оставались покрытыми мраком до 1980-х, когда появились современные подходы к изучению мембранных белков, а именно — ионных каналов.
Потенциал действия в возбудимой клетке начинается с открывания Na + -каналов, реагирующих на деполяризацию — уменьшение ТМ-потенциала, равного в покоящейся клетке примерно −70 мВ (цитоплазматическая сторона мембраны заряжена отрицательно по отношению к внеклеточной). Возникающий в связи с входящим в клетку «натриевым током» скачок потенциала открывает K + -каналы, и ионы калия устремляются изнутри клетки наружу. Позже нарушенный баланс K + и Na + будет восстановлен за счет действия Na + /K + -насоса, но главное уже произошло — потенциал действия «побежал» по мембране возбудимой клетки.
И Na + -, и K + -каналы здесь — потенциал-чувствительные, то есть они открываются и закрываются, реагируя на электрическое поле, причем в покое (когда потенциал ≈−70 мВ) они закрыты, а открываются они при деполяризации, когда ТМ-напряжение исчезает. Удивительная способность чувствовать такую «не биологическую» характеристику, как разность потенциалов, у всех потенциал-чувствительных каналов (и натриевых, и калиевых, и кальциевых) определяется наличием потенциал-чувствительного домена (ПЧД), четвертый ТМ-сегмент (S4) которого несет большой положительный заряд, а значит, может служить сенсором потенциала. Такие ионные каналы образуются из четырех субъединиц, в каждой из которой есть поровый домен (ПД) и ПЧД, «закрученные» вокруг общей оси, подобно лепесткам диафрагмы .
Подробнее строение потенциал-чувствительного канала мы уже разбирали в статье «О чем не знал Гальвани: пространственная структура натриевого канала» [2]
Структурная биология уже более 15 лет назад расшифровала строение K + -канала: сначала «обычного», потом и потенциал-чувствительного. (На самом деле, у человека более 40 типов разных K + -каналов, так что разнообразие не ограничивается двумя названными типами ;-) Однако особенность приготовления образцов для рентгеноструктурного анализа или спектроскопии ядерного магнитного резонанса (основных методов определения строения биомолекул) такова, что в эксперименте невозможно сохранить ТМ-потенциал, и все структуры каналов из-за этого получаются «открытыми» (то есть, активированными). До сих пор неизвестно строение неактивного (закрытого) канала, а значит и подробности цикла активации / инактивации неизвестны тоже.
Выход из сложившегося положения предлагает группа американских биофизиков во главе с Дэвидом Шоу (David Shaw), заслужившим себе репутацию на мировом финансовом рынке, а потом неожиданно «переквалифицировавшимся» в компьютерную молекулярную биологию и уже потрясшим мир преодолением «миллисекундного барьера» [3] в моделировании молекулярной динамики биомолекул [4].
На этот раз ученые не ставили задачи смоделировать процесс сворачивания белка (фолдинг); вместо этого они решили исследовать работу потенциал-чувствительного K + -канала в ответ на приложение внешней разности потенциалов: как он открывается, закрывается и проводит ионы [5]. Фактически, исследователи используют созданный ими специализированный суперкомпьютер для МД «Anton» в качестве микроскопа: без особенных хитростей запустив МД, наблюдают за тем, что произойдет. Подобную работу ни за что бы не опубликовали в одном из самых известных журналов — Science, — если бы не то обстоятельство, что длительность рассчитанных траекторий (сотни микросекунд) на порядки превосходит то, что можно посчитать на «обычных» суперкомпьютерах для довольно сложной системы, содержащей тетрамерный ионный канал, мембрану, воду и ионы. (Обычно для таких систем больше 1-10 мкс посчитать не удается.) Ну и конечно, рецензентов работы не мог не подкупить тот факт, что полученная в результате моделирования картина в целом согласуется с уже известным механизмом активации / инактивации канала, но показывает его в невиданных ранее подробностях.
В работе было проведено более двух десятков расчетов МД структуры K + -канала («химера Kv2,1/Kv1,2»), помещенной в липидный бислой в ячейке с водой с растворенным в ней KCl (0,5 М). Часть траекторий была получена в «деполяризованном» (V > 0 мВ), а часть — в «гиперполяризованном» (V < 0 мВ) состоянии. В условиях гиперполяризации мембраны канал из первоначально «открытого» состояния переходил в «закрытую» форму, не способную пропускать ионы K + и воду (рис. 1а). Наиболее сильные изменения в структуре канала происходили, как и ожидалось, в области потенциал-чувствительного домена: вольт-сенсорная α-спираль S4, в открытом состоянии «выдвинутая» наружу (во внеклеточную область), при появлении напряжения «ввинчивалась» в ПЧД, что сопровождается переносом заряженных групп (остатков аргинина и лизина) «вниз», с образованием временных солевых мостиков с противоположно заряженными группировками сегментов S1 и S2 ПЧД (рис. 1б). Такой механизм активации / инактивации предполагали и ранее, на основании многочисленных биохимических и биофизических экспериментов. Однако в таких подробностях ранее проследить за процессом не было никакой возможности (видео 1).
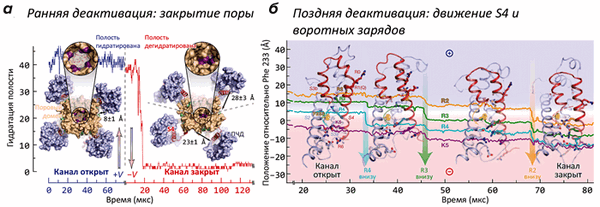
Рисунок 1. Движения потенциал-чувствительного домена (ПЧД) при активации K + -канала. а — Вид модели канала с внутриклеточной стороны в активированном (+V) и покоящемся (−V) состояниях. Канал представляет собой тетрамер: находящийся в центре поровый домен окружен четырьмя ПЧД. Геометрическое закрывание поры (показано на увеличенных врезках) подтверждается кривой гидратации, показывающей количество молекул воды, находящихся в «вестибюле» канала. При «включении» потенциала (через ≈20 мкс) растворитель и ионы K + покидают канал, и пора «захлопывается» под действием гидрофобного коллапса. Интересно, что в открытом канале ПЧД «прижаты» к поре, в то время как в закрытом — расположены более свободно. б — Постепенное «вдвигание» вольт-сенсора S4 и находящихся в нем «воротных зарядов» в ПЧД при «включении» потенциала (т.е., в процессе закрывания канала). В частности, в процессе инактивации заряд R2 переносится на 15 Å «вниз», что в общих чертах описывает основную структурную перестройку, сопровождающую инактивацию канала. Попутно с «нырянием» в ПЧД, сегмент S4 совершает поворот на ≈120°.
Видео 1. Визуализация инактивации K + -канала при реполяризации мембраны. Канал показан «сбоку», мембрана и две субъединицы из четырех для ясности скрыты. В начале траектории можно видеть проникающие через пору ионы K + и показанную синей поверхностью гидратированную полость канала; при закрывании канала эти события пропадают.
В моделировании был показан гипотетический до того переход из состояния канала, когда все вольт-сенсоры S4 уже выдвинуты деполяризацией (снятием напряжения) «вверх», но сама пора пока еще остается закрытой, в «полностью открытое» состояние. Показана и роль «линкера», соединяющего конец S4 с двумя ТМ-спиралями S5 и S6, образующими пору: этот линкер передает механическое движение переноса S4 вверх / вниз, что приводит к открыванию и закрыванию поры. На основе проделанного моделирования исследователи предложили схему функционирования потенциал-чувствительного K + -канала (рис. 2).
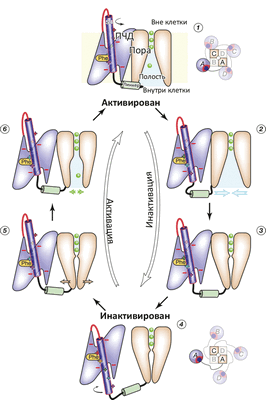
Рисунок 2. Схема работы потенциал-чувствительного K + -канала. (1) Реполяризация (восстановление ТМ-потенциала покоя −70 мВ) приводит к «вдвиганию» вольт-сенсора S4 в ПЧД, что приводит к (2) дегидратации полости канала и «гидрофобному коллапсу» (закрытию поры) (3). При окончании «вдвигания» S4 (4) линкер S4—S5 становится максимально длинным, что позволяет ПЧД «отсоединиться» от поры. При деполяризации (5) (например, при входящем Na + -токе) α-спираль S4 опять выдвигается, ПЧД плотно присоединяется к поре, которая вследствие этого открывается (6). Цикл замкнулся.
Отдельный акцент сделан на практическом применении таких «тяжелых» расчетов: кроме использования компьютера в качестве микроскопа, можно исследовать механизм возникновения так называемых каналопатий — таких заболеваний как аритмия, мигрени, параличи, болевые синдромы, которые связаны с нарушением работы ионных каналов. В частности, мутации в ПЧД (тех самых положительно заряженных остатков аргинина / лизина в S4) приводят к тому, что ПЧД начинает «подтекать» и пропускать через себя так называемые Ω-токи. В ряде дополнительных расчетов исследователи обнаружили и этот феномен, продемонстрировав механизм «протечки».
С одной стороны, Шоу и коллеги не открыли ничего особо нового — схема работы канала, предложенная на рис. 2, в общих чертах была известна и ранее. Однако, пожалуй, самое важное, что следует из их работы, — это то, что увеличение длительности расчетов МД позволяет узнать о биологических системах что-то новое, что само по себе отнюдь не очевидно (такие сложные конформационные явления могли и не произойти вовсе, несмотря на «игру» с потенциалом). Так что истинная причина, по которой чисто «расчетную» работу опубликовали в Science, заключается в том, что возможности методов молекулярного моделирования, часто подвергающиеся (вполне справедливой) критике, все же больше, чем полагали скептики.
Калиевые каналы
Общие моменты о калиевых каналах. Калиевые (К + ) каналы — суперсемейство интегральных мембранных белков, обеспечивающих селективный пассивный транспорт ионов К+ через клеточную мембрану. К-каналы встречаются у всех живых организмов — от бактерий до человека. Вместе с Na- и Са-каналами, К-каналы образуют семейство белков, которые по своему количеству уступают лишь семейству рецепторов, сопряженных с G-белком, и семейству протеинкиназ, т. е. являются третьей по величине группой белков человека, участвующих в передаче сигналов. Около 13 % лекарственных препаратов, используемых в настоящее время, воздействуют на ионные каналы. Ионные каналы занимают второе место в списке наиболее распространенных фармакологических мишеней после G-белок-сопряженных рецепторов.
Основные функции К-каналов состоят в поддержании мембранного потенциала (покоя), а также в формировании потенциала действия (ПД) в электровозбудимых клетках. Они обеспечивают синаптическую передачу, клеточную миграцию, клеточную коммуникацию, процессы пролиферации, ангиогенеза, процессы апоптоза, иммунный ответ, а также участвуют в реализации гуморальной регуляции деятельности внутренних органов. К-каналы являются самым крупным суперсемейством среди ионных каналов, поэтому они рассматриваются как одна из перспективных фармакологических мишеней.
Классификация К-каналов. Все калиевые каналы содержат альфа-субъединицу, которая кодируется разными генами и поэтому по своему строению имеет определенные особенности. Кроме альфа-субъединицы в составе канала могут быть регуляторные белки типа бета-субъединицы, либо кальмодулин, или сульфонилмочевин- ные рецепторы (sulfonyl urea receptor, SUR).
С позиций функции и строения альфа-субъединиц все К-каналы млекопитающих принято делить на классы. А. И. Кузьменков и со- авт. (2015) сообщают, что по классификации Международного союза фундаментальной и клинической фармакологии (IUPHAR) выделяется 5 классов К-каналов. Внутри каждого класса, имеющего свое буквенно-цифровое обозначение, есть изоформы, число которых зависит от класса канала.
1. К-каналы входящего выпрямления (Kir; не менее 14 изоформ, 15 генов) представляют собой гомо- и гетеротетрамеры, каждая субъединица которых состоит из двух трансмембранных (Тм) сегментов с поровым участком (Р) между ними. Работа этих каналов модулируется нуклеотидами (АТФ, АДФ), фосфорилированием, G-белками и фосфатидилинозитол-4,5-бисфосфатом. У человека Kir- каналы кодируются 15 различными генами.
- 2. К-каналы, имеющие два поровых участка (К2Р); или каналы утечки, или двупоровые калиевые каналы (не менее 12 изоформ, 15 генов). Они построены из четырех трансмембранных сегментов, а при формировании канала альфа-субъединицы димеризуются. Эти каналы регулируются широким спектром факторов: pH, температурой, натяжением клеточной мембраны. У человека обнаружено 15 генов К2Р каналов.
- 3. Потенциал-зависимые, или потенциал-чувствительные, К-каналы (Kv). Они имеют не менее 30 изоформ, кодируются 40 генами). Их альфа-субъединицы состоят из шести трансмембранных (Тм) сегментов (S1 — S6). Они имеют один поровый участок (Р), который расположен между S5 и S6. Зрелый канал представляет собой тетрамер альфа-субъединиц. В состав канала входит потенциал-чув- ствительный домен, состоящий из четырех трансмембранных сегментов (S1 — S4). Сегмент S4 содержит регулярно расположенные положительно заряженные аминокислотные остатки и выполняет роль сенсора потенциала. Это самая обширная группа К-каналов. У человека обнаружено 40 генов этого канала.
- 4. Са 2+ -активируемые К-каналы малой (SKCa) и средней (IKca) проводимости (не менее 4 изоформ, 4 гена). Они построены из субъединиц, имеющих шесть трансмембранных (Тм) сегментов с поровым участком между S5 и S6, как и в случае Kv каналов. Однако, сегмент S4 в этом случае нечувствителен к изменению потенциала. Активация ионами Са 2 + является кальмодулин-опосредо- ванной. У человека семейство этих каналов кодируются 4 генами. Первый когда-либо описанный Са 2+ -активированный калиевый канал — это так называемый Гардош-канал, который был открыт в 1950-х гг. в эритроцитах человека. Он получил символ «Канал 1К». «I» обозначает промежуточную проводимость, которая отличает IK- каналы от Са-активированных К-каналов малой (SK) или большой (ВК) проводимости. Ген IK человека — KCNN4.
- 5. Са 2+ -активируемые К-каналы большой проводимости (ВКСа; или Maxi-каналы; или SLO-1) не менее 4 изоформ, которые кодируются четырьмя slo-генами (Kcnmal), т. е. генами, которые кодируют белки, находящиеся в волосковых клетках кортиевого органа, участвующие в восприятии звуков. Содержат не 6, а 7 трансмембранных (Тм) сегментов. Особенность этих каналов состоит в том, что они могут быть активированы изменением потенциала и некоторыми ионами (в зависимости от изоформы канала активаторами могут выступать Са 2+ , Na + , СП).
Существуют и другие варианты классификации калиевых каналов.
В данном разделе, посвященном калиевым каналам, последовательность изложения материала изменена с методической точки зрения, т. е. для облегчения восприятия материала. Кроме того, каналы, указанные в классификации (IUPHAR) в разделах 4 и 5,
мы объединили в один раздел как Са-зависимые каналы (ВК-, IK- и SK-). Поэтому последовательность изложения сведений о калиевых каналах будет такой:
- 1) потенциал-чувствительные калиевые каналы (Kv);
- 2) калиевые каналы входящего выпрямления (Kir);
- 3) К-каналы, имеющие два поровых участка, или каналы утечки
- (Кар);
- 4) Са-регулируемые калиевые каналы, в том числе ВК-, IK- и SK- каналы.
Предваряя детальное рассмотрение сведений о каждом классе калиевых каналов, отметим ряд важных моментов.
- 1. У человека обнаружено 78—80 генов, кодирующих главные (альфа-) субъединицы калиевых каналов. Каналы SK, вероятно, кодируются тремя генами Kcnnl-З. Каналы IK кодируются генами Кспп4. ВК-каналы кодируются, скорее всего, генами Slo (Kcnmal).
- 2. Эволюционные аспекты. К-каналы появились приблизительно с момента зарождения жизни на земле, в пользу чего свидетельствует обнаружение более 200 каналоподобных белков у архей и бактерий, родственных К-каналам эукариот. В геноме инфузории Paramecium tetraurelia найдено 298 генов К-каналов, что в 3,8 раз больше, чем у человека.
- 3. По механизму действия все лиганды калиевых каналов делятся на поровые блокаторы и модуляторы. Поровые блокаторы «затыкают» пору канала, подобно пробке в бутылке, а модуляторы изменяют работу канала без непосредственного физического препятствования току ионов, за счет взаимодействия не с поровой частью канала, а другими его участками (например, с сенсорным доменом или со вспомогательной бета-субъединицей).
Первоначально было установлено, что ряд ионов блокирует калиевые каналы. Среди них ионы Sc 2+ , Ва 2+ , Cd 2+ , Pb 2+ , Со 2+ , Ni 2+ и другие ионы, действующие в миллимолярных концентрациях. Позже стало ясно, что ионы блокируют неселективно. Кроме того, было установлено, что блокаторами калиевых каналов являются небольшие органические молекулы, среди которых, прежде всего, те- траэтиламмоний (ТЭА) и 4-аминопиридин (4-АП), ингибирующие большинство К-каналов (в миллимолярных концентрациях) без воздействия на Na + - и Са 2+ -каналы. Для некоторых К-каналов, таких, как Kv3.1 или Kv4.1, не было найдено ни одного другого низкомолекулярного лиганда. В последующем были открыты и продолжают открываться другие органические молекулы, среди которых хини- дин, d-тубокурарин, верапамил, дилтиазем, местные анестетики и многие другие органические блокаторы.
Начиная с 1985 г., т. е. с момента открытия харибдотоксина (ChTX) — первого токсина из яда скорпиона, было установлено, что различные представители ядовитых животных содержат в своем яде токсины, которые являются пептидными блокаторами калиевых каналов, т. е. эти каналы являются для токсинов своеобразными рецепторами. В настоящее время известно порядка 400 полипептидных токсинов — лигандов калиевых каналов, выделенных из ядовитых животных. Среди них: дендротоксины из яда змей, 25 различных полипептидных токсинов из морских анемон, или актиний, выявлено большое число конотоксинов (конопептидов) — компонентов яда конусов (хищных морских моллюсков из семейства Conidae), основной мишенью которых являются Kv-каналы, а для отдельных конотоксинов — ВК^-каналы. Из яда пчел получены два коротких пептида апамин и тертиапин, состоящие из 18 и 21 аминокислотного остатка; апамин блокирует преимущественно БК^-каналы, а тертиапин блокирует ВК^-каналы и Kir-каналы. Получены токсины пауков, которые в основном блокируют Kv-каналы, в частности хана- токсин (HaTxl) блокирует Kv2.1, токсины HpTxl и PaTxl — блокируют Ку4-каналы, токсины от африканских тарантулов Stromatopelma calceata (ScTxl) и от Heteroscodra maculata (токсин HmTxl, HmTx2) блокируют Kv2 и Kv4. Но самое большое число (около 250) токсинов-блокаторов калиевых каналов найдено в яде скорпионов (КТх). Все они являются полипептидами, содержащими 20—75 аминокислотных остатков. Из них наиболее известны такие, как ноксиусток- син, влияющий на калиевый ток в гигантском аксоне кальмара, ха- рибдотоксин, или ChTX, полученный из яда желтого израильского скорпиона (.Leiurus quinquestriatus hebraeus), или скорпиона смерти (Deathstalker), ибериотоксин (IbTX), полученный из яда восточного индийского красного скорпиона (Buthus tamulus), маргатоксин, или MgTX, полученный из скорпиона Centruroides margaritatus, ка- лиотоксин, выделенный из яда скорпиона Androctonus mauretanicus mauretanicus, агитоксин-2, выделенный из яда скорпиона Leiurus quinquestriatus var. Hebraeus, BeKm-1-токсин из яда среднеазиатского скорпиона Buthus eupeus; OSK1 и 08К2-токсины из скорпиона Orthochirus scrobiculosus. Все они стали классическими «молекулярными инструментами» в области изучения К-каналов. Известные в настоящее время токсины скорпионов (КТх) действуют в основном на Kv и в меньшей степени на ВК^- и БК^-каналы. Среди токсинов скорпионов найдены молекулы, селективно воздействующие на отдельные изоформы Kv каналов (например, ВеКт-1 и OSK2) и BKqj (IbTX). В то же время блокаторов Kir-каналов и К2Р-каналов в яде скорпионов пока не удалось обнаружить.
Механизм, с помощью которого блокируются калиевые каналы под влиянием зоотоксинов, пока окончательно не ясен. В то же время признается, что важную роль в блокаде калиевых каналов играет остаток лизина в молекуле токсина.
Полипептидным блокаторам, т. е. зоотоксинам, принадлежит важная роль в изучении К-каналов, так как они использовались для
выделения каналов, а их радиоактивно-меченые и флуоресцентные аналоги используются для локализации К-каналов. Например, с помощью флуоресцентных меток методом проточной цитометрии удалось установить наличие К-каналов в клетках крови, в частности в Т-лимфоцитах. Ежегодно международная база данных последовательностей белков (UniProt) пополняется новыми полипептидными токсинами, активными в отношении калиевых каналов. Это свидетельствует о высоком интересе к этой научной области.
Помимо зоотоксинов как блокаторов калиевых каналов, для некоторых изоформ К-каналов были получены антитела, способные селективно блокировать ионный ток. Было также установлено, что альфа- и бета-дефензины, т. е. катионные пептиды, состоящие из 18—45 аминокислотных остатков, клеток иммунной системы (нейтрофилов, моноцитов) также способны модулировать калиевые каналы бактерий, грибков и многих вирусов, что ведет к их гибели. Так, человеческий бета-дефензин-2 (hBD2) селективно блокирует Kvl.3-канал. Это означает, что бета-дефензины человека являются новым классом канальных лигандов, которые могут существенно изменять функцию иммунных клеток.
Строение и функции мембраны, ионные каналы и их функции, ионные градиенты
Согласно современным представлениям, биологические мембраны образуют наружную оболочку всех животных клеток и формируют многочисленные внутриклеточные органеллы. Наиболее характерным структурным признаком является то, что мембраны всегда образуют замкнутые пространства, и такая микроструктурная организация мембран позволяет им выполнять важнейшие функции.
Строение и функции клеточных мембран.
1. Барьерная функция выражается в том, что мембрана при помощи соответствующих механизмов участвует в создании концентрационных градиентов, препятствуя свободной диффузии. При этом мембрана принимает участие в механизмах электрогенеза. К ним относятся механизмы создания потенциала покоя, генерация потенциала действия, механизмы распространения биоэлектрических импульсов по однородной и неоднородной возбудимым структурам.
2. Регуляторная функция клеточной мембраны заключается в тонкой регуляции внутриклеточного содержимого и внутриклеточных реакций за счет рецепции внеклеточных биологически активных веществ, что приводит к изменению активности ферментных систем мембраны и запуску механизмов вторичных «месенджеров» («посредников»).
3. Преобразование внешних стимулов неэлектрической природы в электрические сигналы (в рецепторах).
4. Высвобождение нейромедиаторов в синаптических окончаниях.
Современными методами электронной микроскопии была определена толщина клеточных мембран (6—12 нм). Химический анализ показал, что мембраны в основном состоят из липидов и белков, количество которых неодинаково у разных типов клеток. Сложность изучения молекулярных механизмов функционирования клеточных мембран обусловлена тем, что при выделении и очистке клеточных мембран нарушается их нормальное функционирование. В настоящее время можно говорить о нескольких видах моделей клеточной мембраны, среди которых наибольшее распространение получила жидкостно-мозаичная модель.
Согласно этой модели, мембрана представлена бислоем фосфолипидных молекул, ориентированных таким образом, что гидрофобные концы молекул находятся внутри бислоя, а гидрофильные направлены в водную фазу. Такая структура идеально подходит для образования раздела двух фаз: вне- и внутриклеточной.
В фосфолипидном бислое интегрированы глобулярные белки, полярные участки которых образуют гидрофильную поверхность в водной фазе. Эти интегрированные белки выполняют различные функции, в том числе рецепторную, ферментативную, образуют ионные каналы, являются мембранными насосами и переносчиками ионов и молекул.
Некоторые белковые молекулы свободно диффундируют в плоскости липидного слоя; в обычном состоянии части белковых молекул, выходящие по разные стороны клеточной мембраны, не изменяют своего положения.
Электрические характеристики мембран:
Емкостные свойства в основном определяются фосфолипидным бислоем, который непроницаем для гидратированных ионов и в то же время достаточно тонок (около 5 нм), чтобы обеспечивать эффективное разделение и накопление зарядов и электростатическое взаимодействие катионов и анионов. Кроме того, емкостные свойства клеточных мембран являются одной из причин, определяющих временные характеристики электрических процессов, протекающихщих на клеточных мембранах.
Проводимость (g) — величина, обратная электрическому сопротивлению и равная отношению величины общего трансмембранного тока для данного иона к величине, обусловившей его трансмембранной разности потенциалов.
Через фосфолипидный бислой могут диффундировать различные вещества, причем степень проницаемости (Р), т. е. способность клеточной мембраны пропускать эти вещества, зависит от разности концентраций диффундирующего вещества по обе стороны мембраны, его растворимости в липидах и свойств клеточной мембраны.
Проводимость мембраны является мерой ее ионной проницаемости. Увеличение проводимости свидетельствует об увеличении количества ионов, проходящих через мембрану.
Строение и функции ионных каналов. Ионы Na+, K+, Са2+, Сl- проникают внутрь клетки и выходят наружу через специальные, заполненные жидкостью каналы. Размер каналов довольно мал.
Все ионные каналы подразделяются на следующие группы:
a) Селективные, т.е. специфические. Эти каналы проницаемы для строго определенных ионов.
b) Малоселективные, неспецифические, не имеющие определенной ионной избирательности. Их в мембране небольшое количество.
a) быстроинактивирующиеся, т.е. быстро переходящие в закрытое состояние. Они обеспечивают быстро нарастающее снижение МП и такое же быстрое восстановление.
b) медленноинактирующиеся. Их открывание вызывает медленное снижение МП и медленное его восстановление.
4. По механизмам открывания:
a) потенциалзависимые, т.е. те которые открываются при определенном уровне потенциала мембраны.
b) хемозависимые, открывающиеся при воздействии на хеморецепторы мембраны клетки физиологически активных веществ (нейромедиаторов, гормонов и т. д).
В настоящее время установлено, что ионные каналы имеют следующее строение:
1.Селективный фильтр, расположенный в устье канала. Он обеспечивает прохождение через канал строго определенных ионов.
2.Активационные ворота, которые открываются при определенном уровне мембранного потенциала или действии соответствующего ФАВ. Активационные ворота потенциалзависимых каналов имеется сенсор, который открывает их на определенном уровне МП.
3.Инактивационные ворота, обеспечивающие закрывание канала и прекращение проведения ионов по каналу на определенном уровне МП.(Рис).
Неспецифические ионные каналы не имеют ворот.
Селективные ионные каналы могут находиться в трех состояниях, которые определяются положением активационных (м) и инактивационных (h) ворот:
1.Закрытом, когда активационные закрыты, а инактивационные открыты.
2.Активированном, и те и другие ворота открыты.
3.Инактивированном, активационные ворота открыты, а инактивационные закрыты
Функции ионных каналов:
1. Калиевый (в покое) - генерация потенциала покоя
2. Натриевый - генерация потенциала действия
3. Кальциевый - генерация медленных действий
4. Калиевый (задержанное выпрямление) - обеспечение реполяризации
5. Калиевый кальций-активируемый - ограничение деполяризации, обусловленной током Са+2
Функцию ионных каналов изучают различными способами. Наиболее распространенным является метод фиксации напряжения, или «voltage-clamp». Сущность метода заключается в том, что с помощью специальных электронных систем в процессе опыта изменяют и фиксируют на определенном уровне мембранный потенциал. При этом измеряют величину ионного тока, протекающего через мембрану. Если разность потенциалов постоянна, то в соответствии с законом Ома величина тока пропорциональна проводимости ионных каналов. В ответ на ступенчатую деполяризацию открываются те или иные каналы, соответствующие ионы входят в клетку по электрохимическому градиенту, т. е. возникает ионный ток, который деполяризует клетку. Это изменение регистрируется с помощью управляющего усилителя и через мембрану пропускается электрический ток, равный по величине, но противоположный по направлению мембранному ионному току. При этом трансмембранная разность потенциалов не изменяется.
Изучение функции отдельных каналов возможно методом локальной фиксации потенциала «path-clamp». Стеклянный микроэлектрод (микропипетка) заполняют солевым раствором, прижимают к поверхности мембраны и создают небольшое разрежение. При этом часть мембраны подсасывается к микроэлектроду. Если в зоне присасывания оказывается ионный канал, то регистрируют активность одиночного канала. Система раздражения и регистрации активности канала мало отличается от системы фиксации напряжения.
Ток через одиночный ионный канал имеет прямоугольную форму и одинаков по амплитуде для каналов различных типов. Длительность пребывания канала в открытом состоянии имеет вероятностный характер, но зависит от величины мембранного потенциала. Суммарный ионный ток определяется вероятностью нахождения в открытом состоянии в каждый конкретный период времени определенного числа каналов.
Наружная часть канала сравнительно доступна для изучения, исследование внутренней части представляет значительные трудности. П. Г. Костюком был разработан метод внутриклеточного диализа, который позволяет изучать функцию входных и выходных структур ионных каналов без применения микроэлектродов. Оказалось, что часть ионного канала, открытая во внеклеточное пространство, по своим функциональным свойствам отличается от части канала, обращенной во внутриклеточную среду.
Именно ионные каналы обеспечивают два важных свойства мембраны: селективность и проводимость.
Селективность, или избирательность, канала обеспечивается его особой белковой структурой. Большинство каналов являются электроуправляемыми, т. е. их способность проводить ионы зависит от величины мембранного потенциала. Канал неоднороден по своим функциональным характеристикам, особенно это касается белковых структур, находящихся у входа в канал и у его выхода (так называемые воротные механизмы).
Рассмотрим принцип работы ионных каналов на примере натриевого канала. Полагают, что в состоянии покоя натриевый канал закрыт. При деполяризации клеточной мембраны до определенного уровня происходит открытие m-активационных ворот (активация) и усиление поступления ионов Na+ внутрь клетки. Через несколько миллисекунд после открытия m-ворот происходит закрытие h-ворот, расположенных у выхода натриевых каналов (инактивация). Инактивация развивается в клеточной мембране очень быстро и степень инактивации зависит от величины и времени действия деполяризующего стимула.
При генерации одиночного потенциала действия в толстом нервном волокне изменение концентрации ионов Na+ во внутренней среде составляет всего 1/100000 от внутреннего содержания ионов Na гигантского аксона кальмара.
Кроме натриевых, в клеточных мембранах установлены другие виды каналов, избирательно проницаемых для отдельных ионов: К+, Са2+, причем существуют разновидности каналов для этих ионов.
Ходжкин и Хаксли сформулировали принцип «независимости» каналов, согласно которому потоки натрия и калия через мембрану независимы друг от друга.
Свойство проводимости различных каналов неодинаково. В частности, для калиевых каналов процесс инактивации, как для натриевых каналов, не существует. Имеются особые калиевые каналы, активирующиеся при повышении внутриклеточной концентрации кальция и деполяризации клеточной мембраны. Активация калий-кальцийзависимых каналов ускоряет реполяризацию, тем самым восстанавливая исходное значение потенциала покоя.
Процесс инактивации кальциевых каналов достаточно сложен. С одной стороны, повышение внутриклеточной концентрации свободного кальция приводит к инактивации кальциевых каналов. С другой стороны, белки цитоплазмы клеток связывают кальций, что позволяет поддерживать длительное время стабильную величину кальциевого тока, хотя и на низком уровне; при этом натриевый ток полностью подавляется. Кальциевые каналы играют существенную роль в клетках сердца. Электрогенез кардиомиоцитов рассматривается в главе 7. Электрофизиологические характеристики клеточных мембран исследуют с помощью специальных методов.
Читайте также:
