Кислотно-перфузионный тест - тест Бернштейна. Ниточковая проба
Добавил пользователь Алексей Ф. Обновлено: 01.02.2026
Длительная пассивная ортостатическая проба (Tilt-test) выполняется в отделе новых методов диагностики с 1991 года.
Длительная пассивная ортостатическая проба (ДПОП) проводится пациентам, страдающих повторяющимися приступами потери сознания (обмороками). Синкопальные состояния (обмороки) могут быть обусловлены заболеваниями сердечно-сосудистой или нервной системы, но могут наблюдаться и при отсутствии каких-либо патологических проявлений в данных системах. Среди множества типов синкопальных сотояний можно выделить так называемые нейрокардиогенные синкопальные состояния. Этот термин характеризует группу клинических синдромов, проявляющихся приступами потери сознания и связанных с патологическим рефлекторным воздействием вегетативной нервной системы на регуляцию сосудистого тонуса и сердечного ритма. К этой группе относятся и вазовагальные обмороки, которые являются достаточно частым вариантом кратковременной потери сознания и составляют по данным различных авторов и в различных категориях пациентов от 28 до 93% от общего числа синкопальных состояний.
Показаниями для проведения длительной пассивной ортостатической пробы являются:
- уточнение генеза рецидивирующих синкопальных и пресинкопальных приступов неясной причины;
- контроль эффективности терапии или имплантированного искусственного водителя ритма (кардиостимулятора) у пациентов с ранее наблюдавшимися синкопальными состояниями.
Если проведенное в стенах Института Кардиологии обследование, включавшее в себя: клинический осмотр, ЭКГ, эхокардиографию, чреспищеводное и/или внутрисердечное электрофизиологическое исследование (для исключения аритмической природы обмороков), пробу с массажем областей синокаротидных зон (для исключения синдрома каротидного синуса), электроэнцефалографию с провокационными пробами, осмотр невролога, не определило причину синкопальных приступов, больному проводится ДПОП с непрерывным неинвазивным (бескровным) мониторированием показателей кровообращения в обязательном сочетании с электроэнцефалографией (ЭЭГ).
Противопоказаниями для проведения этого исследования служат:
- нестабильная стенокардия;
- недостаточность кровообращения, начиная со II ф.к. по классификации NYHA;
- тяжелая артериальная гипертония;
- состояние после острого нарушения мозгового кровообращения (менее 6 месяцев);
- выраженная дыхательная недостаточность;
- острый тромбофлебит;
- острые инфекционные заболевания;
- эндокринные заболевания;
- психические расстройства;
Проба проводится в утренние часы (с 10 до 12 час), натощак и на фоне отмены всех кардиоактивных и психотропных препаратов, как минимум за 5 периодов их полувыведения.
Пациента заранее знакомят с методикой проведения исследования, чтобы исключить выраженные проявление тревожности, проводят разъясняющее собеседование, по итогам которого больному предлагается ознакомиться и подписать «протокол информированного согласия больного на проведение длительной пассивной ортостатической пробы», разработанный в Отделе Клинической Электрофизиологии НИИ Кардиологии им. А.Л. Мясникова РКНПК и, принятый этическим комитетом Института в 2000 году.
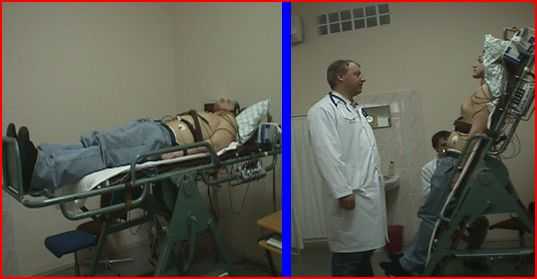
ДПОП проводится на специальном поворотном (ортостатическом) столе, позволяющим осуществлять перевод больного из горизонтального в вертикальное положение и обратно с регулируемым углом наклона. Стол оборудован упором для ног, подножкой для облегчения подъема на стол и ремнями безопасности.
При поведении теста регистрируются следующие биосигналы:
- ЭКГ во II стандартном отведении;
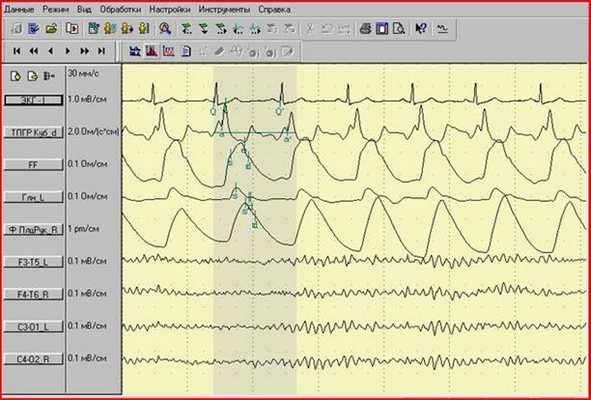
- Тетраполярная грудная реография по Кубичеку и ее первая производная (дифференциальная реограмма), необходимые для документирования изменений МО и кровенаполнения, как показателей «возмущающих» воздействий на систему кровообращения пациента;
- Реовазография левой голени, для объективной оценки тонуса сосудов и депонирования крови в нижних конечностях;
- Сигнал датчика грудного дыхания, для оценки частоты и глубины дыхания с целью учета фактора гипервентиляции в момент развития пресинкопального и синкопального состояния;
- ЭЭГ в четырех биполярных отведениях, позволяет документировать возможные эпилептиформные проявления.
Для оперативного контроля показателей кровообращения при проведении длительной пассивной ортостатической пробы применяется либо компютеризированный реограф-полианализатор РГПА- 6/12 с программным обеспечением «РЕАН-ПОЛИ» отечественного производства («МЕДИКОМ-МТД», г.Таганрог), либо аналогичный комплекс Task Force Monitor, (производства фирмы CNSystem, Австрия).
После наложения необходимых электродов и датчиков пациент укладывается на ортостатический стол и фиксируется ремнями безопасности.
Первоначально, в течение минимум 20 минут, при горизонтальном положении пациента проводятся измерения и регистрация фоновых (исходных) значений показателей системы кровообращения для оперативного контроля. Затем выполняется перевод больного в вертикальное положение (+ 60°) с опорой ног на подставку ортостатического стола. В этом положении пациента непрерывно, в реальном масштабе времени производился контроль основных показателей состояния сердечно-сосудистой системы (Частоты Сердечных Сокращений, Ударного Объема Сердца, Минутного Объема Кровообращения, Общего Периферического Сосудистого Сопротивления, Артериального Давления ) в автоматическом режиме, в течение 40 мин, или до развития синкопального состояния.
Критериями прекращения пробы (переворота в горизонтальное положение) являются:
- развитие синкопального или пресинкопального состояния, причем в этом случае результат пробы считается положительным;
- достижение заданной продолжительности исследования.
Если во время проведенич ДПОП не удается индуцировать синкопальное (пресинкопальное) состояние, результат пробы считается отрицательным.
После перевода больного в горизонтальное положение, в течение 5 - 10 минут продолжается регистрация и контроль гемодинамических показателей вплоть до их полного восстановления.
После окончания ДПОП пациенту выдается заключение и протоколы исследования
ДЛИТЕЛЬНАЯ ПАССИВНАЯ ОРТОСТАТИЧЕСКАЯ ПРОБА ( ТИЛТ-ТЕСТ) С ОЦЕНКОЙ ПЕРЕРАСПРЕДЕЛЕНИЯ ЖИДКОСТИ В РАЗЛИЧНЫХ РЕГИОНАХ ТЕЛА
В отделе новых методов диагностики НИИ кардиологии им.А.Л.Мясникова РКНПК разработан и применяется вариант длительной пассивной ортостатической пробы (ДПОП) для диагностики возможных регионов депонирования крови у больных с синкопальными состояниями. Эта проба выполняется с целью выбора тактики дальнейшего лечения больных с применением лечебного трикотажа. Проба проводится по протоколу, разработанному в Институте кардиологии. Мониторирование перераспределения объемов крови производится с помощью прибора «Анализатор оценки баланса водных секторов организма АВС-01 МЕДАСС» с программным обеспечением АВС-501 для оценки перераспределения венозной крови в ортостатических, фармакологических и др. нагрузочных пробах, разработанного и выпускаемого ЗАО НТЦ «МЕДАСС» (г.Москва). При положительном результате ДПОП ( развитие синкопального или пресинкопального состояния в ходе пробы) определяется регион тела пациента, в котором произошло максимальное депонирование.
Глава 7. Диагностика пищеводного рефлюкса, кратковременная и стимулированная рН-метрия.
Кратковременная внутрижелудочная рН-метрия - наиболее простой и исторически самый ранний вариант рН-метрии.
Для обнаружения гастроэзофагеальных рефлюксов применяют стандартный кислотный рефлюксный тест. Больному в желудок вводят 300 мл 0,1 М соляной кислоты и регистрируют рН с помощью рН-зонда, расположенного на 5 см выше НПС (рис.3.1), при проведении маневров, направленных на повышение интраабдоминального давления: глубокое дыхание, кашель, пробы Мюллера и Вальсальвы в четырех положениях (лежа на спине, правом и левом боку, лежа с опущенной на 20° вниз головой). Проба положительна, если снижение рН пищевода регистрируется не менее чем в трех положениях.
Известен тест выявления болезней пищевода без рН-метрии. Это кислотный перфузионный тест, или тест Бернштейна и Бейкера (LM Bernstein, LA Baker, 1958). При проведении теста пациент находится в сидячем положении. Зонд вводят через нос в среднюю часть пищевода (30 см от крыльев носа). Через зонд со скоростью 100-200 капель в 1 мин вводят 15 мл 0,1 М соляной кислоты. Тест считается положительным при появлении изжоги, болей за грудиной и стихании их после введения физиологического раствора. Для достоверности тест повторяют дважды. Чувствительность и специфичность этого теста около 80%. J Spencer (1972) сообщил о положительной пробе у 18% здоровых лиц, 29% больных с пептической язвой и 67% - с камнями желчного пузыря. Такая высокая частота ложноположительных результатов говорит о необходимости весьма осторожной интерпретации кислотного перфузионного теста у лиц с диспепсией (А.Д. Битти, 1995).
Более физиологичным является тест А.С. Степенко (1988), при котором вместо соляной кислоты пациенту вводят его собственный желудочный сок.
Несмотря на это, применение рН-метрии предпочтительнее, поскольку измерение рН происходит непосредственно в желудке в естественных условиях пищеварения, независимо от наличия в желудке различных примесей (слюны, желчи, крови). Имеется возможность непрерывной графической регистрации изменений уровня рН под влиянием различных стимуляторов или ингибиторов желудочной секреции. Также происходит постоянное совершенствование аппаратуры, которое повышает информативность интрагастральной рН-метрии. Благодаря компьютерному анализу результатов исследований и разработке дополнительных критериев оценки состояния кислотообразующей функции желудка, а также возможности раздельного измерения уровня рН в пищеводе, различных отделах желудка (антрум, тело, кардия) и двенадцатиперстной кишке, рН-метрия является главным методом исследования кислотообразующей функции желудка.
Кратковременную и стимулированную рН-метрию можно выполнять с помощью прибора “Гастроскан-5М”. Исследование чаще всего проводят в утреннее время, натощак. Иногда в ЛПУ организуют двухсменную работу с прибором “Гастроскан-5М”. Во второй смене исследование проводится в послеобеденное время, но также натощак.
Процедура подготовки больного к исследованию и введение рН-зонда проходит по стандартной схеме. На первом этапе рН-метрии исследуют состояние кислотообразующей функции желудка в базальных условиях (базальная секреция). Исследование продолжается 30-45 мин. Следует отметить, что в базальном периоде секреторный аппарат желудка находится в состоянии функционального покоя, при этом работает около 15% париетальных клеток.
В этот период проводят щелочной тест (тест Ноллера) (Noller Н.G., 1959). Тест проводится через 20 мин после стабилизации рН в базальных условиях или через 45 мин после введения стимуляторов. При рН равном или выше 4,0 щелочной тест не проводится.
Через рот в желудок вводят 0,5 г гидрокарбоната натрия, растворенного в 30 мл дистиллированной воды. Обычно в теле желудка рН регистрируется ниже 2,5. В результате введения в желудок щелочи показатели рН изменяются до щелочных и в течение определенного времени сохраняются на одном уровне, а затем возвращаются к исходным. Иначе говоря, щелочной тест позволяет “оттитровать” соляную кислоту желудочного секрета непосредственно в полости желудка.
Данная методика позволяет получить представление не только о концентрации водородных ионов, интенсивности кислотообразования в просвете желудка, но и о количестве желудочного сока, т.е. дает возможность косвенно судить о продукции соляной кислоты. Время, за которое показатели рН возвращаются к исходным называется щелочным временем (ЩВ). Щелочное время определяется в минутах и является основным показателем, регистрируемым с помощью теста Ноллера.
В среднем щелочное время в теле желудка равно 17±3,2 мин и не превышает 25 мин. В зависимости от величины щелочного времени можно судить об интенсивности кислотовыделения в желудке, т.е. можно вычислить количество хлористоводородной кислоты в секрете желудка в момент исследования. Критерии оценки ощелачивающей функции желудка при щелочном тесте представлены в табл. 7.1 (А.С. Логинов, А.А. Ильченко, 1995; В.А. Ступин с соавт., 1995). Уменьшение времени ощелачивания может свидетельствовать о снижении ощелачивающей функции антрального отдела желудка.
Диагностика и лечение хронической ишемической болезни сердца Диагностика хронической ИБС (ч2)
После первичных исследований врач строит план дальнейшего обследования и лечения больного, исходя из полученных первичных данных и априорной вероятности диагноза хронической ИБС (Таблица 4).
Таблица 4. «Априорная вероятность диагноза хронической ИБС в зависимости от характера боли в грудной клетке»
| Типичная стенокардия | Атипичная стенокардия | Боль некоронарного характера | ||||
| Возраст, лет | мужчины | женщины | мужчины | женщины | мужчины | женщины |
| 30—39 | 59 | 28 | 29 | 10 | 18 | 5 |
| 40—49 | 69 | 37 | 38 | 14 | 25 | 8 |
| 50—59 | 77 | 47 | 49 | 20 | 34 | 12 |
| 60—69 | 84 | 58 | 59 | 28 | 44 | 17 |
| 70—79 | 89 | 68 | 69 | 37 | 54 | 24 |
| >80 | 93 | 76 | 78 | 47 | 65 | 32 |
Если по результатам первичных исследований априорная вероятность хронической ИБС превышает 85% — дальнейшие исследования для уточнения диагноза можно не проводить, а приступать к стратификации риска осложнений и назначению лечения.
Если по результатам первичных исследований априорная вероятность хронической ИБС не превышает 15% — следует заподозрить функциональное заболевание сердца или некардиальные причины симптомов.
Пациентов с промежуточной априорной вероятностью ИБС (15—85%) направляют на дополнительные неинвазивные визуализирующие исследования (Таблица 5).
Таблица 5. «Диагностические пробы при ИБС»
| Диагностика ИБС | ||
| Чувствительность (%) | Специфичность (%) | |
| Нагрузочная ЭКГ | 45—50 | 85—90 |
| Стресс-ЭхоКГ | 80—85 | 80—88 |
| Стресс-ОЭКТ | 73—92 | 63—87 |
| Стресс-ЭхоКГ с добутамином | 79—83 | 82—86 |
| Стресс-МРТ | 79—88 | 81—91 |
| Стресс-ЭхоКГ с вазодилататором | 72—79 | 92—95 |
| Стресс-ОЭКТ с вазодилататором | 90—91 | 75—84 |
| Стресс-МРТ с вазодилататором | 67—94 | 61—85 |
| МСКТ-ангиография КА | 95—99 | 64—83 |
| Стресс-ПЭТ с вазодилататором | 81—97 | 74—91 |
2.7.2. Нагрузочные ЭКГ-пробы
Нагрузочные пробы показаны всем пациентам с подозрением на стенокардию напряжения и априорной вероятностью ИБС 15—85%. Показания к проведению нагрузочных проб лицам с ранее установленным диагнозом ИБС: первоначальная и повторная стратификации риска осложнений, оценка эффективности медикаментозного и хирургического лечения.
Обычно проводят велоэргометрическую пробу (ВЭМ-проба) или тредмил-тест. Проба с ходьбой (тредмил-тест) более физиологична и чаще используется для верификации функционального класса пациентов с ИБС. Велоэргометрия информативнее при выявлении ИБС в неясных случаях, но при этом требует от пациента, как минимум, начальных навыков езды на велосипеде, труднее выполняется пожилыми пациентами и при сопутствующем ожирении.
Распространенность чреспищеводной стимуляции (ЧПЭС) предсердий в повседневной диагностике ИБС ниже, хотя этот метод сравним по информативности с ВЭМ-пробой и тредмил-тестом. Метод ЧПЭС является средством выбора при невозможности выполнения пациентом других нагрузочных проб из-за некардиальных факторов (заболевания опорно-двигательного аппарата, перемежающаяся хромота, склонность к выраженному повышению АД при динамической физической нагрузке, детренированность, дыхательная недостаточность).
Для определения суммарного риска по результатам нагрузочных проб используется тредмил-индекс — показатель, комбинирующий информацию, полученную при нагрузочном тестировании.
Таблица 6. «Расчет тредмил-индекса»
| Тредмил-индекс = А - [5 × В] - [4 × С] | А — продолжительность нагрузки в минутах |
| В — отклонение от изолинии сегмента ST в мм (в ходе нагрузки или после ее завершения) | |
| С — индекс стенокардии: 0 — стенокардии нет; 1 — стенокардия есть; 2 — стенокардия приводит к остановке исследования |
Тредмил-индекс в равной степени информативен у стационарных и амбулаторных больных, а также у мужчин и женщин, однако у пожилых пациентов его прогностическая ценность изучена недостаточно
Результаты тредмил-теста выражаются в метаболических единицах (оксигенация тканей в единицу времени), а велоэргометрии — в ваттах или двойном произведении (характеристики мышечной работы). Для пересчета этих единиц измерения и стандартизации результатов нагрузочных проб используют Таблицу 7 .
Таблица 7. «Характеристика функционального класса стенокардии по результатам проб с физической нагрузкой»
| Показатели | Функциональный класс стенокардии | |||
| I | II | III | IV | |
| Число МЕ (тредмил-тест) | >7,0 | 4,0—6,9 | 2,0—3,9 | |
| Двойное произведение (ВЭМ): (ЧСС*САД)/100 | >278 | 218—277 | 151—217 | |
| Мощность последней ступени нагрузки, Вт (ВЭМ) | >125 | 75—100 | 50 | 25 |
2.7.3. Фармакологические пробы
В основе метода — провокация приступа ишемии миокарда с помощью лекарственных средств с одновременной записью ЭКГ. В зависимости от вводимого препарата, различают пробы: с вазодилататором (дипиридамолом) или с инотропным средством (добутамином).
Указанные препараты вводят в условиях палаты интенсивной терапии внутривенно под строгим контролем АД и ЧСС, под непрерывным мониторированием ЭКГ.
Фармакологические пробы показаны для диагностики ИБС только при невозможности выполнения или неинформативности проб с физической нагрузкой. Для оценки эффективности лечения ИБС фармакологические пробы не используются.
Сочетание нагрузочной пробы с визуализирующими методами (ЭхоКГ, томография, радиоизотопная сцинтиграфия) существенно повышает ценность полученных результатов.
2.7.4. Стресс-эхокардиография
Один из самых востребованных и высокоинформативных методов неинвазивной диагностики ИБС. В основе метода лежит визуальное выявление локальной дисфункции левого желудочка во время физической нагрузки или фармакологической пробы. Стресс-ЭхоКГ превосходит обычную нагрузочную ЭКГ по диагностической ценности, обладает большей чувствительностью (80— 85%) и специфичностью (84—86%) в диагностике ИБС. Метод позволяет не только доказательно верифицировать ишемию, но и предварительно определить симптом-связанную коронарную артерию по локализации преходящей дисфункции левого желудочка. При технической возможности метод показан всем больным с доказанной ИБС для верификации симптом-связанной коронарной артерии, а также при сомнительных результатах обычной нагрузочной пробы в ходе первоначальной диагностики.
2.7.5. Радиоизотопные исследования
Перфузионная сцинтиграфия миокарда — чувствительный и высокоспецифичный метод исследования с высокой прогностической значимостью. Сочетание сцинтиграфии с физической нагрузкой или фармакологическими пробами (дозированное в/в введение добутамина, дипиридамола) намного повышает ценность полученных результатов.
Отсутствие существенных нарушений перфузии миокарда по данным нагрузочной сцинтиграфии говорит о хорошем прогнозе даже при доказанной ИБС.
Выявление существенных нарушений перфузии в ходе сцинтиграфических исследований у больных с ИБС говорит о неблагоприятном прогнозе и служат веским основанием для проведения КАГ с последующим решением вопроса о хирургической реваскуляризации миокарда.
Исследование перфузии миокарда показано всем пациентам с доказанной хронической ИБС для стратификации риска сердечно-сосудистых осложнений.
2.7.6. Томографические исследования
Мультиспиральная рентгенкомпьютерная томография коронарных артерий
После внутривенного введения рентгенконтрастного вещества можно визуализировать коронарные артерии и шунты к ним, довольно точно выявить атеросклеротические бляшки и определить степень внутрисосудистого стенозирования.
При диагностике ИБС в неясных случаях метод является альтернативой обычной инвазивной КАГ и может проводиться по тем же показаниям. Преимуществом метода является малоинвазивность. У пожилых пациентов с множественными кальцинированными внутрисосудистыми бляшками этот метод нередко приводит к гипердиагностике стенозирования коронарных артерий. При доказанной ИБС и выборе способа хирургической реваскуляризации — предпочтительнее проводить КАГ.
Электронно-лучевая томография коронарных артерий
Метод используется в диагностике атеросклероза коронарных артерий, — особенно при верификации многососудистого поражения и поражении ствола левой коронарной артерии. Однако для повсеместного применения этот метод пока малодоступен, дорог и имеет ряд ограничений. Целесообразность повсеместного проведения этого исследования при ИБС пока не доказана.
Другие методы томографической визуализации
Магнитно-резонансная томография сердца, однофотонная эмиссионная компьютерная томография, позитронно-эмиссионная томография сердца, — в покое и в комбинации со стрессовыми воздействиями, — доказали в эксперименте высокую чувствительность и специфичность при хронической ИБС, однако повсеместно они не проводятся.
2.8. Итоговая стратификация риска осложнений
Конечной целью неинвазивных диагностических исследований является распределение больных с доказанной ИБС в группы: с высоким, умеренным или низким риском тяжелых осложнений и фатальных исходов (Таблица 8).
Стратификация пациентов на группы риска имеет важное практическое значение, поскольку позволяет избежать ненужных дальнейших диагностических исследований и сократить медицинские расходы у одних пациентов, и активно направлять на КАГ и реваскуляризацию миокарда других больных.
- В группе с низким риском осложнений (предполагаемая ежегодная смертность <1%) проведение дополнительных визуализирующих исследований с диагностической целью не оправданно. Также нет необходимости в рутинном направлении таких больных на КАГ.
- Больных с высоким риском осложнений (предполагаемая ежегодная смертность >3%) следует направлять на КАГ без дальнейших неинвазивных исследований.
- У больных, отнесенных к группе умеренного риска (предполагаемая ежегодная смертность 1—3%) показания к КАГ определяют по дополнительным исследованиям (визуализирующие стресс-тесты, наличие левожелудочковой дисфункции).
Таблица 8. «Распределение больных с ИБС по степени риска на основании неинвазивных диагностических исследований»
| Низкий риск | Умеренный риск | Высокий риск |
| (ежегодная смертность <1%) | (ежегодная смертность 1—3%) | (ежегодная смертность >3%) |
| Высокий тредмил-индекс (>5) | Незначительная/умеренная дисфункция ЛЖ в покое (ОФВ 35—49%) | Тяжелая дисфункция ЛЖ в покое (ОФВ<35%) |
| Незначительный дефект перфузии или его отсутствие в покое и при нагрузке* | Пограничный тредмил-индекс (-11/+5) | Низкий тредмил-индекс (<-11) |
| Нормальная сократимость миокарда по данным нагрузочной эхокардиографии. Либо имеющиеся участки локального гипокинеза не увеличиваются при нагрузке* | При нагрузке индуцируется дефект перфузии миокарда умеренной величины без сопутствующей дилатации ЛЖ и без увеличения поглощения индикатора легкими | Тяжелая дисфункция ЛЖ при нагрузке (ОФВ<35%) |
| При фармакологической стресс-эхокардиографии нарушение локальной сократимости вызывается только большими дозами препарата и распространяется не более, чем на 2 сегмента | Крупный дефект перфузии при нагрузке (особенно в передней стенке ЛЖ) | |
| Множественные умеренные дефекты перфузии миокарда при нагрузке | ||
| Крупный необратимый дефект перфузии миокарда в сочетании с постстрессовой дилатацией ЛЖ или увеличением поглощения индикатора легочной тканью | ||
| При стресс-эхокардиографии — нарушение локальной сократимости в >2 сегментах на фоне введения низких доз фамакологического препарата или при низкой ЧСС ( | ||
| Распространенный гипокинез по данным стресс-эхокардиографии с использованием иных методов нагрузки |
2.9. ИНВАЗИВНЫЕ ИССЛЕДОВАНИЯ
2.9.1 Коронароангиография
Является «золотым стандартом» при выявлении и оценке степени поражения коронарных артерий. Показания к проведению КАГ при хронической ИБС:
- Верификация диагноза ИБС в неясных случаях;
- Определение тактики реваскуляризации миокарда при доказанной ИБС:
- при неэффективности медикаментозного лечения ИБС;
- при высоком риске сердечно-сосудистых осложнений по клиническим данным и результатам неинвазивных исследований.
Для обоснованного проведения КАГ необходимо учитывать весь комплекс данных, полученных в ходе расспроса, осмотра и неинвазивных инструментальных исследований. Наиболее оправдано проведение КАГ пациентам с априорно высоким риском смерти и тяжелых сердечно-сосудистых осложнений, — поскольку в ходе исследования у таких пациентов обычно принимается решение о способе реваскуляризации миокарда с целью снижения этого риска. При низком риске сердечно-сосудистых осложнений проведение КАГ нецелесообразно, поскольку ее результаты обычно не оказывают влияния на ход лечения и, соответственно, не изменяют прогноз. При необходимости КАГ дополняют проведением внутрикоронарного ультразвукового исследования (ВкУЗИ).
Данные КАГ являются одним из важнейших критериев доказанности диагноза ИБС, прогнозирования частоты осложнений и выживаемости при этом заболевании.
В практике используют классификацию атеросклероза коронарных артерий по количеству пораженных сосудов (однососудистое, двухсосудистое, трехсосудистое). Доказано, что неблагоприятная прогностическая роль стенозов в проксимальных отделах коронарных артерий выше, чем роль стенозов в дистальных участках. Отдельно выделяют группы больных со стенозированием ствола левой коронарной артерии и проксимальной части передней нисходящей артерии.
В основе предложенного прогностического индекса ИБС лежит распространенность атеросклероза коронарных артерий (Таблица 9). Прогностический вес признаков тяжести поражения варьирует от 0 (интактные КА) до 100 (стенозирование ствола ЛКА).
Таблица 9. «Прогностический индекс ИБС по данным коронароангиографии (при медикаментозном лечении)»
Примечания: КА — коронарная артерия; ПНА — передняя нисходящая ветвь левой коронарной артерии;Распространенность атеросклероза и степень стенозирования КА (% стенозирования) Прогностический вес показателя (0—100) 5-летняя выживаемость (%) Поражение 1 КА (75%) 23 93 Поражение >1 КА (50—74%) 23 93 Поражение 1 КА (>95%) 32 91 Поражение 2 КА 37 88 Поражение 2 КА (оба стеноза >95%) 42 86 Поражение 1 КА, стеноз в проксимальном отделе ПНА >95% 48 83 Поражение 2 КА, стеноз ПНА >95% 48 83 Поражение 2 КА, стеноз в проксимальном отделе ПНА >95% 56 79 Поражение 3 КА 56 79 Поражение 3 КА, один из стенозов >95% 63 73 Поражение 3 КА, стеноз в проксимальном отделе ПНА 75% 67 67 Поражение 3 КА, стеноз в проксимальном отделе ПНА >95% 74 59 2.9.2. Вентрикулография
Иногда коронароангиографию дополняют вентрикулографическим исследованием. Главное показание к проведению вентрикулографии — детальная оценка общей и локальной левожелудочковой сократимости. Значение выявленной при вентрикулографии левожелудочковой дисфункции очень важно для прогнозирования выживаемости больных со всеми формами ИБС. Вентрикулографию проводят при неинформативности эхокардиографического исследования.
2.9.3. Внутрикоронарное ультразвуковое исследование
Сравнительно новый метод диагностического исследования, дополняющий КАГ. Он свободен от некоторых недостатков КАГ, поскольку позволяет изучить поверхность и внутреннюю структуру атеросклеротических бляшек, выявить тромбоз коронарных артерий, исследовать состояние сосудистой стенки вокруг бляшек. Кроме того, с помощью ВкУЗИ удается точнее верифицировать бляшки сложной конфигурации, плохо поддающиеся количественной оценке при КАГ в обычных проекциях. Наибольшее значение метод имеет при выявлении нормальных или малоизмененных КА во время обычной КАГ. Исследование не показано к повсеместному применению при хронической ИБС.
Гастроэзофагеальная рефлюксная болезнь (ГЭРБ) - Диагностика
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Основными методами диагностики гастроэзофагеальной рефлюксной болезни являются рентгенологическое исследование пищевода, эзофагоскопия, сцинтиграфия с радиоактивным технецием, манометрическое исследование пищеводных сфинктеров, суточное мониторирование внутрипищеводного рН. Большую ценность пролонгированное интраэзофагеальное рН-мониторирование имеет при атипичных формах гастроэзофагеальной рефлюксной болезни (для верификации некардиальной боли за грудиной, при хроническом кашле и предполагаемой легочной аспирации желудочного содержимого); при рефрактерности проводимого лечения; при подготовке больного к антирефлюксной операции.
Методы диагностики гастроэзофагеальной рефлюксной болезни
Позволяет выявить изменение тонуса пищеводных сфинктеров. Норма по DeMeester:
базальное давление НПС 14,3-34,5 мм рт. ст.
Общая длина НПС не менее 4 см. Длина абдоминальной части нижнего пищеводного сфинктера не менее 2 см.
Дополнительными методами являются билиметрия и омепразоловый тест, тест Бернштейна, тест Степенко, стандартный кислотный рефлюксный тест, изучение клиренса пищевода, проба с применением метиленового синего, изучение протеолитической интраэзофагеальной активности по методу В.Н. Горшкова, проведение легочных функциональных тестов после интраэзофагеальной перфузии соляной кислоты.
При проведении рентгеновского исследования с целью выявления гастроэзофагеального рефлюкса больному необходимо выпить контрастную взвесь с сульфатом бария, после эвакуации которой из пищевода в желудок больной обследуется в горизонтальном положении или в положении Тренделенбурга. Используют ряд дополнительных методических приёмов, повышающих внутрибрюшное давление (пробы Вальсальвы и Мюллера, Вайнштейна и др.). При наличии гастроэзофагеального рефлюкса барий вновь поступает в пищевод. Часто при рентгеноскопии выявляются признаки эзофагита: расширение просвета пищевода, перестройка рельефа слизистой оболочки пищевода, неровность очертаний, ослабление перистальтики. Особенно ценен рентгенологический метод для выявления грыжи пищеводного отверстия диафрагмы.
Дополнительные методы диагностики гастроэзофагеальной рефлюксной болезни
Наличие гастроэзофагеальных рефлюксов может быть определено при помощи зондирования с применением метиленового синего. Через тонкий желудочный зонд пациенту вводят в желудок краситель (3 капли 2% раствора метиленового синего на 300 мл кипяченой воды), далее зонд промывают физиологическим раствором, подтягивают чуть проксимальнее кардии и шприцем отсасывают содержимое пищевода. Проба считается положительной при окрашивании содержимого пищевода в синий цвет.
Для обнаружения гастроэзофагеальных рефлюксов применим также стандартный кислотный рефлюксныи тест. Больному в желудок вводят 300 мл 0,1 М соляной кислоты и регистрируют рН с помощью рН-зонда, расположенного на 5 см выше нижнего пищеводного сфинктера, при проведении маневров, направленных на повышение интраабдоминального давления: глубокое дыхание, кашель, пробы Мюллера и Вальсальвы в четырех положениях (лежа на спине, правом и левом боку, лежа с опущенной на 20° вниз головой). Проба положительна, если снижение рН пищевода регистрируется не менее чем в трех положениях.
При проведении кислотного перфузионного теста или теста Бернштейна и Бейкера пациент находится в сидячем положении. Зонд вводят через нос в среднюю часть пищевода (30 см от крыльев носа). Со скоростью 100-200 капель в 1 мин вводят 15 мл 0,1 М соляной кислоты. Тест считается положительным при появлении изжоги, болей за грудиной и стихании их после введения физиологического раствора. Для достоверности тест повторяют дважды. Чувствительность и специфичность этого теста около 80%.
Более физиологичным является тест Степенко, при котором вместо соляной кислоты пациенту вводят его собственный желудочный сок.
Патогномоничных для ГЭРБ лабораторных признаков нет.
Рекомендуемые лабораторные исследования: общий анализ крови, группа крови, резус-фактор.
Актуальные вопросы диагностики муковисцидоза
Е.И. Кондратьева, д. м. н., профессор, В.Д. Шерман, к. м. н., Н.И. Капранов, д. м. н., профессор, Н.Ю. Каширская, д. м. н., профессор, НКО муковисцидоза ФГБНУ «МГНЦ», ГБУЗ «ДГКБ № 13 им. Н.Ф. Филатова ДЗМ», г. Москва
Муковисцидоз (МВ), или кистозный фиброз (cysticfibrosis), - одно из наиболее частых моногенных наследственных заболеваний с полиорганной патологией, резко сокращающее продолжительность и качество жизни пациентов без адекватного комплексного лечения в течение всей жизни. МВ распространен среди населения всей Земли, но наиболее часто поражает европеоидов: в среднем с частотой 1 на 2500-4500 новорожденных. Еще совсем недавно больные муковисцидозом умирали в раннем детском возрасте или даже на первом году жизни от пневмонии и истощения, обусловленными мальабсорбцией.
Ключевые слова: диагностика, генетика, мутации, неонатальный скрининг, потовая проба, эластаза кала.
Key words: cystic fibrosis, diagnosis, genetics, mutation, newborn screening, sweat test, fecal elastase.Болезнь прежде всего характеризуется повышенной продукцией вязкого бронхиального секрета, частыми легочными инфекциями и обструкцией дыхательных путей. По мере прогрессирования легочной болезни образуются участки ателектазов, развивается эмфизема, постепенно разрушается паренхима легких с развитием бронхоэктазов и участков пневмосклероза, а больной имеет высокий риск погибнуть от легочно-сердечной недостаточности. В финальной стадии заболевания пересадка комплекса «сердце-легкие» остается для больного единственной надеждой. Помимо бронхолегочной системы у большинства больных муковисцидозом поражается поджелудочная железа, при этом это происходит внутриутробно. Недостаточность панкреатических ферментов обусловливает нарушение всасывания жиров и белков, развитие нутритивной недостаточности. В результате больные отстают в росте и страдают гипотрофией. Продукция инсулина также может быть нарушена, что ведет к развитию диабета. К частым осложнениям течения муковисцидоза относят остеопороз, а также жировой гепатоз с переходом в цирроз. При наличии «мягкой» мутации клинические проявления развиваются постепенно, преобладают моносимптомы, диагноз «муковисцидоз» устанавливается поздно или случайно.
Своевременная диагностика муковисцидоза, обеспечивающая в большинстве случаев раннее начало терапии, в том числе на доклиническом этапе, улучшает прогноз заболевания, повышает эффективность лечения, позволяет предупредить развитие тяжелых осложнений, значительного отставания в физическом развитии, а в ряде случаев и необратимых изменений в легких. Ранняя диагностика позволяет семье вовремя решить необходимые вопросы, связанные с рождением здорового ребенка (генетическое консультирование, пренатальная диагностика МВ в последующие беременности).
Диагностика делится на:
1) пренатальную диагностику;
2) диагностику по неонатальному скринингу (до клинических проявлений или при их дебюте);
3) диагностику при клинических проявлениях:4) диагностику среди родственников больных.
Клинические признаки
1. Диагностика классической формы МВ обычно не представляет сложностей. Классический фенотип больного является результатом наличия двух мутантных копий гена муковисцидозного трансмембранного регулятора (CFTR) и характеризуется хронической бактериальной инфекцией дыхательных путей и придаточных пазух носа, стеатореей из-за внешнесекреторной недостаточности поджелудочной железы, мужским бесплодием из-за обструктивной азооспермии, а также повышенной концентрацией хлоридов потовой жидкости.
2. Проблемы диагностики МВ, как правило, связаны с фенотипическим разнообразием его форм, обусловленным генетическим полимор-В ряде случаев атипичного течения МВ возможна его диагностика во взрослом возрасте. Как правило, в этой группе больных отмечается более мягкое течение болезни в связи с сохранностью функции поджелудочной железы и нетяжелым поражением органов дыхания.
В абсолютном большинстве случаев МВ может быть диагностирован в раннем детском возрасте (в 90% случаев - на первом году жизни). К сожалению, нередки случаи диагностики МВ у взрослых с классическим фенотипом.
Диагностика МВ у носителей «мягких» генотипов (актуально для детей, рожденных до 2006-2007 гг., и взрослых):
В настоящее время выделяют несколько групп риска по МВ.
Основной группой риска по заболеванию в РФ в настоящее время являются новорожденные с неонатальной гипертрипсиногенемией. Учитывая возможность получения ложноотрицательных результатов неонатального скрининга, а также то обстоятельство, что в РФ неонатальный скрининг на МВ проводится с 2006-2007 гг., не теряет своей актуальности анализ групп риска, включающих пациентов с патологией желудочно-кишечного тракта, бронхолегочными нарушениями, патологией других органов и родственников больных МВ (табл. 1).
Таблица 1.
Группы риска для дифференциальной диагностики муковисцидоза
I. Бронхолегочные нарушения 1. Повторные и рецидивирующие пневмонии с затяжным течением, особенно двусторонние
2. Бронхиальная астма, рефрактерная к традиционной терапии
3. Рецидивирующие бронхиты, бронхиолиты, особенно с высевом Ps. aeruginosa
4. Двусторонние бронхоэктазыII. Изменения со стороны желудочно-кишечного тракта 1. Синдром нарушенного кишечного всасывания неясного генеза
2. Мекониальный илеус и его эквиваленты
3. Гиперэхогенность кишечника плода
4. Желтуха обструктивного типа у новорожденных с затяжным течением
5. Цирроз печени
6. Сахарный диабет
7. Гастроэзофагеальный рефлюкс
8. Выпадение прямой кишкиIII. Патология со стороны других органов 1. Нарушение роста и развития
2. Задержка полового развития
3. Мужское бесплодие
4. Хронический синусит
5. Полипы носа
6. Электролитные нарушенияIV. Члены семей больных муковисцидозом Среди клинических проявлений, характерных для МВ, можно выделить высоко-и менее специфичные (табл. 2). Состояния, представленные в левой колонке таблицы, в абсолютном большинстве случаев встречаются у больных МВ. Причиной состояний из правой колонки могут быть другие заболевания, например первичная цилиарная дискинезия, гуморальный иммунодефицит и т. д.
Таблица 2.
Клинические проявления, характерные для МВ
В таблице 3 представлены особенности проявлений МВ в разные возрастные периоды. Знание этих особенностей помогает специалистам, наблюдающим пациента с теми или иными симптомами, включить МВ в перечень заболеваний для дифференциальной диагностики. Особенно это касается детей раннего возраста, когда клиническая картина еще может быть неполной, но на себя будут обращать внимание некоторые проявления, например мекониальный илеус при рождении или синдром потери солей, не имеющий связи с патологией почек. Диагноз в этом случае может быть установлен еще до рождения ребенка. В то же время этот признак не является высоко специфичным для МВ, может быть транзиторным явлением, а также связанным с другими патологическими состояниями.
Таблица 3.
Клинические особенности проявлений МВ в различные возрастные периоды
Диагностические критерии МВ
Для решения проблем диагностики МВ, в том числе и его атипичных форм, были разработаны критерии, согласно которым обязательным для МВ является наличие характерного клинического синдрома плюс доказательство какого-либо нарушения функции хлорного канала.Учитывая все научные достижения в понимании природы муковисцидоза и МВ-зависимых заболеваний за последние 10 лет, в 2013 году группа экспертов Европейского общества муковисцидоза (European Cystic Fibrosis Society) под руководством Carlo Castellani подготовила новые стандарты диагностики в редакции Alan R. Smyth и Scott Bell (схема).
Схема.
Диагностические критерии муковисцидоза ECFS 2013
Положительная потовая проба
и/или
две мутации МВТР, вызывающие МВ (согласно базе CFTR-2)И Неонатальная гипертрипсиногенемия
или
характерные клинические проявления, такие как диффузные бронхоэктазы, высев из мокроты значимой для МВ патогенной микрофлоры (особенно синегнойной палочки), экзокринная панкреатическая недостаточность, синдром потери солей, обструктивная азооспермияНеонатальный скрининг
Проводится на основании Методических рекомендаций по проведению неонатального скрининга в РФ с использованием Европейских рекомендаций по неонатальному скринингу. 90% новорожденных без клинических проявлений муковисцидоза диагноз может быть установлен на основании скрининга в возрасте до 6 недель. В 5-10% случаев возникают трудности с диагностикой муковисцидоза (Cystic Fibrosis Foundation Patient Registry, 2005 Annual Data Report to the Center Directors. Bethesda, MD: CFF).Проблемы неонатального скрининга:
Потовая проба
Показания:1. При положительном результате неонатального скрининга (двукратном повышении уровня иммунореактивного трипсиногена в крови в течение первого месяца жизни ребенка).
2. При наличии у пациента каких-либо характерных клинических проявлений МВ.
3. Случаи МВ в семье.Потовая проба является надежным методом диагностики МВ у 98% больных. Исследование можно проводить всем детям через 48 часов после рождения, хотя у новорожденных могут быть проблемы с набором пота. Несмотря на то, что «золотым стандартом» диагностики МВ считается количественное определение хлоридов в потовой жидкости (классический метод Гибсона - Кука), метод определения проводимости на аппаратах «Макродакт» и «Нанодакт» («Вескор», США) показал хорошую с ним корреляцию в многочисленных исследованиях.
Оценка результата
При положительном результате потовой пробы (хлориды > 60 ммоль/л при классическом методе Гибсона - Кука и/или проводимость > 80 ммоль/л NaCl) диагноз подтверждается.Генетическое исследование
Генетическое исследование проводится после потовой пробы. Однако в связи с ограниченными возможностями ДНК-диагностики в России данный метод не является обязательным, однако применяется с исследовательской целью и для окончательного подтверждения диагноза.На первом этапе ДНК-обследования наиболее часто используется панель, включающая 28 мутаций, как наиболее частых в мире, так и специфичных для России: F508del, CFTRdele2,3(21kb), 3849+10kbC>T, W1282X, 2143delT, 2184insA, 1677delTA, N1303K, G542X, R334W, E92K, L138ins, 394delTT, 3821delT, S1196X, 2789+5G>A, G85E, 2183AA>G, 604insA, 621+1G>T, R117H, R347P, R553X, 3667insTCAA, G551D, I507del, 1717-1G>A, 2184delA. По данным лаборатории генетической эпидемиологии ФГБУ «Медико-генетический научный центр» (МГНЦ) РАМН, при использовании данной панели удается обнаружить лишь около 82,5% мутантных аллелей у больных МВ. В случае когда при положительной потовой пробе не будет найдено ни одной мутации гена (что само по себе маловероятно), может потребоваться секвенирование гена МВ, позволяющее идентифицировать примерно 98% мутаций в гене CFTR.
Рекомендации:
1. На основании данных национального регистра больных МВ по ДНК-диагностике гена CFTR установлены особенности характера и частоты мутаций в регионах страны. На основе данных регистра рекомендуется создание региональных рекомендаций по определению мутаций со ссылкой на регистр (последнюю версию).
2. Отсутствие мутациий без проведения секвенирования - недостаточно для исключения МВ.
3. Некоторые мутации МВТР (3849+10 kb C>T) ассоциированы с нормальным или пограничным результатом потового теста.
4. «Мягкие» мутации характеризуются поздним дебютом заболевания, пограничным значением потовых проб, выявляются чаще при секвенировании.
5. Пациенты с пограничными результатами потовых проб (хлориды 30-60 ммоль/л и/или проводимость 50-80 ммоль/л), единственной мутацией гена представляют реальные трудности для диагностики.Для диагностики МВ или его исключения при пограничных результатах пробы необходимо:
В европейских странах для подтверждения дефекта ионного транспорта применяется метод определения разности назальных потенциалов или измерение электрического тока в биоптате кишки, отражающие нарушение функции хлорного канала. Оба метода основаны на электрическом характере транспорта ионов и являются высокоинформативными для диагностики МВ.
Диагностика панкреатической недостаточности включает:
У больных МВ показатель эластазы может снижаться в течение первых лет жизни, поэтому определяется в динамике. Низкий уровень панкреатической эластазы расценивается как один из признаков МВ. Приблизительно 1% пациентов с МВ имеет пограничный результат потового теста в комплексе с сохранной функцией поджелудочной железы и хроническим бронхитом.
Диагностика хронического бронхолегочного процесса:
В качестве дополнительных диагностических маркеров могут быть использованы азооспермия в постпубертатном возрасте, идентификация МВ-ассоциированных патогенов из респираторного тракта, рентгенологические признаки синусита.
ЛИТЕРАТУРА
Читайте также:
- Отравление тетраэтилсвинцом и свинцовым бензином: проникновение в организм, клиника, профилактика
- Диагностика и дифференциация синдрома Конна. Лечение первичного альдостеронизма
- Резекция двух долей. Показания и преимущество билобэктомии
- Техника срединного трансперитонеального доступа к пояснично-крестцовому сочленению позвоночника
- Варианты сочетания лучевой и химиотерапии опухоли головы и шеи
