Комбинированные дефициты иммунитета в пульмонологии. Дефекты функции фагоцитарных клеток
Добавил пользователь Владимир З. Обновлено: 01.02.2026
Т.В. Латышева, Н.Х. Сетдикова, К.С. Манько
Начало развития иммунологии относится к концу XVIII в. и связано с именем Э. Дженнера, впервые применившего на основании лишь практических наблюдений метод (впоследствии обоснованный теоретически) вакцинации против натуральной оспы.
Открытый Э. Дженнером факт лег в основу дальнейших экспериментов Л. Пастера, завершившихся формулировкой принципа профилактики от инфекционных заболеваний - принцип иммунизации ослабленными или убитыми возбудителями. Многочисленные попытки выяснения механизмов, обусловливающих устойчивость организма против возбудителя, увенчались созданием двух теорий иммунитета - фагоцитарной, сформулированной в 1887 г. И.И. Мечниковым, и гуморальной, выдвинутой в 1901 г. П. Эрлихом.
Ухудшение экологической ситуации, влияние на организм неблагоприятных факторов окружающей среды привели к росту заболеваемости населения. Изменилось и клиническое течение различных заболеваний человека, увеличился процент атипичных и стертых форм инфекционных заболеваний, чаще отмечается хронизация и резистентность к общепринятым методам терапии, нередко условно-патогенные микробы становятся патогенными для человека. Одновременно с этим, по мере развития иммунологии, становится ясно, что практически все заболевания, процессы в организме в той или иной степени связаны с включением различных звеньев иммунного ответа, которые обеспечивают биологическую индивидуальность и направлены на ее сохранение. Иммунная система находится в состоянии готовности к защите внутренней среды организма от вторжения чужеродных агентов или сформировавшихся внутри организма измененных макромолекул (например, опухолевых клеток и их продуктов). Степень готовности зависит от генетической основы и особенно состояния организма на момент агрессии. Реализация защиты осуществляется через специфические и неспецифические факторы защиты, которые взаимодействуют между собой. Главной особенностью неспецифической составляющей иммунных процессов является то, что ее формирование не зависит от агрессии и является частью естественного развития организма. Неспецифический иммунный ответ включается практически немедленно после появления в организме чужеродного тела, в отличие от специфического ответа, для которого требуется определенное время.
Важную роль в неспецифическом иммунном ответе играют нейтрофилы, моноциты, макрофаги, а затем уже подключаются и лимфоциты. Активация этих клеток приводит к высвобождению медиаторов воспаления и активации ряда гуморальных систем защиты. Все это приводит к включению адаптивной реакции лимфоцитов. Антиген-специфические и неспецифические факторы действуют в тесной взаимосвязи, и их значение в формировании иммунного ответа бывает трудно разграничить [24, 25, 30].
В последнее время большое значение придается роли иммунных нарушений как системного, так и местного характера в патогенезе воспалительного процесса различной этиологии, что часто является причиной хронизации процесса и развития резистентности к общепринятой базисной терапии. Известно, что вторичный иммунодефицит (ВИД) отличается значительной гетерогенностью своего происхождения, вариабельностью нарушений показателей иммунного статуса, полиморфизмом клинических проявлений.
Основными клиническими проявлениями ВИД является развитие хронических, рецидивирующих инфекционно-воспалительных процессов бронхолегочного аппарата, придаточных пазух носа, урогенитального тракта, глаз, кожи, мягких тканей, вызванных оппортунистическими, условно-патогенными микроорганизмами и резистентными к этиопатогенетической терапии.
Результаты исследований позволяют утверждать, что иммунологическая система - важное звено в сложном механизме адаптации человеческого организма, а ее действие направленно, в первую очередь, на сохранение антигенного гомеостаза, нарушение которого может быть обусловлено проникновением в организм чужеродных антигенов (инфекция, трансплантация) или спонтанной мутацией.
Иммунодефициты - это снижение функциональной активности основных компонентов иммунной системы, ведущее к нарушению защиты организма от микробов и проявляющееся в повышенной инфекционной заболеваемости.
К первичным иммунодефицитам (ПИД) относятся врожденные нарушения иммунной системы, связанные с генетическими дефектами одного или нескольких ее компонентов, а именно - комплемента, фагоцитоза, гуморального и клеточного иммунитета.
К вторичным иммунодефицитам (ВИД) относятся нарушения иммунной системы, которые развиваются в позднем постнатальном периоде или у взрослых, и которые (как принято считать) не являются результатом какого-либо генетического дефекта.
Среди ВИД выделяют 3 формы: приобретенную (СПИД), индуцированную (имеется конкретная причина, вызвавшая их появление) и спонтанную (отсутствует явная причина, вызвавшая нарушение иммунологической реактивности).
Наиболее ярким примером приобретенной формы ВИД является синдром приобретенного иммунодефицита человека (СПИД), развивающийся в результате поражения лимфоидной ткани человека вирусом.
Индуцированная форма ВИД возникает в результате конкретных причин, вызвавших ее появление: рентгеновского излучения, цитостатической терапии, применения кортикостероидов, травм и хирургических вмешательств, а также нарушений иммунитета, развивающихся вторично по отношению к основному заболеванию (диабет, заболевание печени, почек, злокачественные новообразования). Спонтанная форма ВИД характеризуется отсутствием явной причины, вызвавшей нарушение иммунной реактивности. Клинически она проявляется в виде хронических, часто рецидивирующих инфекционно-воспалительных процессов бронхолегочного аппарата, придаточных пазух носа, урогенитального и желудочно-кишечного тракта, глаз, кожи, мягких тканей, вызванных оппортунистическими или условно-патогенными микроорганизмами.
В количественном отношении спонтанная форма является доминирующей формой ВИД.
При ВИД нарушается функция различных звеньев иммунной системы: фагоцитарного, клеточного, гуморального, системы комплемента и т. д.
В основе спонтанной формы ВИД может лежать первичная иммунологическая недостаточность какого-либо компонента иммунной системы, скомпенсированная за счет высокой активности других показателей этой системы.
По выявляемости лабораторными методами дефектов в иммунном статусе больных можно разделить на 3 группы:
1. Имеются клинические признаки нарушения иммунитета в сочетании с выявленными изменениями в параметрах иммунного статуса.
2. Имеются только клинические признаки иммунной недостаточности без конкретно выявленных изменений в параметрах иммунного статуса. Поэтому хронические, часто рецидивирующие, вялотекущие, трудно поддающиеся лечению традиционными средствами инфекционно-воспалительные процессы любой локализации у взрослых рассматриваются как ВИД состояния.
3. Имеются только изменения показателей иммунного статуса без клинических признаков иммунной недостаточности.
Исходя из данного деления пациентов на группы, можно сказать, что в первом и втором случаях необходимо введение в комплекс терапевтических мероприятий иммунотропных препаратов, в третьем же случае требуется лишь динамическое наблюдение за пациентом для возможно более раннего введения иммунотропных препаратов при появлении клинических признаков иммунодефицитного состояния.
Таким образом, иммунотерапию вообще можно разделить на активную иммунизацию (вакцинация), заместительную терапию и терапию иммунотропными препаратами. Одним из перспективных направлений является использование иммунотропных препаратов и разработка адекватных методов направленной иммунокоррекции в комплексной терапии.
Тяжелый комбинированный иммунодефицит
Первичные иммунодефициты (ПИД) - генетические нарушения иммунитета, встречаемость, которых варьирует от 1:250 до 1:1,000,000 в зависимости от вида иммунодефицита и исследования населения. ПИД является важной группой генетических заболеваний, критически влияющих на здоровье, качество жизни пациентов и в связи с этим, представляют собой проблему национального масштаба.
Тяжелый комбинированный иммунодефицит (тяжелая комбинированная иммунная недостаточность-ТКИН) - генетически обусловленный иммунодефицит, характеризующийся практически полным отсутствием зрелых Т-лимфоцитов при наличии или отсутствии В- и НК-лимфоцитов, что ведет к ранним, крайне тяжелым инфекциям вирусной, бактериальной и оппортунистической природы и в отсутствие патогенетической терапии смерти в первые два года жизни.
Общая частота ТКИН 1:50000 новорожденных. Среди больных преобладают лица мужского пола.
Соотношение кодов МКБ-10 и МКБ-9
| МКБ-10 | МКБ-9 | ||
| Код | Название | Код | Название |
| D81.0 | Тяжелый комбинированный иммунодефицит с ретикулярным дисгенезом | 86.10 | Диагностические процедуры на коже и подкожных тканях |
| D81.1 | Тяжелый комбинированный иммунодефицит с низким содержанием Т и В- клеток | 86.11 | Биопсия кожи и подкожных тканей |
| D81.2 | Тяжелый комбинированный иммунодефицит с низким и нормальным содержанием В-клеток | 40.11 | Биопсия лимфатической структуры |
| D81.3 | Дефицит аденозиндезаминазы | ||
| D81.4 | Синдром Незелофа | ||
| D81.5 | Дефицит пуриннуклеозидфосфорилазы | ||
| D81.6 | Дефицит молекул класса I главного комплекса гистосовместимости | ||
| D81.7 | Дефицит молекул класса IIглавного комплекса гистосовместимости | ||
| D81.8 | Другие комбинированный иммунодефициты | ||
| D81.9 | Комбинированный иммунодефицит неуточненный | ||
Дата разработки/пересмотра протокола: 2016 год.
Пользователи протокола: врачи общей практики, педиатры, неонатологи, детские онкологи/гематологи, иммунологи, аллергологи.
Категории пациентов: дети 0-2 года.
Шкала уровня доказательности:
| A | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки результаты которых могут быть распространены на соответствующую популяцию. |
| B | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или Высококачественное (++) когортное или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с невысоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| C | Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+). Результаты которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++ или +), результаты которых не могут быть непосредственно распространены на соответствующую популяцию. |
| D | Описание серии случаев или неконтролируемое исследование или мнение экспертов. |

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 800 RUB / 4500 KZT / 27 BYN - 1 рабочее место в месяц

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место - 800 RUB / 4500 KZT / 27 BYN в месяц
Мне интересно! Свяжитесь со мной
Классификация
Классификация [2,4]
На основании различий в иммунологическом фенотипе ТКИН может быть разделена на 4 группы [2]:
· Т - B + NK -
· T - B - NK +
· T - B + NK -
· T - B - NK -
В зависимости от измененного гена выделяют аутосомно-рецессивный и Х-сцепленный тип наследования [2].
Согласно классификации 2015 г., основанной на генетических особенностях, ТКИНы представлены следующими формами [4]:
1. T-B+ тяжелая комбинированная иммунная недостаточность с дефицитом общей y-цепи. Причина: мутация в гене общей у-цепи суперсемейства рецептора ИЛ-2. Ген расположен в локусе q13.1 на Х-хромосоме (рецепторы IL-2R, IL-4R, IL-7R, IL-9R, IL-5R, IL-21R).
· ТКИН c дефицитом JAK3 (семейство Janus-ассоциированных киназ, которое входят Jak1,Jak2, Tyk2, Jak3 вместе с Jak 1 соединены с общей y-цепью рецепторов, относящихся к суперсемейству IL-2R);
· ТКИН с дефицитом a-цепи ИЛ-7 (IL7Ra) - мутация гена IL7Ra, находящемся на хромосоме 5, локус р13;
· ТКИН с дефицитом CD 45 (мутация гена рецептора тирозинфосфатазы) - расположен на хромосоме 1, в локусе q31-32;
· ТКИН с дефицитом TCR (антигенсвязывающего комплекса) - мутация CD3б цепи Т-клеточного рецептора;
· ТКИН с дефицитом TCR (антигенсвязывающего комплекса) - мутация CD3e цепи Т-клеточного рецептора;
· ТКИН с дефицитом TCR (антигенсвязывающего комплекса) - мутация CD3z цепи Т-клеточного рецептора;
· ТКИН с дефицитом Coronin-1A (мутация гена CORO1A)- нарушение выхода и миграции Т- лимфоцитов из тимуса.
2. Т-В- тяжелый комбинированный иммунодефицит (дефекты рекомбинации ДНК):
· Мутация гена RAG1/RAG2 - нарушение формирования преТ- и пре В- клеточных рецепторов, приводящее с дефекту дифференцировки Т и В-лимфоцитов;
· Мутация гена DCLRE1C (ARTEMIS) - нарушение VDJ рекомбинации; репарации ДНК;
· Мутация гена PRKDC - нарушение VDJ рекомбинации, нарушение репарации ДНК;
· Ретикулярная дисгенезия - мутация гена AK2 (митохондриальная аденилат киназа 2), нарушение дифференцировки лимфоидного и миелоидного ростков;
· Дефицит синтеза аденозиндезаминазы - нарушение пуринового обмена, мутация гена ADA приводит к отсутствию активности аденозиндезаминазы, накоплению токсических метаболитов пуринового обмена;
· Мутация гена CD40LG - дефект формирования CD40 лиганда (CD40L; TNFSF5 или CD154) с нарушением сигналинга дендритных клеток;
· Мутация гена пуриннуклеозидфосфорилазы (PNP)- нарушение пуринового обмена, мутация гена PNP приводит к отсутствию активности та, накоплению токсических метаболитов пуринового обмена;
· Мутация CD8α - дефект α-цепи СD8 молекулы с нарушен созревания CD8T лимфоцитов;
· Мутация гена ZAP70/SRK - дефект сигналинговых киназ с нарушением первичной дифференцировки CD8+Тклеток;
· Мутации генов TAP1,TAP2, or TAPBP (tapasin) - нарушение экспрессии молекул гистосовместимости I класса;
· Мутация генов факторов транскрипции молекул гистосовместимости II класса (CIITA,RFX5,RFXAP, RFXANK) - нарушение экспрессии молекул гистосовместимости II класса;
· Мутации гена ITK - дефект IL-2-зависимой Т-клеточной киназы, необходимой для активации Т-клеточного рецептора.
Диагностика (амбулатория)
ДИАГНОСТИКА НА АМБУЛАТОРНОМ УРОВНЕ [1-3,5,7]
Диагностические критерии
Жалобы и анамнез: разнообразие жалоб связано с многообразием клинических проявлений осложнений тяжелого комбинированного иммунодефицита и уровнем дефекта. Преимущественные жалобы на затяжные пневмонии, отставание массы тела, частый жидкий стул, длительный кашель, затяжные лихорадки, появление частых гнойных выделений из различных локусов, упорный афтозный стоматит, снижение аппетита, рвота, длительный кашель [3,5].
При сборе семейного анамнеза надо обращать внимание на случаи повторных тяжелых инфекций и смертей детей в раннем возрасте с клиникой инфекционных заболеваний. Смерти мальчиков в нескольких поколениях в семье позволяет предполагать Х-сцепленный характер заболевания. Близкородственный брак у родителей увеличивает вероятность аутосомно-рецессивной патологии [2, 5-7].
Клиническая симптоматика:
· отставание ребенка в возрасте до 1 года в весе и росте;
· поствакцинальные осложнения (БЦЖит диссеминированный, полиомиелит паралитический и др.);
· перенесенные не менее 2 раз тяжелые инфекции, такие как: менингит, остеомиелит, целлюлит, сепсис;
· частые гнойные отиты — не менее 3-4 раз в течение одного года;
· упорная молочница и грибковые поражения кожи;
· гнойное воспаление придаточных пазух носа 2 и более раз в течение года;
· рецидивирующие гнойные поражения кожи;
· рецидивирующие типичные бактериальные инфекции, протекающие в тяжелой форме, с необходимостью использования множественных курсов антибиотиков (до 2 месяцев и дольше);
· оппортунистические инфекции (например: Pneumocystic carini), вирусами герпес группы, грибками, проявляются в очень тяжелой, хронической форме или не поддаются стандартному лечению, (необходимо внутривенное введение антибиотиков);
· рецидивирующие (повторные) диареи; мальабсорбция;
· отсутствие/увеличение лимфатических узлов;
· увеличение печени и селезенки;
· наличие в семье больных ПИД;
· наличие в семейном анамнезе смерти ребенка раннего возраста с клиникой инфекционного заболевания;
· изменения в анализе крови: очень часто анемия, в лейкоформуле снижение количества лимфоцитов, эритроцитов, реже тромбоцитов;
· абсцессы внутреннего органа;
· рецидивирующие абсцессы подкожной клетчатки;
· тяжелое или длительное проявление бородавок, контагиозный моллюск.
Физикальное обследование
· рост и вес ребенка. У детей с ТКИН часто отмечается задержка развития;
· лимфатическая система: периферические лимфатические узлы уменьшены или отсутствуют, реже лимфаденопатия (чрезмерная);
· увеличение печени и селезенки;
· кожные покровы и слизистые: кандидоз кожи и слизистых при отсутствии предрасполагающих факторов (лечения антибиотиками или кортикостероидами, инфицирование при кормлении грудью). Изъязвления языка, слизистой рта и перианальной области. Гнойные инфекции кожи и подкожной клетчатки. Возможна сыпь по типу себорейного дерматита. Конъюнктивит, вызванный Haemophilus influenzae;
· заболевания ЛОР органов: хронические гнойные отиты, сопровождающиеся рубцовыми имениями барабанной перепонки;
· неврологические нарушения: энцефалопатии;
· позднее отпадение пуповины, омфалиты.
Лабораторные исследования:
· общий анализ крови: позволяет выявить анемию, лейкопению или лимфоцитопению. Общее число лимфоцитов должно составлять не менее 1000 мкл -1 , у детей младше 2 лет число лимфоцитов в норме должно быть не менее 2800 мкл -1 . Поскольку T-лимфоциты составляют около 75% всех лимфоцитов крови, лимфопения почти всегда свидетельствует о снижении числа T-лимфоцитов при выявлении абсолютной или относительной лимфопении [1].
· биохимический анализ крови - креатинин, электролиты, печеночные ферменты, мочевая кислота. У детей обязательно определяют уровень хлора в поте и оценивают экзокринную функцию поджелудочной железы. Это особенно необходимо при рецидивирующих инфекциях дыхательных путей, синдроме нарушенного всасывания и задержке развития.
· микробиологическая диагностика:
- микроскопия мазка, окрашенного по Грамму
- культуральное исследование крови, мокроты, мочи, кала для выделения возбудителя и оценки его чувствительности к антибиотикам.
· количественное определение иммуноглобулинов А, М, G, Е;
· количественное определение субпопуляций лимфоцитов методом проточной цитофлюориметрии (CD 3+; CD 4+; CD 8+; CD 16+/56+,CD 19+; CD 3+ HLADR+; CD 16+/56+);
· тест на ВИЧ;
· определение активности фагоцитарного звена иммунитета.
Инструментальные исследования:
· УЗИ органов брюшной полости, щитовидной железы и других органов (по показаниям);
· УЗИ вилочковой железы;
· Рентгенография органов грудной клетки (по показаниям);
· Рентгенография грудной клетки в двух проекциях (дополнительно размер вилочковой железы).
Диагностический алгоритм: (схема)
Диагностика (стационар)
ДИАГНОСТИКА НА СТАЦИОНАРНОМ УРОВНЕ [2,4] (УД - В)
Диагностические критерии: см. амбулаторный уровень.
Лабораторные исследования:
· общий анализ крови + лейкоформула ручным методом;
· биохимический анализ крови: ферритин сыворотки, железо сыворотки, трансферрин, АЛТ, АСТ, билирубин общий/фракции, щелочная фосфатаза, гамма‐глутамилтранспептидаза, общий белок, определение белковых фракций, уровень иммуноглобулинов A,M,G,E, креатинин, мочевина, электролиты;
· развернутая иммунограмма : подсчет субпопуляционного состава Т-, В-лимфоцитов, NK-клеток, HLA DR+CD3+, HLADR+CD3-, CD25+, CD95+;
· CD4+8+, уровень сывороточных иммуноглобулинов (с подтипами G1,2,3,4, sIgA), кислородзависимый и кислороднезависимый фагоцитоз, определение активности компонентов комплемента, тесты функциональной активности Т-лимфоцитов, цитокиновый статус, интерфероновый статус, экспрессия рецепторов цитокинов;
· определение TREG [2];
· исследование крови на ВИЧ;
· HLA-типирование ребенка и его ближайших родственников (сибсов и родителей) [2];
· микробиологические исследования - посевы биоматериала (на флору и грибы) с определением антибиотикочувствительности со слизистых, из очагов инфекции (включая кровь, мочу, кал, бронхоальвеолярный лаваж, ликвор и биопсийный материал) [2];
· при наличии вакцинации БЦЖ микроскопия материала на кислотоустойчивые бактерии, а также выявление M.bovii методом ПЦР;
· молекулярно- генетический анализ с помощью ПЦР и последующего секвенирования;
· ИФА и ПЦР на цитомегаловирусную, Эпштейн-Барр вирусную, герпес-инфекцию, токсоплазмоз;
· при подозрении на Т-В- ТКИН - АДА недостаточность необходимо цитохимическое исследование: определение АДА в эритроцитах и лимфоцитах;
· морфологическое исследование пунктата костного мозга с целью дифференциальной диагностики;
· гистологическое исследование кожи, лимфоузлов и ткани тимуса при подозрении на синдром Омен [4].
Инструментальные исследования [2]:
· УЗИ брюшной полости и забрюшинного пространства для оценки вовлеченности внутренних органов;
· УЗИ вилочковой железы;
· компьютерная томография грудной клетки с контрастированием сосудов даже при отсутствии указаний на подтвержденные пневмонии в анамнезе;
· рентгенография грудной клетки;
· рентгенография придаточных пазух носа в динамике.
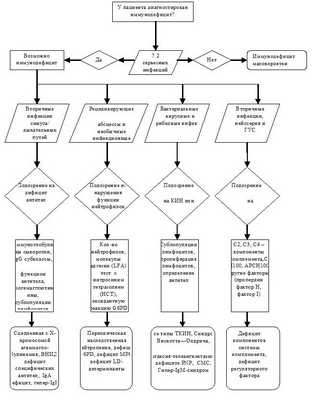
Диагностический алгоритм: (схема)
Перечень основных диагностических мероприятий:
· общий анализ крови + лейкоформула ручным методом;
· пунктат костного мозга (миелограмма);
· биохимический анализ крови;
· определение белковых фракций;
· развернутая иммунограмма : подсчет субпопуляционного состава Т-,В-лимфоцитов, NK-клеток, HLA DR+CD3+, HLADR+CD3-, CD25+, CD95+, CD4+8+, уровень сывороточных иммуноглобулинов (с подтипами G1,2,3,4, sIgA), кислородзависимый и кислороднезависимый фагоцитоз, определение активности компонентов комплемента, тесты функциональной активности Т-лимфоцитов, цитокиновый статус, интерфероновый статус, экспрессия рецепторов цитокинов;
· общий анализ мочи;
· исследование крови, других сред на стерильность, грибы;
· бак посев из зева на стерильность, грибы;
· ИФА на цитомегаловирус, вирусы простого герпеса;
· ПЦР (кровь, моча, слюна) на цитомегаловирус, ВПГ, ВЭБ, вирус Зостер;
· ИФА на грибковые инфекции;
· ПЦР (кровь, отделяемого из различных локусов) на грибковую инфекцию;
· копрология, исследование кала на яйца глист и простейших;
· УЗИ органов брюшной полости и забрюшинного пространства;
· УЗИ вилочковой железы;
· рентгенография грудной клетки в 2-х проекциях;
· компьютерная томография грудной клетки с контрастированием сосудов;
· молекулярно-генетическое исследование с целью выявления причинной генетической мутации;
· исследование крови на ВИЧ;
· HLA типирование пациента (в качестве реципиента ТГСК) и его сиблингов ( в качестве потенциальных доноров).
Перечень дополнительных диагностических мероприятий:
· ИФА на гепатиты А, В, С, Д, G;
· ПЦР на гепатиты;
· общий анализ ликвора + цитопрепарат (люмбальная пункция);
· определение группы крови и резус фактора;
· ЭКГ;
· ЭХОКГ;
· антропометрия, измерение артериального давления, контроль диуреза;
· реоэнцефалография - по показаниям;
· электроэнцефалография - по показаниям;
· ЭХО-энцефалография - по показаниям;
· компьютерная томография брюшной полости - по показаниям;
· рентгенография костей и суставов - по показаниям;
· УЗИ областей увеличенных лимфоузлов, яичек, органов малого таза - по показаниям;
· компьютерная томография головы - желательно, а при наличии показаний (неврологическая симптоматика) - обязательно;
· проведение туберкулиновой пробы.
Первичные иммунодефициты
Первичные иммунодефициты - группа патологических состояний преимущественно врожденного характера, при которых наблюдается нарушение работы определенных звеньев иммунитета. Симптомы варьируются, зависят от типа заболевания, в основном наблюдается повышенная восприимчивость к бактериальным и вирусным агентам. Диагностика патологии производится посредством лабораторных методов исследования, молекулярно-генетического анализа (при наследственных формах), изучения анамнеза больного. Лечение включает в себя заместительную терапию, трансплантацию костного мозга, мероприятия по борьбе с инфекциями. Некоторые формы иммунодефицитов являются неизлечимыми.
Общие сведения
Первичные иммунодефициты стали активно изучаться с 50-х годов XX века - после того, как в 1952 году американским педиатром Огденом Брутоном было описано первое состояние такого типа, получившее его имя. На настоящий момент известно свыше 25 разновидностей патологии, большая часть из них - генетически детерминированные болезни. Встречаемость разных типов иммунодефицита колеблется от 1:1 000 до 1:5 000 000. Подавляющее большинство больных - дети в возрасте младше 5 лет, слабовыраженные формы могут впервые обнаруживаться у взрослых. В отдельных случаях иммунодефицитное состояние выявляется только по результатам лабораторных анализов. Некоторые виды заболевания сочетаются с многочисленными пороками развития, обладают высокой летальностью.
Причины первичных иммунодефицитов
Иммунодефицитные состояния первичного характера начинают формироваться на этапе внутриутробного развития под воздействием различных факторов. Нередко они сочетаются с иными пороками (дистрофиями, аномалиями тканей и органов, ферментопатиями). По этиологическому признаку выделяют три основные группы врожденных патологий иммунной системы:
- Вследствие генетических мутаций. Подавляющее большинство заболеваний возникает из-за дефектов в генах, ответственных за развитие и дифференцировку иммунокомпетентных клеток. Обычно отмечается аутосомно-рецессивное или сцепленное с полом наследование. Имеется небольшая доля спонтанных и герминативных мутаций.
- В результате тератогенного воздействия. К врожденным проблемам с иммунитетом может приводить влияние на плод токсинов различной природы. Иммунодефицит часто сопровождает пороки развития, обусловленные TORCH-инфекциями.
- Неясной этиологии. К данной группе относят случаи, когда выявить причину слабости иммунной системы не удается. Это могут быть еще неизученные генетические аномалии, слабое или неустановленное тератогенное воздействие.
Изучение причин, патогенеза и поиск методик лечения первичных иммунодефицитов продолжается. Уже имеются указания на целую группу подобных состояний, которые не проявляют себя выраженными симптомами, но при определенных условиях могут провоцировать инфекционные осложнения.
Патогенез
Механизм развития недостаточности иммунитета зависит от этиологического фактора. При наиболее распространенном генетическом варианте патологии из-за мутации некоторых генов кодируемые ими белки либо не синтезируются, либо имеют дефект. В зависимости от функций протеина нарушаются процессы формирования лимфоцитов, их трансформации (в Т- или В-клетки, плазмоциты, натуральные киллеры) или выделения антител и цитокинов. Некоторые формы заболевания характеризуются снижением активности макрофагов или комплексной недостаточностью множества звеньев иммунитета. Разновидности иммунодефицита, обусловленные влиянием тератогенных факторов, чаще всего возникают из-за поражения зачатков иммунных органов - тимуса, костного мозга, лимфоидной ткани. Недоразвитие отдельных элементов иммунной системы приводит к ее дисбалансу, что проявляется ослаблением защитных сил организма. Первичный иммунодефицит любого генеза становится причиной развития частых грибковых, бактериальных или вирусных инфекций.
Количество видов первичных иммунодефицитов достаточно велико. Это объясняется сложностью иммунной системы и тесной интеграцией ее отдельных звеньев, в результате чего нарушение работы или «выключение» одной части способствует ослаблению всей защиты организма в целом. На сегодняшний день разработана сложная разветвленная классификация подобных состояний. Она состоит из пяти главных групп иммунодефицитов, каждая из которых включает несколько наиболее распространенных типов патологии. В упрощенном варианте данную классификацию можно представить следующим образом:
- Первичные дефициты клеточного иммунитета. Группа объединяет состояния, обусловленные недостаточной активностью или низким уровнем Т-лимфоцитов. Причиной может выступать недостаточность тимуса, ферментопатии и иные (преимущественно генетические) нарушения. Наиболее распространенными формами иммунодефицитов такого типа являются синдромы Ди Джорджи и Дункана, оротацидурия, недостаточность ферментов лимфоцитов.
- Первичные дефициты гуморального иммунитета. Группа состояний, при которых понижена функция преимущественно В-лимфоцитов, нарушен синтез иммуноглобулинов. Большинство форм относится к категории дисгаммаглобулинемий. Наиболее известны синдромы Брутона, Веста, дефициты IgM или транскобаламина II.
- Комбинированные первичные иммунодефициты. Обширная группа заболеваний с пониженной активностью как клеточных, так и гуморальных звеньев иммунитета. По некоторым данным, этот тип включает более половины всех разновидностей иммунной недостаточности. Среди них выделяют тяжелые (синдром Гланцманна-Риникера), умеренные (болезнь Луи-Бар, аутоиммунный лимфопролиферативный синдром) и минорные иммунодефициты.
- Первичная недостаточность фагоцитов. Генетические патологии, вызывающие пониженную активность макро- и микрофагов - моноцитов и гранулоцитов. Все заболевания этого типа разделяются на две большие группы - нейтропении и дефекты активности и хемотаксиса лейкоцитов. Примерами являются нейтропения Костмана, синдром «ленивых лейкоцитов».
- Дефициты белков комплемента. Группа иммунодефицитных состояний, развитие которых обусловлено мутациями генов, кодирующих компоненты комплемента. В результате нарушается образование мембраноатакующего комплекса, страдают другие функции, в которых участвуют данные белки. Это вызывает комплемент-зависимые первичные иммунодефициты, аутоиммунные состояния или наследственный ангионевротический отек.
Симптомы первичных иммунодефицитов
Клиническая картина различных форм дефицита иммунитета очень разнообразна, может включать не только иммунологические нарушения, но и пороки развития, опухолевые процессы, дерматологические проблемы. Это позволяет врачам-педиатрам или иммунологам дифференцировать разные типы патологии еще на этапе физикального осмотра и базовых лабораторных исследований. Тем не менее, существуют определенные общие симптомы, схожие у заболеваний каждой группы. Их наличие указывает, какое звено или часть иммунной системы были поражены в большей степени.
При первичных дефицитах клеточного иммунитета превалируют вирусные и грибковые заболевания. Таковыми выступают частые простуды, более тяжелое, нежели в норме, протекание детских вирусных инфекций (ветряной оспы, паротита), выраженные герпетические поражения. Нередко возникает кандидоз полости рта, половых органов, велика вероятность грибковых поражений легких, ЖКТ. У лиц с недостатками клеточного звена иммунной системы повышен риск развития злокачественных новообразований - лимфом, рака различной локализации.
Ослабление гуморальной защиты организма обычно проявляется повышенной чувствительностью к бактериальным агентам. У больных развиваются пневмонии, гнойничковые поражения кожи (пиодермия), часто принимающие тяжелый характер (стафило- или стрептодермия, рожистое воспаление). При уменьшении уровня секреторного IgA поражаются преимущественно слизистые оболочки (конъюнктива глаз, поверхности ротовой и носовой полостей), а также бронхи и кишечник. Комбинированные иммунодефициты сопровождаются как вирусными, так и бактериальными осложнениями. Зачастую на первый план выступают не проявления недостатка иммунитета, а иные, более специфические симптомы - мегалобластная анемия, пороки развития, опухоли тимуса и лимфоидной ткани.
Для врожденных нейтропений и ослабления фагоцитоза гранулоцитов также характерно частое возникновение бактериальных инфекций. Нередки гнойно-воспалительные процессы с образованием абсцессов в различных органах, при отсутствии лечения возможно формирование флегмон, сепсис. Клиническая картина комплемент-ассоциируемых иммунодефицитов представлена либо как снижение устойчивости организма к бактериям, либо в форме аутоиммунных поражений. Отдельный вариант комплемент-зависимого нарушения иммунитета - наследственный АНО - проявляется рецидивирующими отеками различных участков тела.
Осложнения
Все виды первичного иммунодефицита объединяет повышенный риск тяжелых инфекционных осложнений. Из-за ослабления защиты организма болезнетворные микробы вызывают тяжелые поражения различных органов. Чаще всего страдают легкие (пневмонии, бронхиты, бронхоэктатическая болезнь), слизистые оболочки, кожа, органы желудочно-кишечного тракта. При тяжелых вариантах заболевания именно инфекция становится причиной смерти в младенческом возрасте. К усугублению патологии могут приводить сопутствующие нарушения - мегалобластная анемия, аномалии развития сердца и сосудов, поражение селезенки и печени. Некоторые формы иммунодефицитных состояний в отдаленной перспективе могут стать причиной образования злокачественных опухолей.
Диагностика
В иммунологии используется огромное количество методик для определения наличия и идентификации типа первичного иммунодефицита. Чаще иммунодефицитные состояния являются врожденными, поэтому могут быть выявлены уже в первые недели и месяцы жизни ребенка. Поводом для обращения к специалисту становятся частые бактериальные или вирусные заболевания, отягощенный наследственный анамнез, наличие иных пороков развития. Разновидности слабо проявляющихся иммунодефицитов могут определяться позже, зачастую обнаруживаются случайно при проведении лабораторных исследований. Основными методами диагностики наследственных и врожденных нарушений иммунитета считаются:
- Общий осмотр. Заподозрить наличие выраженного иммунодефицита можно еще при осмотре кожных покровов. У больных детей часто выявляют выраженные дерматомикозы, гнойничковые поражения, атрофии и эрозии слизистых оболочек. Некоторые формы также проявляются отеком подкожной жировой клетчатки.
- Лабораторные анализы. Лейкоцитарная формула в общем анализе крови нарушается - отмечаются лейкопении, нейтропении, агранулоцитоз и другие аномалии. При некоторых разновидностях возможно увеличение уровня отдельных классов лейкоцитов. Биохимический анализ крови при первичном иммунодефиците гуморального типа подтверждает дисгаммаглобулинемию, наличие необычных метаболитов (при ферментопатиях).
- Специфические иммунологические исследования. Для уточнения диагноза применяют ряд методик, направленных на определение активности иммунной системы. К таковым относят анализ на активированные лейкоциты, фагоцитарную активность гранулоцитов, уровень иммуноглобулинов (в целом и отдельных фракций - IgA, E, G, M). Также производят исследование уровня фракций комплемента, интерлейкинового и интерферонового статусов больного.
- Молекулярно-генетический анализ. Наследственные разновидности первичных иммунодефицитов можно диагностировать путем секвенирования генов, мутации которых приводят к той или иной форме заболевания. Так подтверждают диагноз при синдромах Ди Джорджи, Брутона, Дункана, Вискотта-Олдрича и ряде других иммунодефицитных состояний.
Дифференциальную диагностику в первую очередь производят с приобретенными вторичными иммунодефицитами, которые могут быть вызваны радиоактивным заражением, отравлением цитотоксическими веществами, аутоиммунными и онкологическими патологиями. Особенно тяжело бывает различить причину дефицита при сглаженных формах, определяемых преимущественно у взрослых людей.
Лечение первичных иммунодефицитов
Единых для всех форм патологии принципов лечения не существует из-за различий в этиологии и патогенезе. В наиболее тяжелых случаях (синдром Гланцманна-Риникера, агранулоцитоз Костмана) любые терапевтические мероприятия носят временный характер, больные умирают из-за инфекционных осложнений. Некоторые виды первичных иммунодефицитов лечат путем трансплантации костного мозга или эмбриональной ткани тимуса. Недостаточность клеточного иммунитета можно ослабить использованием специальных колоний-стимулирующих факторов. При ферментопатиях терапию производят применением недостающих энзимов или метаболитов - например, препаратов биотина.
При дисглобулинемиях (первичном гуморального иммунодефиците) используют заместительную терапию - введение иммуноглобулинов недостающих классов. В лечении любых форм крайне важно уделять внимание устранению и профилактике инфекций. При первых признаках бактериального, вирусного или грибкового заражения больным назначают курс соответствующих препаратов. Нередко для полного излечения инфекционных патологий требуются повышенные дозировки лекарственных средств. У детей отменяют все вакцинации - они в большинстве случаев неэффективны, а некоторые даже опасны.
Прогноз и профилактика
Прогноз первичного иммунодефицита сильно варьируется при разных типах патологии. Тяжелые формы могут быть неизлечимыми, приводить к гибели в первые месяцы или годы жизни ребенка. Другие разновидности могут успешно контролироваться посредством заместительной терапии или иными методиками лечения, лишь незначительно ухудшая качество жизни пациента. Легкие формы не требуют регулярного врачебного вмешательства, однако больным следует избегать переохлаждения и контактов с источниками инфекции, при признаках вирусного или бактериального заражения обращаться к специалисту. Меры профилактики, учитывая наследственный и часто врожденный характер первичных иммунодефицитов, ограничены. К ним относят медико-генетическое консультирование родителей перед зачатием ребенка (при отягощенной наследственности) и пренатальную генетическую диагностику. В период беременности женщинам необходимо избегать контакта с токсичными веществами или источниками вирусных инфекций.
Иммунодефицит у детей
Иммунодефицит у детей подразделяется на первичный (врожденный) и вторичный, вызванный экзогенными влияниями, тяжелыми инфекциями, ятрогенными факторами. Симптомы патологии включают частые и затяжные инфекционные заболевания различной локализации, задержку физического и психического развития, аллергические и аутоиммунные расстройства. Для диагностики назначают общеклинические анализы, расширенную иммунограмму, серологические и генетические тесты. Лечение иммунодефицитов состоит из заместительной и антибактериальной терапии, хирургических методов (трансплантация костного мозга и тимуса).
МКБ-10
Частота встречаемости иммунодефицитов в детском возрасте колеблется от 1:10000 до 1:100000. Вариативность данных обусловлена большим разнообразием клинических форм патологии и полиморфностью симптоматики. Легкие вторичные иммунодефициты обычно не диагностируются и не попадают в общую статистику. Лечение заболевания, особенно связанного с генетическим дефектом, представляет большие трудности. При тяжелых нарушениях иммунной системы нередки инвалидизации и летальные исходы.
Причины
Этиологическая структура первичных иммунодефицитов включает врожденные дефекты иммунной системы — как наследственные заболевания, так и пороки развития (эмбриопатии, фетопатии), возникшие под действием тератогенных факторов. Большинство случаев обусловлено генетическими аномалиями, передающимися аутосомно или сцепленными с половыми хромосомами. Причины вторичных форм более обширны и включают следующие категории:
- Недостаточность питания.Дефицит белка приводит к недостатку строительного материала для иммунных молекул, вследствие чего снижается активность гуморального звена защиты. При нехватке эссенциальных микроэлементов и витаминов нарушается функционирование Т-клеточной системы.
- Потеря иммуноглобулинов. В норме защитные молекулы постоянно циркулируют в крови, а при патологических процессах они усиленно выводятся из организма. Подобная ситуация наблюдается при нефротическом синдроме на фоне гломерулонефрита, массивных кровотечениях или лимфорее, обширных ожогах.
- Экзогенные вредные воздействия. Иммунитет ухудшается под влиянием физических факторов: ионизирующего излучения, высокой или низкой температуры, радиоактивных волн, что часто связано с местом проживания ребенка. Причиной иммунного расстройства также может послужить загрязнение окружающей среды пестицидами и промышленными выбросами.
- Инфекции. Иммунодефициты встречаются при заражении типичными детскими инфекциями (корью, краснухой, эпидемическим паротитом), могут быть результатом опасных хронических заболеваний — гепатита В, СПИДа, подострого склерозирующего энцефалита. Реже болезнь обусловлена бактериальной или протозойной инвазией.
- Злокачественные новообразования. Нарушения защитных сил организма возникают при любых лимфопролиферативных процессах, поскольку они затрагивают процесс образования и функционирования иммунокомпетентных клеток. Недостаточность гуморального звена преимущественно вызвана миеломной болезнью.
- Ятрогенные факторы. После спленэктомии страдает гуморальный иммунный ответ, поскольку селезенка является основным органом антителопродукции. Нарушения Т-клеточного звена зачастую отмечаются, когда проводится длительное лечение иммуносупрессорами, кортикостероидами, химиотерапевтическими препаратами.
Заболевание проявляется нарушениями в одном или нескольких звеньях иммунного ответа, в результате чего у ребенка повышается чувствительность к инфекциям. Если есть дефект иммуноглобулинов или комплемента, у детей в основном возникают рецидивирующие гнойные патологии, вызванные инкапсулированными бактериями. Дефицит клеточного звена иммунитета повышает частоту оппортунистических инфекций.
В детской иммунологии все иммунодефициты разделяют на 2 категории согласно причине появления: первичные (ПИД), связанные с врожденными факторами, и вторичные (ВИД), вызванные внешним воздействием или соматическим заболеванием. Вторые, в свою очередь, делятся на индуцированные, приобретенные и спонтанные. Среди ПИД выделяют 5 основных разновидностей:
- В-клеточные иммунодефициты. Самая распространенная форма, составляющая до 50% от общего числа патологий. Она обусловлена недостаточной продукцией защитных антител, которые в норме синтезируются при активации В-лимфоцитов. В эту категорию входят болезнь Брутона, гипер-IgM синдром, делеция генов тяжелых цепей иммуноглобулинов.
- Т-клеточные иммунодефициты. Вызваны снижением количества или нарушением функциональной активности Т-лимфоцитов. К ним принадлежат синдром Ди Джорджи, первичный дефицит CD4-клеток, дефицит ИЛ-2.
- Комбинированные иммунодефициты. Тяжело протекающие процессы, которые сочетают в себе признаки двух предыдущих форм. Встречаются в 30% случаев. К комбинированным патологиям относят синдром Вискотта-Олдрича, синдром Луи-Бар (атаксия-телеангиоэктазия).
- Дефекты фагоцитоза. При этой форме иммунодефицитов нарушается переваривание инфекционных агентов, возникают проблемы с антигенпрезентацией и выработкой антител. Сюда относят разные формы наследственных нейтропений.
- Дефекты комплемента. Нехватка этого фактора делает невозможным уничтожение антигена после присоединения к нему антитела, поэтому наблюдается несостоятельность В-лимфоцитов. Такие состояния составляют не более 2% от иммунодефицитов у детей.
Симптомы иммунодефицита у детей
Основным признаком иммунодефицитов является инфекционный синдром, который встречается у 95-100% детей. Заболевание отличается затяжным и рецидивирующим течением, а стандартное лечение не дает результатов. При первичных иммунодефицитах, которые протекают более тяжело, часто сочетается несколько инфекций разной локализации, что ухудшает состояние ребенка. Типичными маркерами являются гнойные отиты (6-8 раз в год), синуситы (4 раза в год), пневмонии (1 раз в полгода).
У детей с первичными иммунодефицитами, как правило, возникает задержка роста и нервно-психического развития. Она наиболее характерна для дефицитов клеточного звена, которые сопровождаются хронической диареей, мальабсорбцией и мальдигестией. У 18% детей болезнь дополняется системными аллергическими реакциями, в 6% случаев — аутоиммунными поражениями тканей.
Клиническая картина иммунодефицитов отличается при нарушениях Т-клеточного или В-клеточного звеньев иммунитета. В первом случае симптомы проявляются сразу после рождения, у младенца выявляются кандидоз полости рта, гнойничковые высыпания на коже, затяжная диарея. Позже присоединяются рекуррентные вирусные и микотические инфекции, наблюдается гепатоспленомегалия и костные аномалии.
Для дефицита В-клеточного иммунитета характерно начало после 6-месячного возраста, когда из крови ребенка исчезают материнские антитела. Типичным симптомом являются затяжные респираторные инфекции, вызванные бактериальной флорой или микоплазмами. Если лечение отсутствует, начинаются менингоэнцефалиты, артриты, энтеровирусные гастроэнтериты.
Вторичный иммунодефицит протекает в легкой форме, если он не спровоцирован ВИЧ-инфекцией или онкологическими процессами. При ВИД повышается частота ОРВИ и кишечных инфекций, болезни хуже поддаются терапии, а выздоровление наступает медленнее. Больных относят к группе длительно и часто болеющих детей. При отсутствии медицинской помощи и коррекции иммунитета возможно отставание в физическом развитии, снижается успеваемость в школе.
При тяжелых первичных иммунодефицитах и отсутствии адекватной терапии смертность достигает 30-50% в первые годы жизни ребенка. Пациенты, которым удалось выжить, зачастую становятся инвалидами из-за последствий инфекционных болезней, неизлечимых злокачественных или аутоиммунных процессов. У большинства детей с ПИД определяются интеллектуальные нарушения разной степени выраженности.
При первом обследовании ребенка иммунолог-аллерголог собирает подробный анамнез о всех перенесенных заболеваниях и полученных прививках, факторах риска беременности и родов, материально-бытовых и экологических условиях проживания. Для обнаружения дефектов иммунного ответа и установления их причин назначают ряд инструментальных и лабораторных методов, основными из которых являются:
- Иммунограмма. Врач оценивает количество Т- и В-лимфоцитов и их соотношение, смотрит на уровни разных типов иммуноглобулинов. Полученные показатели сопоставляются с симптоматикой и данными общеклинических тестов. Для оценки тяжести и течения иммунодефицита выполняют несколько иммунограмм в динамике.
- Анализы крови. Гемограмма показывает признаки воспалительного процесса, по наличию лейкопении судят о недостаточном иммунном ответе. В биохимическом исследовании интересует значение острофазовых белков, протеинограммы. Ставится тест на ВИЧ, ИФА или РИФ на другие специфические инфекции.
- Расширенные тесты. Для выявления клеточного иммунодефицита проводится исследование на Т-рецепторные эксцизионные кольца, серологическое HLA-типирование. Чтобы оценить нарушения фагоцитоза, применяется проточная цитометрия, оценка хемотаксической активности нейтрофилов. Недостаточность системы комплемента определяется с помощью теста CH50.
- Пренатальная диагностика. Многие ПИД удается выявить во время беременности, если у родителей отягощена наследственность. Для пренатального скрининга осуществляют биопсию ворсин хориона, цитологию амниотической жидкости или анализ фетальной крови.
Лечение иммунодефицита у детей
Консервативная терапия
Лечебная схема подбирается с учетом формы патологии, причины и степени ее тяжести. Для большинства вторичных иммунодефицитов основу терапии составляет ликвидация факторов риска и устранение хронических вялотекущих инфекций. Это позволяет нормализовать работу иммунной системы. Лечение первичных иммунодефицитов у детей сложное и комплексное, оно включает 3 основных направления:
- Заместительная терапия. При дефиците гуморального звена рекомендуют длительное и постоянное введение гамма-глобулинов с антителами. Таким образом работа иммунной системы восстанавливается, пациенты доживают до зрелых лет и ведут активный образ жизни.
- Антибиотикотерапия. Лечение противомикробными препаратами применяется для ликвидации основного кинического проявления иммунодефицитов — бактериальных и грибковых инфекций. Чтобы минимизировать риски длительного употребления антибиотиков, показаны пробиотики, антимикотики.
- Иммуномодулирующее лечение. Использование иммуномодуляторов у детей, страдающих первичными иммунодефицитами, не так эффективно, как при вторичных нарушениях иммунитета, но в ряде случаев препараты усиливают эффективность заместительного лечения. Они активируют систему фагоцитоза, нормализуют функции Т-лимфоцитов.
Хирургическое лечение
При нарушении В-клеточной системы иммунитета перспективным методом терапии является пересадка костного мозга. Процедура ликвидирует врожденные аномалии, нормализует выработку и активность лимфоцитов, оказывает пожизненный лечебный эффект. Для коррекции патологии Т-лимфоцитов производят трансплантацию тимуса как основного источника иммунных клеток у детей.
Прогноз при иммунодефицитах сомнительный, но раннее начало терапии позволяет скорректировать нарушения и улучшить качество жизни больных. Профилактика ПИД включает медико-генетическое консультирование пар с отягощенным семейным анамнезом, антенатальную охрану плода. Для предупреждения вторичных иммунодефицитов необходимо своевременное лечение инфекционных и соматических заболеваний, устранение негативного влияния неблагоприятных внешних факторов.
1. Первичные иммунодефициты. Актуальные проблемы диагностики и лечения/ Л.Н. Ончул// Здоровье ребенка. — 2015.
2. Введение в клиническую иммунологию и аллергологию. Первичные и вторичные иммунодефицитные состояния. Методические рекомендации/ Е.В. Нусинов. — 2012.
3. Первичные и вторичные иммунодефициты/ Л.М. Карзакова, О.М. Мучукова, Н.Л. Рассказова// В помощь практикующему врачу. — 2008.
Вторичные иммунодефициты
Вторичные иммунодефициты - это болезни иммунной системы, возникающие у детей и взрослых, не связанные с генетическими дефектами и характеризующиеся развитием повторных, затяжных инфекционно-воспалительных патологических процессов, плохо поддающихся этиотропному лечению. Выделяют приобретенную, индуцированную и спонтанную форму вторичных иммунодефицитов. Симптоматика обусловлена снижением иммунитета и отражает конкретное поражение того или иного органа (системы). Диагностика основана на анализе клинической картины и данных иммунологических исследований. В лечении используется вакцинация, заместительная терапия, иммуномодуляторы.
Вторичные иммунодефициты - нарушения иммунитета, которые развиваются в поздний постнатальный период и не связаны с генетическими дефектами, возникают на фоне исходно нормальной реактивности организма и обусловлены конкретным причинным фактором, вызвавшим развитие дефекта иммунной системы.
Причинные факторы, приводящие к нарушению иммунитета, многообразны. Среди них - длительное неблагоприятное воздействие внешних факторов (экологических, инфекционных), отравления, токсическое действие лекарственных препаратов, хронические психоэмоциональные перегрузки, недоедание, травмы, оперативные вмешательства и тяжелые соматические заболевания, приводящие к нарушению работы иммунной системы, снижению сопротивляемости организма, развитию аутоиммунных расстройства и новообразований.
Течение заболевания может быть скрытым (жалобы и клиническая симптоматика отсутствует, наличие иммунодефицита выявляется только при лабораторном исследовании) или активным с наличием признаков воспалительного процесса на коже и в подкожной клетчатке, верхних дыхательных путях, легких, мочеполовой системе, пищеварительном тракте и в других органах. В отличие от преходящих сдвигов в иммунитете, при вторичном иммунодефиците патологические изменения сохраняются и после ликвидации возбудителя заболевания и купирования воспаления.
Привести к выраженному и стойкому снижению иммунной защиты организма могут самые разнообразные этиологические факторы - как внешние, так и внутренние. Вторичный иммунодефицит нередко развивается при общем истощении организма. Длительное недоедание с дефицитом в рационе белка, жирных кислот, витаминов и микроэлементов, нарушения всасывания и расщепления питательных веществ в пищеварительном тракте приводят к нарушению процессов созревания лимфоцитов и снижают сопротивляемость организма.
Тяжелые травматические повреждения опорно-двигательного аппарата и внутренних органов, обширные ожоги, серьезные оперативные вмешательства, как правило, сопровождаются кровопотерей (наряду с плазмой теряются белки системы комплемента, иммуноглобулины, нейтрофилы и лимфоциты), а выброс кортикостероидных гормонов, предназначенных для поддержания жизненно-важных функций (кровообращения, дыхания и др.) еще больше угнетает работу иммунитета.
Ведущую роль в развитии вторичных иммунодефицитов играют хронические вирусные инфекционные заболевания (ВИЧ, цитомегаловирусная инфекция, вирусы Эпштейна-Барр и другие герпес-вирусы, реже корь, краснуха, вирусные гепатиты и т. д.), вызывая подавление клеточного и гуморального иммунитета. Неблагоприятное влияние на иммунный статус оказывает бактериальная и грибковая инфекция, паразитарные заболевания.
Выраженное нарушение обменных процессов в организме при соматических заболеваниях (хронические гломерулонефриты, почечная недостаточность) и эндокринных расстройствах (диабете, гипо- и гипертиреозе) приводит к угнетению хемотаксиса и фагоцитирующей активности нейтрофилов и, как следствие, к вторичному иммунодефициту с возникновением воспалительных очагов различной локализации (чаще это пиодермии, абсцессы и флегмоны).
Снижается иммунитет при длительном приеме некоторых лекарственных препаратов, обладающих подавляющим действием на костный мозг и кроветворение, нарушающих формирование и функциональную активность лимфоцитов (цитостатики, глюкокортикоиды и пр.). Схожий эффект оказывает и лучевое воздействие.
При злокачественных новообразованиях происходит продукция опухолью иммуномодулирующих факторов и цитокинов, в результате чего снижается количество T-лимфоцитов, увеличивается активность клеток-супрессоров, угнетается фагоцитоз. Ситуация усугубляется при генерализации опухолевого процесса и метастазировании в костный мозг. Вторичные иммунодефициты нередко развиваются при аутоиммунных заболеваниях, острых и хронических отравлениях, у людей старческого возраста, при длительных физических и психоэмоциональных перегрузках.
Симптомы вторичных иммунодефицитов
Клинические проявления характеризуются наличием в организме затяжного, устойчивого к этиотропной терапии хронического инфекционного гнойно-воспалительного заболевания на фоне снижения иммунной защиты. При этом изменения могут быть преходящими, временными или имеют необратимый характер. Выделяют индуцированную, спонтанную и приобретенную формы вторичных иммунодефицитов.
К индуцированной форме относят нарушения, возникающие вследствие конкретных причинных факторов (рентгеновское излучение, длительный прием цитостатиков, кортикостероидных гормонов, тяжелые травмы и обширные хирургические операции с интоксикацией, кровопотерей), а также при тяжелой соматической патологии (сахарный диабет, гепатиты, циррозы, хроническая почечная недостаточность) и злокачественных опухолях.
При спонтанной форме видимый этиологический фактор, вызвавший нарушение иммунной защиты, не определяется. Клинически при этой форме отмечается наличие хронических, трудно поддающихся лечению и часто обостряющихся заболеваний верхних дыхательных путей и легких (синуситы, бронхоэктазы, пневмонии, абсцессы легких), пищеварительного тракта и мочевыводящих путей, кожи и подкожной клетчатки (фурункулы, карбункулы, абсцессы и флегмоны), которые вызваны условно-патогенными микроорганизмами. В отдельную - приобретенную форму выделен синдром приобретенного иммунодефицита (СПИД), вызванный ВИЧ-инфекцией.
О наличии вторичного иммунодефицита при всех стадиях можно судить по общим клиническим проявлениям инфекционно-воспалительного процесса. Это может быть длительный субфебрилитет или лихорадка, увеличение лимфатических узлов и их воспаление, боли в мышцах и суставах, общая слабость и утомляемость, снижение работоспособности, частые простудные заболевания, повторные ангины, часто рецидивирующие хронические гаймориты, бронхиты, повторные пневмонии, септические состояния и т. п. При этом эффективность стандартной антибактериальной и противовоспалительной терапии невысока.
Выявление вторичных иммунодефицитов требует комплексного подхода и участия в процессе диагностики различных врачей-специалистов - аллерголога-иммунолога, гематолога, онколога, инфекциониста, оториноларинголога, уролога, гинеколога и др. При этом учитывается клиническая картина заболевания, свидетельствующая о наличии хронической инфекции, трудно поддающейся лечению, а также выявление оппортунистических инфекций, вызванных условно-патогенными микроорганизмами.
Необходимо изучение иммунного статуса организма с использованием всех доступных методик, применяемых в аллергологии и иммунологии. Диагностика основана на исследовании всех звеньев иммунитета, участвующих в защите организма от инфекционных агентов. При этом изучается фагоцитарная система, система комплемента, субпопуляции T- и B-лимфоцитов. Исследования выполняются путем проведения тестов первого (ориентировочного) уровня, позволяющего выявить грубые общие нарушения иммунитета и второго (дополнительного) уровня с идентификацией конкретного дефекта.
При проведении скрининговых исследований (тесты 1 уровня, которые можно выполнить в любой клинико-диагностической лаборатории) можно получить информацию об абсолютном количестве лейкоцитов, нейтрофилов, лимфоцитов и тромбоцитов (встречается как лейкопения, так и лейкоцитоз, относительный лимфоцитоз, повышенная СОЭ), уровне белка и сывороточных иммуноглобулинов G, A, M и E, гемолитической активности комплемента. Кроме того, можно выполнить необходимые кожные пробы для выявления гиперчувствительности замедленного типа.
При углубленном анализе вторичного иммунодефицита (тесты 2 уровня) определяется интенсивность хемотаксиса фагоцитов, завершенность фагоцитоза, субклассы иммуноглобулинов и специфические антитела к конкретным антигенам, продукция цитокинов, индукторов T-клеток и другие показатели. Анализ полученных данных должен проводиться только с учетом конкретного состояния данного пациента, сопутствующих заболеваний, возраста, наличия аллергических реакций, аутоиммунных расстройств и других факторов.
В процессе обследования проводится дифференциальная диагностика с первичными иммунодефицитами, затяжными инфекционными заболеваниями вирусной, бактериальной, грибковой и паразитарной природы, соматическими заболеваниями, эндокринными расстройствами, новообразованиями.
Лечение вторичных иммунодефицитов
Эффективность лечения вторичных иммунодефицитов зависит от правильности и своевременности выявления этиологического фактора, вызвавшего появление дефекта иммунной системы и возможности его устранения. Если нарушение иммунитета возникло на фоне хронической инфекции, применяются меры по ликвидации очагов воспаления с использованием антибактериальных препаратов с учетом чувствительности к ним возбудителя, проведением адекватной противовирусной терапии, использованием интерферонов и т. п. Если причинный фактор - недостаточное питание и авитаминоз, проводятся мероприятия по разработке правильного рациона питания со сбалансированным сочетанием белков, жиров, углеводов, микроэлементов и необходимой калорийности. Также устраняются имеющиеся нарушения обмена веществ, восстанавливается нормальный гормональный статус, проводится консервативное и оперативное лечение основного заболевания (эндокринная, соматическая патология, новообразования).
Важный компонент лечения больных вторичным иммунодефицитом - иммунотропная терапия с использованием активной иммунизации (вакцинации), заместительного лечения препаратами крови (внутривенное введение плазмы, лейкоцитарной массы, человеческого иммуноглобулина), а также использованием препаратов иммунотропного действия (иммуностимуляторов). Целесообразность назначения того или иного лечебного средства и подбор дозировки осуществляется врачом аллергологом-иммунологом с учетом конкретной ситуации. При преходящем характере иммунных нарушений, своевременном выявлении вторичного иммунодефицита и подборе правильного лечения, прогноз заболевания может быть благоприятным.
Читайте также:
- Синдром Бернута (Bernuth)
- Местная иммунокоррекция при эндофтальмите. Повышение местного иммунитета при внутриглазной инфекции
- Подслизистые расщелины неба и нарушения речи при них
- Термины лучевой диагностики опухоли органов грудной клетки
- Инфекции вызванные оральными стрептококками и энтерококками: диагностика, лечение, профилактика
