Макролиды и кетолиды для лечения заболеваний уха, горла, носа
Добавил пользователь Alex Обновлено: 21.01.2026
О.Р. Бакумова, Е.Г. Шахова
Кафедра оториноларингологии Волгоградского государственного медицинского университета, Волгоград
Современные макролидные антибиотики прочно завоевали свое место в лечении воспалительных заболеваний респираторного тракта благодаря высокой антибактериальной активности в отношении грамположительных кокков, возбудителей коклюша, дифтерии, моракселл, легионелл, кампилобактеров, листерий, спирохет, хламидий, микоплазм, уреаплазм, анаэробов и некоторых простейших. Сочетание дополнительных эффектов, не ассоциированных с антимикробным влиянием, открывает перспективы в применении макролидов. В настоящем обзоре более подробно представлены характеристики рокситромицина, который успешно применяется в клинике благодаря оптимальным параметрам фармакокинетики и хорошей переносимости. На сегодняшний день на российском фармацевтическом рынке представлено лишь несколько генерических препаратов рокситромицина, в связи с этим определенный интерес вызывает появление препарата Эспарокси компании «Esparma».
Макролидные антибиотики используются в практической медицине более 60 лет и до сих пор остаются наиболее безопасными антимикробными препаратами. Их применение при лечении воспалительных заболеваний верхних и нижних дыхательных путей обусловлено высокой активностью и в отношении т.н. атипичных возбудителей [1]. Увеличение интереса к макролидным антибиотикам связано с появлением на фармацевтическом рынке полусинтетических 14- и 15-членных препаратов этой группы [2].
Важно понимать, что нет существенных различий в антимикробной активности между эритромицином и современными макролидами. Главными их преимуществами являются особенности фармакокинетики, значительно лучшая переносимость и безопасность для больного [3]. Такие фармакокинетические показатели макролидов, как пик сывороточной концентрации препарата, время его достижения, площадь под кривой изменения концентрации вещества в сыворотке крови, зависят от химической структуры препаратов [4].
Наибольшие показатели абсорбции наблюдаются у рокситромицина. При приеме 150 мг препарата его максимальная концентрация в сыворотке крови составляет от 5,4 до 7,9 мг/л, что превышает максимальную концентрацию эритромицина (1,9-3,8 мг/л) после приема 500 мг в виде микрокапсулированной формы. По сравнению с кларитромицином и азитромицином прием 300 мг рокситромицина обеспечивал концентрацию в крови 11 мг/л, что выше концентрации кларитромицина (2,3 мг/л) после приема 500 мг и такой же дозы азитромицина (пиковая сывороточная концентрация - 0,4 мг/л). При этом прием 150 мг рокситромицина обеспечивает в 4 раза более высокую концентрацию в сыворотке крови, чем 1000 мг джозамицна [5].
Указанные значительные различия в абсорбции макролидов могут наблюдаться из-за различной степени ионизации молекулы в кислой среде желудка и «дистализации» всасывания в тонкой кишке. При этом прием пищи (стандартный завтрак) способен снижать всасываемость эритромицина, рокситромицина и спирамицина, не изменяет абсорбцию кларитромицина и ускоряет - азитромицина [6].
Одним из индивидуальных показателей фармакокинетики макролидов является наличие второго пика концентрации в плазме крови. Последний отмечается после накопления препарата в желчи с последующим быстрым или более медленным высвобождением. Временной период между первым и вторым пиками составляет не более 3 часов.
После попадания в плазму крови макролиды на 90 % связываются с альбуминами, липопротеидами и в большей степени с α1-кислым гликопротеином. Метаболизм макролидов происходит в печени; кроме метаболита кларитромицина - 14-гидроксикларитромицина, который является фармакологически активным метаболитом, метаболиты других макролидов неактивны.
Выведение макролидных антибиотиков происходит с желчью и не более 10 % с мочой. Период полувыведения рокситромицина у пациентов со сниженной клубочковой фильтрацией увеличивается в 1,8 раза [6].
Биодоступность препаратов в большей степени объясняет клиническую эффективность макролидов, но при этом необходимо учитывать несколько особенностей. Во-первых, макролиды быстро и активно захватываются клетками и тканевыми структурами, максимально - при парентеральном пути введения. Накопление в больших концентрациях внутри клеток обеспечивает бактерицидный эффект в отношении внутриклеточных возбудителей. Депонируясь в макрофагах и нейтрофилах, антибиотики поступают в очаг воспаления, а также повышают фагоцитарную активность [7].
Во-вторых, для этой группы антибиотиков характерен «индивидуальный» пик концентрации в плазме. Это привело к пониманию наличия т.н. парадокса макролидов, который состоит в наличии различий между эффективностью препаратов in vivo и in vitro.
Антибактериальная активность рокситромицина
Известно, что рокситромицин реализует свое антибактериальное действие путем связывания с 50S-субъединицей рибосомы микробной клетки и нарушения синтеза белка. При этом установлено, что его специфичность к участку связывания меньше, чем у эритромицина [4]. Однако этот «проигрыш» компенсируется лучшими фармакокинетическими параметрами препарата.
Современные макролидные антибиотики прочно завоевали место в лечении воспалительных заболеваний респираторного тракта благодаря высокой антибактериальной активности в отношении грамположительных кокков, возбудителей коклюша, дифтерии, моракселл, легионелл, кампилобактеров, листерий, спирохет, хламидий, микоплазм, уреаплазм, анаэробов и некоторых простейших.
Спектр антибактериальной активности рокситромицина принципиально не отличается от эритромицина. Рокситромицин оказывает различную активность в отношении метициллинчувствительных штаммов Staphylococcus aureus, уступая в этом эритромицину, не действует на MRSA (Methicillin-resistant Staphylococcus aureus), Streptococcus haemolyticus, Staphylococcus epidermidis и Staphylococcus hominis. На пневмококк рокситромицин действует эффективнее эритромицина [7].
Рокситромицин активен в отношении Listeria monocytogenes и Corynebacterium diphtheriae, высокоактивен в отношении Moraxella catarrhalis. Одним из основных преимуществ рокситромицина является высокая активность в отношении Mycoplasma pneumoniae и Chlamydophila pneumoniae. Рокситромицин практически не действует на грамотрицательные бактерии семейства Enterobacteriaceae, Pseudomonas spp. и Acinetobacter spp.
Важным дополнительным свойством макролидов является постантибиотический эффект в отношении основных возбудителей инфекций дыхательных путей (S. aureus, Streptococcus pyogenes, Streptococcus pneumoniae и Haemophilus influenzae). Длительность постантибиотического эффекта рокситромицина сопоставима с эритромицином. Показано, в частности, что в условиях влияния субингибирующих концентраций рокситромицина in vitro тормозится выработка коагулазы, лецитиназы, дезоксирибонуклеазы и гемолизинов золотистым стафилококком [8].
Неантибактериальные эффекты макролидов
Неантибактериальные эффекты макролидов связаны с противовоспалительным и иммунотропным влиянием. Данные эффекты отмечены только у 14- и 15-членных макролидов (см. таблицу).
Рокситромицин, так же как и другие макролиды, способен изменять функции нейтрофилов. Показано, что он усиливает фагоцитоз и киллинг золотистого стафилококка, ингибирует окислительный «стресс» [10].
Противовоспалительный эффект макролидов обусловлен подавлением активности нейтрофилов, которое осуществляется благодаря супрессии факторов транскрипции нуклеарного фактора kappa В (NF-kB) и активирующего протеина-1, а также последующим снижением синтеза цитокина ИЛ-8, который и запускает активность нейтрофилов [10, 11]. Противовоспалительное действие рокситромицина также связано с антиоксидантными свойствами и способностью ингибировать выработку провоспалительных цитокинов (ИЛ-3, -4, ФНО-α) [9]. По выраженности противовоспалительного эффекта он превосходит кларитромицин и азитромицин [12].
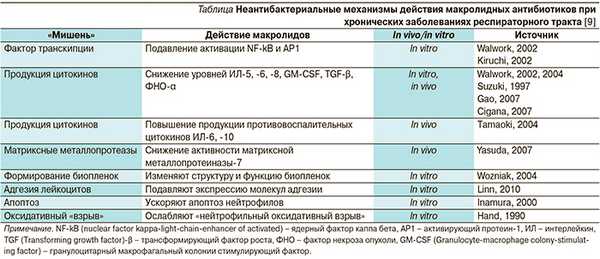
Реализацию этих эффектов рокситромицина в клинике можно наблюдать при бронхиальной астме, протекающей без клинических симптомов сопутствующей бактериальной инфекции. Отмечен лучший контроль бронхиальной астмы, при этом попытка заменить его другим макролидом (тролеандомицином) оказалась неудачной [13].
В исследовании U. Hatipoglu (2004) показано, что рокситромицин снижает чувствительность бронхов к бронхоспастическому действию метахолина [13].
Главным механизмом развития резистентности бактерий к 14-членным макролидам является модификация мишени связывания антибиотика на уровне рибосомы. Поэтому микроорганизмы, выработавшие резистентность к эритромицину, устойчивы и к рокситромицину 15.
Безопасность макролидов
Макролиды остаются одной из самых безопасных групп антибиотиков. К наиболее частым побочным эффектам относятся симптомы со стороны желудочно-кишечного тракта (тошнота, тяжесть в эпигастральной области), которые, как правило, выражены умеренно и быстро проходят при приеме лекарств после еды [17]. Прокинетическим эффектом обладают 14-членные макролиды, в наибольшей степени - эритромицин. Он рассматривается как агонист рецепторов, чувствительных к эндогенному стимулятору моторики - мотилину [18]. Клинически прокинетический эффект может проявляться побочными эффектами в виде болей в животе, тошноты, рвоты, диареи. Даже при длительном применении макролидов редки случаи развития дисбактериозов желудочно-кишечного тракта, отсутствуют подавление гемопоэтических реакций, кардиотоксичность и гепатотоксичность 20.
Низкая токсичность макролидов позволяет использовать их при беременности, в период лактации, а также в педиатрической практике для лечения детей, в т.ч. новорожденных [22].
За последнее время все больше внимания уделяется группе препаратов, относящихся к макролидам, с учетом перспективы их использования в оториноларингологии. Макролиды обладают рядом свойств, довольно привлекательных для лечения ЛОР-патологии. Это широкая антибактериальная активность по отношению к респираторным патогенам и атипичным возбудителям. Быстро и интенсивно накапливаясь в организме, они легко проникают через слизистую оболочку дыхательных путей и уха. Отдельным достоинством этих препаратов служит хорошая концентрация в воспаленных тканях, экссудате барабанной полости и, что особенно важно, - в лимфоидной ткани. Весьма существенно, что в большинстве случаев у штаммов стафилококка, устойчивых к пенициллину, аминогликозидам и тетрациклину, чувствительность к макролидам сохраняется.
Среди заболеваний верхних дыхательных путей значительную долю составляют воспалительные заболевания ЛОР-органов - синуситы, тонзиллиты, отиты. Неуклонный рост их числа ставит проблемы антибиотикотерапии инфекционной патологии ЛОР-органов на одно из главных мест в системе медикаментозного лечения. Так, риносинусит (РС) - это одно из наиболее распространенных заболеваний в США. По результатам проведенного национального обследования здоровья было установлено, что 14 % человек в популяции болеют РС и число больных продолжает неуклонно расти [23]. Эти данные основаны на обращаемости пациентов, поэтому они не отражают истинной заболевае-мости.
РС означает воспаление слизистой оболочки полости носа и околоносовых пазух. РС - часто встречающееся заболевание верхних дыхательных путей, оказывающее значительное влияние на качество жизни населения, расходы на здравоохранение и экономический ущерб от невыхода на работу и снижения производительности труда. Ежегодно в США тратится около 6 млрд долл. на лечение РС [24].
Результаты недавно проведенных в Канаде исследований показали, что качество жизни пациентов с хроническим риносинуситом (ХРС) сопоставимо с таковым жизни пациентов, страдающих артритом, бронхиальной астмой, воспалительными заболеваниями кишечника и онкологическими заболеваниями [25]. В 2006 г. в Канаде было выписано 2,89 млн рецептов на антибактериальные препараты, из них приблизительно 2/3 - для лечения острого РС и 1/3 - для лечения ХРС [4].
Острым считается РС продолжительностью до 4 недель. Рецидивирующий острый синусит характеризуется развитием от 4 и более эпизодов в год продолжительностью не мене 7 дней.
В этиологии острого РС преобладает вирусная инфекция, которая в 0,5-2,0 % случаев осложняется бактериальной [26]. При лечении вирусных РС проводится симптоматическая терапия с использованием противовоспалительных средств, деконгестантов. Среди возбудителей острого бактериального РС наиболее значимыми остаются S. pneumoniae (41 %) и H influenzae (35 %). Эти возбудители наиболее часто выделяются в чистой культуре, но изредка встречаются вместе или в комбинации с другими микроорганизмами. М. catarrhalis редко высеваются у взрослых людей, но у детей на его долю приходится около 25 %. Другими микроорганизмами, вызывающими развитие РС, являются S. pyogenes, S. aureus, грамотрицательные бактерии, анаэробы 28.
Клинические проявления острого РС: заложенность носа, выделения из носа, дискомфорт, боль в проекции пазухи, гипосмия. Провести дифференциальную диагностику вирусного и бактериального РС достаточно сложно, но существует ряд предикторов, которые позволяют с большей вероятностью определять бактериальную природу заболевания. В диагностике острого бактериального РС значительную роль играет эндоскопическое исследование полости носа и проведение бактериологического исследования аспирата из верхнечелюстной пазухи. Часто антибактериальная терапия назначается эмпирически с учетом наиболее вероятного возбудителя, данных о резистентности возбудителя и с учетом коморбидного фона пациента [29].
Для лечения острого бактериального РС традиционно препаратами выбора считаются β-лактамные антибиотики. Амоксициллин - наиболее популярный антибиотик, но в США 20-30 % случаев H. Influenzae и M. catarrhalis устойчивы к амоксициллину из-за выработки β-лактамаз. При неэффективности амоксициллина широкое применение получил Амоксиклав (амоксициллин/клавулановая кислота). Единственным недостатком препарата служит развитие гастроинтестинальных побочных эффектов, что вынуждает пациентов прекращать лечение. В качестве альтернативных антибиотиков рекомендуют цефалоспорины II-III поколений. За последнее время возросло количество инфекций, обусловленных пенициллинрезистентными штаммами S. pneumoniae.
В случае непереносимости препаратов пенициллинового и цефалоспоринового рядов для лечения используют макролиды. Как и другие новые макролиды, рокситромицин заслуживает особого внимания в лечении инфекций респираторного тракта.
В открытом рандомизированном исследовании 60 пациентов с острым или острым рецидивирующим синуситом бактериологический и клинический эффекты рокситромицина (150 мг два раза в сутки) сравнивали с действием Амоксиклава (625 мг три раза в сутки). Клиническая эффективность рокситромицина отмечалась в 93,1 %, Амоксиклава - в 88,8 %.
Переносимость рокситромицина была лучше, чем Амоксиклава. В группе пациентов, принимавших рокситромицин, было всего 3,4 % гастроинтестинальных побочных эффектов, в группе пациентов, принимавших Амоксиклав, - 25,9 % [30].
ХРС диагностируют, когда специфические синоназальные симптомы сохраняются более 12 недель без полного разрешения всех патологических симптомов и подтверждаются результатами эндоскопических исследований полости носа, радиографических исследований полости носа и околоносовых пазух.
Если ОРС практически не вызывает особых проблем в плане диагностики и лечения, то ХРС расценивают сегодня как серьезную медико-социальную проблему [32]. На основании клинических симптомов ХРС делят на два типа: ХРС с назальным полипозом (ХРС + НП) и ХРС без полипоза (ХРС - НП). Отдельную группу составляет фенотипический вариант НП при муковисцидозе [32, 33]. Особенно тяжелым течением отличается вариант ХРС + НП, сочетающийся с непереносимостью ацетилсалициловой кислоты, чаще всего ассоциированный с тяжелой формой бронхиальной астмы (аспириновая триада). Лечение больных ХРС представляет большую проблему.
Несмотря на длительное использование антибиотика, что в определенной мере противоречит правилам рациональной антибиотикотерапии, назначение макролидов в курсе комплексной терапии на срок более 3 месяцев доказано и целесообразно. Макролиды эффективны при лечении ХРС, особенно у пациентов с низким уровнем иммуноглобулина E [35, 36].
А.И. Ерохин и М.С. Гостев (2013) сообщили о хорошей клинической эффективности и безопасности рокситромицина при использовании больными одонтогенным гайморитом в однократной суточной дозе 300 мг. Несомненное преимущество рокситромицина - его однократный прием в сутки, что повышает приверженность пациентов лечению и увеличивает практическую эффективность препарата [37, 38].
Рокситромицин удовлетворяет критериям эффективности, безопасности, удобства применения и фармакоэкономическим параметрам, предъявляемым к антибактериальным препаратам, что делает его востребованным в лечении острой и хронической воспалительной ЛОР-патологии.
Литература
Об авторах / Для корреспонденции
Макролиды и кетолиды для лечения заболеваний уха, горла, носа
Овчинников А.Ю., Дженжера Г.Е., Овчаренко С.И.
Кафедра болезней уха, горла и носа ММА им. И.М. Сеченова, Москва. Кафедра факультетской терапии ММА им. И.М. Сеченова, Москва.
Подчеркивается функциональная связь полости носа и околоносовых пазух с другими органами и системами, в первую очередь, с бронхолегочной. Число заболеваний верхних дыхательных путей, в частности хронического риносинусита растет пропорционально количеству заболеваний нижних дыхательных путей. В этиологии бактериального обострения риносинусита и хронической обструктивной болезни легких основная роль отводится Streptococcus pneumoniae, Haemophilus influenzae, реже встречаются Moraxella catarrhalis, а также атипичная флора. Перспективны для лечения инфекций респираторного тракта ?-лактамы (аминопенициллины, цефалоспорины), азалиды-макролиды и современные фторхинолоны с антипневмококковой активностью. Наибольшее “перекрытие” спектра возбудителей прослеживается у азалидных антибиотиков (азитромицин) из группы макролидов.
Разнообразие клинической картины хронического риносинусита (РС) настолько велико, что его вполне можно рассматривать как синдром с характерными стойкими симптомами. В настоящее время под определением “хронический РС” следует понимать воспаление слизистой оболочки полости носа и околоносовых пазух (ОНП) в течение не менее 90 дней (12 недель), подтвержденное рентгенографическими методами исследования, желательно компьютерной томографией околоносовых пазух и эндоскопическим обследованием полости носа. Пациенты с предположительным или установленным диагнозом хронического РС чаще всего предъявляют жалобы на заложенность носа, отсутствие обоняния, обильное отделяемое из полости носа, иногда неожиданного для пациента цвета, неприятные тянущие боли в области лба или глаз.
В настоящее время распространенность хронического РС среди населения планеты велика, и зачастую его обострения становятся причиной нетрудоспособности, что влечет за собой весьма ощутимые экономические потери. Причиной значительной распространенности данного заболевания являются многочисленные предрасполагающие факторы, начиная от врожденных, возможно даже незначительных, нарушений иммунного статуса и завершая ухудшающейся экологией окружающей среды. Генетически обусловленные факторы вкупе с ухудшающейся экологией, чрезмерной запыленностью промышленных центров, плохими бытовыми условиями безусловно влияют не только на верхние дыхательные пути (ВДП), но и на дыхательную систему в целом.
Еще с начала прошлого века ученые отметили тесную взаимосвязь ВДП и нижних дыхательных путей (НДП). Для обозначения тесных взаимоотношений патологических процессов в дыхательных путях Wassen в 1929 г. впервые предложил термин “синобронхит”. В отечественной литературе для обозначения связи заболеваний носа и околоносовых пазух с бронхолегочной патологией использовались термины “синусопневмония” [1], “синобронхопульмональный синдром” [2], “ринобронхопульмональный синдром” [3], “ринобронхиальный симптомокомплекс” [4].
С развитием науки указанные взаимосвязи уточнялись и корректировались. На данный момент известно, что ВДП и НДП имеют более чем тесные анатомо-физиологические связи на ультраструктурном уровне и по сути являются единым целым. Не приходится удивляться тому, что рост количества заболеваний ВДП, в частности хронического РС, пропорционален росту такового заболеваний НДП, и эту тенденцию не удается нарушить, несмотря на совместные усилия ведущих экспертов всего мира.
Тесные и разноплановые взаимоотношения между ВДП и НДП особенно ярко прослеживаются у больных аллергическим ринитом и бронхиальной астмой (БА). По данным различных авторов, у 20-0 % больных с круглогодичным аллергическим ринитом имеются симптомы БА [5, 6]. С другой стороны, у 80-8 % больных БА отмечается патология ВДП, причем чаще всего наблюдаются поражения носа и ОНП, среди которых в 50-7 % случаев встречается аллергический ринит с полипозным изменением слизистой оболочки [7-]. Несколько в тени в этой ситуации оказалась проблема взаимосвязей хронической обструктивной болезни легких (ХОБЛ) и РС.
ХОБЛ -это заболевание, характеризующееся ограничением скорости воздушного потока, которое обратимо не полностью. Ограничение скорости воздушного потока является прогрессирующим и связано с патологическим воспалительным ответом легких [10]. ХОБЛ диагностируется более чем у 5 % взрослого населения и занимает четвертое место в мире в качестве причины смерти [11]. Распространенность данного заболевания неуклонно растет, и к 2020 г. ХОБЛ как причина смерти, вероятно, займет 3-е место [12]. Факторы риска ХОБЛ весьма многочисленны и схожи с таковыми хронического РС. Ведущим фактором риска является курение.
Освещение нюансов сочетания ХОБЛ и РС началось в литературе недавно по сравнению с проблемой взаимосвязи ВДП и НДП в целом. Скорее всего связано это с тем, что ХОБЛ как самостоятельная нозологическая единица была выделена довольно поздно, однако накопленные данные о факторах риска, механизмах воспаления, характере микрофлоры позволяют с определенной долей уверенности говорить о том, что ХОБЛ и РС - это единое заболевание.
По данным различных исследований с использованием анкет, 40-88 % пациентов с ХОБЛ предъявляют те или иные жалобы со стороны носа 15. Группа ученых Академического медицинского центра Амстердама на примере 1145 пациентов старше 40 лет с хронической бронхиальной обструкцией установили, что диагноз РС в данной группе встречается значительно чаще (12,4 %), чем среди случайно отобранных пациентов старше 40 лет [16]. Затрудненное носовое дыхание, установленное с помощью риноманометрии, прямо коррелирует с уровнем обструкции дыхательных путей по данным спирометрии [17].
В 2004 г. проведено исследование, в котором оценивалось влияние заболеваний носа и ОНП на качество жизни 65 пациентов с ХОБЛ среднетяжелого и тяжелого течения. Было выявлено, что у 88 % больных присутствуют те или иные симптомы заболеваний носа и ОНП и чем они сильнее, тем больше их влияние на качество жизни [17]. В проспективном исследовании длительностью 24 месяца обследовали 107 пациентов с ХОБЛ. В результате была выявлена зависимость между частотой эпизодов РС и обострений ХОБЛ [18]. В другом исследовании 150 пациентов с ХОБЛ в течение 1047 дней заполняли дневник, в котором указывали пиковую объемную скорость форсированного выдоха, респираторные и назальные жалобы. Выяснилось, что у пациентов, у которых частота обострений ХОБЛ превышала среднее значение, значительно чаще возникали инфекции ВДП [17].
В защитной функции дыхательных путей как полости носа, так и легких ведущая роль принадлежит мукоциллиарному транспорту. В нормальных условиях никогда не прекращающаяся двигательная активность ресничек мерцательного эпителия обеспечивает перемещение слизистого секрета, а вместе с ним - попавших в полость носа микроорганизмов и аэрополлютантов в сторону носоглотки. Благодаря наличию этого уникального механизма происходит очищение полости носа и бронхиального дерева от обилия продуцируемой слизи. Основой патогенеза хронического воспалительного процесса в полости носа, ОНП и при ХОБЛ является угнетение мукоциллиарного транспорта с формированием “порочного круга”. Под воздействием факторов риска у предрасположенных лиц происходят последовательные и тесно связанные между собой структурные изменения дыхательных путей, а также легочной ткани, нарушается мукоцилиарный транспорт, изменяются количество и реологические свойства секрета. В результате разрушения естественного барьера присоединяется бактериальная микрофлора, прогрессирует воспаление и как следствие - происходят сужение и обструкция дыхательных путей или блок соустья пазухи. Структурные изменения в полости носа, пазухах и бронхолегочной системе, нарушение местного иммунитета создают условия, когда защитные системы макроорганизма в лучшем случае способны лишь ограничить “микробную нагрузку”, но не элиминировать микроорганизмы, т. е. возникает колонизация дыхательных путей и замыкается “порочный круг”.
Ранее существовало заблуждение о стерильности дыхательных путей у здоровых людей. Однако это вряд ли возможно, т. к., согласно законам нормальной физиологии, нос и ОНП имеют постоянный контакт с внешней средой и другими отделами ВДП, где постоянно вегетирует самая разнообразная микрофлора. Возбудителями инфекционного обострения РС и ХОБЛ могут быть как патогенные, так и условно-патогенные микроорганизмы. Последние являются естественными обитателями организма человека и вызывают заболевания при снижении местного и общего иммунитета. Именно представители условно-патогенной микрофлоры являются наиболее значимыми возбудителями РС и ХОБЛ, подчеркивая тот факт, что при любом хроническом заболевании в той или иной степени страдает иммунитет.
В этиологии бактериального обострения РС и ХОБЛ основная роль отводится трем основным возбудителям, которые наиболее часто, по результатам проведенных исследований, определяются в мокроте и отделяемом полости носа: Streptococcus pneumoniae, Haemophilus influenzae, реже встречается Moraxella catarrhalis 19.
При обострении хронического РС спектр возбудителей сходен с таковым при остром; здесь также преобладают аэробы (52 %): S. pneumoniae-21 %, H. influenzae-16 %, M. catarrhalis-10 %, Pseudomonas aeruginosa -15 % и др.; на долю анаэробов приходится 48 %, в т. ч. Prevotella-31 %, Fusobacterium- 15 % и др. 19.
Ключевое место в развитии инфекционных обострений ХОБЛ занимают бактериальные возбудители, которые, согласно результатам многочисленных исследований, выделяются из мокроты или бронхиального секрета в 40-0 % случаев инфекционно-зависимых обострений заболевания [22, 23]. Микроорганизмы, определяемые в мокроте больных ХОБЛ и являющиеся наиболее вероятными причинами обострений, -это H. influenzae, S. pneumoniaeи M. catarrhalis, удельный вес которых составляет 13-6, 7-6 и 9-0 % соответственно 22. У пациентов с тяжелыми обострениями, нуждающихся в искусственной вентиляции легких, увеличивается доля P. aeruginosa и грамотрицательных бактерий [24].
Постепенно бактерии, колонизирующие дыхательные пути, эволюционируют, появляются новые штаммы, следствием чего становитсяновое обострение с выбросом медиаторов. Микроорганизмы вырабатывают вещества, приводящие к развитию цилиарной дисфункции, стимулируют гиперсекрецию слизи и оказывают прямое повреждающее действие на эпителий дыхательных путей [13]. Бактериальное воспаление характеризуется инфильтрацией CD-8 T лимфоцитами, связано с увеличением числа нейтрофилов, всегда сопровождается повышением содержания медиаторов воспаления, таких как интерлейкин-8 и фактор некроза опухоли α, и нейтрофильной эластазы [25] как в слизистой оболочке полости носа, так и в бронхах [26]; сопровождается гиперсекрецией [27, 28].
С учетом основных патогенов, фигурирующих в этиологии инфекций респираторного тракта, подлежащих лечению в поликлинике, можно выделить следующие группы препаратов, перспективных для использования: β-лактамы (аминопенициллины, цефалоспорины), азалиды-макролиды и современные фторхинолоны с антипневмококковой активностью, причем наибольшее “перекрытие” спектра возбудителей прослеживается у азалидов. Многочисленные подтверждения клинической эффективности этих средств представлены как в отечественной, так и в зарубежной литературе. Макролиды - большая группа антибиотиков (природных и полусинтетических), основу химической структуры которых составляет макроциклическое лактонное кольцо с одним или несколькими углеводными остатками. В зависимости от числа атомов углерода в кольце макролиды подразделяются на 14-членные (эритромицин, кларитромицин, рокситромицин), 15-членные (азитромицин) и 16-членные (джозамицин, мидекамицин, спирамицин).
Современные макролиды (особенно полусинтетические) по широте и особенностям спектра действия превосходят антибиотики других групп. В пределах терапевтических концентраций они активны в отношении практически всех групп возбудителей внебольничных инфекций дыхательных путей. Препараты этой группы высокоэффективны при внутрибольничных инфекциях, вызываемых многими грамотрицательными бактериями (см. таблицу). В спектр их действия входят внутриклеточные возбудители.
Таблица.Активность макролидов в отношении основных респираторных патогенов.
Азитромицин является полусинтетическим производным эритромицина А, в котором метильная группа замещена атомом азота, образуя новую 15-членную структуру, выделенную в новую подгруппу, получившую название “азалиды”. По ряду свойств (более высокая активность в отношении некоторых грамотрицательных бактерий, наибольшая продолжительность действия, клеточная направленность фармакокинетики и др.) азитромицин отличается от своих предшественников.
Aзитромицин характеризуется сверхшироким спектром действия: он активен в отношении большинства грамположительных микроорганизмов, многих грамотрицательных бактерий, “атипичных” внутриклеточных возбудителей респираторных инфекций. Азитромицин обладает улучшенными фармакокинетическими свойствами, к которым относятся пролонгированная фармакокинетика (период полужизни азитромицина в зависимости от дозы составляет 48-60 часов), способность накапливаться и длительно задерживаться в иммунокомпетентных клетках (в течение 8-12 суток после завершения 3-5-дневных курсов приема внутрь в стандартной дозе). Тканевая и клеточная направленность кинетики, пролонгированное действие азитромицина, возможность эффективного применения короткими курсами без опасности развития серьезных побочных реакций обусловливают невысокий риск развития и распространения антибиотикоустойчивости.
Азитромицин характеризуется высокой комплаентностью, оптимальным показателем соотношения стоимость/ эффективность.
Все вышеизложенное подтверждает целесообразность применения азитромицина в лечении больных с коморбидно протекающей инфекционновоспалительной патологией ВДП и НДП.
1. Домбровская Ю.Ф., Каганов С.Ю. О некоторых насущных вопросах хронической пневмонии у детей // Вопр охр. мат. и дет. 1972. C. 8-12.
2. Константинова Н.П. Роль заболеваний верхних дыхательных путей и миндалин в патогенезе некоторых поражений бронхов и легких у детей. Дисс. доктора мед. наук. М. 1970.
3. Гаджимирзаев Г.А. Ринобронхопульмональный синдром. Махачкала: Юпитер. 1998.
4. Овчинников А.Ю., Колбанова И.Г. Ринобронхиальный симптомокомплекс. Материалы 17-го Съезда оториноларингологов России. 2006. С. 319-20
6. Pawankar R. Allergic rhinitis and its impact on asthma: an evidence-based treatment strategy for allergic rhinitis Asian. Pac. JAllergyImmunol2002;3:43-52.
7. Овчаренко С.И., Чичкова Н.В. Бронхиальная астма и аллергический риносинусит (взаимосвязь патологических процессов) // Врач. 1999. 2123. 12 c.
9. Овчинников А.Ю., Купреенко И.Г., Панякина М.А. Особенности лечения острого гнойного синусита, протекающего на фоне аллергических заболеваний дыхательной системы // Consilium medicum 2004. Т. 6. № 4. С. 284-86.
10. Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: NHLBI WHO Workshop. 2001;19.
11. Pauwels RA, Rabe KF. Burden and clinical features of chronic obstructive pulmonary disease (COPD). Lancet 2004; 364:613-20.
12. Murray CJ, Lopez AD. Alternative projections of mortality and disability by cause 1990- 2020: Global Burden of Disease Study. Lancet 1997;349:1498-504.
13. Hurst JR, Wilkinson TMA, Donaldson GC, Wedzicha JA. Upper airway symptoms and quality of life in chronic obstructive pulmonary disease (COPD). Respir Med 2004;98:767-70.
14. Montnemery P, Svensson C, Adelroth E, et al. Prevalence of nasal symptoms and their relation to self-reported asthma and chronic bronchitis/ emphysema. Eur Respir J 2001;17:596-603.
15. Roberts NJ, Lloyd-Own SJ, Rapado F, et al. Relationship between chronic nasal and respiratory symptoms in patients with COPD. Respir Med 2003;97:909-14.
16. van Manen JG, Bindels PJ, IJzermans CJ, et al. Prevalence of comorbidity in patients with a chronic airway obstruction and controls over the age of 40. J Clin Epidemiol 2001;54:287-93.
17. Hurst JR, Kuchai R, Michael P, et al. Nasal symptoms, airway obstruction and disease severity in chronic obstructive pulmonary disease. Clin Physiol Funct Imaging 2006;26:251-56.
18. Dewan NA, Rafique S, Kanwar B, et al. Acute exacerbation of COPD: factors associated with poor treatment outcome. Chest 2000; 117:662-71.
19. Лопатин А.С. Фармакотерапия воспалительных заболеваний околоносовых пазух // Consilium medicum 2002. Т.4. №4. С. 186-88.
20. Свистушкин В.М., Никифорова Г.Н. Возможности беспункционного лечения гнойных гайморитов // Рос. оторинолар. 2004. № 3(10). С. 150-52.
21. Страчунский Л.С., Каманин Е.И., Тарасов А.А. Влияние антибиотикорезистентности на выбор антимикробных препаратов в оториноларингологии // Consilium medicum. 2001. Т. 3. № 8. С. 23-25.
22. Sethi S, Murphy TF. Acute exacerbations of chronic bronchitis: new developments concerning microbiology and pathophysiology-impact on approaches to risk stratification and therapy. Infect Dis Clin North Am 2004;18:861-82.
23. Sethi S, Muscarella K, Evans N, et al. Airway inflammation and etiology of acute exacerbations of chronic bronchitis. Chest 2000; 118:1557-65.
24. Soler N, Torres A, Ewig S, et al. Bronchial microbial patterns in severe exacerbations of chronic obstructive pulmonary disease (COPD) requiring mechanical ventilation. Am J Respir Crit Care Med 1998;157:1498-505.
25. Sethi S, Muscarella K, Evans N, et al. Airway inflammation and etiology of acute exacerbations of chronic bronchitis. Chest 2000; 118:1557-65.
26. Vachier, I, Vignola, AM, Chiappara, G, et al Inflammatory features of nasal mucosa in smokers with and without COPD. Thorax 2004;59:303-7.
27. Balzano G, Stefanelli F, Iorio C, et al. Eosinophilic inflammation in stable chronic obstructive pulmonary disease: relationship with neutrophils and airway function. Am J Respir Crit Care Med 1999;160:1486-92.
28. Henke MO, Shah SA, Rubin BK. The role of airway secretions in COPD: clinical applications. COPD 2005;3:377-90.
Постковидный синдром в практике врача-оториноларинголога
Все больше внимания уделяется долгосрочным последствиям COVID-19. На девятом съезде оториноларингологов Республики Беларусь о постковидном синдроме в практике лор-врачей рассказала доцент кафедры оториноларингологии БелМАПО, кандидат мед. наук Жанна Романова.

Сегодня Жанна Григорьевна отвечает на вопросы корреспондента «Медвестника» о постковидном синдроме, с которыми сталкиваются врачи-оториноларингологи. Выступая на съезде, вы говорили, что, по международным данным, до 20 % пациентов, перенесших коронавирусную инфекцию, страдают от долгосрочных симптомов, длящихся до 12 недель, а в 2,3 % случаев и дольше…
Недавние исследования показывают, что значительное число пациентов испытывают длительные постковидные симптомы, характер и продолжительность которых все еще остаются неопределенными.
В настоящее время 35 % пациентов, которые перенесли COVID-19 легкой степени, не возвращаются к исходному уровню здоровья после окончания заболевания. 87,4 % пациентов с COVID-19 сообщили о сохранении по крайней мере одного симптома. При этом заметное снижение качества жизни отмечали 44,1 % пациентов.
Каковы же наиболее стойкие симптомы, сохраняющиеся у тех, кто переболел коронавирусной инфекцией?
Пост-COVID-синдром — новая клиническая форма, которая в контексте инфекции SARS-CoV-2 у взрослых внесена в МКБ-10 под кодом рубрики U09.9. Постковидный синдром определяется признаками и симптомами, которые длятся свыше 12 недель, необъяснимы альтернативным диагнозом, способны меняться со временем, исчезать и вновь возникать, затрагивая многие системы организма у пациентов, перенесших коронавирусную инфекцию.
К наиболее стойким симптомам относятся утомляемость (сохраняется у 92 % пациентов), потеря концентрации внимания или памяти (74 %), слабость (68 %), стойкие, резистентные к обезболивающей терапии головные боли (65 %), головокружение (64 %).
Если говорить о долгосрочных симптомах, то это проблемы, возникающие волнообразно или на постоянной основе: одышка, неполный вдох, тяжесть за грудиной; боли в мышцах, суставные боли; потеря волос, выпадение зубов; кожные реакции (сыпь, обширные крапивницы, капиллярные сетки). Кроме того, это резкие скачки давления и пульса; «туман в голове», дезориентация в пространстве, нарушения сна, тревога и панические атаки; расстройства желудочно-кишечного тракта, диарея; продолжительное повышение или понижение температуры тела либо колебания температуры.
Возможно, вклад в патогенез осложнений заболевания вносит антифосфолипидный синдром — это обусловлено тем, что вирус, размножаясь во многих тканях и органах, использует для своей оболочки фосфолипиды организма хозяина, которые, соединяясь с белками поверхности (капсида) вируса, представляют из себя цель для антител.
Но сходные структуры могут быть и у самого организма, тогда эти антитела будут атаковать и здоровые ткани (аутоантитела). Не исключено, что антитела могут помогать вирусу проникать в иммунные клетки по принципу антителозависимого усиления инфекции (ADE).
Следует заметить, что это исключительно гипотетическое предположение, озвученное некоторыми исследователями.
К слову, следствием перенесенной вирусной инфекции в организме может быть нарушение уровня гемостаза, что вызывает изменение уровня циркулирующего серотонина. Из-за этого пациент испытывает мучительные мигрени, глубокие депрессивные состояния. Действуя на рецепторы, которые участвуют в регулировании кровяного давления, вирус вызывает брадикининовый шторм. Сосуды расширяются и становятся более проницаемыми, плазма накапливается в тканях, вызывая отек и действуя на ноцицепторы, что вызывает боль.
А как постковидный синдром проявляется со стороны лор-органов?
Этих проявлений довольно много. Во-первых, это, конечно, нарушение обоняния — аносмия. Оториноларингологи наблюдают также аудиовестибулярные нарушения — тиннитус (шум в ушах), ушную боль, головокружение. Следующие проявления — боль в горле, длительный кашель, ком в горле, нарушения голоса.
Существует несколько гипотез возникновения таких последствий. Прежде всего стоит рассмотреть возможность прямого повреждения органов. Специалисты также говорят о возможной вирусной персистенции, новых волнах воспаления, запуске аутоиммунных реакций вследствие перенесенной вирусной инфекции.
Нарушение обоняния (аносмия) знакомо многим переболевшим COVID-19, о нем пациенты вспоминают, пожалуй, в первую очередь. Что можно сказать об этой проблеме, если рассматривать ее более детально?
Вирусная инфекция вызывает отек и застойные явления в слизистой оболочке полости носа, что может привести к блоку обонятельной щели и кондуктивной дизосмии. Кроме этого нарушение обоняния обусловлено нейротропным вирусным поражением непосредственно самой обонятельной системы.
SARS-CoV-2 может проникать в ткани головного мозга (через обонятельную луковицу): в грушевидную и инфралимбическую кору, базальные ганглии (вентральный паллидум, боковое преоптическое ядро), дорсальный шов среднего мозга.
Поражение грушевидной коры вызывает нарушение пищевого поведения, психоэмоциональные расстройства (страхи). Инфралимбическая кора — важнейший координатор стрессовых реакций, а вентральный паллидум — важнейший координатор социального поведения и уровня тревожности. Вентролатеральное преоптическое ядро — один из центров сна.
При COVID-19 нарушение обоняния в 70-80 % случаев сопровождается нарушением вкуса (агевзия), но может протекать как моносимптом. Изолированное нарушение вкуса без обонятельной дисфункции встречается редко (примерно у 5-15 % пациентов). Обонятельная дисфункция при COVID-19 у 70-80 % пациентов протекает в виде аносмии. Гипосмия была подтверждена у 20-30 %.
В большинстве случаев восстановление обонятельной функции происходит самопроизвольно в течение месяца на фоне лечения основного заболевания. проведение дополнительных лечебных мероприятий не требуется. 60-70 % пациентов с COVID-19 отмечают улучшение обоняния на 8-9-й день заболевания, к 15-му дню наблюдается полное восстановление у 80-90 % исследуемых лиц. И только 10-15 % заболевших вынуждены обращаться за медицинской помощью к оториноларингологу по поводу отсутствия обоняния и/или вкуса более 20 дней.
И чем же таким пациентам могут помочь оториноларингологи и другие специалисты, какое лечение предложить?
Лечение нарушения обоняния при COVID-19 то же, что и лечение невропатии обонятельного нерва. Лечение пациентов с нарушениями обоняния и вкуса необходимо начинать через 2 недели от начала заболевания, чтобы избежать отдаленных осложнений и развития стойкой аносмии/агевзии.
Очень важны обонятельные тренинги, которые представляют собой самостоятельное регулярное вдыхание носом ароматических пахучих веществ (одорантов): 6-8 тренировок в день по 2 вдоха каждой половиной носа каждого одоранта.
При этом важно спокойно глубоко дышать через нос. Длительность обонятельного тренинга — от 1 до 3 месяцев, а при необходимости и более. Одоранты наносят на ватный диск, чтобы избежать проливания, через 3 месяца рекомендовано менять состав набора одорантов, использовать эфирные масла с другими запахами.
Для обонятельного тренинга подходят эфирные масла с мягкими, приятными запахами, например, зеленый чай, бергамот, розмарин, гардения, корица, ваниль, апельсин, банан.
Патофизиологический механизм улучшения обоняния на фоне тренировок связан с повышением регенеративной способности ольфакторных нейронов в ответ на стимуляцию пахучими веществами. Применение медикаментозного лечения носит вспомогательный характер.
Комплексное лечение аносмии включает применение ипидакрина гидрохлорида, тиоктовой кислоты, Омега-3 жирных кислот, поливитаминных комплексов (витамины D, А, С, группы В), интраназальных кортикостероидов, проведение обонятельных тренингов, о которых я уже рассказала, физиотерапевтическое лечение и психотерапевтическую коррекцию.
А часто ли пациенты жалуются на головокружения и как им можно помочь в подобных случаях?
Китайские, немецкие и другие ученые продемонстрировали, что рецепторы, необходимые для проникновения SARS-CoV-2 в ткани, экспрессируются во внутреннем ухе человека. Это говорит о том, что вирусная инфекция может непосредственно вызывать повреждение внутреннего уха, приводящее к потере слуха, шуму в ушах или дисбалансу и головокружению. Другие объяснения поражения внутреннего уха, связанного с COVID-19, включают окклюзию улиткового или вестибулярного микроциркуляторного русла из-за состояния гиперкоагуляции, часто наблюдаемого у пациентов с COVID-19.
В целом аудиовестибулярные симптомы и последствия у пациентов с COVID-19 таковы: потеря слуха (преходящая) отмечена у 1-3 % пациентов, шум в ушах — от 16 % до 26 %, головокружение — от 37 % до 43 %.
Большинство аудиовестибулярных симптомов преходящие и впоследствии самостоятельно регрессировали.
На сегодняшний день нет четких доказательств клинически значимого стойкого кохлеарного или вестибулярного повреждения после выздоровления.
На девятом съезде оториноларингологов Беларуси вы приводили данные о нарушениях голоса у пациентов, перенесших COVID-19, полученные в РНПЦ оториноларингологии…
В январе-мае 2022 года мы наблюдали подобные голосовые нарушения у 21 человека. У 17 пациентов была (80,9 %) дисфония, у 4 человек (19 %) — афония. Длительность заболевания составляла от 2 до 6 месяцев. Во всех этих случаях мы можем говорить о миопатическом парезе гортани.
Курс лечения для таких пациентов — это комплекс мероприятий, который включает в себя препараты, улучшающие проводимость нервных импульсов (нейромидин, ипигрикс), витамины группы В (боривит, мильгамма, неуробекс), витамин D, цинк, ноотропы, при необходимости — курс гипербарической оксигенации, нейромышечные электростимуляции (Vocastim), фонопедию, психотерапевтическую коррекцию.
Еще одно из нередких проявлений постковидного синдрома — кашель. Что вы можете рассказать о нем?
Сильный и долго сохраняющийся кашель — одна из частых жалоб при заражении «омикрон»-вариантом коронавируса. Особенно активно этот симптом развивается у тех, кто подхватил последнюю версию коронавируса — «стелс-омикрон», или подвариант ВА.2. Когда вирусные частицы попадают внутрь клеток, организму поступает сигнал о нарушении целостности тканей.
В ответ развивается воспаление, в процесс вовлекаются различные элементы иммунной системы: цитокины, антитела и другие. Внутри организма зараженного человека начинается активная война иммунитета с вирусом. И именно поэтому появляются эти неприятные симптомы: чихание, насморк, отеки слизистых, боли в горле и кашель.
Кашель многих пугает больше всего. Причины его возникновения при COVID-19 могут быть разными. Вариант «омикрон», как уже установлено, поражает в большей степени верхние дыхательные пути и не так активно стремится в легкие, как «дельта». Основное количество вируса накапливается в гортани, трахее и бронхиальной ткани, не уходя глубоко вниз. В результате могут повреждаться нервы, которые связаны с кашлевым рефлексом.
К кашлю нужно относиться очень осторожно. Все противокашлевые препараты можно условно разделить на две группы. Это препараты, которые блокируют кашлевой центр и не влияют на слизь. И мукоактивные — назовем их так — лекарственные средства, которые могут остановить кашель, но могут привести и к стабилизации слизи. Выбор препаратов для лечения кашля очень велик. Но обращаться с лекарствами нужно со знанием дела и с индивидуальным подходом к каждому конкретному случаю.
А что поможет избавить пациента от боли в горле?
Боль в горле вызывают вирусные фарингиты и тонзиллиты. Для их лечения эффективны местные антисептические средства, которые приводят к регрессу субъективных и объективных признаков заболевания, предотвращают распространение воспаления в нижние отделы дыхательного тракта, что дает возможность избежать системной антибиотикотерапии и нежелательных последствий, связанных с ее назначением (дисбактериоз, иммуносупрессия, аллергические реакции).
Вы также упоминали о том, что постковидный синдром может давать симптомы со стороны лор-органов, которые на самом деле говорят о появлении у пациента приступа панической атаки…
Да, такое может быть — например, ощущение удушья, головокружение, нарушение слуха, ком в горле — как атипичное проявление панической атаки. Поэтому и нам, и другим специалистам так важно быть на связи, сотрудничать, в том числе с неврологами, психотерапевтами и психиатрами. Ясно, что постковидный синдром — это мультидисциплинарная проблема.
Антимикробная терапия острых заболеваний лор-органов
К неудачам антибиотикотерапии приводят неправильный выбор препарата, дозы, пути введения. К сожалению, антибиотики нередко назначают, не задумываясь о наиболее вероятном возбудителе, его чувствительности к противомикробным средствам, не учитывая результаты, полученные в контролированных клинических исследованиях.
Согласно принципам рациональной антимикробной терапии, при инфекционных заболеваниях в большинстве случаев назначается эмпирическая терапия (т. е. антибиотик выписывается, основываясь на диагнозе и без предварительных микробиологических исследований). Эмпирическая терапия не остается постоянной — она меняется вслед за чувствительностью микробов (которая постепенно снижается).
Проблема резистентности микроорганизмов оказывает пагубное влияние на здравоохранение и всемирную экономику, и главной целью борьбы с этой проблемой является сохранение человечества.
Основная причина развития устойчивости микробов — ненадлежащее применение антимикробных средств:
- в случае заболеваний, при которых они изначально неэффективны;
- при самостоятельном выборе антибиотика пациентом-непрофессионалом;
- при несоблюдении предписанного врачом режима приема антибиотика;
- при излишнем (когда они уже (или еще) не нужны) назначении антибиотиков специалистами.
Итак, выбор антибиотика зависит от инфекционного заболевания. Этиотропная терапия (после микробиологического определения возбудителя и его чувствительности к антибиотикам) обычно назначается лишь при неудаче эмпирической.
В лечении предпочтительны наиболее эффективные, приемлемые по цене и наименее токсичные антибиотики. Выбор зависит от локализации инфекции (антибиотик должен поступать в ее очаг). При наличии энтеральных и парентеральных форм у одного и того же антибиотика выбор диктуется тяжестью заболевания. При более тяжелой инфекции — парентерально, в менее тяжелых случаях достаточно назначения препаратов внутрь (ступенчатая терапия — переход от парентеральных форм к пероральным).
Учитывается состояние организма больного: иммунитет, функция печени, почек, беременность, возраст и др. Предпочтительно назначение антибиотиков максимально узкого спектра, чтобы не подавлять нормальную микрофлору организма. Комбинируются антибиотики для усиления эффекта, профилактики устойчивости с учетом возможности осложнений (аллергия, токсичность, суперинфекции вследствие дисбактериоза).
Необходимо правильно подобрать:
- разовую и курсовую дозы химиотерапевтического средства;
- частоту введения;
- длительность курса (оценивать лечебный эффект следует только после 3-4 дней);
- химиотерапия должна назначаться до полного клинического выздоровления (обычно все дни болезни плюс 1-2 дня после исчезновения симптомов).
Несмотря на то что эмпирический выбор антибиотиков положен в основу их назначения, бактериологическое исследование, когда это представляется возможным, должно обязательно проводиться. Помимо прямой пользы для данного пациента, например, при неэффективности стартовой терапии и необходимости смены антибиотиков, это позволит получать и накапливать эпидемиологические данные о структуре возбудителей и, что наиболее важно, их чувствительности к антибиотикам.
Основными бактериальными возбудителями острых инфекций в оториноларингологии являются пневмококк (Streptococcus pneumoniae) и гемофильная палочка (Haemophilus influenzae). Гораздо реже выделяют моракселлу (Мoraxella catarrhalis), β-гемолитический стрептококк группы А (БГСА, S. pyogenes).
Дети до 2 лет с острым средним отитом, по мнению большинства специалистов, должны получать антибиотики во всех случаях. Если состояние ухудшается через 24 ч, то это может свидетельствовать о развитии гнойных осложнений, требующих немедленного обращения к врачу. При инфекциях лор-органов у детей старше 2 лет без выраженных симптомов интоксикации, болевого синдрома, температуры выше 38 °С в течение суток можно ограничиться симптоматической терапией. Однако при сохранении симптомов или отсутствии улучшения в течение 24 ч необходимо назначить антибиотики.
При использовании местных деконгестантов (МД) более 5 дней развивается медикаментозный ринит. Поэтому западные рекомендации не разрешают использовать МД даже более 3 дней. Отечественные клинические протоколы разрешают (например, при синусите — в течение 5-7 дней).
Также следует учитывать, что попытки заменить прием антибиотиков внутрь местными антибактериальными препаратами или препаратами с иммуностимулирующей активностью, декларируемой производителями, представляются необоснованными, так как нет достоверных клинических данных, показывающих эффективность этих препаратов.
Принимая во внимание важность проблемы рациональной антибиотикотерапии, в Беларуси приняты соответствующие нормативные документы. Это приказ Минздрава «О мерах по снижению антибактериальной резистентности микроорганизмов», который содержит таблицы по эмпирической терапии бактериальных инфекций. Издаются и обновляются стандарты лечения инфекций, относящихся к отдельным врачебным дисциплинам.
Например, по лор-болезням имеется Клинический протокол от 25.05.2018 № 46 «Диагностика и лечение пациентов (детское население) с болезнями уха, горла и носа» и Клинический протокол от 01.06.2017 № 49 «Диагностика и лечение пациентов с оториноларингологическими заболеваниями» (взрослое население). Однако из-за развития резистентности микробов протоколы неминуемо обречены на отставание от реальной жизни, поэтому врачи-специалисты должны вести постоянный мониторинг медицинской литературы.
Эмпирическая антибиотикотерапия острых синуситов
Этиология синусита определяется главным образом пневмококком и гемофильной палочкой (по 1/3 случаев), также присутствуют вирусы (15-18 %), моракселла (9 %), золотистый стафилококк (10 %), анаэробы (6 %), БГСА (2 %). Наиболее часто встречается неинфекционный синусит (воспаление, аллергия) вследствие нарушения оттока из пазух. Лечение — промывание солевым раствором. Критерии для назначения антибиотиков: лихорадка, боль, гнойное отделяемое из носа, отсутствие улучшений без антибиотика в течение 10 дней.
Далее приведены стандарты лечения острых инфекций лор-органов по клиническим протоколам, упомянутым выше. Для большей наглядности после описания лечения из отечественных клинических протоколов в квадратных скобках приведены стандарты лечения соответствующих заболеваний, принятые в США.
Дети. Клинический протокол от 25.05.2018 № 46 рекомендует:
Амоксициллин 40 мг/кг/сут внутрь в 3 приема в течение 7-10 дней [амоксициллин 90 мг/кг/сут в 2 приема в течение 10-14 дней] или амоксициллин/клавулановая кислота 40-45 мг/кг/сут (по амоксициллину) внутрь в 2-3 приема 7-10 дней [амоксициллин/клавулановая кислота 45 мг/кг/сут используется только при уверенности в отсутствии устойчивой флоры, в остальных случаях — 90 мг/кг/сут за 2 приема в течение 10-14 дней].
При аллергии на бета-лактамные антибиотики — пенициллины: азитромицин 10 мг/кг/сут за 1 прием 3-5 дней или кларитромицин15 мг/кг/сут внутрь 2 раза в сутки 5-7 дней [макролидов следует избегать из-за частой резистентности микробной флоры]. Также зарубежные источники указывают, что у детей при аллергии (нафилактоидные реакции) на пенициллины применяют клиндамицин 30-40 мг/кг/сут за 3 приема в течение 10-14 дней.
Однако при подозрении на наличие гемофильной палочки или моракселлы, устойчивой к клиндамицину, надо добавлять второй антибиотик (пероральные цефалоспорины). Если присутствует аллергия на пенициллины, но без симптомов анафилаксии, то детям назначают цефподоксим 10 мг/кг/сут за 2 приема. Вспомогательное лечение — назальные деконгестанты курсом до 3 дней, солевые орошения, в то же время не прослеживается четкого положительного результата от назначения назальных стероидов и антигистаминных средств.
Взрослые. Клинический протокол от 01.06.2017 № 49 рекомендует:
Амоксициллин по 500 мг 3-4 раза в сутки внутрь 7-10 дней [в рекомендациях США он есть только для детей], амоксициллин/клавулановая кислота по 1 г 2 раза в сутки внутрь 7-10 дней [в зарубежных рекомендациях — по 2 г 2 раза в сутки 5-7 дней].
Цефалоспорины 2-3-го поколения: цефуроксим аксетил по 250-500 мг 2 раза в сутки внутрь 7 дней, цефиксим по 400 мг 1 раз в сутки внутрь 7-14 дней [из 3-го поколения цефалоспоринов в зарубежных рекомендациях присутствуют также цефподоксим (200 мг 2 р/сут), цефдинир и цефпрозил].
Макролиды (например, азитромицин по 500 мг 1 раз в сутки внутрь 5 дней, кларитромицин по 0,5-1,0 г 1-2 раза в сутки внутрь 5-7 дней) [из-за очень распространенной резистентности микробов к макролидам в США они не рекомендуются в качестве препаратов выбора].
Хинолоны 3-4-го поколения (левофлоксацин по 0,5 г однократно в сутки, курс от 10 до 14 дней, моксифлоксацин) [хинолоны применяются как препараты резерва (при анафилактоидных реакциях на пенициллины или при отсутствии результатов после 3 дней лечения); левофлоксацин в дозе 750 мг курсом 5 дней эквивалентен левофлоксацину 500 мг 14 дней; хинолоны 4-го поколения: моксифлоксацин 400 мг/сут].
За рубежом возможно также лечение доксициклином 100 мг 2 р/сут и (тяжелого синусита) цефтриаксоном.
Резерв (MRSA) — оксазолидиноны (например, линезолид по 600 мг 2 раза в сутки внутрь 10 дней).
Примечание. Следует особо отметить, что в США на ранних этапах лечения острого синусита придают огромное значение промыванию слизистой оболочки носа солевыми растворами, т. к. это способствует восстановлению оттока из пазух.
Эмпирическая антибиотикотерапия острых тонзиллитов/фарингитов
Дети. По отечественным клиническим протоколам лечение проводится аналогично лечению синуситов, т. е. из пенициллинов используют амоксициллин или амоксициллин/клавуланат, а также макролиды.
Зарубежные рекомендации (при предполагаемой стрептококковой этиологии): пенициллины — амоксициллин 50 мг/кг/д 1 р/д (max 1 000 мг/д) в течение 10 дней или феноксиметилпенициллин — детям до 12 лет 25-50 мг/д за 3-4 приема в течение 10 дней, детям >12 лет — доза взрослых. Макролиды — азитромицин 12 мг/кг 1 р/д 5 дней, кларитромицин 15 мг/д за 2 приема 10 дней. (По отечественным протоколам: азитромицин 10 мг/кг/д, а кларитромицин принимают 5-7 дней).
Пероральные цефалоспорины (зарубежные рекомендации, в отечественных протоколах цефалоспоринов для эмпирической терапии нет) — при остром или рецидивирующем заболевании стрептококковой этиологии: цефдинир (7 мг/кг 2 р/д в течение 5 дней) или цефподоксим (10 мг/кг/д за 2 приема 5 дней).
Взрослые. в отечественных клинических протоколах антибиотики для системного применения не упоминаются. Согласно зарубежным рекомендациям, пенициллины: бензатинпенициллин 1,2 млн ЕД в/м однократно или феноксиметилпенициллин 500 мг 2 р/д в течение 10 дней или макролиды (азитромицин 500 мг 1 р/д 3 дня, кларитромицин 250 мг 2 р/д 10 дней) или цефалоспорины — цефдинир (300 мг 2 р/д 5 дней) либо цефподоксим (100 мг 2 р/д 5 дней).
Примечания.
1. При стрептококковой этиологии у детей и взрослых в США также применяют все пероральные цефалоспорины 2-го поколения. Курс лечения: 4-6 дней.
2. При наличии анаэробной инфекции Fusobacterium necrophorum назначается амоксициллин/клавуланат или клиндамицин (детям — 20-30 мг/д за 3 приема, взрослым — 300 мг 3 р/д 10 дней) либо метронидазол. Макролиды при Fusobacterium necrophorum неэффективны!
3. Важно не спутать острый тонзиллит/фарингит (при нем сохранена чувствительность флоры к пенициллинам, разрушающимся бета-лактамазой) с рецидивирующим.
Эмпирическая антибиотикотерапия острого среднего отита (ОСО)
Взрослые. Клинический протокол от 01.06.2017 № 49 рекомендует:
Амоксициллин/клавулановая кислота по 1 г 2 раза в сутки внутрь 7-10 дней [по 2 г 2 р/д].
Цефалоспорины 2-го и 3-го поколения упоминаются только при хроническом гнойном отите: пероральные (цефуроксим аксетил 250-500 мг 2 раза в сутки 7 дней или цефиксим 400 мг в сутки 7-14 дней). При ОСО детализации выбора цефалоспоринов в клиническом протоколе нет, присутствует фраза «стартовая терапия бета-лактамные антибиотики». [Выбор пероральных цефалоспоринов в США более широкий.
Кроме вышеперечисленных также цефподоксим, цефдинир, цефпрозил. Следует учесть, что пероральные цефалоспорины рекомендуют только при отсутствии приема антибиотиков в предыдущий месяц. В ином случае предпочтителен цефтриаксон в/м. Цефтриаксон в США назначают по 1 г/д 3 дня. Перорально антибиотики принимают 5-7 дней, а при тяжелых формах ОСО и у детей < 2 лет — 10 дней].
Макролиды (например, азитромицин внутрь 500 мг 1 р/сут 5 дней) [в США из-за широкой распространенности резистентных штаммов пневмококка и гемофильной палочки их рекомендуют только при невозможности назначить бета-лактамы].
Хинолоны 3-го поколения (левофлоксацин по 0,5 г однократно в сутки, курс от 10 до 14 дней) [левофлоксацин может применяться в большей дозе (750 мг) и коротким курсом (5 дней); высокоэффективный препарат резерва].
Дети. Согласно отечественным протоколам, у детей острый средний отит лечится подобно синуситу и тонзиллофарингиту [зарубежные рекомендации — см. лечение ОСО у взрослых].
Выводы. Согласно современной мировой практике, при антибиотикотерапии острых инфекций лор-органов стартовая терапия в большинстве случаев — амоксициллин/клавуланат в высоких дозах. В то же время макролиды постепенно теряют значение при этих инфекциях из-за развития к ним устойчивости микробной флоры. Важную роль в качестве альтернативы стартовой терапии (в т. ч. у детей) играют пероральные цефалоспорины 2-го (цефуроксим аксетил и др.) и 3-го поколения (цефподоксим и др.).
При проведении антибиотикотерапии, согласно зарубежным рекомендациям, прослеживается тенденция увеличения разовой и суточной дозы препаратов (но не длительности курса лечения!). Тяжелые формы острых лор-инфекций успешно лечатся цефтриаксоном и фторхинолонами — хинолонами 3-го (левофлоксацин) или 4-го (моксифлоксацин) поколения.
Пациентка Д., 36 лет, в анамнезе начиная со студенческих лет 5 эпизодов острого синусита (всегда лечилась амоксициллином/клавуланатом), заболела острым средним отитом. Назначение амоксициллина/клавуланата 10-дневным курсом по 1 г 2 р/д оказалось неэффективным — сохранялись субфебрильная температура и болевые ощущения в области правого уха.
Назначение макролида (азитромицин 500 мг 1 р/д в течение 5 дней) также оказалось безуспешным. Тогда ей был рекомендован левофлоксацин (750 мг 1р/д в течение 5 дней). Он оказался эффективен — симптомы отита исчезли уже на второй день лечения.
Из этого случая можно сделать вывод о формировании устойчивости микробной флоры не только к макролидам, но и к амоксициллину/клавуланату при его повторных назначениях у пациентов с лор-инфекциями.
Читайте также:
- Диагностика гипертрофической дегенерации олив мозга по КТ, МРТ
- Рак толстой кишки: лечение, схемы химиотерапии при колоректальной онкологии
- Инструментальная диагностика острого панкреатита у пожилых. Методика
- Полипы шейки матки
- Осложнения пункций при деструктивной пневмонии. Профилактика воздушной эмболии при пункции легкого
