Механизм экспорта белка из ядра клетки
Добавил пользователь Евгений Кузнецов Обновлено: 08.01.2026
В ядро и из ядра белки транспортируются через ядерные поры. Через ядерную пору может одновременно транспортироваться до 500 макромолекул в обоих направлениях. Белки (пептиды) с молекулярной массой до 5.000 дальтон свободно диффундируют через ядерные поры (так что их концентрация в цитоплазме и в ядре одинаковая). Путем пассивного транспорта (диффузии) через поры могут проникать белки с молекулярной массой до 60.000 дальтон. Из более крупных белков в ядро попадают только обладающие сигнальной последовательностью для ядра (это один или два коротких участка белка, богатых остатками положительно заряженных аминокислот — аргинина или лизина). С этой последовательностью связываются специальные белки — рецепторы импорта в ядро (иногда с помощью дополнительных адаптерных белков). Рецепторы импорта в ядро связываются также с компонентами ядреных пор. Энергию для транспорта обеспечивает гидролиз ГТФ, осуществляемый малыми мономерными ГТФ-азами — Ran-белками. В цитоплазме Ran-белок находится в связанном с ГДФ виде, так как в цитоплазме локализованы Ran-GAP белки (белки-активаторы ГТФ-азной активности Ran), а в ядре Ran-белок находится в связанном с ГТФ виде, так как в ядре локализован белок, обеспечивающий обмен ГДФ на ГТФ. Ran-ГТФ, связываясь на внутренней стороне ядреной поры с «нагруженным» рецептором импорта в ядро, обеспечивает его прохождение внутрь ядра и разгрузку. Затем рецептор с присоединенным Ran-ГТФ выходит в цитоплазму, где GAP-белок вызывает гидролиз ГТФ и отделение Ran-ГДФ от рецептора импорта в ядро. Аналогичный механизм обеспечивает экспорт белков из ядра, только эти белки должны обладать иной сигнальной последовательностью, с которой связываются рецепторы экспорта из ядра (белки, сходные по структуре с рецепторами импорта).
Транспорт белков из аппарата Гольджи на наружную мембрану
Белки, встроившиеся в мембрану ЭПС и попавшие оттуда в составе везикул в АГ, могут перемещаться на наружную мембрану клетки. Их направление к мембране осуществляется благодаря взаимодействию везикул с микротрубочками цитоскелета и благодаря особым стыковочным белкам, которые обеспечивают слияние везикул с мембраной.
Секреторная функция аппарата Гольджи
Эндоцитоз: фагоцитоз и пиноцитоз
Эндоцитоз — способ поглощения клеткой веществ, при котором поглощаемые вещества окружаются мембраной и первоначально попадают в пузырек из мембраны.
Фагоцитоз — поглощение клеткой крупных оформленных частиц (обычно видимых в световой микроскоп, то есть размером не меньше сотен нанометров). Типичный пример фагоцитоза - поглощение бактерий амебой или клеткой-фагоцитом в теле человека.
Пиноцитоз — поглощение клеткой более мелких частиц: растворенных макромолекул (чаще всего белков) или их комплексов (например, поглощение ЛПНП клетками печени из плазмы крови). В целом механизмы фагоцитоза и пиноцитоза очень сходны; принципиальной разницы и четкой границы между этими процессами нет, хотя одно отличие все-таки можно указать. При пиноцитозе (если он рецептор-опосредованный, см. ниже) одна молекула рецептора обычно связывает одну молекулу лиганда; при фагоцитозе несколько молекул рецепторов связываются с поглощаемой частицей. Типичный эндоцитоз встречается у эукариот, лишенных клеточной стенки - животных и многих протистов. Долгое время считалось, что прокариоты полностью лишены способности к эндоцитозу. Однако в 2010 г была опубликована статья, сообщающая об открытии эндоцитоза у бактерий рода Gemmata.
Экзоцитоз и трансцитоз
Молекулярная машина экзоцитозного высвобождения нейромедиатора в синапсе. SNARE комплекс формируется за счёт образования четырёхспиральной сцепки между синаптобревином, синтаксином и SNAP-25. Синаптотагмин служит кальциевым сенсором и внутренним регулятором образования белкового комплекса
Экзоцитоз есть как у эукариот, так иу прокариот. Экзоцитоз (от греч. Έξω — внешний и κύτος — клетка) у эукариот — клеточный процесс, при котором внутриклеточные везикулы (мембранные пузырьки) сливаются с наружной клеточной мембраной. При экзоцитозе содержимое секреторных везикул (экзоцитозных пузырьков) выделяется наружу, а их мембрана сливается с клеточной мембраной. Практически все макромолекулярные соединения (белки, пептидные гормоны и др.) выделяются из клеток эукариот этим способом. У прокариот везикулярный механизм экзоцитоза не встречается, у них экзоцитозом называют встраивание белков в клеточную мембрану (или в наружную мембрану у грамотрицательных бактерий), выделение белков из клетки во внешнюю среду или в периплазматическое пространство [10].
Экзоцитоз может выполнять различные задачи:
доставка на клеточную мембрану липидов, необходимого для роста клетки;
доставка на клеточную мембрану мембранных белков, таких как рецепторы или белки-транспортёры. При этом часть белка, которая была направлена внутрь секреторной везикулы, оказывается выступающей на наружной поверхности клетки;
выделение различных веществ из клетки; это могут быть, например, непереваренные остатки пищи у фаготрофных протистов, пищеварительные ферменты у животных с полостным пищеварением, белки межклеточного вещества у животных и материал клеточной стенки у растений, сигнальные молекулы (гормоны или нейромедиаторы).
У эукариот различают два типа экзоцитоза:
Кальций-независимый конститутивный экзоцитоз встречается практически во всех эукариотических клетках. Это необходимый процесс для построения внеклеточного матрикса и доставки белков на внешнюю клеточную мембрану. При этом секреторные везикулы доставляются к поверхности клетки и сливаются с наружной мембраной по мере их образования. Кальций-зависимый неконститутивный экзоцитоз встречается, например, в химических синапсах, где служит для выделения нейромедиаторов. При этом типе экзоцитоза секреторные пузырьки накапливаются в клетке, а процесс их высвобождения запускается по определённому сигналу, опосредованному быстрым повышением концентрации ионов кальция в цитозоле клетки. В пресинаптических мембранах процесс осуществляется специальным кальций-зависимым белковым комплексом.
Механизм импорта белков в ядро
Рассмотрим механизм поступления субстратов в ядро на примере импорта NLS-содержащих белков. Первой стадией транспортировки является узнавание субстрата транспортинами, в данном случае комплексом импортинов-α/β (транспортины, участвующие в транспорте в ядро называются импортинами, а из ядра — экспортинами). Затем образовавшийся комплекс заякоривается на белках ядерной поры с цитоплазматической стороны и транслоцируется через канал в ядро, где с ним связывается Ran-ГТФ, что вызывает диссоциацию комплекса и высвобождение груза. После этого импортины в комплексе с Ran-ГТФ направляются обратно в цитоплазму, где Ran под действием RanGAP1 гидролизует ГТФ (ГТФ => ГДФ + PO43-). Комплекс Ran-ГДФ-импортины α/β нестабилен и диссоциирует. Ran-ГДФ поступает обратно в ядро при помощи собственного переносчика, белка NTF2. В ядре под действием белка RanGEF ГДФ в активном центре Ran заменяется на ГТФ, и цикл, тем самым, замыкается.
Механизм экспорта белков из ядра
Теперь рассмотрим механизм экспорта из ядра на примере белков, содержащих сигналы ядерного экспорта (англ., Nuclear Export Signal, NES). Для этой сигнальной последовательности характерно выскокое содержание гидрофобных аминокислот. Первой стадией транспортировки здесь также является рецепция субстрата специфическим экспортином Crm1 (англ., Chromosome Region Maintenance) и образование комплекса. Главным отличием механизмов экспорта является тот факт, что в состав транслоцирующегося комплекса в случае экспорта помимо субстрата и Crm1 входит и Ran-ГТФ, то есть сопряжение с циклом Ran происходит на стадии транслокации, а не на стадии реимпорта рецептора. После прохождения через ядерную пору в цитоплазму Ran расщепляет ГТФ, комплекс теряет стабильность и диссоциирует, высвобождая груз.
Хроматин
Хроматин — это вещество хромосом: комплекс ДНК, РНК и белков. Хроматин находится внутри ядра клеток эукариот и входит в состав нуклеоида у прокариот. ДНК в клетке всегда входит в состав хроматина, поэтому именно в составе хроматина происходит реализация генетической информации, а также репликация и репарация ДНК.т Основную массу хроматина составляют белки гистоны. Гистоны являются компонентом нуклеосом, — надмолекулярных структур, участвующих в упаковке хромосом. Нуклеосомы располагаются довольно регулярно, так что образующаяся структура напоминает бусы. Нуклеосома состоит из белков-гистонов четырех типов: H2A, H2B, H3 и H4. В одну нуклеосому входят по два белка каждого типа — всего восемь молекул. Гистон H1, более крупный, чем другие гистоны, связывается с ДНК в месте ее входа на нуклеосому. Нить ДНК с нуклеосомами образует нерегулярную соленоид-подобную структуру толщиной около 30 нанометров, так называемую 30 нм фибриллу. Дальнейшие уровни упаковки хроматина изучены гораздо хуже. Упаковка хроматина может иметь различную плотность. Если хроматин упакован плотно, его называют конденсированным или гетерохроматином, он хорошо видим под микроскопом. ДНК, находящаяся в составе гетерохроматина, не транскрибируется, обычно это состояние характерно для незначащих (не кодирующих белки) или молчащих участков. В интерфазе гетерохроматин обычно располагается по периферии ядра (пристеночный гетерохроматин). Полная конденсация хромосом происходит у большинства эукариот перед делением клетки. Если хроматин упакован неплотно, его называют эухроматин. Этот вид хроматина обычно характеризуется наличием транскрипционной активности. Плотность упаковки хроматина во многом определяется модификациями гистонов — ацетилированием и фосфорилированием. Считается, что в ядре существуют так называемые функциональные домены хроматина (ДНК одного домена содержит приблизительно 30 тысяч пар оснований), то есть каждый участок хромосомы имеет собственную «территорию». Вопрос пространственного распределения хроматина в ядре изучен пока недостаточно. Известно, что теломерные (концевые) и центромерные (отвечающие за связывание сестринских хроматид в митозе) участки хромосом закреплены на белках ядерной ламины. Длины метафазных хромосом человека на цитологических препаратах лежат в пределах 1-10 мкм. Однако, по данным новых исследований, в клетке хромосомы имеют иную форму, а при приготовлении препаратов в результате фиксации и окраски сильно вытягиваются.
Ядрышко
Ядерный матрикс
Я́дерный скеле́т, или ядерный матрикс (англ. nuclear matrix) — опорная структура ядра клетки, составленная периферической пластинкой (ламиной) и пронизывающими ядро тяжами. В настоящий момент функция ядерного скелета окончательно не выяснена. Считается, что матрикс построен преимущественно из негистоновых белков, формирущих сложную развлетвленную сеть, сообщающуюся с ядерной ламиной. Возможно, ядерный матрикс принимает участие в формировании функциональных доменов хроматина. В геноме эукариот имеются специальные незначащие А-Т-богатые участки прикрепления к ядерному матриксу (англ. S/MAR — Matrix/Scaffold Attachment Regions), служащие, как предполагается, для заякоривания петель хроматина на белках ядерного матрикса. Впрочем, не все исследователи признают существование ядерного матрикса в виде прочной, относительно стабильной сети фибриллярных белков, подобной цитоскелету цитоплазмы эукариот.
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.
Ядерно-цитоплазматический транспорт
Материальный обмен между ядром и цитоплазмой клетки осуществляется посредством ядерных пор — транспортных каналов, пронизывающих двухслойную ядерную оболочку. Переход макромолекул из ядра в цитоплазму и в обратном направлении называется ядерно-цитоплазматическим транспортом.
Содержание
Структура
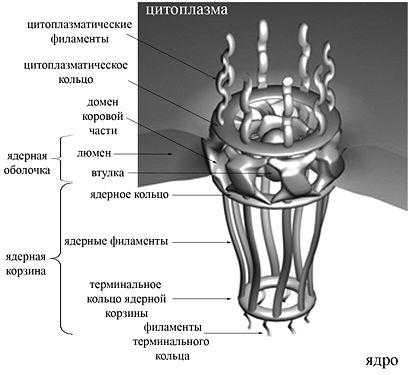
Ядерные поры — это не просто перфорации, а сложно устроенные, многофункциональные регулируемые структуры, организованные приблизительно 30 белками — нуклеопоринами. Белковая составляющая ядерной поры обозначается термином «комплекс ядерной поры» (англ., nuclear pore complex, NPC). Масса комплекса ядерной поры колеблется в пределах от ~44 МДа в клетках дрожжей до ~125 МДа у позвоночных.
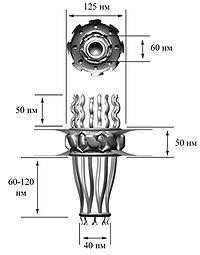
По данным электронной микроскопии, ядерные поры в поперечном сечении имеют форму «восьмиспицевого тележного колеса», то есть имеют ось симметрии восьмого порядка. Эти данные подтверждает тот факт, что молекулы нуклеопоринов присутствуют в составе ядерной поры в количестве, кратном восьми. Проницаемый для молекул канал располагается в центре структуры. Комплекс ядерной поры заякорен на ядерной оболочке с помощью трансмембранной части, от которой к просвету канала обращены структуры, получившие название спиц (англ., spokes), по аналогии со спицами тележного колеса. Эта коровая часть поры, построенная из восьми доменов, с цитоплазматической и ядерной сторон ограничена соответственно цитоплазматическим и ядерным кольцами (англ., rings; у низших эукариот они отсутствуют). К ядерному кольцу прикреплены белковые направленные внутрь ядра тяжи (ядерные филаменты, англ., filaments), к концам которых крепится терминальное кольцо (англ., terminal ring). Вся эта структура носит название ядерной корзины (англ., nuclear basket). К цитоплазматическому кольцу также прикреплены направленные в цитоплазму тяжи — цитоплазматические филаменты. В центре ядерной поры видна электрон-плотная частица, «втулка» или транспортер (англ., plug).
Свойства ядерных пор
Количество ядерных пор на одно ядро может колебаться от 190 у дрожжей, 3000-5000 в клетках человека, до 50 млн в зрелых ооцитах шпорцевой лягушки (Xenopus laevis). Этот показатель может также варьировать в зависимости от типа клетки, гормонального статуса и стадии клеточного цикла. Например, в клетках позвоночных количество ядерных пор удваивается на протяжении S фазы, одновременно с удвоением хромосом. При разборке ядерной оболочки во время митоза ядерные поры позвоночных распадаются на субкомплексы с массами около миллиона дальтон. Показано, что разборка комплекса ядерной поры инициируется циклин B-зависимой киназой, фосфорилирующей нуклеопорины. После завершения клеточного деления ядерные поры собираются de novo. Ядерные поры интерфазного ядра перемещаются большими массивами, а не независимо друг от друга, причем эти перемещения происходят синхронно с перемещениями ядерной ламины. Это служит доказательством того, что ядерные поры механически связаны между собой и формируют единую систему (англ., NPC network).
Нуклеопорины
Нуклепорины, белки из которых постоены ядерные поры, делят на три подгруппы. К первой относят трансмембранные белки, заякоривающие комплекс в ядерной оболочке. Нуклепорины второй группы содержат характерный аминокислотный мотив — несколько раз повторенные FG, FXFG или GLFG — последовательности (так называемые FG-повторы, где F — фенилаланин, G — глицин, L — лейцин, X — любая аминокислота). Функция FG-повторов, по-видимому, заключается в связывании транспортных факторов, необходимых для осуществления ядерно-цитоплазматического транспорта. Белки третьей подгруппы не имеют ни мембранных доменов, ни FG- повторов, наиболее консервативны среди всех нуклеопоринов, их роль, по-видимому, заключается в обеспечении связывания FG-содержащих нуклепоринов с трансмембранными. Нуклеопорины также отличаются по своей мобильности в составе ядерной поры. Некоторые белки связаны с конкретной порой на протяжении всего клеточного цикла, в то время как другие полностью обновляются всего за несколько минут.
Ядерно-цитоплазматическим транспортом называется материальный обмен между ядром и цитоплазмой клетки. Ядерно-цитоплазматический транспорт можно разделить на две категории: активный транспорт, требующий затрат энергии, а также специальных белков-рецепторов, и пассивный транспорт, протекающий путем простой диффузии молекул через канал ядерной поры.
Пассивный транспорт
Молекулы небольших размеров (ионы, метаболиты, мононуклеотиды и т. д.) способны пассивно диффундировать в ядро. Проводимость ядерных пор для молекул разных размеров различна. Белки массой менее 15 кДа быстро проникают в ядро, в то время как для белка массой более 30 кДа на это требуется определенное время. Белковые молекулы массой более 60-70 кДа, по-видимому, вообще не могут пассивно проходить через ядерные поры. Впрочем, пропускная способность ядерных пор для пассивной диффузии может изменяться в зависимости от типа клетки и стадии клеточного цикла.
Активный транспорт
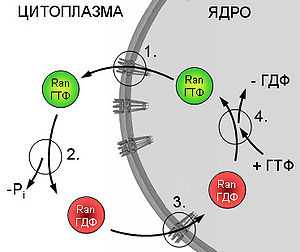
Цикл Ran.
1. Транслокация Ran-ГТФ в цитоплазму в комплексе с транспортинами. 2. Гидролиз ГТФ. Собственная ГФАзная активность Ran активируется цитоплазматическим белком RanGAP. 3. Ran-ГДФ реимпортируется в ядро при участии белка NTF2. 4. ГДФ в активном центре Ran заменяется на ГТФ под действием ядерного белка RCC1 (фактора обмена нуклеотидов).
Пропускная способность ядерной поры для активного транспорта значительно выше. Так рибосомные субчастицы размерами до нескольких мегадальтон транспортируются из ядра в цитоплазму через ядерные поры, и нет никаких оснований предполагать, что процесс транспорта сопровождается частичной разборкой этих субчастиц. Системы активного транспорта обеспечивают весь макромолекулярный обмен между ядром и цитоплазмой. Молекулы РНК, синтезируемые в ядре, поступают через поры в цитоплазму, а в ядро попадают белки участвующие в ядерном метаболизме. Причем одни белки должны поступать в ядро конститутивно (например, гистоны), а другие в ответ на определенные стимулы (например, транскрипционные факторы). У ядерных белков идентифицированы специальные последовательности, отвечающие за их локализацию. Самая распространенная из них, так называемый «классический» сигнал ядерной локализации — NLS (от англ., Nuclear Localization Signal), представляет собой один или два участка положительно заряженных аминокислот, аргинина и лизина. Транслокация белков в ядро, в отличие от транслокации в митохондрии и эндоплазматический ретикулум, не сопровождается отщеплением этой сигнальной последовательности и разворачиванием полипептидной цепи. NLS-содержащие белки, как и все другие субстраты систем ядерного транспорта, переносятся в ядро в комплексе со специальными белками — транспортинами или кариоферинами (англ., transportins, karyopherins). Каждый транспортин или комплекс транспортинов для осуществления своей функции должен обладать тремя активностями: во-первых, он должен узнавать и связывать транспортируемый субстрат, во-вторых, заякориваться на ядерной поре, и в-третьих, связывать небольшой белок — GTPазу Ran, относящуюся к семейству Ras-подобных ГТФаз и служащую для сопряжения транспорта с гидролизом ГТФ, что придает процессу необратимость (снабжает его энергией). Собственно акт гидролиза ГТФ осуществляется непосредственно этим белком. Фактор обмена нуклеотидов (англ., GTPase Еxchange Factor, GEF) для Ran, хроматин-связывающй белок RCC1, локализован строго в ядре, а активаторы ГТФазной активности (англ., GTPase Activation Protein, GAP) RanGAP1 и некоторые другие белки — строго в цитоплазме. Эта асимметричная локализация приводит к формированию градиента: в ядре находится преимущественно ГТФ-связанная форма Ran, в цитоплазме, наоборот, ГДФ-связанная. Ran используется для снабжения энергией как процессов импорта, так и процессов экспорта различных субстратов, а вся схема носит название Ran-цикла (англ., Ran-cycle). Ran-цикл снабжает энергией и экспорт, и импорт, используя общий принципиальный механизм, ключевыми стадиями которого являются гидролиз ГТФ в цитоплазме и обмен ГДФ на ГТФ в ядре.
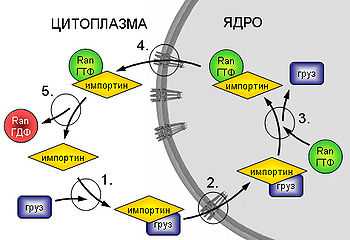
Схема импорта белков в ядро.
1. Образование комплекса груз-рецептор (импортин). 2. Заякоривание комплекса на белках ядерной поры и собственно транслокация. 3. Диссоциация комплекса груз-импортин под воздействием Ran-ГТФ, высвобождение груза, образование комплекса Ran-ГТФ-импортин. 4. Реэкспорт образовавшегося комплекса в цитоплазму. 5. Гидролиз ГТФ и диссоциация комплекса.
Механизм импорта белков в ядро
Рассмотрим механизм поступления субстратов в ядро на примере импорта NLS-содержащих белков. Первой стадией транспортировки является узнавание субстрата транспортинами, в данном случае комплексом импортинов-α/β (транспортины участвующие в транспорте в ядро называются импортинами, а из ядра — экспортинами). Затем образовавшийся комплекс заякоривается на белках ядерной поры с цитоплазматической стороны и транслоцируется через канал в ядро, где с ним связывается Ran-ГТФ, что вызывает диссоциацию комплекса и высвобождение груза. После чего импортины в комплексе с Ran-ГТФ направляются обратно в цитоплазму, где Ran под действием RanGAP1 гидролизует ГТФ (ГТФ => ГДФ + PO4 3- ). Комплекс Ran-ГДФ-импортины α/β нестабилен и диссоциирует. Ran-ГДФ поступает обратно в ядро при помощи собственного переносчика, димерного белка NTF2. В ядре под действием белка RanGEF, ГДФ в активном центре Ran заменяется на ГТФ и цикл, тем самым, замыкается.
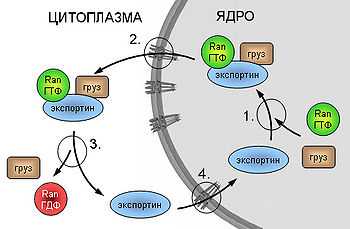
Схема экспорта белков из ядра.
1. Образование комплекса груз-экспортин-Ran-ГТФ. 2. Заякоривание комплекса на белках ядерной поры и собственно транслокация. 3. Гидролиз ГТФ, диссоциация комплекса и высвобождение груза. 4. Реимпорт высвободившегося экспортина.
Механизм экспорта белков из ядра
Теперь рассмотрим механизм экспорта из ядра на примере белков, содержащих сигналы ядерного экспорта (англ., Nuclear Export Signal, NES). Для последовательностей этих сигналов характерно содержание гидрофобных аминокислот. Первой стадией транспортировки здесь также является рецепция субстрата специфическим экспортином Crm1 (англ., Chromosome Region Maintenance) и образование комплекса. Главным отличием механизмов импорта является тот факт, что в состав транслоцирующегося комплекса в случае экспорта помимо субстрата и Crm1 входит и Ran-ГТФ, то есть сопряжение с циклом Ran происходит на стадии транслокации, а не на стадии реимпорта рецептора. После прохождения через ядерную пору в цитоплазму, Ran расщепляет ГТФ, комплекс теряет стабильность и диссоциирует, высвобождая груз.
Нуклео-цитоплазматический транспорт
Ядерная пора
Читайте также:
