Операция при повреждении печеночной артерии. Доступ, тактика
Добавил пользователь Владимир З. Обновлено: 22.01.2026
Маскин С.С., Александров В.В., Матюхин В.В., Ермолаева Н.К.
Федеральное государственное бюджетное образовательное учреждение высшего образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации, г. Волгоград, Россия
ЗАКРЫТЫЕ ПОВРЕЖДЕНИЯ ПЕЧЕНИ: АЛГОРИТМ ДЕЙСТВИЙ ХИРУРГА В УСЛОВИЯХ ТРАВМОЦЕНТРА I УРОВНЯ
При ЗТЖ консервативному лечению подлежат пострадавшие с внутриорганными (I I AAST) и небольшими субкапсулярными (I AAST) ненапряженными стабильными гематомами печени (отсутствие в них турбулентного кровотока при УЗДГ или отсутствие экстравазации контрастного вещества в паренхиму органа на КТ-ангиографии) [7, 21], если нет распространения центральной гематомы под капсулу органа и увеличения размеров органа [7, 8, 12].
Согласно рекомендациям Всемирного общества неотложной хирургии (World Society of Emergency Surgery), гемодинамически стабильные пациенты с закрытой ТП и отсутствием других абдоминальных повреждений, требующих операции, должны пройти попытку неоперативного ведения независимо от степени травмы (A2) [ 4].
При отрицательной динамике по данным УЗИ/КТ показано использование ультразвуковой допплерографии и ангиографии, последняя позволяет осуществить эндоваскулярный гемостаз [5, 9, 10, 22].
Рентгеноэндоваскулярную окклюзию ветвей печеночной артерии проводят трансфеморальным или трансаксиллярным доступом, катетер подводят к источнику кровотечения и осуществляют редукцию кровотока введением в просвет сосуда эмболов, часто дополняют введением в афферентный сосуд окклюзирующей спиралиилипериферической заглушки [3, 5, 10, 12] .
Показания к эндоваскулярной эмболизации (ЭЭ):
1. КТ-признаки продолжающегося кровотечения при отсутствии геморрагического шока (А2) [4, 5, 22].
2. Сохраняющаяся гипотония после тампонады/пакетирования [ 4, 9, 14].
3. Посттравматическая ложная аневризма печеночной артерии и ее ветвей [ 4, 7], артерио-венозная фистула или их сочетание. ЭЭ ветвей печеночной артерии в 80 % случаев позволяет избежать повторных хирургических вмешательств [3, 10].
4. Нестабильные гематомы [5, 7] , внутрипеченочные гематомы, осложненные гемобилией [3]. Ермолов А.С. и др. [7] считают показанием к ангиографии и эндоваскулярному гемостазу наличие кровотока в гематоме. Отсутствие допплеровских признаков кровотока и клиники артериобилиарного свища, небольшие размеры гематомы дают возможность выполнить ее пункцию под ультразвуковым контролем; при гематомах более 5 см показано наружное дренирование [7, 21].
В систематическом обзоре 459 публикаций, проведенном Green C.S. et al. [10] из MEDLINE, SCOPUS и Cochrane Library, показана общая эффективность ангиоэмболизации при ТП 93 %.
При наличии признаков продолжающегося интраабдоминального кровотечения у гемодинамически нестабильных пациентов с закрытой травмой печени и отсутствии других причин для шока показана экстренная операция (А2) [4, 6-8, 22].
Лапароскопические операции с низкой вероятностью конверсии выполняются у пострадавших при гемоперитонеуме до 500 мл и отсутствии признаков продолжающегося интенсивного внутрибрюшного кровотечения и шока [7, 9] , при ТП I-II ст. тяжести [5, 9, 22] .
Показаниями к лапаротомии служат: объем гемоперитонеума более 500 мл при нестабильной гемодинамике [7, 8] ; продолжающееся интраабдоминальное кровотечение, когда эндовидеохирургический или эндоваскулярный гемостаз технически невозможен/неэффективен [7]; отсутствие визуализации источника продолжающегося кровотечения [9, 12, 21, 22].
Для остановки кровотечения широко используются физические средства (табл.).
Таблица. Преимущества и недостатки некоторых физических методов гемостаза
Преимущества
Точное рассечение ткани
Минимальное распространение тепла
Длины световых волн с тканевой селективностью
Дороговизна аппарата и расходных материалов
Необходимость обучения и сертификации
При лапароскопическом использовании уменьшается визуализация из-за дымообразования
Риск повреждения соседних органов и тканей при долгой экспозиции
При использовании необходима защита глаз
При сильном кровотечении уменьшается коагулирующий эффект
Уменьшение распространения тепла
Исключение ожога тканей и прохождения тока через пациента
Не требуется нейтральный электрод
Высокая стоимость аппарата и расходных материалов
Ограничение сосудами 2-3 мм или меньше - низкая прочность на более крупных сосудах [1, 9]
Пользовательские (технические) ограничения
Относительная медленность работы
Удобство применения в тканях
Большой опыт использования
Ограничение сосудами 2 мм или меньше
Искрение, прилипание, нагар
Боковое термическое повреждение
Инструменты создают небольшое давление, не деформируя коллаген сосудистой стенки
При лапароскопическом использовании из-за дымообразования уменьшается визуализация [8]
Меньший риск дополнительных электроповреждений
Значительный опыт использования в хирургии
Не требуется нейтрального электрода
Коагулирует сосуды диаметром до 2 мм - на более крупных сосудах прочность коагулята непредсказуема
Используется при небольших (до 2 см) поверхностных повреждениях [7]
Часто требуются повторные аппликации
Боковое распространение тепла
Коагуляционный некроз глубиной около 5 мм с возможным его отслоением и развитием повторного кровотечения; грубый рубец и выраженный спаечный процесс
Гомогенная термокоагуляция сосудов d до 7 мм
Отсутствие карбонизации тканей
Минимальное воздействие в латеральных направлениях
Быстрая и безопасная коагуляция и диссекция
Нет образования аэрозолей
Хороший обзор зоны операции [8]
Максимальная глубина коагуляции 3 мм
Меньшее закисление тканей (способствует скорейшему заживлению)
Невозможно остановить кровотечение из крупной артерии
Нет технической возможности локального воздействия на сосуд
Потребность в охлаждении плазмотрона проточной водой с высокой степенью очистки, электропитании от сети 380 В, заправке баллонов дефицитным аргоном [7,8]
На базе кафедры госпитальной хирургии ВолгГМУ изучена возможность использования локального криогемостаза при повреждениях печени и селезенки [1] за счет отека тканей, сдавления мелких сосудов, внутрисосудистого стаза форменных элементов крови с тромбообразованием. Криовоздействие при травме печени способствует ижелчестазу. При ТП криогемостаз показан в случае продолжающегося кровотечения из паренхимы, при сохранении магистрального кровотока и отсутствии необходимости резекции органа [1].
Большую известность получили и местные гемостатические материалы. Однако широкому внедрению в хирургию часто препятствует высокая стоимость. Их используют в сочетании с другими хирургическими мерами или тампонированием при венозном или умеренном паренхиматозном кровотечении (В1) [8, 9].
Широко для местного гемостаза стали использовать биополимеры коллагена и желатина. Гемостатическая коллагеновая губка применяется при капиллярных и паренхиматозных кровотечениях и противопоказана при повреждении крупных сосудов, вызывает рубцевание, обладает антигенной активностью, может способствовать инфицированию вирусами гепатита и ВИЧ [19]. Тромбокол-биокомпозиция коллагена с тромбоцитарной массой и антибактериальными средствами эффективна при капиллярно-паренхиматозных кровотечениях, в условиях гипокоагуляции и гиперфибринолиза.
Гемостатическое действие губки из желатина (Spongostan, Gelfoam, Гемасепт) связано с ее ячеистой структурой и абсорбцией на ней многократно превосходящих собственную массу количеств крови, разрушением клеток крови с высвобождением тромбопластина [15].
Кровоостанавливающее действие препаратов на основе целлюлозы ( Surgicel ) обусловлено способностью оксицеллюлозы вступать в химическую связь с гемоглобином. Целлюлоза также способствует формированию фибринового сгустка и активации тромбоцитов.
Часто используются препараты тиссукол и тахокомб. Основные компоненты клея - тиссукол-тромбин, фибриноген, фактор свертывания XIII - выделяются из донорской плазмы. При нанесении на раневую поверхность происходит его полимеризация и образуется эластичная фибриновая пленка белого цвета. В результате останавливаются диффузные кровотечения, склеиваются ткани, ускоряется заживление ран. Его использование требует согревания и смешивания компонентов перед нанесением, а также специального устройства для наложения на поврежденную поверхность [8, 9].
Тахокомб представлен коллагеновой пластиной, покрытой апротинином, фибриногеном, тромбином и рибофлавином. При контакте с раневой поверхностью тромбин превращает фибриноген в фибрин, и образуется фибриновый сгусток. Апротинин препятствует фибринолизу плазмином. Агрегация тромбоцитов стимулируется коллагеном. Обладает высокой адгезивной способностью, «склеивается» с раневой поверхностью за 3-5 минут. При профузном кровотечении он может «смываться» с раневой поверхности. Пластина плохо фиксируется на неровной раневой поверхности из-за ригидности коллагеновых волокон.
Препарат Quik Clot представляет собой пористый минеральный порошок, абсорбирущий воду, увеличивая концентрацию факторов свертывания крови и ускоряя образование тромба. Препарат Celox на основе хитозана обладает повышенной адгезией к форменным элементам крови и тканям, герметизирует кровоточащую рану и не приводит к развитию экзотермической реакции [9, 23].
При обнаружении разрывов в зоне прикрепления круглой связки печени, капсулы достаточен гемостаз электрокоагуляцией. При разрыве паренхимы печени глубиной более 2 см возможно использование гемостатической губки, Тахокомба (при умеренном кровотечении) или ушивание (при сильном кровотечении) с использованием эндохирургической техники или через мини-лапаротомный/лапаротомный доступы [20].
Подкапсульная гематома представлена флюктуирующим плоским образованием темного цвета под капсулой Глиссона. Если она стабильная, занимает менее 10 % поверхности, нет необходимости в ее ревизии. Диагностику дополняют интраоперационным ультразвуковым исследованием для определения кровотока в ней и наблюдением в последующие дни. При нестабильной подкапсульной гематоме любого размера или стабильной, занимающей более 10 % поверхности печени, напряженной гематоме капсула над ней должна быть вскрыта, кровотечение остановлено. Возможно укрытие декапсулированного участка печени сеткой Surgicel [22] .
Гематомы ворот печени необходимо тщательно осматривать для исключения повреждения магистральных сосудов и внепеченочных желчных протоков. Внутрипеченочную гематому трудно диагностировать даже интраоперационно. Если она стабильная, то подлежит консервативному лечению и динамическому наблюдению.
При абдоминальной травме универсальным доступом является верхне-средне-срединная лапаротомия [8, 20, 21, 24] . Если выявлено повреждение ретрогепатического отдела НПВ и печеночных вен, то возможно расширение разреза на правую половину грудной клетки в VII-VIII межреберье с диафрагмотомией [7, 9].
В момент лапаротомии кровотечение усиливается за счет снижения интраабдоминального давления. Анестезиолог старается стабилизировать гемодинамику, хирург выполняет временный гемостаз (В2) [4, 20], а ассистент эвакуирует кровь с использованием аппарата для реинфузии [7]. Если гипотония имеет критический характер (АДсист < 70 мм рт. ст.), а ревизия органов брюшной полости затруднена вследствие большого гемоперитонеума, целесообразно прижать кулаком или сосудистой вилкой аорту к позвоночнику сразу ниже диафрагмы продолжительностью до 20-30 мин [7, 24]. Прием позволяет стабилизировать состояние пациента, приостановить артериальное и паренхиматозное кровотечение и выиграть время для интенсивной терапии (С1) [9, 24].
Альтернативой данному приему может быть установка баллона-обтуратора (С2) через бедренную артерию под рентгенологическим контролем на уровень 1-й зоны брюшного отдела аорты [12, 16]. В клинике военно-полевой хирургии Военно-медицинской академии им. С.М. Кирова за 5 лет выполнены 22 эндоваскулярные баллонные окклюзии аорты [16]. Была получена достоверно большая выживаемость в первые 12 часов [16] при использовании данного метода.
При наличии интенсивного кровотечения из паренхимы печени, глубоких разрывах с повреждением сегментарных сосудов, ассистент выполняет бимануальную компрессию органа [8, 22], а хирург для временной остановки кровотечения и обнаружения поврежденных сосудов осуществляет прием Прингла, пережимая печеночно-двенадцатиперстную связку (ПДС) [9, 20, 22]. С целью уменьшения печеночной недостаточности следует:
1) пережимать ПДС не более 20 минут с 5-минутным восстановлением кровотока через 10 минут окклюзии, а при полной сосудистой изоляции печени - не более 10 минут [7];
2) переливать в момент устранения сдавления ПДС перфторан (20 мл/кг массы). При его отсутствии можно использовать изотонический раствор хлорида натрия (30 мл/кг) с реополиглюкином (15 мл/кг). Эффективно также введение глюкокортикоидов [7];
3) осуществлять медленное восстановление кровотока после данного приема.
Тактика ведения пациентов с закрытой травмой печени во многом обусловлена гемодинамическим статусом пациента. При его стабильности возможна попытка консервативного ведения, при необходимости дополненная эндоваскулярным гемостазом. При хирургическом лечении ТП и профузном кровотечении необходим быстрый временный гемостаз с последующим окончательным, где при показаниях к тактике damage control оптимальной является тампонада печени.
Информация о финансировании и конфликте интересов.
Исследование не имело спонсорской поддержки.
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Операция аневризмы печеночной артерии

Аневризма печеночной артерии встречается редко, чаще всего ее диагностируют при разрыве. В таких случаях пациента спасти очень трудно, однако современные методы диагностики органов брюшной полости (УЗИ, МРТ или МСКТ) позволяют установить аневризму и провести ее хирургическое лечение. Сосудистые методы улучшили предыдущий серьезный прогноз. В историческом аспекте операции при аневризме печеночной артерии проходили последовательно ряд этапов: перевязка, ушивание (эндоаневризморрафия), иссечение и протезирование печеночной артерии, спленогепатический анастомоз, протезирование искусственным протезом, внутрисосудистое эндопротезирование.
Лечение аневризмы печеночной артерии в Инновационном сосудистом центре
Эта патология является очень сложной для лечения. В нашей клинике предпочтение отдается эндоваскулярным технологиям:
- Эндопротезирование - установка искусственного сосуда в просвет печеночной артерии, для того, чтобы кровь шла по этому сосуду, а полость аневризмы выключалась из кровотока. Это идеальный вариант лечения, но он требует наличия неизмененных и прямых участков артерии, чтобы хорошо спозиционировать стент-графт. Из основных недостатков - высокая стоимость стент-графта и риск его зарастания со временем.
- Эмболизация аневризмы - введение в полость аневризмы специальной спирали, которая приводит к тромбозу полости, но проходимость основного ствола сохраняется. Такой подход возможен при мешотчатых выпячиваниях стенки артерии.
- Открытая операция - резекция аневризмы с протезирование печеночной артерии собственной веной. Это эффективный и самый надежный метод лечения, однако технически бывает сложно выделить такую аневризму, так как печеночная артерия проходит в забрюшинном пространстве позади желудка и это создает известные трудности для операции. В нашей клинике при необходимости операций на общей печеночной артерии мы выполняем гибридное вмешательство - протезирование собственной печеночной артерии веной, перевязку проксимального отдела и эмболизацию полости аневризмы эндоваскулярным методом.
Прогноз после лечения при печеночной аневризме
Без хирургического лечения риск разрыва печеночной аневризмы составляет около 20% в год. Разрыв приводит к гибели 90% пациентов в течение ближайших часов от кровотечения.
Большие аневризмы вызывают эмболизацию печени, с развитием очагов ишемии или даже абсцессов печени. Иногда большая аневризма может вызвать пролежень соседних органов и желудочно-кишечное кровотечение.
До эры ультразвуковой диагностики и компьютерной томографии аневризму печеночной артерии редко диагностировали прижизненно. Сейчас это возможно на неосложненной стадии. Поэтому, если вам установили диагноз аневризмы печеночной артерии - необходимо искать хирурга, который предложит вам операцию и не надо отказываться, потому что риск смертельных осложнений очень высок.
Особенности хирургической тактики при повреждении крупных артерий брюшной полости и забрюшинного пространства (обзор литературы)
Повреждения крупных кровеносных сосудов брюшной полости и забрюшинного пространства относятся к наиболее тяжелым травмам. Несвоевременная диагностика, нерациональные доступы и методы временного гемостаза усугубляют тяжесть состояния, приводят к опасным для жизни осложнениям. Цель - обобщить данные отечественной и зарубежной литературы для улучшения результатов лечения пациентов с травмой магистральных сосудов брюшной полости и забрюшинного пространства. Рассмотрены этиология, клиника, алгоритм диагностики при абдоминальной сосудистой травме и лечение больных с повреждением крупных артерий живота, описаны способы временного и окончательного гемостаза. Для общего хирурга необходимо знание лечебно-диагностического алгоритма при травме сосудов, рациональных доступов к ним и методов временного и окончательного гемостаза, а также принципов тактики «damage control» для спасения жизни пострадавшего.
Ключевые слова
Об авторах
Федеральное государственное бюджетное образовательное учреждение высшего образования Волгоградский государственный медицинский университет Министерства здравоохранения Российской Федерации
Россия
Маскин Сергей Сергеевич - доктор медицинских наук, профессор, зав. кафедрой госпитальной хирургии.
Александров Василий Владимирович - кандидат медицинских наук, доцент кафедры
400131, Волгоград, пл. Павших Борцов, д. 1
Матюхин Виктор Викторович - кандидат медицинских наук, доцент кафедры госпитальной хирургии.
Список литературы
1. Sidawy A. N., Perler B. A. Rutherford’s vascular surgery and еndovascular therapy. 9th ed. Philadelphia, PA, Elsevier, 2019. P. 8762.
2. Pereira B. M. T., Chiara O., Ramponi F. et al WSES position paper on vascular emergency surgery // World J. Emerg. Surg. 2015. Vol. 10. P. 49. Doi: 10.1186/s13017-015-0037-2.
3. Штейнле А. В., Ефтеев Л. А., Бодоев Б. В. и др. Хирургия повреждений сосудов живота // Сибир. мед. журн. 2009. № 1. С. 147-157.
4. Затевахин И. И., Кириенко А. И., Сажин А. В. Неотложная абдоминальная хирургия : метод. рук. для практикующего врача. М. : Мед. информ. аг-во, 2018. C. 488.
6. Rasmussen T. E., Tai N. R. Rich’s Vascular Trauma. 3rd ed. Philadelphia, PA, 2016. P. 405.
7. Завражнов А. А. Применение эндоваскулярной баллонной окклюзии при повреждении крупных сосудов живота // Ангиология и сосуд. хир. 1997. № 3. С. 142.
8. Bordlee B., Schiro B., Peña C. Trauma in the Great Vessel s: from the Aorta to the Pelvis // Curr. Trauma Rep. 2017. Vol. 3. P. 207-211. Doi: 10.1007/s40719-017-0100-4.
9. Ермолов А. С., Хубутия М. Ш., Абакумов М. М. Абдоминальная травма : рук. для врачей. М. : Видар-М, 2010. C. 504.
11. Feliciano D. V., Moore E. E., Biffl W. L. Western Trauma Association Critical Decisions in Trauma. Management of abdominal vascular trauma // Journal of Trauma and Acute Care Surgery. 2015. Vol. 79, № 6. P. 1079-1088. Doi: 10.1097/TA.0000000000000869.
12. Talving P., Saar S., Lam L. Management of Penetrating Trauma to the Major Abdominal Vessels // Curr. Trauma Rep. 2016. Vol. 2. P. 21-28. Doi: 10.1007/s40719-016-0033-3.
13. Patel J. A., Rasmussen T. E. Vascular Trauma-Open or Endovascular // Curr. Trauma Rep. 2019. Vol. 5. P. 137-145. Doi: 10.1007/s40719-019-00167-5.
14. Бокерия Л. А. Клинические рекомендации. Рекомендации по диагностике и лечению заболеваний аорты // Кардиология и сердченососуд. хир. 2018. Т.11, № 1. С. 7-67.
15. Де Беки М. Е., Петровский Б. В. Экстренная хирургия сердца и сосудов. М. : Медицина, 1980. C. 248.
16. Суворов В. В., Маркевич В. Ю., Пичугин А. А. и др. Результаты внедрения дифференцированного лечебно-диагностического алгоритма при тяжелой сочетанной травме живота в травмоцентре первого уровня // Скорая мед. помощь. 2016. Т. 17. № 4. С. 45-50.
17. Смоляр А. Н., Иванов П. А. Диагностика и лечение травматических забрюшинных кровоизлияний // Травма - 2017 : мультидисциплинарный подход : сб. тез. Международ. конф., 2017. С. 369-370.
18. Spahn D., Bouillon B., Cerny V. et al. The European guideline on management of major bleeding and coagulopathy following trauma. 5th ed. // Crit. Care. 2019. Vol. 23, № 1. P. 98. Doi: 10.1186/s13054-019-2347-3.
19. Coccolini F., Coimbra R., Ordonez C. et al. Liver trauma : WSES 2020 guidelines // World J. Emerg Surg. 2020. Vol. 15. P. 24. Doi: 10.1186/s13017-020-00302-7.
20. Самохвалов И. М., Кажанов И. В., Мануковский В. А. и др. Опыт применения внебрюшинной тампонады таза при нестабильных повреждениях тазового кольца // Вестн. хир. им. И. И. Грекова. 2017. Т. 176, № 4. С. 44-47.
21. Faulconer E. R., Branco B. C., Loja M. N. et al. Use of open and endovascular surgical techniques to manage vascular injuries in the trauma setting // Journal of Trauma and Acute Care Surgery. 2018. Vol. 84. P. 411-417. Doi: 10.1097/TA.0000000000001776.
22. Рева В. А., Самохвалов И. М. Эндоваскулярная хирургия на войне // Ангиология и сосуд. хир. 2015. Т. 21, № 2. С. 166-175.
23. Chun Y., Cho S. K., Clark W. C. et al. A retrievable rescue stent graft and radiofrequency positioning for rapid control of noncompressible hemorrhage // Journal of Trauma and Acute Care Surgery. 2017. Vol. 83, № 2. P. 249-255. Doi: 10.1097/TA.0000000000001534.
24. Черная Н. Р., Муслимов Р. Ш., Селина И. Е. и др. Эндоваскулярное и хирургическое лечение больного с травматическим разрывом аорты и печеночной артерии // Ангиология и сосуд. хир. 2016. Т. 22, № 1. С. 176-181.
25. Войновский Е. А., Колтович А. П. Хирургическая тактика «damage control» при повреждении сосудов (обзор литературы) // Медицина катастроф. 2011. Т. 73, № 1. С. 54-58.
27. Ибрагимов Ф. И., Касумов Н. А. Хирургическое лечение множественных и сочетанных травм // Вестн. хир. им. И. И. Грекова. 2018. Т. 177, № 5. С. 30-35.
28. Владимирова Е. С., Валетова В. В. Временный гемостаз у пострадавших с тяжелой травмой печени и его влияние на показатели витальных функций // Мед. алф. 2016. Т. 3, № 20 (283). С. 14-19.
29. Семенов Е. А. Применение баллонной окклюзии аорты при тяжелых ранениях и травмах : автореф. дисс. … канд. мед. наук. СПб., 2018. C. 23.
30. Рева В. А., Петров А. Н., Самохвалов И. М. Первый отечественный опыт применения эндоваскулярной баллонной окклюзии аорты в зоне боевых действий // Ангиология и сосуд. хир. 2020. Т. 26. № 2. С. 61-75. Doi: 10.33529/ANGI02020204.
31. Maruhashi T., Minehara H., Takeuchi I. et al. Resuscitative endovascular balloon occlusion of the aorta may increase the bleeding of minor thoracic injury in severe multiple trauma patients : a case report // J. Med. Case Rep. 2017. Vol. 11, № 1. P. 347. Doi: 10.1186/s13256-017-1511-0.
32. Joseph B., Zeeshan M., Sakran J. et al. Nationwide Analysis of Resuscitative Endovascular Balloon Occlusion of the Aorta in Civilian Trauma // JAMA Surg. 2019. Vol. 154, № 6. P. 500-508. Doi: 10.1001/jamasurg.2019.0096.
33. Gamberini E., Coccolini F., Tamagnini B. et al. Resuscitative Endovascular Balloon Occlusion of the Aorta in trauma : a systematic review of the literature // World J. Emerg Surg. 2017. Vol. 12. P. 42. Doi: 10.1186/s13017-017-0153-2.
34. Moore L. J., Brenner M., Kozar R. A. et al. Implementation of resuscitative endovascular balloon occlusion of the aorta as an alternative to resuscitative thoracotomy for noncompressible truncal hemorrhage // Journal of Trauma and Acute Care Surgery. 2015. Vol. 79, № 4. P. 523-532. Doi: 10.1097/TA.0000000000000809.
35. Выбор тактики хирургического вмешательства при травматическом повреждении сосудов / А. В. Костырной, М. А. Потапенков, А. Э. Аргунова, В. И. Чорнобрывый // Вестн. науки и обр. 2017. Т. 1, № 25. С. 95-97.
36. Рева В. А., Самохвалов И. М., Юдин А. Б. и др. Временное эндоваскулярное протезирование артерий - новое решение в лечении тяжелой сосудистой травмы // Воен.-мед. журн. 2017. Т. 338, № 9. С. 15-19.
37. Hoehn M., Fox C., Moore E. Challenges in acute care surgery. Blunt celiac artery injury // Journal of Trauma and Acute Care Surgery. 2020. Vol. 88, № 2. P. 92-94. Doi: 10.1097/TA.0000000000002539.
38. Coleman K. C., Warner R. L., Bardes J. M. et al. Successful management of injuries to the portal triad // Journal of Trauma and Acute Care Surgery. 2019. Vol. 87, № 1. P. 240-246. Doi: 10.1097/TA.0000000000002253.
40. Ghelfi J., Frandon J., Barbois S. et al. Arterial Embolization in the Management of Mesenteric Bleeding Secondary to Blunt Abdominal Trauma // Cardiovasc. Intervent. Radiol. 2016. Vol. 39, P. 683-689. Doi: 10.1007/s00270-015-1266-1.
Аневризма печеночной артерии
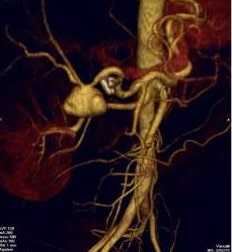
Аневризма печеночной артерии - патологическое расширение печеночной артерии, занимает четвертое место среди всех аневризм внутренних органов. Опасность представляют осложнения аневризмы - разрыв или тромбоз.
Печеночная аневризма может располагаться вне печени в ее воротах, либо внутри печени в ветвях собственной печеночной артерии. Аневризма печеночной артерии может долгое время никак себя не проявлять, но ее осложнения имеют очень высокий риск летального исхода от внутрибрюшного или кишечного кровотечения.
Чаще всего аневризма печеночной артерии бывает случайной находкой при обследовании органов брюшной полости по другому поводу. Аневризму могут выявить при УЗИ органов брюшной полости или компьютерной томографии.
Причины аневризмы печеночной артерии
Самой частой причиной развития печеночной аневризмы являются травмы печени, нетравматические аневризмы могут вызываться системными воспалительными заболеваниями, желчекаменная болезнь и холангит. Одной из возможных причин является атеросклероз с дегенерацией сосудистой стенки печеночной артерии.
Ранения и разрывы печени являются одной из самых частых причин внутрипеченочной аневризмы. Причем аневризма может развиться через любое время после перенесенной травмы. Так как болезнь проявляется только при осложнениях, диагностика бывает либо случайной, либо запоздалой.
Жалобы и симптомы
Неосложненное течение аневризмы может не вызывать никаких жалоб и тогда диагноз становится случайной находкой. При выслушивании живота можно определить в проекции печени систолический шум. Аневризмы больших размеров могут вызвать сдавление желчных протоков и механическую желтуху. При больших аневризмах может ощущаться боль в правом подреберье, такие образования могут прощупываться при обычной пальпации живота, как пульсирующая опухоль.
Осложнения печеночной аневризмы
При осложнении аневризмы прорывом в желчные пути может развиться клиника желудочно-кишечного кровотечения - рвота с кровью, черный стул. При разрыве аневризмы печеночной артерии в свободную брюшную полость развивается клиника профузного внутреннего кровотечения с холодным липким потом, слабостью, учащением пульса.
При образовании артерио-венозного свища между аневризмой и воротной веной развивается картина портальной гипертензии с характерными кровотечениями из варикозно-расширенных вен пищевода.
Спасти пациента с разорвашейся аневризмой или желудочно-кишечным кровотечением на фоне прорыва аневризмы в желчные пути очень сложно. Поэтому, если при случайном обследовании выявляется аневризма печеночной артерии - необходима срочная консультация сосудистого хирурга.
Прогноз при аневризме печеночной артерии
Заболевание протекает скрыто и часто проявляется только при развитии осложнений. При осложнениях кровотечением в брюшную полость или желчные пути прогноз очень сомнительный. Только своевременное и быстрое вмешательство у подготовленных специалистов позволяет рассчитывать на успех и выживание пациента.
В силу такой опасности, аневризмы печеночных артерий должны оперироваться в ближайшее время после выявления заболевания. После эндоваскулярного лечения или открытой операции риски разрыва аневризмы устраняются и пациент выздоравливает.
Трансъюгулярное внутрипеченочное портосистемное шунтирование (TIPS)
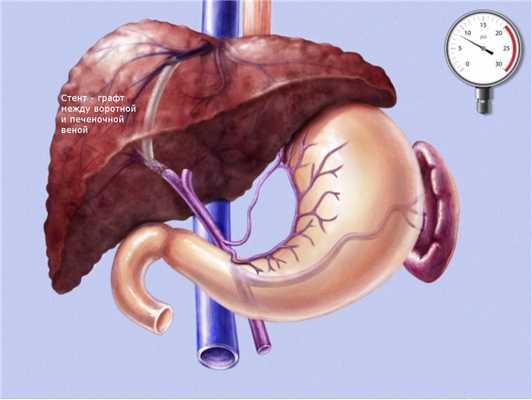
Трансюгулярное внутрипеченочное портосистемное стентирование (TIPS) представляет собой эндоваскулярную операцию по созданию искусственного канала в печени, который обеспечивает отток крови из воротной вены в нижнюю полую вену, минуя пораженную печеночную ткань.
Операция эффективно останавливает кровотечения из варикозных вен пищевода и уменьшает асцит, за счет снижения давления в воротной вене, которое всегда повышено при циррозе печени.
Операция проводится в рентгеноперационной под контролем ангиографии. Во время вмшетельства используются контрастные вещества и ультразвуковое сканирование печени. Средняя продолжительность вмешательства около 2 часов.
Подготовка и обследование для TIPS
Для определения вида портальной гипертензии необходимо выполнить визуализацию структуры печени, проходимость вен воротной системы и определить степень портальной гипертензии и ее риски.
Необходимые методы диагностики:
- УЗИ внутренних органов живота (печени, селезенки, поджелудочной железы) - дают возможность оценить степень поражения печени, выявить опухоли печени и поджелудочной железы, увеличение селезенки.
- УЗИ воротной вены позволяет получить общую информацию о размере и проходимости воротной вены.
- МРТ внутренних органов и вен брюшной полости - в сосудистом режиме позволяет оценить проходимость воротной вены
- Компьютерная томография с ангиографией аорты и венозной фазы - позволяет получить общую оценку воротной системы и варикозных вен в брюшной полости
- Прямая портография (чрезпеченочное введение катетера и контрастирование воротной системы) - заключительный метод диагностики перед вмешательством.
Анестезиологическая поддержка
- За неделю до операции мы переводим пациентов на диету с ограничением белковых продуктов. Это делается для того, чтобы избежать развития энцефалопатии в раннем послеоперационном периоде.
- Накануне вмешательства даются слабительные препараты и ставится очистительная клизма, дается легкий ужин.
- Операция проводится под местной анестезией мест проколов. Анестезиолог присутствует в операционной, для контроля за жизненно-важными функциями организма.
- Пациенту устанавливается мочевой катетер и монитор для измерения артериального давления и снятия ЭКГ.
Как проходит операция
Трансюгулярное внутрипеченочное портосистемное шунтирование проводится под рентгеноскопическим контролем с использованием ультразвукового сканирования для контроля доступов к сосудам.
Доступ к печеночной вене осуществляется через внутреннюю яремную вену на шее. Для облегчения доступа используется ультразвуковой контроль. После пункции устанавливается проводник и интродьюсер. Проводник с катетером проводятся в нижнюю полую и печеночную вену. После установки катетера в печеночной вене измеряется давление прямым методом, чтобы рассчитать в последующем градиент.
Для поиска ветви воротной вены может использоваться УЗИ навигация, либо проводится пункция печени под УЗИ контролем и проводится контрастное исследование портальной системы с использованием функции roadmap.
После определения целевой воротной вены через катетер в печеночной вене проводится пункция специальной иглой. Проведя последнюю в воротную вену через нее устанавливают проводник и проводят катетер. Проводится контрастирование воротной системы через яремный катетер и замеряется давление в воротной системе.
Через паренхиму печени по проводнику проводится баллон, который затем раздувается создавая канал в печеночной ткани. После извлечения баллона по проводнику проводится специальный стент-графт, представляющий собой трубчатую металлическую сетку покрытую внутри специальным герметичным пластиком.
Таким образом, мы соединяем прямым шунтом воротную и печеночную вену, что способствует снижению давления в воротной системе и предупреждает рецидивы кровотечения.
После измерения давления в воротной системе все инструменты удаляются, а пациент помещается в палату наблюдения.
Возможные осложнения
В руках опытного хирурга частота опасных осложнений составляет менее 1%. Очень редко может развиться внутрибрюшное кровотечение или абсцесс печени.
Чаще встречаются осложнения, связанные с успехом процедуры. Прямой поток крови из кишечника может привести к увеличению поступления в системный кровоток азотистых шлаков и развитие энцефалопатии. Проявления энцефалопатии (тремор, бессоница, спутанность сознания) наблюдаются у 25% прооперированных пациентов, однако у большинства пациентов эти симптомы проходят в течение недели после операции. Для предупреждения энцефалопатии необходимо уменьшить потребление белковой пищи.
Недостаточность кровоснабжения печени - ишемический гепатит является более редким осложнением, так как при портальной гипертензии основное кровообращение печень получает за счет печеночной артерии. Однако в некоторых случаях, создание шунта может вызвать ишемическое повреждение печени с острой печеночной недостаточностью, что может потребовать срочного закрытия шунта.
Редким, но серьезным осложнением является развитие инфекционного процесса в зоне вмешательства, то есть нагноения стент-графта. Для предупреждения подобного осложнения в послеоперационном периоде применяются сильные антибиотики.
Прогноз после TIPS
Важно понимать, что портокавальные анастомозы не лечат цирроз печени, но устраняют опасные для жизни осложнения. Пациенты с функционирующим шунтом имеют меньший риск умереть от желудочно-кишечного кровотечения, однако сохраняется риски связанные с печеночной недостаточности.
В целом TIPS позволяет избежать преждевременного неблагоприятного исхода связанного с кровотечениеми и часто применяется как предварительное вмешательство перед пересадкой печени.
Наблюдение после операции
Контроль за функцией шунта осуществляется как с помощью прямых методов визуализации, так и косвенных.
Из косвенных признаков важным является уменьшение диаметра вен в подслизистом слое перехода из пищевода в желудок. Это позволяет иметь уверенность, что рецидива кровотечения не будет. ЭГДС мы рекомендуем выполнять через неделю и через месяц после вмешательства, а затем раз в 6 месяцев.
При ультразвуковом сканировании отмечается кровоток по шунту и определяется его скорость. Оценивается диаметр воротной вены и размеры селезенки. Так же можно отметить уменьшение асцита. УЗИ рекомендуем выполнять каждые 3 месяца у нашего специалиста.
Через год после вмешательства мы рекомендуем выполнить МСКТ ангиографию брюшной полости с оценкой венозной фазы. При этом хорошо выявляется функционирующий стент.
Метод TIPS в Инновационном сосудистом центре
Сосудистые хирурги Инновационного сосудистого центра с 2004 года занимались проблемой лечения осложнений портальной гипертензии, выполняя открытые портокавальные вмешательства. С 2011 года в нашей клинике появилась возможность выполнять эндоваскулярные операции взамен более опасных открытых вмешательств.
Для операций TIPS мы берем пациентов с печеночной формой портальной гипертензии и осложненной тяжелым варикозным расширением вен пищевода, либо уже после состоявшегося пищеводного кровотечения. После обследования мы принимаем решение о виде оперативного вмешательства.
Читайте также:
- Характерный, народный танцы, танец модерн и их характеристика
- Орган обоняния эмбриона. Носовые камеры и раковины плода
- Случай успешного лечения смешанного геморроя
- Преимущества и недостатки местной анестезии при бронхоскопии. Противопоказания к местной анестезии
- Всасывание. Функция всасывания кишечника. Транспорт питательных веществ. Щеточная кайма энтероцита. Гидролиз питательных веществ.
