Перитонеовенозный шунт LeVeen. Описание особенностей перитонеовенозного шунта.
Добавил пользователь Skiper Обновлено: 08.01.2026
Действующее вещество: макроагрегированный человеческий сывороточный альбумин, 2,0 мг.
Вспомогательные вещества: олова (II) хлорид дигидрат, аскорбиновая кислота, глюкоза, натрия хлорид
1 флакон содержит 2-4 × 106 частиц диаметром 10-90 мкм.
Фармакотерапевтическая группа
Диагностические радиофармацевтические средства. Средства для исследования респираторной системы. КОД ATX: V09EB01.
Фармакологические свойства
Фармакодинамика
При введении раствора 99mТс-Макро-Альбумон в обычных дозах и обычным путем не выявляется клинических значимых фармакодинамических эффектов.
Фармакокинетика
Через 5-10 минут после внутривенного введения раствора 99тТс-Макро-Альбумон более 80% меченых макроагрегатов, приводящих к микроэмболии, блокируются в легочных капиллярах. Принимая по внимание, что при введении используется достаточное количество радиоактивных частиц, распределение радиоактивных агрегатов происходит равномерно во всей кровеносной сети легких, образуя однородное изображение. Участки со сниженным кровообращением будут накапливать меньшее количество радиоактивных частиц. Меченые макроагрегаты остаются в легких в течение различного количества времени в зависимости от структуры, размеры и количества частиц.
Размер частиц составляет от 10 до 100 мкм. Микроэмболия, которая вызывается введением 300000-500000 частиц, не вызывает нарушений кровообращения.
Уровень радиоактивности в легких снижается экспоненциально. Частицы размером от 5 до 90 мкм имеют период полувыведения от 2 до 8 часов, агрегаты большего размера имеют более длительный период полувыведения.
Снижение содержания в легких вызвано механическим разрушением частиц, блокировавших легочные капилляры, под воздействием систо-диастолического давления внутри самого капилляра. При распаде частицы фрагментируются до более мелких частиц, и при попадании в кровоток в виде микроколлоидного альбумина удаляются из организма макрофагами ретикулоэндотелиальной системы в печени и селезенке. Микроколлоидные частицы метаболизируются при попадании радиоактивной метки (99тТс) в системный кровоток, после чего выводятся через почки.
Доклинические данные по безопасности
В ходе доклинических исследований не было выявлено патологических поражений органов лабораторных животных. На сегодняшний день в соответствующей литературе отсутствуют данные о мутагенности, тератогенности и канцерогенности данного радиофармацевтического препарата.
Существует корреляция между размеров частиц макро-альбумона и их токсическим эффектом. Патофизиологические механизмы, ответственные за развитие токсического действия, связаны с повышением легочного артериального давления. Первые признаки токсического действия на легкие (например, тахипноэ) наблюдались при введении собакам частиц размером от 10 до 50 мкм в дозе 20-25 мг/кг массы тела.
Показания к применению
Раствор 99mТс-Макро-Альбумон предназначен для проведения сцинтиграфии легких с целью оценки перфузии легких у взрослых и детей.
Раствор 99mТс-Макро-Альбумон может быть использован у взрослых для оценки проходимости перитонеовенозного шунта (LeVeen).
Способ применения и дозировка
Применение у взрослых
Рекомендуемая активность при выполнении сцинтиграфии легких взрослым пациентам (средняя масса 70 кг) составляет 37-185 МБк.
Количество частиц для перфузионной сцинтиграфии легких должно составлять в диапазоне от 60 × 103 до 700 × 103. Исследование должно быть начато сразу после введения препарата.
Применение у детей
Активность у детей может быть рассчитана из рекомендованной дозы для взрослых, скорректированной на массу тела ребенка.
Педиатрическая группа Европейского общества ядерной медицины рекомендует
использовать для расчета дозы следующую таблицу:
| 3 кг = 0.10 | 22 кг = 0.50 | 42 кг = 0.78 |
| 4 кг = 0.14 | 24 кг = 0.53 | 44 кг = 0.80 |
| 6 кг = 0.19 | 26 кг = 0.56 | 46 кг = 0.82 |
| 8 кг = 0.23 | 28 кг = 0.58 | 48 кг = 0.85 |
| 10 кг = 0.27 | 30 кг = 0.62 | 50 кг = 0.88 |
| 12 кг = 0.32 | 32 кг = 0.65 | 52-54 кг = 0.90 |
| 14 кг = 0.36 | 34 кг = 0.68 | 56-58 кг = 0.92 |
| 16 кг = 0.40 | 36 кг = 0.71 | 60-62 кг = 0.96 |
| 18 кг = 0.44 | 38 кг = 0.73 | 64-66 кг = 0.98 |
| 20 кг = 0.46 | 40 кг = 0.76 | 68 кг = 0.99 |
Минимальная рекомендованная активность составляет 15 МБк для детей менее 1 года.
В соответствии с рекомендациями Европейского общества ядерной медицины количество частиц должно быть следующим:
Противопоказания
Гиперчувствительность к активной субстанции или любым вспомогательным веществам, входящим в состав лекарственного средства.
Лекарственное средство не должно использоваться для проведения коронарографии при введении в коронарные артерии, а также для сцинциграфического исследования церебрального кровотока при введении во внутреннюю сонную артерию.
Лекарственное средство не должно использоваться у людей, имеющих аллергические реакции на введение белка.
Передозировка
Результаты экспериментов на животных с использованием препарата Макро-Альбумон указывают на то, что риск передозировки отсутствует.
При использовании данного препарата передозировки в классическом смысле слова не существует (напр., введение слишком большого количества препарата на кг массы тела), но для раствора 99mТс-Макро-Альбумон под передозировкой следует понимать введение чрезмерно большого количества агрегированных частиц. У взрослых максимальное количество вводимых частиц не должно превышать 1.5 × 106. Риск ненамеренной передозировки, связанной с введением чрезмерного количества радиоактивности, может быть снижен путем стимуляции диуреза, т.е. более частым мочеиспусканием.
Меры предосторожности
Взаимодействие с другими лекарственными средствами
Срок годности
Условия хранения
Условия отпуска
Перитонеовенозный шунт LeVeen. Описание особенностей перитонеовенозного шунта.
Как вы заботитесь о собственной печени?
Конференция, посвященная 80-летию со дня рождения профессора А.К. Ерамишанцева
4 правила здоровой печени
Сергей Собянин: Крупнейшие московские клиники должны быть названы именами выдающихся врачей
Россияне будут бесплатно лечиться за рубежом
Перитонеовенозное шунтирование
Перитонеовенозное шунтирование обеспечивает продолжительный лечебный эффект на длительный период. Оно вызывает увеличение объёма циркулирующей крови путём непрерывного поступления асцитической жидкости из брюшной полости в общий кровоток (рис. 9-8). Увеличение объёма циркулирующей крови подтверждается снижением в плазме уровней ренина, ангиотензина, норадреналина, антидиуретического гормона и ПНФ. Улучшаются кровоснабжение и функция почек.
Операцию выполняют под общим обезболиванием на фоне профилактического введения антибиотиков. Брюшную полость дренируют с помощью длинной перфорированной пластиковой трубки, достигающей области таза. Трубку соединяют с реагирующим на изменение давления клапаном, который располагают экстраперитонеально. Который в свою очередь соединен с силиконовой трубкой, которая проходит в подкожном канале от живота до шеи.
На шее трубку проводят через внутреннюю яремную вену в верхнюю полую вену. При смещении вниз диафрагмы во время вдоха давление внутрибрюшной жидкости нарастает, в то время как давление в верхней полой вене и в грудной полости падает. Таким образом при дыхании возникает сила, открывающая клапан и засасывающая жидкость в верхнюю полую вену. Эта операция устраняет асцит на длительное время.
Перитонеовенозный шунт LeVeen
До недавнего времени единственным методом лечения рефрактерного к лекарственной терапии асцита, вызванного циррозом печени, было портокавальное шунтирование. Однако портокавальное шунтирование приводило к высокой смертности из-за частых осложнений, обусловленных энцефалопатией и усугублением печеночной недостаточности.
В настоящее время, благодаря эффективности современных диуретических и антиальдостероновых препаратов в сочетании с низкосолевой диетой (1), преобладающее большинство пациентов с асцитом, вызванным циррозом, поддается лечению. Прежде чем подвергать пациента оперативному вмешательству по поводу асцита, вызванного циррозом печени, всегда необходимо попытаться провести активное медикаментозное лечение в течение по крайней мере двух недель. В 1974 г. Напу LeVeen (4) разработал перпто- неовенозный шунт с однонаправленным клапаном, который позволяет асцитической жццкости течь из брюшной полости в венозную систему. Этот клапан устроен таким образом, что открывается при внут- рибрюшном давлении, превышающем 3 см вод. ст. (т.е. когда оно превышает внутригрудное и центральное венозное давление'). При повышении центрального венозного давления клапан закрывается (4—7).
Без сомнения, шунт LeVeen — искусное изобретение, способствующее уменьшению симптомов асцита. Однако, когда пациенты, получающие медикаментозное лечение, перестают отвечать на диуретики, возникает опасность тубулярного некроза. В этой ситуации наложение шунта не дает эффекта. С другой стороны, еслп у пациентов с гепаторенальным синдромом не применить шунтирование, также может развиться тубулярный некроз. Иногда эти две ситуации трудно различить. Важным отличительным признаком может быть концентрация натрия в моче (5, 6).
Несмотря на кажущуюся простоту, перитонеовенозный шунт может приводить к многочисленным осложнениям, возникающим при его наложении и в послеоперационном периоде. Среди этих осложнений метут быть: инфекция, тромбоз, диссеминированное внутрисосудпстое свертывание іфови.
воздушная эмболия и т. п. (6, 12). Частота этих и других осложнений значительно снижается, если строго следовать инструкциям LeVeen и его сотрудников, которые накопили огромный опыт (6, 7). С той же целью, что и клапан LeVeen, используют другие перптонеовеноз- ные клапаны, например шунт Denver. Сравнительное исследование клапанов LeVeen и Denver, выполненное Fulenwider и его коллегами, показало, что клапан LeVeen превосходит клапан Denver, хотя при пх использовании длительность жизни пациентов после операции не отличается. Автор имеет опыт работы исключительно с шунтом LeVeen. Перитонеовеноз-
ный шунт можно также использовать для лечения асцита, вызванного другими причинами, например, асцита при злокачественных опухолях. Однако онкологическим больным перптонеовенозный клапан накладывают іфайне редко, обычно при раке яичника. Асцитическая жидкость, продуцируемая карциномой, часто содержит опухолевые клетки, способные образовывать колонии. Это приводит к тому, что шунт становится фактором распространения опухолевых клеток через кровяное русло.
Единственной альтернативой лечению цирроза печени и его осложнений является трансплантация печени. В случаях, когда трансплантацию выполнить нельзя, перитонеовенозный шунт может быть временным решением для уменьшения симптомов, от которых страдают пациенты, что делает остаток пх жизни менее мучительным. Шунт улучшает состояние пищеварения и снижает дыхательные расстройства, вызванные повышением внугрибрюшного давления с его гемодинамически ми последствиями. Шунт также улучшает способность пациентов к передвижению и тд.
TIPS. Когда? Кому? Зачем?
Статья представляет собой обзор современных данных о применении трансъюгулярного внутрипеченочного портосистемного шунтирования (TIPS) у больных циррозом печени. Дана историческая справка о становлении метода и теоретическое обоснование его применения. Основное внимание уделено показаниям и противопоказаниям к проведению TIPS, названы наиболее частые осложнения после его проведения. Представлены данные об эффективности TIPS в зависимости от исходного состояния на основании результатов рандомизированных клинических исследований.
- КЛЮЧЕВЫЕ СЛОВА: цирроз печени, асцит, энцефалопатия
Общие положения
Единственным радикальным методом лечения цирроза печени (ЦП) и его осложнений является трансплантация печени. Существуют противопоказания к выполнению пересадки печени при ЦП, но развитие этого направления во всем мире в наибольшей степени сдерживает ограниченная доступность донорских органов.
Как правило, пациенты с ЦП умирают от осложнений. Поэтому от комплекса мер, направленных на профилактику прогрессирования ЦП, а также профилактику и лечение осложнений, следует ожидать продления жизни у многих пациентов.
Большинство осложнений (самые грозные из них кровотечение из варикозно расширенных вен пищевода (ВРВП) и желудка, рефрактерный асцит и гепаторенальный синдром (ГРС)) развивается вследствие прогрессирующей печеночной недостаточности и портальной гипертензии. Несмотря на возможность медикаментозной коррекции портального давления, наиболее продолжительный и надежный эффект достигается хирургическими методами.
Длительная история хирургии портальной гипертензии привела к селекции небольшого числа наиболее эффективных и безопасных шунтирующих операций, различные модификации которых используются в настоящее время.
С начала 1990-х гг. увеличилось число публикаций, посвященных результатам применения метода малоинвазивного портокавального шунтирования. Это так называемые операции трансъюгулярного внутрипеченочного портосистемного шунтирования, или TIPS (transjugular intrahepatic portosystemic shunt). Эта аббревиатура широко используется в англоязычной литературе. В русскоязычной медицинской литературе кроме этой аббревиатуры встречается ТИПС - трансъюгулярное интрапеченочное портосистемное стентирование.
Изначально методика была предложена для малоинвазивного лечения и профилактики осложнений портальной гипертензии, связанной с ЦП.
Метод основан на принципе равенства давления в синусоидах и давления заклинивания в печеночных венах (ДЗПВ), а также устойчивой прямой корреляции между давлением в системе воротной вены и давлением в синусоидах. Под давлением заклинивания подразумевается давление, достигаемое в крупном притоке одной из печеночных вен при раздувании баллончика на рабочей части катетера, который проводится пункционно через яремную вену, верхнюю полую вену, правое предсердие и нижнюю полу вену в устье одной из печеночных вен. Создаваемая таким образом окклюзия для кровотока в печеночной вене позволяет определить давление ниже уровня окклюзии и получить информацию о давлении в синусоидах. В здоровой печени механизм компенсации повышения давления в синусоидах функционирует благодаря перераспределению тока крови между синусоидами. Поэтому значение давления заклинивания несколько меньше. Подобный механизм перераспределения практически отсутствует в цирротически измененной печени вследствие нарушения архитектоники долек постнекротическими изменениями. ДЗПВ отражает давление в системе воротной вены только при отсутствии подпеченочного блока.
Для диагностических целей не используются собственно значения ДЗПВ, а также свободного давления в печеночных венах (СДПВ). Диагностическое значение имеет разница этих показателей, называемая градиентом давления в печеночных венах (ГДПВ). Как правило, для получения более точного значения ГДПВ проводится трехкратное измерение ДЗПВ. В норме ГДПВ составляет 3-5 мм рт. ст. Более высокие значения ГДПВ расцениваются как показатель портальной гипертензии независимо от наличия или отсутствия клинических проявлений [1].
Измерение ДЗПВ - эффективный метод оценки давления в системе воротной вены, особенно для пациентов с алкогольным ЦП и ЦП вирусной этиологии (в том числе вирус гепатита C) [2].
Тем не менее в ряде исследований, посвященных сравнению эффективности измерения ДЗПВ с прямыми методами измерения величины портального давления, показано расхождение полученных данных у больных ЦП в исходе хронического гепатита С [3].
В настоящее время считается доказанным, что превышение пороговых значений ГДПВ служит прогностическим показателем для развития ВРВП и кровотечения [4].
ГДПВ > 5 мм рт. ст. в отсутствие клинических проявлений соответствует субклинической портальной гипертензии. ГДПВ ≥ 10 мм рт. ст. считается показателем клинически значимой портальной гипертензии и служит предиктором развития осложнений ЦП, в том числе летального исхода [5]. ГДПВ > 12 мм рт. ст. является пороговым для разрыва ВРВП [4, 6].
Впервые давление в воротной системе было измерено в 1896 г. у собаки посредством канюли, установленной в брыжеечную вену и соединенной с водным манометром [7]. Тем не менее методика прямого измерения портального давления не получила клинического применения из-за инвазивности и неудобства использования на практике.
В 1951 г. J.D. Myers и W.J. Taylor впервые описали измерение давления заклинивания в печеночных венах, которое отражало давление в синусоидах, как первый метод непрямой оценки портального давления [8]. Впоследствии было доказано, что давление заклинивания строго коррелирует с давлением в системе воротной вены. Однако на практике стали использовать разницу давления заклинивания и свободного давления в печеночных венах. Экспериментальное изучение TIPS началось в 1970-х гг. Первые публикации о клиническом применении методики появились в начале 1990-х гг. В настоящее время опыт применения TIPS, согласно данным литературы, исчисляется тысячами пациентов.
Первые рекомендации были разработаны после конференции, проведенной под эгидой национальных институтов здоровья в 1995 г. Было показано, что методика TIPS эффективна как для купирования острого кровотечения из ВРВП, так и для профилактики рецидива кровотечения из ВРВП. Однако оставалось неясным, насколько TIPS по эффективности превосходит медикаментозную терапию и хирургию в лечении осложнений портальной гипертензии. Не было полного представления и о возможностях TIPS в лечении рефрактерного асцита и синдрома Бадда - Киари.
Операции TIPS внедрены в ограниченном числе российских клиник 11. В проекте клинических рекомендаций по лечению кровотечений из ВРВП и желудка, разработанных в 2013 г. специалистами ведущих центров СНГ, занимающихся лечением больных портальной гипертензией, сказано, что применение TIPS должно быть ограничено случаями профузных кровотечений из ВРВП и желудка у больных ЦП и портальной гипертензией, которым планируется трансплантация печени [12].
При выполнении TIPS крайне важны правильная регистрация и интерпретация показателей венозного давления. Измерение ГДПВ обычно проводится под седацией и местной анестезией. Интродьюсер устанавливается обычно в правую яремную вену пункционно по методике Сельдингера. Реже используются бедренный или кубитальный доступы. Катетер с баллончиком на рабочей части (Swan-Ganz или Goodale Lubin) диаметром 7-Fr под рентген-телевизионным контролем проводится и «заякоривается» в печеночной вене на глубине 3-4 см от устья печеночной вены. Измеряется СДПВ. После стабилизации показателей СДПВ и подтверждения герметичности окклюзии просвета печеночной вены баллоном трехкратно регистрируются показатели ДЗПВ. Учитывается их среднее значение, причем разница всех трех измерений не должна превышать 1 мм рт. ст. При наличии показаний к шунтированию проводник из печеночных вен через паренхиму печени низводится в одну из ветвей воротной вены. Проводятся канюляция воротной вены и портография. Устанавливается саморасширяющийся стент.
Показания к TIPS
Согласно рекомендациям Американской ассоциации по изучению заболеваний печени (American Association for the Study of Liver Diseases - AASLD) показания к TIPS условно разделены на две группы - подтвержденные и не подтвержденные контролируемыми исследованиями [13].
К первой группе показаний эксперты относят прежде всего профилактику повторных кровотечений из ВРВП и рефрактерный асцит на фоне ЦП. Вторую группу показаний, в отношении которых эффективность оценивалась в неконтролируемых исследованиях, составляют острое кровотечение из варикозно расширенных вен (ВРВ) при неэффективности эндоскопических методов гемостаза, портальная гастропатия, кровотечение из ВРВ желудка, желудочная антральная сосудистая эктазия, гидроторакс на фоне портальной гипертензии, рефрактерный к другим методам лечения, гепаторенальный синдром 1-го и 2-го типов, синдром Бадда - Киари, веноокклюзионная болезнь, гепатопульмональный синдром.
Основной задачей TIPS является снижение давления в системе воротной вены. При этом достигается доказанная в рандомизированных клинических исследованиях профилактика рецидива кровотечения из ВРВП и купирование или уменьшение проявлений рефрактерного асцита.
Критериями эффективности TIPS в профилактике рецидива кровотечения служат снижение ГДПВ 20 мм рт. ст. показано TIPS (летальность 11% против 38% в группе без TIPS) [18]. В отсутствие эффективных методов прогнозирования риска рецидива кровотечения TIPS не должно использоваться в профилактике рецидива кровотечения у пациентов только с одним эпизодом кровотечения из ВРВП. Показания к TIPS должны быть ограничены неэффективностью медикаментозной терапии или эндоскопического лечения.
Методика TIPS эффективна в профилактике кровотечения из ВРВ желудка и эктопических ВРВ (включая ВРВ кишечника, кишечных стом, аноректальные) и предпочтительна в профилактике рецидива кровотечения в этой группе пациентов. Показано, что для профилактики рецидива кровотечения из ВРВ желудка можно достичь меньшего ГДПВ, чем для ВРВП, хотя не исключена необходимость эмболизации ВРВ [19].
Еще одно показание к TIPS, целесообразность которого доказана в рандомизированных клинических исследованиях, - рефрактерный асцит. Это асцит, не поддающийся курации при ограничении поваренной соли и назначении высоких доз диуретиков (спиронолактон 400 мг/сут, фуросемид 160 мг/сут), а также асцит у пациентов, не толерантных к диуретикам [20, 21]. Развитие рефрактерного асцита усугубляет прогноз заболевания, повышая годичную летальность до 50% [21, 22].
Из многих методов лечения рефрактерного асцита в настоящее время обсуждаются только TIPS и парацентез большими объемами. Методы перитонеовенозного шунтирования не рассматриваются из-за высокого риска осложнений. Вместе с тем по сравнению с профилактикой кровотечений из ВРВП эффективность TIPS в купировании или уменьшении рецидивов рефрактерного асцита определена в меньшей степени. Трудная объективизация прогноза связана с тем, что причиной рефрактерного асцита является не только нарушение кровотока в системе воротной вены, но и нарушение почечного кровотока. Поэтому снижение портального давления может быть недостаточным для увеличения диуреза и уменьшения продукции асцита. Одним из способов повышения эффективности TIPS в такой ситуации стало более выраженное снижение ГДПВ по сравнению с профилактикой рецидивов кровотечения из ВРВП 45 мм рт. ст.).
Относительными противопоказаниями считаются гепатоцеллюлярная карцинома (ГЦК), особенно центральной локализации, обструкция всех печеночных вен, тромбоз воротной вены, тяжелая коагулопатия (международное нормализованное отношение > 5), тромбоцитопения 3 , легочная гипертензия средней тяжести [13].
При высоком риске летального исхода в течение 30 дней (MELD > 15-18 или уровень общего билирубина > 70 мкмоль/л) пациент должен быть информирован о прогнозе. TIPS возможно только при отсутствии других вариантов лечения (метод выбора - трансплантация).
В связи с изложенным выше особое значение имеет правильный отбор кандидатов для проведения TIPS.
Перитонеовенозный шунт (шунт Левина)
Перитонеовенозное шунтирование обеспечивает продолжительный лечебный эффект (на многие месяцы) [29]. Оно вызывает увеличение объёма циркулирующей крови путём непрерывного поступления асцитической жидкости из брюшной полости в общий кровоток (рис. 9-8). Увеличение объёма циркулирующей крови подтверждается снижением в плазме уровней ренина, ангиотензина, норадреналина, антидиуретического гормона и ПНФ. Улучшаются кровоснабжение и функция почек.
Эту операцию выполняют под общим обезболиванием на фоне профилактического введения антибиотиков. Брюшную полость дренируют с помощью длинной перфорированной пластиковой трубки, достигающей области таза. Трубку соединяют с реагирующим на изменение давления клапаном, который располагают экстраперитонеально. Он в свою очередь соединен с силиконовой трубкой, которая проходит в подкожном канале от живота до шеи. На шее трубку проводят через внутреннюю яремную вену в верхнюю полую вену. При смещении вниз диафрагмы во время вдоха давление внутрибрюшной жидкости нарастает, в то время как давление в верхней полой вене и в грудной полости падает. Таким образом при дыхании возникает сила, открывающая клапан и засасывающая жидкость в верхнюю полую вену.
Эта операция устраняет асцит на длительное время. Однако число осложнений велико. Периоперационная летальность составляет около 18 % [39], а по некоторым данным, достигает 52 % [56]. Обычно после операции развивается легкая форма ДВС-синдрома, вызванного попаданием в кровь прокоагулянтов и коллагена, содержащихся в асцитической жидкости [6]. ДВС-синдром может протекать тяжело и привести к летальному исходу. Удаление асцита и введение солевых растворов перед шунтированием служат профилактикой осложнений. К ранним осложнениям относятся подтекание асцитической жидкости из операционной раны, кровотечение из варикозно-расширенных вен и отёк лёгких. Позднее развиваются инфекционные осложнения, чаще — эндокардит правых отделов сердца. Несмотря на высокую частоту повторных госпитализаций в связи с нарушением функции шунта, необходимость в них возникает реже, чем при повторных парацентезах. Продолжительность пребывания больного в стационаре зависит от тяжести основного заболевания. Операция противопоказана при гепаторенальном синдроме [13].
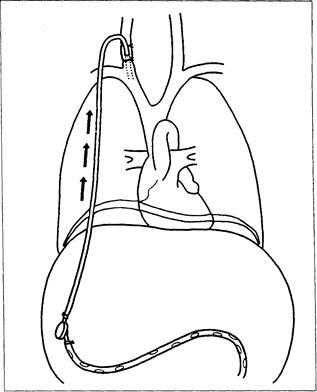
Рис. 9-8. Перитонеовенозный шунт.
В многоцентровом исследовании не выявлено преимуществ шунтирования по Ле Вину по сравнению с парацентезом независимо от применения диуретиков. Эффект лечения через месяц после шунтирования был лучше, но при этом показатель выживаемости оказался ниже. Однако через год эффективность лечения и показатель выживаемости были примерно одинаковыми в обеих группах больных. Наложение перитонеовенозного шунта позволяет быстрее удалить асцитическую жидкость, однако на прогноз заболевания не влияет |63|. Больным циррозом печени группы С по Чайлду операция противопоказана.
Найдите 2 минуты и прочитайте про:
Перманганатометрическое титрование Перманганатометрическое титрование, или перманганатометрия, &mdash.
ФИЛОСОФИЯ XX ВЕКА И ЕЕ ОСНОВНЫЕ НАПРАВЛЕНИЯ Вторая половина XIX-XX вв. - новый этап в развитии мировой философии. Философию XX века можно назвать постклассической.
Теория культурно-исторических типов Н. Я. Данилевского В 1869 году увидела свет знаменитая работа публициста, социолога и естествоиспытателя Николая Яковлевича Данилевского .
Акторы международных отношений: государственные и негосударственные 1. Участник международных отношений - это лицо, которое участвует в международных отношениях и влияет (изменяет) их. Лондонская.
Цитатная характеристика Базарова Базаров - друг Аркадия Кирсанова: ". Приятель Аркаши, очень, по его словам, умный человек. " Возраст Базарова - около 30 лет. Он.
Читайте также:
- Патология верхних дыхательных путей. Деформация челюсти при патологии дыхательных путей.
- Черепно-мозговая травма от жесткого обращения на КТ, МРТ
- Результаты электроокулограммы (ЭОГ) и электроретинограммы (ЭРГ) в норме
- Острая ревматическая лихорадка
- МРТ латеральных поддерживающих структур коленного сустава в норме
