Постменопаузальный и сенильный остеопороз: атлас фотографий
Добавил пользователь Владимир З. Обновлено: 08.01.2026
Остеопороз (ОП) развивается постепенно и клинически нередко выявляется уже после переломов, что послужило основанием называть его «скрытой эпидемией». По мнению экспертов ВОЗ, ОП сегодня — одно из наиболее распространенных заболеваний: в
В настоящее время выделяют два основных типа ОП — первичный и вторичный. Первичный ОП является наиболее распространенным: отношение его частоты к частоте всех форм вторичного ОП достигает 4:1. Вторичный ОП можно разделить на две большие группы: ОП, обусловленный основным заболеванием, например, ревматоидным артритом, и ОП, возникший в результате проводимого лечения (ятрогенный). В первом случае необходимо установить основное заболевание, симптомом которого является ОП, во втором — должна быть проанализирована терапия, которая, возможно, привела к развитию ОП.
К первичному ОП относят возрастозависимые потери костной массы и остеопатии неясной этиологии: ювенильный (ОП детей и подростков), идиопатический (ОП взрослых молодого и среднего возраста). Однако наиболее часто встречается первичный ОП, который подразделяется на постменопаузальный и сенильный. Постменопаузальный ОП связан с ускоренной потерей костной массы у женщин после прекращения менструаций, причина его развития — дефицит эстрогенов. Наиболее выраженные изменения на фоне дефицита эстрогенов происходят в трабекулярной кости. Активация костного обмена на тканевом уровне характеризуется увеличением количества активированных единиц костного ремоделирования, наряду с увеличением резорбции возрастает и формирование костной ткани, однако оно не может полностью компенсировать резорбцию, вследствие чего увеличивается нестабильность костной трабекулярной архитектоники, что приводит к повышенному риску развития переломов трабекулярных костей.
Сенильный ОП характеризуется пропорциональными потерями трабекулярной и кортикальной кости. Основными причинами развития сенильного ОП у лиц обоего пола являются снижение потребления кальция, нарушение его всасывания в кишечнике и дефицит витамина D, что может приводить к вторичному гиперпаратиреозу и вследствие этого ускорению костного ремоделирования. Одним из факторов, влияющих на развитие сенильного ОП, считают снижение физической активности в пожилом возрасте. Необходимо подчеркнуть, что в процессе старения организма взаимодействие гормонов с факторами роста и другими цитокинами, влияющими на процесс остеобластогенеза, подвергается существенным изменениям, а активность многих локальных факторов снижается. Гистоморфометрические исследования показали значительное уменьшение количества остеобластов у данных больных, а также замедление процессов ремоделирования (снижение остеобластогенеза и остеокластогенеза, уменьшение продолжительности жизни остеоцитов).
Низкая минеральная плотность костной ткани (МПК) не ассоциируется с конкретными клиническими проявлениями, и, как было сказано выше, основным клиническим симптомом ОП являются переломы костей, развившиеся при минимальной травме, из которых наиболее типичны переломы грудных и поясничных позвонков, дистального отдела предплечья и проксимального отдела бедренной кости. Переломы позвонков могут проявляться снижением роста, увеличением грудного кифоза, уменьшением расстояния между реберными дугами и гребнями подвздошных костей, появлением расстояния между затылком и стеной при измерении роста. Боль в спине при переломах позвонков не имеет специфических особенностей, так как она может быть и острой (например, при компрессионном переломе), и хронической (при постепенном оседании тел позвонков под тяжестью собственного тела). Переломы позвонков в сочетании с болью ограничивают способность больных к повседневной жизни (одеванию, уборке, приготовлению пищи, мытью посуды), из-за усиления кифоза теряется ортостатическая стабильность, что может повышать риск падений.
Диагностика заболевания ОП сосредоточена вокруг двух параметров, характеризующих прочность кости: МПК и качество кости. При этом необходимо отметить, что какие-либо клинико-инструментальные методы оценки качества костной ткани, помимо МПК, в настоящее время отсутствуют, поэтому в клинической практике для диагностики ОП используют определение костной массы, эквивалентом которой является МПК, измеренная с помощью рентгеновской денситометрии (ДМ).
Общеизвестно, что на основании ДМ-обследования в соответствии с критериями ВОЗ женщине устанавливается диагноз и в последующем даются рекомендации. При выявлении нормальных показателей МПК — Т-критерий более -1 стандартного отклонения — пациентке объясняют важность достаточного потребления кальция с пищей, адекватных физических нагрузок и негативного влияния курения и злоупотребления алкоголем. Если Т-критерий находится в пределах от -1 до -2 стандартных отклонений ниже среднего показателя здорового молодого взрослого, то указывается необходимость добавления к профилактическим мероприятиям препаратов кальция и витамина D, а в случае Т-критерия ниже -2,5 стандартного отклонения необходимо назначать антирезорбтивную терапию.
Следует отметить, однако, что не всегда нормальная МПК, измеренная с помощью ДМ, является гарантией того, что у пациентки не случится перелом, поэтому, по мнению ряда экспертов, обследовать с помощью ДМ всех женщин в постменопаузальном периоде нецелесообразно. На сегодняшний день хорошо изучены факторы риска (ФР) ОП и их легко определить у каждой женщины. К этим ФР относят низкую массу тела; предшествующие переломы, возникшие при минимальной травме; переломы бедра у родителей; курение в настоящее время; длительное использование глюкокортикоидов внутрь; ежедневное употребление алкоголя в количестве трех и более стаканов пива по 285 мл или трех и более бокалов вина по 120 мл; ревматоидный артрит и другие причины, вызывающие вторичный ОП [3]. В связи с этим в основу выявления больных, которым показана терапия, положена стратегия поиска отдельных случаев, заключающаяся в установлении лиц с высоким риском переломов на основе оценки ФР, и приоритетным направлением в диагностике является не факт наличия ОП, а оценка риска развития перелома [3].
Согласно рекомендациям Международного фонда по остеопорозу и ВОЗ, риск перелома, связанного с хрупкостью костей, должен выражаться в виде краткосрочного абсолютного риска, т. е. вероятности события за 10-летний период времени. Период в 10 лет выбран потому, что он покрывает предполагаемую длительность лечения и включает развитие благоприятных эффектов, продолжающихся после прекращения терапии.
В этой связи новые подходы в диагностике ОП, основанные на определении абсолютного риска переломов, выражающегося в вероятности развития перелома в течение последующих 10 лет жизни, позволяют начинать лечение у пациентов с предшествующими переломами при минимальной травме и у пациентов в возрасте 65 лет и старше с наличием других ФР без учета МПК. У пациентов моложе 65 лет терапевтическая тактика определяется на основании сочетания ФР и результатов денситометрии.
Лечение ОП включает в себя как немедикаментозные способы терапии (отказ от вредных привычек, занятия физкультурой, профилактика падений), так и фармакологическое вмешательство. Основной целью терапевтического вмешательства при постменопаузальном ОП является нормализация процесса костного ремоделирования, которая приводит к стабилизации или увеличению МПК, улучшению качества кости и снижению частоты переломов с соответствующим сокращением необходимых затрат со стороны пациентов и органов здравоохранения.
Патогенетическая терапия ОП включает препараты, замедляющие костную резорбцию: бисфосфонаты (БФ), кальцитонины, селективные модуляторы эстрогенных рецепторов, эстрогены, а также средства, преимущественно усиливающие костеобразование (паратиреоидный гормон), и медикаменты многопланового действия (витамин D и его активные метаболиты), двойного действия — повышение костеобразования и снижение костного разрушения (стронция ранелат).
Препаратами первой линии в лечении ОП являются БФ. Они подавляют повышенную в постменопаузе костную резорбцию путем физико-химического связывания с гидроксиапатитом на резорбтивной поверхности и прямого действия на остеокласты, приводящего к нарушению их метаболизма и функциональной активности, индукции их апоптоза, что способствует сдвигу баланса в сторону костеобразования. Среди БФ для лечения постменопаузального ОП в клинической практике используется ибандроновая кислота (Бонвива) — препарат, который при приеме 1 таблетки в дозе 150 мг 1 раз в месяц или в дозе 3 мг в/в 1 раз в 3 месяца ведет к нормализации костного обмена и увеличению МПК, снижению риска переломов. Оценка эффективности и переносимости ежедневного перорального приема Бонвивы, включая режимы с удлинением интервалов между дозами, и в/в применения при постменопаузальном ОП проводилась в многочисленных рандомизированных клинических исследованиях (РКИ).
В рандомизированном двойном слепом многоцентровом (73 центра) клиническом исследовании (BONE) с участием 2946 женщин в постменопаузе, имевших от одного до четырех переломов позвонков и МПК поясничного отдела позвоночника менее -2,0 SD по Т-критерию, была показана эффективность ежедневного приема ибандроната 2,5 мг и интермиттирующего приема 20 мг через день в течение первых 24 дней каждые 3 месяца в отношении снижения риска переломов позвонков через 3 года лечения на 62% и 50% соответственно (р < 0,001 в сравнении с плацебо) на фоне приема 500 мг кальция/сут и 400 МЕ/сут витамина D. Данные ретроспективного анализа продемонстрировали, что ежедневный прием снижал риск внепозвоночных переломов на 69% (p = 0,012) в группе высокого риска (с МПК шейки бедра < -3,0 SD по Т-критерию). Кроме того, показана хорошая переносимость перорального ибандроната [5]. Изучение биопсийного материала подвздошной кости, проведенное в рамках исследования BONE, показало отсутствие негативного влияния препарата на минерализацию костной ткани [6].
Для оптимизации приверженности пациентов лечению были проведены два РКИ по использованию более удобного режима приема ибандроната в режиме 1 раз в месяц. В ходе пилотного многоцентрового (5 центров) двойного слепого плацебо-контролированного РКИ MOPS (Monthly Oral Pilot Study) исследовался эффект различных доз (50 мг, 100 мг и 150 мг) ибандроната при приеме один раз в месяц на показатели костной резорбции у 144 здоровых женщин в постменопаузе. В указанных дозах препарат эффективно подавлял костную резорбцию, что было подтверждено, в частности, достоверным и значимым снижением уровней маркеров костного обмена (CTX сыворотки крови и СTX мочи), при этом в группах, получавших 100 мг и 150 мг, сывороточный CTX снизился на 40,7% и 56,7%, а CTX мочи — на 34,6% и 54,1% соответственно (p < 0,001 по сравнению с плацебо) [7]. По причине небольшого числа участниц исследования и отсутствия приема ими препаратов кальция и витамина D возникла необходимость в дальнейшей оценке перорального приема ибандроната 1 раз в месяц, в связи с чем было инициировано исследование MOBILE (the Monthly Oral iBandronate in Ladies).
MOBILE представляло собой многоцентровое (65 центров, 1609 пациенток), двойное слепое, параллельногрупповое РКИ III фазы, которое проводилось с целью сравнения эквивалентности по эффективности и безопасности перорального приема ибандроната один раз в месяц и ежедневного приема 2,5 мг препарата. Через 1 год средние показатели МПК в поясничном отделе увеличились на 4,3% при пероральном приеме препарата 50 мг 2 дня подряд один раз в месяц, на 4,1% — при приеме 100 мг 1 раз/мес, на 4,9% в режиме приема — 150 мг 1 раз/мес и на 3,9% — при приеме 2,5 мг ежедневно [8, 9]. Дисперсионный анализ ANOVA позволил доказать достоверно более высокую эффективность режима приема 150 мг один раз в месяц по сравнению с ежедневным приемом препарата. Достоверное повышение МПК позвоночника, отмечавшееся через 1 год при всех режимах приема ибандроната один раз в месяц, было подтверждено и через два года исследования: на 5,3%, 5,6% и 6,6% при приеме 50/50 мг, 100 мг и 150 мг соответственно и на 5,0% при ежедневном приеме 2,5 мг. Кроме того, отмечалось увеличение показателей МПК в проксимальном отделе бедра во всех группах лечения через 1 год терапии. Через 2 года прирост МПК на дозе 150 мг ежемесячно был достоверно выше, чем при ежедневном приеме 2,5 мг (р < 0,05) [10]. При всех режимах приема один раз в месяц были получены результаты не хуже, чем при ежедневном приеме; однако статистический анализ продемонстрировал преимущество дозы 150 мг, принимаемой один раз в месяц.
Результаты исследований последовательно подтверждали, что пероральный прием не ассоциировался с повышенным риском развития побочных эффектов и обладал профилем безопасности, эквивалентным таковому при приеме плацебо [11, 12]. По данным двух РКИ прием ибандроната ежедневно и по интермиттирующей схеме у пожилых людей не приводил к увеличению риска развития нежелательных явлений и не влиял на кальцификацию аорты [13, 14]. Относительно большие дозы, которые были необходимы для приема препарата один раз в месяц, не оказывали существенного влияния на суммарную переносимость ибандроната.
Проведенное 12-месячное, многоцентровое (65 центров) двойное слепое, двойное маскированное, параллельногрупповое РКИ (MOTION) показало сопоставимость результатов динамики МПК в поясничном отделе позвоночника и проксимальном отделе бедра при еженедельном приеме 70 мг алендроната и ежемесячном приеме 150 мг ибандроната через год терапии. Так, повышение МПК позвоночника составило 5,1% и 5,78%, а в общем показателе бедра 2,94% и 3,03% для ибандроната и алендроната соответственно. Таким образом, более редкий прием ибандроната не повлиял на эффективность антирезорбтивного лечения [16].
Возможность использования ибандроната для лечения постменопаузального ОП в виде внутривенных инъекций было исследовано в нескольких программах. Последней из них являлось 2-летнее исследование DIVA, которое продемонстрировало сопоставимость влияния ибандроната на МПК и костные маркеры при различных способах введения — внутривенном по 2 мг каждые 2 месяца или по 3 мг каждые 3 месяца в сравнении с ежедневным приемом 2,5 мг внутрь [17]. Важно отметить, что годовая кумулятивная доза (ГКД) при внутривенном введении составляла 12 мг в год, а при пероральном приеме — примерно 5,5 мг/год, что связано с низкой абсорбцией препарата в желудочно-кишечном тракте, которая составляет около 0,6% от принятой дозы внутрь. Все пациенты дополнительно принимали 500 мг кальция и 400 МЕ витамина D. Через 2 года лечения в группе, получавшей 3 мг ибандроната внутривенно, прирост МПК в позвоночнике составил 6,3% по сравнению с 4,8% при ежедневном приеме 2,5 мг (р < 0,05). Обе внутривенные дозы препарата показали больший прирост МПК по сравнению с исходными данными, в том числе в области проксимального отдела бедра по сравнению с ежедневным приемом.
Переносимость внутривенного ибандроната была сопоставима с таковой при ежедневном пероральном приеме, при этом нежелательные явления, связанные с приемом исследуемого препарата, встречались с одинаковой частотой — 39,0% и 33,3% соответственно. Следует отметить, что при внутривенном введении чаще встречался гриппоподобный синдром (4,9%). Он в основном был связан с первым введением препарата, возникал в течение первых суток после внутривенной инъекции, имел слабую или среднюю степень интенсивности и разрешался самостоятельно или после приема жаропонижающих препаратов через 1-2 дня без каких-либо серьезных последствий для пациентки. Нежелательные явления, связанные с поражением почек, встречались редко (в каждой группе менее чем у 3% женщин), а снижение клиренса креатинина было примерно одинаковым у пациенток всех трех групп (14-17%).
Влияние различных доз и режимов введения ибандроната на риск переломов в описанных выше исследованиях специально не изучалось. Во всех исследованиях фиксировались клинические переломы с рентгенологическим подтверждением в качестве нежелательного явления. По этой причине были проведены два метаанализа исследований для оценки влияния ибандроната на частоту внепозвоночных переломов, определившие зависимость эффекта от годовой кумулятивной дозы препарата. В метаанализе Cranney A. с соавт. прием высоких доз ибандроната (150 мг 1 раз в месяц в течение 2 лет и внутривенное введение 3 мг каждые 3 мес) уменьшали риск внепозвоночных переломов на 38% по сравнению с ежедневным приемом 2,5 мг [18]. Эффективность высоких доз была подтверждена в опубликованном в 2008 г. метаанализе Harris S. T. с соавт., который показал, что применение этих режимов в течение двух лет по сравнению с плацебо значимо снижало риск шести основных переломов (ключицы, плечевой кости, костей предплечья, таза, бедра и голени) на 34,4% (p = 0,032), всех внепозвоночных переломов на 29,9% (p = 0,041) и клинических переломов на 28,8% (p = 0,010). При приеме высоких доз ибандроната по сравнению с плацебо удлинялось время до возникновения шести основных переломов (p = 0,031), всех внепозвоночных переломов (p = 0,025) и клинических переломов (p = 0,002) [19].
В повседневной клинической практике терапевтические преимущества пероральной терапии бисфосфонатами зачастую нивелируются тем, что больной не выполняет назначений врача и не принимает предписанные медикаментозные препараты. В то же время строгое соблюдение назначений врача — основной фактор, определяющий эффективность проводимого лечения. Терапия хронических заболеваний, к которым относится и постменопаузальный ОП, характеризуется низким уровнем выполнений назначений врача. Следовательно, более редкое дозирование препарата внутрь, позволяющее уменьшить раздражающее действие бисфосфонатов на слизистую оболочку пищевода и способствующее снижению частоты развития побочных эффектов со стороны желудочно-кишечного тракта, обеспечивает большее удобство при проведении длительной терапии. Кроме того, при наличии противопоказаний для приема бисфосфонатов внутрь, а также невозможности в течение часа находиться в вертикальном положении или в случае приема большого количества таблетированных средств для лечения коморбидных состояний у больных с постменопаузальным ОП появилась возможность длительно получать антирезорбтивную терапию путем внутривенного введения препарата с доказанным эффектом по снижению риска переломов.
Литература
Н. В. Торопцова, доктор медицинских наук
О. А. Никитинская, кандидат медицинских наук
ИР РАМН, Москва
Постменопаузальный остеопороз
Постменопаузальный остеопороз — патологическая деструкция костной ткани, вызванная системными обменными нарушениями вследствие гипоэстрогении. В половине случаев протекает скрыто и диагностируется после возникновения перелома. Может проявляться болями в крестце, пояснице, межлопаточной области, костях таза, предплечья и голени, искривлением позвоночника, уменьшением роста. Диагностируется при помощи денситометрии, определения уровня кальция, фосфора, маркеров костной резорбции, кальцитонина, паратгормона. Для лечения используют гормональные средства, ингибиторы остеорезорбции, стимуляторы остеосинтеза, препараты кальция и витамина D.
МКБ-10


Общие сведения
Первичный постменопаузальный остеопороз — наиболее распространенный вариант остеопоретической болезни, составляющий более 85% в структуре этого метаболического заболевания костно-мышечной системы. По данным ВОЗ, денситометрически подтвержденное снижение минеральной плотности костей и нарушение их микроархитектоники наблюдается у 30-33% женщин старше 50 лет. В России частота типичных для остеопороза переломов предплечья составляет более 560 случаев на 100 тысяч пациенток постменопаузального возраста, остеопоретических переломов бедра — свыше 120 на 100 тыс. Социальная значимость патологии определяется ее влиянием на инвалидизацию и смертность пожилых женщин.

Причины
Уменьшение костной массы и нарушение микроархитектоники костей во время постменопаузы связано с инволютивными процессами, происходящими в женском организме, и возрастным изменением стиля жизни. Специалисты в сфере гинекологии подробно изучили причины расстройства и предрасполагающие факторы. К возникновению остеопороза у пожилых женщин приводят:
- Снижение уровня эстрогенов. Женские половые гормоны участвуют в метаболизме кальция — важного структурного компонента костей, обеспечивающего их прочность, обновление и восстановление костной ткани. Гипоэстрогения развивается при недостаточности или угасании функции яичников, медикаментозном подавлении секреции эстрогенов, хирургическом удалении органа у пациенток с опухолями, эндометриозом, внематочной беременностью.
- Нерациональное питание. Дефицит кальция возникает при ограниченном потреблении молокопродуктов, рыбы, диетических сортов мяса, бобовых, зелени, овощей, фруктов на фоне избытка легкоусвояемых углеводов, жиров, кофе, крепкого чая. Подобный рацион отличается низким содержанием кальция, веществ, которые способствуют усвоению минерала организмом, и повышенной концентрацией ингибиторов его всасывания в кишечнике.
- Низкая двигательная активность. С возрастом подвижность женщины уменьшается. Ситуация усугубляется снижением времени естественной инсоляции, наличием избыточного веса, заболеваний и патологических состояний, ограничивающих способность к самостоятельному передвижению, — длительным постельным режимом при лечении хронической соматической патологии, последствиями перенесенных нарушений мозгового кровообращения и инфарктов.
Факторами риска возникновения остеопороза в постменопаузальный период являются возраст, превышающий 65 лет, принадлежность к европеоидной расе, ранний климакс, дефицит массы тела, наличие в анамнезе дисгормональных расстройств, курение, злоупотребление спиртным. Не исключено влияние наследственности - заболевание чаще выявляют у женщин, близкие родственники которых страдали остеопорозом или имели частые переломы. Вероятность поражения костной системы также повышается при более чем трехмесячном приеме глюкокортикоидных препаратов, оказывающих влияние на кальциевый обмен.
Патогенез
При постменопаузальном остеопорозе нарушается баланс между остеосинтезом и остеорезорбцией — основными механизмами ремоделирования костной ткани. На фоне дефицита эстрогенов снижается секреция кальцитонина — гормона щитовидной железы, являющегося функциональным антагонистом паратгормона, повышается чувствительность костной ткани к резорбтивному действию гормона паращитовидной железы. Основной эффект паратгормона — увеличение концентрации кальция в крови за счет усиленного транспорта через кишечную стенку, реабсорбции из первичной мочи и остеорезорбции. Параллельно с этим активируются остеокласты — клетки, разрушающие костную ткань, инсулиноподобные факторы роста 1 и 2, остеопротогерин, трансформирующий β-фактор, колониестимулирующий фактор и другие цитокины, усиливающие костную резорбцию.
Дополнительными элементами патогенеза, способствующими развитию остеопороза, становятся ухудшение всасывания минерала из-за субатрофии кишечного эпителия и дефицита витамина D, для достаточной секреции которого требуется более длительное пребывание на солнце. Снижение двигательной активности в постменопаузальном периоде приводит к уменьшению динамических нагрузок на костно-мышечный аппарат, что также замедляет процессы его ремоделирования. Ситуация усугубляется ухудшением всасывания кальция в кишечнике и его усиленной экскрецией с мочой при приеме глюкокортикоидов, часто применяемых в схемах лечения эндокринных, аутоиммунных, воспалительных и других болезней, которыми страдают пожилые пациентки.
Симптомы постменопаузального остеопороза
Практически у половины женщин заболевание протекает бессимптомно и выявляется только после перелома, вызванного незначительной травмой. В остальных случаях симптоматика прогрессирует постепенно. По мере потери костной массы пациентка начинает ощущать боли в пояснично-крестцовой области, усиливающиеся во время поднятия тяжелых предметов, поворотов, ходьбы. В последующем появляется ощущение тяжести в межлопаточном пространстве, болезненность в тазовом кольце, длинных трубчатых костях голени. Чтобы избавиться от болей и дискомфорта, на протяжении дня требуется дополнительный отдых в положении лежа.
Нарастание интенсивности болезненных ощущений приводит к тому, что со временем они беспокоят больную даже в состоянии покоя. Обычно нарушение осанки и искривление позвоночника сопровождается кифозом. Часто женщины постменопаузального возраста с остеопорозом жалуются на слабость, быструю утомляемость при физических нагрузках. Крайними формами проявления патологии становятся компрессионные переломы нижнегрудных и верхних поясничных позвонков с уменьшением их высоты, спонтанные или возникающие при незначительных нагрузках переломы лодыжек, костей предплечья, шейки бедра. Характерный признак — снижение роста на несколько сантиметров за год.
Осложнения
Наиболее серьезным последствием постменопаузального остеопороза является инвалидизация вследствие искривления позвоночника и частых переломов конечностей, усугубляемых постоянными болевыми ощущениями в костях. Пациентке сложно передвигаться не только на большие расстояния, но и по дому, ухаживать за собой, выполнять простые бытовые действия. Существенное ухудшение качества жизни может спровоцировать эмоциональные расстройства — тревожность, плаксивость, ипохондричность, склонность к депрессивному реагированию. У части женщин с остеопорозом отмечается длительная бессонница.
Диагностика
При выявлении у пациентки постменопаузального возраста компрессионных изменений позвоночника или типичных переломов конечностей в первую очередь необходимо исключить остеопороз. С диагностической целью используют методы, позволяющие оценить архитектонику костной ткани и степень ее насыщенности кальцием, а также обнаружить биохимические маркеры поражения костей. Наиболее информативными являются:
- Денситометрия. Современные двухэнергетические рентгеновские остеоденситометры с высокой точностью определяют, насколько снижена плотность костной ткани. С их помощью легко оценивать минерализацию «маркерных» костей (предплечья, тазобедренного сустава, поясничных позвонков) и всего организма. Метод применим для диагностики ранних стадий постменопаузального остеопороза. Вместо классического двухэнергетического исследования может выполняться ультразвуковой скрининг плотности костей (эходенситометрия), КТ-денситометрия.
- Биохимическое исследование крови. В ходе лабораторных анализов определяют содержание кальция, фосфора и некоторых специфических маркеров, свидетельствующих о нарушении ремоделирования костей. При усилении возрастной костной резорбции повышается уровень щелочной фосфатазы, остеокальцина в крови, дезоксипиридонолина в моче. При соотнесении с экскрецией креатинина достаточно специфичным является определение кальция в моче, содержание которого повышается при усилении резорбтивных процессов в костной ткани.
- Анализ содержания гормонов. Поскольку постменопаузальный остеопороз патогенетически связан с возрастным гормональным дисбалансом, показательным для диагностики является исследование уровня тиреокальцитонина (ТКТ) и паратирина. При инволютивном нарушении резорбции костей уменьшается концентрация кальцитонина в крови, при этом уровень паратиреоидного гормона остается нормальным или пониженным. Контрольное исследование содержания половых гормонов подтверждает естественную возрастную гипоэстрогению.
Дифференциальная диагностика проводится с сенильным и вторичным остеопорозом, злокачественными костными опухолями и метастазами в кости, миеломной болезнью, фиброзной дисплазией, болезнью Педжета, обычными травматическими переломами, сколиозом, остеохондропатией позвоночника, периферической нейропатией. При необходимости пациентку консультируют ортопед, травматолог, эндокринолог.

КТ таза. Выраженное разрежение трабекулярной структуры и жировая дегенерация костей таза (слева) у пожилой женщины, справа для сравнения норма у молодого мужчины.
Лечение постменопаузального остеопороза
Основной целью терапии является предотвращение возможных переломов за счет улучшения минерализации и архитектоники костей с одновременным повышением качества жизни пациенток. Для этого применяется комплексная антиостеопоретическая терапия, направленная на различные звенья патогенеза заболевания. Стандартная схема лечения остеопороза, вызванного постменопаузальными изменениями в организме женщины, включает следующие группы препаратов:
- Ингибиторы костной резорбции. Эстрогены, их комбинации с прогестинами или андрогенами предотвращают преждевременное разрушение костей и рекомендуются при сохранении климактерических проявлений в первые годы постменопаузы. При наличии противопоказаний или отказе пациентки от приема половых гормонов возможна их замена фитоэстрогенами, селективными модуляторами эстрогенной активности или рецепторов к эстрогенам. Кроме заместительной гормонотерапии эффект замедления резорбции оказывают кальцитонин, бисфосфонаты, препараты стронция.
- Стимуляторы образования костей. Усилению остеогенеза способствует назначение паратиреоидного гормона, анаболических стероидов, андрогенов, соматотропина, фторидов. Ускоренное ремоделирование костей при применении этих лекарственных средств достигается за счет активации остеобластов, усиления анаболических процессов, стимуляции гидроксилирования. Следует учитывать, что при постменопаузальных расстройствах применение таких препаратов ограничено рядом противопоказаний и возможных осложнений.
- Средства многопланового действия. Минерализация и архитектоника костной ткани улучшается при приеме препаратов кальция, особенно в комбинации с витамином D, что позволяет относить такие средства к категории базовых. Разносторонний эффект на процессы остеогенеза и разрушения костей также оказывают оссеино-гидроксилатный комплекс и флавоновые соединения, которые при минимальной вероятности осложнений эффективно тормозят функцию остеокластов, ответственных за резорбцию и деминерализацию, стимулируя остеобластный остеопоэз.
Результативное лечение остеопороза у женщин постменопаузального возраста невозможно без коррекции образа жизни и диеты. Пожилым больным рекомендованы умеренные физические нагрузки с исключением падений, подъема тяжестей, резких движений. В рацион необходимо добавить продукты, богатые кальцием, — молоко, творог, твердый сыр, бобовые, рыбу, другие морепродукты, отказавшись от злоупотребления кофе и спиртными напитками.
Прогноз и профилактика
Хотя постменопаузальный остеопороз является прогрессирующим заболеванием, регулярное поддерживающее лечение и здоровый образ жизни позволяют существенно уменьшить вероятность переломов. С профилактической целью женщинам в постменопаузе рекомендован прием препаратов кальция, содержащих витамин D, дозированные инсоляции, коррекция диеты, достаточная физическая активность с учетом возрастной нормы, отказ от курения, ограниченное потребление продуктов, содержащих кофеин (кофе, чая, шоколада, колы, энергетиков). При выявлении признаков остеопороза эффективной защитой от нагрузок, провоцирующих переломы, могут стать корсеты и протекторы бедра.
Сенильный остеопороз
С возрастом человек может столкнуться с проблемой разрушения тканей костей. С каждым разом уменьшается плотность тканей, а кости теряют прочность. В этот момент начинается развитие сенильного остеопороза. С патологией чаще всего сталкиваются люди в более пожилом возрасте от 70 лет. Женщины больше склонны к развитию этого заболевания, особенно с наступлением менопаузы. Причиной являются гормональная перестройка и замедленный метаболизм.
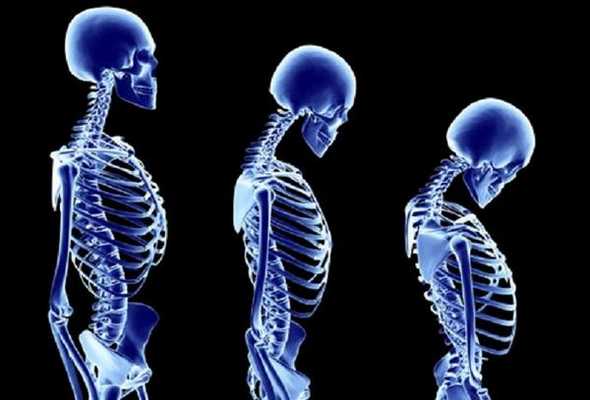
Сенильный остеопороз - болезнь, связанная с ослабеванием прочности костей. Его часто можно обнаружить у женщин с приходом климакса. Хрупкость кости объясняется нехваткой кальция и витамина Д, что может стать причиной перелома даже под силой собственного веса. Особенность этой разновидности патологии заключается в том, что развивается она у женщин и мужчин в преклонном возрасте.
Классификация болезней
Выделяют 2 основных разновидности остеопороза: местный и системный.
Системный остеопороз в свою очередь включает: инволютивный, ювенильный, идиопатический и наследственный.
Инволютивный делится еще на постменопаузальный (1 тип) и сенильный (2 тип). Сенильный остеопороз чаще всего диагностируют у людей возрастом 70+ лет. Соотношение женщин и мужчин при сенильном и постменопаузальном остеопорозе — 1:2 и 1:6 соответственно.
Сенильный остеопороз отличается тем, что кортикальная и губчатая кость «рассасываются» в равной степени, а во время постменопаузального остеопороза в большей степени страдает губчатая кость.
При остеопорозе 2 типа шейка бедра имеет больший процент переломов, чем во время остеопороза 1 типа. Заболевание позвоночника схоже с клиновидным переломом костей, который редко вызывает острые болевые ощущения, что не скажешь о компрессионных переломах при остеопорозе 1 типа.
Патогенез и этиология
От количества минеральных элементов, поступающих в человеческий организм, зависит плотность костей. Чем больше минералов, тем прочнее костная ткань. Сенильный остеопороз характеризуется некоторыми особенностями:
- кости конечностей и скелет начинают равномерное разрушение;
- поражение позвонков имеет вид клиновидных переломов костей. Симптом тяжело диагностировать на первых порах болезни, поскольку болевые ощущения отсутствуют;
- одновременная резорбция кортикальных и губчатых костей. Другими словами, разрушение ткани костей сопровождается разрушением конечностей. При прочих разновидностях заболевания участки опорно-двигательной системы страдают по отдельности.
Риск столкнуться с переломами у людей в преклонном возрасте зависит не только от уменьшения массы костей, но и от факторов, способствующих периодическим падениям: аритмия, обморок, плохое зрение, нарушение ходьбы.
Сенильный остеопороз часто сопровождается многочисленными переломами, поскольку костная ткань становится очень слабой
Этот тип остеопороза может быть как первичной патологией, так и появляться в результате обострения других болезней. Хрупкость костной ткани может спровоцировать появление других заболеваний:
- синдром Иценко-Кушинга;
- сахарный диабет 1 степени;
- тиреотоксикоз;
- гиперпаратиреоз;
- хроническая недостаточность почек;
- злокачественные образования;
- саркоидоз;
- гипогонадизм;
- мальабсорбция.
Также патология может быть вызвана приемом таких лекарств, как: гепарин, кортикостероиды, препараты против судорог, иммунодепрессанты, барбитураты.
Причины появления заболевания у возрастного населения
Причины появления остеопороза в зрелом возрасте объединяются в две большие группы.
Гормональный сбой
Нарушение гормонального баланса может быть связано с:
- нехваткой кальция и витамина Д. Нарушение проявляется в результате ослабевания работы почек и недостачи альфа-гидроксилазы;
- паращитовидная железа вырабатывает недостаточное количество паратгормона, от которого зависит наличие кальция в человеческом организме;
- щитовидная железа вырабатывает недостаточное количество кальцитонина, который за счет снижения содержания остеокластов останавливает разрушение ткани костей;
- недостатком половых гормонов, уменьшающих действие остеокластов и способствующих замедлению разрушения костей.
Развиться остеопороз в зрелом возрасте может из-за гормонального сбоя, вызванного нехваткой определенных веществ
Образ жизни
- рацион питания. Потребление малого количества мясных, рыбных и молочных продуктов;
- недостаточное нахождение под солнечными лучами и на свежем воздухе;
- недостаточные физические нагрузки;
- сидячий образ жизни.

Проявление остеопороза
Вся опасность состоит в том, что заболевание проходит без каких-либо симптомов. Утрата массы костей проходит медленно и постепенно, не сопровождаясь при этом болевыми ощущениями. За счет того, что процесс утраты организмом кальция является постепенным, без дискомфортных ощущений, пациенты обращаются в клиники с жалобами уже на последних стадиях болезни.
Чаще всего это происходит на момент значительного изменения позвоночника, сильных острых болях в области спины либо переломах конечностей. Клинические симптомы заболевания у пожилых людей:
- приступ острых ощущений в спине, которые дают о себе знать на момент физических нагрузок, длительных прогулок либо во время долгого стояния на одном месте. Боль вызвана стремительным разрушением позвоночника, повышенной активностью спинных мышц, компрессией кровеносных сосудов;
- уменьшение роста на 15 см (тогда как физиологическое старение допускает уменьшение позвоночника всего на пару сантиметров), изменение привычной походки, горбатость и сутулость, что требует непременного лечения на начальных этапах болезни. Спустя время эти признаки могут привести к нарушению дыхательной системы, анемии, потере сознания, регулярным головокружениям;
- непредвиденное повреждение бедренной кости в области шейки, что обычно является причиной утраты подвижности и дальнейшего передвижения на инвалидной коляске, в худшем случае приводит к летальному исходу;
- обильное выпадение волос, преждевременное появление седины.
Повреждение локтевой и лучевой кости происходит из-за падения на прямую руку, чаще встречается у женского пола. Процесс сращивания кости у людей с сенильным остеопорозом занимает длительное время и требует медицинского вмешательства, физических процедур и соблюдения особой диеты.
Возможные осложнения
В большинстве случаев пациенты диагностируют у себя сенильный остеопороз уже в запущенной форме, что сигнализирует о большой опасности. Частые падения связывают с ухудшением зрения, головокружениями, нестабильной походкой. Даже при незначительных физических утомлениях, кость, которая почти полностью утратила костную ткань, может поломаться.
Самым опасным является перелом шейки бедра. В таком случае пациент надолго остается в лежачем положении, прикованным к кровати, и нуждается в постоянной поддержке и помощи от окружающих. Некоторые случаи приводят к тому, что человек становится инвалидом или, что еще хуже, умирает.
Еще одна опасность кроется в искривлении позвоночника. Даже при незначительных силовых нагрузках, либо вовсе без них, начинает появляться компрессионный перелом, который очень опасен. Если позвоночник начинает проседать, грудная клетка начинает сдавливаться и сужаться, что плохо отражается на работе организма человека.
В некоторых случаях пациенты страдают нехваткой кислорода, головокружениями, неровной походкой и общим плохим самочувствием.
Диагностика патологии
Обнаружить сенильный остеопороз можно за счет денситометрии, рентгенографии и прочих медицинских и лабораторных исследований.

Рентгеновское обследование губчатых тканей предполагает взятие прямой проекции тазобедренного сустава и костей, боковые проекции позвоночных тканей.
Боковые снимки очень хорошо дают картину о:
- проседании позвоночного столба;
- сужении передних костей;
- уменьшении длины всего позвоночника;
- компрессионных повреждениях костей;
- увеличении высоты дисков;
- двояковыпуклой форме дисков позвоночника с допустимостью проникновения в позвонковые кости;
- многочисленных разъединениях замыкательных пластин.
Обнаружить давние скрытые переломы и новые повреждения можно при помощи сцинтиграфического метода, который предполагает введение в человеческий организм контрастного вещества.
Обследовать костные ткани можно за счет денситометрического способа, который можно осуществлять на любом месте скелета и предоставляет обширную полную информацию о протекающем заболевании.
В целях профилактического и проверочного обследования используют компактные стационарные установки, рассчитанные на кости пяток и запястье рук. Аппараты способны предвидеть переломы и приступить к немедленному лечению.
Усовершенствованные аппараты костных денситометров способны также отображать уровень биохимического маркера, который задействован в процессе костного метаболизма: кальций, гидроксипролин и фосфатаза щелочная. Люди в преклонном возрасте (женщины от 50, а мужчины от 60 лет) должны в обязательном порядке проводить денситометрию каждые два года.
Лечение заболевания
Сенильный остеопороз предполагает постепенное развитие патологических процессов в тканях костей, которые тяжело предотвратить и остановить. Поэтому процесс лечения болезни весьма сложный и длительный. Все терапевтические способы имеют цель уменьшить потерю массы костей и возможность переломов.
Приступать к лечению стоит как можно быстрее. Курс лечения предполагает:
- прием прописанных лекарств с учетом индивидуальных характеристик каждого пациента и степени его заболевания. В большинстве случаев прописывают «Кальцитонин»;
- соблюдение диеты, которая также составляется с учетом индивидуальных особенностей. Рацион питания должен содержать продукты с большим количеством витамина Д и кальция. Стоит добавить рыбные продукты, бобы, гречку, яйца, орехи и зелень;
- прогулочную ходьбу на свежем воздухе, нетяжелые специальные физические упражнения;
- прием солнечных ванн.

Лечение такого заболевания - сложный и продолжительный процесс, поэтому приступить к нему важно как можно раньше
Лечебные препараты
Принимая лекарства, которые содержат витамин Д, стоит рассчитать подходящую дозировку, поскольку может появиться гиперкальциемия, которая выражается рвотой, болями в области живота, жидким стулом, сильными болями в костных тканях.
Гиперкальциемия практически не подвластна корректировке. Поэтому начав курс активного лечения, стоит регулярно отслеживать уровень кальция и контролировать количество щелочной фосфатазы и фосфора. Убедившись в поддержании нормального уровня кальция, можно делать анализы каждые три месяца. В случае, если содержание кальция выше положенной нормы (допустимый уровень 2,75 ммоль/л), стоит отказаться от приема препарата на некоторый промежуток, а после принимать половину от прежней дозы длительное время. Пожилым людям стоит прописывать кальцитонин (который содержится, например, в препарате «Миакальцик»). Он уменьшает действие остеокластов, что сказывается на замедлении процесса разрушения костей. Помимо этого, он оказывает обезболивающий эффект и рекомендуется при частых острых спинных болях.

Монотерапия кальцитонином может вызвать гипокальцемию. Из-за этого его не назначают в качестве профилактики, а применяют исключительно при точном обнаружении остеопороза.
Помимо патогенетической терапии можно прописывать обезболивающие препараты. Можно начать с обычных анальгетиков, в их число входят «Ацетаминофен», «Парален» и пр. Если их действие недостаточно сильное, прописываются нестероидные противовоспалительные препараты, такие как «Диклофенак» или «Бруфен». Нелишним будет применение миорелаксантов, проведение местной терапии.
Операция
Таблица №1. Операции для устранения последствий сенильного остеопороза.
| Название | Описание |
|---|---|
| Кифопластика | Операция направлена на восстановление положения позвоночника. Проведение операции предполагает вставку баллона или прочей установки в место перелома позвонков. После баллон наполняется воздухом, под воздействием которого он расширяется, и место перелома начинает расправляться. В появившееся отверстие позвонкового тела помещают полимерный наполнитель, костный цемент или схожие вещества. Кифопластика назначается в том случае, когда есть острая необходимость вернуть прежнюю высоту позвонков, и чаще всего операцию проводят в условиях стационара. |
| Вертебропластика | Операция подразумевает введение костного или полимерного вещества при помощи особенной иглы. Операция назначается при стандартных болевых симптомах в районе позвоночника. Также рекомендуется проводить при патологических повреждениях позвонковых тел или при повышенном риске их появления. Помимо уменьшения болевых ощущений и стабилизации функций опорно-двигательной системы, костный цемент вызывает цитотоксическое действие. Процедура является весьма эффективной. Уже спустя 1-2 дня за счет обезболивающего эффекта пациент может покинуть стационар. Уменьшение проявления болевого синдрома и возвращение двигательной активности значительно сказываются на качестве жизни больного. |
Лечение проводится в амбулаторных условиях. После успешного проведения операции прописываются лекарства кальция.
Профилактические меры
Сенильный остеопороз - стадия, когда заболевание достигает полного развития. В этот момент уже поздно прибегать к профилактическим процедурам, поскольку у пациента чаще всего уже существует перелом, и необходимо переходить к более серьезным и эффективным процедурам, цель которых - не допустить появление повторных переломов.
В связи с этим стоит:
- не допускать падений на улице и дома;
- не ездить на общественном транспорте самостоятельно;
- не носить и не двигать тяжелые вещи, предметы, оберегая, таким образом, спину от нагрузок во время наклонов;
- постоянно проверять точность зрения;
- не увлекаться снотворными и успокоительными препаратами;
- повысить количество потребляемой пищи с кальцием (людям в возрасте 65+ стоит употреблять 1500 мг кальция в день);
- избавиться от вредных привычек, в частности от курения. В зависимости от самочувствия, можно активнее заниматься физическими упражнениями. Стоит также уделить внимание других имеющимся у больного заболеваниям, которые могут привести к падениям и травматизму.
Подводим итоги
Сенильный остеопороз - заболевание, которое редко обнаруживают вовремя. Как правило, избавиться от него невозможно - можно лишь устранить последствия, вызванные таким недугом, и предотвратить осложнения.
Конечно, лучше смолоду думать о своем здоровье - регулярно заниматься спортом, исключить вредные привычки, следить за своим питанием. В таком случае риск заболевания остеопорозом, в том числе и сенильным, в пожилом возрасте будет намного ниже.
Впрочем, если такая патология уже обнаружена - отчаиваться не стоит. Главное уделять повышенное внимание своему здоровью и не допустить переломов, а также вовремя принимать препараты, назначенные врачом.
Постменопаузальный и сенильный остеопороз: атлас фотографий
Институт клинической эндокринологии ЭНЦ РАМН, Москва
О стеопороз - самое частое метаболическое заболевание костной системы, характеризующееся уменьшением массы костной ткани в единице ее объема, приводящее к хрупкости и переломам костей.
Остеопороз, развивающийся в периоде постменопаузы, относится к классу первичных остеопорозов. Известно, что снижение секреции половых гормонов в период климактерия оказывает прямое и опосредованное влияние на состояние костного метаболизма. Снижение содержания эстрогенов приводит к нарушению кальциевого обмена, что сопровождается уменьшением минеральной плотности костной ткани (МПКТ). Кроме того, имеет место подавление активности остеобластов, что приводит к преобладанию резорбции над процессами формирования костной ткани. Постменопаузальный остеопороз составляет 85% общего количества первичного остеопороза.
Сенильный остеопороз - так называемый второй тип остеопороза, в патогензе которого важную роль играет снижение всасываемости кальция в кишечнике, чему также способствует дефицит витамина D, вызванный уменьшением поступления его спищей, замедлением образования его в коже из провитамина D. Наибольшее значение в патогенезе сенильного остеопороза имеет дефицит активных метаболитов витамина D вследствие снижения его синтеза в почках. При сенильном остеопорозе определенную роль играет развитие резистентности к витамину D - т.е. дефицит рецепторов 1,25(ОН)2D. Указанные факторы вызывают развитие транзиторной гипокальциемии, что приводит к усилению продукции паратиреоидного гормона. В результате вторичного гиперпаратиреоза усиливается резорбция костной ткани, в то время как костеообразование к старости снижено.
Стероидный остеопороз также относится к классу вторичных остеопорозов и вызывается патологическим повышением эндогенной продукции глюкокортикоидов надпочечниками или возникает при введении синтетических аналогов кортикостероидов, применяемых для лечения ревматологических, аллергических, гематологических, глазных болезней, заболеваний кожи, желудочно-кишечного тракта (ЖКТ), почек, печени. Стероидный остеопороз возникает при заболеваниях, характеризующихся повышенной секрецией кортикостероидов надпочечниками. К ним относится болезнь Иценко-Кушинга, при которой адренокортикотропный гормон (АКТГ)-продуцирующая опухоль гипофиза приводит к стимуляции и гиперплазии коры надпочечников. В свою очередь опухоли коры надпочечников, как доброкачественные, так и злокачественные, продуцируя повышенное количество кортикостероидов, сопровождаются клинической картиной синдрома Кушинга.
Снижение костной массы происходит неравномерно в различных отделах скелета, в большинстве случаев более активно протекает в трабекулярных костях, чем кортикальных. Патогенез остеопороза представлен на рисунке 1.
Рис. 1. Патогенез остеопороза
Клинические проявления
. Магия, мечи, топоры, стрелы, драконы, чародеи, рыцари и многое другое нас ждет в долгожданной RPG Dragon Age: Inquisition. Ее история берет свое начало с предыдущей части игрушки Dragon Age 2. События в ней будут происходить в увлекательном мире, и имя ему Тедасу. Процесс развития остеопороза характеризуется медленным нарастанием потери костной массы и деформации позвонков и длительное время может протекать бессимптомно. Острая интенсивная боль в пораженном отделе позвоночника связана с компрессией тел одного или нескольких позвонков, резко ограничивает объем движений и вызывает мучительные страдания, порой приводя больных к тяжелому депрессивному состоянию. Для остеопороза характерны переломы ребер, протекающие с болями в грудной клетке. Болевой синдром при остеопорозе объясняют мелкими костными микропереломами и раздражением периоста. При развитии асептического некроза головок бедренных костей, характерных для остеопороза, у больных нарушается походка, которая носит название “утиная”.
. Процесс развития остеопороза характеризуется медленным нарастанием потери костной массы и деформации позвонков и длительное время может протекать бессимптомно. в пораженном отделе позвоночника связана с компрессией тел одного или нескольких позвонков, резко ограничивает объем движений и вызывает мучительные страдания, порой приводя больных к тяжелому депрессивному состоянию. Для остеопороза характерны , протекающие с болями в грудной клетке. при остеопорозе объясняют мелкими костными микропереломами и раздражением периоста. При развитии асептического некроза головок бедренных костей, характерных для остеопороза, у больных , которая носит название “утиная”.
Характерным для остеопороза также является уменьшение роста взрослых больных на 2-3 см, а при длительном течении заболевания до 10-15 см. При этом увеличивается грудной кифоз и происходит наклон таза кпереди.
Диагностика
Наиболее распространенным методом диагностики остеопенического синдрома является визуальная оценка рентгенограмм различных отделов скелета. По рентгенологическим признакам профессор-рентгенолог А.И. Бухман выделяет небольшой, умеренный и резко выраженный остеопороз.
Небольшой остеопороз характеризуется снижением костной плотности, когда имеется повышение прозрачности рентгенологической тени и грубая исчерченность вертикальных трабекул позвонков.
При умеренном остеопорозе имеется выраженное снижение костной плотности, характеризующееся двояковогнутостью площадок тел позвонков и клиновидной деформацией одного позвонка.
При тяжелой степени остеопороза наблюдается резкое повышение прозрачности, так называемые стеклянные позвонки и клиновидная деформация нескольких позвонков.
При помощи рентгенологических данных диагноз остеопороза может быть поставлен, когда потеряно до 20-30% костной массы. В значительной степени установление диагноза при этих условиях зависит от квалификации рентгенолога.
В настоящее время для ранней диагностики остеопороза используются различные методы количественной костной денситометрии, позволяющей выявлять уже 2-5% потери массы кости, оценить динамику заболевания или эффективность лечения. Наиболее адекватным методом при остеопорозе является применение двухэнергетической рентгеновской абсорбциометрии (DEXA), позволяющей измерять содержание костного минерала в любом участке скелета, а также определять содержание солей кальция, жира и мышечной массы во всем организме. Аксиальная компьютерная томография измеряет МПКТ поясничных позвонков, разделяя трабекулярные и кортикальные костные структуры, измеряя объемные показатели в г/см3. Стандартными (автоматическими) программами для DEXA денситометров являются программы для поясничных позвонков, проксимальных отделов бедра, костей предплечья и программа “все тело”. Наряду с абсолютными показателями плотности кости в г/см3 исследуемого участка в результатах денситометрии автоматически вычисляется Z-критерий в процентах от половой и возрастной популяционной нормы и в величинах стандартного отклонения от нее (SD). Также рассчитывается и Т-критерий - в процентах или величинах SD от пиковой костной массы лиц соответствующего пола. Согласно рекомендациям ВОЗ по Т-критерию оценивают выраженность остеопении или остеопороза (табл. 1).
Биохимические маркеры костного метаболизма
Их исследуют для оценки скорости протекания процессов костного ремоделирования и диагностики остеопороза с высоким или низким темпом костного обмена, разобщенности или дисбаланса его составляющих: костной резорбции и костеобразования.
Наиболее точным маркером костного образования в настоящее время признают исследование содержания остеокальцина в крови.
Их исследуют для оценки скорости протекания процессов костного ремоделирования и диагностики остеопороза с высоким или низким темпом костного обмена, разобщенности или дисбаланса его составляющих: костной резорбции и костеобразования.Наиболее точным маркером костного образования в настоящее время признают исследование содержания остеокальцина в крови.
К маркерам резорбции костной ткани относят экскрецию оксипролина с мочой, активность кислой тартратрезистентной фосфатазы и определение пиридинолина, деоксипиридинолина и N-концевого телопептида в моче натощак. Наиболее информативным маркером костной резорбции является деоксипиридинолин.
Под нашим наблюдением находились более 150 пациентов с болезнью Иценко-Кушинга, из них 40 человек после двухсторонней адреналэктомии, среди которых 16 с синдромом Нельсона. Более 100 пациентов наблюдались в динамике, как в активной стадии заболевания, так и на фоне ремиссии гиперкортицизма. Анализ клинико-рентгенологических данных показал, что в активной стадии заболевания болевой синдром в позвоночнике наблюдался у 73% пациентов, причем выраженность его зависела от тяжести заболевания и не была связана с полом и возрастом больных. По данным визуальной оценки рентгенограмм грудного отдела позвоночника рентгенологические признаки остеопороза были выявлены у 90% пациентов, в поясничном отделе - у 45%, переломы ребер - у 52%, компрессионные переломы тел позвонков - у 40% больных. Значительно реже наблюдались переломы периферических костей скелета, что подтверждает преимущественное поражение костей с трабекулярной структурой. Измерение МПКТ, проведенное у пациентов с болезнью Иценко-Кушинга в 1991-1992 гг. методом двухэнергетической рентгеновской абсорбциометрии в дистальном радиусе (зоны интереса выделяли исследователи) и в поясничных позвонках (зоны интереса выделялись в автоматическом режиме), выявило следующее. У больных с болезнью Иценко-Кушинга выявлено снижение МПКТ в поясничных позвонках в среднем до 72,4 ± 5% от возрастной нормы (по Z-критерию) и практически не изменялась МПКТ в костях предплечья. У пациентов с синдромом Нельсона отмечалось аналогичное снижение МПКТ в поясничных позвонках - 70,6±6,3% от возрастной нормы и достоверное уменьшение МПКТ в дистальном отделе лучевой кости до 86,1%. Выявленное снижение МПКТ у пациентов с синдромом Нельсона можно объяснить более тяжелым течением гиперкортицизма у этих больных до двухсторонней адреналэктомии, наличием последующей заместительной терапии глюкокортикоидами и более старшим возрастом этих пациентов.
С 1996 г. исследования МПКТ мы проводили двумя методами: двухэнергетической рентгеновской абсорбциометрии на аппарате “Expert” фирмы “Lunar” (рис. 2) и ультразвуковой денситометрии (УЗД). Первым методом измеряли МПКТ в поясничных позвонках и проксимальном отделе бедра (шейке бедра), вторым методом определяли интегральный показатель Stiffness, измеряя скорость прохождения ультразвука и коэффициент затухания ультразвуковой волны в пяточной кости. У пациентов с болезнью Иценко-Кушинга МПКТ в поясничных позвонках составила 81,7±4,2% от возрастной нормы, что согласуется с данными других исследователей, выявивших снижение МПКТ на 20%. В шейке бедра этот показатель был 88,8%±3,9%, а Stiffness пяточной кости оказался почти в пределах нормы (94,5±3,8%). Необходимо отметить, что выраженные изменения МПКТ наблюдались не у всех пациентов с эндогенным гиперкортицизмом. При болезни Иценко-Кушинга в поясничных позвонках остеопению находили в 32% случаев, остеопороз - в 45%; нормальные значения МПКТ - в 23%; при синдроме Нельсона соответственно 36, 47 и 17% случаев. Значительно реже выявляли изменения в шейке бедра: при болезни Иценко-Кушинга остеопения выявлена в 26% случаев, остеопороз - в 22%, отсутствие изменений - в 52%; при синдроме Нельсона - соответственно 32, 38 и 30% случаев. Таким образом, наши исследования подтверждают преимущественное поражение костей с трабекулярной структурой при гиперкортицизме, особенно тел позвонков и ребер.
Рис. 2. Аппарат "Expert XL", фирма "Lunar"
Наиболее адекватным методом ранней диагностики остеопении при остеопорозе является остеоденситометрия позвоночника и рентгенография костей черепа и грудных позвонков в боковой проекции.
Лечение остеопороза
В настоящее время существует большой спектр препаратов для лечения остеопороза, в большей или меньшей степени удовлетворяющих критериям эффективности терапии (табл. 2). Для лечения и профилактики остеопороза в зависимости от его тяжести и выраженности назначают бисфосфонаты, кальцитонин, фториды, активные метаболиты витамина D.
При эндогенном гиперкортицизме (болезнь или синдром Иценко-Кушинга) часто наблюдается резко выраженная степень остеопороза с компрессионными переломами тел позвонков и переломами ребер. В активной фазе заболевания требуется энергичное лечение остеопороза; при выраженном болевом синдроме препаратом выбора является кальцитонин, применяемый одновременно с солями кальция и препаратами витамина D.
При постменопаузальном остеопорозе также рекомендуется назначение кальцитонина в дозе 100 МЕ (парентерально), а при достижении эффекта - 50-100 МЕ парентерально или 100-200 МЕ через день в виде интраназального аэрозоля.
В терапии вторичного остеопороза (в частности, стероидного) наибольшее распространение получили антирезорбтивные средства и препараты витамина D.
Отделение нейроэндокринологии ЭНЦ РАМН обладает большим опытом в лечении больных с остеопорозом препаратами бисфосфонатами, фторидами, препаратами витамина D и солями кальция.
Применение натрия фторида привело к приросту МПКТ в поясничных отделах позвоночника на 4,9% через 6 мес в первом случае, и 4-10% через 9 мес во втором. Дополнительные назначения к препаратам кальцитонина и кальция карбоната препаратов витамина D (альфакальцидол) приводит к нормализации кальция в крови и предотвращает гипокальциемию.
Таким образом, в настоящее время имеется целый арсенал средств для профилактики и лечения остеопороза. Задача врача заключается в адекватном выборе препаратов, их комбинации, схем лечения. Необходимо помнить, что остеопороз является заболеванием, которое очень медленно подвергается обратному развитию и нужно проводить мониторинг МПКТ 1 раз в 6-12 мес и/или маркеров костной резорбции для оценки эффективности лечения.
1. Рожинская Л.Я. “Системный остеопороз”. Крон-Пресс, М., 1996; 208.
2. Насонов Е.Л. и соавт. “Проблема остеопороза в ревматологии”. Стин, М., 1997; 429.
3. Марова Е.И. и соавт. “Нейроэндокринология”. Диа-Пресс, Ярославль, 1999; 423-84.
Читайте также:
