Преимущества ингибиторов ароматазы перед кломифеном. Сочетание с гонадотропинами
Добавил пользователь Skiper Обновлено: 01.02.2026
В последние годы целый ряд новых гормональных агентов для лечения рака молочной железы (чистые антиэстрогены, ингибиторы ароматазы и агонисты гонадотропин-рилизинг-гормонов) интенсивно изучаются у женщин с гормонозависимыми опухолями. Эти препараты сравниваются с "золотым" стандартом тамоксифеном, а также друг с другом в больших клинических исследованиях.
Тамоксифен vs Анастрозол при диссеминированном раке молочной железы.
Сравнение эффективности ингибитора ароматазы анастрозола с тамоксифеном в качестве гормонотерапии первой линии проведено в двух больших мультицентровых исследованиях, имевших сходный дизайн: Европейском и Северо-Американском. [1,2]. Эти исследования продемонстрировали небольшое повышение эффективности анастрозола по сравнению с тамоксифеном, а также увеличение времени до прогрессирования, особенно у больных с положительными рецепторами к эстрогену.
Аналогичные результаты получены также в исследовании испанских авторов, в котором анастрозол сравнивался с тамоксифеном при проведении гормонотерапии первой линии у больных с положительными рецепторами к эстрогену [3] (табл.4).
Таблица 4.
Анастрозол vs Тамоксифен: Барселонское исследование.
В этом сравнительно небольшом исследовании поучено увеличение продолжительности безрецидивного интервала и повышение непосредственной эффективности при использовании тамоксифена по сравнению с анастрозолом. Спектр токсичности был сходным с незначительным преобладанием частоты вагинальных кровотечений и ощущения приливов у больных, получавших такмоксифен.
Эффективность тамоксифена и анастрозола при перекрестном назначении (cross-over). Частью Европеского и Северо-Американского исследований была оценка эффективности перекрестного (cross-over) назначения анастрозола и тамоксифена в случае прогрессирования (больным, получавшим тамоксифен, при прогрессировании назначался анастрозол и наоборот) (табл.5) [4].
Таблица 5.
Результаты перекрестного назначения тамоксифена/анастрозола.
Полученные данные свидетельствуют о существенной активности анастрозола у больных с прогрессированием на фоне приема тамоксифена и наоборот. Это несомненно является обнадеживающим для больных с гормоночувствительными опухолями молочной железы. Однако, проведение перекреста не позволяет сделать вывод о том, какой же из двух препаратов обеспечил улучшение выживаемости в этих исследованиях.
При среднем сроке наблюдения 2 года никаких существенных изменений содержания холестерина, липопротеидов низкой и высокой плотности, а также триглицеридов не было отмечено ни среди больных, принимавших тамоксифен, ни в группе пациенток, принимавших анастрозол [5].
Летрозол в сравнении с Тамоксифеном при лечении распространенного и раннего рака молочной железы.
Второй ингибитор ароматазы летрозол также является объектом пристального внимания исследователей. Результаты двух больших исследований представлены компанией Новартис. В первом (двойном слепом, перекрестном) сравнивалась эффективность летрозола и тамоксифена при проведении гормонотерапии первой линии у больных в менопаузе с положительными или неизвестными рецепторами [6]. Полученные результаты представлены в табл. 6.
Таблица 6.
Летрозол в сравнении с тамоксифеном при распространенном раке молочной железы.
В этом исследовании летрозол обеспечивал лучшую непосредственную эффективность и более продолжительное время до прогрессирования по сравнению с тамоксифеном. Данные относительно выживаемости отсутствуют. Оба вида лечения переносились больными сравнительно хорошо. Летрозол оценен в сравнении с тамоксифеном также у больных в менопаузе с ранним раком молочной железы [7]. В исследование включались больные, которым планировалось органосохраняющее лечение, с гормонозависимыми опухолями. Продолжительность неоадъювантной гормонотерапии составляла 4 мес., после чего больные подвергались хирургическому лечению. Полученные результаты представлены в табл. 7.
Таблица 7.
Летрозол в сравнении с тамоксифеном в качестве предоперационной гормонотерапии рака молочной железы.
Полученные данные показали, что летрозол был более эффективным по сравнению с тамоксифеном при проведении неоадъювантной гормонотерапии и позволил выполнить большее число органосохраняющих операций. В исследовании были проанализированы также некоторые маркеры клинического эффекта. С этих позиций, гиперэкспрессия HER2 была ассоциирована с резистентностью к тамоксифену, но не летрозолу. Биологические основы этого явления пока не ясны.
Чистые антиэстрогены в сравнении с ингибиторами ароматазы.
Тамоксифен и препараты ему подобные, например, ралоксифен, являются селективными модуляторами рецепторов эстрогенов и обладают свойствами как эстрогенов, так и антиэстрогенов. Одним из перспективных направлений развития гормонотерапии представляется использование "чистых" антиэстрогенов, обладающих исключительно антиэстрогенной активностью и ассоциирующихся с деградацией рецепторов эстрогенов в опухолевых клетках. Целый ряд доклинических исследований свидетельствуют о том, что "чистые" антиэстрогены могут быть полезны в резистентных к тамоксифену случаях рака молочной железы. Эти слова в полной мере могут быть отнесены к "чистому" антиэстрогену фулвестранту (Фазлодекс, ICI 182780), которому посвящены два крупных рандомизированных исследования (Европейское и Северо-Американское), в которых препарат сравнивался с анастрозолом у резистентных к тамоксифену больных в менопаузе [8,9]. Все пациентки, включенные в исследование, имели положительные РЭ и/или РП, а в случае неизвестного рецепторного статуса ранее отвечали на гормонотерапию. Два дозовых режима фулвестранта (125 и 250 мг/сут.) сравнивались с анастрозолом в дозе 1 мг/сут. Характеристика пациенток и предварительные результаты приведены в табл. 8.
Таблица 8.
Фулвестрант vs анастрозол при резистентном к тамоксифену раке молочной железы.
В целом не было выявлено каких-либо существенных различий в частоте объективных эффектов или времени до прогрессирования между фулвестрантом и анастрозолом. Небольшое различие в длительности эффекта было отмечено в Северо-Американском исследовании.
Экземестан в сравнении с Тамоксифеном в качестве первой линии терапии диссеминированного рака молочной железы.
Экземестан в отличие от анастрозола и летрозола имеет стероидную структуру и необратимо блокирует ароматазу. Сравнение эффективности экземестана и тамоксифена проведено в рамках рандомизированного исследования, в котором приняли участие больные диссеминированным раком молочной железы в менопаузе с положительными РЭ и/или РП [10]. Основные результаты исследования приведены в табл. 9.
Таблица 9.
Экземестан vs Тамоксифен при диссеминированном раке молочной железы.
В этом исследовании экземестан продемонстрировал лучшие непосредственные результаты лечения по сравнению с тамоксифеном.
Экземестан в неоадъювантной терапии местно-распространенного рака молочной железы. Роль экземестана в предоперационной терапии рака молочной железы оценена в небольшом исследовании II фазы [11], в которое включены 13 больных постменопаузального возраста с РЭ+. Участницы исследования получали экземестан в суточной дозе 25 мг в течение 3 месяцев перед хирургическим лечением. В среднем отмечено уменьшение опухолевой массы на 85%, и 83% больных ответили на лечение. В результате изучения биоптатов молочных желез было показано, что экземестан снижает циркуляцию периферических и синтез внутриопухолевых эстрогенов.
Итак, несколько рандомизированных исследований были посвящены сравнению тамоксифена и ингибиторов ароматазы в первой линии гормонотерапии диссеминированного рака молочной железы у больных в менопаузе. В целом, ингибиторы ароматазы отличались более благоприятным спектром токсичности по сравнению с тамоксифеном. В большинстве исследований ингибиторы ароматазы продемонстрировали сравнимую с тамоксифеном, а иногда и превосходящую его эффективность. Полученные результаты свидетельствуют о том, что ингибиторы ароматазы могут рассматриваться, наряду с тамоксифеном, как препараты выбора для лечения больных постменопаузального возраста с РЭ+, правда пока нет четких данных об улучшении выживаемости при использовании ингибиторов ароматазы. Нерешенным остается и вопрос об оптимальной последовательности назначения ингибиторов ароматазы и тамоксифена.
Выключение функции яичников или химиотерапия в качестве адъювантного лечения.
Возрождается интерес к проблеме аменореи/овариоэктомии у женщин пременопаузального возраста с гормонозависимой болезнью. Полагают, что эффект адъювантной химиотерапии частично реализуется через индуцируемую аменорею; исследования по изучению этой проблемы признаны сегодня приоритетными [12]. В частности, в исследовании ZEBRA с участием пациенток пременопаузального (
Copyright © Российское общество клинической онкологии (RUSSCO).
Полное или частичное использование материалов возможно только с разрешения администрации портала.
Гормонотерапия при раке молочной железы
Гормонотерапия при раке молочной железы сегодня проводится теми же препаратами, что и 20 лет назад, не изменились и основополагающие принципы её назначения, существенное отличие современного подхода в более точном подборе лекарственного средства с ориентировкой на биологические характеристики опухоли и индивидуальные эндокринные показатели пациентки.
Что такое гормонотерапия?
Гормонотерапия при раке молочной железы предполагает применение в лечебных или профилактических целях похожих на половые гормоны лекарственных средств для «обмана» раковой клетки или полное прекращение воспроизводства эндокринных субстанций яичниками, а также синтеза гормонов в жировой ткани.
Конечная цель гормонотерапии — не допустить поступления половых гормонов в раковую клетку молочной железы, чем нарушается синтез необходимых для её жизни веществ и вынужденно включается программа клеточной гибели — апоптоз.
В качестве гормональных (эндокринных) лекарственных средств при раке молочной железы используют:
- натуральные гормоны и их синтетические аналоги — эстрогены, андрогены и прогестины;
- блокирующие связывание естественного гормона с рецептором опухолевой клетки антигормоны — антиэстрогены;
- нарушающие локальный синтез гормонов в жировой ткани ингибиторы ароматазы;
- гонадотропин-релизинг-гормон — химическое вещество, подменяющее естественный гормон гипоталамуса, который блокирует синтез яичниками собственных половых гормонов.
Аналогично гонадотропин-релизинг-гормону действуют хирургическое удаление придатков или облучение яичников, без них невозможно лечение менструирующих женщин ингибиторами ароматазы.

Показания к назначению
Рак молочной железы возникает на фоне гормонального дисбаланса, но не все опухоли чувствительны к гормональному воздействию, некоторые популяции клеток не используют половые гормоны для своей жизнедеятельности — они гормонально независимы. Как правило, независимой считается опухоль, в которой не больше 1% клеток нуждается в эстрогенах.
О гормональной зависимости злокачественного новообразования молочной железы судят по наличию на ядерных мембранах клеток рака специальных гормональных рецепторов, взаимодействующих с эстрогенами и переносящих их внутрь клеточного ядра, кратко обозначаемых как «ЭР+» или «ER+». Рецепторы определяет специальный анализ.
Дополнительный косвенный признак гормонозависимого рака молочной железы — наличие мембранных рецепторов прогестерона — «ПР+» или «PR+», пороговое значение — более 20% клеток в популяции.
Наиболее благоприятно для назначения гормонотерапии при раке молочной железы сочетание максимально высокого уровня ЭР+ с ПР+. Формально гормонотерапия показана всем пациенткам, в опухоли молочной железы которых имеется более 1% клеток ЭР+ без учёта концентрации ПР+.
Особенности гормонотерапии при РМЖ
Гормональная зависимость рака молочной железы обещает чувствительность к гормонотерапии, но не гарантирует её.
Во-первых, не все ЭР способны взаимодействовать с лекарственным препаратом, нацеленным на него антиэстрогеном. Результат лечения прогнозирую по объёму популяции чувствительных клеток, считается, что чем больше в раке ЭР+, тем эффективнее будет эндокринная терапия.
Во-вторых, некоторые опухоли формируют устойчивость к лекарству, ускоренно разрушая его в своей цитоплазме или выводя из клетки в межклеточную жидкость. Формирование устойчивости легло в основу поэтапной гормонотерапии, когда при утрате опухолью чувствительности к одному препарату переходят на другую группу лекарственных средств. Особенность рака молочной железы — возможность перехода с одной линии гормонотерапии на другую при снижении клинической эффективности воздействия.
В-третьих, ради собственного выживания на фоне гормонотерапии, опухоль постепенно становится нечувствительной к препарату, происходит естественный отбор — реагирующие на гормональные лекарства клетки погибают, выживают и дают потомство нечувствительные. Отчасти на этой особенности рака молочной железы базируется отказ от одновременного использования химиотерапии и гормонотерапии — только последовательно.
При подборе лекарственного препарата обязательно учитывается гормональный период, в котором пребывает женщина. При недавнем прекращении менструации определяется концентрация производимых гипофизом лютеинезирующего (ЛГ) и фолликулостимулирующего (ФСГ) гормонов, стимулирующих работу яичников.
Виды гормональной терапии
В зависимости от цели гормонотерапию подразделяют на неоадъювантную, адъювантную и лечебную.
Неоадъювантная ГТ проводится до радикальной операции для уменьшения объема опухолевого узла и уничтожения микрометастазов, попутно выясняется клиническая чувствительность опухоли к конкретному лекарственному препарату и перспективность профилактической антигормональной терапии после операции. Этот вид ГТ назначается при люминальном молекулярно-биологическом подтипе рака молочной железы с ЭР+ и ПР+. Эффект при гормонотерапии отсроченный, в отличии от химиотерапии, поэтому неоадъювантное лечение проводится не менее 4 месяцев, при хорошем результате — 8 месяцев и дольше, соответственно, на такой же срок откладывается операция на молочной железе. Поскольку наименее токсичными считаются ингибиторы ароматазы, их и используют, но они разрешены только для переживших менопаузу женщин.

Адъювантная гормонотерапия назначается для профилактики рецидива и метастазирования, она проводится всем больным с ЭР+, в том числе при карциноме in situ, только цель при 0 стадии иная — предотвращение развития рака в другой молочной железе. Продолжительность терапии — до прогрессирования или 5-10 лет в зависимости от исходного прогноза, а начинают ГТ строго после завершения адъювантной химиотерапии. Выбор препарата зависит от менструального статуса женщины.
Лечебная ГТ применяется при неоперабельном раке молочной железы или метастазах после радикального лечения. Длительность эндокринного воздействия зависит от эффективности, при прогрессировании переходят на следующий по очереди лекарственный препарат, выбор которого определяется по гормональному статусу женщины.
Препараты
Гормональная терапия рака молочной железы проводится антиэстрогенами и ингибиторами ароматазы, применение эстрогенов, прогестинов и андрогенов ограничено высокой частотой осложнений. Каждый препарат в лечебных целях принимают до прогрессирования заболевания, в профилактически — до появления метастазов или не менее 5 лет.
Антиэстрогены представлены двумя препаратами:
- ежедневно принимаемые при всех видах ГТ и в любом гормональном периоде таблетки тамоксифена;
- фулвестрант (Фазлодекс™) используется при распространенном раке молочной железы, ранее прогрессировавшем на тамоксифене, и только после менопаузы, он вводится в мышцу раз в месяц, главный недостаток — стоимость инъекции около 500$.
Ингибиторы ароматазы в таблетках для ежедневного приема применяются при любом виде ГТ у женщин после менопаузы, все лекарства одинаково эффективны:
Никогда одновременно не используются лекарственные средства разных групп — только по-отдельности. Некоторые схемы адъювантной ГТ предполагают смену лекарства через определенный срок, например, молодая женщина 5 лет пьет тамоксифен, при прекращении менструальной функции ещё 2 года получает ингибиторы ароматазы. При лечении неоперабельного рака или метастазов смена группы происходит при возобновлении опухолевого роста или появлении выраженных побочных осложнений.
Для временного выключения функции яичников у менструирующих женщин применяются аналоги гонадотропин-рилизинг-гормона (ГРГ), при раке молочной железы Стандарты рекомендуют каждые 28 дней инъекцию одного из одинаково эффективных средств:
- гозерелин (Золадекс™);
- трипторелин (Диферелин™);
- бусерелин (Бусерелин-депо™);
- лейпрорелин (Люкрин-депо™)
Группа ГРГ вспомогательная, используется вместе с ингибиторами ароматазы или антиэстрогенами. Прием таблеток начинают после полутора-двух месяцев инъекций антагонистов гонадотропинов. ГРГ конкуренты удаления или облучения яичников, после прекращения инъекций менструация у молодых женщин восстанавливается в ближайшие 3 месяца.
Побочные действия
Антиэстрогены и ингибиторы ароматазы обладают схожими побочными реакциями, самые опасные из которых: образование тромбов и дисгормональный остеопороз. Тамоксифен активнее влияет на свертываемость крови, и при многолетнем использовании у небольшого процента женщин индуцирует рак эндометрия. Ингибиторы ароматазы чаще осложняются остеопорозом. Одинаково часто обе группы вызывают приливы.
Все гормональные препараты подвергаются трансформации в печени. Тамоксифен может вызвать токсическое поражение печени и привести к застою желчи — холестазу, клиника которого отчасти напоминает острый холецистит, все симптомы исчезают после отмены антиэстрогена.
В настоящее время нет однозначного мнения по выбору лекарственного средства — эффективность их одинаковая, поэтому ориентируются на гормональный возраст и сопутствующую патологию, к примеру, при варикозной болезни или патологии эндометрия целесообразно избегать тамоксифена, при остеопорозе — ингибиторов.
В подавляющем большинстве случаев ГТ хорошо переносится, что позволяет при неблагоприятных прогностических факторах пролонгировать её до 7-10 лет.
Возможные последствия
На фоне приёма тамоксифена:
- при метастазах в костях рака молочной железы в первый месяц лечения могут усилиться боли — синдром «вспышки» требует отмены антиэстрогена;
- стимулируется овуляция и возможна беременность, поэтому женщины репродуктивного возраста должны прибегать к контрацепции;
- течение кардиальных заболеваний улучшается вследствии благоприятного действия на обмен липидов, но только после нескольких лет ГТ;
- опосредованное повышение в крови эстрогенов приводит к приливам, но также несколько «омолаживает» кожу и слизистые половых органов;
- осложнения со стороны глаз редки, но возможно обострение давней ретинопатии, кератопатии или усугубление возрастной катаракты.
Использование препарата группы ГРГ часто сопровождается посткастрационным синдромом с приливами, частыми кольпитами, недержанием мочи, болями в мочевом пузыре и т.д. У женщин в пременопаузе при совместном применении ГРГ с ингибитором ароматазы возможно повышение уровня эстрадиола, что исключает эффект от лечения.
Диета при гормонотерапии
Многие женщины считают, что на фоне гормональных препаратов растет вес тела, клинические исследования на счет ГТ относят всего лишь 1,6% — 4% случаев повышения веса. Избыток веса обусловливается не фармакологическим действием, а изменением ритма жизни после выявления рака молочной железы, нормализацией питания после завершения химиотерапии и снижением уровня стресса после проведения радикальной терапии. На профилактической ГТ женщина успокаивается и бережет себя, избегая физических нагрузок, и вес растет даже без лекарств.
Гормонотерапия не нуждается в особой диете, необходима коррекция питания с учетом ежедневных нагрузок и сопутствующих болезней.
Эффективность
Результат терапии зависит от чувствительности опухолевых клеток к лекарствам, поэтому в обязательном порядке до начала лечения определяется молекулярно-биологический подтип рака молочной железы.
Эффект адъювантной терапии оценивается по времени появления метастазов — на фоне ГТ или в течение года после её завершения. В отсутствии клинически определяемой опухоли косвенно об эффективности свидетельствует уровень эстрадиола в крови.
Результат гормонального воздействия более медленный, нежели химиотерапии, поэтому оценка эффективности при распространенном раке молочной железы проводится каждые 3-4 месяца приема. Общий эффект ГТ — от 15% до 36%, и тем выше, чем больше концентрация ЭР и ПР.
Прогноз при применении гормонотерапии
Распространенность рака молочной железы на момент выявления косвенно свидетельствует об агрессивности и гормональной независимости опухоли. ГТ мало полезна при метастатической стадии, сопровождающейся висцеральным кризом — при множественных злокачественных новообразованиях внутренних органов с нарушением их функции.
При распространенном процессе с высоким уровнем ЭР и ПР на фоне ГТ регрессируют множественные метастазы, особенно в костях, коже и лимфоузлах, даря женщине годы качественной жизни. Эндокринное воздействие бесполезно при прогрессировании рака молочной железы на фоне трех линий ГТ.
Лечение рака должно быть своевременным и адекватным, в «Евроонко» можно выполнить геномный анализ опухоли на чувствительность к препаратам, что повысит непосредственные результаты терапии и положительно отразится на продолжительности жизни.
Ингибиторы ароматазы
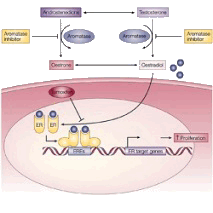
В многочисленных исследованиях было доказано, что рост некоторых опухолей, возникающих у женщин, может зависеть от наличия в организме женских половых гормонов - эстрогенов. К таким опухолям относится рак молочной железы, рак тела матки (эндометрия), а также рак яичников. Лишив опухолевые клетки «подпитки» этими гормонами, можно остановить их рост и даже добиться полного или частичного исчезновения опухоли. Для выяснения, является ли конкретная опухоль зависимой от эстрогенов, проводится специальное исследование, направленное на выявление рецепторов этих гормонов в опухолевых клетках (подробнее - здесь).
Внимание! Ингибиторы ароматазы эффективны для лечения только тех опухолей, которые вырабатывают рецепторы эстрогена.
Основными источниками эстрогенов в организме женщин до наступления менопаузы являются яичники. После наступления менопаузы выработка эстрогенов в яичниках резко сокращается и их уровень в организме резко снижается. Тем не менее, небольшое их количество непрерывно вырабатывается в других органах, большая часть - в жировой ткани. Для стимуляции роста опухолевых клеток может оказаться достаточно минимального количества эстрогенов. Образование эстрогенов в ней происходит за счет работы особого фермента (белка) - ароматазы. Таким образом, в случае отсутствия образования эстрогенов в яичниках, подавление активности ароматазы приводит к прекращению их образования в организме [1].
Ингибиторы ароматазы - класс лекарственных препаратов, подавляющих активность этого фермента и, следовательно, снижающих уровень эстрогенов в организме. При применении ингибиторов ароматазы опухолевые клетки лишаются «подпитки» эстрогенами, их рост замедляется или останавливается. Это останавливает процесс прогрессирования опухоли, снижает риск развития рецидива. Важно отметить, что ингибиторы ароматазы не влияют на процессы образования эстрогенов в яичниках. По этой причине их применение у пациенток, не достигших менопаузы (т.е., во время продолжающихся менструаций), не эффективно. Ингибиторы ароматазы назначаются только пациенткам в постменопаузальном возрасте.
В настоящее время существует три препарата, относящихся к этому классу:
Все ингибиторы ароматазы выпускаются в форме таблеток и принимаются внутрь по 1 таблетке в день. Эксеместан предпочтительно принимать после приема пищи, летрозол и анастрозол можно принимать как до, так и после приема пищи. Вышеуказанные препараты выпускаются под многими торговыми названиями. В многочисленных исследованиях было показано, что применение ингибиторов ароматазы является одним из лучших вариантов для первоначальной эндокринотерапии рака молочной железы. Этот вид лечения может проводиться как после хирургического лечения, лучевой терапии и химиотерапии для снижения риска развития рецидива болезни (адъювантная терапия) , так и в качестве самостоятельного метода лечения в тех случаях, когда проведение других методов не показано. Наиболее часто пациентки принимают ингибиторы ароматазы в течение долгого времени, например, в течение 5 или более лет.
Лечение ингибиторами ароматазы, как правило, хорошо переносится пациентками, однако, на его фоне возможно развитие ряда побочных эффектов. Наиболее часто отмечается снижение минеральной плотности костей (остеопороз), что проявляется снижением их прочности и повышением риска развития переломов. С целью предотвращения развития осложнений в процессе лечения ингибиторами ароматазы периодически проводятся специальные исследования, направленные на оценку состояния костной системы (денситометрия) и, при необходимости, назначаются специальные препараты, направленные на поддержание прочности костей. Также у некоторых пациентов отмечается появление чувства «скованности» в суставах или болей в них, также может отмечаться развитие побочных эффектов со стороны сердца и сосудов и других нежелательных явлений.
Если в процессе лечения у Вас отмечается развитие этих или других побочных эффектов обсудите это с Вашим лечащим врачом. Ваш лечащий врач может предложить вам способы устранения или облегчения этих побочных эффектов или, в случае неудовлетворительной переносимости лечения, заменить препарат на альтернативный. В целом, риск развития побочных эффектов при применении ингибиторов ароматазы ниже, чем на фоне лечения тамоксифеном.
Как было сказано выше, ингибиторы ароматазы способны подавить процессы образования эстрогенов только у пациенток после менопаузы. Для лечения пациенток более молодого возраста чаще используется тамоксифен, препарат, блокирующий связывание эстрогена с его рецепторами за счет их «захвата». Тем не менее, так как эффективность ингибиторов ароматазы может быть выше, чем эффективность тамоксифена. По этой причине разработана методика, предусматривающая «выключение» функции яичников на период лечения ингибиторами ароматазы.
Необходимо отдельно отметить, что в некоторых ситуациях выяснить, действительно ли пациентка достигла менопаузы бывает непросто: не всегда прекращение менструаций (аменорея) означает менопаузу. Существуют и другие причины аменореи, включая недавно проведенную химиотерапию, выраженное снижение массы тела и т.д. Разработаны специальные критерии определения менопаузы [2]:
- Отсутствие менструаций в течение 12 месяцев или более при отсутствии ранее проведенной химиотерапии, эндокринотерапии, а также проведения других видов лечения, способствующих подавлению функции яичников;
- Ранее проведенная операция по удалению яичников (придатков матки);
- Возраст старше 60 лет;
- Концентрация ФСГ и эстрадиола в плазме крови, гормонов, отражающих функцию яичников, соответствующая постменопаузе.
Если пациентка не соответствует этим критериям, факт наступления менопаузы может быть сомнительным. В этом случая следует обсудить вопрос о подавлении функции яичников (медикаментозном, при помощи препаратов-аналогов ГНРГ или хирургическом) либо обсудить другие методы лечения.
Преимущества ингибиторов ароматазы перед кломифеном. Сочетание с гонадотропинами
Кафедра акушерства, гинекологии, перинатологии и репродуктологии факультета последипломного профессионального обучения врачей Московской медицинской академии им. И.М. Сеченова;
Научный центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова
Российский научный онкологический центр им. Н.Н. Блохина РАМН
ФГБУ "Научный центр акушерства, гинекологии и перинатологии им. В.И. Кулакова" Минздравсоцразвития России, Москва
Применение ингибиторов ароматазы у больных раком молочной железы в программах вспомогательных репродуктивных технологий
Журнал: Проблемы репродукции. 2012;(2): 72‑76
Назаренко Т.А., Пароконная А.А., Шарипова Н.Ю. Применение ингибиторов ароматазы у больных раком молочной железы в программах вспомогательных репродуктивных технологий. Проблемы репродукции. 2012;(2):72‑76.
Nazarenko TA, Parokonnaia AA, Sharipova NIu. THE USE OF AROMATASE INHIBITORS IN ART IN WOMEN WITH BREAST CANCER. Russian Journal of Human Reproduction. 2012;(2):72‑76. (In Russ.).
Использование ингибиторов ароматазы в протоколах стимуляции суперовуляции, проводимых с целью забора ооцитов и криоконсервации генетического материала перед полихимиотерапией у женщин репродуктивного возраста, больных раком молочной железы, обеспечивает выраженное снижение уровня эстрадиола при нормальных показателях оо- и эмбриогенеза.
Комплексный подход к лечению онкологических заболеваний позволяет спасти жизнь многим больным. Однако полихимиотерапия дает гонадотоксичный эффект и может привести к преждевременной недостаточности функции яичников и бесплодию. Увеличивающийся уровень выживаемости после комбинированного и комплексного лечения онкологических заболеваний, новые репродуктивные технологии, а также возрастающее внимание к вопросам качества жизни больных делают возможным сохранение фертильности у данной группы пациенток.
Во многих странах разработаны рекомендации сохранения репродуктивного материала больных, получающих гонадотоксичное лечение [1—3]. Определены критерии отбора пациентов, наиболее приемлемые и эффективные методы сохранения генетического материала, а также сроки проведения лечебных мероприятий.
Криоконсервация гамет и/или эмбрионов у пациенток, подлежащих гонадотоксичному лечению, в настоящее время становится все более распространенной и проводится во многих странах мира.
При ряде заболеваний, таких как рак молочной железы, использование стандартных схем стимуляции суперовуляции не совсем приемлемо, так как приводит к выраженному повышению уровня половых стероидов в крови, что может иметь потенциальный риск для здоровья женщины. Забор ооцитов в «естественном» цикле позволяет избежать этих рисков, однако дает очень маленький шанс на рождение детей в будущем. При наличии нескольких эмбрионов, доступных для криоконсервации, у пациентки появляются реальные шансы иметь генетически родного ребенка. Времени для проведения программы сохранения генетического материала, как правило, недостаточно, что обусловлено необходимостью начать лечение основного заболевания. В связи с этим крайне актуальным является вопрос использования модифицированных протоколов стимуляции овуляции, сочетающих эффективность и безопасность.
Наиболее привлекательными в плане обеспечения этих эффектов являются ингибиторы ароматазы (ИА). Данная группа препаратов в течение многих лет обсуждается в качестве средств для стимуляции овуляции как в режиме монотерапии, так и в комбинации с гонадотропинами. Однако использование ИА в программах ВРТ не получило столь широкого распространения, и роль их на сегодняшний день в этой области остается не ясной.
Некоторое время назад препараты, относящиеся к группе ИА, привлекли внимание специалистов в качестве средств, снижающих уровень эстрадиола при проведении стимуляции овуляции у больных раком молочной железы.
Ароматаза является ферментным комплексом микросом, членом цитохрома Р450, необходимым в организме для завершения синтеза эстрогенов путем уникальной реакции ароматизации С19-стероидов, а именно биосинтеза эстрона из андростендиона, эстрадиола из тестостерона. Эти реакции могут происходить в яичниках, жировой ткани, плаценте, молочных железах, мышцах, головном мозге, фибробластах, остеобластах, печени, т.е. ароматизация является универсальной реакцией организма человека [4].
По существу, ИА представляют собой антиэстрогены. Блокирование ароматазной реакции нарушает синтез эстрогенов, а именно переход эстрона в эстрадиол, в результате чего снижается уровень эстрадиола в периферической крови. Это свойство препаратов используют для лечения эстрогенположительного рака молочной железы [5—7].
В качестве препаратов, входящих в состав модифицированных протоколов для стимуляции овуляции, обсуждаются летрозол и анастразол. Оба данных вещества относятся к III поколению ИА, к группе конкурентных ингибиторов (их действие обратимо).
Зарубежные исследования показывают эффективность ИА в снижении уровня эстрадиола при индукции суперовуляции у больных раком молочной железы [8, 9]. В настоящей статье представлен собственный опыт применения этой группы лекарственных средств в программе сохранения генетического материала у больных раком молочной железы молодого возраста.
Материал и методы
В настоящее исследование включены 20 женщин (средний возраст 29±3,6 года) репродуктивного возраста, больных раком молочной железы I—IIIА стадии. Пациентки были направлены онкологами Российского онкологического научного центра им. Н.Н. Блохина РАМН для решения вопроса о возможности сохранения генетического материала перед предстоящим проведением полихимиотерапии. На первом этапе онкологами оценивался прогноз и возможность благоприятного течения заболевания на основании данных о стадии заболевания, результатов гистологического и иммуногистохимического исследований. На момент обращения 8 из 19 пациенток было проведено оперативное лечение в объеме мастэктомии или радикальной резекции молочной железы (11). Всем женщинам, за исключением 1 пациентки, планировалось проведение адъювантной полихимиотерапии, в 1 случае — неадъювантной.
У всех пациенток был проведен анализ овариального резерва: исследован уровень ФСГ, ЛГ, эстрадиола, антимюллерова гормона (АМГ) в сыворотке крови на 2—3-й день менструального цикла, оценен объем яичников и число антральных фолликулов в них при ультразвуковом исследовании. У пациенток исследуемой группы были использованы различные схемы управления менструальным циклом, протокол выбирался на основании гинекологического и онкологического статуса (стадии заболевания, клинических, патоморфологических и иммуногистохимических характеристик опухоли).
У 5 пациенток забор ооцитов осуществляли в «модифицированном» естественном цикле, включающем назначение антагониста ГнРГ при достижении доминантным фолликулом размера 14 мм с целью предупреждения паразитарного пика ЛГ и отмены протокола. Триггер овуляции вводили при достижении фолликулом 18—19 мм в диаметре. Трансвагинальную пункцию производили через 36 ч при кратковременном внутривенном наркозе и под контролем ультразвука. Данный протокол использовали у пациенток, направленных к нам в середине менструального цикла, а также у женщин, не желающих прибегать к стимуляции яичников.
Протокол с антагонистами ГнРГ использовали у 5 пациенток. Введение гонадотропинов начинали со 2—3-го дня менструального цикла. Критерии назначения антагонистов ГнРГ и триггера овуляции описаны ранее.
У 5 женщин забор ооцитов осуществляли в протоколе с депо-формой агониста ГнРГ. Введение агониста ГнРГ (золадекс 3,6 мг) осуществляли на 2—3-й день менструального цикла, через 2 дня вводили гонадотропины. Триггер овуляции вводили по общепринятым критериям.
В 6 случаях использовали модифицированный протокол, включающий ИА (анастразол, летрозол) и гонадотропины. Пероральное введение ИА начинали со 2—3-го дня менструального цикла в дозе 2 и 2,5 мг соответственно. Дозу ИА корректировали в течение цикла стимуляции в зависимости от количества растущих фолликулов и уровня эстрадиола в сыворотке крови. Максимальная доза ИА составила 6 мг для анастразола, 5 мг для летрозола. С 3—6-го дня цикла начинали введение гонадотропинов, при достижении лидирующим фолликулом диаметра 14 мм начинали введение антагонистов ГнРГ. Триггер овуляции вводили исходя из общепринятых критериев. В день введения триггера овуляции прием ИА прекращали, возобновляя его в день трансвагинальной пункции.
Во всех случаях трансвагинальную пункцию производили через 36 ч после внутримышечного введения овуляторной дозы хорионического гонадотропина человека (чХГ). Оплодотворение в 8 случаях проводили методом ИКСИ, в 12 — методом ЭКО. Криоконсервацию эмбрионов проводили на стадии бластоцисты (в 6 случаях на стадии 8 бластомеров) методом медленного замораживания в 15 случаях, в 4 — произведена витрификация.
Статистический анализ. С целью сравнительной оценки количественных данных использовали непараметрический тест Манна—Уитни для независимых выборок. При р
Результаты и обсуждение
Средний возраст пациенток составил 29 лет (23—40 лет). У 8 пациенток была диагностирована I стадия заболевания, у 10 — II стадия, у 2 — III стадия. Пациенткам планировалось проведение лечения рака молочной железы по общепринятым стандартам, включающим полихимиотерапию в неадъювантном и/или адъювантном режиме. У одной пациентки 40 лет от проведения химиотерапии отказались, и планировалось лишь гормональное лечение в течение 5 лет, однако, учитывая старший репродуктивный возраст пациентки, длительность лечения и вероятную потерю фертильности, было решено произвести сохранение генетического материала.
Всем пациенткам проведена программа ЭКО с последующей криоконсервацией полученных эмбрионов. У одной пациентки удалось произвести забор ооцита в естественном цикле, сразу после обращения, и ввиду возможности отсрочки начала лечения основного заболевания в следующем менструальном цикле проведена вторая попытка ЭКО в модифицированном протоколе с ИА.
При анализе репродуктивной функции и овариального резерва у пациенток не было выявлено значительных отклонений от нормы. Лишь у 2 пациенток отмечалось снижение уровня АМГ в сыворотке крови (0,47 и 0,5 нг/мл соответственно), при этом уровень ФСГ и данные ультразвукового исследования были в пределах нормы. У одной из этих пациенток нам не удалось получить ооциты в протоколе с депо-агонистами ГнРГ, у второй был получен 1 ооцит в «модифицированном» естественном цикле.
Следует отметить, что у 12 женщин были самостоятельные беременности, но лишь у 2 пациенток были дети, остальные планировали реализовать репродуктивную функцию в будущем.
Подробная характеристика репродуктивной функции и овариального резерва представлена в табл. 1, 2.
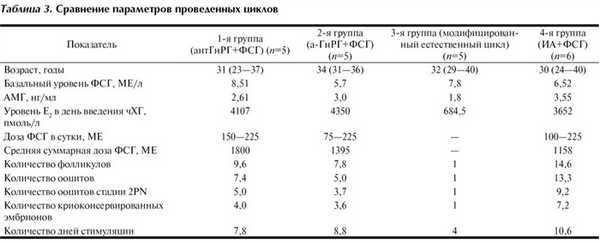
Используемые протоколы управления менструальным циклом имели различные характеристики и эффективность (табл. 3).
Наиболее эффективным, по нашему мнению, явился протокол, включающий ИА и гонадотропины, поскольку он обеспечил возможность получения достаточного числа ооцитов при относительно невысоком уровне эстрадиола в сыворотке крови.
Для оценки выраженности антиэстрогенного эффекта ИА мы сравнили стандартные циклы стимуляции у 6 женщин аналогичного возраста и с сопоставимыми параметрами овариального резерва и фолликулогенеза и пациенток группы исследования, у которых в протокол стимуляции были включены ИА.

Анализ показал, что ИА обеспечивали снижение уровня эстрадиола в сыворотке крови в 6 раз (р <0,05) по сравнению со стандартным протоколом стимуляции. При этом не было отмечено нарушения фолликуло- и оогенеза, снижения качества и количества полученных ооцитов и эмбрионов (табл. 4).
Показано, что использование летрозола в схеме стимуляции обеспечивало более выраженное снижение уровня эстрадиола (в 3,5 раза по сравнению с анастразолом), однако данные различия статистически незначимы, что, вероятно, связано с маленьким объемом выборки. Нужно отметить, что у пациенток, получавших анастразол, доза препарата 2 мг оказалась неэффективной, и во всех случаях требовалось увеличение дозы до 4 мг, максимально до 6 мг. При этом доза летрозола 2,5 мг позволила снизить уровень эстрадиола до нормальных значений; у одной пациентки, у которой отмечался мультифолликулярный рост, потребовалось увеличение дозы препарата до 5 мг.
В качестве клинического примера приводим следующее наблюдение.
Пациентка 40 лет, у которой сразу после обращения был произведен забор ооцита в модифицированном естественном цикле. Уровень эстрадиола в день введения чХГ составил 526 пмоль/л. Со 2-го дня следующего менструального цикла начали пероральное введение летрозола в дозе 2,5 мг в сутки. С 4-го дня менструального цикла начали введение гонадотропинов в дозе 150 МЕ в сутки. Уровень эстрадиола в день введения триггера овуляции составил 561 пмоль/л, т.е. не отличался от такового в естественном менструальном цикле. Тем не менее при трансвагинальной пункции яичников получено 5 ооцитов хорошего качества. На 3-и сутки после забора ооцитов при продолжающемся введении ИА уровень эстрадиола составлял 213 пмоль/л.
В настоящем исследовании показано, что использование ИА в протоколах стимуляции суперовуляции приводит к значительному снижению уровня эстрадиола в сыворотке крови, при этом удается получить достаточное количество ооцитов и эмбрионов хорошего качества. Длительность проведения стимуляции с ИА не превышает 14 дней, что позволяет производить забор генетического материала в короткие сроки до начала полихимиотерапии.
Полученные нами данные согласуются с результатами исследований зарубежных авторов, также показавших возможность использования данного протокола стимуляции у больных раком молочной железы [10, 11]. Некоторыми авторами [11] описана более высокая эффективность летрозола по отношению к анастразолу. В нашей работе достоверных данных на этот счет получено не было, вследствие небольшого числа пациентов, что делает необходимым продолжение исследований в этой области.
Обсуждается безопасность использования ИА в циклах стимуляции суперовуляции. По данным нескольких зарубежных авторов [12, 13], использование ИА не приводит к увеличению частоты пороков развития у детей. Эксперименты, проведенные на мышах, показали, что ИА не вызывают хромосомных нарушений в ооцитах и не приводят к нарушению эмбриогенеза, уровень образования бластоцист сравним с контролем [14, 15]. Кроме того, при использовании в циклах стимуляции ИА выводятся из организма к моменту имплантации эмбриона, поскольку имеют короткий период полувыведения (48 ч), а при культивировании in vitro эмбрионы вообще не подвергаются воздействию летрозола. Таким образом, на данный момент нет сведений о возможном тератогенном влиянии ИА.
Важным вопросом является безопасность использования ИА и гонадотропинов для проведения стимуляции суперовуляции у больных раком молочной железы в отношении прогрессирования основного заболевания. В исследовании A. Amr и соавт. [16], включающем 215 женщин репродуктивного возраста, показано, что использование данной схемы стимуляции с целью сохранения генетического материала не приводит к увеличению частоты рецидива заболевания. Однако, учитывая довольно короткий период наблюдения (в среднем 2 года) и небольшое число больных, окончательные выводы можно будет сделать лишь после накопления фактических данных и клинического опыта.
В заключение следует отметить, что сохранение генетического материала у молодых пациенток перед проведением гонадотоксичного лечения входит в клинические рекомендации многих стран мира. Использование ИА в протоколах стимуляции позволяет проводить забор достаточного числа ооцитов хорошего качества и в то же время снизить возможное неблагоприятное воздействие на организм женщины высокого уровня эстрогенов.
Клиника репродукции человека Альтравита ООО «ЭКО центр», Москва, Россия
Клиника репродукции человека «АльтраВита», ООО «ЭКО ЦЕНТР», Москва, Россия, 117186
Клиника "Альтра Вита", Москва, Российская Федерация
Летрозол в индукции овуляции (обзор литературы)
Журнал: Проблемы репродукции. 2016;22(6): 51‑57
Как потенциальные препараты для восстановления фертильности, ингибиторы ароматазы (ИА) были впервые введены в медицинскую практику более 15 лет назад. Проведено большое количество исследований с использованием летрозола для индукции овуляции: у женщин с синдромом поликистозных яичников, у кломифенцитрат (КЦ) резистентных женщин, при проведении внутриматочной инсеминации, а также в различных протоколах мягкой стимуляции при оплодотворении in vitro (IVF). Летрозол является многообещающим препаратом для лечения бесплодия в связи с возможностью его перорального приема, невысокой стоимостью, более коротким периодом полувыведения, чем у КЦ, и минимальным количеством побочных эффектов. Однако окончательное решение относительно эффективности и безопасности применения летрозола все еще отсутствует. Чтобы установить истинный потенциал этого препарата как средства для лечения бесплодия, необходимо проведение большего количества рандомизированных исследований. В настоящей статье приведен обзор научных данных, касающийся практики применения летрозола как индуктора овуляции.
Летрозол — мощный обратимый оральный ингибитор ароматазы (ИА) третьего поколения, является широко используемым препаратом для лечения женщин в постменопаузе с метастатическим раком молочной железы [1]. Такое лечение, обычно проводящееся в дозе 2,5—5,0 мг/сут, позволяет достигнуть оптимального подавления уровня эстрогенов в сыворотке крови и почти лишено побочных симптомов [1, 2]. Свойство летрозола эффективно снижать уровень эстрогенов может быть использовано, чтобы временно нивелировать действие эстрогенов по механизму отрицательной обратной связи на гипоталамус и таким образом стимулировать секрецию фолликулостимулирующего гормона (ФСГ) [3]. При пероральном приеме в дозах 1—5 мг/сут летрозол и анастрозол снижают уровень эстрогенов на 97—99% [4]. За счет существенного уменьшения уровня циркулирующих в периферической крови эстрогенов ИА являются многообещающим средством терапии не только эстрогензависимых заболеваний, но также использование их в ранней фолликулярной фазе менструального цикла позволяет повысить выброс гипофизарных гонадотропных гормонов, приводя к росту фолликулов и овуляции у инфертильных пациенток. Хотя использование летрозола как индуктора овуляции широко распространено, оно все еще остается «off label».
Цель настоящего обзора — оценка результатов использования ИА летрозола как препарата для индукции овуляции.
Летрозол или кломифенцитрат? Что выбрать?
Достаточно долго кломифенцитрат (КЦ) использовался как препарат первой линии выбора для лечения пациенток с синдромом поликистозных яичников (СПКЯ). Главные недостатки применения КЦ заключаются в том, что: КЦ блокирует эстрогеновые рецепторы (ER) во всем организме, снижая при этом рецептивность эндометрия, имеет длительный период полувыведения и обладает кумулятивным свойством [5—7].
Альтернатива для КЦ как индуктора овуляции была найдена в 1990-х годах. R. Casper и M. Mitwally [3, 8] впервые заявили о концепции использования ИА для индукции овуляции.
Блокирование ИА преобразования андрогенов в эстрогены приводит к двум следствиям: уменьшению уровня циркулирующих и локально действующих эстрогенов и повышению уровня внутриовариальных андрогенов. Снижение уровня эстрогенов снимает блок отрицательной обратной связи эстрогенов в гипоталамо-гипофизарной системе. Таким образом, повышается инкреция ФСГ, что приводит к росту фолликулов. Поэтому механизм отрицательной обратной связи остается интактным, происходит нормальный рост фолликулов, выбор доминантного фолликула, атрезия меньших по размеру фолликулов, что приводит в конечном счете к монофолликулярному росту и овуляции [9—12].
Другой вероятный механизм действия ИА на рост фолликулов — увеличение уровня внутриовариальных андрогенов. Это, по всей видимости, увеличивает чувствительность фолликулов к действию ФСГ. Недавние исследования показали значительную роль андрогенов в развитии событий раннего фолликулогенеза [9, 13, 14]. Андрогены увеличивают количество рецепторов к ФСГ и стимулируют выработку инсулиноподобного фактора роста (IGF-I), а ФСГ и IGF-I действуют как синергисты, способствуя росту фолликулов.
Таким образом, суммируя, ИА имеют следующие преимущества перед КЦ: не блокируют ER в организме; сохраняют гипоталамо-гипофизарную дугу интактной; имеют короткий период действия (период полувыведения ≈45 ч). Такая фармакодинамика летрозола способствует увеличению толщины эндометрия, качеству цервикальной слизи, монофолликулярному росту и лучшему фолликулогенезу. Поэтому эти факторы могут привести к более высокому проценту беременности и большей вероятности одноплодной беременности [15]. Хотя летрозол и создает дефицитную по эстрогенам среду, факт этого не имеет никакого отрицательного влияния на эндометрий и шейку матки из-за короткого периода полувыведения препарата [16].
ИА в лечении бесплодия
ИА и, главным образом, летрозол открывают новые перспективы в индукции овуляции у женщин с ановуляторным бесплодием. Они оказались полезными в терапии бесплодия неясного генеза и у женщин с низким овариальным резервом. Кроме того, обсуждается эффективность применения ИА для контроля за овариальной гиперстимуляцией и в лечении бесплодия, осложненного эндометриозом.
Летрозол, как индуктор овуляции, наиболее часто используется в трех ситуациях: индукция овуляции при СПКЯ; индукция овуляции при проведении внутриматочной инсеминации (ВМИ); овариальная стимуляция для проведения IVF/ICSI.
Индукция овуляции при синдроме поликистозных яичников
Недавние исследования показали, что у пациенток с СПКЯ летрозол не обладал неблагоприятным антиэстрогенным свойством кломифена и приводил к более высокому проценту беременности, чем при лечении КЦ [3, 18]. Несмотря на то что еще ожидаются результаты обширных исследований, получены обнадеживающие результаты успешного применения летрозола в предварительных исследованиях, показывающих, что он может быть хорошей альтернативой КЦ в лечении ановуляторного бесплодия [18—20].
Эффективность летрозола сравнима с таковой при использовании рекомбинантного ФСГ для стимуляции овуляции у женщин с СПКЯ, и, как было найдено, летрозол был подходящим и экономически рентабельным лекарственным средством для стимуляции [21].
Результаты отдельных рандомизированных контролируемых исследований [16, 18, 22—25] по изучению эффективности применения летрозола и КЦ свидетельствуют о том, что в целом у женщин с СПКЯ, резистентных и не резистентных к терапии КЦ, получены гораздо лучшие результаты при терапии летрозолом, чем при лечении КЦ, по частоте спонтанных овуляций (p<0,0001). Не отмечено статистического различия между ними по проценту женщин с овуляторными циклами (p<0,37), по кумулятивной частоте наступления беременности, частоте потери беременности, проценту живорождений или проценту многоплодных беременностей.
В рандомизированном контролируемом исследовании A. Hashim и соавт. [26], в котором сравнивалась эффективность терапии летрозолом и КЦ + метформин у 250 КЦ-резистентных женщин с СПКЯ, не было статистических различий между этими двумя группами по частоте овуляции, наступлению беременности на цикл, проценту прерываний беременности, частоте наступления многоплодной беременности.
S. Franik и соавт. [27] сообщили об отсутствии различий в эффективности между терапией летрозолом и лапароскопической каутеризацией яичников. В течение более чем 6 мес не было выявлено никаких различий между двумя группами по всем показателям, кроме частоты овуляторных циклов [28, 29].
В исследованиях M. Abdellah и соавт. [29] летрозол показал себя лучше, чем лапароскопическая каутеризация яичников, в течение шести циклов по количеству овуляций, но не было найдено различий по проценту беременности. После применения лапароскопическкой каутеризации яичников наблюдался послеоперационный спаечный процесс и имелись проблемы, связанные с долгосрочной функцией яичников [30].
Пока не сообщалось о дальнейших углубленных исследованиях, однако имеются доказательства, позволяющие рекомендовать использовать летрозол после проведения процедуры лапароскопической каутеризации яичников [31].
Летрозол как индуктор овуляции при внутриматочной инсеминации
Летрозол также использовался для индукции овуляции или контролируемой овариальной стимуляции при проведении ВМИ. Показаниями для проведения ВМИ могли быть идиопатическое бесплодие, умеренный эндометриоз и мужской фактор. Первое преимущество ИА — уменьшение количества требующихся гонадотропинов и снижение рисков возникновения многоплодной беременности. A. Hashim и соавт. [32] провели исследование, в котором 136 женщин, предварительно прошедших хирургическое лечение минимального и умеренного эндометриоза, были разделены на две группы — получающих КЦ или летрозол, с последующей ВМИ. Авторы не обнаружили статистических различий по частоте наступления клинической беременности на цикл, частоте кумулятивной беременности, потери беременности или проценту живорождений. А. Badawy и соавт.[33] разделили 280 женщин с бесплодием неясного генеза на две группы: получавшие КЦ (100 мг/сут) или летрозол (5 мг/сут) в сочетании с терапией гонадотропинами и последующим проведением ВМИ. В обеих группах получены сопоставимые результаты, но выявить преимущество использования летрозола по отношению к КЦ не удалось.
За минувшие 15 лет опубликовано около 20 подобных работ. Почти во всех исследованиях получены сходные результаты для КЦ и летрозола.
Летрозол в овариальной стимуляции при проведении IVF/ICSI
Летрозол также был использован для проведения овариальной стимуляции в рамках программы ВРТ. В протоколах с использованием «мягкого» стимулирования в циклах IVF с целью улучшения процента имплантации летрозол является многообещающим препаратом. Он имеет два потенциально возможных пути использования в циклах IVF: 1) в фолликулярной фазе, обычно совместно с ФСГ/чМГ, для индукции овуляции (5,0 мг летрозола ежедневно с 3-го по 7-й день менструального цикла); 2) в лютеиновой фазе стимулируемого цикла IVF (2,5—5 мг летрозола однократно после проведения процедуры пункции фолликулов) с целью снижения уровня циркулирующих эстрогенов, таким образом, потенциально снижая риск развития синдрома гиперстимуляции яичников (СГЯ) [34, 35].
По этой тематике было проведено 7 рандомизированных контролируемых исследований с использованием летрозола в циклах овариальной стимуляции у пациенток, проходящих процедуры IVF или ICSI [36—42]. В 2 исследованиях [36, 37] использовали летрозол у пациенток с нормальным овариальным ответом, проходящих процедуры IVF/ICSI. В группах, где совместно с гонадотропными гормонами (рФСГ, чМГ) применялся летрозол, обнаружен более высокий процент имплантации и процент развивающейся беременности, однако результаты не были статистически достоверными. Также выявлено существенное увеличение толщины эндометрия у пациенток, использовавших летрозол.
В 5 рандомизированных исследованиях оценивалось действие летрозола у 265 пациенток с низким овариальным ответом [38—42]. Пациентки были разделены на две группы: в одной группе пациентки получали летрозол совместно с гонадотропинами, в другой — только гонадотропины в протоколах с использованием агонистов или антагонистов ГнРГ. Во всех исследованиях используемая доза гонадотропинов была существенно ниже в группе летрозола. В 2 исследованиях, в которых использовались антагонисты ГнРГ, у пациенток, принимавших летрозол, отмечались сопоставимые результаты по частоте наступления беременности [39, 40].
Летрозол как агент для сохранения фертильности у больных раком
Надо отметить, что летрозол является одним из немногих безопасных препаратов для индукции овуляции, которые могут использоваться у больных раком, проходящих процедуру овариальной стимуляции перед проведением химиотерапии, с целью сохранения фертильности, путем криоконсервации ооцитов или эмбрионов [43]. Положительные результаты при применении летрозола, о которых было сообщено это: значительно более низкий фон эстрогенов, сниженные дозы триггера (агонистов ГнРГ) и отсутствие увеличения риска рецидива рака [44—46].
Безопасность применения
Применение ИА в качестве индукторов овуляции рассматривается как «off-label». Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) внесло данные препараты в категорию D при беременности.
Беспокойство относительно инцидентов возникновения врожденных аномалий при использовании летрозола было опровергнуто данными исследований T. Tulandi и соавт. [48], согласно которым не наблюдалось никаких различий в частоте встречаемости малых и больших пороков развития при терапии летрозолом и К.Ц. Кроме того, было показано, что врожденные пороки сердца встречаются реже в группе летрозола.
Поскольку период полувыведения летрозола короче чем у КЦ, летрозол полностью элиминируется из организма женщины до момента имплантации эмбриона, предотвращая таким образом тератогенный эффект, который мог бы возникнуть при индукции овуляции [49]. Полное выведение летрозола из организма происходит приблизительно через 10—12 дней после приема последней дозы.
В целом вопрос относительно безопасности применения летрозола все еще не решен. Имеющиеся данные указывают на одинаковые или более высокие риски при использовании КЦ, хотя КЦ используется в медицинской практике уже в течение более 40 лет.
В настоящее время проводятся два больших рандомизированных мультицентровых исследования с использованием КЦ и летрозола при индукции овуляции, результаты которых с нетерпением ожидаются [15, 50].
ИА — хорошо переносящиеся пациентами препараты с минимальным побочным действием. Первичные негативные эффекты включают признаки менопаузы (сухость влагалища, сексуальная дисфункция), желудочно-кишечные расстройства и воздействие на скелетно-мышечную систему, включая деминерализацию костей с высоким риском развития остеопороза и переломов, артралгий и миалгий [51]. Использование И.А. является фактором риска развития остеопороза [52]. Все пациенты, получающие ИА, должны дополнительно принимать витамин D и источники кальция. В отличие от тамоксифена, ИА не увеличивают риск развития рака эндометрия, тромбоэмболии и цереброваскулярных осложнений [53].
В настоящее время имеющиеся медицинские данные свидетельствуют, что летрозол, по крайней мере, столь же эффективен в применении по показателям овуляции и проценту беременности, как и КЦ, у женщин с резистентностью к действию или неудачному применению К.Ц. Дети, рожденные этими женщинами, не имеют повышенных рисков врожденных аномалий, общих или специфических [17]. И все же пока ни в одной стране мира летрозол не является одобренным препаратом для индукции овуляции. Его использование как индуктора овуляции является главным образом «off label».
Трудности в применении ИА как индукторов овуляции
Относительно применения ИА для стимуляции овуляции имеется несколько вопросов, которые требуют своего решения.
Во-первых, оптимальная доза ИА до сих пор не найдена. В рандомизированных исследованиях, сравнивающих эффективность КЦ и летрозола у женщин с идиопатическим бесплодием, использование летрозола в более высокой дозе (7,5 мг/сут) по сравнению с более низкой дозой (2,5 мг/сут) было выгоднее. Возможно, что этот феномен является случайной ошибкой выборки, и никакого эффекта дозы не существует. Однако недавнее предварительное рандомизированное исследование, сравнивающее эффективность применения двух ежедневных дозировок летрозола (2,5 и 5,0 мг) у женщин с бесплодием неясного генеза, показало обратное [54]. Число фолликулов в день введения хорионического гонадотропина было значительно выше у пациенток, которые применяли более высокие дозы. Кроме того, процент клинической беременности был значительно выше в группе с более высокой дозой [22, 55]. Для получения достоверных результатов проблема оптимальной дозы ИА должна быть разрешена путем проведения исследований ответа на различные дозы с достаточным количеством пациентов в группах. Дозы, которые в настоящее время используют для стимуляции роста фолликулов, получены исходя из доз терапии женщин с раком молочной железы в период постменопаузы. В исследованиях по применению анастрозола у женщин в период предклимакса был получен очевидный эффект ответа на дозу по числу растущих фолликулов, и самое большое число фолликулов наблюдали в группе с самой высокой дозировкой препарата [56].
Вторым вопросом является кратность приема препарата. Не ясно, необходимо ли ИА принимать ежедневно на протяжении 5 дней (как применяется КЦ) или достаточно однократной дозы. Применение единственной дозы на 3-й день МЦ обосновано коротким периодом полувыведения летрозола. Найдено, что препарат в единственной дозе 20 мг действует приблизительно 5 дней с полной элиминацией из организма на 13-й день, т. е. ко времени, когда предположительно происходит овуляция [57]. В исследовании у женщин с неясным бесплодием, где сравнивали единственную дозу (20 мг) летрозола, которую давали на 3-й день МЦ (как монотерапия, так и совместно с ФСГ с 7-го дня в дозе 50—150 МЕ/сут), с режимом многократного ежедневного приема летрозола в дозе 2,5 мг/сут с 3-го по 7-й день (как монотерапия, так и совместно с ФСГ) не было получено никаких существенных различий между приемом единственной дозы и режимом многократного дозирования по таким показателям, как толщина эндометрия, уровень эстрадиола, число фолликулов и частота наступления клинической беременности в группах, где использовалась как монотерапия летрозолом, так и совместно с ФСГ. Это исследование показало, что режим с применением единственной дозы мог бы рассматриваться как альтернатива режиму многократного ежедневного приема.
Заключение
Летрозол и другие ИА уже хорошо зарекомендовали себя как препараты для лечения рака молочной железы, различных эстрогензависимых гинекологических заболеваний, препаратов коррекции гормонального статуса и фертильности у мужчин. Однако нехватка опыта применения и имеющиеся побочные эффекты являются ограничивающими факторами в использовании этих препаратов для лечения бесплодия.
Доступные данные показывают, что летрозол, по крайней мере, столь же эффективен (а вероятнее всего, более эффективен), как и КЦ, для индукции овуляции и имеет сходный процент живорождения. Также важно, что он имеет определенные преимущества перед К.Ц. Многочисленные исследования показали, что летрозол может быть столь же эффективным, как и гонадотропины, обладая такими преимуществами, как низкая стоимость и низкий процент возникновения многоплодной беременности.
Нет сомнения, что вопрос потенциальных тератогенных эффектов летрозола нуждается в дальнейшем решении с проведением крупномасштабных исследований.
ИА, и в частности летрозол, заслуживают справедливого внимания и оценки, по крайней мере, быть доступными в исследовательском контексте для сбора объективных данных относительно их эффективности и безопасности.
Читайте также:
