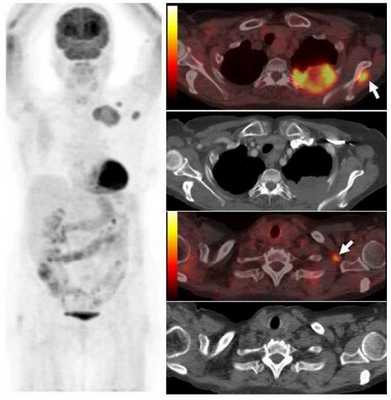
Пример ПЭТ/КТ при опухоли органа средостения - пищевода
Добавил пользователь Валентин П. Обновлено: 28.01.2026
Рак легкого является ведущей причиной смерти от рака во всем мире и обусловливает 1,59 миллионов смертей в год. Несмотря на прогресс, достигнутый в лечении пациентов, страдающих этой болезнью, пятилетняя выживаемость все еще остается невысокой, составляя приблизительно 15-16%. Основным фактором риска развития рака является табакокурение, повышающим вероятность его возникновения более чем в десять раз по сравнению с некурящими людьми. Другими состояниями, при которых повышен развития новообразования, являются идиопатический легочный фиброз и воздействие канцерогенов, например, асбеста.
Правильное определение стадии является крайне важным и необходимым моментом, позволяющим правильно спланировать лечение и оценить выживаемость. У больных раком легких является методом выбора при определении стадии опухоли, более эффективным, чем другие лучевые методы, такие как КТ или рентгенография. Благодаря возможности одновременной оценки анатомических и функциональных изменений, ПЭТ-КТ позволяет добиться большей точности по сравнению с ПЭТ и КТ в отдельности.
Этот метод диагностики позволяет более четко определить первичную опухоль, отличить опухолевую ткань от участков ателектаза и фиброзных изменений, расположенных рядом. Доказана высокая эффективность в оценке состояния лимфоузлов, а также обнаружения отдаленных метастазов. Также была подтверждена ценность этого метода как инструмента прогнозирования выживаемости путем оценки метаболизма в опухоли при первичном исследовании и в определении раннего (промежуточного) и завершающего ответа на химиотерапию. В последних литературных источниках этот метод был упомянут как рекомендуемый с экономической точки зрения.
Что такое ПЭТ-КТ?
Стадии рака легкого
В первичном обследовании пациента, страдающего раком легкого, должны принимать участие несколько специалистов: опытный рентгенолог, специалист по ядерной медицине (радионуклидным методам — сцинтиграфии и ПЭТ), рентгенохирург (специалист в области интервенционной радиологии), пульмонолог, торакальный хирург; необходимо также использовать точные и экономически эффективные методы диагностики. Существующие на данный момент руководства содержат рекомендации, что методы нужно выполнять любому пациенту, у которого имеется высокий риск рака, предпочтительно с выполнением гистологического исследования и взятием образцов ткани. Это позволяет не только установить точный гистологический вариант опухоли, но и правильно стадировать заболевание. Во многих случаях предпочтительнее выполнить биопсию подозрительных лимфоузлов средостения, а не первичной опухоли, что позволяет лучше оценить стадию (например, при биопсии лимофузла с выполнением ПЭТ ставится стадия T2N2, в то время как без ее использования - T2Nx). Кроме того, для опухолей, осложненных обструктивной пневмонией, и образований с выраженными некротическими изменениями, данные играют важную роль для определения области биопсии.
Опухоль левого легкого с частичным некрозом и деструкцией ребер. Визуализируются два метастаза в подключичных лимфоузлах и в мышцах (стрелки), которые на КТ не видны. Необходимо выполнить трансторакальную биопсию той части опухоли, которая расположена в периферических отделах, чтобы получить образец жизнеспособных тканей.
Варианты рака легкого
Остальные 10-15% случаев обусловлены мелкоклеточным раком, биологически более агрессивным, при котором стадирование, лечение и прогноз отличаются от таковых при немелкоклеточном раке. Этот тип рака очень тесно связан с курением. Выделяют две стадии заболевания: ограниченную, при которой опухоль располагается в половине грудной клетки на стороне поражения, в том числе в средостении и ипсилатеральной надключичной области; и распространенную, когда опухоль распространяется за пределы одной половины грудной клетки. Поскольку мелкоклеточный рак легочной ткани в корне отличается от немелкоклеточного, его диагностика при помощи будет обсуждаться в специально отведенной главе в конце этой статьи.
Визуализация первичной опухоли: Т-стадия
С помощью КТ можно достоверно оценить размер опухоли практически во всех случаях. Тем не менее, при наличии обусловленных опухолью осложнений, например, ателектаза легкого или обструктивной пневмонии, истинный размер первичной опухоли оценить сложнее. Позволяет отличить паренхиму спавшегося участка легочной ткани от злокачественной опухоли, т. к. опухоль характеризуется интенсивным захватом ФДГ, а спавшееся легкое — нет. Также он помогает оценить опухолевую инвазию (прорастание) в плевру и средостение. Накопление плеврой ФДГ всегда является патологическим, и при наличии новообразования органов дыхания крайне подозрительно на метастатическое поражение. При прорастании опухоли в средостение необходимо выполнять КТ с внутривенным введением йодсодержащего контрастного вещества с целью определения взаимоотношения опухоли, крупных кровеносных сосудов и перикарда.
Интенсивный захват ФДГ первичной опухолью обусловлен ее биологическим типом и степенью «агрессивности» опухолевых клеток; повышенный захват ФДГ может становиться прогностическим фактором рецидива. В исследовании Kim et al. была продемонстрирована группа пациентов, подвергшихся оперативному вмешательству по поводу новообразований легких, у которых при патологическом исследовании была установлена стадия N0. У пациентов, у которых возник рецидив опухоли, максимальный стандартизированный уровень накопления (SUV max) первичной опухолью легкого был выше, чем у пациентов, у которых рецидива не было. Пороговое значение SUV max, отделяющее пациентов с высоким уровнем рецидива, было определено равным 6,9. Было также сделано заключение, что для пациентов высокой группы риска по развитию рецидива предпочтительна изначально более «агрессивная» терапия. Таким образом, помогает точно спрогнозировать, как будет вести себя опухоль после лечения.
ПЭТ-КТ лимфоузлов: N-стадия
С помощью ПЭТ можно обнаружить метастатическое поражение лимфоузлов корней легких и средостения лучше, чем с помощью любого другого метода, так как метаболически активные лимфоузлы при ПЭТ-КТ, даже малого размера, характеризуются повышенным захватом ФДГ. Это справедливо и для тех случаев, когда морфологические признаки злокачественного поражения узлов могут не обнаруживаться на КТ-изображениях. Также метод позволяет оценить увеличенные лимфоузлы, не накапливающие или минимально накапливающие радиофармпрепарат, которые часто носят реактивный характер или отражают остаточные изменения в отсутствие опухолевого поражения. При определении стадии N чувствительность составляет 81% против 61% у КТ, и специфичность 90%, в то время как КТ характеризуется специфичностью 79%.
Наибольшее преимущество в оценке средостения — это возможность исключить злокачественное поражение любого лимфоузла с высокой степенью точности. То есть, отсутствие интенсивного захвата ФДГ лимфоузлом достоверно говорит об истинном отсутствии метастазов (прогностическое значение отрицательного результата равно 99%). В то же время не все лимфоузлы средостения, характеризующиеся повышенным метаболизмом, обязательно являются злокачественными; ложноположительный результат может быть обусловлен воспалительными изменениями. Это объясняет, почему изменения со стороны средостения должны оцениваться количественно с использованием SUV (стандартизированного уровня накопления). Пороговое значение SUV max в пределах 4,0-5,3 позволяет рассматривать изменения со стороны лимфоузлов средостения как положительные (то есть, метастатическое поражение есть).
Лучшее картирование лимфоузлов средостения позволяет избежать медиастиноскопии, ограничившись трансбронхиальной игольной аспирацией под контролем УЗИ, особенно в труднодоступных областях, таких как аортопульмональное окно или область, находящаяся позади бифуркации трахеи.
Особенное значение в стадировании поражения лимфатических узлов имеет на ранних стадиях заболевания (I и II), что позволяет избежать ненужной торакотомии.
Оценка метастазов: M-стадия
У 40-50% пациентов, страдающих раком органов дыхания, в момент установления диагноза присутствуют метастазы. Наличие отдаленных метастазов в корне меняет план лечения этих пациентов, делая оперативное вмешательство намного более сложным, что приводит к гораздо более неблагоприятному прогнозу. ПЭТ-КТ имеет неоспоримые преимущества в диагностике метастазов по сравнению с традиционными методами исследования, особенно в случаях одновременного метастатического поражения множества органов, часто без какой-то определенной локализации вследствие диссеминации процесса. Повышенное накопление ФДГ в метастазах рака легкого и возможность исследования всего тела делают методом выбора при выявлении метастазов (вне головного мозга). Также метод позволяет выявить отдаленные метастазы, о которых до проведения исследования ничего не было известно, вплоть до 30% всех случаев.
Самые частые вторичные изменения при раке легкого - метастазы в кости, которые имеют место у 8-27% пациентов на момент установления диагноза. Вторичные изменения костей лучше обнаруживаются при помощи ПЭТ, чем при использовании других методов диагностики. Так, больше чем в половине случаев костных метастазов поражается только костный мозг и не происходит существенного нарушения костной структуры, из-за чего при помощи рентгенографии и КТ их не удается обнаружить, и даже сцинтиграфия скелета с использованием метилендифосфоната Tc-99m оказывается малоспецифичной при обнаружении этого типа поражений. Метастазы в кости могут иметь исключительно литический характер и интенсивно накапливать ФДГ, но в то же время гиперфиксация препарата в очагах поражения может и не определяться.
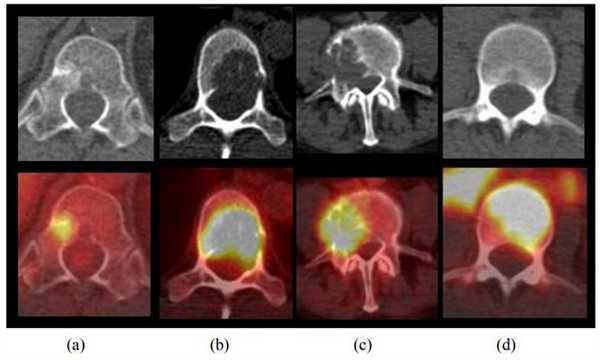
Типы метастазов в кости при раке легкого. (a) Остеобластический. (b) Остеолитический. (c) Смешанный. (d) Поражение костного мозга.
У пациентов, страдающих раком легкого, часто возникают метастазы в органы брюшной полости. Чаще всего поражаются печень и надпочечники. Поскольку также могут встречаться доброкачественные изменения печени и надпочечников, необходимо использовать диагностические методы, позволяющие распознать их и отличить от метастазов. В случаях изменений со стороны надпочечников, умеренное или выраженное накопление ФДГ обладает высокой прогностической ценностью положительного результата для метастазов. Чувствительность и специфичность ПЭТ с использованием SUV (стандартизированного уровня накопления) в целом в популяции составляет 87% и 87%, в то время как у пациентов с раком легкого 94% и 82% соответственно. Лучшим пороговым значением SUV max, позволяющим дифференцировать злокачественные и доброкачественные поражения, по-видимому, является 2,5.
В случаях метастазов в печень, практически все доброкачественные поражения (кисты, гемангиомы, фокальная нодулярная гиперплазия) характеризуются меньшим или идентичным по сравнению с паренхимой печени уровнем накопления ФДГ. Любой узел, любые объемные образования, накапливающие ФДГ интенсивнее, чем нормальная паренхима печени, крайне подозрительны на злокачественные изменения.
Метастазы в печени при аденокарциноме правого легкого. Определяется один метастаз в печени, который не виден на КТ с контрастным усилением.
Для обнаружения метастазов в надпочечники, почки и кости, в случаях, когда невозможно проведение, приемлемой альтернативой является МРТ всего тела с выполнением программы DWI. Позволяет оценить метастазы в областях, изменения в которых не стадируются при традиционных методах диагностики, например, в коже, скелетных мышцах, мягких тканях, поджелудочной железе, почках.
Второе мнение по ПЭТ-КТ
Необходимым условием достоверного определения стадии злокачественного новообразования является правильная оценка результатов ПЭТ-исследования. При неоднозначных или противоречивых результатах рекомендуется получить второе мнение специализированного радиолога. Повторный экспертный анализ исследования в профильном центре позволяет избежать ошибки интерпретации снимков, сделать более обоснованные выводы о стадии процесса, наличии или отсутствии метастазов, вторичных очагов в лимфатических узлов. Это исключительно важно и планировании тактики операции, химио- и лучевого лечения.
Стадирование метастазов в головной мозг
Даже несмотря на то, что вторичные изменения головного мозга не так часто встречаются у пациентов с раковыми опухолями легких, они имеют большое значение, поскольку их наличие приводит к высокому уровню заболеваемости и смертности, чего в некоторых случаях можно избежать или минимизировать путем подбора соответствующего лечения. Поскольку головной мозг характеризуется высоким базовым метаболизмом глюкозы, вторичные очаги в нем могут быть замаскированы, а чувствительность ПЭТ-исследования в обнаружении метастазов - ограничена. В связи с этим, в соответствии с существующими на данный момент протоколами рекомендуется дополнительное использование МРТ. В случаях, когда провести МРТ невозможно, можно сделать КТ с внутривенным контрастным усилением. Это дает схожие результаты с МРТ головного мозга.
Одновременное присутствие легочной и внелегочной опухоли
У 1-8% пациентов, страдающих раком легкого, на момент установления диагноза обнаруживается рак иной локализации. Большинство этих новообразований также тесно связаны с табакокурением. И, действительно, у 6,5% хронических курильщиков, которым была выставлена та или иная стадия рака любого типа, на момент установления диагноза обнаруживался одновременно существующий рак других органов и систем.
В случаях множественного рака используемые диагностические критерии являются следующими:
- Оба очага гистологически различны.
- Гистологический тип один и тот же, но нет поражения лимфоузлов и экстраторакальных метастазов.
На основании этих критериев, частота синхронного множественного рака легкого, описанная в литературе, составляет 0,5-3,3%. Наиболее часто одновременно существующие раковые опухоли, обнаруживаемые у пациентов, страдающих раком легкого, располагается в молочных железах, в голове и шее, пищеводе и щитовидной железе. Более чем 80% этих синхронных поражений обнаруживаются на ранней стадии, что предполагает возможность лечения, устраняющего причину заболевания. Тем не менее, возможность лечения в значительной степени зависит от того, насколько далеко зашла раковая опухоль на момент установления диагноза.
ПЭТ-КТ: планирование лучевой терапии
Возможность ПЭТ различить метаболически активную ткань опухоли от ателектаза, обструктивной пневмонии или фиброзных изменений имеет решающее значение в определении объема опухоли. Это очень полезно при планировании лучевой терапии, так как позволяет скорректировать форму и размер облучаемого объема тканей и уменьшить степень облучения непораженных опухолью органов (например, пищевода, сердца, спинного мозга), находящихся вблизи опухоли. Кроме того, использование ПЭТ значительно изменяет поле облучения по сравнению с КТ. Так, использование ПЭТ в дополнение к традиционным методам диагностики приводило к изменению объема облучаемых тканей более чем у 20% пациентов, и изменение стадии происходило в 20-50% случаев. В различных источниках описывается, что изменения планируемого целевого объема достигают 50% у пациентов с немелкоклеточным раком.
Контроль лечения и прогноз рака легкого
Наиболее важный прогностический фактор опухоли, подвергаемой хирургическому лечению — это степень ее диссеминации на время установления диагноза. В случает отсутствия метастазов пятилетняя выживаемость равна 57-67%; в случае вторичного поражения лимфоузлов ворот легкого — 47% , при поражении лимфоузлов средостения на стороне, противоположной опухоли — 23%. Обнаружение отдаленных метастазов является одним из основных критериев невозможности удаления опухоли хирургическим путем. Ввиду важности изложенных фактов особое значение принимает второе мнение по ПЭТ.
Опухоли пищевода
Опухоли пищевода - доброкачественные и злокачественные новообразования, возникающие из различных слоев пищеводной стенки. Клинически проявляются нарушением глотания, рвотой и отрыжкой, болями и тяжестью за грудиной, ощущением комка в горле, кашлем, исхуданием, анемией. В диагностике используются рентгенография пищевода с контрастированием, эзофагоскопия, эндоскопическая биопсия, обзорная рентгенография органов грудной клетки, МРТ и КТ органов грудной клетки. Лечение доброкачественных опухолей пищевода только хирургическое, злокачественных - комплексное (оперативное, лучевая и полихимиотерапия).

Общие сведения
За термином «опухоли пищевода» практически всегда скрывается рак, так как доброкачественные новообразования этого органа встречаются чрезвычайно редко. В литературе по гастроэнтерологии описано примерно 400 случаев выявления доброкачественных опухолей пищевода, в подавляющем большинстве у мужчин в возрасте около 40 лет. Злокачественные новообразования встречаются намного чаще - рак пищевода занимает седьмое место среди всех опухолей, а по уровню смертности - третье (после онкологических заболеваний легких и желудка). Общая распространенность данного заболевания - 5-6%. Средний возраст выявления онкологии пищевода составляет 60-65 лет. Замечено, что в странах с высокой распространенностью эзофагеального рака имеется тенденция к омоложению этой патологии, выравниванию различий по полу (мужчины и женщины болеют одинаково часто). В последние десятилетия в России отмечается некоторое снижение заболеваемости новообразованиями пищевода.
Классификация опухолей пищевода
Все опухоли пищевода разделяют на две большие группы: доброкачественные (менее 1%) и злокачественные (более 99%). Доброкачественные опухоли классифицируют по гистологическому строению и характеру роста. Гистологически выделяют следующие виды доброкачественных опухолей пищевода: эпителиальные (полипы, аденомы, папилломы), неэпителиальные (липомы, фибромы, ангиомы, миомы, нейрофибромы, хондромы, миксомы и др.). Неэпителиальные опухоли встречаются гораздо чаще. По характеру роста опухоль пищевода может быть внутрипросветной и интрамуральной (внутристеночной).
Злокачественные опухоли пищевода классифицируют по гистологическому строению, расположению, распространенности процесса и т. д. В морфологическом плане выделяют эпителиальные злокачественные новообразования - плоскоклеточный ороговевающий и неороговевающий рак (более 95%), базальноклеточный, переходноклеточный, мукоэпидермоидный и анапластический рак, аденокарцинома (менее 5%); неэпителиальные - саркома, лимфома, меланома.
Классификация TNM систематизирует рак пищевода по следующим критериям:
1. Анатомическая область - шейный отдел пищевода, внутригрудной отдел (верхний, средний, нижний). Если опухоль поражает одновременно пищевод и желудок, то ее локализация определяется исходя из преимущественного поражения органа (более 50% образования находится в пищеводе или желудке). В случаях, когда новообразование равномерно распространяется в обе стороны, опухолью пищевода считают плоскоклеточный и мелкоклеточный рак, недифференцированные опухоли; опухолью желудка - аденокарциному и перстневидноклеточный рак.
2. Вовлечение в патологический процесс регионарных и отдаленных лимфоколлекторов.
3. Первичная опухоль - какие слои пищевода поражены, есть ли инвазия опухоли в соседние органы и ткани.
4. Степень дифференцировки - высокая, средняя, низкая, недифференцированная опухоль пищевода.
Доброкачественные опухоли пищевода
Симптомы доброкачественных опухолей пищевода
Доброкачественные опухоли пищевода встречаются достаточно редко и насчитывают не более 1% всех новообразований этого органа пищеварения. Львиная доля доброкачественных новообразований - это неэпителиальные опухоли, 70% из которых занимает лейомиома пищевода. Интрапросветные опухоли обычно представлены полипами эпителиального (железистые полипы, папилломы, аденомы) либо мезенхимального (фибромы, липомы, смешанные полипы) происхождения. В отдельную группу выделяют такие редко встречающиеся опухоли, как миксома, хондрома, гамартома, гемангиома.
Доброкачественные новообразования обнаруживаются во всех отделах пищевода. Обычно это одиночные опухоли на широкой ножке, имеющие гладкую или бугристую структуру. Учитывая достаточно медленный рост таких новообразований, клиническое течение часто бывает бессимптомным, а по достижению опухолью больших размеров появляются признаки непроходимости пищевода и сдавления органов средостения. Однако чаще всего доброкачественные опухоли пищевода являются случайной находкой во время обзорной рентгенографии органов брюшной полости.
Различные виды доброкачественных опухолей имеют определенные особенности клинической и рентгенологической картины. Так, полип пищевода может быть одиночным либо множественным, располагаться в любом отделе органа. Он явно выступает в просвет пищевода, имеет выраженную подвижность за счет широкого основания и ножки. Проявляется дисфагией, периодически возникающей в течение многих лет. Характерным признаком при рентгенологическом исследовании является смещаемый дефект наполнения барием с четкими и ровными контурами, сохраненная рельефность и перистальтика на уровне дефекта.
Папиллома обычно имеет большие размеры, чем полип, дольчатую или бородавчатую поверхность. Склонна к малигнизации. Лейомиомы являются наиболее распространенными опухолями пищевода. Располагаются в нижних и средних его отделах, интрамурально на широком основании. Течение обычно бессимптомное, первыми признаками являются изъязвление опухоли и кровотечение. Липомы встречаются очень редко, не имеют четких клинических отличий от других опухолей.
Диагностика и лечение доброкачественных опухолей пищевода
При проведении рентгенографии пищевода с контрастированием выявляются дефекты наполнения, деформация просвета пищеводной трубки, изменения рельефа слизистой. По рентгенологической картине можно выделить опухоли, полностью находящиеся в просвете органа; растущие как в просвет, так и интрамурально; распространяющиеся из внутренних слоев пищевода кнаружи и сдавливающие его извне. Отличием доброкачественных неэпителиальных опухолей от рака является сохраненный рельеф слизистой и эластичность стенок пищевода на уровне расположения новообразования. Диагноз подтверждается гистологически.
Дифференциальная диагностика проводится с такими заболеваниями, как инородное тело, варикозное расширение вен, злокачественные новообразования пищевода. Для установления правильного диагноза в условиях стационара проводится эзофагоскопия и хромоскопия пищевода, эндоскопическая биопсия тканей опухоли с последующим гистологическим исследованием, обзорная рентгенография грудной полости и рентгенография пищевода с контрастированием. При трудностях диагностики показано проведение магнитно-резонансной или компьютерной томографии органов грудной клетки.
Следует обращать внимание на такие неблагоприятные прогностические признаки, как быстрый рост опухоли, изъязвление, нетипичная форма опухолевого узла, изменение рельефа слизистой и эластичности стенок пищевода в месте локализации новообразования. Данные симптомы могут говорить о малигнизации доброкачественной опухоли и требуют от гастроэнтеролога обязательного назначения эзофагоскопии с биопсией.
Лечение только хирургическое, удаление доброкачественных опухолей пищевода может проводиться эндоскопическим либо полостным способом. В послеоперационном периоде назначается специальная диета, ингибиторы протонного насоса длительным курсом (в случае, если опухоль сопровождалась явлениями эзофагита, недостаточности кардии).
Злокачественные опухоли пищевода
Симптомы злокачественных опухолей пищевода
Злокачественные опухоли пищевода в подавляющем своем большинстве представлены раком. Это новообразование коварно тем, что выявляется обычно уже на поздних стадиях, в связи с чем доля операбельных опухолей составляет не более 30%, а летальность превышает 15%. Достаточно часто встречаются множественные злокачественные опухоли пищевода. По гистологической структуре чаще выявляется плоскоклеточный неороговевающий рак, реже базальноклеточный и ороговевающий, крайне редко - аденокарцинома и другие злокачественные новообразования. Чаще всего злокачественные новообразования локализуются в средней части пищевода, а расположение опухоли в дистальных отделах обычно связано с ее распространением из желудка. Растущая опухоль может поражать трахею, крупные артерии и вены, корень легкого, лимфатический проток, печень и диафрагму. Метастазы при раке пищевода выявляются в 60% случаев.
Злокачественные опухоли пищевода имеют характерную клинику: медленно прогрессирующая дисфагия, боль при глотании, отрыжка, слюнотечение. Часто отмечается отвращение к мясу. На поздних стадиях развиваются симптомы опухолевой интоксикации, гнойный медиастинит. Бессимптомное течение злокачественных новообразований возможно только на начальных этапах развития опухоли.
Саркома пищевода может происходить из соединительной, мышечной, сосудистой, нервной, пигментной тканей; также встречаются смешанные и дисэмбриопластические опухоли. Чаще всего диагностируются лейомиосаркомы. По характеру роста выделяют инфильтрирующие опухоли и полиповидные. Рентгенологические признаки сарком неспецифичны, напоминают доброкачественные опухоли. Отличительной чертой может служить множественность опухолевых узлов.
Злокачественные лимфомы пищевода обычно развиваются при генерализованных онкологических заболеваниях лимфатической ткани. Выделяют опухолевую, инфильтративную и комбинированную формы лимфом. Рентгенологически данные новообразования весьма схожи с эзофагеальным раком, отличает их менее выраженный стеноз пищевода, высокая частота изъязвлений с разрывом пищевода, формированием свищей. Также для лимфом характерно сохранение перистальтики пищеводной стенки над опухолью.
Диагностика и лечение злокачественных опухолей пищевода
Диагностирование злокачественных опухолей пищевода обычно включает в себя эзофагоскопию с биопсией, контрастную рентгенографию пищевода, МРТ и компьютерную томографию. Признаки, которые говорят в пользу злокачественного новообразования: нетипичное изменение рельефности слизистой; неравномерность контуров пищеводной стенки или дефект наполнения, сопровождающийся отсутствием перистальтики на этом уровне; неравномерность просвета пищевода, стеноз пищевода с расширением просвета над опухолевым узлом, подрытые контуры стенки пищевода на границе здоровой ткани и опухоли. Компьютерная томография позволяет с большой вероятностью определить возможности оперативного лечения, составить прогноз для выздоровления и жизни пациента.
Лечение злокачественных опухолей пищевода является весьма сложной задачей. Учитывая тип опухоли, стадию и распространенность процесса, может использоваться оперативное лечение (резекция, экстирпация пищевода с последующей эзофагопластикой), лучевая и полихимиотерапия в различных комбинациях. На поздних этапах заболевания терапия паллиативная (гастростомия).
Прогноз опухолей пищевода
При доброкачественных опухолях пищевода прогноз благоприятный, однако пациенты требуют пожизненного диспансерного наблюдения из-за высокой частоты рецидивов. При злокачественных новообразованиях прогноз зависит от сроков выявления и начала лечения опухоли. При наличии метастазов прогноз для выздоровления и жизни неблагоприятный. Специфической профилактики опухолей пищевода не существует.
Пример ПЭТ/КТ при опухоли органа средостения - пищевода
2. Гранов А.М. ПЭТ в онкологической клинике / А.М Гранов, Л.А. Тютин, Костеников // Материалы Х Российского онкологического конгресса. - 2006. - С.46-49.
3. Давыдов М.И. Актуальные вопросы лимфодиссекции у больных раком грудного отдела пищевода / М.И. Давыдов, И.С. Стилиди, Ж.А. Арзыкулов // Современная онкология. - 2000. - Т. 2, №1. - С.15-22.
4. Рязанов В.В., Шевкунов Л.Н. Возможности совмещенной позитронно-эмиссионной и компьютерной томографии в дифференциальной диагностике и стадировании первично выявленных образований пищевода и желудка / В.В. Рязанов, Л.Н. Шевкунов // Материалы Х Российского онкологического конгресса. - 2006. - С.212.
5. Синяков А.Г. Онкологическая ситуация в Тюменской области в 2005-2012 гг. и факторы влияющие на её улучшение / А.Г. Синяков, П.Б. Зотов, М.М. Наумов.// Тюменский медицинский журнал. - 2012. - № 4. - С. 5-8.
6. Труфанов Г.Е. Совмещенная позитронно-эмиссионная и компьютерная томография (ПЭТ-КТ) в онкологии / Г.Е. Труфанов, В.В. Рязанов, Н.М. Дергунова и др. - М.: ЭЛБИ-СПб, 2005. - С. 126.
7. Тюляндин С.А. Рациональная тактика лечения операбельного рака пищевода / С.А. Тюляндин // Материалы Х Российского онкологического конгресса. - М., 2006. - С.85-87.
8. Cerfolio R.J. Maximum standardized up take values on positron emission tomography of esophageal cancer predicts stage, tumor biology, and survival / R.J. Cerfolio, A.S. Bryant // AnnThoracSurg. - 2006, № 82. - Р.391-395.
9. Diagnostic and prognostic value of 18F-FDG PET/CT for patients with suspected recurrence from squamous cell carcinoma of the esophagus/ Guo H. et al. // J Nucl Med. - 2007, № 48. - Р.1251-1258.
12. Pantel K. Detection, clinical relevance and specific biological properties of disseminating tumour cells / K. Pantel, Brakenhoff R.H., B. Brandt // Nat Rev Cancer. - 2008. - № 8. - Р.329-340.
13. Rizk N. Preoperative 18[F]- fluorodeoxyglucose positron emission tomography standardized uptake values predict survival after esophageal adenocarcinoma resection / N. Rizk, R.J. Downey, T. Akhurst // Ann Thorac Surg. - 2006, № 81. - Р.1076-1081.
В настоящее время большинство онкобольных нуждаются в комбинированном лечении [1,3]. Объем оперативного вмешательства зависит от метастатического поражения лимфатического коллектора. Наблюдаемые у ряда больных неудачи побудили в последнее время шире прибегать к выбору тактики лечения в зависимости от оценки распространенности процесса [2,4]. Лимфогенное метастазирование является независимым значимым фактором прогноза, с учетом основных используемых классификаций Международного Противоракового Союза (2002). Происходит постоянная оптимизация методов для оценки распространения заболевания у пациентов с опухолями пищевода и желудка [7,8]. Основными факторами, влияющими на объём лимфогенного метастазирования, являются глубина инвазии опухолевого процесса, степень дифференцировки и размер первичной опухоли. Отмечено, что при наличии 3 и более пораженных лимфатических узлов прогноз существенно ухудшается [135]. При этом до настоящего времени не разработано достоверных методов визуализации поражения лимфатических узлов на дооперационном этапе [151]. На сегодняшний день комбинированный ПЭТ/КТ может быть наиболее эффективным методом для предоперационной постановки диагноза рака пищевода и рака желудка и определения оперативной тактики [10]. Метод ПЭТ позволяет изучать на молекулярном уровне биохимические процессы организма в томографическом режиме. В онкологической практике ПЭТ позволяет выявлять опухолевые очаги и количественно оценивать их активность. Принцип функциональной визуализации опухолей выгодно отличает ПЭТ от анатомо-топографических методов лучевой диагностики (ультразвуковой томографии, рентгеновской компьютерной и магнитно-резонансной томографии), которые оценивают динамику опухолевых субстратов по изменению их размеров и структуры. Специфичность ПЭТ заключается в возможности визуализации жизнеспособной опухолевой ткани и оценки ее биологической активности по степени интенсивности накопления в тканях метаболического радиофармпрепарата. Основным фактором, влияющим на повышенную аккумуляцию радиомодифицированной глюкозы в лимфатическом узле, является его поражение в результате метастазирования первичной опухоли [5,6,9].
Цель работы
Анализ поражения лимфатического коллектора у больных раком верхних отделов желудочно-кишечного тракта методом ПЭТ/КТ-сканирования.
Материалы и методы
В исследование были включены 26 больных, которым проведено комбинированное лечение по поводу рака желудка и пищевода. Эти пациенты проходили обследование на базе отделения радиоизотопной диагностики АО «Республиканского диагностического центра» г. Астана в период с 2010 по 2012 г. Локализация патологического процесса в пищеводе отмечена у 16 больных, в желудке - у 10 больных. При локализации патологического процесса в пищеводе возраст больных варьировал от 45 до 76 лет, средний возраст больных составил 63,1 года. При локализации патологического процесса в желудке возраст больных варьировал от 29 до 89 лет, средний возраст больных составил 56,3 года. Исследование проводилось после письменного согласие пациента на проведение исследования. Всем больным проведено ПЭТ/КТ исследование, позитронно-эмиссионный томограф, совмещенный с 16-срезовым компьютерным томографом GeminiGXL 16 фирмы Philips. При проведении ПЭТ/КТ исследования проводили сканирование всего тела (с головы до бедра), сканирование было начато через 40 минут после инъекции ФДГ с помощью метода одновременного излучения / передачи. При проведении ПЭТ/КТ использовался радиофармацевтический препарат «Фтордезоксиглюкоза, 18 F, раствор для внутривенного введения». Вводимая доза препарата зависела от площади поверхности тела исследуемого человека. Диагностическая доза препарата составляла 220 МБк на 1 м 2 поверхности тела пациента; как правило, использовали 300-550 МБк на одно исследование. Препарат вводился внутривенно медленно в объеме 5,0-10,0 мл. Рассчитывался коэффициенты SUVmax - максимального накопления радиофармпрепарата. Для статистического анализа применяли статистический пакет "Statistica" с применением описательной статистики, корреляции.
Результаты и их обсуждение
При анализе поражения лимфатического коллектора нами были установлены индивидуальные особенности лимфогенного метастазирования, которые определяются при проведении ПЭТ/КТ-сканирования. Среди 26 больных с выявленными метастазами в лимфатических узлах, при ПЭТ/КТ-исследовании у 16 больных опухоль имела локализацию в пищеводе, у 10 - в желудке.
При проведении позитронно-эмиссионной томографии, совмещенной с компьютерной томографией, у 16 больных раком пищевода выявлены 65 лимфатических узлов, пораженных метастазами. Распределение пораженных лимфатических узлов по локализации представлено в табл. 1.
Локализация лимфатических узлов, пораженных метастазами, у больных раком пищевода
Опухоли средостения
Опухоли средостения, или по-другому медиастинальные опухоли — это новообразования, которые берут свое начало из органов средостения. Средостение - это область, ограниченная легкими по бокам, грудиной спереди и позвоночником сзади. К органам средостения относятся сердце, аорта, пищевод, тимус, трахея, лимфатические узлы, сосуды и нервы.
Кто находится в «зоне риска»?
Медиастинальные опухоли встречаются достаточно редко. Они могут развиваться в любом возрасте и из любых органов и тканей, которые находятся в средостении, однако в большинстве случаев их диагностируют у пациентов от 30 до 50 лет. В детском возрасте чаще встречаются опухоли заднего средостения. Они обычно происходят из нервной ткани и, в большинстве случаев, не злокачественные. У взрослого населения преобладают опухоли переднего средостения - обычно там располагаются лимфомы и тимомы.
Классификация образований средостения
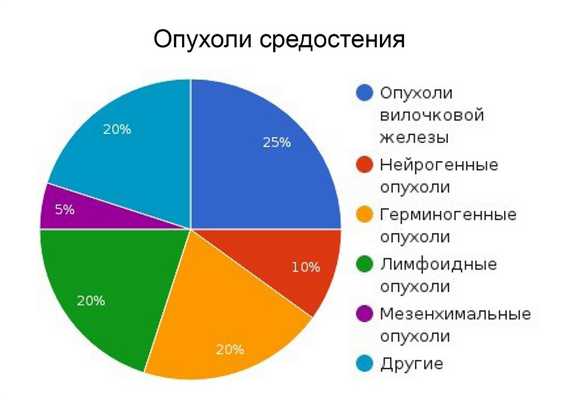
Средостение анатомически делится на 3 зоны. Соответственно этим зонам классифицируются и опухоли средостения.
- Опухоли переднего средостения: лимфома (Ходжкинская и неходжкинская), тимома. герминогенные опухоли, загрудинный зоб.
- Опухоли центрального средостения: бронхогенная киста, лимфаденопатия, киста перикарда, опухоли трахеи, опухоли пищевода, аномалии пищевода (ахалазия, грыжа, дивертикул).
- Заднее средостение: нейрогенные опухоли, лимфаденопатия, нейроэнтерические кисты.
Клиническая картина
Чаще всего опухоли средостения являются случайной находкой при рентгенологических исследованиях, так как до 40% опухолей клинически не проявляются. Клинические проявления опухоли средостения будут зависеть от следующих факторов:
- локализация и размеры опухоли;
- злокачественный или доброкачественный характер образования;
- темп роста.
В зависимости от вышеописанных факторов клиническая картина может быть различной. Самые частые симптомы можно разделить на две группы:
- Местные: кашель, кровохарканье, охриплость, одышка, затрудненное дыхание, боли в грудной клетке, гиперемия лица и верхней половины туловища, расширение вен лица, шеи, нарушения ритма.
- Общие: Лихорадка, озноб, ночная потливость, потеря веса.

Диагностика
Рентгенологический метод является основным для визуализации новообразования средостения. Компьютерная томография позволяет оценить локализацию опухоли и спланировать дальнейшее обследование.
Без гистологической верификации поставить окончательный диагноз невозможно. При вовлечении в процесс пищевода или трахеи выполняют эндоскопическое исследование для взятия биопсии и визуализации изменений.
При невозможности получить образец ткани для исследования эндоскопически применяются инвазивные методы: трансторакальная биопсия, медиастиноскопия, видеоторакосокпия. Последние два метода — это серьезные операции, которые проводятся в специализированных медицинских учреждениях.

Лечение
В связи с разнообразием возможных причин медиастинальные опухоли лечатся в зависимости от типа опухоли:
- Тимомы нуждаются в хирургическом лечении. При высокой степени злокачественности за хирургическим вмешательством следует лучевая терапия. Для удаления опухоли используются различные доступы: как минимально инвазивные и роботические операции, так и открытые «большие» операции (торакотомии и стернотомии).
- Лимфомы лечатся химиотерапией и лучевой терапией. Хирургия в данном случае применяется как диагностический метод, а не лечебный.
- Нейрогенные опухоли удаляются хирургическим методом.
- Некоторые опухоли, если они не проявляются клинически и являются доброкачественными, можно оставить под наблюдение.
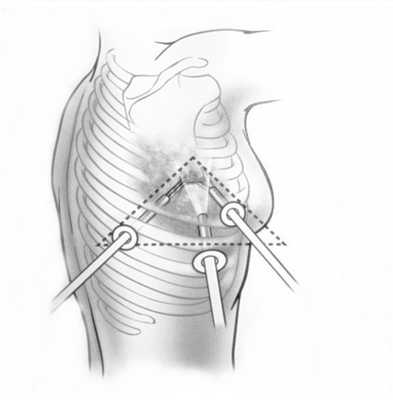
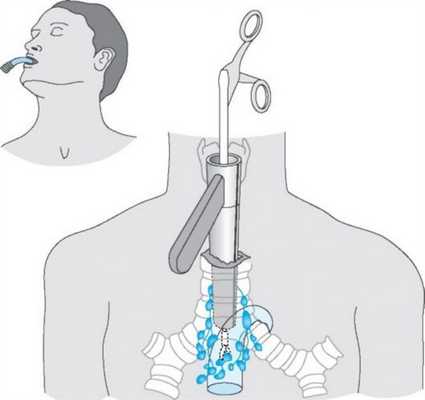
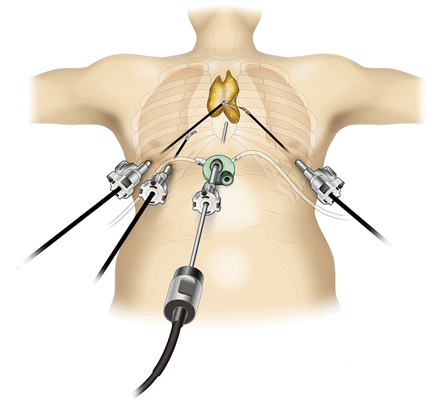
Профилактика и прогнозы
К сожалению, достоверных методов профилактики для опухолей средостения не выявлено. Но результаты можно существенно улучшить, если выявить заболевание на ранней стадии. Если симптомы, описанные ранее не проходят в течение двух недель, возможно стоит обратиться за квалифицированной медицинской помощью. Прогнозы в данном случае трудно давать, они зависят, типа опухоли и ее злокачественности от проводимого лечения.
Список литературы:
Сто оттенков лучевой диагностики: у каждого вида рака — свой «золотой стандарт» исследования
8 ноября — День рентгенолога. В этот день, в 1895 году, немецкий физик Вильгельм Конрад Рентген, проводя очередной эксперимент, открыл рентгеновское излучение. Сегодня это самый доступный и распространенный метод диагностики в мире.
Ни один метод лучевой диагностики не является универсальным, каждый имеет свои преимущества и недостатки, поэтому в реальной клинической практике врачи применяют все возможности медицинской визуализации, обсуждая в рамках мультидисциплинарной команды оптимальный алгоритм обследования пациента. С помощью Сергея Сергеевича Багненко, доктора медицинских наук, профессора, заведующего научным отделением диагностической и интервенционной радиологии НМИЦ онкологии им. Н.Н. Петрова, разбираемся, какие лучевые исследования нужно делать при конкретных онкопатологиях.

Методы лучевого исследования
Принято считать, что всего существует пять методов лучевой диагностики. В целом, деление базируется на видах лучевого воздействия, которое применяется в том или ином случае.
Рентгеновский метод — рентгеновское излучение, ультразвуковое (УЗИ) - ультразвуковые волны, МРТ - электромагнитные колебания, радионуклидный метод (позитронно-эмиссионная томография — ПЭТ, одно-фотонная эмиссионная томография - ОФЭКТ) — гамма и другие виды ионизирующего воздействия. Исключение - компьютерная томография (КТ). Данный вариант лучевой визуализации в своей основе предполагает рентгеновское излучение, и должен был бы относиться к рентгеновскому, однако его появление настолько расширило возможности классической рентгенодиагностики, что в свое время было принято решение вынести КТ в самостоятельный метод.
По большому счету, задачи, которые они выполняют, следующие:
Рентгенодиагностика — оценка состояния костей и органов грудной клетки, как правило, в рамках первичной диагностики, а также желудочно-кишечного тракта, желчных протоков и сосудов, если речь идет о рентген-контрастных методиках.
УЗИ — первичная диагностика практически любой онкопатологии, а также экспертная оценка при злокачественных поражениях щитовидной и паращитовидных желез, наружных половых органах, опухолях мягких тканей, имеющих поверхностное расположение, в том числе патологии молочных желез.
КТ — анализ состояния грудной клетки, скелета и органов живота в рамках предоперационного планирования (инвазия сосудов, поражение лимфатических узлов и пр.)
МРТ — головной, спинной мозг, молочные железы, связки и мышцы, органы малого таза и другие мягкотканные структуры.
Радионуклидный метод — решение отдельных вопросов дифференциальной диагностики (доброкачественный/злокачественный процесс и др.), оценка функционального состояния органов, а также стадирование онкологического заболевания (визуализация отдаленных метастазов и пр.).
Независимо от конкретного варианта лучевой диагностики, нативное исследование (без применения контрастных веществ) изредка может быть оправдано, однако в подавляющем большинстве случаев, особенно, если речь идет об онкопатологии, применение контрастных препаратов является обязательным.
Виды рака и методы лучевой диагностики
Рассмотрим лучевую диагностику по отдельным анатомическим локализациям.
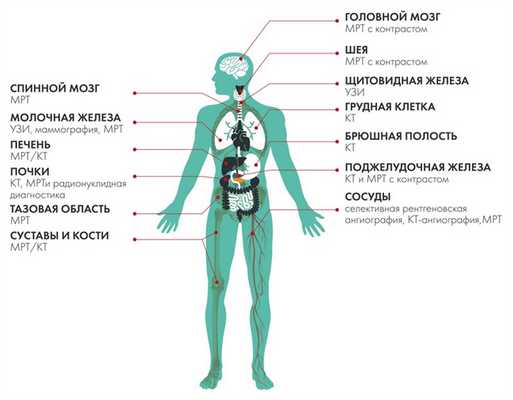
Головной мозг
Основной метод оценки непосредственно вещества головного мозга (в том числе первичных опухолей и метастазов) — МРТ с применением контрастного усиления.
Вопросы стадирования (поиск отдаленных метастазов) лучше всего решаются с помощью ПЭТ, в том числе с метионином.
Компьютерная томография используется как дополнительный метод в случае, если требуется оценка состояния костных структур, а также при наличии абсолютных противопоказаний к МРТ исследованию (наличие металла в теле — например, кардиостимулятора, ферромагнитных инородных металлических соединений: пластины, протезы, импланты и т.п.)
Первичный метод диагностики опухолей шеи — УЗИ.
Экспертная оценка - МРТ с контрастом.
КТ используется, когда необходимо оценить процесс разрушения (деструкции) костной ткани, требуется детальный анализ состояния гортани, а также есть показания к выполнению исследования сосудов (КТ-ангиография).
Радионуклидная диагностика - определение наличия онкологического процесса как такового, а также стадирование заболевания (применяются различные фармпрепараты: 18F-дезоксиглюкоза, метионин и пр.).
Щитовидная железа
Основной метод диагностики опухолевого процесса в щитовидной и паращитовидных железах — УЗИ. Отсутствие лучевой нагрузки, высокая разрешающая способность, а также доступность оборудования являются очевидными достоинствами эхографии. Особенно справедлив данный тезис, если речь идет об УЗИ с контрастным усилением и применением эластографии. Так называемое, мультипараметрическое УЗИ, то есть вариант исследования с включением в процедуру максимально количества различных методик, является наиболее перспективным вариантом реализации сонографической диагностики, особенно при злокачественной патологии.
Радионуклидная диагностика (к примеру, ПЭТ с 18F-DOPA) информативна в рамках подтверждения злокачественного характера имеющегося процесса, а также для выявления отдаленных метастазов.
Грудная клетка
С момента своего открытия (ровно 101 год назад) и по сей день рентгенодиагностика сохраняет свою актуальность (прежде всего, как метод первичной визуализации) в рамках оценки состояния легких и костной ткани. Однако «золотым стандартом» в данных областях заслужено стала КТ, базирующаяся на рентгеновском излучении, но существенно расширившая возможности классической рентгенографии. Компьютерная томография позволяет детально проанализировать состояние органов грудной клетки, оценить стадию и распространенность патологического процесса, вовлечение сосудов и других тканей, ответ на проводимую терапию.
У пациентов с острой патологией (например, реанимационных больных) может быть оправдано применение УЗИ (плевриты и др.).
МРТ эффективно для диагностики нейрогенных образований, которые располагаются в заднем средостении, а также как дополнительный метод диагностики при стадировании других опухолей средостения, например, рака пищевода.
Молочная железа
В настоящее время основными методами исследования молочных желез являются: маммография, УЗИ и МРТ. Все они обладают очевидными достоинствами и активно конкурируют между собой. Классическим вариантом визуализации (широкодоступным и понятным подавляющему большинству специалистов) является рентгеновская маммография.
УЗИ - неинвазивный метод, не предполагающий лучевую нагрузку, обладающий чрезвычайно высокими характеристиками в плане разрешающей способности изображений. Многие учреждения именно сонографический вариант диагностики рассматривают как «золотой стандарт», однако «операторозависимость» (когда два разных специалиста могут по-разному трактовать увиденное), а также невозможность оценить результаты другим специалистом (альтернативное мнение), ограничивают «зону ответственности» ультразвуковой диагностики.
МРТ решает большинство рассматриваемых вопросов, также не предполагает лучевой нагрузки, но имеет определенные ограничения в плане доступности и стоимости процедуры.
Печень
Первичная диагностика - УЗИ.
Экспертная оценка — КТ/МРТ с динамическим контрастированием.
КТ - доступнее, необременительна для пациента (само сканирование происходит за считанные секунды/минуты), позволяет в ходе одного визита исследовать в том числе легкие (что часто требуется в рамках онкоскриннинга).Это более простой, а потому более стандартизированный метод, который позволяет детально оценить состояние сосудов, что крайне важно при предоперационном планировании. Независимо от того, в каком центре проводится исследование, качество собранных данных будет, как правило, на достаточном уровне.
МРТ дает максимум информации в плане выявления и дифференциальной диагностики очаговой патологии печени, особенно если сканирование проводится с гепатотропными контрастными препаратами. Не предполагает лучевой нагрузки (то есть безвредно), а потому может выполняться многократно, в том числе беременным и детям. Однако многое зависит от того, в каком конкретно центре выполнено исследование (аппарато- и операторозависимость), занимает больше времени (сложности при обследовании пожилых, ослабленных пациентов), имеет ограничения в плане исследования легких (МРТ легких обычно не проводится и для их анализа приходится совершить визит в КТ отделение), имеет абсолютные противопоказания (например, металл в теле), уступает КТ в отношении предоперационной оценки.
Поджелудочная железа
По большому счету ситуация аналогична применяемым методам лучевой диагностики печени, однако есть некоторые нюансы. Так, из-за центрального расположения органа в теле визуализация при УЗИ может быть затруднена (тучные пациенты, при метеоризме — вздутие кишечника). Локальные обызвествления значительно лучше выявляются при КТ.
МРТ эффективнее для дифференциальной диагностики выявленных изменений.
Почки
Основные методы диагностики опухоли почки — КТ, МРТ и радионуклидный. Только в совокупности эти три составляющие могут дать врачам-онкологам полную информацию о состоянии органов. Традиционное УЗИ активно применяется для первичной оценки зоны интереса. Большие перспективы связывают с внедрением в клиническую практику УЗИ с контрастным усилением, однако по ряду технических моментов доступность данной методики сейчас ограничена.
Малый таз
«Золотым стандартом» оценки состояния органов малого таза, независимо от пола пациента, считают МРТ. И женские и мужские внутренние половые органы лучше всего оценивать с помощью МРТ с динамическим контрастированием. Впрочем, существуют ситуации, когда КТ может дать ценную дополнительную информацию.
Суставы и кости
В онкологической практике основными методами диагностики опухолей костно-мышечной системы являются МРТ и КТ.
Определенный приоритет имеет МРТ, однако, если требуется детальная оценка структуры кости или речь идет о параметрах деструкции, без КТ не обойтись.
Также в НИМЦ онкологии им. Петрова используется SLOT-рентгенография костей, когда с помощью специальной методики вся конечность, позвоночник или весь скелет целиком визуализируются на одном рентгеновском изображении. Этот метод позволяет точно определить параметры опухоли и соотнести ее с размером кости, что чрезвычайно важно хирургам при планировании вмешательства, подбора протеза или изготовления импланта.
Сосуды
Определенную информацию о состоянии некоторых сосудов можно получить при допплерографическом УЗИ, однако в онкологической практике чаще требуется более детальная информация и приходится прибегать к ангиографическим методикам.
Наиболее информативны - артериография на фоне плоскодетекторной компьютерной томографии (ПДКТ-артериография) и селективная цифровая субтракционная ангиография (ЦСА).
В 2021 году в НМИЦ онкологии им. Н.Н. Петрова в рентгеноперационной отделения рентгенохирургических методов диагностики и лечения был установлен современный ангиографический комплекс Artis Zee Flor (Siemens), позволяющий выполнять весь спектр диагностических и лечебных вмешательств, применяемых в интервенционной онкологии (в том числе с использованием ПДКТ-артериографии, ЦСА, внутрисосудистой и чрескожной 3D навигации). Однако основным недостатком данных методов визуализации является их инвазивность, требующая госпитализации пациентов для проведения вмешательства с соблюдением строгих правил асептики и антисептики.
Поэтому в рутинной практике чаще прибегают к менее инвазивным КТ-ангиографии и неинвазивной МР-ангиографии. Эти варианты визуализации позволяют проследить ход сосудов, выявить наличие тромбов, оценить наличие и степень опухолевой инвазии. КТ быстрее и обеспечивает более высокое пространственное разрешение изображений. Если применение йодсодержащих контрастов противопоказано (аллергические реакции, почечная недостаточность), выполняют магнитно-резонансное исследование. Современные технологии позволяют проводить сканирование с ЭКГ синхронизацией (требуется при изучении сосудов сердца), а также выполнять бесконтрастную МР-ангиографию (без введения контрастных препаратов в сосудистое русло).
Спинной мозг
Основной метод диагностики опухолей в спинном мозге — МРТ с контрастом. Он позволяет определить локализацию патологического процесса (интрамедуллярный или экстрамедуллярный, то есть находящийся в структуре спинного мозга или вне его), оценить его распространённость, вовлечение соседних структур. Если есть противопоказания к МРТ, а также, когда нужно детально разобраться с состоянием расположенных рядом позвонков, проводят КТ.
Пациенту важно помнить, что любые обследования, их последовательность и объем должен назначить врач-онколог. В подавляющем большинстве случаев диагностика нужна не сама по себе, а для планирования лечения, которое будет проводить соответствующий врач. Поэтому «назначенные» самостоятельно процедуры без предварительной консультации со специалистом могут быть абсолютно не информативны, то есть бесполезны, а с учетом возможной лучевой нагрузки даже вредны.


Автор:
Ирина Фигурина
специалист по связям с общественностью НМИЦ онкологии им. Н. Н. Петрова
Оренбургский государственный университет, факультет филологии
Что вам необходимо сделать
Если вы хотите узнать побольше о бесплатных возможностях ФБГУ НМИЦ онкологии им. Н.Н. Петрова Минздрава России, получить очную или заочную консультацию по диагностике и лечению, записаться на приём, ознакомьтесь с информацией на официальном сайте.
Если вы хотите общаться с нами через социальные сети, обратите внимание на аккаунты в ВКонтакте и Одноклассники.
Читайте также:
- Техника, этапы операции при травме двенадцатиперстной кишки
- Жалобы и симптомы заболеваний, повреждений слезоотводящих путей
- Гипертермия неясного генеза: причины, диагностика, лечение
- Уход после операции большеберцово-таранно-пяточного артродеза с фиксацией ретроградным интрамедуллярным стержнем
- Беременность у больной раком
