Продуктивная фаза иммунного ответа. Взаимодействие клеток в продуктивную фазу
Добавил пользователь Валентин П. Обновлено: 28.01.2026
Иммунная система имеет сложную организацию - для осуществления специфической функции задействовано множество различных клеточных популяций и растворимых факторов иммунитета. Клетки постоянно циркулируют в организме, погибают в процессе жизнедеятельности и воспроизводятся.
В зависимости от конкретной потребности специфическая функция иммунной системы может быть активирована либо подавлена (супрессирована). Однако любое реагирование иммунной системы осуществляется только при постоянном взаимодействии практически всех типов ее клеток, т.е. в условиях межклеточной кооперации. Раздражителем (активирующим сигналом) является антиген. В развитии любого иммунного реагирования прослеживается каскад последовательно сменяющихся этапов.
10.2.2.1. Взаимодействие клеток иммунной системы
Необходимым условием функционирования иммунной системы является тесная межклеточная кооперация,основу которой составляет рецептор-лигандное взаимодействие. Для связи между собой клетки используют различные дистантные растворимые факторы и прямой контакт.
Синтез растворимых факторов является одним из универсальных способов коммутации клеток между собой. К таковым относятся цитокины, которых в настоящее время известно более 25. Они представляют собой гетерогенное семейство разнообразных по структуре и функции биологически активных молекул, имеющих ряд общих свойств:
• как правило, цитокины не депонируются в клетке, а синтезируются после соответствующего стимула;
• для восприятия цитокинового сигнала клетка экспрессирует соответствующий рецептор, который может взаимодействовать с несколькими различными цитокинами;
• цитокины синтезируются клетками разных ростков, уровней и направлений дифференцировки;
• субпопуляции клеток иммунной системы различаются по спектру синтезируемых цитокинов и их рецепторов;
• цитокины обладают универсальностью, множественностью эффектов и синергизмом;
• цитокины могут воздействовать как на рядом расположенную клетку (паракринная регуляция), так и на сам продуцент (аутокринная регуляция);
• цитокиновая регуляция носит каскадный характер: активация клетки одним цитокином вызывает синтез другого;
• в подавляющем большинстве это короткодистантные медиаторы - их эффекты проявляются на месте выработки. Вместе с тем ряд провоспалительнъгх цитокинов (ИЛ-1, 6, α-ФНО и др.) могут оказывать системное действие.
Цитокины различаются по ведущей функциональной направленности:
• медиаторы доиммунного воспаления (ИЛ-1, 6,12, α-ФНОидр);
• медиаторы иммунного воспаления (ИЛ-5, 9, 10, γ-ИФН
• стимуляторы пролиферации и дифференцировки лимфоцитов (ИЛ-2, 4, 13, трансформирующий фактор роста - β-ТФР
• факторы роста клеток, или колониестимулирующие факторы
(ИЛ-3, 7, ГМ-КСФ и др.);
• хемокины, или клеточные хемоаттрактанты (ИЛ-8 и др.). Краткая характеристика некоторых цитокинов приведена в
10.2.2.2. Активация иммунной системы
Активация иммунной системы подразумевает развитие продуктивной иммунной реакции в ответ на антигенное раздражение
Таблица 10.3. Характеристика основных цитокинов
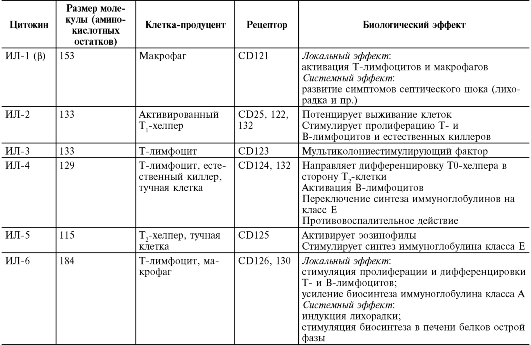
Продолжение табл. 10.3
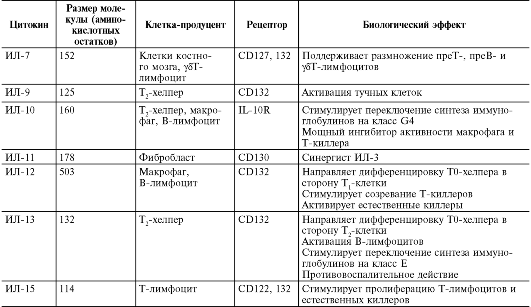
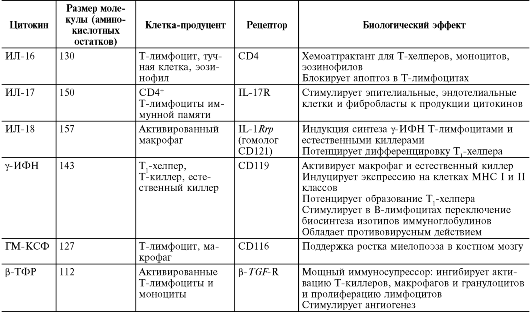
Окончание табл. 10.3
Примечание. МИФ - миграцию ингибирующий фактор.
и появление продуктов деструкции тканей макроорганизма. Это сложный многоступенчатый процесс, требующий продолжительного времени для своей индукции - около 4 сут. Критическим событием является невозможность элиминации антигена факторами врожденного иммунитета в течение указанного срока.
Пусковым механизмом адаптивного иммунитета является распознавание «свой-чужой», которое осуществляют Т-лимфоциты при помощи своих прямых иммунорецепторов - TCR. В случае установления чужеродности биоорганической молекулы включается второй этап реагирования - запускается интенсивное тиражирование клона высокоспецифичных для антигена лимфоцитовэффекторов, способных прервать антигенную интервенцию. Это явление получило название «экспансия клона». Параллельно, но несколько позже пролиферации стимулируются дифференцировка иммунных лимфоцитов и формирование из него клеток иммунологической памяти, гарантирующих выживание в будущем.
Таким образом, продуктивная активация иммунной системы связана с размножением и дифференцировкой антигенореактивных клонов иммунокомпетентных клеток. Антигену в этом процессе отведена роль индуктора и фактора клональной селекции. Механизмы основных этапов активации иммунной системы рассмотрены ниже.
Активация Т-хелпера. Процесс (см. рис. 10.6) осуществляется при непосредственном участии АПК (дендритные клетки, В-лимфоциты и макрофаги). После эндоцитоза и процессинга антигена во внутриклеточных везикулах АПК встраивает образовавшийся олигопептид в молекулу MHC II класса и выставляет полученный комплекс на наружной мембране. На поверхности АПК также экспрессируются ко-стимулирующие факторы - молекулы CD40, 80, 86, мощным индуктором которых являются продукты разрушения покровных тканей на этапе доиммунного воспаления.
В случае признания чужеродности комплекса антиген-MHC II класса (точнее, «не своего») Т-хелпер активируется. Он экспресси-
рует рецептор к ИЛ-2 и начинает синтезировать ИЛ-2 и другие цитокины. Итогом активации Т-хелпера являются его размножение и дифференцировка в одного из своих потомков - T1- или Т2-хелпер (см. рис. 10.2). Любое изменение условий рецепции прекращает активацию Т-хелпера и может индуцировать в нем апоптоз.
Активация В-лимфоцита. Для активации В-лимфоцита (рис. 10.9) необходима суммация трех последовательных сигналов. Первый сигнал - результат взаимодействия молекулы антигена со специфичным для него BCR, второй - интерлейкиновый стимул активированного Т-хелпера и третий - результат взаимодействия ко-стимулирующих молекул CD40 с CD40-лигандом.
Активация инициирует размножение и дифференцировку специфичного для конкретного антигена В-лимфоцита (см. рис. 10.2). В итоге в пределах зародышевых (герминативных) центров лимфоидных фолликулов появляется клон специфических антителопродуцентов. Дифференцировка позволяет переключить биосинтез иммуноглобулинов с классов M и D на более экономные: G, A или Е (редко), повысить аффинность синтезируемых антител и образовать В-клетки иммунологической памяти или плазматические клетки.
Активация В-лимфоцита - весьма тонкий процесс. Отсутствие хотя бы одного из стимулов (нарушение межклеточной кооперации, неспецифичность рецептора В-лимфоцита или элиминация антигена) блокирует развитие антительного иммунного ответа.
Активация Т-киллера. Для исполнения надзорной функции Т-киллер вступает в тесный и прочный контакт с потенциальной
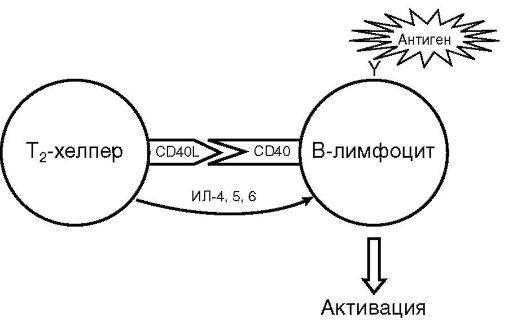
Рис. 10.9. Схема активации В-лимфоцита (пояснения в тексте)
клеткой-мишенью, используя молекулы адгезии (см. рис. 10.8). Затем иммунорецептор Т-киллера (αβTCR)совместно с молекулой CD3 при поддержке ко-рецепторной молекулы CD8 взаимодействует с антигенным комплексом MHC I класса и анализирует его структуру. Обнаружение отклонений в пользу аллогенности активирует Т-киллер к экспрессии рецептора к ИЛ-2 и синтезу ИЛ-2 и высвобождение эффекторных молекул (перфорин, гранзимы, гранулизин) из цитоплазматических гранул в синаптическую щель межклеточного контакта.
Для адекватного развития клеточной формы иммунного ответа требуются активизирующие стимулы со стороны Т1-хелпера. Т-киллер может функционировать автономно, самостоятельно инициируя и поддерживая клонообразование за счет аутокринной стимуляции ИЛ-2. Однако это свойство реализуется редко.
10.2.2.3. Супрессия иммунного ответа
Супрессия или подавление иммунного ответа является физиологической реакцией организма, которая в норме завершает иммунный ответ и направлена на торможение экспансии антигенспецифических клонов лимфоцитов. В отличие от иммунологической толерантности, супрессии подвергается уже инициированное иммунное реагирование. Различают три механизма иммуносупрессии: уничтожение клонов иммунокомпетентных клеток, торможение активности иммунокомпетентных клеток, элиминация антигенного стимула.
Устранить иммунокомпетентные клетки можно путем апоптоза. При этом элиминации подвергаются следующие группы клеток:
• терминально дифференцированные лимфоциты, завершившие свою биологическую программу;
• активированные лимфоциты, не получившие антигенного стимула;
Естественными факторами, инициирующими апоптоз, яляются глюкокортикоидные гормоны, Fas-лиганд, α-ФНО и другие иммуноцитокины, гранзимы и гранулизин. Апоптотическое уничтожение клеток-мишеней могут активировать Т-киллеры, ЕК с фенотипом CD16 - CD56 много и Т1-хелперы.
Помимо апоптоза возможен антителозависимый лимфоцитолиз. Например, с медицинской целью применяют антилимфоцитарную
сыворотку, которая в присутствии комплемента вызывает лизис лимфоцитов. Устранить лимфоидную популяцию возможно также воздействием ионизирующего излучения или цитостатиков.
Функциональная активность иммунокомпетентных клеток может быть ингибирована растворимыми факторами их конкурентов или потомков. Ведущая роль принадлежит иммуноцитокинам с множественными эффектами. Известно, например, что Т2- хелперы, γδТ-лимфоциты и тучные клетки при помощи ИЛ-4, 13 препятствуют дифференцировке Т0-хелпера в Т1-клетку. Последний, в свою очередь, может блокировать образование Т2-хелпера, синтезируя γ-ИФН. Пролиферацию Т- и В-лимфоцитов ограничивает β-ТФР, который продуцируют терминально дифференцированные Т-хелперы. Уже упомянутые продукты Т2-хелпера (ИЛ-4, 13 и β-ТФР) подавляют биологическую активность макрофагов.
Супрессия гуморального звена иммунитета может быть вызвана иммуноглобулинами. Избыточные концентрации иммуноглобулина класса G, связываясь со специальными рецепторами на мембране В-лимфоцита, тормозят биологическую активность клетки и ее способность дифференцироваться в плазмоцит.
Устранение из организма антигена в природе наблюдается при полном освобождении организма от патогена при развитии стерильного иммунитета. В клинической практике эффект достигается очищением организма плазмоили лимфосорбцией, а также нейтрализацией антигена антителами, специфичными для высокоиммуногенных эпитопов.
10.2.2.4. Возрастные изменения иммунной системы
В развитии иммунной системы четко прослеживаются два этапа. Первый, антигеннезависимый, который начинается с эмбрионального периода развития и частично продолжается всю жизнь. В течение этого периода образуются стволовые клетки и разнообразные антигенспецифические клоны лимфоцитов. Предшественники γδT и В1-лимфоцитов мигрируют в покровные ткани и формируют автономные лимфоидные ростки.
Второй этап, антигензависимый, продолжается с момента рождения особи до ее гибели. В этот период идет «ознакомление» иммунной системы с многообразием окружающих нас антигенов. По мере накопления биологического опыта, т.е. количества и качества продуктивных контактов с антигенами, происходят селекция
и тиражирование отдельных клонов иммунокомпетентных клеток. Особенно интенсивная экспансия клонов характерна для детского возраста. В течение первых 5 лет жизни иммунной системе ребенка приходится усваивать примерно 90% биологической информации. Еще 9% воспринимается до наступления пубертата, на взрослое состояние остается лишь около 1%.
С возрастом иммунная система меняет свою структуру. В организме взрослого до 50% всего лимфоидного пула представлено клонами клеток, прошедших антигенную стимуляцию. Накопленный иммунной системой биологический опыт проявляется образованием узкой «библиотеки» жизненно важных (актуальных) клонов лимфоцитов, специфичных для основных патогенов. Благодаря долгоживучести клеток иммунологической памяти актуальные клоны со временем становятся самодостаточными. Они приобретают способность к самоподдержанию и независимость от центральных органов иммунной системы. Функциональная нагрузка на тимус снижается, что проявляется его возрастной инволюцией. Тем не менее в организме сохраняется широкий набор невостребованных «наивных» клеток. Они способны отреагировать на любую новую антигенную агрессию.
Структура популяции Т-лимфоцитов также претерпевает возрастные изменения. Установлено, что в организме новорожденных преобладают Т2-хелперы, необходимые для развития антительной защиты. Однако со временем перед организмом все острее встает проблема внутриклеточного паразитизма, различных инвазий, мутаций, что требует надежного и хорошо организованного иммунологического надзора за морфогенетическим постоянством кле-
точных элементов организма. Поэтому после рождения начинает усиленно развиваться система адаптивного клеточного иммунитета, а вместе с ним образование клонов Т1-хелперов и Т-киллеров. Отмечено, что нарушение постнатальной колонизации желудочнокишечного тракта нормальной флорой тормозит процесс адекватного формирования популяции Т1-хелперов в пользу Т2-клеток. Избыточная активность последних оборачивается аллергизацией детских организмов.
Продуктивный иммунный ответ после своего завершения (нейтрализации и элиминации антигена из организма) также сопровождается изменениями клональной структуры антигенореактивных лимфоцитов. При отсутствии активирующих стимулов клон инволюционирует. Невостребованные клетки со временем погибают от старости или индукции апоптоза, причем этот процесс начинается с более дифференцированных лимфоцитов-эффекторов. Численность клона постепенно снижается и проявляется постепенным угасанием иммунного ответа. Однако в организме длительно персистируют клетки иммунологической памяти.
Старческий период жизни характеризуется доминированием в иммунной системе актуальных клонов антигенспецифических лимфоцитов в сочетании с нарастающей иммунодепрессией и снижением общей реактивности. Инфекции, вызванные даже условно-патогенными микробами, зачастую принимают затяжной или угрожающий характер. Клеточный иммунитет также теряет эффективность, постепенно нарастает объем злокачественно трансформированных клеток. Поэтому у пожилых людей часто встречаются новообразования.
Микробиология: конспект лекций.
Иммунный ответ - это цепь последовательных сложных кооперативных процессов, идущих в иммунной системе в ответ на действие антигена в организме.
1) первичный иммунный ответ (возникает при первой встрече с антигеном);
2) вторичный иммунный ответ (возникает при повторной встрече с антигеном).
Любой иммунный ответ состоит из двух фаз:
1) индуктивной; представление и распознавание антигена. Возникает сложная кооперация клеток с последующей пролиферацией и дифференцировкой;
2) продуктивной; обнаруживаются продукты иммунного ответа.
При первичном иммунном ответе индуктивная фаза может длиться неделю, при вторичном - до 3 дней за счет клеток памяти.
В иммунном ответе антигены, попавшие в организм, взаимодействуют с антигенпредставляющими клетками (макрофагами), которые экспрессируют антигенные детерминанты на поверхности клетки и доставляют информацию об антигене в периферические органы иммунной системы, где происходит стимуляция Т-хелперов.
Далее иммунный ответ возможен в виде по одного из трех вариантов:
1) клеточный иммунный ответ;
2) гуморальный иммунный ответ;
3) иммунологическая толерантность.
Клеточный иммунный ответ - это функция Т-лимфоцитов. Происходит образование эффекторных клеток - Т-киллеров, способных уничтожать клетки, имеющие антигенную структуру путем прямой цитотоксичности и путем синтеза лимфокинов, которые участвуют в процессах взаимодействия клеток (макрофагов, Т-клеток, В-клеток) при иммунном ответе. В регуляции иммунного ответа участвуют два подтипа Т-клеток: Т-хелперы усиливают иммунный ответ, Т-супрессоры оказывают противоположное влияние.
Гуморальный иммунитет - это функция В-клеток. Т-хелперы, получившие антигенную информацию, передают ее В-лимфоцитам. В-лимфоциты формируют клон антителопродуцирующих клеток. При этом происходит преобразование В-клеток в плазматические клетки, секретирующие иммуноглобулины (антитела), которые имеют специфическую активность против внедрившегося антигена.
Образующиеся антитела вступают во взаимодействие с антигеном с образованием комплекса АГ - АТ, который запускает в действие неспецифические механизмы защитной реакции. Эти комплексы активируют систему комплемента. Взаимодействие комплекса АГ - АТ с тучными клетками приводит к дегрануляции и выделению медиаторов воспаления - гистамина и серотонина.
При низкой дозе антигена развивается иммунологическая толерантность. При этом антиген распознается, но в результате этого не происходит ни продукции клеток, ни развития гуморального иммунного ответа.
Иммунный ответ характеризуется:
1) специфичностью (реактивность направлена только на определенный агент, который называется антигеном);
2) потенцированием (способностью производить усиленный ответ при постоянном поступлении в организм одного и того же антигена);
3) иммунологической памятью (способностью распознавать и производить усиленный ответ против того же самого антигена при повторном его попадании в организм, даже если первое и последующие попадания происходят через большие промежутки времени).
Физиология иммунного ответа ( по материалам статьи Angel A. Justiz Vaillant с соавторами)
Иммунный ответ - это способность организма оставаться в безопасности, обеспечивая защиту от вредных агентов, и включает в себя линии защиты от большинства микробов, а также специализированную и высокоспецифичную реакцию на конкретного агента - "преступника". Этот иммунный ответ классифицируется как врожденный, который является неспецифическим, и как адаптивный, приобретенный, который является высокоспецифичным. Иммунная система эволюционировала для поддержания гомеостаза, поскольку она может различать чужеродные антигены и собственные; однако, когда эта специфичность нарушается, развивается аутоиммунная реакция или заболевание.
Пржденный иммунитет
Врожденный иммунный ответ ( реакция), часто наша первая линия защиты от всего постороннего, всегда защищает организм от патогена аналогичным образом. Эти естественные механизмы включают кожный барьер, слюну, слезы, различные цитокины, белки комплемента, лизоцим, бактериальную флору и многочисленные клетки, включая нейтрофилы, базофилы, эозинофилы, моноциты, макрофаги, ретикулоэндотелиальную систему, естественные клетки-киллеры (NK-клетки), эпителиальные клетки. , эндотелиальные клетки, эритроциты и тромбоциты. Воспалительный иммунный ответ является примером врожденного иммунитета, поскольку он блокирует проникновение вторгающихся патогенов через кожу, дыхательные пути или желудочно-кишечный тракт. Если патогены могут пробить эпителиальные поверхности, они сталкиваются с макрофагами в субэпителиальных тканях, которые будут не только пытаться поглотить их, но и продуцировать цитокины для усиления воспалительной реакции.
Приобретенный иммунитет
Адаптивный приобретенный иммунный ответ будет использовать способность конкретных лимфоцитов и их продуктов (иммуноглобулинов и цитокинов) генерировать ответ против вторгшихся микробов, и проявляет типичные особенности. Активный иммунитет возникает в результате реакции иммунной системы на антиген и, следовательно, приобретается. Иммунитет, возникающий в результате передачи иммунных клеток или антител от иммунизированного человека, является пассивным иммунитетом .
Аутоиммунитет
Хотя иммунная система предназначена для защиты человека от угроз, иногда чрезмерный иммунный ответ вызывает реакцию против аутоантигенов, приводящую к аутоиммунитету. Кроме того, иммунная система не может постоянно защищаться от всех угроз.
Основные тезисы аутоиммунитета
Отказ от трансплантации является иммуноопосредованным ответом, представляет собой препятствие для трансплантации. Этиология многих аутоиммунных заболеваний неясна - реальность такова, что распространенность этих расстройств увеличивается и проявляется более агрессивно.
Расстройства гиперчувствительности I типа являются иммуноопосредованными и включают аллергическую бронхиальную астму, пищевую аллергию и анафилактический шок. Нарушения иммунодефицита встречаются редко, но они поражают некоторых детей.
Вакцинация
Вакцинация необходима для индукции адекватного активного иммунного ответа на определенные патогены. Живые аттенуированные вакцины: вызывают как гуморальный, так и клеточный ответ. Эти вакцины противопоказан при беременности и состояниях с ослабленным иммунитетом. Примеры включают аденовирус, полиомиелит, ветряную оспу, оспу, БЦЖ, желтую лихорадку, грипп (интраназальный), MMR, ротавирус и т. д. Убитые или инактивированные вакцины: вызывают только гуморальный ответ. Примеры включают бешенство, грипп (инъекции), полиомиелит , гепатит А и т. д. Субъединичные вакцины: Примеры включают HBV, HPV (типы 6,11,16 и 18), бесклеточный коклюш, Neisseria meningitides, Streptococcus pneumoniae, Hemophilus influenza типа b и т. д. Анатоксиновая вакцина: примеры включают Clostridium tetani, Corynebacterium diphtheria и т. д.
Генез клеток иммунной системы
Клетки мезодермы индуцируются с образованием гемангиобластов, общих предшественников сосудов и образования клеток крови. Окончательные гемопоэтические стволовые клетки происходят из мезодермы, окружающей аорту, называемой областью аорта-гонад-мезонефрос. Эти стволовые клетки колонизируют печень и после этого к седьмому месяцу беременности активно вырабатываются костным мозгом. Т-лимфоциты созревают в тимусе, где эти клетки достигают стадии функциональной компетентности, в то время как В-лимфоциты созревают в костном мозге, месте образования всех циркулирующих клеток крови.
Системы органов, учавствующих в иммунном ответе
Системы органов, участвующие в иммунном ответе, - это прежде всего лимфоидные органы, которые включают селезенку, тимус, костный мозг, лимфатические узлы, миндалины и печень. Система лимфоидных органов классифицируется следующим образом: 1) первичные лимфоидные органы (тимус и костный мозг), где Т- и В-клетки сначала экспрессируют антигенные рецепторы и становятся функционально зрелыми; 2) вторичные лимфоидные органы, такие как селезенка, миндалины, лимфатические узлы, кожная и слизистая иммунная система; именно здесь В- и Т-лимфоциты распознают чужеродные антигены и вырабатывают соответствующие иммунные ответы.
Иммунный ответ на бактерии
Здесь ответ часто зависит от патогенности бактерий : нейтрализующие антитела синтезируются, если бактериальная патогенность обусловлена токсином; опсонизирующие антитела - вырабатываются, поскольку они необходимы для уничтожения внеклеточных бактерий; система комплемента активируется, в частности, липидными слоями грамотрицательных бактерий; фагоциты убивают большинство бактерий, используя положительный хемотаксис, прикрепление, захват и, наконец, поглощение бактерий; CD8 + Т-клетки могут убивать клетки, инфицированные бактериями.
Иммуный ответ на грибы
Врожденный иммунитет к грибам включает дефенсины и фагоциты. CD4 + Т-хелперные клетки несут ответственность за адаптивный иммунный ответ против грибов. Дендритные клетки секретируют IL-12 после употребления в пищу грибов, а IL-12 активирует синтез гамма-интерферона, который активирует клеточный иммунитет.
Иммунный ответ на вирусы
Интерферон, NK-клетки и фагоциты предотвращают распространение вирусов на ранней стадии. Специфические антитела и белки комплемента участвуют в нейтрализации вирусов и могут ограничивать распространение и повторное заражение. Адаптивный иммунитет имеет первостепенное значение для защиты от вирусов - они включают CD8 + Т-клетки, которые их убивают, и CD4 + Т-клетки как доминирующую популяцию эффекторных клеток в ответ на многие вирусные инфекции.
Иммуный ответ на паразитов
Паразитарная инфекция стимулирует различные механизмы иммунитета из-за их сложного жизненного цикла. Клетки CD4 + и CD8 + защищают от паразитов. Макрофаги, эозинофилы, нейтрофилы и тромбоциты могут убивать простейших и червей, высвобождая реактивные радикалы кислорода и оксид азота. Повышенное количество эозинофилов и стимуляция IgE Th-2 CD4 + Т-клетками необходимы для уничтожения кишечных червей. Воспалительные реакции также борются с паразитарными инфекциями.
Уклонение от иммунного ответа
Несмотря на иммунный ответ (ы), генерируемый неповрежденной и функциональной иммунной системой, мы все равно болеем, и это часто происходит из-за механизмов уклонения, используемых этими микробами. Вот некоторые из них:
Стратегия вирусов
Антигенная вариация : это мутация белков, которые обычно распознаются антителами и лимфоцитами. ВИЧ постоянно мутирует, что затрудняет защиту иммунной системы от него, а также препятствует разработке вакцины. Нарушая активность 2 ', 5'-олигоаденилатсинтетазы или продуцируя растворимые рецепторы интерферона, вирусы нарушают интерфероновую реакцию. Вирусы влияют на экспрессию молекул MHC по нескольким механизмам. Вирус может инфицировать иммунные клетки : нормальные Т- и В-клетки также являются местами персистенции вируса. ВИЧ скрывается в CD4 + Т-клетках, а ВЭБ - в В-клетках.
Стратегия бактерий
Внутриклеточные патогены могут скрываться в клетках : бактерии могут жить внутри метаболически поврежденных лейкоцитов хозяина и ускользать из фаголизосом ( Shigella spp). Прочие механизмы: производство токсинов, подавляющих фагоцитоз; предотвращания убийства путем инкапсуляции; высвобождение каталазы инактивирующей перекись водорода; заражение клетки, а затем нарушение антигенной презентации; уничтожение фагоцитов путем апоптоза или некроза.
Стратегия грибов
Грибы производят полисахаридную капсулу, которая подавляет процесс фагоцитоза и преодолевает опсонизацию, комплемент и антитела.Некоторые грибы подавляют активность Т-клеток-хозяев, замедляя клеточно-опосредованное уничтожение. Другие организмы (например, Histoplasma capsulatum ) избегают гибели макрофагов, проникая в клетки через CR3 и избегая образования фагосом.
Стратегия паразитов
Паразиты могут противостоять разрушению за счет дополнения. Паразиты могут противостоять разрушению за счет дополнения. Паразиты маскируются под защитный механизм. Антигенная вариация (например, африканская трипаносома) - важный механизм уклонения от иммунной системы. Паразиты выделяют молекулы, которые мешают нормальному функционированию иммунной системы.
Механизмы иммунного ответа
Наиболее важные механизмы иммунной системы, с помощью которых она генерирует иммунный ответ, включают: макрофаги, которые производят лизосомальные ферменты и активные формы кислорода для устранения проглоченных патогенов. Эти клетки производят цитокины, которые привлекают другие лейкоциты к месту инфекции, чтобы защитить организм. Врожденный ответ на вирусы включает синтез и высвобождение интерферонов, а также активацию естественных клеток-киллеров, которые распознают и уничтожают инфицированные вирусом клетки. Врожденный иммунитет против бактерий состоит из активации нейтрофилов, которые поглощают патогены, и перемещения моноцитов к воспаленной ткани, где они превращаются в макрофаги. Они могут поглощать и обрабатывать антиген, а затем представлять его группе специализированных клеток приобретенного иммунного ответа. Эозинофилы защищают от паразитарных инфекций, высвобождая содержимое своих гранул.
Антителозависимая клеточно-опосредованная цитотоксичность (ADCC) : цитотоксическая реакция, при которой клетки-киллеры, экспрессирующие Fc-рецептор, распознают клетки-мишени через специфические антитела. Созревание аффинности : увеличение средней аффинности антител, в основном наблюдаемое во время вторичного иммунного ответа. Система комплемента : это молекулярный каскад белков сыворотки, участвующих в контроле воспаления, литической атаке на клеточные мембраны и активации фагоцитов. Система может активироваться за счет взаимодействия с IgG или IgM (классический путь) или за счет вовлечения факторов B, D, H, P, I и C3, которые тесно взаимодействуют с поверхностью активатора с образованием конвертазы C3 альтернативного пути.Анергия : это неспособность вызвать иммунный ответ после стимуляции потенциальным иммуногеном. Процессинг антигена : преобразование антигена в форму, распознаваемую лимфоцитами. Это начальный стимул для выработки иммунного ответа. Презентация антигена : это процесс, при котором определенные клетки иммунной системы экспрессируют антигенные пептиды в своей клеточной мембране вместе с аллелями главного комплекса гистосовместимости (MHC), который распознается лимфоцитами. Апоптоз : запрограммированная гибель клеток, включающая фрагментацию ядра и образование апоптотических тел. Хемотаксис : миграция клеток в ответ на градиенты концентрации хемотаксических факторов.
Реакция гиперчувствительности : устойчивый иммунный ответ, который вызывает более значительное повреждение тканей, чем вызванное антигеном или патогеном, вызвавшим ответ. Например, аллергическая бронхиальная астма и системная красная волчанка являются примерами реакций гиперчувствительности типа I и типа III соответственно.
Реакции гиперчувствительности 2 типа (антителозависимая цитотоксическая гиперчувствительность): иммунный ответ против антигенов, присутствующих на поверхности клетки. Антитела, связывающиеся с поверхностью клетки, активируют систему комплемента и вызывают дегрануляцию нейтрофилов и разрушение клетки. Такие реакции могут быть нацелены на собственные или чужие антигены. Несовместимость групп крови по системе ABO, приводящая к острым гемолитическим трансфузионным реакциям, является примером гиперчувствительности 2 типа.
Реакции гиперчувствительности 3 типа также опосредуются циркулирующим комплексом антиген-антитело, который может откладываться в тканях и повредить их. Антигены в отношениях типа 3 являются растворимыми, в отличие от связанных с клетками антигенов в типе 2.
Реакции гиперчувствительности 4 типа (реакции гиперчувствительности замедленного типа): они опосредуются антиген-специфическими активированными Т-клетками . Когда антиген попадает в организм, он обрабатывается антигенпрезентирующими клетками и вместе с MHC II передается в клетку Th1. Если Т-хелперная клетка уже была сенсибилизирована к этому конкретному антигену, она будет стимулирована к высвобождению хемокинов для рекрутирования макрофагов и цитокинов, таких как интерферон-γ, для их активации. Это вызывает локальное повреждение тканей. Реакция занимает больше времени, чем все другие типы, от 24 до 72 часов.
Воспаление : определенные реакции, которые привлекают клетки и молекулы иммунной системы к месту инфекции или повреждения. Он отличался повышенным кровоснабжением, проницаемостью сосудов и повышенной трансэндотелиальной миграцией клеток крови (лейкоцитов). Опсонизация : процесс облегчения фагоцитоза за счет отложения опсонинов (IgG и C3b) на антигене. Фагоцитоз : процесс, при котором клетки (например, макрофаги и дендритные клетки) захватывают или поглощают антигенный материал или микроб и заключают его в фагосому в цитоплазме. Иммунологическая толерантность : состояние специфической иммунологической невосприимчивости.
Отторжение трансплантата
Ксенотрансплантаты - это трансплантаты между представителями разных видов, вызывающие максимальный иммунный ответ. Быстрый отказ.
Аллотрансплантаты - это трансплантаты между представителями одного вида.
Аутотрансплантаты - это трансплантаты от одной части тела к другой. Никакого отказа.
Изотрансплантаты - это трансплантаты между генетически идентичными людьми. Никакого отказа.
Сверхострое отторжение: при сверхостром отторжении пересаженная ткань отторгается в течение нескольких минут или часов, потому что васкуляризация быстро разрушается. Сверхострое отторжение опосредовано антителами и происходит потому, что у реципиента уже есть антитела против трансплантата, что может быть связано с предыдущими переливаниями крови, многоплодной беременностью, предшествующей трансплантацией или ксенотрансплантатами. Активация системы комплемента приводит к тромбозу сосудов, препятствующему васкуляризации трансплантата.
Острое отторжение: развивается в течение нескольких недель или месяцев. Включает активацию Т-лимфоцитов против донорских МНС. Также может быть задействован гуморальный иммунный ответ, когда после трансплантации вырабатываются антитела. Проявляется васкулитом сосудов трансплантата с плотным интерстициальным лимфоцитарным инфильтратом.
Хроническое отторжение: хроническое отторжение развивается от месяцев до лет после того, как приступы острого отторжения утихли. Хронические отторжения опосредованы как антителами, так и клетками. Использование иммунодепрессантов и методов тканевого типирования увеличило выживаемость аллотрансплантатов в первый год, но хроническое отторжение в большинстве случаев не предотвращается. Обычно это проявляется фиброзом и рубцеванием. При пересадке сердца хроническое отторжение проявляется в виде ускоренного атеросклероза. В пересаженных легких проявляется облитерирующим бронхиолитом. При трансплантации печени это проявляется как синдром исчезающего желчного протока. У реципиентов почек это проявляется фиброзом и гломерулопатией.
Болезнь « трансплантат против хозяина»: начало заболевания варьируется. Привитые иммунокомпетентные Т-клетки пролиферируют в хозяине с ослабленным иммунитетом и отторгают хозяйские клетки, которые они считают «чужеродными», что приводит к тяжелой органной дисфункции. Это реакция гиперчувствительности 4 типа, которая проявляется макулопапулезной сыпью, желтухой, диареей, гепатоспленомегалией. Обычно возникает при трансплантации костного мозга и печени, которые богаты лимфоцитами.
3. Формы иммунного ответа
Клеточный иммунный ответ - это функция T-лимфоцитов. Происходит образование эффекторных клеток - T-киллеров, способных уничтожать клетки, имеющие антигенную структуру путем прямой цитотоксичности и путем синтеза лимфокинов, которые участвуют в процессах взаимодействия клеток (макрофагов, T-клеток, B-клеток) при иммунном ответе. В регуляции иммунного ответа участвуют два подтипа T-клеток: T-хелперы усиливают иммунный ответ, T-супрессоры оказывают противоположное влияние.
Гуморальный иммунитет - это функция B-клеток. Т-хелперы, получившие антигенную информацию, передают ее В-лимфоцитам. В-лимфоциты формируют клон антителопродуцирующих клеток. При этом происходит преобразование B-клеток в плазматические клетки, секретирующие иммуноглобулины (антитела), которые имеют специфическую активность против внедрившегося антигена.
Взаимодействие клеток при иммунном ответе
Иммунный ответ возможен в результате активации клонов лимфоцитов и состоит из двух фаз. В первой фазе Аг активирует те лимфоциты, которые его распознают. Во второй (эффекторной) фазе эти лимфоциты координируют иммунный ответ, направленный на устранение Аг.
Гуморальный иммунный ответ
В гуморальном иммунном ответе эффекторными клетками являются В-лимфоциты. Регуляцию антителообразования осуществляют Т-хелперы и Т-супрессоры.
Вторгшийся в организм Аг поглощается макрофагом и подвергается процессингу — расщеплению на фрагменты. Фрагменты Аг выставляются на поверхности клетки вместе с молекулой MHC. Комплекс «Аг-молекула MHC класса II» предъявляется T‑хелперу (рис. 16‑4).
Рис. 16‑4. Распознавание антигена рецептором T‑лимфоцита. При помощи рецептора Т-лимфоцита Т‑клетка распознает Аг, но только находящийся в комплексе с молекулой MHC. В случае ТH‑клетки в процессе участвует её молекула — CD4, которая свободным концом связывается с молекулой MHC. Распознаваемый Т‑клеткой Аг имеет два участка: один взаимодействует с молекулой MHC, другой (эпитоп) связывается с рецептором Т-лимфоцита. Подобный тип взаимодействия, но с участием молекулы CD8, характерен для процесса распознавания TC‑лимфоцитом Аг, связанного с молекулой MHC класса I.
T‑хелпер распознаёт комплекс «Аг-молекула MHC класса II» на поверхности антигенпредставляющей клетки (рис. 16‑5). Для активации Т‑хелпера специфическое узнавание Т‑хелпером фрагмента Аг на поверхности антигенпредставляющей клетки оказывается недостаточным. Активацию Т‑хелперов обеспечивает взаимодействие молекулы В7 (расположена на поверхности антигенпредставляющей клетки) с молекулой CD28 на поверхности Т‑хелпера. Узнавание Т‑хелпером нужных молекул на поверхности антигенпредставляющей клетки стимулирует секрецию ИЛ1 (рис. 16‑5). Активированный ИЛ1 T‑хелпер синтезирует ИЛ2 и рецепторы ИЛ2, через которые агонист стимулирует пролиферацию Т‑хелперов и цитотоксических T‑лимфоцитов. В случае Т‑хелпера речь идёт об аутокринной стимуляции, когда клетка реагирует на тот агент, который сама же синтезирует и секретирует. Таким образом, после взаимодействия с антигенпредставляющей клеткой T‑хелпер приобретает способность отвечать на действие ИЛ2 всплеском пролиферации. Биологический смысл этого процесса состоит в накоплении такого количества Т‑хелперов, которое обеспечит образование в лимфоидных органах необходимого количества плазматических клеток, способных вырабатывать АТ против данного Аг.
Рис. 16‑5. Взаимодействие клеток при иммунном ответе. Рецептор Т‑хелпера распознаёт антигенную детерминанту (эпитоп) вместе с молекулой MHC класса II, выставленные на поверхности антигенпредставляющей клетки. В молекулярном взаимодействии участвует дифференцировочный Аг Т‑хелпера CD4. В результате подобного взаимодействия антигенпредставляющая клетка секретирует ИЛ1, стимулирующий в Т‑хелпере синтез и секрецию ИЛ2, а также синтез и встраивание в плазматическую мембрану того же Т‑хелпера рецепторов ИЛ2. ИЛ2 стимулирует пролиферацию Т‑хелперов и активирует цитотоксические T‑лимфоциты. Отбор В‑лимфоцитов производится при взаимодействии Аг с Fab‑фрагментами IgM на поверхности этих клеток. Эпитоп этого Аг в комплексе с молекулой MHC класса II узнаёт рецептор Т‑хелпера, после чего из T‑лимфоцита секретируются цитокины, стимулирующие пролиферацию В‑лимфоцитов и их дифференцировку в плазматические клетки, синтезирующие АТ против данного Аг. Рецептор цитотоксических T‑лимфоцитов связывается с антигенной детерминантой в комплексе с молекулой MHC класса I на поверхности вирус-инфицированной или опухолевой клетки. В молекулярном взаимодействии участвует дифференцировочный Аг цитотоксического T‑лимфоцита CD8. После связывания молекул взаимодействующих клеток цитотоксический T‑лимфоцит убивает клетку-мишень.
Активация B‑лимфоцита (рис. 16‑5) предполагает прямое взаимодействие Аг с Ig на поверхности B‑клетки. В этом случае сам B‑лимфоцит процессирует Аг и представляет его фрагмент в комплексе с молекулой MHC II на своей поверхности. Этот комплекс распознаёт T‑хелпер, отобранный при помощи того же Аг. В активации В‑клетки участвуют две пары молекул: с одной стороны, специфическое взаимодействие Аг с рецептором (IgM) на поверхности В‑лимфоцита, а с другой стороны, молекула CD40 на поверхности В‑клетки взаимодействует с молекулой CD40L на поверхности Т‑хелпера, активирующего В‑клетку. Узнавание рецептором T‑хелпера комплекса «Аг-молекула MHC класса II» на поверхности B‑лимфоцита приводит к секреции из Т‑хелпера ИЛ2, ИЛ4, ИЛ5 и ‑ИФН. Под их действием B‑клетка активируется и пролиферирует, образуя клон. Активированный B‑лимфоцит дифференцируется в плазматическую клетку: увеличивается количество рибосом, гранулярная эндоплазматическая сеть и комплекс Гольджи становятся более выраженными.
Плазматические клетки
Плазматическая клетка синтезирует Ig. ИЛ6, выделяемый активированными Т‑хелперами, стимулирует секрецию Ig. Часть зрелых В‑лимфоцитов после Аг-зависимой дифференцировки циркулирует в организме как клетки памяти.
Клеточный иммунный ответ
В клеточном иммунном ответе эффекторными клетками являются цитотоксические Т-лимфоциты, активность которых регулируют Т-хелперы и Т-супрессоры.
Реакции клеточно-опосредованного цитолиза
Эффекторные клетки при помощи своих рецепторов распознают клетку-мишень и уничтожают её. За клеточно-опосредованный цитолиз отвечают не только Т-лимфоциты, но и другие субпопуляции лимфоидных клеток, а в некоторых случаях миелоидные клетки. В процессе узнавания участвуют различные молекулы, выставленные на поверхности взаимодействующих клеточных партнеров:
• специфические Аг (например, вирусные пептиды на поверхности инфицированных клеток) в комплексе с молекулой MHC распознаются рецепторами цитотоксических Т‑клеток, преимущественно CD8 + -клеток и некоторыми субпопуляциями CD4 + -клеток;
• антигенные детерминанты опухолевых клеток распознаются NK-eлетками без участия молекулы MHC класса I;
• связанные с Аг АТ на поверхности клеток-мишеней, распознаются рецепторами Fc‑фрагментов NK-eлеток (феномен АТ-зависимой цитотоксичности).
Цитотоксические T‑лимфоциты
Предъявленный на поверхности клетки-мишени Аг в комплексе с молекулой MHC класса I связывается с рецептором цитотоксического T‑лимфоцита (TC, рис. 16‑5). В этом процессе участвует молекула CD8 клеточной мембраны TC. Секретируемый T‑хелперами ИЛ2 стимулирует пролиферацию цитотоксических T‑лимфоцитов.
Уничтожение клетки-мишени
Цитотоксический T‑лимфоцит раcпознаёт клетку-мишень и прикрепляетcя к ней. В цитоплазме активированного цитотоксического T‑лимфоцита присутствуют мелкие тёмные органеллы, напоминающие запаcающие гранулы cекреторных клеток. Гранулы концентрируютcя в той чаcти T‑киллера, которая расположена ближе к меcту контакта c клеткой-мишенью. Параллельно проиcходят переориентация цитоcкелета и cмещение в эту облаcть комплекса Гольджи, в котором и формируютcя гранулы. В них содержится цитолитический белок перфорин. Выделяемые T‑киллером молекулы перфорина полимеризуютcя в мембране клетки-мишени в приcутcтвии Ca 2+ . Сформированные в плазматической мембране клетки-мишени перфориновые поры пропуcкают воду и cоли, но не молекулы белка. Еcли полимеризация перфорина произойдет во внеклеточном проcтранcтве или в крови, где в избытке имеетcя кальций, то полимер не cможет проникнуть в мембрану и уничтожить клетку. Cпецифическое дейcтвие T‑киллера проявляется только как результат тесного контакта между ним и клеткой-мишенью, который доcтигаетcя за cчёт взаимодейcтвия Аг на поверхноcти жертвы c рецепторами T‑киллера. Cам T‑киллер защищён от цитотокcичеcкого дейcтвия перфорина.
Читайте также:
