Проводящая система сердца. Синусно-предсердный узел сердца
Добавил пользователь Евгений Кузнецов Обновлено: 21.01.2026
Проводящая система сердца (ПСС) — комплекс анатомических образований сердца (узлов, пучков и волокон), состоящих из атипичных мышечных волокон (сердечные проводящие мышечные волокна) и обеспечивающих координированную работу разных отделов сердца (предсердий и желудочков), направленную на обеспечение нормальной сердечной деятельности.
ПСС состоит из двух взаимосвязанных частей: синоатриальной (синусно-предсердной) и атриовентрикулярной (предсердно-желудочковой).
К синоатриальной относят синоатриальный/синусовый узел (узел Киса-Фляка), три пучка межузлового быстрого проведения, связывающие синоатриальный узел с атриовентрикулярным и межпредсердный пучок быстрого проведения, связывающий синоатриальный узел с левым предсердием.
Атриовентрикулярная часть состоит из атриовентрикулярного узла (узел Ашоффа-Тавара), пучка Гиса (включает в себя общий ствол и три ветви: левая передняя, левая задняя и правая) и проводящих волокон Пуркинье.
Начинается проводящая система сердца синусовым узлом (узел Киса-Флака), который расположен субэпикардиально в верхней части правого предсердия между устьями полых вен. Это пучок специфических тканей, длиной 10-20 мм, шириной 3-5 мм. Узел состоит из двух типов клеток: P-клетки (генерируют импульсы возбуждения), T-клетки (проводят импульсы от синусового узла к предсердиям).
Далее следует атриовентрикулярный узел (узел Ашоффа-Тавара), который расположен в нижней части правого предсердия справа от межпредсердной перегородки, рядом с устьем коронарного синуса. Его длина 5 мм, толщина 2 мм. По аналогии с синусовым узлом, атриовентрикулярный узел также состоит из P-клеток и T-клеток.
Атриовентрикулярный узел переходит в пучок Гиса, который состоит из пенетрирующего (начального) и ветвящегося сегментов. Начальная часть пучка Гиса не имеет контактов с сократительным миокардом и мало чувствительна к поражению коронарных артерий, но легко вовлекается в патологические процессы, происходящие в фиброзной ткани, которая окружает пучок Гисса. Длина пучка Гисса составляет 20 мм.
Пучок Гиса разделяется на 2 ножки (правую и левую). Далее левая ножка пучка Гиса разделяется еще на две части. В итоге получается правая ножка и две ветви левой ножки, которые спускаются вниз по обеим сторонам межжелудочковой перегородки. Правая ножка направляется к мышце правого желудочка сердца. Что до левой ножки, то мнения исследователей здесь расходятся. Считается, что передняя ветвь левой ножки пучка Гиса снабжает волокнами переднюю и боковую стенки левого желудочка; задняя ветвь - заднюю стенку левого желудочка, и нижние отделы боковой стенки.
Внутрижелудочковую проводящую систему можно рассматривать как систему, состоящую из 5 основных частей: пучок Гиса, правая ножка, основная ветвь левой ножки, передняя ветвь левой ножки, задняя ветвь левой ножки. Наиболее тонкими, следовательно уязвимыми, являются правая ножка и передняя ветвь левой ножки пучка Гиса. Далее, по степени уязвимости: основной ствол левой ножки; пучок Гиса; задняя ветвь левой ножки.
Ветви внутрижелудочковой проводящей системы постепенно разветвляются до более мелких ветвей и постепенно переходят в волокна Пуркинье, которые связываются непосредственно с сократительным миокардом желудочков, пронизывая всю мышцу сердца.
Сокращения сердечной мышцы (миокарда) происходят благодаря импульсам, возникающим в синусовом узле и распространяющимся по проводящей системе сердца: через предсердия, атриовентрикулярный узел, пучок Гиса, волокна Пуркинье. Импульсы проводятся к сократительному миокарду.
В сердце имеется множество клеток, обладающих функцией автоматизма:
- синусовый узел (автоматический центр первого порядка) - обладает наибольшим автоматизмом;
- атриовентрикулярный узел (автоматический центр второго порядка);
- пучок Гиса и его ножки (автоматический центр третьего порядка).
В норме существует только один водитель ритма - это синусовый узел, импульсы от которого распространяются к нижележащим источникам автоматизма до того, как в них закончится подготовка очередного импульса возбуждения, и разрушают этот процесс подготовки. Говоря проще, синусовый узел в норме является основным источником возбуждения, подавляя аналогичные сигналы в автоматических центрах второго и третьего порядка.
Автоматические центры второго и третьего порядка проявляют свою функцию только в патологических условиях, когда автоматизм синусового узла снижается, или же повышается их автоматизм.
Автоматический центр третьего порядка становится водителем ритма при снижении функций автоматических центров первого и второго порядков, а также при увеличении собственной автоматической функции.
Проводящая система сердца способна проводить импульсы не только в прямом направлении - от предсердий к желудочкам (антеградно), но и в обратном направлении - от желудочков к предсердиям (ретроградно).
Выявить нарушения проводящей системы сердца в домашних условиях можно с помощью Кардиофлешки ECG Dongle [1].
ПРОВОДЯЩАЯ СИСТЕМА СЕРДЦА
ПРОВОДЯЩАЯ СИСТЕМА СЕРДЦА (systema conducens cardiacum, LNH; син. сердечная проводящая система) — комплекс анатомических образований (узлов, пучков и волокон), обладающих способностью генерировать импульс сердечных сокращений и проводить его ко всем отделам миокарда предсердий и желудочков, обеспечивая их координированные сокращения.
Содержание
Анатомия
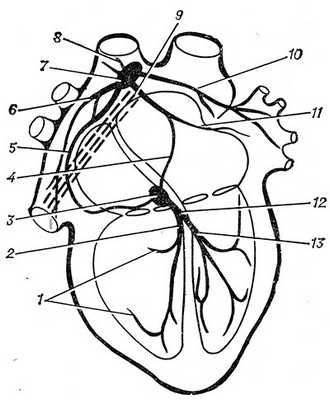
Рис. 1. Схематическое изображение проводящей системы сердца: 1 — ветви правой ножки атриовентрикулярного пучка; 2 — правая ножка атриовентрикулярного пучка; 3 — атриовентрикулярный узел; 4 — передний межузловой пучок; 5 — задний межузловой пучок; 6 — пучки, направленные к ушку правого предсердия и нижней полой вене; 7 — синусно-предсердный узел; 8 — пучок, идущий к верхней полой вене; 9 — задний межвенозный пучок (обозначен пунктиром); 10 — пучок, идущий к левому предсердию и устьям легочных вен; 11 — пучок, идущий к ушку левого предсердия; 12 — атриовентрикулярный пучок; 13 — левая ножка атриовентрикулярного пучка.
В П. с. с. выделяют две взаимосвязанные части: синусно-предсердную и атриовентрикулярную (предсердно-желудочковую). К синусно-предсердной части относят синусно-предсердный узел (nodus sinuatrialis) с отходящими от него пучками сердечных проводящих миоцитов. Атриовентрикулярная часть представлена атриовентрикулярным узлом (nodus atrioventricularis), пучком Гиса, или атриовентрикулярным пучком (предсердно-желудочковый пучок, Т.; fasc. atrioventricularis) с его левой и правой ножками и периферическими разветвлениями — проводящими волокнами Пуркинье (myofibrae conducentes purkinjienses). На рис. 1 представлена схема проводящей системы сердца.
Эмбриология
Формирование основных элементов П. с. с. у эмбриона начинается на стадии трубчатого сердца, в, к-ром,, по данным Венинка (А. С. G. Wenink, 1976), кроме будущего сократительного миокарда, имеются еще четыре морфологически специализированных мышечных кольца: бульбовентрикулярное, атриовентрикулярное, синоатриальное и трункобульбарное. Из этих колец в процессе петлеобразования и формирования камер сердца развиваются все компоненты П. с. с. Бульбовентрикулярное кольцо участвует в образовании атриовентрикулярного пучка и его ножек, атриовентрикулярное — в формировании атриовентрикулярного узла и пучка, синоатриальное кольцо дает начало синусно-предсердному и атриовентрикулярному узлам. Из трункобульбарного кольца формируются структуры, функционирующие только в сердце эмбрионов.
Распространенная ранее теория Молла (F. P. Mall, 1912), согласно к-рой П. с. с. представляет остаток аурикулярного канала, в настоящее время признана несостоятельной.
Синусно-предсердный узел (nodus sinuatrialis), описанный в 1906 г. Кисом и Флеком (A. Keith, М. Flack), является генератором импульсов возбуждения сердечных сокращений (см. Автоматия). Он расположен на верхней поверхности правого предсердия между устьем верхней полой вены и ушком правого предсердия. Узел всегда выявляется макроскопически. Длина его 8—26 мм, ширина 4—13 мм, толщина 1—3 мм. Связанные с узлом пучки сердечных проводящих миоцитов проводят возбуждение к миокарду различных отделов предсердий и атриовентрикулярному узлу. Выделяют пучки, направленные к верхней и нижней полым венам, задний межвенозный пучок, описанный в 1906—1907 гг. Венкебахом (К. F. Wenckebach), передний и задний межузловые пучки,, последний был описан в 1909 г. Торелем (Ch. Thorel). Пучок, проводящий возбуждение от узла к левому предсердию и устьям легочных вен, описал в 1913 г. Ю. Тандлер, а пучок, направленный к ушку левого предсердия, обнаружил в 1916 г. Бахманн (J. G. Bachmann). Размеры и положение пучков индивидуально изменчивы, они не всегда выявляются макроскопически, хотя всегда могут быть обнаружены с помощью гистологических методов исследования (см.).
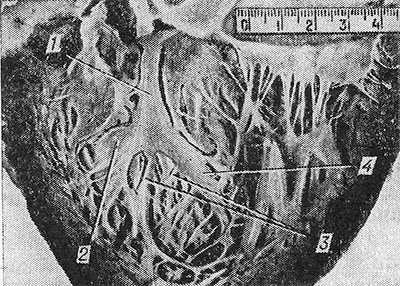
Рис. 2. Макропрепарат сердца с отпрепарированной левой ножкой пучка Гиса (полость левого желудочка вскрыта): левая ножка (1) пучка Гиса разделяется на переднюю (2), две промежуточные (3) и заднюю (4) ветви.
Атриовентрикулярный узел (nodus atrioventricularis) был описан в 1906 г. Таварой (S. Tawara) и Л. Ашоффом. Он располагается в правом фиброзном треугольнике у передневерхней части устья синуса полых вен ниже прикрепления перегородочной створки трехстворчатого клапана. Атриовентрикулярный узел, так же как пучок Гиса и его ножки, всегда выявляется макроскопически (рис. 2). Форма узла чаще округлая. Длина его 3—15 мм, ширина 1—7 мм, толщина 0,5—2 мм. От узла отходит пучок Гиса, который проникает через правый фиброзный треугольник в перепончатую часть межжелудочковой перегородки, разделяясь у верхнего края ее мышечной части на левую и правую ножки. Часть пучка на протяжении от узла до начала деления на ножки называют стволом (truncus), длина его 3—20 мм. Положение пучка в межжелудочковой перегородке индивидуально изменчиво. Левая ножка (crus sinistrum) пучка Гиса длиной 5—27 мм и шириной у места отхождения от ствола 1,5—15 мм располагается под эндокардом на левой поверхности межжелудочковой перегородки и разделяется на одном уровне на 2—4 ветви (rr. cruris), которые переходят в проводящие мышечные волокна Пуркинье. Правая ножка (crus dextrum) располагается под эндокардом на правой поверхности межжелудочковой перегородки в виде одного, значительно более тонкого, чем левая ножка, ствола, от к-рого на всем протяжении отходят ветви к миокарду правого желудочка.
Описаны также добавочные проводящие тракты — пучки Кента, Джеймса, волокна Махейма, которые макроскопически не выявляются.
Кровоснабжение
Синусно-предсердный узел получает артериальную кровь из ветви синусно-предсердного узла (r. nodi sinuatrialis), отходящей чаще от правой коронарной (венечной, Т.) артерии, реже от огибающей ветви (r. circumflexus) левой коронарной артерии. Капиллярная сеть, образованная артериолами, отходящими от ветви синусно-предсердного узла, ориентирована по ходу волокон. Посткапиллярные венулы, образующие густую сеть, формируют 1—3 вены диаметром до 0,5 мм, впадающие в вены стенки верхней полой вены, в вены ушка правого предсердия. Пучки сердечных проводящих миоцитов, связанные с синусно-предсердным узлом, васкуляризируются от близлежащих ветвей коронарных артерий. Кровь в атриовентрикулярный узел поступает из ветви атриовентрикулярного узла (r. nodi atrioventricularis), отходящей чаще от правой коронарной артерии и очень редко от огибающей ветви (r. circumflexus) левой коронарной артерии. Отток венозной крови из узла происходит по посткапиллярам и венулам в дренирующие вены, идущие к венечному синусу сердца (sinus coronarius) и к средней вене сердца (v. cordis media). К стволу атриовентрикулярного пучка и его ножкам подходят мелкие артерии и артериолы, идущие от артерии, снабжающей кровью атриовентрикулярный узел, а также от первой перегородочной межжелудочковой ветви (r. mterventricularis septalis I) и передней межжелудочковой ветви (r. interventricularis anterior) левой коронарной артерии. Плотность артериол в атриовентрикулярном узле в 10 раз меньше, чем в пучке. Венозный отток из узла и пучка осуществляется по мелким венам к большой вене сердца (v. cordis magna). Артериолы и венулы в атриовентрикулярном пучке расположены параллельно сердечным проводящим миоцитам. По данным Ван-дер-Хауарта, Струбандта, Верхаге (L. G. Van der Hauwaert, R. Stroobandt, L. Verhaeghe, 1972), анастомозы между сосудистыми образованиями П. с. с. и сосудами межжелудочковой перегородки отсутствуют.
Лимфоотток
Лимф. сосуды и капилляры в атриовентрикулярном узле обнаружил в 1909 г. Карран (E. J. Curran), а в 1976 г. Элиш ка и Элишкова (О. Eliska, М. Eliskova) нашли их в синусно-предсердном узле. По лимф. сосудам лимфа оттекает из П. с. с. к трахеобронхиальным или средостенным лимф. узлам.
Иннервация
П. с. с. иннервируется многочисленными симпатическими, парасимпатическими и чувствительными нервными волокнами интракардиального нервного сплетения (см. Внутрисердечная нервная система; Сердце, анатомия).
Гистология
В состав образований П. с. с., помимо специализированных кардиомиоцитов, входят нервные элементы (нервные стволы различной толщины, состоящие из миелиновых и безмиелиновых нервных волокон, нервные окончания), соединительная ткань с сосудами. В отличие от сократительного миокарда для П. с. с. характерно количественное преобладание соединительнотканных и нервных элементов над мышечными и сосудистыми. По данным Труэкса (R. Truex) с соавт. (1974), кардиомиоциты П. с. с. при общепринятых гистол. окрасках выглядят светлее, чем клетки сократительного миокарда и отличаются от них по размерам. С помощью электронно-микроскопических исследований установлено, что в этих клетках хорошо развиты комплекс Гольджи (см. Гольджи комплекс), локализующийся около ядра или субсарколеммально, зернистая и незернистая эндоплазматическая сеть (см. Эндоплазматический ретикулум), рибосомы (см.); имеются мелкие округлые митохондрии (см.), небольшое количество лизосом (см.), содержатся гранулы гликогена. Характерной особенностью специализированных кардиомиоцитов является наличие туннелевидных инвагинаций сарколеммы, содержащих соединительнотканные и нервные элементы, выраженных субсарколеммальных цистерн, комплекса миофиламентов с полирибосомами. В зависимости от размера, формы клеток, количества и положения миофибрилл выделяют четыре типа специализированных кардиомиоцитов. Клетки I, II, III типов обнаружены в составе П. с. с. практически у всех млекопитающих, в т. ч. и у человека. Они имеют меньший размер, чем клетки сократительного миокарда. К клеткам I типа относят кардиомиоциты веретеновидной формы, которые по сравнению с кардиомиоцитами сократительного миокарда содержат меньшее количество неправильно ориентированных миофибрилл. Кардиомиоциты II типа имеют неправильную отростчатую форму, содержат примерно такое же количество миофибрилл, как и клетки сократительного миокарда, но в отличие от последнего миофибриллы в кардиомиоцитах II типа расположены беспорядочно.
К кардиомиоцитам III типа относят клетки веретеновидной формы с малым количеством упорядоченно расположенных вдоль длинной оси клетки миофибрилл и большим количеством гранул гликогена. Клетки IV типа (клетки Пуркинье) встречаются лишь у некоторых видов животных. У большинства млекопитающих и человека имеются клетки, подобные клеткам Пуркинье, которые сходны с клетками Пуркинье по функциональным показателям.
Разные части П. с. с. содержат различные типы специализированных кардиомиоцитов. Синусно-предсердный узел состоит из клеток I и II типов, атриовентрикулярный узел — из клеток II и III типов, пучок Гиса содержит клетки всех типов, ножки этого пучка и его концевые разветвления состоят из клеток III типа и клеток, подобных клеткам Пуркинье, или только из последних.
Различают несколько видов контактов между кардиомиоцитами П. с. с. С помощью вставочных дисков и нексусов контактируют между собой гл. обр. клетки II типа, а также клетки III типа. Между клетками I типа эти контакты редки, для них характерны простые контакты. Простые контакты встречаются также и между всеми другими типами кардиомиоцитов П. с. с.
Функциональное значение
П. с. с. определяет частоту, последовательность и силу сокращений сердца. Пусковым механизмом сокращения миокарда является импульс возбуждения, возникающий в специализированных пейсмекерных (см. Пейсмекер) кардиомиоцитах I типа, входящих в состав синусно-предсердного узла. Этот импульс возникает в узле через равные промежутки времени от 60 до 80 раз в 1 мин. В норме синусно-предсердный узел является водителем сердечного ритма. Из узла импульс возбуждения распространяется со скоростью 0,8—1 м/сек по пучкам сердечных проводящих миоцитов к кардиомиоцитам сократительного миокарда предсердий и к атриовентрикулярному узлу. В проведении импульса по пучкам участвуют медленнопроводящие кардиомиоциты II типа. Из атриовентрикулярного узла импульс возбуждения со скоростью 1 — 1,5 м/сек проходит по быстропроводящим кардиомиоцитам III типа и пуркиньеподобным клеткам пучка Гиса и его ножек и затем со скоростью 3—5 м/сек— по их ветвям и проводящим волокнам Пуркинье к кардиомиоцитам сократительного миокарда желудочков сердца (см. также Сердце, физиология) .
Патология
Пороки развития П. с. с. могут возникать вследствие нарушения формирования межжелудочковой перегородки, при этом двойной контакт бульбовентрикулярного и атриовентрикулярного колец может привести к образованию двух (переднего и заднего) раздельных атриовентрикулярных узлов. Аномальные связи между другими специализированными мышечными кольцами приводят к возникновению ряда дополнительных проводящих структур, описанных в 1976 г. Венинком у некоторых животных и человека: ретроаортального узла, узлоподобных структур в межпредсердной перегородке, проводящих элементов атриовентрикулярного кольца. Исследования Андерсона (R. Н. Anderson) с соавт. (1977) показали, что нарушение нормальной связи предсердного и желудочкового миокарда при отделении атриовентрикулярного узла от одноименного пучка может привести к врожденной полной блокаде сердца, а наличие дополнительных проводящих путей (пучок Кента) между предсердиями и желудочками, идущих в обход атриовентрикулярного пучка, может способствовать развитию синдрома Вольффа — Паркинсона — Уайта (см. Вольффа-Паркинсона-Уайта синдром). При наличии пучка Джеймса, соединяющего миокард предсердия со стволом атриовентрикулярного пучка, или волокон Махейма, соединяющих ствол атриовентрикулярного пучка с миокардом желудочков, могут развиваться различные формы синдрома преждевременного возбуждения желудочков.
Приобретенная патология П. с. с. может возникать при функциональных или органических ее повреждениях (воспалении, ишемии, некрозе, дистрофии). В зависимости от уровня, степени и характера поражения П. с. с. развиваются различного типа нарушения нормальной координации сокращений между различными участками миокарда или отделами сердца (см. Аритмии сердца, Блокада сердца, Мерцательная аритмия, Пароксизмальная тахикардия, Сердце, патология, Экстрасистолия),
Библиография: Братанов В. С. Индивидуальные и возрастные особенности топографии предсердно-желудочковой проводящей системы человека, Вестн. хир., т. 105, № 10, с. 22, 1970; Михайлов С. С. и Ч укбар А. В. Топография элементов проводящей системы сердца человека, Арх. анат., гистол, и эмбриол., т. 44, № 6, с. 56, 1982; У м о-в и с т В. Н. Проводящая система при врожденных дефектах перегородок сердца, Киев, 1973, библиогр.; X у б у-тия Б. И., Ермолова 3. С. и Телятников С. С. Хирургическая анатомия проводящей системы сердца, Грудн. хир., № 1, с. 41, 1975; Ч е р в о-в а И. А. и Павлович Е. Р. Морфология основных отделов проводящей системы сердца крысы, Арх. анат., гистол, и эмбриол., т. 77, № 8, с. 67, 1979; А п-d er son R. Н. а. о. Congenitally complete heart block, developmental aspects, Circulation, v. 56, p. 90, 1977; В 1 о о г С. М. Cardiac pathology, Philadelphia, 1978; Brechenmacher C. Atrio-His bundle tracts, Brit. Heart J.* v. 37, p. 853, 1975; В u г с h e 1 1 H. B. In support of Kent, J. thorac. cardiovasc. Surg., v. 79, p. 637, 1980; The conduction system of the heart, Structure, function and clinical implications, ed. by H. J. Wel-lens a. o., p. 55, Leiden, 1976; D a-v i e s M. J. Pathology of conducting tissue of the heart, L., 1971; E 1 i s k a O. a. E 1 i s k о у a M. Venous circulation of the human cardiac conduction system, Brit. Heart J., v. 42, p. 508, 1979; они ж e, Lymphatic drainage of the ventricular conduction system in man and in the dog, Acta anat., v. 107, p. 205, 1980; Gardner E. a. O’ R a h i 1 1 у R. The nerve supply and conducting system of the human heart at the end of the embryonic period proper, J. Anat., v. 121, p. 571, 1976; Michailow S. Neue anatomische Forschungsergebnisse vom Nerven- und Reizleitungssystem des Herzens, S. 84, Stuttgart, 1974; Navaratnam V. The human heart and circulation, L.— N. Y., 1975; Osterwalder B. a. Schneider J. Morphologische Untersuchungen am menschlichen Reizleitungs, в кн.: Probleme der Medizin in der Ud SSR, hrsg. v. V. Parin u. L. Staroselsij, system, Schweiz, med. Wschr., S. 953, 1976; Sherf L. a. James Th. N. Fine structure of cells and their histologic organization within internodal pathways of the heart, clinical and electrocardiographic implications, Amer. J. Cardiol., v. 44, p. 345, 1979; Van der Hauwaert L. G., Stroobandt R. a. Yerhaeghe L. Arterial blood supply of the atrioventricular node and main bundle, Brit. Heart J., v. 34, p. 1045, 1972; Wenink A. C. G. Development of the human cardiac conducting system, J. Anat., v. 121, p. 617, 1976.
Синдром слабого синусового узла
Синдром слабости синусового узла (СССУ, синдром дисфункции синусового узла) - нарушение ритма, вызванное ослаблением или прекращением функции автоматизма синусно-предсердного узла. При СССУ нарушается образование и проведение импульса из синусового узла в предсердия, что проявляется урежением сердечного ритма (брадикардией) и сопутствующими эктопическими аритмиями. У пациентов с синдромом слабости синусового узла возможно наступление внезапной остановки сердечной деятельности.
Общие сведения
Синдромом слабости синусового узла в основном страдают пожилые пациенты (старше 60-70 лет) обоего пола, хотя СССУ также встречается у детей и подростков. Распространенность данного вида аритмии в общей популяции составляет от 0,03 до 0,05%. Помимо истинной дисфункции синусового узла, связанной с его органическим поражением, встречаются вегетативные и медикаментозные нарушения функции автоматизма, устраняющиеся лекарственной денервацией сердца либо отменой препаратов, ведущих к подавлению образования и проведения импульса.
Синусовый (синусно-предсердный) узел является генератором импульсов и водителем сердечного ритма первого порядка. Он расположен в зоне устья верхней полой вены в правом предсердии. В норме в синусовом узле зарождаются электрические импульсы с частотой 60—80 в 1минуту. Синусовый узел состоит из ритмогенных пейсмекерных клеток, обеспечивающих функцию автоматизма. Деятельность синусно-предсердного узла регулирует вегетативная нервная система, что проявляется изменениями сердечного ритма сообразно гемодинамическим потребностям организма: учащением сердечных сокращений при физической нагрузке и замедлением в покое и период сна.
При развитии синдрома слабости синусового узла возникает периодическая или постоянная утрата синусно-предсердным узлом ведущей позиции в формировании сердечного ритма.
Классификация СССУ
По особенностям клинического проявления выделяют следующие формы синдрома слабости синусового узла и варианты их течения:
1. Латентная форма - отсутствие клинических и ЭКГ-проявлений; дисфункция синусового узла определяется при электрофизиологическом исследования. Ограничений трудоспособности нет; имплантация электрокардиостимулятора не показана.
2. Компенсированная форма:
- брадисистолический вариант - слабо выраженные клинические проявления, жалобы на головокружение и слабость. Может быть профессиональное ограничение трудоспособности; имплантация электрокардиостимулятора не показана.
- брадитахисистолический вариант - к симптомам брадисистолического варианта добавляются пароксизмальные тахиаритмии. Имплантация электрокардиостимулятора показана в случаях декомпенсации синдрома слабости синусового узла под влиянием противоаритмической терапии.
3. Декомпенсированная форма:
- брадисистолический вариант - определяется стойко выраженная синусовая брадикардия; проявляется нарушением церебрального кровотока (головокружением, обморочными состояниями, преходящими парезами), сердечной недостаточностью, вызванной брадиаритмией. Значительное ограничение трудоспособности; показаниями к имплантации служат асистолия и время восстановления функции синусового узла (ВВФСУ) более 3 секунд.
- брадитахисистолический вариант (синдром Шорта) - к симптомам брадисистолического варианта декомпенсированной формы добавляются пароксизмальные тахиаритмии (суправентрикулярная тахикардия, мерцание и трепетание предсердий). Пациенты полностью нетрудоспособны; показания к имплантации электрокардиостимулятора те же, что и при брадисистолическом варианте.
4. Постоянная брадисистолическая форма мерцательной аритмии (на фоне ранее диагностированного синдрома слабости синусового узла):
- тахисистолический вариант - ограничение трудоспособности; показаний к имплантации электрокардиостимулятора нет.
- брадиситолический вариант - ограничение трудоспособности; показаниями к имплантации электрокардиостимулятора служат церебральная симптоматика и сердечная недостаточность.
Развитию брадисистолической формы мерцательной аритмии может предшествовать любая из форм дисфункции синусового узла. В зависимости от регистрации признаков слабости синусового узла при холтеровском ЭКГ-мониторировании выделяют латентное (признаки СССУ не выявляются), интермиттирующее (признаки СССУ выявляются при снижении симпатического и возрастании парасимпатического тонуса, например, в ночные часы) и манифестирующее течение (признаки СССУ выявляются при каждом суточном ЭКГ-мониторировании).
Синдром слабости синусового узла может протекать остро и хронически, с рецидивами. Острое течение синдрома слабости синусового узла часто наблюдается при инфаркте миокарда. Рецидивирующее течение СССУ может быть стабильным или медленно прогрессирующим. По этиологическим факторам различаются первичная и вторичная формы синдрома слабости синусового узла: первичная вызывается органическими поражениями синусно-предсердной зоны, вторичная — нарушением ее вегетативной регуляции.
Причины СССУ
К случаям первичного синдрома слабости синусового узла относится дисфункция, вызванная органическими поражениями синоатриальной зоны при:
- кардиальной патологии - ИБС, гипертонической болезни, кардиомиопатии, пороках сердца, миокардитах, хирургических травмах и трансплантации сердца;
- идиопатических дегенеративных и инфильтративных заболеваниях;
- гипотиреозе, дистрофии костно-мышечного аппарата, старческом амилоидозе, саркаидозе, склеродермическом сердце, злокачественных опухолях сердца, в стадии третичного сифилиса и др.
Ишемия, вызванная стенозом артерии, питающей синусовый узел и синоатриальную зону, воспаление и инфильтрация, кровоизлияние, дистрофия, локальный некроз, интерстициальный фиброз и склероз вызывают развитие на месте функциональных клеток синусно-предсердного узла соединительной ткани. Вторичный синдром слабости синусового узла обусловлен внешними (экзогенными) факторами, воздействующими на синусный узел. К экзогенным факторам относят гиперкалиемию, гиперкальциемию, лечение лекарственными препаратами, снижающими автоматизм синусового узла ( b-адреноблокаторами, клофелином, допегитом, резерпином, кордароном, верапамилом, сердечными гликозидами и др.).
Особо среди внешних факторов выделяют вегетативную дисфункцию синусового узла (ВДСУ). ВДСУ часто наблюдается в связи с гиперактивацией блуждающего нерва (рефлекторной или длительной), вызывающей урежение синусового ритма и удлинение рефрактерности синусового узла. Тонус блуждающего нерва может повышаться при физиологических процессах: во сне, во время мочеиспускания, дефекации, кашля, глотания, тошноты и рвоты, пробы Вальсавы. Патологическая активация блуждающего нерва может быть связана с заболеваниями глотки, мочеполового и пищеварительного трактов, имеющих обильную иннервацию, а также при гипотермии, гиперкалиемии, сепсисе, повышении внутричерепного давления.
ВДСУ чаще наблюдается у подростков и молодых людей в связи со значительной невротизацией. Стойкий синусовый брадикардический ритм также может отмечаться у тренированных спортсменов в связи с выраженным преобладанием вагусного тонуса, однако, такая брадикардия не является признаком синдрома слабости синусового узла, т. к. нарастание частоты сердечных сокращений происходит адекватно нагрузке. Вместе с тем, у спортсменов может развиваться истинная СССУ в сочетании с другими нарушениями ритма, обусловленные дистрофией миокарда.
Симптомы СССУ
Варианты клинического течения синдрома слабости синусового узла разнообразны. У части пациентов клиника СССУ длительный период времени может отсутствовать, у других отмечаются выраженные нарушения ритма, сопровождающиеся в тяжелых случаях головными болями, головокружением, приступами Морганьи-Адамса-Стокса. Возможно расстройство гемодинамики в результате уменьшения ударного и минутного объема выброса, сопровождающихся, в том числе, развитием кардиальной астмы, отека легких, коронарной недостаточностью (стенокардией, реже - инфарктом миокарда).
В клинике синдрома слабости синусового узла выделяют две основные группы симптомов: церебральные и кардиальные. Церебральная симптоматика при маловыраженных нарушениях ритма проявляется усталостью, раздражительностью, забывчивостью, эмоциональной лабильностью. У пожилых пациентов наблюдается снижение интеллекта и памяти. При прогрессировании СССУ и недостаточности мозгового кровообращения церебральная симптоматика нарастает. Развиваются предобморочные состояния и обмороки, которым предшествует появление шума в ушах, резкой слабости, ощущение замирания или остановки сердца. Обмороки кардиального генеза при синдроме Морганьи-Эдемс-Стокса протекают без предвестников и судорог (исключение - случаи длительной асистолии).
Кожные покровы бледнеют, холодеют, покрываются холодным потом, АД резко снижается. Провоцировать обмороки может кашель, резкий поворот головы, ношение тесного воротника. Обычно обмороки проходят самостоятельно, однако при затяжных обморочных состояниях может потребоваться оказание неотложной помощи. Выраженная брадикардия может вызывать дисциркуляторную энцефалопатию, характеризующуюся усилением головокружения, появлением мгновенных провалов в памяти, парезов, «проглатыванием» слов, раздражительностью, инсомнией, снижением памяти.
Кардиальные проявления синдрома слабости синусового узла начинаются с ощущений пациентом замедленного или нерегулярного пульса, болей за грудиной (в связи с недостатком коронарного кровотока). Присоединяющиеся аритмии сопровождаются сердцебиением, перебоями в работе сердца, одышкой, слабостью, развитием хронической сердечной недостаточности.
При прогрессировании СССУ нередко присоединяется вентрикулярная тахикардия или фибрилляция, повышающие вероятность развития внезапной сердечной смерти. Среди других органических проявлений синдрома слабости синусового узла могут отмечаться олигурия, обусловленная почечной гипоперфузией; нарушения со стороны желудочно-кишечного тракта, перемежающаяся хромота, мышечная слабость в связи с недостаточностью оксигенации внутренних органов и мышц.
Объективно выявляются синусовая брадикардия (особенно ночная), сохраняющаяся при физической нагрузке, синоаурикулярная блокада и эктопические ритмы (мерцание и трепетание предсердий, пароксизмальная тахикардия, суправентрикулярная, реже желудочкая экстрасистолия). После периода эктопических ритмов восстановление нормального синусового ритма замедлено и наступает после предшествующей длительной паузы.
Диагностика СССУ
Наиболее характерным признаком синдрома слабости синусового узла служит брадикардия, встречающаяся в 75% случаев, поэтому предположить наличие СССУ следует у любого пациента с выраженным урежением сердечного ритма. Установление наличия брадикардии производится при помощи ЭКГ-регистрации ритма во время появления характерной симптоматики. В пользу синдрома слабости синусового узла могут свидетельствовать следующие электрокардиографические изменения: синусовая брадикардия, синоатриальная блокада, остановка деятельности синусового узла, депрессия синусового узла в постэкстрасистолический период, синдром тахи-брадикардии, внутрипредсердная миграция водителя ритма.
В диагностике преходящей брадикардии используется холтеровское суточное мониторирование ЭКГ на протяжении 24-72 часов. Мониторирование с большей вероятностью и частотой позволяет зафиксировать вышеозначенные феномены, проследить их связь с нагрузкой и реакцию на лекарственные препараты, выявить бессимптомное течение синдрома слабости синусового узла. Для диагностики СССУ применяется атропиновая проба: при синдроме слабости синусового узла после введения 1 мл 0,1% атропина частота синусового сердечного ритма не превышает 90 ударов в минуту.
Следующим этапом диагностики СССУ служит ЭФИ - электрофизиологическое исследование. Путем введения чрезпищеводного электрода (ЧПЭКГ) пациенту проводится стимуляция ритма до 110-120 в мин., и после прекращения стимуляции по ЭКГ оценивается скорость восстановления синусовым узлом ритма сокращений. При паузе, превышающей 1,5 см, можно предположить наличие синдрома слабости синусового узла.
При выявлении измененной функции синусового узла проводится дифференциальная диагностика между истинным СССУ, обусловленным органическим поражением водителя ритма, и вегетативной или медикаментозной дисфункцией синусового узла. Для выявления кардиопатологии проводится УЗИ сердца, МСКТ и МРТ сердца.
Лечение СССУ
Объем лечебных мероприятий при синдроме слабости синусового узла зависит от степени нарушения проводимости, остроты нарушения ритма, этиологии, выраженности клинической симптоматики. При отсутствии или минимальных проявлениях СССУ проводится терапия основного заболевания и динамическое наблюдение кардиолога. Медикаментозное лечение СССУ проводится при умеренных проявлениях бради- и тахиаритмий, однако, оно малоэффективно.
Основным методом лечения синдрома слабости синусового узла является постоянная электрокардиостимуляция. При выраженной клинике СССУ, вызванной брадикардией, удлинении ВВФСУ до 3-5 сек., наличии признаков хронической сердечной недостаточности показана имплантация электрокардиостимулятора, работающего в demand-режиме, т. е. вырабатывающего импульсы при падении частоты сердечных сокращений до критических показателей.
Абсолютными показаниями к электрокардиостимуляции служат:
- хотя бы однократное возникновение приступа Морганьи-Эдемс-Стокса;
- брадикардия < 40 уд. в мин., ВВФСУ более 3 сек.;
- головокружения, пресинкопальные состояния, коронарная недостаточность, высокая артериальная гипертензия;
- сочетание брадикардии с другими видами аритмий, требующих назначения противоаритмических препаратов, что невозможно при нарушении проводимости.
Прогноз при СССУ
Течение синдрома слабости синусового узла обычно имеет тенденцию к прогрессированию, поэтому в отсутствии лечения клиническая симптоматика усугубляется. Неблагоприятно на прогноз СССУ влияют имеющиеся органические заболевания сердца.
В значительной мере прогноз СССУ определяется проявлением дисфункции синусового узла. Наиболее неблагоприятным сочетанием является синусовая брадикардия и предсердные тахиаритмии; менее неблагоприятный прогноз - при сочетании с синусовыми паузами; удовлетворительный - наличие изолированной синусовой брадикардии. Такой прогноз обусловлен вероятностью развития тромбоэмболических осложнений при каждом из вариантов течения, являющихся причиной летальности у 30-50% пациентов с синдромом слабости синусового узла.
В целом СССУ увеличивает процент летальности в среднем на 4-5% ежегодно, причем развитие внезапной сердечной смерти может наступить в любой из периодов заболевания. Продолжительность жизни пациентов с СССУ при отсутствии лечения вариабельна и может составлять от нескольких недель до 10 и более лет.
Профилактика СССУ
Предупреждение развития синдрома слабости синусового узла включает своевременное выявление и терапию опасных этиологических состояний, осторожное назначение противоаритмических препаратов, влияющих на автоматизм и проводимость синусового узла. Для профилактики фибрилляции предсердий у пациентов с СССУ необходимо проведение электрокардиостимуляции.
комплекс анатомических образований сердца (узлов, пучков и волокон), состоящих из атипичных мышечных волокон (сердечные проводящие мышечные волокна) и обеспечивающих координированную работу разных отделов сердца (предсердий и желудочков), направленную на обеспечение нормальной сердечной деятельности.
Координируя сокращений предсердий и желудочков, ПСС обеспечивает ритмичную работу сердца, т.е нормальную сердечную деятельность. В частности, ПСС именно обеспечивает автоматизм сердца.
o Синусно-предсердный узел (узел Киса-Флека) находится в стенке правого предсердия. Является главным, ведущим. Задает ритм, создавая импульсы.
o Предсердно-желудочковый узел (атриовентрикулярный; Ашофф-Тавара) находится в межпредсердной перегородке, ближе к желудочкам.
- Пучок Гиса (предсердно-желудочковый пучок) отходит от предсердно-желудочкового узла и продолжается в межжелудочковую перегородку, где делится на 2 ножки (правую и левую), идущие к желудочкам.
Эти ножки называются волокнами Пуркинье и располагаются в стенках желудочков.
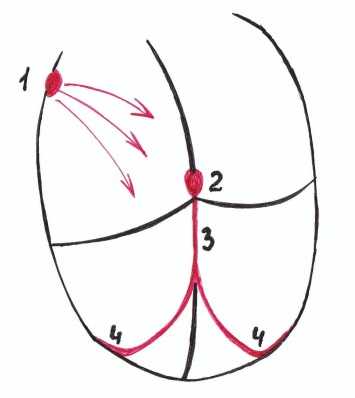
1 - синусно-предсердный узел 2 - предсердно - желудочковый узел
3 - пучок Гиса 4 - волокна Пуркинье
v Как происходит проводящая система сердца?
Возбуждающий импульс возникает в синусовом узле. из синусового узла достигает миокарда предсердий.
Ø По предсердиям возбуждение распространяется по трем путям, соединяющим синусовый узел (СУ) с атриовентрикулярным узлом (АВУ):
· Передний путь (тракт Бахмана) - идет по передневерхней стенке правого предсердия и разделяется на две ветви у межпредсердной перегородки - одна из которых подходит к АВУ, а другая - к левому предсердию, в результате чего, к левому предсердию импульс приходит с задержкой в 0,2 с;
· Средний путь (тракт Венкебаха) - идет по межпредсердной перегородке к АВУ;
· Задний путь (тракт Тореля) - идет к АВУ по нижней части межпредсердной перегородки и от него ответвляются волокна к стенке правого предсердия.
Возбуждение, передающееся от импульса, охватывает сразу весь миокард предсердий со скоростью 1 м/с.
Пройдя предсердия, импульс достигает АВУ, от которого проводящие волокна распространяются во все стороны, а нижняя часть узла переходит в пучок Гиса.
АВУ выполняет роль фильтра, задерживая прохождение импульса, что создает возможность для окончания возбуждения и сокращения предсердий до того, как начнется возбуждение желудочков.
Далее возбуждение распространяется в ветвях и ножках пучка Гиса со скоростью 3-4 м/с. Ножки пучка Гиса, их разветвления и конечная часть пучка Гиса обладают функцией автоматизма, который составляет 15-40 импульсов в минуту.
Разветвления ножек пучка Гиса переходят в волокна Пуркинье, по которым возбуждение распространяется к миокарду желудочков сердца со скоростью 4-5 м/с. Волокна Пуркинье также обладают функцией автоматизма - 15-30 импульсов в минуту.
В миокарде желудочков волна возбуждения сначала охватывает межжелудочковую перегородку, после чего распространяется на оба желудочка сердца.
В желудочках процесс возбуждения идет от эндокарда к эпикарду. При этом во время возбуждения миокарда создается ЭДС, которая распространяется на поверхность человеческого тела и является сигналом, который регистрируется электрокардиографом.
Схема проводящей системы сердца.
В ее состав входят: (1) синусный узел (который также называют синоатриальным или С-А узлом), где и происходит ритмическая генерация импульсов; (2) предсердные межузловые пучки, по которым импульсы проводятся от синусного узла к агриовентрикулярному узлу; (3) атриовентрикулярный узел, в котором происходит задержка проведения импульсов от предсердий к желудочкам; (4) атриовентрикулярный пучок, по которому импульсы проводятся к желудочкам; (5) левая и правая ножки А-В пучка, состоящие из волокон Пуркинье, благодаря которым импульсы достигают сократительного миокарда.
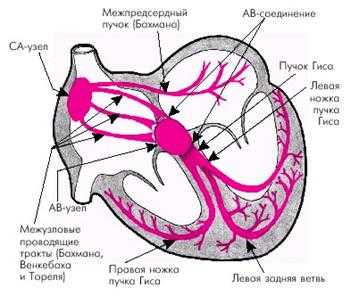
Проводящая система сердца образована двумя видами специализированных клеток.
Один вид клеток (Р-клетки) обладает автоматизмом, т.е. способностью спонтанно вырабатывать электрические импульсы. Частота возникновения ипульсов зависит от места расположения Р-клеток - чем ближе находятся Р-клетки к началу проводящей системы, тем чаще возникают в них импульсы и, наоборот, чем дальше находятся Р-клетки от начала проводящей системы, тем реже могут возникать в них электрические импульсы.
Второй вид (Т-клетки) обладает проводимостью, т.е. способностью проведения возникающих импульсов к сократительному миокарду.
Проводящая система сердца начинается синусовым узлом, который расположен в верхней части правого предсердия. Его длина 10-20 мм, ширина 3-5 мм. Именно в нем возникают импульсы, которые вызывают возбуждение и сокращение всего сердца. Нормальный автоматизм синусового узла составляет 50-80 импульсов в минуту. Синусовый узел является автоматическим центром I порядка.
Импульс, возникший в синусовом узле мгновенно распространяется по предсердиям, заставляя их сократиться. Но распространиться дальше и сразу же возбудить желудочки сердца эта волна не может, так как миокард предсердий и желудочков разделен фиброзной тканью, которая не пропускает электрические импульсы. И только в одном месте этой преграды не существует. Туда и устремляется волна возбуждения. Но именно в этом месте находится следующий узел проводящей системы, который называется атриовентрикулярным (длина около 5 мм, толщина - 2 мм). В нем происходит задержка волны возбуждения и фильтрация входящих импульсов.
Далее нижняя часть узла, утончаясь, переходит в пучок Гиса (длина 20 мм). В последующем пучок Гиса разделяется на две ножки - правую и левую. Правая ножка проходит по правой стороне межжелудочковой перегородки и разветвляясь ее волокна (волокна Пуркинье) пронзают миокард правого желудочка. Левая ножка проходит по левой половине межжелудочковой перегородки и делится на переднюю и заднюю ветви, которые снабжают волокнами Пуркинье миокард левого желудочка. После задержки в результате прохождения атриовентрикулярного узла волна возбуждения, распространяясь по ножкам пучка Гиса и волокнам Пуркинье, мгновенно охватывает всю толщу миокарда желудочков, вызывая их сокращение. Задержка импульса имеет огромное значение и не дает сократиться предсердиям и желудочкам одновременно - сперва сокращаются предсердия, и только вслед за этим - желудочки сердца.
В атриовентрикулярном узле, так же как и в синусовом узле, имеются два вида клеток - Р и Т. Атриовентрикулярный узел вместе с начальной частью пучка Гиса является автоматическим центром II порядка, который может самостоятельно вырабатывать импульсы с частотой 35-50 в минуту.
Конечная часть пучка Гиса, его ножки и волокна Пуркинье также обладают автоматизмом, однако могут вырабатывать импульсы лишь с частотой 15-35 в минуту и являются автоматическим центром III порядка.
Между автоматическими центрами I, II и III порядков возникают следующие взаимодействия. В норме импульс, возникающий в синусовом узле, распространяется на предсердия и желудочки, вызывая их сокращения. Проходя на своем пути автоматические центры II и III порядков импульс каждый раз вызывает разрядку этих центров. После этого в автоматических центрах II и III порядков снова начинается подготовка очередного импульса, которая каждый раз вновь прерывается после прохождения возбуждения из синусового узла. По сути дела, в норме автоматический центр I порядка подавляет активность автоматических узлов II и III порядков. И только в случае отказа синусового узла или нарушения проведения его импульсов на нижележащие отделы включается автоматический узел II порядка, а при его отказе - автоматический узел III порядка.
22.Потенциал действия в клетках рабочего миокарда.
Клетки проводящей системы сердца и, в частности, клетки пейсмекера, обладающие автоматией могут спонтанно деполяризоваться до критического уровня. В таких клетках за фазой реполяризации следует фаза медленной диастолическои деполяризации (МДД), которая приводит к снижению МП до порогового уровня и возникновению ПД. МДД — это местное, нераспространяющееся возбуждение, в отличие от ПД, который является распространяющимся возбуждением. Таким образом, пейсмекерные клетки отличаются от кардиомиоцитов: 1) низким уровнем МП — около 50 — 70 мВ, 2) наличием МДД, 3) близкой к пикообразному потенциалу формой ПД, 4) низкой амплитудой ПД — 30 — 50 мВ без явления риверсии (овершута).
Клетки миокарда обладают возбудимостью, но им не присущаавтоматия. В период диастолы мембранный потенциал покоя этих клеток стабилен, и его величина выше (80—90 мВ), чем в клетках водителей ритма. Потенциал действия в этих клетках возникает под влиянием возбуждения клеток водителей ритма, которое достигает кардиомиоцитов, вызывая деполяризацию их мембран
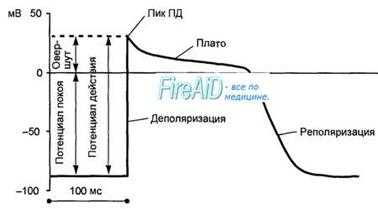
Потенциал действия клетки рабочего миокарда. Быстрое развитие деполяризации и продолжительнаяреполяризация. Замедленнаяреполяри-зация (плато) переходит в быструю реполяризацию. Потенциал действия клеток рабочего миокарда состоит из фазы быстрой деполяризации, начальной быстрой реполяризации, переходящей в фазу медленной реполяризации (фаза плато), и фазы быстрой конечной реполяризации (рис. 9.8). Фаза быстрой деполяризации создается резким повышением проницаемости мембраны для ионов натрия, что приводит к возникновению быстрого входящего натриевого тока. Последний, однако, при достижении мембранного потенциала 30—40 мВ инактивируется и в последующем, вплоть до инверсии потенциала (около +30 мВ) и в фазу «плато», ведущее значение имеют кальциевые ионные токи. Деполяризация мембраны вызывает активацию кальциевых каналов, в результате чего возникает дополнительный деполяризирующий входящий кальциевый ток
Рис. 9.9. Сопоставление потенциала действия и сокращения миокарда с фазами изменения возбудимости. 1 — фаза деполяризации; 2 — фаза начальной быстрой реполяризации; 3 — фаза медленной реполяризации (фаза плато); 4 — фаза конечной быстрой реполяризации; 5 — фаза абсолютной рефрактерности; 6 — фаза относительной рефрактерности; 7 — фаза супернормальной возбудимости. Рефрактерность миокарда практически совпадает не только с возбуждением, но и с периодом сокращения. Конечная реполяризация в клетках миокарда обусловлена постепенным уменьшением проницаемости мембраны для кальция и повышением проницаемости для калия. В результате входящий ток кальция уменьшается, а выходящий ток калия возрастает, что обеспечивает быстрое восстановление мембранного потенциала покоя. Длительность потенциала действия кардиомиоцитов составляет 300—400 мс, что соответствует длительности сокращения миокарда (рис. 9.9).
Читайте также:
