Псевдосиндром Конна (Pseudo Conn syndrome) - синонимы, авторы, клиника
Добавил пользователь Дмитрий К. Обновлено: 21.01.2026
Тяжелое осложнение муковисцидоза — синдром псевдо-Бартера, которое может развиваться у больных в экстремальных погодных условиях при несоблюдении рекомендаций по дополнительному обеспечению солями натрия и хлора и коррекции водной нагрузки.
Впервые признаки, характерные для псевдо-Барттер синдрома, описали в 1951 г Kessler WR, Andersen DH. Авторы наблюдали «тепловую прострацию» у детей жарким летом 1948 года, и у большинства из этих детей был муковисцидоз. Авторы исследовали причины высокой чувствительности детей с муковисцидозом к теплу, и обнаружили аномально высокое содержание натрия и хлора в поте - то есть нетипичное для здоровых людей повышенное выделение солей. Это наблюдение было важным шагом в понимании патогенеза муковисцидоза.
В 1959 г в Австралии, в стране с жарким климатом, Douglas WAC наблюдал двоих детей с симптомами острого недостатка солей. Детям рекомендовали увеличить потребление поваренной соли до 4 грамм в день в жаркий период, и состояние детей нормализовалось.
В 1971 г Gottlieb RP., а в 1979 Beckerman RC и Taussig LM. описали случаи метаболического алкалоза, гипохлоремии и гипокалиемии у детей с муковисцидозом, не связанные с выраженным обезвоживанием и перегревом. Это осложнение стали назвать синдромом псевдо-Баттера.
Синдром псевдо-Барттера — симптомокомплекс, характеризующийся гипокалиемией, гипохлоремией, метаболическим алкалозом, обезвоживанием, повышенной активностью ренина плазмы крови, повышенным содержанием альдостерона в крови.
Причины развития синдрома псевдо-Баттера
Неправильная работа (или его отсутствие) белка - регулятора натриевого обмена в клетках приводит к изменению водно-солевого баланса в организме. У пациентов в условиях жаркого климата, а также у младенцев с еще не совершенной системой терморегуляции, с повышенным выделением натрия с потом (соленый вкус кожи), концентрация натрия и других солей в крови снижается. У детей, находящихся на грудном вскармливании, особенно живущих в жарком климате, риск развития этого синдрома особенно высок связи с низким содержанием солей в грудном молоке.
Значение Калия, Натрия и Хлора в организме
Калий (К+) создает и поддерживает электрический мембранный потенциал клеток. Участвует в регуляции осмотического давления, метаболизма глюкозы и белков. Важную роль играет в проведении нервных импульсов и в формировании потенциала действия нервных и мышечных клеток. Участвует в иммунных процессах.
Концентрация калия в плазме (сыворотке) зависит от равновесия следующих процессов: поступления калия извне, распределения в организме и выведения (почками, потовыми железами, через кишечник и т. п.). Запасов калия в организме не существует. Поэтому даже при небольших изменениях концентрации калия внутри клеток, значительно изменяется его концентрация в плазме. Потребление калия клетками стимулируется инсулином (гормоном поджелудочной железы), также захват калия клетками усиливается под действием катехоламинов, альдостерона (гормонов надпочечников). Изменения рН (кислотности) крови приводят к изменению содержания К+ в клетках: при ацидозе — он выходит из клеток в плазму, при алкалозе поступает внутрь клеток. При гиперкалиемии отмечаются желудочковая тахикардия, фибрилляция желудочков и даже асистолия. При гипокалиемии развиваются мышечная слабость, снижение рефлексов, гипотония, нарушения в проводящей системе сердца, непроходимость кишечника, полиурия.
Натрий (Na+) является важнейшим осмотически активным компонентом внеклеточного пространства, с которым связана регуляция объема внеклеточной жидкости. 96% общего количества натрия в организме содержится вне клеток. Он участвует в проведении возбуждения в нервных и мышечных клетках, в формировании щелочного резерва крови и транспорте ионов водорода.
Концентрация натрия в плазме (сыворотке) зависит от равновесия следующих процессов: поступления натрия, распределения его в организме и выведения почками, потовыми железами. Основными регуляторами обмена натрия в организме являются ренин-ангиотензин-альдостероновая система, АДГ (вазопрессин), предсердный натрийуретический гормон.
Ионы хлора играют важную роль в поддержании кислотно-щелочного состояния, осмотического давления и баланса воды в организме.
Содержится в плазме, лимфе, ликворе. Баланс ионов хлора в организме зависит от равновесия между процессами поступления хлора с пищей, распределением в организме и выведением его с мочой, потом и калом. При потере хлоридов развивается алкалоз, при избыточном потреблении — ацидоз.
Нормальные значения Калия, Натрия и Хлора в сыворотке крови
Синдром Леннокса — Гасто - симптомы и лечение
Что такое синдром Леннокса — Гасто? Причины возникновения, диагностику и методы лечения разберем в статье доктора Поздняковой А. А., детского невролога со стажем в 5 лет.
Над статьей доктора Поздняковой А. А. работали литературный редактор Вера Васина , научный редактор Сергей Макаров и шеф-редактор Маргарита Тихонова
Определение болезни. Причины заболевания
Синдром Леннокса — Гасто (Lennox — Gastaut Syndrome) — это тяжёлая форма эпилепсии, которая начинается в детстве.
Заболевание проявляется выраженным снижением интеллекта и частыми приступами трёх видов:
- тоническими — внезапное напряжение всех мышц, основной признак заболевания;
- атоническими — кратковременное расслабление мышц с потерей сознания;
- атипичными абсансами — сокращение мышц, потеря сознания, автоматические действия; атипичные абсансы длятся дольше типичных, более постепенно начинаются и заканчиваются, их сложнее контролировать и лечить [14] .
Приступы при синдроме Леннокса — Гасто вызваны внезапными вспышками аномальной электрической активности в головном мозге и с трудом поддаются лечению противосудорожными препаратами.
Распространённость синдрома Леннокса — Гасто
Синдром Леннокса — Гасто — это редкое заболевание. Его выявляют у 2 из 100 000 детей, чаще у мальчиков. Среди всех форм эпилепсии на этот синдром приходится 2-5 % случаев [4] .
Заболевание проявляется в возрасте от года до 9 лет, чаще в 2-4 года [1] .
Причины синдрома Леннокса — Гасто
Выделяют криптогенный и симптоматический варианты синдрома.
Примерно у 40 % детей причина болезни неясна, в таких случаях синдром называют идиопатическим, или криптогенным [4] .
Вторичный, или симптоматический, вариант синдрома Леннокса — Гасто — это проявление диффузного поражения головного мозга (диффузные поражения, в отличие от очаговых, затрагивают весь мозг, а не отдельный участок). Причинами такого поражения могут быть:
- тяжёлые генетические заболевания;
- энцефалит и менингит;
- черепно-мозговые и родовые травмы;
- пороки развития коры головного мозга;
- метаболические нарушения (митохондриальные заболевания);
- опухоли головного мозга; .
При симптоматическом варианте прогноз хуже, чем при идиопатическом. У 30 % детей развитию заболевания предшествуют инфантильные спазмы (синдром Веста) [4] . Спазмы не являются причиной синдрома Леннокса — Гасто, но у таких детей болезнь протекает тяжелее.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы синдрома Леннокса — Гасто
Для синдрома Леннокса — Гасто характерны различные типы приступов: тонические и атонические припадки, атипичные абсансы.
При тонических приступах напрягаются мышцы всего тела, рук и ног, чаще с разгибанием, чем со сгибанием. Эти приступы непродолжительны: не более полминуты, обычно около 10 секунд. Часто они возникают по ночам и могут остаться незамеченными для родителей ребёнка.
Атонические приступы состоят из миоклонического и атонического компонентов. При миоклоническом приступе пациент непроизвольно вздрагивает, выбрасывает руки вперёд и подгибает ноги. Затем следует атонический приступ, при котором слабеют мышцы, человек теряет сознание и падает, что нередко приводит к травмам. Как правило, атонический приступ длится всего несколько секунд.
Атипичные абсансы проявляются кратковременной потерей сознания, не больше чем на несколько минут. Во время приступа подёргиваются мышцы лица, пациент высовывает язык, кивает и часто моргает. Также человек может совершать автоматические действия, например включить свет, о чём в дальнейшем забывает.
У взрослых пациентов могут возникать генерализованные тонико-клонические приступы. Они проявляются потерей сознания, судорогами по всему телу, прикусом языка, непроизвольным мочеиспусканием. У детей таких приступов, как правило, не бывает.
Бессудорожный эпилептический статус часто встречается при синдроме Леннокса — Гасто. Это состояние может длиться от пары часов до нескольких недель. Проявляется в двух основных формах: спутанным сознанием и тоническими приступами. У пациента снижается психическая и двигательная активность, вплоть до ступора, лицо становится похожим на маску, слабеют мышцы, возникает слюнотечение, временами теряется ясность сознания. Такое состояние трудно распознать при тяжёлых когнитивных нарушениях — эпизоды спутанного сознания можно принять за нарушения интеллекта. Вероятно, бессудорожный статус усугубляет уже имеющиеся интеллектуальные нарушения [12] .
Умственная отсталость тоже относится к классическим проявлениям синдрома Леннокса — Гасто. У некоторых пациентов она наблюдается ещё до начала болезни. В течение пяти лет после начала заболевания умственная отсталость развивается у 90 % пациентов, но в литературе описаны редкие случаи нормального интеллекта при синдроме Леннокса — Гасто.
Также у многих пациентов наблюдается агрессивность, импульсивность и аутичные черты (задержка речи, повторяющиеся стереотипные движения, трудности в общении, ограниченный круг интересов) [3] .
Патогенез синдрома Леннокса — Гасто
Патогенез синдрома Леннокса — Гасто до конца не изучен. Это связано с разнообразием симптомов и причин заболевания, а также с ограниченными данными о генетических причинах болезни.
В основе синдрома Леннокса — Гасто лежит повышенная возбудимость коры головного мозга. Предполагается, что у детей с этим заболеванием нарушено формирование синапсов между нервными клетками, из-за чего в дальнейшем повышается их возбудимость. К такому нарушению может приводить повреждение как корковых, так и подкорковых структур (кортикоретикулярных связей и таламуса).
Нарушения в работе этих структур могут быть вызваны различными заболеваниями: гипоксически-ишемической энцефалопатией, менингоэнцефалитом, нейрокожными синдромами, опухолями и пороками развития головного мозга. Синдром Леннокса — Гасто может развиться при любом типе повреждения головного мозга.
Обычно в начале заболевания возникают тонические приступы, затем присоединяются атипичные абсансы, миоклонические и тонико-клонические приступы. Тонический компонент связан с поражением мезэнцефальной ретикулярной формации, а клонический — с поражением переднего мозга. Отсюда следует, что присоединение атипичных абсансов и клонических приступов вызвано возрастающим участием коры головного мозга.

При некоторых состояниях центральной нервной системы, например при кровоизлиянии или дефиците кислорода, повышается возбудимость в коре головного мозга. Неконтролируемая электрическая активность, возникающая при повышенной возбудимости, проявляется симптомами синдрома Леннокса — Гасто [5] .
Классификация и стадии развития синдрома Леннокса — Гасто
Согласно классификации Международной противоэпилептической лиги (ILAE), синдром Леннокса — Гасто относится к генерализованной криптогенной или симптоматической формам эпилепсии, т. е. болезнь вызвана аномальной электрической активностью в обоих полушариях, но причина может быть как выявлена, так и неизвестна.
Согласно Проекту классификации ILAE 2001 года, синдром Леннокса — Гасто входит в группу детских эпилептических энцефалопатий. К тяжёлым детским энцефалопатиями также относят синдромы Веста, Драве и Дуза [2] .
В Международной классификации болезней (МКБ-10) синдром Леннокса — Гасто кодируется как G40.4 Другие виды генерализованной эпилепсии и эпилептических синдромов.
Осложнения синдрома Леннокса — Гасто
Синдром Леннокса — Гасто часто приводит к развитию эпилептического статуса, из-за чего значительно ухудшаются умственные способности. Пациент может утратить необходимые для жизни навыки, и в дальнейшем ему потребуется постоянный уход.
Во время эпистатуса слабеют и беспорядочно подёргиваются мышцы лица и рук, снижается двигательная и психическая активность. Контакт с пациентом затруднён, он может лежать неподвижно или его движения становятся замедленными. Чаще всего приступы происходят по утрам. Эпистатус свидетельствует о неблагоприятном течении заболевания и может угрожать жизни.
У многих пациентов с синдромом Леннокса — Гасто развиваются экстрапирамидные и мозжечковые расстройства, которые проявляются слюнотечением, нарушением походки, координации, глотания и речи (дисфагией и диазартрией). При нарастающей дисфагии трудно есть и принимать лекарства, может потребоваться установка гастростомы [1] .
Нарушение походки и атонические приступы часто приводят к падениям и черепно-мозговым травмам. Нередко пациентам приходится пользоваться инвалидной коляской.
Также синдром Леннокса — Гасто может осложняться нарушением сна и психозом.
Диагностика синдрома Леннокса — Гасто
Диагностика синдрома Леннокса — Гасто включает сбор анамнеза, электроэнцефалографию (ЭЭГ), магнитно-резонансную или компьютерную томографию (МРТ или КТ). Может потребоваться генетическое тестирование.
Сбор жалоб и истории болезни
Для постановки диагноза важна подробная история болезни: как протекала беременность, роды и перинатальный период, какие симптомы беспокоят.
Неврологические нарушения при идиопатическом синдроме Леннокса — Гасто обычно отсутствуют. При симптоматических формах могут возникать нарушения со стороны нервной системы: паралич, неустойчивость при ходьбе, микроцефалия, нарушения речи, косоглазие. Также на синдром Леннокса — Гасто будет указывать задержка в развитии или потеря уже приобретённых навыков и устойчивость судорог к противоэпилептическим препаратам.
Магнитно-резонансная и компьютерная томография (МРТ и КТ)
Характер нарушений зависит от формы заболевания. Идиопатический вариант синдрома Леннокса — Гасто протекает без структурных изменений головного мозга. У многих пациентов на КТ и МРТ выявляют диффузную атрофию головного мозга, при которой отмирают нейроны и разрушаются нервные связи. При симптоматической форме наблюдаются очаговые поражения коры головного мозга.
Электроэнцефалография (ЭЭГ)
При диагностике синдрома Леннокса — Гасто проводится ЭЭГ с записью во время ночного сна и бодрствования. ЭЭГ позволяет выявить эпилептиформную активность — острые волны и пики. Для записи и оценки различных типов приступов может проводиться видео-ЭЭГ-мониторинг.

В самом начале заболевания на ЭЭГ заметно только изменение основной биоэлектрической активности. Кроме того, судороги и клинические симптомы развиваются с течением времени, отставание в развитии также не всегда проявляется в начале болезни. Поэтому часто диагноз устанавливают после нескольких лет наблюдения за пациентом [3] .
Синдром Леннокса — Гасто проявляется характерным паттерном ЭЭГ: медленными спайк-волновыми комплексами между приступами и генерализованной пароксизмальной быстрой активностью во сне (т. е. изменениями потенциала в форме острых волн, пиков и др.). Спайк-волна — это комплекс, который имеет высокую амплитуду и возникает при комбинации спайка с медленной волной.
Чтобы установить диагноз, необходимо наличие минимум двух типов генерализованных приступов и медленных спайк-волн на ЭЭГ в состоянии бодрствования.
![ЭЭГ при синдроме Леннокса — Гасто [15]](https://probolezny.ru/media/bolezny/sindrom-lennoksa-gasto/eeg-pri-sindrome-lennoksa-gasto-15_s.jpg)
Генетическое тестирование
Иногда проводится тестирование для выявления генетических нарушений: дефекта транспортёра глюкозы (SLC2A1), позднего детского нейронального липофусциноза цероидов (CLN2) и туберозного склероза (TSC 1,2). У детей с такими нарушениями часто наблюдаются эпилептические приступы.
Дифференциальная диагностика
Синдром Леннокса — Гасто следует отличать от других ранних эпилептических энцефалопатий:
- от синдромов Драве, Дуза, Ландау — Клеффнера, Веста и Ангельмана;
- атипичной эпилепсии детства с центро-темпоральными спайками;
- эпилептической энцефалопатии с продолженной спайк-волновой активностью во сне;
- синдрома псевдо-Леннокса (при такой эпилепсии во время засыпания или пробуждения быстро сокращаются мышцы лица и плеч, нарушается речь и усиливается потливость).
Также проводится дифференциальная диагностика с некоторыми наследственно-дегенеративными заболеваниями, например нейрофиброматозом 1-го типа [3] [12] .
Лечение синдрома Леннокса — Гасто
При синдроме Леннокса — Гасто применяют противосудорожные препараты, кортикостероды, кетогенную диету, стимуляцию блуждающего нерва и хирургическое лечение. Не доказано, что какой-то определённый препарат помогает лучше, чем другой. Поэтому терапию для каждого пациента подбирают индивидуально [8] .
Медикаментозное лечение
Судороги при синдроме Леннокса — Гасто устойчивы к лечению — полностью устранить их не получится, но можно уменьшить частоту.
Наиболее эффективны противосудорожные препараты широкого спектра: Вальпроат натрия, Клобазам, Ламотриджин, Топирамат и Зонисамид. Вальпроат натрия — это препарат первой линии в лечении синдрома Леннокса — Гасто. Часто сочетают два лекарства, например Вальпроат натрия с Ламотриджином или Клобазамом. Ламотриджин хорошо помогает при атонических припадках. Также могут быть эффективны Леветирацетам и Перампанел.
Если противосудорожные препараты не помогают, то назначают кортикостероиды: адренокортикотропный гормон, Преднизолон, Метилпреднизолон. При приёме кортикостероидов часто возникают побочные эффекты, например отёки, высокое давление, ожирение.
Для экстренного лечения частых атипичных абсансов, бессудорожного эпистатуса или других тяжёлых приступов обычно назначают бензодиазепины. При бессудорожном эпилептическом статусе может применяться короткий курс Клобазама или бензодиазепинов, высокие дозы кортикостероидов или вальпроевой кислоты. В некоторых случаях бензодиазепины могут увеличить частоту тонических судорог.
Кетогенная диета
Кетогенная диета показана, если лечение противосудорожными препаратами неэффективно. При такой диете потребляют много жиров, умеренное количество белков и мало углеводов. В рацион входят орехи, сыр, масло, жирная рыба. Исключают конфеты, картофель, выпечку, мёд, шоколад [13] .
Стимуляция блуждающего нерва
Стимуляцию блуждающего нерва проводят с помощью вживлённого электрода, подключённого к генератору импульсов. Этот метод рекомендован пациентам с атоническими приступами, которые могут привести к травмам и инвалидности. Стимуляция блуждающего нерва позволяет уменьшить частоту приступов.

Хирургическое лечение
При синдроме Леннокса — Гасто может проводиться мозолотомия и гемисферэктомия. Операции позволяют облегчить симптомы и в некоторых случаях уменьшить частоту приступов.
Мозолотомия — это рассечение мозолистого тела, т. е. пучка нервных волокон, соединяющих полушария мозга. После операции припадки не могут распространяться из одного полушария в другое.

Гемисферэктомия — это частичное или полное удаление полушария головного мозга. Проводится в редких случаях, когда остальные методы лечения неэффективны.
Прогноз. Профилактика
Судороги при синдроме Леннокса — Гасто часто не поддаются лечению. Они вызывают у пациентов страх перед физической травмой, при постоянных и плохо контролируемых приступах ухудшаются умственные способности. У пациентов часто возникают трудности в учёбе, социальной и личной жизни.
Практически во всех случаях судороги продолжаются и во взрослом возрасте. При этом заболевание сопровождается слюнотечением, нарушением походки, речи и глотания.
Прогноз лучше, если до начала приступов не было поражения мозга и отклонений в интеллектуальном развитии. Обычно если синдрому Леннокса — Гасто предшествовали инфантильные спазмы, то судороги тяжелее контролировать. Умственные способности у таких пациентов ухудшаются сильнее.
Как правило, частота припадков снижается в период полового созревания. Однако у 2/3 пациентов спустя десять лет после начала болезни приступы по-прежнему происходят ежедневно.
Атипичные абсансы иногда сменяются фокальными приступами: двигательными нарушениями, ощущением онемения и ударов током в руках, ногах или лице, покраснением кожи, дискомфортом в верхней части живота.
Гиперактивность, агрессия и аутистические черты могут сохраняться во взрослом возрасте, но чаще развивается медлительность и апатия. Большинство пациентов нуждаются в посторонней помощи, лишь немногие могут жить самостоятельно [7] .
Профилактика заключается в раннем выявлении заболевания, что позволит облегчить симптомы болезни [8] .
Синдром Конна (первичный гиперальдостеронизм) - симптомы и лечение
Что такое синдром Конна (первичный гиперальдостеронизм)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Лукьянова Сергея Анатольевича, хирурга-эндокринолога со стажем в 18 лет.
Над статьей доктора Лукьянова Сергея Анатольевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина

Синдром Конна (первичный гиперальдостеронизм) — это гормональное расстройство, при котором надпочечники в избыточном количестве вырабатывают гормон альдостерон. Проявляется повышением артериального давления.
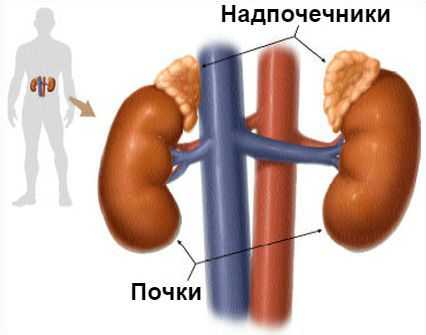
Основная задача альдостерона состоит в регулировании уровня натрия и калия в крови. Если этого гормона становится слишком много, организм начинает терять калий и удерживать слишком много воды, из-за чего объём крови и артериальное давление увеличиваются.
Первичный гиперальдостеронизм может быть вызван гиперактивностью либо одного, либо обоих надпочечников, т. е. быть односторонним или двусторонним. Одностороннее заболевание обычно вызывается альдостерон-продуцирующей аденомой (доброкачественной опухолью ), гиперплазией (усиленным ростом клеток) или, реже, раком одного надпочечника. На развитие этих причин влияют генетические факторы. Двустороннее заболевание обычно вызывает двусторонняя гиперплазия, т. е. усиленный рост клеток обеих желёз . Причиной такой гиперактивности надпочечников могут быть редкие генетические синдромы: семейный гиперальдостеронизм 1-го и 2-го типа.
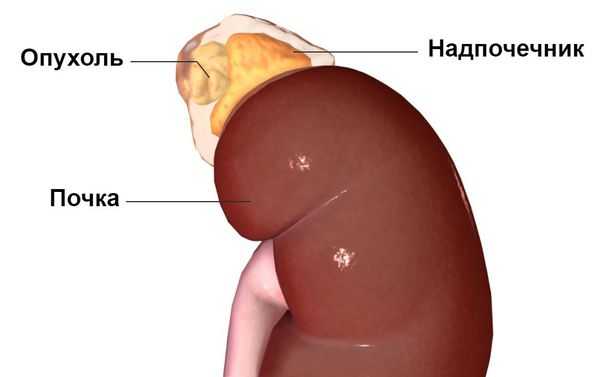
Наиболее часто синдром Конна встречается у людей 30-50 лет, преимущественно среди женщин — в 60-70 % случаев. Изначально он считался крайне редким заболеванием. В настоящее время установлено, что это одна из наиболее распространённых причин симптоматической артериальной гипертензии. Последние исследования показывают, что данное заболевание встречается у 5-15 % пациентов с гипертонией. Но так как пациентов, устойчивых к лечению артериальной гипертензии, редко направляют для обследования к эндокринологу, синдром Конна, по-видимому, часто остаётся недиагностированным [1] .
Хотя первичный гиперальдостеронизм всё ещё является значительной диагностической проблемой, его распознавание имеет решающее значение, поскольку артериальную гипертонию при этом заболевании можно полностью вылечить с помощью хирургического вмешательства (в отличие от гипертонической болезни, когда пациенты вынуждены пожизненно принимать гипотензивные препараты).
Симптомы синдрома Конна
Высокое давление является постоянным и зачастую единственным симптомом первичного гиперальдостеронизма. Оно наблюдается в 75-98 % случаев, вызывает головные боли, помутнение зрения и головокружение [2] [4] .
Повышение артериального давления может быть как незначительным, так и очень высоким. Причём высокие цифры при синдроме Конна обычно трудно контролировать, поэтому пациенты вынуждены принимать по четыре препарата для снижения давления или даже больше.
Часто у больных могут наблюдаться гипертонические кризы, при которых верхнее (систолическое) давление поднимается выше 250 мм рт. ст [3] . Клиническая картина таких кризов при синдроме Конна не отличается от обычного гипертонического криза: пациентов беспокоит головная боль, тошнота, рвота, головокружение, мелькание мушек перед глазами, избыточная потливость, боли в области сердца, учащённый пульс, чувство страха, звон в ушах и др.

Гипокалиемия (низкий уровень калия в крови) — второй по частоте симптом первичного гиперальдостеронизма. Его выявляют у 9-37 % больных [5] . Гипокалиемия может вызвать такие симптомы, как усталость, онемение, учащённое мочеиспускание, жажда, судороги и мышечная слабость. Увеличение объёма мочи (полиурия) и ночные пробуждения из-за позыва к мочеиспусканию (ноктурия) являются результатом нарушения работы почек. Иногда гипокалиемия может быть вызвана приёмом диуретиков. Уровень натрия в этом случае может быть нормальным или умеренно повышенным. Отёчный синдром, в отличие от других заболеваний почек, при этом встречается редко.
Все перечисленные жалобы часто встречаются и при других заболеваниях. Заподозрить именно синдром Конна можно, если у пациента:
- очень высокое артериальное давление, плохо поддающееся лекарственной терапии;
- семейный анамнез первичного альдостеронизма;
- высокое артериальное давление в возрасте до 40 лет;
- высокое артериальное давление и опухоль в одном из надпочечников;
- высокое артериальное давление и низкий уровень калия;
- высокое артериальное давление и апноэ во время сна.
Патогенез синдрома Конна
В связи с высоким уровнем альдостерона почки начинают сильнее всасывать натрий, задерживать воду и выводить калий из организма. Повышенное всасывание натрия почками, в свою очередь, увеличивает объём плазмы, что является первичным инициирующим механизмом гипертонии. Все эти изменения могут вызвать воспаление и отёк тканей с последующим развитием фиброза в жизненно важных органах, таких как сердце, почки и сосудистая сеть. В результате этого в дальнейшем развивается хроническая почечная недостаточность, мерцательная аритмия, инсульт, ишемическая болезнь сердца и застойная сердечная недостаточность.
Первичный гиперальдостеронизм может быть семейным (наследственным) и спорадическим (ненаследственным). Семейный вариант заболевания вызывает один из 4-х генетических вариантов гиперальдостеронизма, которые передаются по наследству. Также он может возникать спорадически, т. е. от случая к случаю. Генетические формы болезни связаны с мутацией генов, спорадические — с развитием альдостерон-продуцирующей аденомы или двусторонней гиперплазии надпочечников. До 2011 года причина возникновения этих аденом была не известна. Позже врачи установили, что в возникновении этих заболеваний особую роль также играют различные мутации [14] .
Не менее 6 % всех случаев первичного гиперальдостеронизма передаётся по наследству. Первый тип вызывается химерным геном, который содержит определённую последовательность структурных элементов ДНК гена 11β-гидроксилазы (CYP11B1). Этот ген регулируется АКТГ — адренокортикотропным гормоном, поэтому при первом типе заболевания также нарушается синтез глюкокортикоидов — других гормонов надпочечников. Тяжесть гиперальдостернизма может быть различной, отмечается раннее начало заболевания и высокая частота инсульта.
Клиническое течение второго типа неотличимо от спорадической формы болезни. Он диагностируется тогда, когда по крайней мере у двух членов семьи установлен этот диагноз. Генетическая основа данного типа остаётся неизвестной.
Третий тип ассоциируется с мутациями в гене KCNJ. Данные мутации приводят к нарушению транспорта калия и увеличению проводимости для натрия. В результате этого клеточная мембрана деполяризуется и вызывает открытие зависимых от каналов ионов кальция, который затем активирует выработку альдостерона. Для этого типа характерен дебют заболевания в раннем возрасте.
Недавно был описан новый, четвёртый тип семейного гиперальдостеронизма. Его вызывает мутация в гене CACNA1H, который кодирует работу кальциевых каналов. Этот тип также часто развивается ещё в детском возрасте и протекает с высоким артериальным давлением.
Спорадические формы гиперальдостеронизма (ненаследственные), тоже обусловлены различными мутациями, но уже соматическими (возникающими в течение жизни). Это в основном мутации усиления функции в генах, кодирующих ионные каналы или транспортёры (KCNJ5, CACNA1D, ATP1A1 и ATP2B3), которые приводят к избыточной продукции альдостерона [6] .
Достижения в области секвенирования генома человека (направленного на определение последовательности структурных элементов в молекуле ДНК) значительно продвинули наше понимание патогенеза первичного гиперальдостеронизма и показали, что чрезмерная выработка альдостерона при этой наиболее распространённой форме эндокринной гипертензии не так проста, как считалось ещё каких-то 10 лет назад.
Классификация и стадии развития синдрома Конна
Первичный гиперальдостеронизм классифицируется на основании анатомических характеристик и физиологических реакций.
Анатомически синдром Конна можно разделить на неопластический (аденомы, карциномы и эктопический гиперальдостеронизм) и неопухолевый (односторонняя или двусторонняя гиперплазия надпочечников).
Физиологически выделяют две формы заболевания:
- Ангиотензин чувствительная форма. К ней относится двусторонняя гиперплазия надпочечников и редкие формы односторонней аденомы. Они частично зависят от гормональной системы человека, которая регулирует артериальное давление.
- Ангиотензин нечувствительная форма. К ней относятся большинство альдостерон-продуцирующих аденом, рак или гиперплазия одного надпочечника. Они полностью не зависят от гормональной системы, регулирующей артериальное давление.
Частота встречаемости различных типов заболевания:
- Альдостерон-продуцирующие аденомы — 60 %.
- Первичная двухсторонняя гиперплазия надпочечников — 40 %.
- Односторонняя гиперплазия надпочечников — менее 1 %:
- альдостерон-продуцирующие ненадпочечниковые опухоли;
- альдостерон-продуцирующий рак коры надпочечника;
- глюкокортикоид-зависимый гиперальдостеронизм [7] .
Осложнения синдрома Конна
Повышенное артериальное давления и низкий уровень калия при синдроме Конна становятся причинами развития других проблем [8] . Так, гипокалиемия может привести к слабости, нарушению сердечного ритма, мышечным судорогам, чрезмерной жажде или мочеиспусканию, а постоянно высокое давление — к проблемам с сердцем и почками, в том числе инфаркту, инсульту и почечной недостаточности.
Риск возникновения сердечно-сосудистых проблем у пациентов с первичным гиперальдостеронизмом гораздо выше, чем у людей, которые имеют только высокое артериальное давление. Чтобы избежать возможных последствий синдрома Конна, больным с гипертонией, не поддающейся лечению, следует обратиться к эндокринологу для проведения обследования.
Диагностика синдрома Конна
Первичный гиперальдостеронизм диагностируется путём измерения в крови уровня альдостерона и ренина (гормона, вырабатываемого почками). Для более точной диагностики анализы необходимо сдавать утром. При синдроме Конна уровень альдостерона будет высоким, а уровень ренина — низким. При этом уровень калия может быть низким или нормальным.
Если результаты этих анализов будут положительными, то пациенту могут назначить дополнительные тесты для подтверждения диагноза. Они направлены на снижение количества альдостерона. Это можно сделать несколькими способами: ввести определённое лекарство, выполнить внутривенное вливание солевых растворов или ввести дополнительную соль с помощью диеты. Если после этих тестов уровень альдостерона останется высоким, а уровень ренина снизится, то диагноз подтверждается.
Альдостерон-рениновое соотношение (АРС). Этот анализ крови является скрининговым тестом, то есть он проводится при подозрении на гиперальдостеронизм. В настоящее время АРС является самым надёжным тестом по выявлению синдрома Конна. Однако различные методики определения этого соотношения часто приводят к ложноположительным или ложноотрицательным результатам. Об этом обязательно нужно помнить. Поэтому даже при высоком АРС, которое указывает на первичный гиперальдостеронизм, для подтверждения диагноза может потребоваться дополнительное тестирование.
Существует ряд правил по выполнению этого анализа:
- кровь необходимо брать в утренние часы (с 8:00 до 10:00);
- перед забором крови пациенту необходимо спокойно посидеть 5-10 минут;
- если у пациента есть гипокалиемия, то перед проведением анализа уровень калия необходимо нормализовать. Для этого в течение трёх дней перед забором крови рекомендуют соблюдать диету без ограничения соли, при которой пациенту нужно употреблять минимум 5-6 г поваренной соли в день;
- приём препаратов, которые могут повлиять на уровень альдостерона, необходимо отменить (например диуретики, противовоспалительные средства и др.) [9] .
Тест на подавление каптоприлом. Этот анализ крови измеряет реакцию альдостерона на каптоприл — лекарство, используемое для лечения высокого артериального давления. При отсутствии первичного гиперальдостеронизма уровень альдостерона в крови снизится более чем на 30 % от исходного.
24-часовая экскреция альдостерона с мочой. Для проведения этого теста пациент в течение пяти дней придерживается диеты с высоким содержанием соли, а затем сдаёт анализ мочи, собранной за сутки. Если уровень альдостерона в моче будет высоким, то наличие первичного гиперальдостеронизма будет подтверждено.
Тест на подавление физиологическим раствором. В этом тесте пациент получает солевой раствор через капельницу, затем ему измеряют уровень альдостерона и ренина. Первичный гиперальдостеронизм может быть подтверждён, если уровень альдостерона в крови после такой солевой нагрузки останется высоким, а уровень ренина понизится.
Для пациентов с доказанным первичным гиперальдостеронизмом следующим шагом является выяснение, каким заболеванием он вызван, — односторонним или двусторонним. Это очень важно, так как лечение каждого из них отличается. Компьютерная или магнитно-резонансная томография позволяют увидеть, есть ли опухоль в надпочечнике. Если пациент младше 40 лет и у него есть опухоль только в одном надпочечнике, то в этом случае можно приступать к лечению. Если пациент старше 40 лет и/или у него либо нет опухоли, либо есть опухоль, но в обоих надпочечниках, то возникает необходимость в проведении специального теста — селективного забора венозной крови из центральной вены надпочечников. В ходе этого теста хирург или рентгенолог берёт кровь непосредственно из вен обоих надпочечников, чтобы определить, какой именно орган вырабатывает патологическое количество гормона.
Лечение синдрома Конна
Лечение синдрома Конна зависит от его основной причины.
У пациентов с односторонней аденомой надпочечника единственным способом лечения является адреналэктомия — удаление опухоли вместе с надпочечником. Эта операция обычно выполняется ретроперитонеоскопически, т. е. через несколько очень маленьких разрезов со стороны спины. После односторонней адреналэктомии почти у 100 % пациентов снижается артериальное давление и нормализуется уровень калия в крови. При этом более чем у 50 % пациентов артериальная гипертензия полностью излечивается (без приёма лекарственных препаратов). Причинами стойкого повышения артериального давления после адреналэктомии может быть сопутствующая гипертоническая болезнь неизвестной причины и пожилой возраст пациентов.
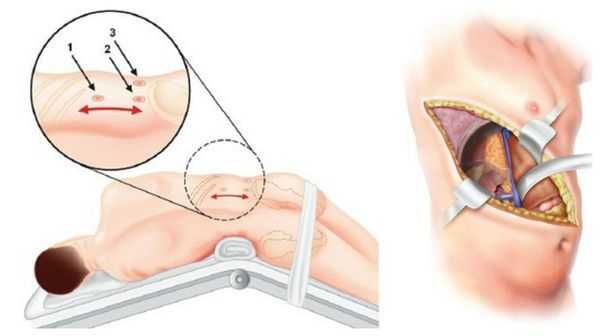
В крайних случаях проводится открытая адреналэктомия. Во время такой операции выполняется широкий разрез через грудную, брюшною полость и диафрагму. По сравнению с таким вмешательством, эндоскопическая адреналэктомия снижает сроки пребывания в стационаре и сочетается с меньшим количеством осложнений. Уже через неделю при эндоскопической операции пациент может вернуться к работе и обычным физическим нагрузкам.
Медикаментозное лечение рекомендуется пациентам с крайне высоким уровнем риска оперативного лечения (например при тяжёлой сердечной недостаточности). Поскольку односторонняя эндоскопическая адреналэктомия может полностью избавить пациента от медикаментозного лечения, её необходимо выполнять во всех остальных случаях. При этом важно, чтобы такое лечение выполнял хирург-эндокринолог, имеющий большой опыт проведения эндоскопических адреналэктомий.
Перед операцией артериальное давление и уровень калия в крови необходимо привести в норму. Если достичь этого в короткие сроки не удаётся, то операцию следует отложить.
После операции следует измерять уровень активности альдостерона и ренина в плазме крови, чтобы сделать предварительные выводы об эффективности оперативного лечения. Также в послеоперационном периоде нужно отменить приём добавок калия, прекратить приём спиронолактона и, при необходимости, уменьшить антигипертензивную терапию. Обычно артериальное давление улучшается или нормализуется через 1-6 месяцев после односторонней адреналэктомии, но у некоторых пациентов оно может оставаться повышенным до 1 года.
Для пациента с двусторонней гиперплазией лучшим способом лечением является консервативное — приём препарата под названием спиронолактон, который блокирует действие альдостерона. Кроме того, пациент должен придерживаться диеты с низким содержанием соли [10] .
Заболеваемость и смертность при синдроме Конна в первую очередь связаны с гипокалиемией и артериальной гипертензией. В случае своевременной диагностики болезнь излечивается полностью.
Причиной смерти могут стать сердечно-сосудистые осложнения. Установлено, что факторами риска развития этих осложнений при первичном гиперальдостеронизме являются гипокалиемия, односторонний первичный гиперальдостеронизм и высокий уровень альдостерона в плазме (не менее 125 пг/мл) [13] . Так, гипокалиемия, особенно тяжёлая, вызывает нарушения сердечного ритма, которые могут привести к летальному исходу.
Другими осложнениями гиперальдостеронизма являются инфаркт миокарда, цереброваскулярные болезни и сердечная недостаточность. Также у пациентов с синдромом Конна с большей вероятностью, чем у пациентов с гипертонией, развиваются острые коронарные синдромы, гипертрофия левого желудочка и инсульт [12] .
Существуют доказательства того, что хронический гиперальдостеронизм при отсутствии повышенного кровяного давления (как это происходит при вторичном гиперальдостеронизме) также связан с повышенным риском сердечных осложнений, включая ишемические, гипертрофические и фиброзные повреждения [11] .
Профилактика синдрома Конна предполагает своевременное лечение болезней, которые могут его вызвать. Пациентам с длительно существующей или трудно контролируемой артериальной гипертензией рекомендуется проходить скрининг на гиперальдостеронизм. В зоне риска находятся молодые люди до 40 лет и те, чьи родители страдают гипертонией.
Гиперальдостеронизм первичный (синдром Конна)
Что такое Гиперальдостеронизм первичный (синдром Конна) -
В 1955 г. Конн описал синдром, сопровождающийся артериальной гипертонией и снижением уровня калия в крови, развитие которого связано с опухолью (аденомой) коры надпочечников, вырабатывающей гормон альдостерон. Эта патология получила название синдрома Конна.
Первичный гиперальдостеронизм (синдром Конна) - заболевание, характеризующееся увеличением секреции альдостерона надпочечниками, проявляющееся в снижении активности специфического вещества - ренина плазмы крови - играющего важную роль в регуляции работы организма, артериальной гипертензии и уменьшении содержания калия в крови. Позднее были описаны многие другие случаи гиперплазии (избыточного разрастания ткани и ее изменения) коры надпочечников с увеличением секреции альдостерона, и теперь термин «первичный гиперальдостеронизм» используется как для описания самого синдрома Конна, так и другой патологии, сопровождающейся гиперсекрецией альдостерона, например, гиперплазии коры надпочечников. В настоящее время первичный гиперальдостеронизм (ПГА), и в частности синдром Конна, является наиболее частой причиной вторичной артериальной гипертензии.
Что провоцирует / Причины Гиперальдостеронизма первичного (синдрома Конна):
В настоящий момент выделено две основные причины ПГА, сопровождающегося увеличением секреции альдостерона:
- односторонняя альдостерон-продуцирующая опухоль - аденома или синдром Конна (50-60% случаев);
- двусторонняя гиперплазия коры надпочечников или идиопатический гиперальдостеронизм (40-50% случаев).
Существуют редкие виды заболеваний и опухолей, которые сходны по симптомам, в том числе наследственное заболевание, сопровождающиеся повышением концентрации альдостерона.
Еще реже встречаются секретирующие альдостерон рак коры надпочечника или опухоли яичников.
Наиболее частой причиной ПГА является синдром Конна, при этом аденома обычно не превышает 3 см в диаметре, является односторонней и ренин-независимой. Это означает, что секреция альдостерона не зависит от изменения положения тела. Реже аденома может быть ренин-зависимой (то есть, уровень альдостерона увеличивается в вертикальном положении). Синдром Конна встречается в 50-60% случаев.
Оставшиеся 40-50% случаев приходится на двустороннюю гиперплазию коры надпочечников, когда уровень альдостерона увеличивается в вертикальном положении. Реже встречается первичная гиперплазия надпочечников, при которой уровень альдостерона не зависит от положения тела, как при ренин-независимой аденоме.
Альдостерон могут секретировать опухоли вненадпочечниковой локализации - в почках или яичниках.
Симптомы Гиперальдостеронизма первичного (синдрома Конна):
Жалобы пациентов с тяжелой гипокалиемией: утомляемость, мышечная слабость, судороги в мышцах, головные боли и приступы сердцебиения. У таких пациентов также могут наблюдаться повышенная жажда: как результат - они много пьют, и полиурия (много выделяют мочи) вследствие так называемого несахарного диабета, развившегося в результате гипокалиемии и соответствующих изменений со стороны почек, обусловленных влиянием на них альдостерона.
Развивается относительная гипокальцемия (уменьшение содержания кальция в крови) с развитием чувства онемения в области конечностей и вокруг рта, мышечных спазмов в области кистей и стоп и, в крайней степени, спазма гортани с возникновением ощущения удушья и судорог. При этом препараты кальция не назначаются, так как общее содержание кальция в крови нормально, но из-за гормонального нарушения изменяется баланс кальция в организме.
Длительно существующая артериальная гипертензия может привести к возникновению осложнений со стороны сердечно-сосудистой и нервной систем со всеми сопутствующими симптомами.
Диагностика Гиперальдостеронизма первичного (синдрома Конна):
Специфических проявлений синдрома Конна не существует.
При развитии у пациентов сердечной недостаточности, инсульта или внутричерепного кровоизлияния вследствие повышения АД появляются соответствующие симптомы.
Лабораторные исследования
- Исследования содержания натрия, калия и кальция в плазме крови (биохимический анализ) могут показать увеличение содержания натрия в крови, наличие гипокалиемии и «защелачивания» крови, что является следствием действия альдостерона на почки. Также можно легко выявить относительное уменьшение содержания кальция в крови. Почти у 20% пациентов можно выявить нарушение углеводного обмена (повышение уровня глюкозы в крови), хотя диабет развивается редко. Следует учесть, что нормальное содержание калия в крови не исключает ПГА. Исследования показывают, что от 7 до 38% пациентов с ПГА имеют нормальный уровень калия в сыворотке крови. Гипокалиемия развивается при употреблении в пищу значительного количества натрия.
- Характерно снижение уровня ренина в плазме крови у пациентов с ПГА, причем эта цифра не поднимается выше определенных значений при введении мочегонных препаратов или переходе в вертикальное положение (что обычно происходит в норме). Некоторые специалисты предлагают анализ уровня ренина в плазме крови считать специальным тестом для выявления ПГА. Однако согласно некоторым данным, пониженный уровень ренина встречается и у 30% пациентов с гипертонической болезнью. Поэтому низкий уровень ренина в плазме крови не следует считать специфичным тестом для ПГА.
- Достаточно чувствительным тестом для ПГА следует считать определение отношения активности альдостерона плазмы (ААП) к активности ренина плазмы (АРП). Следует учитывать возможные взаимодействия различных препаратов при проведении теста.
- При положительном тесте на ААП/АРП отношение проводят дополнительные тесты: определение уровня альдостерона в суточной порции мочи с поправкой на уровень калия в сыворотке крови (так как эти показатели влияют друг на друга).
Инструментальное обследование
- Компьютерная томография (КТ) брюшной полости. Является обязательным методом обследования в случае ПГА. При установленном диагнозе ПГА целью КТ является определение типа патологии и возможности ее хирургического лечения (аденома надпочечника или двусторонняя гиперплазия). При КТ определяется объем операции.
- Сцинтиграфия с 131-I-йодохолестеролом используется для выявления одностороннего функционального (секретирующего гормоны) образования надпочечника. Однако данная процедура не имеет широкого распространения ввиду необходимости тщательной подготовки пациента, высокой стоимости и того, что метод редко выявляет образование больше 1,5 см в диаметре.
- Магнитно-резонансная томография (МРТ). Не является более чувствительным методом, чем КТ.
Другие методы диагностики
Постуральная проба (переход из горизонтального положения тела в вертикальное). Может использоваться в поликлинике для первичной диагностики ренин-зависимой аденомы надпочечника. В настоящее время используется редко.
Ввиду сложности дифференцировки диагноза между гиперплазией надпочечника и аденомой после КТ-исследования может быть проведена процедура взятия анализа непосредственно из вены надпочечника. При этом производится введение катетера в вену надпочечника через вену на бедре. Анализы крови берутся из обеих вен надпочечников, а также из нижней полой вены. Определяется уровень альдостерона после максимальной стимуляции АКТГ.
Лечение Гиперальдостеронизма первичного (синдрома Конна):
Основная цель - предотвратить возникновение осложнений вследствие гипокалиемии и артериальной гипертензии.
Если при синдроме Конна гипертензия корректируется с помощью односторонней адреналэктомии, то двустороннее поражение чаще всего лечится консервативно, так как эффективность односторонней или двусторонней адреналэктомии составляет всего 19%. В случае аденомы медикаментозная терапия также проводится с целью контроля кровяного давления и коррекции гипокалиемии, что уменьшает риск последующей хирургической операции.
Основные компоненты терапии:
Хирургическое лечение
Хирургическое вмешательство - основной метод лечения синдрома Конна. Проводится по возможности лапароскопическая адреналэктомия (см ниже).
У пациентов с синдромом Конна показателем эффективности будущей односторонней адреналэктомии в отношении артериальной гипертензии служит снижение кровяного давления в ответ на спиронолактон в предоперационный период. Спиронолактон назначается курсом по крайней мере на 1-2 недели (лучше на 6 недель) до хирургического вмешательства с целью снижения риска операции, коррекции гипокалиемии и установления контроля за артериальным давлением.
Следует учесть, что гипертония обычно не исчезает сразу после операции. Артериальное давление постепенно снижается в течение 3-6 месяцев. Почти все пациенты отмечают снижение цифр артериального давления после операции. Продолжительный терапевтический эффект наблюдается после односторонней адреналэктомии по поводу синдрома Конна в среднем у 69% пациентов.
К каким докторам следует обращаться если у Вас Гиперальдостеронизм первичный (синдром Конна):
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Гиперальдостеронизма первичного (синдрома Конна), ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору .
Узники собственного тела: синдром «взаперти»

Почти в любом сериале, посвященном работе врачей, есть эпизоды, связанные с лечением больного с синдромом «запертого человека» (Locked-in-syndrome). Что это за заболевание, и почему оно привлекает столько внимания, больше, чем другие редкие болезни? MedAboutMe предлагает разбираться вместе.
Заперты в собственном теле: псевдокома
В отличие от истинной комы, «запертый» человек находится в полном сознании. Но во многих случаях не может никак сообщить об этом окружающим, так как утрачивает способность управлять собственным телом. Врачи выделяют три степени синдрома запертого человека (СЗЧ):
- Полный СЗЧ. В этом состоянии нарушены все двигательные волокна, идущие от головного мозга, а также расположенные в стволе головного мозга центры дыхания, глотания, речи и мимики. Помимо тетраплегии (паралича всех четырех конечностей), у больного отсутствует возможность двигать всеми остальными мышцами тела, включая даже мышцы, обеспечивающие моргание и движение глаз.
- Классический СЗЧ. Все, что описано выше, за исключением вертикального движения глаз и моргания. Это дает возможность для общения с помощью специального кода, простейшим является код «Да-Нет», в котором утвердительному ответу соответствует одинарное моргание, отрицательному — двойное.
- Неполный СЗЧ. Помимо движения глаз, могут сохраняться или быстро восстанавливаться некоторые другие движения. Обычно это движения головы или всех или некоторых пальцев на руках и ногах, или движения мимических мышц.
Во всех случаях электроэнцефалограмма показывает нормальную активность мозга, но гораздо более показательным методом диагностики является позитронно-эмиссионная томография (ПЭТ). Болевая чувствительность может полностью отсутствовать или частично сохраняться.
По имеющейся статистике, чаще всего СЗЧ диагностируется у людей 40-50 лет, половая принадлежность не играет роли. Чем моложе больной, тем больше у него шансов на восстановление, особенно при адекватной терапии.
У врачей нет достаточно полной информации относительно редкости синдрома «запертого человека», так как, по всей видимости, многие случаи остаются недиагностированными. До 2009 года в медицинской литературе было описано всего 33 случая болезни. А это означает, что «запертые» в своем теле пациенты не получали того лечения, которое помогло бы им восстановиться хотя бы частично. А это возможно благодаря современным возможностям медицины. Еще недавно 80% пациентов с синдромом «взаперти» умирали в течение первых 6 месяцев после начала заболевания. Сегодня пятилетняя выживаемость — более 60%. Причем сами больные отмечают удовлетворительное качество своей жизни, несмотря на все имеющиеся ограничения возможностей.
Причины развития синдрома
Чаще всего СЗЧ развивается вследствие инсульта с локализацией очага поражения в мосте головного мозга.
Мост представляет собой подковообразное скопление нервных волокон, соединяющее продолговатый мозг и мозжечок, среди функций которого координация движений и управление двигательными функциями тела.
Другими причинами могут стать инфекционные заболевания мозга, синдром Гийена-Барре, боковой амиотрофический склероз (БАС), рак мозга с расположением опухоли в области задней черепной ямки, а также серьезные черепно-мозговые травмы.
Клинический случай: Рикке Кьергаард
В 2013 году, во время рождественских праздников, живущая в Великобритании Рикке Кьергаард внезапно почувствовала себя плохо. Всего за четверть часа ее температура поднялась до 42°С, женщина начала бредить. На следующий день она уже не могла даже сесть без помощи окружающих, и вскоре впала в кому. В отделении больницы скорой помощи у Рикке была обнаружена полиорганная недостаточность, тромбоз множества сосудов, токсический шок, поставлен диагноз бактериальный менингит. Сердце женщины останавливалось на 40 секунд, но реанимационные мероприятия оказались успешными, и сердцебиение возобновилось, но сознание не вернулось. На тот момент врачи оценивали шанс Рикке выжить как очень низкий — не выше 5%.
Женщина пробыла в состоянии комы 10 дней.
Но потом сознание начало к ней возвращаться. И она услышала, как врачи говорят ее мужу, что ему стоит начать готовиться к похоронам, так как шансов на то, что мозг его жены не умер, близки к нулю.
Рикке повезло: ее семья верила в нее. В какой-то момент муж Питер обратил внимание на то, что на вопросы жена отвечает морганием. Это стало сигналом, что функции мозга сохранились, что Рикке не только слышит, но и может общаться.
Процесс восстановления был долгим и трудным, ведь женщине пришлось не только заново учиться дышать, глотать, жевать, говорить, ходить, но и пережить ампутацию почти всех пальцев на руках из-за развившейся гангрены, и частичную потерю зрения: один глаз перестал видеть. Через 4 месяца Рикке смогла произнести первое слово.
Восстановившись, насколько это было возможно, Рикке Кьергаард основала компанию, главная цель которой — помогать людям с тяжелыми хроническими заболеваниями. А еще она написала книгу о своем удивительном опыте узника собственного тела.
Не всем «узникам» везет так же, как Рикке. Медицинский персонал или родственники (если они есть) могут не заметить проявлений сознания, особенно в случае полного СЗЧ, когда больной не может даже морганием дать понять, что слышит и осознает окружающее. Еще сложнее диагностировать СЗЧ, если у больного есть нарушения слуха и зрения.
Бельгийские исследователи сообщают в статье, опубликованной в 2005 году о том, что иногда диагностика синдрома требовала от 4 до 6 лет — пока окружающие улавливали признаки того, что больной находится в сознании. В той же статье указывается, что как только пациент после диагностики СЗЧ начинает получать адекватную медицинскую помощь, ожидаемая продолжительность жизни увеличивается до нескольких десятилетий, хотя шансы на восстановление двигательных функций могут оставаться низкими.
Лечение синдрома «взаперти»

Специфического лечения не существует, как и лекарств. В каждом случае терапия подбирается индивидуально, и направлена на устранение причин, вызвавших паралич. Однако замечено, что если в остром периоде заболевания начата интенсивная, или даже агрессивная терапия, шансов на восстановление больше. Известны случаи даже полного восстановления, но они очень редки. В большинстве случаев можно рассчитывать только на частичную реабилитацию.
На начальном этапе важнее всего поддерживающая терапия и обучение самого больного и окружающих навыкам общения с использованием имеющихся возможностей.
Проблемы могут возникать на разных уровнях, начиная с дыхания и питания. Из-за нарушения дыхательных функций пациенты с СЗЧ часто находятся на аппарате искусственного дыхания, воздух поступает в легкие через трахеостому — специальную трубку, вводимую в дыхательные пути через отверстие в трахее. Питание через рот в этом случае представляет опасность, поэтому больного кормят через зонд. Переход к обычному питанию возможен только после восстановления дыхательной и глотательной функций, и только жидкой или пюреобразной пищей.
Из-за неподвижности больного высок риск развития пневмонии, тромбоза, инфекций мочевыводящих путей, образования пролежней и контрактур конечностей. Пациент нуждается в частой смене положения тела, в массаже, физиотерапевтическом лечении.
С помощью логопедов устанавливается система общения. Благодаря современным технологиям у больных с СЗЧ появилась возможность использовать для общения компьютер. Для этого используются специальные датчики, реагирующие на движения глаз, а также синтезаторы речи. Если сохранились или восстановились двигательные функции каких-либо мышц, то возможности еще более расширяются: такие больные могут использовать коляски с электроприводом, с управлением, приспособленным к имеющимся возможностям.
Прогноз излечения
Несмотря на то, что многие люди, столкнувшиеся с синдромом «взаперти», не выживают из-за несовершенной диагностики или развившихся осложнений, у остальных есть довольно много шансов не только выжить, но и прожить несколько десятков лет.
Вот что говорят проведенные исследования.
Анализ информации, полученной от самих больных и их родственников, показывает, что окружающие часто оценивают качество жизни больных существенно ниже, чем сами больные. То есть, несмотря на все ограничения, очень многие пациенты с СЗЧ оценивают качество своей жизни как удовлетворительное и даже хорошее. При этом оценка качества жизни прямо связана с уровнем оценки психосоциальной поддержки со стороны окружающих. Это дает основания для вывода о том, что тяжелая двигательная инвалидность не обязательно воспринимается человеком как невыносимая. Анкетирование больных СЗЧ показало, что подавляющее большинство ценят жизнь, хотят и намерены жить столько, сколько получится.
В интернете можно найти несколько книг, написанных людьми, пережившими «заключение» в собственном теле, или остающимися взаперти. Каждая из них — история успешной борьбы и победы, маячок для тех, кто ищет опору и мотивацию, знак, что не стоит сдаваться и «умирать раньше смерти».
Читайте также:
- Дифференциальная диагностика воспалительных и инфекционных заболеваний толстой кишки
- Эффективность стерилизации в медицинских учреждениях. Оценка риска инфицирования
- Дыхание организмов. Рисунки ( картинки ) про дыхание.
- Общие сведения о боли
- Реабилитация после травмы связок голеностопного сустава и физиотерапия при них
