Рекомендации по методике УЗИ трансплантата почки
Добавил пользователь Алексей Ф. Обновлено: 22.01.2026
Ведение реципиента после трансплантации почки - комплекс диагностических и лечебных мероприятий, направленных на поддержание функций органов и систем организма реципиента донорской почки, а также профилактику, раннее выявление и лечение осложнений в раннем посттрансплантационном периоде (до трех месяцев после операции).
Пользователи протокола: нефрологи, анестезиологи-реаниматологи, трансплантологи, хирурги, урологи, терапевты, врачи общей практики, врачи скорой медицинской помощи.
Диагностика
II. МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
• общий анализ крови (определение гемоглобина, эритроцитов, лейкоцитов, тромбоцитов, гематокрита, СОЭ);
• биохимический анализ крови (определение общего белка, креатинина, мочевины, калия/натрия, глюкозы, билирубина, АлТ, АсТ);
• биохимический анализ крови (определение фосфора, железа, ферритина, амилазы, холестерина, щелочной фосфатазы, мочевой кислоты, альбумина, белковых фракций, С-реактивного белка);
• определение цитомегаловируса, герпеса 1 и 2 типа, вируса Эпштейн-Барра, токсоплазмы, кандиды в крови методом ИФА;
• биохимический анализ крови (определение общего белка, альбумина, креатинина, мочевины, калия, натрия, глюкозы, билирубина, АлТ, АсТ, амилазы, С-реактивного белка);
• определение базовой концентрации иммуносупрессивного препарата -С0 (циклоспорина А, такролимуса) в крови;
• определение цитомегаловируса, герпеса 1 и 2 типа, вируса Эпштейн-Барра, кандиды IgG/IgM в крови методом ИФА;
• биохимический анализ крови (определение щелочной фосфатазы,ГГТП, железа, белковых фракций, тест на толерантность к глюкозе);
• определение количественной ПЦР к цитомегаловирусу, герпесу 1 и 2 типа, вирусу Эпштейн-Барра (при положительном Ig M);
• определение вируса простого герпеса 6, 8 типа, полиомавируса, парвовируса, пневмоцисты IgG/IgM методом ИФА;
• иммунограмма (определение иммуноглобулинов классов А, М, G, количества субпопуляций Т- и В-лимфоцитов) методом ИФА;
• УЗИ органов брюшной полости (почки, печень, желчный; пузырь, селезенка, поджелудочная железа) и плевральных полостей, органов малого таза у женщин, простаты, мочевого пузыря;
• бактериологическое исследование биоматериалов (мочи, крови, мокроты, мазка из зева, промывных вод, отделяемого из раны, с катетера);
• наличие сопутствующей/фоновой соматической патологии (длительный сахарный диабет и/или артериальная гипертензия, первичные и/или вторичные болезни почек (гломерулярные, тубулоинтерстициальные, ВАРМС), системные заболевания, корригирующие операции на мочевыделительной системе);
• наличие вирусного гепатита, вирусной и/или бактериальной инфекции.
Объективно: средняя или тяжелая степень общего состояния, бледность кожных покровов и слизистых, высыпания на коже, герпес на губах, кровоизлияния, петехии, гипертермия, отечность, резкое снижение веса, одышка, повышение температуры тела, кашель, притупление легочного звука, ослабление везикулярного дыхания, наличие сухих, крепитирующих и влажных хрипов, нарушение ритма сердца, гипертензия, гипотония, следы расчесов на коже, увеличение границ сердца, акцент 2 тона над аортой, увеличение размеров печени, селезенки, увеличение размеров трансплантата, болезненность при пальпации, наличие артерио-венозной фистулы, подключичного катетера, послеоперационного шва, дренажной трубки.
• азотемия -повышение уровня креатинина выше 97 мкмоль/л у женщин, 115 мкмоль/л у мужчин, или повышение в динамике по сравнению с исходным уровнем;
• нарушение фосфорно-кальциевого обмена (гипокальцемия, гиперфосфатемия выше 1,76, повышенный уровень паратгормона выше 300), гипофосфатемия);
• бактериурия, патологический мочевой осадок (лейкоцитурия, гематурия, цилиндрурия).
диффузные изменения ткани печени и поджелудочной железы,, гепатоспленомегалия, асцит, наличие жидкости в полостях.
• увеличение объема трансплантата, наличие выпота в околопочечном пространстве, наличие лимфоцеле, патологических образований, камней, микролитов, свищей мочевых путей, расширение чашечно-лоханочной системы, отечность (гипоэхогенность) почечной ткани, симптом «выделяющихся пирамид», наличие полостей, микролитов, камней в трансплантате. УЗДГ сосудов почечного трансплантата - снижение/отсутствие линейных скоростей кровотока, повышение индексов сопротивления более 0,7, наличие аваскулярной зоны более 0,3 см.
• признаки сердечной недостаточности (ФВ<60%), снижение сократимости, диастолическая дисфункция, легочная гипертензия, пороки и регургитации клапанов.
• уремическая гастропатия: признаки эзофагита, гастрита, бульбита, дуоденита (поверхностный, катаральный, эрозивный, язвенный). Колоноскопия: уремический колит.
Биопсия с гистологическим исследованием биоптата: признаки клеточного или гуморального отторжения, тубулоинтерстициальный фиброз, признаки циклоспориновой интоксикации, аутоиммунные комплексы
Фибробронхоскопия: признаки бронхита.
• консультация кардиолога - для коррекции стойкой АГ, хронической сердечной недостаточности, нарушения ритма сердечной деятельности.
• консультация невропатолога - для лечения уремической энцефалопатии, периферической нейропатии, синдрома карпального туннельного синдрома.
• консультация психолога - для диагностики и коррекции психологических расстройств (депрессия, анорексия и т.п.), связанные с длительным хроническим заболеванием, в послеоперационном периоде.
• консультация анестезиолога - при необходимости катетеризации центральной вены для проведения гемодиализа/подготовки к операции.
• консультация гематолога - с целью исключения гематологических заболеваний при развитии лейкемоидной реакции, цитопении, развитии ДВС-синдрома.
• консультация эндокринолога - для диагностики и коррекции лечения заболеваний эндокринной системы (сахарный диабет, первичный и вторичный гиперальдостеронизм, гиперпаратиреоидизм и др.)
Лечение
Восстановление или улучшение функции почечного трансплантата, коррекция сопутствующей патологии и осложнений основного заболевания
(поддержание водно-электролитного баланса, коррекция питания, коррекция артериальной гипертензии, анемии, болезни костей, ацидоза, снятие уремической интоксикации).
Тактика лечения
Алгоритм ведения реципиента после трансплантации почки в отделении анестезиологии и реанимации - согласно приложения 11 к Стандарту организации оказания нефрологической помощи населению Республики Казахстан, утвержденному приказом Министра здравоохранения Республики Казахстан №765 от 30 декабря 2014 года.
В первые 3-7 дней после операции трансплантации почки - строгое соблюдение правил асептики и антисептики.
• В раннем послеоперационном периоде калорийность суточного рациона должна составлять 3000- 3500 ккал/сут, в последующем - снижение до 1000 - 1500 ккал/сут.
• Диетический рацион должен быть максимально сбалансирован по количеству белков, жиров, углеводов, витаминов, макро- и микроэлементов, жидкости.
• Общее количество углеводов в диете должно составлять 45-50%, с ограничением быстро всасываемых рафинированных сахаров и увеличением пищевых волокон. Преимущество должно отдаваться продуктам растительного происхождения (крупы, овощи, фрукты).
• Предпочтение должно отдаваться белкам животного и растительного происхождения (нежирное мясо, птица, молочные продукты, бобовые и т.д.).
• Необходимо потреблять продукты питания, богатые витаминами и микроэлементами: фолиевой кислотой, витаминами группы В, С, L-карнитина и др. [18].
• Необходимо обучать пациентов расчитывать суточную энергетическую потребности с использованием таблиц [19].
• При несостоятельности самостоятельного питания и выраженного дефицита ИМТ принять во внимание питание через назогастральный зонд [20].
• Противовирусная и противогрибковая терапия (с целью профилактики и лечения вирусных и грибковых инфекций).
• Симптоматическая терапия (коррекция фосфорно-кальциевых и электролитных нарушений, гипотензивная, спазмолитическая, анальгетическая, инфузионная, гемостатическая, трансфузионная терапия, лечение анемии т.д.).
• Профилактическая терапия (противоязвенные, уросептики, антикоагулянты).
Индукционная терапия - это лечение с применением биологических агентов (лимфоцитразрушающих агентов - антитимоцитарный глобулин (ATG) или антагонистов рецепторов интерлейкина 2 (IL2-RA, Базилискимаб).
Индукционная терапия предназначена для уменьшения или модуляции Т-клеток во время презентации антигена, применяется для повышения эффективности иммуносупрессивных препаратов.
• Сандиммун-неорал, 3-5 мг/кг per os в 2 приема, начало терапии - за 1-3 дня до операции, в день операции - 3-5 мг/кг per os утром/ Такролимус 0,05 - 0,15мг/кг per os в 2 приема, начало терапии - за 1-3 дня до операции, в день операции - 0,05 - 0,15мг/кг per os утром;
• Микофенолат мофетил в день операции - 1000 мг per os утром/ Микофеноловая кислота в день операции 720 мг per os утром;
• Метилпреднизолон 500- 1000 мг внутривенно за 30 минут до реперфузии трансплантата (интраоперационно);
• Базиликсимаб 1-ая доза внутривенно за 2 часа до трансплантации или интраоперационно/Антитимоцитарный тимоглобулин в дозе от 1 - 1.5 мг/кг/сутки в течение 1-9 дней до трансплантации.
При положительной реакции кросс-матч - ритуксимаб (Мабтера) 375мг/м2 поверхности тела в/в один раз, после чего 3-9 сеансов плазмафереза с замещением альбумином 5%-20% и/или СЗП до достижения отрицательного кросс-матча. Одновременно назначается внутривенно человеческий иммуноглобулин по схеме. За 3 -5 суток до операции назначается двухкомпонентная иммуносупрессивная терапия, включающая ИК и ММФ/МКв терапевтических дозировках.
Базовую (поддерживающую) иммуносупрессивную терапию пациенты принимают от одного производителя в течение всего периода жизни трансплантата. Замена препарата на другой осуществляется только в условиях стационара под контролем концентрации иммуносупрессанта в крови.
• Постепенная минимизация иммуносупрессии для профилактики хронического повреждения трансплантата и снижения риска развития инфекционных осложнений и онкологических заболеваний.
• Сандиммун-неорал: 0-1 месяц после трансплантации в дозе 5-10 мг/кг/сут (С0 -150-350 нг/мл); 2-3 месяц - С0 - 200-250 нг/мл; 3-6 месяцев - С0 -100-200нг/мл; 6 мес-1 год - С0-100нг/мл; после 1 года - С0 - 80-100 нг/мл;
• Микофенолат мофетил: рекомендуемая доза составляет в 0-1 месяц - 2000 мг в сутки, со 2 месяца допускается снижение до 1500 мг/сутки;
• Микофеноловая кислота: рекомендуемая доза в 0-1 месяц - 1440 мг в сутки, со 2 месяца допускается снижение до 1080 мг/сутки;
• Преднизолон: 30-100 мг/сут- стартовая доза, затем уменьшение дозы до 20 мг/сут; к 3-му месяцу - 10 мг/сут, 6 мес-1 год - 5 мг/сут; больше 1 года - возможна отмена.
• Метилпреднизолон: 24-80 мг/сут стартовая доза, затем уменьшение дозы до 16 мг/сут; 2-3месяц - 8 мг/сут; к концу 6 месяца - 4 мг/сут; 6 месяцев- 1 год - 4 мг/сут; больше 1 года - возможна отмена.
Используемые дозы и целевые уровни циклоспорина могут варьировать в зависимости от метода определения концентрации препарата, опыта, протокола иммуносупрессии, сопутствующих заболеваний и анамнеза отторжения. Для лучшего контроля предпочтителен мониторинг экспозиции циклоспорина по 2-часовым (С2) пиковым уровням.
• Вирусные, грибковые, бактериальные инфекции (острое течение или обострение хронических процессов).
Антибактериальная терапия по чувствительности высеваемого возбудителя (меропенем, ванкомицин, цефтриаксон и др.).
Терапия: флуконазол 3-6 мг/кг/сут в первый день, затем 3мг/кг/сут через день (максимальная доза 100мг/сут) - 4 недели. Снижение СКФ ≤50мл/мин требует уменьшения дозы флуконазола в 2 раза,
Терапия: Ко-тримоксазол 60мг/кг 2 раза в день через рот или внутривенно 10-14 дней. Необходимо уменьшение дозы при нарушении почечной функции.
Цитомегаловирусная болезнь диагностируется при увеличении ЦМВ по ПЦР или при появлении системных признаков: гипертермия, анемия, нейтропения, гастроинтестинальные проявления, поражение внутренних органов, нарушение функции трансплантата.
Ганцикловир (Цимевен) назначается при клиренсе креатинина больше 80мл/мин/1.73м2 доза 5мг/кг 2 раза в день.
Лечение вируса Эпштейна-Барр и посттрансплантационных лимфопролиферативных заболеваний: требуется уменьшение иммуноссупрессии.
При вторичном гиперпаратиреозе назначается цинакальцет (мимпара) в качестве монотерапии, а также может также назначаться в составе комбинированной терапии, включающей препараты, связывающие фосфаты и/или витамин D. Взрослым и пожилым (>65 лет) рекомендуемая начальная доза для взрослых составляет 30 мг 1 раз в день. Титрование дозы следует проводить каждые 2-4 нед до максимальной дозы 180 мг (1 раз в сутки), при которой у пациентов достигается целевая концентрация ПTГ в диапазоне 150-300 пг/мл (15,9-31,8 пмол/л), определяемая по концентрации иПТГ. Определение концентраций ПТГ должно проводиться не раньше, чем через 12 ч после приема препарата. При оценке концентрации ПТГ следует придерживаться современных рекомендаций.
Определение концентрации ПТГ следует проводить через 1-4 нед после начала терапии или коррекции дозы препарата цинакльцет. При приеме поддерживающей дозы мониторинг концентрации ПТГ должен проводиться примерно 1 раз в 1-3 мес. Во время титрования дозы необходимо часто проводить мониторинг концентрации кальция в сыворотке крови, в т.ч. через 1 нед после начала терапии или коррекции дозы препарата. При достижении целевой концентрации ПТГ и переходе на поддерживающую дозу, концентрации кальция в сыворотке крови должен оцениваться примерно 1 раз в месяц. Если концентрация кальция в сыворотке крови падает ниже нормального диапазона, необходимо предпринять соответствующие меры, включая коррекцию сопутствующей терапии
При повышенном уровне ПТГ в сочетании с гипокальциемией назначается альфакальцидол внутрь, при этом начальная доза составляет 1 мкг/сут, может повышаться на 0.5 мкг каждые 2-4 нед до 2 (в редких случаях до 3) мкг/сут; поддерживающая доза - 0.25-1 мкг/сут. При достижении оптимальной эффективной дозы рекомендуется контролировать содержание кальция в плазме каждые 3-5 нед.
При уменьшении уровня фосфора в крови менее 0,7ммоль/л необходима инфузия глицерофосфат натрия: 0,1-0,3ммоль/кг (до 1ммоль/кг/сут); 15 ммоль Na фосфата+физиологический раствор 50мл (0,3ммоль/мл) со скоростью 0,5-3мл/час. Внутрь фосфат натрия/фосфат калия 4-6 таблеток в день.
При уменьшении уровня магния в крови менее 0,5ммоль/л или при появлении симптомов гипомагниемии (повышение нервной и мышечной возбудимости, тремор, повышение тонуса мышц, спазм кистей, стоп, общее двигательное возбуждение) необходима инфузия 0,2мл/кг 50% раствора магния сульфата (максимум 10мл) медленно внутривенно 1 -2 раза в день.
Внутрь Магния лактата дигидрат (Магне В6), 1 таблетка содержит 48мг Mg++; 300мг/сут в пересчете на магний (6 таблеток) 2-3 раза в день во время еды.
При уменьшении уровня кальция в крови менее 2,0ммоль/л или при появлении симптомов гипокальциемии (онемение, покалывание, мышечные судороги и подергиваниями, вплоть до тетании и эпилептических припадков) необходимо внутривенно ввести 0,5мл (0,113ммоль)/кг 10% раствора глюконата кальция медленно внутривенно через центральный катетер под контролем ЭКГ. Внутрь кальция карбонат (Витрум кальций, 1 таблетка содержит 500мг Са) 1-2 таблетки в день.
При уменьшении уровня калия в крови менее 3,3ммоль/л необходима инфузия 1-2 ммоль/кг/сутки, не более 20 ммоль калия в час, т.к. 50мл/час 4% раствор калия хлорида 10 мл (0,4г) = 5,4 ммоль (= мэкв) или 7,5% раствора калия хлорида 100мл (в 1 мл содержится 1 мэкв К+). Струйное и быстрое капельное введение раствора, содержащего калий, категорически запрещено, так как можно вызвать гиперкалиемию и остановку сердца. Раствор калия хлорида добавляют в растворы глюкозы и изотонический раствор натрия хлорида.
• Натрия нитропруссид, 0,25-0,5мкг/кг/мин→1мкг/кг/мин, не более 10мкг/кг/мин.
• Ранитидин 2-3мг/кг 2 раза в день через рот, не более 300мг/сут (при СКФ менее 50мл/мин уменьшить доза в 2 раза);
• Омепразол 0,7-1,4мг/кг, 10-25кг - 10мг/сут 1 раз в день, более 20кг - 20мг/сут 1 раз в день, до завтрака - 1 месяц.
• Хинолоны и фторхинолоны: хинолоны первого поколения - налидиксовая кислота (неграм, невиграмон) и пипемидовая кислота (палин, пимидель) 200 мг по 2 капсуле 2 раза в день, и хинолоны второго поколения (фторхинолоны) - норфлоксацин (нолицин) 400 мг по 1 таблетке 2 раза в день. На сегодняшний день нолицин (норфлоксацин) можно считать препаратом выбора при любой мочевой инфекции.
• Аспирин- МНН ацетилсалициловач кислота 1мг/кг/сут 1 раз в день через рот, назначается после фраксипарина или клексана.
Медикаментозное лечение, оказываемое на амбулаторном уровне
УЗИ почки трансплантата (лекция на Диагностере)
Статья находится в разработке.
УЗИ трансплантата почки проводили методом УЭСВ, а также использовали стандартные режимы сканирования:
1) серошкальное сканирование: оценка состояния и топометрия трансплантата (размеры трансплантата, толщина коркового слоя, величина чашечно-лоханочной системы и т.д.), оценка состояния околопочечного пространства;
2) цветовое доплеровское картирование скорости и энергии кровотока;
3) спектральное доплеровское исследование.
При пересадке почки методом УЗИ оценивают возможные осложнения в пересаженной почке.
Обычно первое УЗИ проводят через 24-48 часов после трансплантации.
Часто выполняемый с помощью радионуклидной визуализации (йод-131 ортойодогиппурат, Tc-99m MAG3).
Важно знание хирургической техники, отчета об операции часто улучшает интерпретацию исследования.
Трансплантированная почка обычно располагается забрюшинно в подвздошной ямке, чаще справа.
При трансплантации трупной почки основную почечную артерию забирают с прикрепленной частью донорской аорты.
Затем анастомозируется из стороны в сторону к наружной подвздошной артерии реципиента.
Трансплантация живых доноров включает прямой сквозной трансплантат почечной артерии к наружной подвздошной артерии или сквозной анастомоз с внутренней подвздошной артерией.
Основная почечная вена почти всегда пересаживается реципиентной наружной подвздошной вене сквозным образом.
Мочевой дренаж обычно восстанавливается путем имплантации донорского мочеточника в купол мочевого пузыря (уретеронеоцистостомия).
Хотя он также может быть имплантирован в нативный мочеточник или почечную лоханку.
Структурная оценка
Общая структурная оценка включает: эхогенность, кортикомедуллярная дифференциация должна быть сохранена, размер почек.
Увеличение может указывать на отек, который неспецифичен, но изменение размера между исследованиями является признаком основного заболевания.
Хирургические осложнения: Обструктивная уропатия, гидронефроз,проксимальный гидроуретер
Коллекции жидкостей
Характер сбора жидкости после трансплантации не может быть надежно определен только по внешнему виду ультразвука, так как большинство из них безэховые с различными внутренними акустическими характеристиками.
Лучше всего это делать на основе шкалы времени, поскольку разные сборы жидкости имеют тенденцию представлять в разное время в послеоперационном периоде:
сразу после операции: гематома
1-2 недели после операции: уринома
3-4 недели после операции: перинефритический абсцесс
2-й месяц и далее: лимфоцеле
Оценка сосудов
тромбоз почечной вены или стеноз
изменение диастолического кровотока в почечной артерии
тромбоз почечной артерии или стеноз
высокие скорости потока в месте стеноза
пиковая систолическая скорость ≥2 м / с
разница скоростей между пре- и постстенотическими сегментами 2:1
постстенотическое расширение спектра
Форма волны Парвуса и Тардуса дистальнее стеноза
обычно развивается через месяцы или недели
псевдоаневризма: обычно после биопсии или другой почечной пункции
внутрипочечный артериовенозный свищ
Медицинские осложнения
Существует ряд медицинских причин дисфункции или отказа почечного трансплантата:
острый тубулярный некроз
отказ
сверхострый: сразу после операции
острый: 1-3 недели после пересадки
хронический:> 3 месяца после пересадки
лекарственная нефротоксичность
рецидивирующее заболевание, например рецидивирующая IgA нефропатия
пиелонефрит
встречается у 80% получателей в первый год
Ультразвуковое исследование при медицинских осложнениях трансплантата неспецифично и может включать:
повышенный резистивный индекс (RI)> 0,8
очаговый или диффузный паренхиматозный отек
В конечном счете, пациенты с подозреваемыми медицинскими причинами дисфункции трансплантата подвергаются биопсии для окончательного диагноза.
Главная » Методы диагностики заболеваний » Ультразвуковая диагностика »
Дергачев А.И., Котляров П.М., Абдоминальная эхография .Справочник, 2003
« предыдущая
к содержанию
следущая »
Трансплантация почки Ультразвуковое исследование трансплантированной почки
Трансплантированная почка обычно располагается вдоль поверхности подвздошнопоясничной мышцы, ее эхогенность совпадает с эхо- генностью обычной почки. Эхографические признаки отторжения трансплантата включают: патологическое увеличение размеров почки, гидронефроз, паранефральное скопление жидкости, гематомы, абсцессы и экстраренальные накопления мочи. При допплерографии почечного кровотока обычно определяется увеличение сосудистого сопротивления или полное прекращение кровотока в главной почечной артерии, междолевых артериях, дугообразных артериях (для исключения отторжения), почечной вене (для исключения перегиба почечной вены).
Способ диагностики острого отторжения пересаженной почки
Способ диагностики острого отторжения пересаженной почки путем определения в послеоперационном периоде индекса периферического сопротивления сосудистого русла трансплантата при допплеросонографии и, дополнительно, эхосканировании, определяют объем трансплантата, толщину его паренхимы, индекс примамид мозгового вещества,а индекс периферического сопротивления сосудистого русла пересаженной почки определяют по отношению разницы максимального пикового систолического допплеровского частотного сдвига в конце диастолы к максимальному пиковому систолическому допплеровскому частотному сдвигу и при индексе периферического сопротивления сосудистого русла пересаженной почки более 0,79, или объеме почки более 300 см3, или толщине паренхимы более 2 см и индексе пирамид мозгового вещества более 2,1, или толщине паренхимы меньше или равной 2,0 см и индексе пирамид мозгового вещества более 2,8 диагностируют острое отторжение пересаженной почки (Арутюнян С. М. и соавт., 1990).
Рекомендации по методике УЗИ трансплантата почки
М.Г. ТУХБАТУЛЛИН 1,2 , Р.Х. ГАЛЕЕВ 2 , Л.И. ГАРИФУЛЛИНА 1 , Ш.Р. ГАЛЕЕВ 1
1 Казанская государственная медицинская академия , 420012, г. Казань, ул. Бутлерова, д. 36
2 Республиканская клиническая больница МЗ РТ, 420064, г. Казань, Оренбургский тракт, д. 138
В статье представлены результаты 205 ультразвуковых исследований почечных трансплантатов у 85 больных за период с 02.11.2015 г. по 25.04.2016 г. Установлена диагностическая значимость ультразвуковой эластографии сдвиговой волны в оценке состояния трансплантированной почки в ранние и отдаленные сроки наблюдения.
Ключевые слова: ультразвуковое исследование, компресссионная эластография, эластография сдвиговой волны, допплерографическое исследование.
M.G. TUKHBATULLIN 1,2 , R.Kh. GALEEV 2 , L.I. GARIFULLINA 1 , Sh.R. GALEEV 1
1 Kazan State Medical Academy, 36 Butlerov Str., Kazan, Russian Federation, 420012
2 Republican Clinical Hospital of the MH of RT, 138 Orenburgskiy Trakt, Kazan, Russian Federation, 420064
Modern ultrasound diagnostics in the assessment of renal transplant
The article presents the results of 205 ultrasound examinations of kidney transplants in 85 patients from 02.11.2015 till 25.04.2016. The diagnostic value of the shear wave ultrasound elastography is discussed for the evaluation of the transplanted kidney at various stages after transplantation.
Key words: ultrasound examination, compression elastography, shear wave elastography, Doppler examination.
В настоящее время ультразвуковая эластография ― метод качественного и количественного анализа упругих свойств тканей, приобретает все большее клиническое значение. Термин «эластография» (от лат. еlasticus ― «упругий») впервые предложили в 1991 г. врачи-исследователи из Хьюстона (США). Физической составляющей эластографии является модуль упругости Юнга, который характеризует свойства мягких тканей сопротивляться растяжению/сжатию при упругой деформации. В зависимости от способа расчета модуля упругости Юнга эластографию подразделяют на компрессионную и эластографию сдвиговой волны [1, 2].
Компрессионная эластография (real time elastography-RTE) ― метод качественной оценки упругих свойств тканей, основанный на уравнении Е=σ/ɛ, где Е ― модуль упругости Юнга, σ ― величина компрессии, ɛ ― относительная деформация столбика ткани (стрейн-напряжение). Данный метод используется для исследования поверхностно и глубоко расположенных органов, таких как молочные железы, щитовидная железа, предстательная железа, матка, мочевой пузырь и т.д. [1]. Более упругий, твердый объект (например, опухоль) уменьшается в объеме меньше, чем здоровая ткань. Компрессионная эластография дает возможность сравнить упругости различных участков ткани. Отношение показателей упругости называется относительным показателем или коэффициентым деформации SR (strain ratio). Относительно новым является применение компрессионной эластографии в определении эластических свойств глубоко расположенных органов ― печени, почек, поджелудочной железы [3].
Ультразвуковая эластография сдвиговой волны (УЭСВ). С точки зрения физики, сдвиговая волна ― упругая поперечная волна (в отличие от продольной ультразвуковой), которая вызывает смещение частиц среды перепендикулярно направлению распространения волны. Методика базируется на уравнении Е=3*р*С 2 , где Е ― модуль упругости Юнга (Ра), С ― скорость сдвиговой волны (м/сек.), р ― плотность вещества (кг/м 3 ). Скоростные показатели прямо пропорциональны показателям упругости (жесткости) ткани. Следовательно, чем выше жесткость, тем выше скорость [4]. Жесткость тканей определяется в килопаскалях (кПА).
Электронный способ генерации волн используется в ультразвуковых сканерах производителей Aixplorer (SuperSonic Imaging S.A., Aixen-Provens, Франция), Ultima PA Expert (Радмир, Украина) и Acuson S3000 (Siemens, Германия). Причем генерация волн электронным способом также различна. В ультразвуковых сканерах Acuson S3000 (Siemens, Германия) для создания сдвиговой волны используется мощный ульразвуковой импульс, который приобретает максимальную величину в определенной точке-источнике сдвиговых волн, распространяющихся в перпендикулярном направлении. В ультразвуковых системах Aixplorer (SuperSonic Imagine, Франция) и Ultima (Радмир, Украина) с определенной временной задержкой создается не одна, а несколько точек давления по глубине с последующим формированием фронта сдвиговых волн [1, 4].
В таблице приведены экспериментально полученные количественные данные оценки модуля Юнга и, следовательно, жесткости различных тканей [Sarvazyan A.P., 2001] 6. Полученные результаты выражаются в килопаскалях (kPa).
Таблица.
Данные оценки модуля Юнга (экспериментальные данные)
Нормальная гранулированная (normal grandular)
Фиброзная ткань (fibroustissue)
Нормальная ткань задней поверхности (normal posterior)
Доброкачественная гиперплазия предстательной железы (BPH)
Клиническое применение ультразвуковой эластографии:
― диагностика и классификация злокачественных образований молочной железы, печени, простаты, щитовидной железы и др.;
― интервенционный ультразвук: контроль за правильностью наведения биопсийной иглы; терапевтических процедур типа радиочастотной абляции и высокоинтенсивного сфокусированного ультразвука (high intensity focusing ultrasound ― HIFU);
― мониторинг изменений при лечении злокачественных образований;
― трансплантология (мониторинг возможного отторжения трансплантированной почки);
― кардиология (Myocardial Elastography ― ME);
― ангиология ― в частности, исследование характера и жесткости бляшек (Endovascular elastography ― EVE) 6.
Роль трансплантации почки (ТП) на сегодняшний день трудно переоценить. Данный метод относится к наиболее радикальным способам лечения терминальных заболеваний почек. Являясь одним из видов заместительной почечной терапии, трансплантация позволяет не только обеспечить высокий уровень качества жизни, снизить стоимость лечения, уменьшить риски кардиоваскулярной летальности, но и достоверно увеличить продолжительность жизни данной категории пациентов. Допплерографическое исследование и ультразвуковая эластография сдвиговой волны в комплексе, оказались весьма перспективными методами для исследования почечного трансплантата, определения осложнений и морфологических изменений.
Цель исследования ― изучить диагностическую значимость ультразвуковой эластографии сдвиговой волны (УЭСВ) в оценке состоянии почечного трансплантата на разных сроках.
Материал и методы
За период с 02.11.2015 г. по 25.04.2016 г. было выполнено 205 УЗИ почечных трансплантатов у 85 пациентов, средний возраст которых составил 38,2±2,1 года. Сроки проведения УЗИ от 0 суток до 10 лет после трансплантации почки. УЗИ проводилось на аппарате Aixplorer (SuperSonic Imagine S.A., Aixen-Provence, Франция), с применением конвексного датчика 1-6 МГц. Исследование проводилось в РКБ МЗ РТ. При оценке состояния трансплантата нами определялись контуры почки, однородность и эхогенность паренхимы, состояние почечного синуса, чашечно-лоханочной системы и мочеточника. При топометрии устанавливались размеры (длина, ширина и толщина) почечного трансплантата. Оценка состояния околопочечного пространства сводилась к поиску свободной жидкости вокруг трансплантата, которая может наблюдаться при образовании гематом, урином и лимфоцеле. В режимах цветовой и спектральной допплерографии был оценен кровоток в сосудах почечного трансплантата, включая сосудистый анастомоз. Определялись систолическая, диастолическая скорости кровотока и индексы резистентности в сегментарных, дуговых и междольковых артериях. При режиме УЭСВ оценивалась жесткость паренхимы на верхнем, нижнем полюсе, латеральном и медиальном крае почечного трансплантата. Для сравнительного анализа, все результаты исследования были разделены на две группы: первая группа ― пациенты на сроках от 0-30 суток после пересадки почки, вторая ― пациенты на сроках более 30 суток после операции. Основной причиной, приведшей к хронической почечной недостаточности (ХПН), у пациентов, перенесших трансплантацию почки, являлся хронический гломерулонефрит.
Результаты и обсуждение
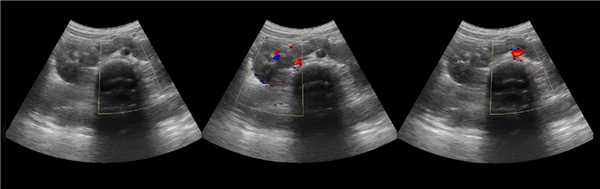
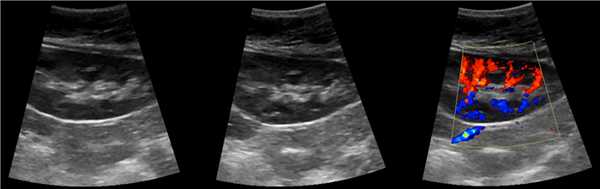
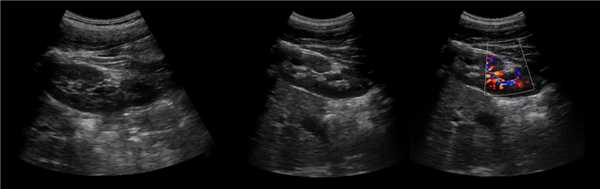
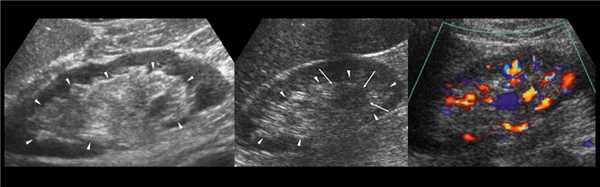
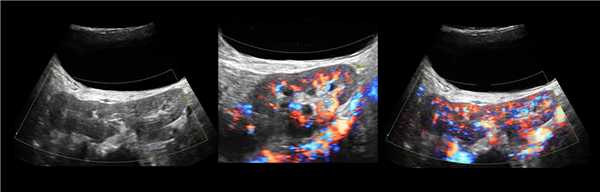
Клинический пример из первой группы. Пациент М., с хронической почечной недостаточностью. Трансплантация почки произведена от живого родственного донора. Трансплантат находится в правой подвздошной области. При нормальном функциональном состоянии трансплантата, показатели цветовой и спектральной допплерографии оценивались как удовлетворительные, с индексом резистентности не более 0,60 (рис. 1); показатели жесткости паренхимы почечного трансплантата при УЭСВ на различных участках составили от 20,05 до 29,18 кПа (рис. 2-4).
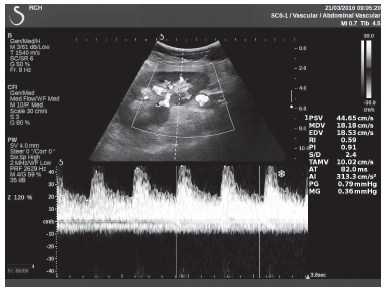
Рисунок 1. Ультразвуковое исследование в режиме цветовой и спектральной допплерографии в междольковых и сегментарных артериях у пациента М. Показатели кровотока в данном случае не изменены
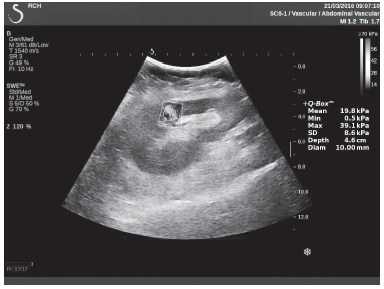
Рисунок 2. Исследование в режиме ультразвуковой эластографии сдвиговой волны у пациента М.: жесткость паренхимы в зоне медиального края трансплантата 19,8 кПа
Рисунок 3. Исследование в режиме ультразвуковой эластографии сдвиговой волны у пациента М.: жесткость паренхимы в зоне верхнего полюса почечного трансплантата 21,4 кПа
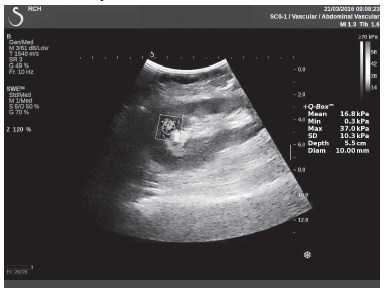
Рисунок 4. Исследование в режиме ультразвуковой эластографии сдвиговой волны у пациента М.: жесткость паренхимы в зоне нижнего полюса почечного трансплантата 16,8 кПа
У пациентов второй группы, при нормальных показателях клинико-лабораторных и допплерографических исследований, показатели жесткости почечного трансплантата составили 17,00-26,06 кПа.
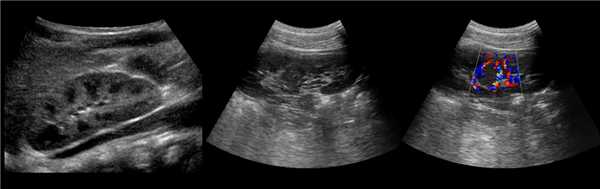
Клинический пример из второй группы. Пациент К. перенес операцию пересадки почки от живого родственного донора. Трансплантат в левой подвздошной области. Индекс резистентности в междольковых артериях составил 0,70 (рис. 5). В сегментарных артериях индекс резистентности составил 0,66 (рис. 6). Показатели жесткости паренхимы почечного трансплантата при режиме УЭСВ составили от 31,6 до 36,9 кПа (рис. 7-9).
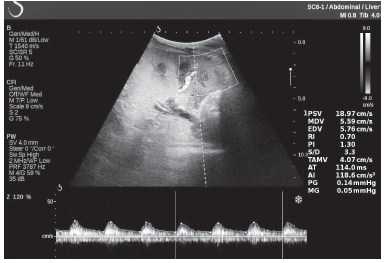
Рисунок 5. Исследование у пациента К. в режиме цветовой и спектральной допплерографии. Индекс резистентности в междольковых артериях почечного трансплантата составил 0,70
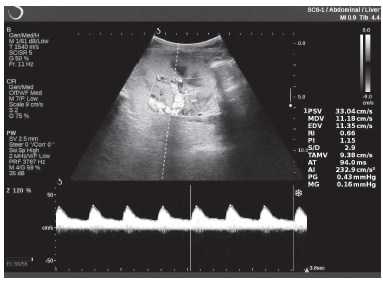
Рисунок 6. Эхограмма пациента К. Кровоток в сегментарных артериях неизменен
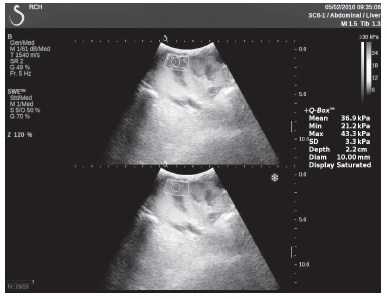
Рисунок 7. Исследование в режиме ультразвуковой эластографии сдвиговой волны у пациента К.: жесткость паренхимы в зоне медиального края почечного трансплантата 36,9 кПа
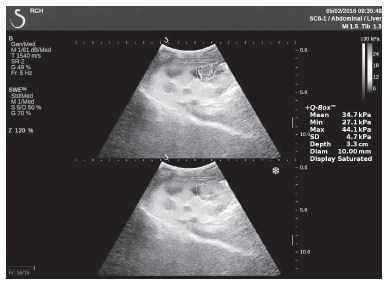
Рисунок 8. Исследование в режиме ультразвуковой эластографии сдвиговой волны у пациента К.: жесткость паренхимы в зоне нижнего полюса почечного трансплантата 34,7 кПа
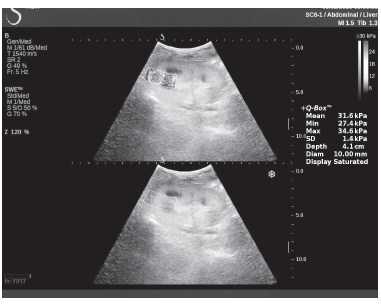
Рисунок 9. Исследование в режиме ультразвуковой эластографии сдвиговой волны у пациента К.: жесткость паренхимы у верхнего полюса почечного трансплантата 31,6 кПа
Заключение
При снижении скорости кровотока и повышении индекса резистентности до 0,70 и более, как в первой, так и во второй группах, показатели УЭСВ составили от 28,00 до 39,45 кПа. Повышение жесткости паренхимы почечного трансплантата, на наш взгляд, связано с начавшимися изменениями (фиброза) в паренхиме почки. При повышении индекса резистентности более 0,70 показатели жесткости паренхимы при УЭСВ является дополнительным критерием, позволяющим оценить функциональное состояние почечного трансплантата. Ультразвуковая эластография ― новая развивающаяся методика, чувствительность, специфичность и точность которой увеличиваются при комплексном использовании с другими методами исследования. Анализ результатов проведенных исследований выявил значительные клинические возможности и перспективы применения метода ультразвуковой эластографии сдвиговой волны в оценке состояния почечного трансплантата. Полученные данные о диагностической точности метода позволяют использовать результаты в целях принятия решения о дальнейшем ведении пациента и тактике лечения [4].
1. Зыкин Б.И., Постнова Н.А., Медведев М.Е. Эластография: анатомия метода // Променева диагностика, променева терапия. ― 2012. ― 2-3.
2. Зубарев А.Р., Федорова В.Н., Демидова А.К. и соавт. Ультразвуковая эластография как новая ступень в дифференциальной диагностике узловых образований щитовидной железы: обзор литературы и предварительные клинические данные // Медицинская визуализация. ― 2010. ― №1. ― С. 11-16.
3. Тухбатуллин М.Г., Алиева И.М. Современные ультразвуковые технологии в клинической практике // Практическая медицина. ― 2012. ― №5.
4. Тухбатуллин М.Г., Галеева З.М., Бастракова А.Е. Ультразвуковая эластография // Эхография в диагностике заболеваний внутренних и поверхностно расположенных органов. ― Казань: Медицинская книга, 2016. ― С. 119-130.
5. Bamber J. et al. EFSUMB* Guidiness and recommendations on the clinical use of ultrasoundelastography. Part 1: Basic principles and technology // Ultrashall in Med. ― 2013. ― 34. ― P. 164-168.
6. Bamber J. et al. EFSUMB* Guidelines and Recommendations on the Clinical Use of Ultrasound Elastography. Part 2: Basic Principles and Technology // Ultrashall in Med. ― 2013. ― 34. ― P. 169-184.
7. Осипов Л.В. Ультразвуковые диагностические приборы: Режимы, методы и технологии —М.: Изомед, 2011. ― 312 с.
8. Ophir J. et al. Elastography: Imaging the Elastic Properties of Soft Tissues with Ultrasound // J. Med. Ultrasonics. ― 2002. ― P. 155-171.
9. Ophir J., Cespedes I., Ponnekanti H., Yazdi Y., Li X. Elastography: a quantita-tive method for imaging the elasticity of biological tissues // Ultrason Imaging. ― 1991. ― Vol. 13. ― P. 111-134.
1. Zykin B.I., Postnova N.A., Medvedev M.E. Elastografiya: anatomiya metoda [Elastography: anatomy method]. Promeneva diagnostika, promeneva terapiya, 2012, 2-3.
2. Zubarev A.R., Fedorova V.N., Demidova A.K. et al. Ultrasound elastography as a new stage in the differential diagnosis of thyroid nodules: a literature review and preliminary clinical data. Meditsinskaya vizualizatsiya, 2010, no. 1, pp. 11-16 (in Russ.).
3. Tukhbatullin M.G., Alieva I.M. Modern ultrasound technology in clinical practice. Prakticheskaya meditsina, 2012, no. 5 (in Russ.).
4. Tukhbatullin M.G., Galeeva Z.M., Bastrakova A.E. Ul’trazvukovaya elastografiya [Ultrasound elastography]. Ekhografiya v diagnostike zabolevaniy vnutrennikh i poverkhnostno raspolozhennykh organov. Kazan: Meditsinskaya kniga, 2016. Pp. 119-130.
5. Bamber J. et al. EFSUMB* Guidiness and recommendations on the clinical use of ultrasoundelastography. Part 1: Basic principles and technology. Ultrashall in Med, 2013, 34, pp. 164-168.
6. Bamber J. et al. EFSUMB* Guidelines and Recommendations on the Clinical Use of Ultrasound Elastography. Part 2: Basic Principles and Technology. Ultrashall in Med, 2013, 34, pp. 169-184.
7. Osipov L.V. Ul’trazvukovye diagnosticheskie pribory: Rezhimy, metody i tekhnologii [Ultrasonic diagnostic equipment: Modes, methods and technologies]. Moscow: Izomed, 2011. 312 p.
8. Ophir J. et al. Elastography: Imaging the Elastic Properties of Soft Tissues with Ultrasound. J. Med. Ultrasonics, 2002, pp. 155-171.
9. Ophir J., Cespedes I., Ponnekanti H., Yazdi Y., Li X. Elastography: a quantita-tive method for imaging the elasticity of biological tissues. Ultrason Imaging, 1991, vol. 13, pp. 111-134.
Трансплантированная почка обычно располагается вдоль поверхности подвздошнопоясничной мышцы, ее эхогенность совпадает с эхо- генностью обычной почки. Эхографические признаки отторжения трансплантата включают: патологическое увеличение размеров почки, гидронефроз, паранефральное скопление жидкости, гематомы, абсцессы и экстраренальные накопления мочи. При допплерографии почечного кровотока обычно определяется увеличение сосудистого сопротивления или полное прекращение кровотока в главной почечной артерии, междолевых артериях, дугообразных артериях (для исключения отторжения), почечной вене (для исключения перегиба почечной вены).
Способ диагностики острого отторжения пересаженной почки
Способ диагностики острого отторжения пересаженной почки путем определения в послеоперационном периоде индекса периферического сопротивления сосудистого русла трансплантата при допплеро- сонографии и, дополнительно, эхосканировании, определяют объем трансплантата, толщину его паренхимы, индекс примамид мозгового вещества,а индекс периферического сопротивления сосудистого русла пересаженной почки определяют по отношению разницы максимального пикового систолического допплеровского частотного сдвига в конце диастолы к максимальному пиковому систолическому допплеровскому частотному сдвигу и при индексе периферического сопротивления сосудистого русла пересаженной почки более 0,79, или объеме почки более 300 см3, или толщине паренхимы более 2 см и индексе пирамид мозгового вещества более 2,1, или толщине паренхимы меньше или равной 2,0 см и индексе пирамид мозгового вещества более 2,8 диагностируют острое отторжение пересаженной почки (Арутюнян С. М. и соавт., 1990).
УЗИ почек для начинающих (лекция на Диагностере)
Почки расположены забрюшинно в поясничной области на уровне двух последних грудных и двух первых поясничных позвонков. Правая почка, как правило, на 1-2 см ниже левой.
Паренхима почки состоит из коркового слоя и пирамид. Почечные столбы (колонны Бертини) между пирамидами состоят из коркового вещества. Пирамида и покрывающее ее корковое вещество образуют почечную дольку. На вершине пирамиды открываются отверстия сосочковых канальцев.
Почечный синус содержит чашечно-лоханочный комплекс (ЧЛК), сосуды, нервы, соединительную ткань и жир. Маленькая чашечка садится на вершину пирамиды как молокоотсос на сосок. Моча активно поступает в маленькие и большие чашечки → почечную лоханку → мочеточник → мочевой пузырь → уретру.
Нажимайте на картинки, чтобы увеличить.
УЗИ почек
Используют конвексный датчик 2,5-7,5 МГц. При подозрении на патологию исследование проводят с наполненным мочевым пузырем при появлении позыва на мочеиспускание. После мочеиспускания почки осматривают повторно.
Нас интересует расположение, размер, эхогенность, эхоструктура почек, а так же проходимость мочевыводящих путей. Как оценить размер почек у детей и взрослых подробнее смотри здесь.
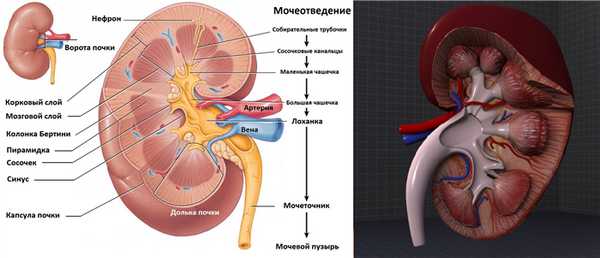
Мочевой пузырь и дистальный отдел мочеточника на УЗИ
В положении пациента лежа на спине в надлобковой области выводим мочевой пузырь. Оцените наполнение мочевого пузыря и дистальный отдел мочеточников. В норме дистальный отдел мочеточника не видно. Мочеточник более 7 мм в диаметре — мегауретер.
Рисунок. На УЗИ расширенный дистальный отдел мочеточника (1, 2, 3). Про уретероцеле (3) подробнее смотри здесь.
Эхогенность почек
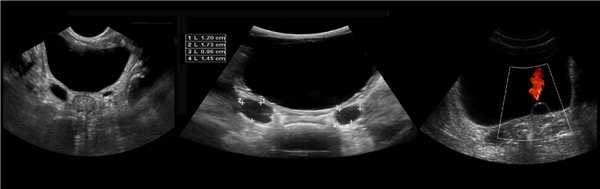
В положении пациента на спине по среднеключичной и переднеподмышечной линии выводим правую почку в соседстве с печенью, а левую почку вблизи селезенки. Оцените эхогенность почек. Корковый слой почки в норме изо- или гипоэхогенный по отношению к печени и гипоэхогенный по отношению к селезенке.
Рисунок. Эхогенность органов сравнивают на одном срезе. На УЗИ нормальная почка по соседству с печенью (1) и селезенкой (2). У детей до 6 месяцев паренхима почек в норме может быть гиперэхогенной по сравнению с печенью (3).
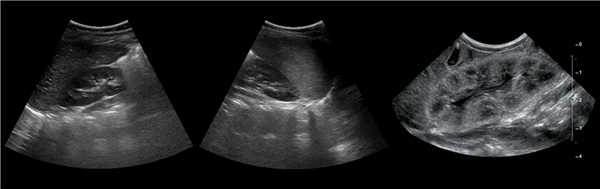
Форма почек на УЗИ
Чтобы увидеть верхний полюс почки, попросите пациента сделать глубокий вдох. Форма почки бобовидная — выпуклая с латеральной и вогнутая с медиальной стороны. Как вариант нормы расценивают эмбрионально-дольчатую почку, а так же горбатую левую почку.
Рисунок. На УЗИ (1) и КТ (2, 3) контур почек волнистый. У эмбриона почка развивается из отдельных долек, которые сливаются по мере их роста. Дольчатое строение почек хорошо видно у плода и новорожденных, в единичных случаях сохраняется у взрослых.
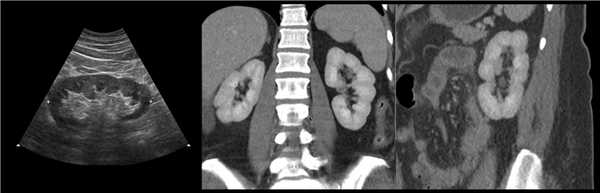
Рисунок. Можно встретить горбатую левую почку — выпуклый неровный наружный контур из-за гипертрофии паренхимы в средней трети почки. Считают, что «горб» формируется у плода под давлением нижнего края селезенки.
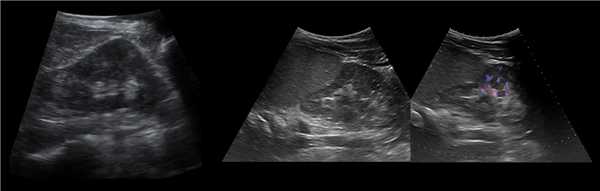
Рисунок. Сканирование со стороны передней брюшной стенки позволяет не пропустить перешеек между почками. Перешеек спереди от позвоночника является доказательством сращения почек — подковообразная почка. Варианты анатомии подковообразных почек смотри здесь.
Видео. На УЗИ подковообразная почка
Эхоструктура почек
В нормальной почке пирамиды гипоэхогенные, корковое вещество и колонны Бертини изоэхогенны друг другу. В синусе располагается в норме невидимый ЧЛК, гиперэхогенная соединительная и жировая ткань, гипоэхогенные сосуды и вершины пирамид.
Когда различают пирамиды, корковое вещество, почечные колонны, то эхоструктура паренхимы почки не изменена. Если их не видно, то эхоструктура изменена за счет отсутствия четкой корково-мозговой дифференциации.
Рисунок. На УЗИ почка с неизмененной эхоструктурой: гипоэхогенный по отношению печени корковый слой и колонны Бертини, почти анэхогенные пирамиды, гиперэхогенный синус.
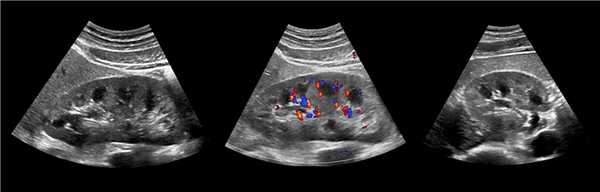
Рисунок. У 37% здоровых новорожденных в первые сутки жизни на УЗИ определяются симптом «белых пирамидок». Преципитация белка Тамма-Хорсфалла и мочевой кислоты вызывает обратимую обструкцию канальцев. К 6 неделям жизни проходит без лечения.
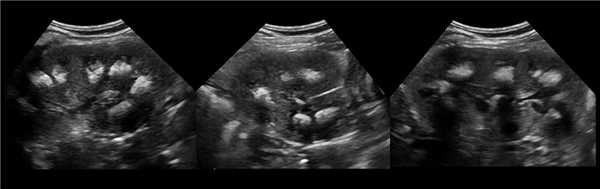
Рисунок. На УЗИ здоровая почка: вдоль основания пирамид (кортикомедуллярный переход) определяются линейные гиперэхогенные структуры с гипоэхогенной дорожкой в центре. Это дугообразные артерии, которые ошибочно расценивать как нефрокальциноз или камни.
Видео. Дугообразные артерии почки на УЗИ
Рисунок. На УЗИ нижний полюс почки отделяет гиперэхогенная фиброзная перемычка; лоханка нижнего сегмента 7 мм. Это вариант нормального строения почки. Почка может быть деформирована, поэтому ее размер и длина немного меньше противоположной. Небольшое расширение лоханки под перемычкой сохраняется пожизненно.
Видео. На УЗИ фиброзная перемычка в почке (вариант строения)
Бывает колонна Бертини врезается в центральную часть почки, разделяя ее полно или неполно на две части. Такая паренхиматозная перемычка — это паренхима полюса одной из эмбриональных долек, которые сливаясь образуют почку; состоит из коры, пирамид, колонн Бертини — все элементы без признаков гипертрофии или дисплазии. Термин гипертрофия колонны Бертини не отражает морфологию структуры, точнее считать данное образование паренхиматозной перемычкой.
Рисунок. На УЗИ округлое образование разделяет почечный синус на два сегмента с общей лоханкой; междолевые артерии огибают образование; эхогенность и интенсивность сосудистого рисунка внутри близка корковой зоне. Заключение: Гипертрофия колонны Бертини или неполная паренхиматозная перемычка. Это вариант нормального строения почки. Термин «неполное удвоение ЧЛК» неверный, т.к. неполная паренхиматозная перемычка не является признаком удвоения ЧЛК.
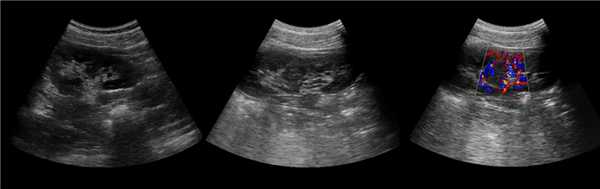
Рисунок. На УЗИ синус почки разделяет полная паренхиматозная перемычка (1, 2). В таких случаях разграничить удвоение почки от гипертрофии колонны Бертини поможет экскреторная урография. Удвоенная почка покрыта общей фиброзной капсулой. Полное удвоение предполагает наличие двух лоханок, двух мочеточников и двух сосудистых пучков. Неполноудвоенная почка (3) питается одним сосудистым пучком, мочеточник может быть удвоен вверху и впадать в мочевой пузырь одним или двумя устьями. Удвоение ЧЛК и мочеточников — фактор риска развития патологии (пиелонефрита, гидронефроза и др.).
Рисунок. На УЗИ синус почек широкий, неоднородной эхоструктуры (1, 2). На фоне гиперэхогенного жира гипоэхогенный очаг округлой формы (2), при ЦДК междолевые сосуды проходят через гипоэхогенную зону без смещения (3) — это гипоэхогенный жир. При ожирении липоматоз синуса можно ошибочно принять за атрофию паренхимы.
Мочеточник, малые и большие чашечки в норме не видно на УЗИ. Существует три типа расположения лоханок: интра-, экстраренальный и смешанный (частично внутри почки, частично вне ее). При интраренальном строение просвет лоханки в раннем возрасте до 3 мм, в 4-5 лет — до 5 мм, в пубертате и у взрослых — до 7 мм. При экстраренальном и смешанном типе строения — 6, 10 и 14 мм, соответственно. При переполненном мочевом пузыре лоханка может увеличиваться до 18 мм, но через 30 минут после мочеиспускания сокращается.
Рисунок. Независимо от наполнения мочевого пузыря на УЗИ видно лоханку смешанного (1, 2) и экстраренального (3) расположения.
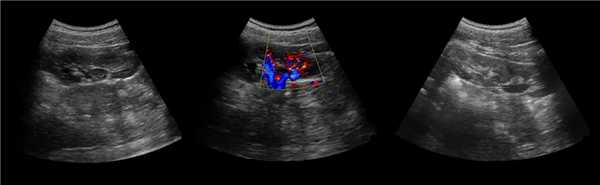
Рисунок. У детей до 1 года на УЗИ синус почки определяется слабо, анэхогенные пирамиды можно ошибочно принять за расширенный ЧЛК (1). На УЗИ в воротах почки линейная гипоэхогенная структура похожа на расширенную лоханку (2); при ЦДК видно, что это сосуды (3).
Аномалии расположения почек на УЗИ
Аномалии расположения почек возникают при нарушении перемещения первичной почки из таза в поясничную область. Почти всегда форма почки изменена, а ворота открыты вперед.
При грудной дистопии почка обычно входит в состав диафрагмальной грыжи. При поясничной дистопии лоханка находится на уровне L4, при подвздошной — L5-S1. Тазовая почка находится позади или чуть выше мочевого пузыря. При перекрестной дистопии мочеточник впадает в мочевой пузырь в обычном месте, а почка смещена контрлатерально.
Рисунок. Дистопия почек по отношению к скелету: грудная справа (1), двусторонняя поясничная (2), тазовая слева (3), поясничная справа и тазовая слева (4), поясничная удвоенной левой почки (5), перекрестная (6).
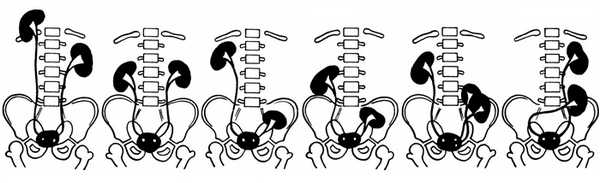
Рисунок. Дистопия почек по отношению друг к другу и их сращение между собой: сращение верхних концов (1), нижних концов и удвоение левой почки (2), средних частей тазово-дистопированных почек (3), боковых частей тазово-дистопированных почек (4), разных концов (5), под углом (6).
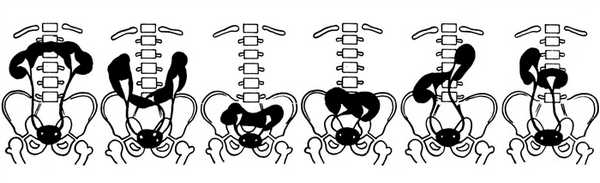
Рисунок. На УЗИ почечное ложе слева пустое (1). Обе почки расположены справа, срастаются полюсами (2, 3). Заключение: Аномалия взаиморасположения почек — I-образная удвоенная правая почка.
Рисунок. На УЗИ в малом тазу (мочевой пузырь — акустическое окно) определяются почки связанные узким перешейком (1, 3); дифференцировка паренхимы сохранена, кровоток прослеживается до капсулы (2, 3). Заключение: Аномалия взаиморасположения почек — сращение нижних полюсов тазово-дистопированных почек.
Подвижность почек на УЗИ
Отметим на коже уровень верхнего полюса почки в положении пациента лежа на животе и стоя. Перед повторным измерением попросите пациента попрыгать.
Как на УЗИ отличить нефроптоз от дистопии? В норме ПА отходит от аорты сразу ниже ВБА, при поясничной дистопии — вблизи бифуркации аорты, при тазовой дистопии — от подвздошной артерии.
Рисунок. При тазовой дистопии на внутривенной урографии в положении лежа мочеточник короткий, почка в тазу (1, 2). При нефроптозе на внутривенной урографии в положении лежа почка определяется в типичном месте (3), в положении стоя почка значительно приспускается (4).
Читайте также:
