Сформированный метанефрос эмбриона. Рост почки плода
Добавил пользователь Cypher Обновлено: 01.02.2026
Пороки развития органов мочевыделительной системы (МВС) составляют 9,3% - 24% от общего количества выявленных пороков плода [1, 2]. Высокая распространенность и многообразие указанных пороков, формирование и развитие фетальной урологии как нового научного и лечебного направления заставляют возвращаться к вопросам эмбриогенеза МВС, значительный прогресс в понимании которых произошел за последние годы.
Эмбриогенез мочевой системы регулируется путем взаимодействия трех групп факторов: генетических механизмов, внутренних эпигенетических факторов (ферментные системы, гормоны) и экзогенных факторов внешней среды.
Не вызывает сомнения факт, что существует четкая генетическая программа для стадий сложного процесса эмбрионального развития. Механизмы, регулирующие органогенез мочевой системы, включают работу огромного числа структурных генов, онкогенов, факторов транскрипции, факторов роста и др. Изучение экспрессии регуляторных генов, их избирательной активности в ходе развития организма, участие в дифференцировке клеток разных типов представляет собой актуальное направление, находящееся на стыке клинической молекулярной генетики, иммуноцитохимии и эмбриологии.
Ведущую роль в процессе эмбриогенеза играют гомеобоксные гены, ответственные за регуляцию основных этапов развития организма, координирующие активность групп структурных генов и проявляющие свое действие строго последовательно. Гомеобоксные гены кодируют факторы транскрипции, то есть специфические белки, обеспечивающие прочтение и интерпретацию генетической информации. Действуя в соответствии с генетической программой и/или в ответ на внешние воздействия, факторы транскрипции активируют или подавляют работу определенных генов, что влечет за собой изменения в клеточной морфологии, дифференциации, морфогенезе, органогенезе и т.д.
В настоящее время наблюдается смещение интересов от изучения отдельных генов к функциональным сетям генома, в которых одновременно задействовано множество генов в тысячах разных клеток [3]. Период органогенеза характеризуется наибольшей генной активностью. Генетические мутации, ошибки в сигнальной сети, управляющей согласованной активностью клеток в тканях именно в этот период, способны привести к серьезным нарушениям нормального хода эмбрионального развития и возникновению врожденных пороков (Барашнев, 2010; Баранов и др., 2000). В настоящее время идет поиск новых генов, ответственных за развитие таких нарушений.
Большинство достижений в области исследований эмбриогенеза мочевыделительной системы представляют собой результаты экспериментов на животных или анализ редких синдромов человека с пороками МВС.
Выделительная система человека начинает свое развитие на 3-й неделе эмбрионального периода из нефрогенной хорды в промежуточной мезодерме, проходя стадию пронефроса, мезонефроса и метанефроса, и отражает этапы эволюционного развития этой системы у позвоночных.
Чрезвычайная значимость процесса сигнального взаимодействия мочеточникового зачатка с метанефрогенной бластемой состоит в том, что данный процесс лежит в основе последующего активного ветвления зачатка мочеточника, формирования канальцевой системы и нефронов, стромы органа.
В раннем развитии метанефроса ведущую роль играет цепь взаимодействий генов WT1/PAX2/GDNF/GFRɑ1. Большинство факторов, влияющих на инициирование метанефрогенеза, являются факторами транскрипции и экспрессируются в метанефрогенной мезенхиме.
Ген-супрессор 1 опухоли Вильмса (WT1 - Wilms tumor factor) в норме участвует в процессе уплотнения мезенхимальных клеток, индуцированныx фактором роста фибробластов FGF2. У мышей при выключении Wt1 гена мезенхима метанефроса формируется, но зачаток мочеточника из Вольфова канала не развивается, образуется метанефрогенная бластема с последующим апоптозом, приводя к полному отсутствию развития почки [5]. Мутация гена WT1 у человека может привести к возникновению опухолей почек в детстве [6], а также и вызвать синдром WAGR (опухоль Вильмса/аниридия/аномалии МПС/умственная отсталость), синдромы Дэниса-Драша и Фрайзера, которые характеризуются аномалиями почек и гонад [7].
Генам WT1 и PAX2 (paired box gene 2) в процессе инициирования метанефрогенеза отводится важное значение, т.к. они взаимодействуют в метанефрогенной мезенхиме посредством экспрессии GDNF (glial cell-line-derived neurotrophic factor 1) - нейротрофического фактора линии глиальных клеток, из семейства трансформирующего фактора роста TGFb (transforming growth factor beta 1) [8]. GDNF является одним из важнейших компонентов первой сигнальной цепи и стимулирует обособление зачатка мочеточника, его внедрение в метанефрогенную бластему, а позже участвует в регуляции ветвления мочеточникового зачатка 12. Мыши с инактивированными аллелями GDNF умирают вскоре после рождения из-за почечной агенезии 11.
Тирозин-киназный рецептор RET экспрессируется в зачатке мочеточника и также контролирует пролиферацию и ветвление зачатка мочеточника, при мутации способен проявлять себя как онкоген [14]. GDNF и RET являются взаимно стимулирующими, а GDNF-индукция развития мочеточникового зачатка является RET-зависимой [9-10, 15-16]. GFRɑ1 (glial cell-line-derived neurotrophic factor receptor - 1) - ген, кодирующий ко-рецептор для RET, также экспрессируется в зачатке мочеточника и участвует в передаче сигналов GDNF. RET9/GFRɑ1/GDNF - система инициирует развитие мочеточника и благодаря хемоаттракции стимулирует рост его зачатка по направлению к мезенхиме, как источнику GDNF.
Экспрессия GDNF в почечной мезенхиме также регулируется геном EYA1 (eyes absent 1), гомологом гена отсутствия глаз у дрозофилы (Eya). EYA1 функционирует в мезенхимной сигнализации ранее GDNF, но позже PAX2, регулируя инициирование развития почки [18]. EYA1-мутации у человека лежат в основе бранхио-ото-ренального синдрома [17]. В эксперименте при отсутствии EYA1 зачаток мочеточника не внедряется в почечную мезенхиму эмбриона мыши, приводя к аплазии органа.
Рост зачатка мочеточника и формирование его просвета регулируется геном SALL1 (sal like 1), который является гомологом регион-специфического гомеозисного гена дрозофилы spalt (Sal1) [19]. Гетерозиготные SALL1-мутации у человека ведут к развитию синдрома Таунса-Брокса, а инактивация этого гена у мышей ведёт к угнетению роста зачатка мочеточника и отсутствию его просвета. По-видимому, SALL1 экспрессируется позже WT1, GDNF и EYA1 или действует независимо.
Фактор транскрипции FOXC1 (forkhead box C1), также экспрессируемый в мезенхиме, определяет местоположение зачатка мочеточника по отношению к Вольфову каналу [20]. У нокаутных по данному гену мышей формируются двойные зачатки мочеточника и почки, приводя к удвоению МВС, причём особенности формирования определяются генотипом.
Белки межклеточного матрикса и белки поверхности клетки, такие как протеогликаны (PGs - Proteoglycans), также вовлечены в процесс роста и ветвления мочеточника. PGs выполняют много функций, в том числе участвуют в передаче сигналов фактора роста и межклеточных взаимодействиях. Некоторые PGs клеточной поверхности принимают участие в передаче сигналов фактора роста фибробластов (FGFs) и являются частью факторов семейства WNT (Wingless-related) 22. При удалении или изменении в почке гликозаминогликановых цепей PGs in vitro зачаток мочеточника приостанавливает рост и ветвление [23]. Эти преобразования могут также вызывать изменение действия BMP4: от подавления роста зачатка мочеточника к стимулированию его ветвления, что указывает на возможность PGs контролировать специфический тип ответа на факторы роста. Видоизменение специфического PGs - глипикана-3 (Gpc3) отмечено у больных с синдромом Симпсона-Голаби-Бехмеля и почечной дисплазией [24]. Gpc3 способен управлять клеточными ответами собирающего протока на факторы роста, стимулируя или подавляя его развитие, что согласуется с ролью PGs в функционировании факторов роста. Gpc3 может принимать участие в Bmp-сигнализации в течение почечного развития [25], связывая определённые Bmp и регулируя эффект передачи их сигналов в почке. Морфогенетические костные белки (BMP - bone morphogenetic proteins) принадлежат к TGF-суперсемейству выделяемых сигналов, BMP4 экспрессируется в клетках мезенхимы, окружающих Вольфов проток и регулирует локализацию и интенсивность роста мочеточникового зачатка. Эмбрионы мыши с мутациями гена Bmp4 имеют целый ряд аномалий мочеточника и дефекты почек, подобные аномалиям почки и МВС у человека [26]. Мезенхимальным антагонистом работы BMP4 является GDNF/WNT1, который обеспечивает снижение экспрессии BMP4 и способствует росту и ветвлению зачатка мочеточника [27].
После внедрения в мезенхимную ткань зачаток стимулирует окружающие его клетки метанефрогенной мезенхимы к уплотнению в виде шляпки, после чего мезенхимный конденсат трансформируется в эпителий. [28]. Индукция стадии уплотнения или конденсации мезенхимы происходит благодаря фактору роста фибробластов - FGF2 (fibroblast growth factor),а для мезенхимно-эпителиального перехода требуется действие дополнительных растворимых сигнальных факторов 29.
Стромальная регуляция метанефрогенеза. В области конденсированной мезенхимы и между ветвями мочеточника развивается интерстициальная строма. Клетки стромы образуются из оставшихся метанефрогенных клеток мезенхимы после ее индукции к формированию нефронов. Строма является важным источником сигнализации в почечном органогенезе. Экспрессия сигналов со стороны клеток стромы по регуляции метанефрогенеза осуществляется за счет гена FOXD1 (Forkhead box D1). Инактивация указанного гена в эксперименте ведет к дефектам в системе собирающего протока и нефронов [31].
Витамин А также участвует в стромальной сигнализации [32], его сигнал преобразован ретиноево-кислотными рецепторами (Rars) ядра. Ретиноево-кислотный рецептор Rara экспрессируется на низком уровне во всей эмбриональной почке, тогда как экспрессия Rarb2 ограничена клетками стромы. Клетки стромы путем сигнализации в зачатке мочеточника поддерживают экспрессию Ret, которая подключает сигнализацию дифференцировки клеток мезенхимы [33].
Сигнализация стромы воздействует или на мезенхиму, или на зачаток мочеточника, а сигнализация от метанефрогенной зоны мезенхимы может регулировать отдел стромы. Так между стромой, зачатком мочеточника и почечной мезенхимой существует сигнальное кольцо, координирующее нефрогенез. Так, экспрессия FGF7 осуществляется клетками стромы, окружающими зачаток мочеточника, в то время как FGF7 рецептор локализован в зачатке мочеточника. Нарушение данного равновесия и дефицит FGF7 в эксперименте у мышей помимо снижения роста зачатка мочеточника приводит к уменьшению числа формирующихся нефронов на 30% [34].
Индукция нефроногенеза. После встречи мочеточникового зачатка с метанефрогенной бластемой происходит дифференциация ее ткани с формированием канальцев и клубочков. Уплотнённые клетки мезенхимы стимулируют ветвление зачатка мочеточника, который начинает активно дихотомически делиться с формированием ампуловидных расширений на конце каждого выроста. В ответ на это в метанефрогенной ткани осуществляется эпителио-мезенхимный переход с формированием канальцеподобных структур в виде эпителиальной трубки, которые пока еще не соединяются с отростками мочеточника.
Гомеобоксный ген LIM1 экспрессируется в Вольфовом канале, зачатке мочеточника и индуцирует эпителиальное преобразование нефрогенной зоны мезенхимы. Условное подавление действия этого гена в мезенхиме блокирует формирование нефронов на стадии почечных клубочков, приводя к появлению уменьшенных, не способных функционировать почек с недостатком нефронов в виде гипоплазии почки [39].
Индукция тубулогенеза. WNT - большое семейство факторов транскрипции, контролирующее ход тубулогенеза [40]. Первичным пусковым сигналом выступает WNT6, который экспрессируется на конце зачатка мочеточника, активируя регуляцию WNT4 [43]. WNT4 непосредственно участвует в эпителио-мезенхимном переходе, то есть в формировании канальцевой системы со стороны мезенхимы [42]. В эксперименте на мышах при инактивации Wnt4 мезенхима первоначально уплотнена, и экспрессируются несколько ранних маркерных генов мезенхимной индукции, таких как Wt1 и Pax2, однако дальнейшего перехода мезенхимы в эпителиальную ткань не происходит, и канальцы не формируются [41].
Аналогичный эффект блокировки формирования канальцевой системы возникает и при выключении ETX2 - гомеобокс-содержащего фактора транскрипции, который экспрессируется первоначально в зачатке мочеточника [44].
Значительную роль в формировании почечных канальцев играет ген PKHD1, продуктом экспрессии которого является рецептороподобный белок фиброцистин, или полидуктин. Фиброцистин служит ключевой молекулой в процессе образования и поддержания просвета канальцев и протоков и, помимо почечных канальцев, обнаруживается в органах с первичной системой трубочек или канальцев, например, в легких и трахее, молочной железе, ЖКТ, мочеполовых путях. Этот белок наиболее выражен в производных эпителия, а в почках локализуется в апикальной части клеток канальцев, связываясь с первичными ресничками, которые обеспечивают сенсорную функцию току мочи. При снижении экспрессии гена PKHD1 происходит нарушение тубуломорфогенеза, в то время как мутация этого гена служит причиной аутосомно-рецессивного поликистоза почек и врожденного фиброза печени [45].
В проксимальные концы почечных канальцев врастают эндотелиальные клетки, дающие начало капиллярному сосудистому руслу клубочка [36]. В начале гломерулярного развития легко определяется граница между эндотелием и формирующейся базальной мембраной. Вскоре подоцитарный эпителий начинает сворачиваться и приобретает свою зрелую форму. На этой стадии эндотелиальные клетки уже плотно прилегают к базальной мембране.
Клубочки постепенно развиваются в зрелый тип. На 14-16 неделе полностью сформированы все отделы нефронов. В ходе ветвления зачатка мочеточника индукция трубочек многократно повторяется, чтобы произвести до 1.000.000 нефронов в человеческой почке. Ветвления канальцев формируют систему протоков, собирающую мочу в почечную лоханку и мочевой пузырь. Впервые моча поступает в чашечки и лоханки на 11-12 неделе эмбриогенеза человека.
Заключение
Учитывая данные настоящего обзора литературы по вопросам эмбриогенеза МВС, а именно, наиболее важного этапа - метанефрогенеза, мы надеемся привлечь внимание специалистов к данной проблеме, которая является основополагающей в аспекте фетальной и неонатальной урологии.
Литература
Таблицы
Таблица 1.Патологические эффекты нарушения экспрессии генов,
Гидронефроз почек у детей

От здоровья почек зависит очень многое, ведь они выполняют функцию естественного фильтра для нашего организма. В то же время почечные патологии могут вызвать весьма негативные последствия. И одной из самых распространенных детских проблем с почками считается гидронефроз.
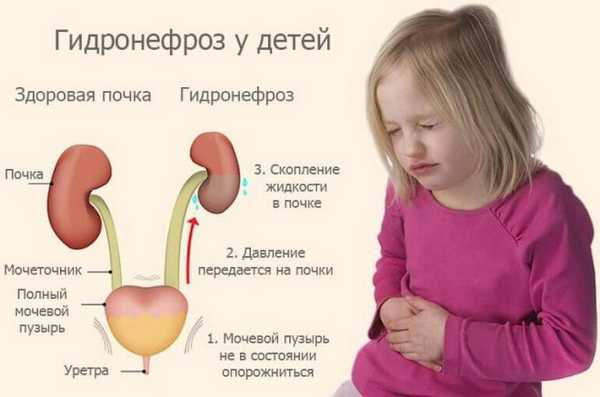
Что это такое?
Гидронефроз почек у детей встречается довольно часто, при этом в большинстве случаев недугу подвержены мальчики. Патология заключается в нарушении оттока мочи, что вызывает изменения в структуре почки, а в тяжелом случае может привести к ее атрофии. Моча давит на структуру почки изнутри, и если давление носит длительный характер, то это приводит к изменению структуры органа, страдают лоханка, чашечка. Они растягиваются, расширяются, их размеры отличаются от нормальных в большую сторону.
Изменения в структуре, в свою очередь, усугубляют нарушение оттока жидкости и гидростатическое давление ее становится сильнее. Поэтому чем дольше длится патологический процесс, тем развиваются более масштабные нарушения структуры почки, вследствие чего она работает всё хуже и хуже.
Считается, что гидронефроз почти всегда связан с врожденными причинами - аномалиями развития органов мочевыделительной системы. Пораженной может быть только правая почка или только левая - в этом случае говорят об одностороннем гидронефрозе. Более тяжелым заболеванием считается двусторонняя форма, при которой нарушены функции сразу обеих почек.
Если заболевание двустороннее, то компенсации не происходит, что и обуславливает тяжелое течение. При одностороннем заболевании недостаточные функции одного органа берет на себя второй, здоровый, поэтому состояние ребенка в целом является скомпенсированным.
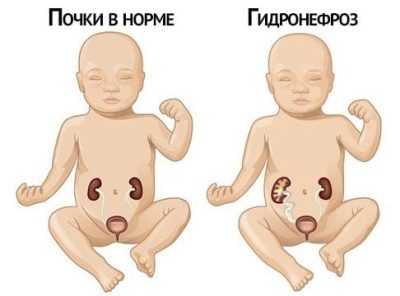
Если не предпринимать ничего, то гидронефроз у детей постепенно переходит в атрофическую форму — паренхима начинает отмирать.
У детей и новорожденных могут обнаружить разные виды заболевания:
- асептическую — если нарушение собирательной функции почки протекает без присоединения инфекции;
- инфекционную — если функциональное и структурное нарушение сопряжено с присоединением инфекции.
Учитывая опасность, которую несет в себе гидронефроз, основная задача врачей — установить заболевание как можно раньше, чтобы оказать необходимое лечение и снизить вероятность осложнений.
Причины
Поскольку в большинстве случаев гидронефроз у детей носит врожденную форму, считается, что истинные причины найти довольно сложно, так как аномалии органов мочевыделительной системы сформировались еще в период внутриутробной жизни малыша.
Почки у плода формируются в период эмбриогенеза - после 6-й недели беременности. И повлиять на этот процесс могут самые разнообразные факторы — курение и алкоголь, принимаемые беременной медикаменты, генетические нарушения плода, воздействие неблагоприятных экологических факторов, заражение будущей мамы гриппом, ОРВИ, другими инфекционными заболеваниями. Причина может крыться в сильном стрессе, который перенесла женщина в период с 6-й по 10-ю неделю беременности.
Какой бы фактор ни сыграл роль, у плода формируются слишком узкие мочевыводящие каналы, за счет чего уже внутриутробно происходит повышенное давление мочи на паренхиму. Дети в материнской утробе пьют воду и писают. Может сформироваться нарушенное положение мочеточников, что приводит к обратному оттоку мочи. Иногда причина кроется в нарушении строения сосудов, питающих почки, и тогда лишние сосуды нарушают проходимость мочеточника.
Врожденный гидронефроз часто заметен уже в период беременности на УЗИ. После рождения малыша у грудничка патология подтверждается или обнаруживается впервые. Последнее случается реже, учитывая, что все женщины проходят УЗ-сканирование за весь период беременности не один раз.
Приобретенный гидронефроз встречается значительно реже. К нему могут привести травмы почек и поясницы, мочекаменная болезнь, нарушения обмена веществ, за счет которого камни в почках образуются более активно. Причиной заболевания может стать предшествующее воспаление мочеточника, после которого образуется рубец, сужающий просвет. Иногда причины кроются в неудачно проведенной операции, при которой мочеточник оказался травмирован.

Классификация
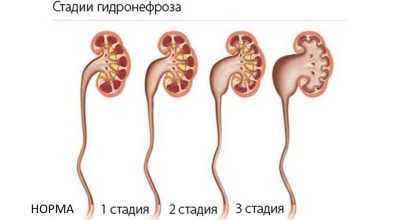
Поскольку изменения, которые давление мочи вызывает в структуре почек, протекают постепенно, выделяют несколько стадий и степеней заболевания.
- При 1 степени (начальной) функции почки сохраняются почти в полном объеме, есть незначительное расширение лоханки.
- При 2 степени функции почки начинают утрачиваться, размеры лоханки превышают нормы, стенки ее более тонкие. Сам орган становится увеличенным.
- При 3 степени функции почки утрачены значительно или полностью, орган сильно увеличен в размерах, имеется очаговая или полная атрофия почечной ткани.
Иногда выделяют и гидронефроз 4 степени, при котором почка не функционирует вообще, то есть она полностью атрофирована. Но часто такую форму недуга включают в 3 степень.
В 90% случаев детский гидронефроз бывает односторонним. В подавляющем большинстве случаев страдает правая почка. Поражение слева встречается реже. Двусторонний гидронефроз у детей встречается в 10% случаев.
Симптомы
Признаки заболевания при одностороннем гидронефрозе могут не проявляться довольно долго, ведь вторая почка полностью компенсирует нарушения в работе первой. И на начальной стадии симптомов может не быть вообще. Но со временем, когда появятся изменения в структуре почки, признаки начнут проявляться. Наиболее часто недуг проявляется так:
- появляются тупые, тянущие боли в области поясницы — они не постоянны, то появляются, то исчезают, по мере прогрессирования патологии появляются все чаще и длятся все дольше;
- гематурия — появление примесей крови в моче, моча становится розовой, красной, алой — все зависит от конкретного количества эритроцитов в урине, чем их больше, тем более насыщенным красным будет цвет мочи;
- уменьшается количество выделяемой почками жидкости;
- повышается артериальное давление, появляются сопутствующие этому симптомы — головная боль, нарушения зрения, повышается тревожность, ребенок начинает быстрее уставать;
- есть признаки интоксикации организма.

Когда гидронефроз достигает третьей стадии, кожные покровы у ребенка выглядят бледными, кожа сухая, в моче увеличивается содержание эритроцитов. Писать малыш начинает настолько редко, что порой говорят о полном прекращении мочеиспускания. Повышается температура тела, страдают сон и аппетит, ребенок апатичен и слаб, его мучает тошнота.
Прогнозы и последствия
Само собой заболевание у детей не проходит, поэтому на то, что малыш «перерастет» проблему, можно не надеяться. Во всех случаях необходимо лечение. И если с ним не спешить, то возможны развитие пиелонефрита, почечной недостаточности. Чем младше ребенок, тем опаснее для него патология почек. У грудничков до года осложнения гидронефроза могут привести к летальному исходу.
Диагностика
Для того, чтобы установить соответствующий диагноз, врач назначает, согласно клиническим рекомендациям, большой перечень лабораторных исследований: анализы крови, анализы мочи, функциональные пробы Реберга. Ребенку проводят УЗИ, УЗИ с Лазиксом, при необходимости делают МРТ или КТ.
Этого обычно вполне хватает, чтобы точно установить правильный диагноз.
Лечение
Начальные формы гидронефроза обычно не требуют серьезного врачебного вмешательства. Ребенку назначается диета, его ставят на диспансерный учет к нефрологу, а сроки наблюдения у врача напрямую будут зависеть от того, как дальше поведет себя больная почка. Проблема в том, что первая степень обнаруживается не так часто, как хотелось бы. Обычно к врачу обращаются уже при появлении симптомов, а сами по себе симптомы говорят о присутствии второй и выше стадии.
При второй и третьей степени назначается консервативное лечение. Ребенку рекомендуются медикаменты, но если их применение по назначенной доктором схеме не приносит желаемого результата, говорят о необходимости хирургического вмешательства.
Среди медикаментов при лечении детского гидронефроза обычно применяются противовоспалительные препараты, средства, позволяющие снизить отеки (мочегонные), иногда — антибиотики (при инфекционной форме). Чтобы облегчить симптомы интоксикации, рекомендуют сорбенты. Если повышается кровяное давление, назначаются противогипертонические средства для снижения АД.
Диета при этом недуге исключает низкокалорийное питание. Рацион малыша должен быть насыщен калориями и витаминами, а вот соль запрещена. Пациенту назначается особый питьевой режим.

Оперирование при гидронефрозе — вынужденная мера, которая применяется, если отток мочи нарушен в значительной степени, а также когда лечение консервативными методами не помогло.
Операция призвана восстановить проходимость протоков и нормальное положение мочеточников. Ее могут провести открытым способом — хирург иссекает пораженную паренхиму, проводя сшивание здоровых участков почечной ткани (пиелопластика).
Если у ребенка причина болезни кроется в узком мочевыводящем канале, проводят эндоскопическую операцию, при узком мочеточнике делают его стентирование.
В большинстве случаев современная медицина старается прибегать к лапароскопии — более щадящему методу, при котором травматическое воздействие минимально, а послеоперационный период проходит быстрее и легче.
Если лечить уже нечего, проводится нефрэктомия — удаление атрофированного органа. Но такое возможно лишь при одностороннем недуге и полной гибели почки.

Эффективность лечения и отзывы
Чем ниже степень, тем лучше прогнозы на лечение. В 90% случаев при начальных стадиях патологии удается добиться полного выздоровления. При 2 и 3 степени прогнозы менее положительные - даже при адекватном лечении не исключено, что ребенок получит инвалидность. Но если лечения не оказывать вообще, то весьма вероятен и летальный исход.
Отзывы родителей о лечении неоднозначные. Даже после успешной операции, которую часто проводят совсем крошечным деткам в возрасте всего нескольких месяцев, дети долго реабилитируются, у них слабый иммунитет, им многое запрещается и через несколько лет после хирургического вмешательства. Часто родители сознательно отказываются от получения инвалидности для ребенка, но это их полное право.
Врожденные пороки развития мочевыделительной системы плода. Особенности течения беременности
Сидельникова К.Н., Соломаха К.И.
Научный руководитель: к.м.н., старший преподаватель кафедры акушерства и гинекологии
Классен А.А.
Резюме
До сих пор актуальной остается проблема коррекции врожденных пороков развития мочевыделительной системы. Данное исследование включает в себя ретроспективный анализ 10 историй родов, с 1 января 2016 по 31 декабря 2017 года на базе ГБУЗ «ОКПЦ» г. Оренбург, в которых были диагностированы патологии развития мочевыделительной системы плода. В ходе изучение которых выявлены статистически наиболее частые патологии развития мочевыделительной системы плода. Представлено к вниманию современный метод коррекции такой, как нефро-амниональное шунтирование плода по УЗИ показаниям с помощью катетера по типу «pigtail», а также показания для проведения данной операции.
So far, the problem of the correction of congenital malformations of the urinary system remains. This study includes a retrospective analysis of 10 birth histories, from January 1, 2016 to December 31, 2017 on the basis of the State Budgetary Health Institution “OKPC”, Orenburg, in which pathologies of the urinary system of the fetus were diagnosed. The study of which revealed statistically the most frequent pathologies of the development of the urinary system of the fetus. A modern correction method, such as nephro-amnional shunting of the fetus by ultrasound indications using a pigtail catheter, as well as indications for this operation, is presented to the attention.
Ключевые слова
Введение
Врожденные пороки развития (ВПР) мочевыделительной системы представляют значительный интерес, так как являются определяющими факторами риска развития заболеваний мочевыводящей системы у новорожденных и детей, приводящими к хронизации почечной патологии. Врожденный пороки развития мочевыделительной системы - это стойкое анатомическое отклонение в развитии органа, возникающее в результате воздействия тератогенных факторов или генетических мутаций.
Врожденные пороки развития мочевой системы относятся к наиболее частым ВПР, выявляемым во время беременности (1−4 на 1000 беременностей), и составляют 15−20 % в структуре пренатально диагностируемых ВПР.
К ВПР мочевыделительной системы относятся:
- Аномалии количества, формы и величины (аплазия, агенезия почки, гиперплазия, гипоплазия почки, полное удвоение почки (одно- и двустороннее), неполное удвоение почки, аномальная форма (щитовидная, ногтевая, бесформенная))
- Аномалии положения и фиксации почек (аномалии положения: тазовое, подвздошное, поясничное, грудная дистопия, незавершенная ротация почки; аномалии со сращением со второй почкой (подковообразная, галетообразная, S- образная, L-образная); без сращения со второй почкой на своей стороне или на противоположной стороне; аномалии фиксации почки (повышенная подвижность, нефроптоз, избыточная фиксация, ротация почки)).
изучить пороки развития мочевыделительной системы, современные способы их коррекции и особенности течения беременности при аномалиях развития почек.
Материал и методы
ретроспективный анализ 10 историй родов, с 1 января 2016 по 31 декабря 2017 года на базе ГБУЗ «ОКПЦ» г. Оренбург. В анализ включены пациентки, у которых до родов, с помощью ультразвукового исследования была диагностирована патология почек у плода.
Результаты
в ходе изучения историй родов, отмечено, что наиболее часто встречается такая патология, как пиелоэктазия односторонняя, либо двусторонняя у 6 плодов, причем 4 плода− мужского пола. Мегауретер был диагностирован по данным ультразвукового исследования в 2 случаях только в третьем триместре. В одном случае, у пациентки, не состоявшей на учете, постнатально, у новорожденного, диагностирован инфантильный тип поликистоза почек. И в 1 случае у плода выявлена простая киста почки пренатально, подтвержденная постнатальным ультразвуковым исследованием.
При этом особенностей течения беременности и родов выявлено не было. 80% родов были срочными. 20% преждевременными в сроках от 34-37 недель. У 2 беременных было выполнено кесарево сечение, по причинам не связанных с патологией почек у плода.
Ранняя пренатальная диагностика и своевременно начатое внутриутробное и постнатальное хирургическое лечение позволяют в большинстве случаев предотвратить развитие осложнений и неблагоприятный исход заболеваний органов мочевой системы у новорожденных детей.
в настоящее время используется нефро-амниональное шунтирование плода по УЗИ показаниям с помощью катетера по типу «pigtail». Суть операции заключается в создании оттока мочи из почки плода в амниотическую полость.
Выделили следующие УЗИ показания к стентированию:
- УЗИ-признаки обструкции;
- Паренхима почек более 4 мм;
- Лоханка почки 30 мм и более;
- Визуализация кровотока в паренхиме почек;
- Срок беременности до наступления периода жизнеспособности плода;
- Постоянный характер нарушения пассажа мочи, при ультразвуковом исследовании регистрировалось маловодие;
- Отсутствие других летальные аномалии, нормальный кариотип плода;
- Двухсторонний характер патологии почек.
Первое стентирование − 27-я неделя беременности. Повторные стентирования осуществляются при ультразвуковых признаках непроходимости стента или его выпадения из почки.
Прерывание беременности рекомендуется при: инфантильном поликистозе, агенезии почек, почечных анамалиях обструктивного типа, синдроме мегацистис.
Наблюдение за пациенткой и новорожденным, проведение контрольного УЗИ после рождения, определение дальнейшей тактики лечения ребенка при пиелоэктазии.
Заключение
Патология почек остается актуальной проблемой. Своевременная внутриутробная диагностика влияет на благоприятный исход для новорожденного. Современные способы коррекции обеспечивают правильное функционирование мочевыделительной системы ребенка, предупреждая развития хронической патологии.
- Зеленцова В. Л., Шилко В. И., Вараксин А. Н., Архипова М. М., Малахова Жанна Леонидовна Врожденные пороки развития органов мочевой системы, анализ факторов риска дизэмбриогенеза // Экология человека. 2010. №1.
- Черненков Юрий Валентинович, Нечаев В. Н. Диагностика, профилактика и коррекция врожденных пороков развития // Саратовский научно-медицинский журнал. 2009. №3.
Презентация
Врожденные пороки развития мочевыделительной системы плода. Особенности течения беременности
Фетальный гидронефроз: что это и стоит ли бояться?
Иногда бывает так, что второй скрининг оборачивает для будущей мамы тонной переживаний и слезами, а не бесконечной радостью и счастьем. Частенько волнения беременной обусловлены заключением доктора УЗИ, которое звучит как «фетальный гидронефроз». Что это такое и стоит ли переживать?
Что такое фетальный гидронефроз
Почки малыша, так же как и почки взрослого человека, состоят из паренхимы (почечной ткани) и полостной системы (чашечек, лоханки и лоханочно-мочеточникового сегмента).
Фетальный гидронефроз — это расширение полостной системы почек плода.
Это нередкая находка на УЗИ во 2-ом и 3-ем триместрах (встречается в 1 из 20-100 беременностей). У мальчиков встречается в 2 раза чаще, чем у девочек. Часто такой гидронефроз бывает двусторонним.
До 88% случаев гидронефроза плода являются ВРЕМЕННЫМИ и обусловлены проходящим сужением соединения лоханки и мочеточника (ЛМС) малыша. В таком случае, как правило, увеличение лоханки незначительное (до 6 мм во 2ом триместре, до 8 мм — в 3-ем).
Другими причинами гидронефроза плода могут являться врожденные аномалии органов мочевыводящей системы, которые проявляют себя более выраженным расширением полостной системы почек плода.
При выявлении такого УЗ признака следует также оценить размеры мочеточников, мочевого пузыря плода (для раннего исключения врожденных патологий) и количество околоплодных вод.
В каких ситуациях фетальный гидронефроз становится опасным?
Действительно опасным является сочетание фетального гидронефроза и малого количества околоплодных вод.
В таких случаях требуется очень внимательное наблюдение за состоянием плода, иногда - преждевременное родоразрешение. В других случаях — прогноз удовлетворительный.
- При двустороннем гидронефрозе рекомендовано повторение УЗИ каждые 2-3 недели для контроля объема околоплодных вод.
- При одностороннем — достаточно повторить исследование на сроке 30-33 недели.
Что ждет такого малыша после рождения?
Означает ли такой диагноз бесконечные проблемы с почками в детстве или во взрослом состоянии?
Нет, конечно. Еще раз повторюсь, что чаще всего расширение лоханки проходит самостоятельно.
При сохранении расширения лоханки плода в третьем триместре более 10 мм после рождения рекомендована антибиотикопрофилактика (чтобы защитить почки малыша от возможного пиелонефрита).
Рекомендуется УЗ-контроль почек новорожденного на 2 — 7 день после рождения. Если по результатам этого УЗИ размер лоханки до 10 мм, антибиотики отменяют, и никаких дальнейших исследований, наблюдений не требуется. Никаких проблем с почками у малыша нет, и вряд ли будут.
Если же размер лоханки и после рождения превышает 10 мм, это повод выполнить дополнительные визуализационные исследования, чтобы исключить наличие каких-то отклонений в строении органов мочевыводящей системы.
Патологии почек у плода: что и когда показывает экспертное УЗИ при беременности
Почечная система плода формируется из нервной трубки на 22-й день беременности и завершает закладку к 28 неделе. Не все женщины знают на ранних сроках о своём интересном положении и продолжают вести обычный образ жизни: занимаются спортом, ездят на отдых, переносят тяжести, принимают лекарства. В результате почечная система может пострадать, и патология не во всех случаях будет совместима с жизнью.
Причины аномального развития почек у плода
Гипоплазия или недоразвитость почки — это внутриутробная аномалия, при которой почка имеет маленькие размеры и неправильно функционирует. Отклонение встречается менее чем в 0,2% всех беременностей.
Развитию гипоплазии почки способствуют следующие факторы:
- поездки в тёплые страны на ранних сроках, нахождение на солнцепёке, перегрев;
- удары в живот, падения;
- влияние алкоголя и табакокурения;
- воспаления матки;
- обострение пиелонефрита, инфицирование плода;
- негативное влияние лекарственных препаратов;
- пищевое отравление, вызвавшее интоксикацию организма;
- маловодие;
- ТОРЧ-инфекции у матери;
- тромбоз почечной вены у плода;
- воздействие ионизирующего облучения.
На УЗИ гипоплазия легко заметна, почки визуализируются с 14 недели беременности. В этом поможет высокоточный 3D аппарат. Почка отображается на экране монитора как овальное или бобовидное образование в продольном сканировании и округлое в поперечном.
Почка — это парный орган, расположенный по обе стороны от позвоночника. Основой органа является почечная лоханка, состоящая из сливающихся друг с другом почечных чашек. Лоханка плавно сужается и переходит в мочеточник, который ведёт в мочевой пузырь. Сам мочеточник у здорового плода не визуализируется на УЗИ.
У здорового органа диаметр почечной лоханки составляет 4-5 мм на 2 триместре и 7 мм на 3 триместре. Структурно-функциональной единицей почки является нефрон, который осуществляет фильтрацию. На 1 скрининге можно убедиться в наличии или отсутствии почек, в односторонней или двухсторонней недоразвитости (гипоплазии), удвоении почки, а также в нормальном или аномальном расположении. Но о функциональности органа станет ясно на 2 скрининге.
Какие патологии почек у плода можно выявить на 2 скрининге
2-й скрининг проводится на сроке 20-24 недели беременности. На нём выявляют различные пороки почки у плода:
- Агенезию (отсутствие одной или обеих почек). При односторонней агенезии на УЗИ с одной стороны почка не визуализируется вовсе, а с другой стороны она увеличена по сравнению с нормой. При двусторонней агенезии органа нет вообще, поэтому плод обычно погибает на определённом сроке беременности. Односторонняя агенезия не является показанием для аборта, потому что человек может жить и с одной почкой.
- Дистопию (нетипичное положение органа). Место расположения почки — это почечная ямка. Иногда почка не поднимается в ямку, а располагается в любой области таза. На УЗИ в этом случае дистопированная почка не будет видна, поэтому неопытный врач может принять дистопию за агенезию.
- Увеличенный или уменьшенный в размерах орган;
- Расширение почечной лоханки свыше 2 мм от нормы;
- Пиелоэктазия — расширение почечной лоханки без сопутствующих патологий органа;
- Пиелоуретероэктазия — расширение почечной лоханки с расширением мочеточника;
- Пиелокаликоэктазия — одновременное расширение и почечной лоханки, и чашки.
- Гидронефроз — скопление мочи в лоханке, приводящее к увеличение чашек и лоханок в размерах. Моча скапливается у основания мочеточника, за счёт чего он расширяется. Патология не является заболеванием, но свидетельствует о патологии лоханки и чашки почки. Диагностируется в 80% беременностей. Если к моменту рождения почечная лоханка будет увеличена более чем на 10 мм, малышу понадобится срочная операция.
- Кисты почек. Мультикистозная дисплазия является одним из самых опасных заболеваний почек. Выражается в перерождении нефронов в кисты, которые закупоривают протоки и затрудняют отток мочи. Они содержат жидкость внутри и достигают размера 3-4 см. При двустороннем мультикистозе почки врачи рекомендуют прервать беременность, а при односторонней патологии — удалить поражённую почку сразу после рождения малыша.
- Поликистоз почки в наличии на органе нескольких кист размером 1-2 мм. На УЗИ аппарате они не видны, но об их наличии свидетельствуют маловодие у беременной и двустороннее увеличение почек в размерах. Эхогенность почек будет повышена, а контур — иметь белый цвет. В этом случае женщину отправляют на аборт, потому что плод погибает ещё в утробе.
- Обструкция лоханочно-мочеточникового соустья. На УЗИ визуализируется расширение почечной лоханки при сохранении нормальной ширины мочеточника и почечной чашки. Количество околоплодных вод остаётся в норме, недоразвитости почки также не наблюдается. На фоне обструкции лоханочно-мочеточникового соустья возникает гидронефроз (застой мочи в почке).
Патология опасна тем, что на её фоне развивается почечная дисплазия — поражение почечной ткани кистами с нарушением функциональности органа. На УЗИ почка становится гиперэхогенной, в ней появляются кисты.
Выводы
Патология органов выделения составляет 1/4 часть всех пренатальных пороков развития. Ошибки возможны только в случае маловодия у женщины, когда органы плохо визуализируются.
Читайте также:
- Инфаркт миокарда (сердечный приступ): причины, симптомы и лечение
- Швы нервов. Техника наложения первичного шва нерва.
- Причины эндофтальмита при проникающих ранениях. Воспаление глаза от инородного тела
- Диагностика односторонней вестибулярной гипофункции при головокружении. Методика
- Болезнь Крейтцфельдта-Якоба на МРТ головного мозга
