Синдром гипотромбопластинемии - синонимы, авторы, клиника
Добавил пользователь Alex Обновлено: 28.01.2026
Миелодиспластический синдром (МДС) - это не одна какая-то болезнь, это целая группа различных патологических состояний костного мозга (КМ), отнесенных к гематологии, но пока не причисленных к лейкозам, хотя болезнь оставляет высокий риск перехода в более тяжелую форму (лейкоз).
Суть МДС заключается в нарушении костномозгового кроветворения на миелоидной линии в отношении какого-то одного клона клеток или затрагивающего несколько популяций. В любом случае для миелодиспластического синдрома характерным признаком будет изменение качественного и количественного состава периферической крови.
Коротко о гемопоэзе
Кроветворение (гемопоэз) - процесс, проходящий много стадий, на каждой из которых клетки крови приобретают новые качества (дифференцируются). Конечным результатом этого процесса является выход в периферическую кровь зрелых (или созревающих, но уже имеющих определенные «навыки»), полноценных, способных осуществлять свои функциональные задачи, форменных элементов крови:
- Красных кровяных телец - эритроцитов;
- Белых клеток - лейкоцитов;
- Кровяных пластинок (бляшек Биццоцеро) - тромбоцитов.
Кроветворение начинается от стволовой клетки, способной, дифференцироваться и давать жизнь всем линиям (росткам) гемопоэза. Миелоидный и лимфоидный ростки пошли от специализированных, обладающих высокой пролиферативной активностью, способных к дифференцировке плюрипотентных клеток.
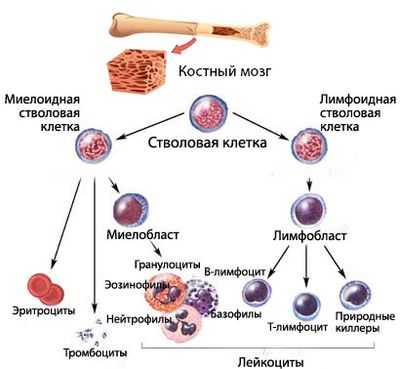
Сбой кроветворения в миелоидном направлении приводит к тому, что сам аномальный клон в некоторой степени теряет возможность продолжать линию (воспроизводить потомство, поэтому количество клеток того ростка, на котором возникла проблема, падает). Естественно, нарушается и созревание полноценных клеток. В результате этого, уменьшается численность одной или нескольких популяций форменных элементов, а также, ввиду ухудшения качества клеток, не в лучшую сторону меняются их функциональные возможности.
Вытекающие из подобных событий последствия - синдром, имеющий различные варианты клинических проявлений, то есть, представляющий собой группу гетерогенных патологических состояний, которая и названа миелодиспластическим синдромом.
Позиция МДС в Международной классификации болезней
Международная классификация болезней десятого пересмотра (МКБ-10), принятая Всемирной организацией здравоохранения (ВОЗ) в Швейцарии Женева, 1989), вступила в силу на территории Российской Федерации в 1997 году. Между тем, в отношении многих патологических состояний в 2010 году были внесены изменения. Нововведения коснулись и гематологической патологии, в том числе, миелодиспластического синдрома. По МКБ-10 в блок диагнозов D37-D48 МДС входит под своим кодом - D46, который имеет 7 или 9 вариантов определений заболеваний или диагнозов (в России, наряду с классификацией ВОЗ, могут использоваться и другие классификации, например, FAB, где вообще только 5 вариантов, поэтому в разных справочниках кодирование также может иметь отличия):
пример МДС с избытком бластов
Примечание: так часто встречающееся определение «рефрактерная» в данном случае объясняет безуспешность лечения железосодержащими и витаминными лекарственными средствами. Рефрактерная анемия устойчива к подобным мерам воздействия, не реагирует на них и нуждается в других терапевтических мероприятиях.
Общая характеристика синдрома
Аномалия генетического материала на уровне полипотентной кроветворной стволовой клетки, мутация ее, а также клеток предшественниц кроветворения, наличие генетически неполноценных клонов приводят к тому, что в клеточном звене системы иммунитета происходят существенные изменения, глубина которых, однако, зависит от того, по каким линиям (одной или нескольким?) пошли нарушения в кроветворении. В зависимости от этого можно ожидать в крови:
- Моноцитопению (уменьшение клеток одного вида);
- Бицитопению (нарушения идут в двух ростках);
- Панцитопению (сбой пошел в трех направлениях, поэтому резко снижено количество белых и красных клеток крови, а также тромбоцитов).
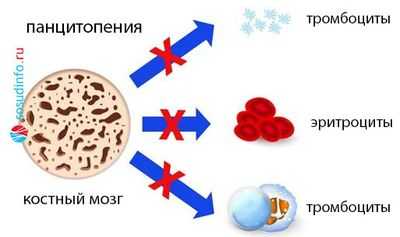
В КМ - аналогично: нормоклеточность, гиперклеточность либо гипоклеточность (миелограмма покажет, какой росток пострадал).
Клинические проявления описываемого синдрома также соответствуют причине, спрятанной на уровне кроветворения:
- Анемия;
- Геморрагический синдром (при снижении численности и нарушении функции тромбоцитов);
- Сочетание анемического и геморрагического синдромов;
- Инфекционный синдром (реже);
- Увеличение селезенки, лимфаденопатия, постоянное повышение температуры тела (эти симптомы присутствуют не так и часто, поэтому относятся к факультативным признакам).
Между тем, опираясь на данные многочисленный исследований МДС (изменение численности и морфологических характеристик клеток крови и костного мозга), гематологи пришли к выводу, что рано или поздно конечным итогом миелодиспластического синдрома станет острый или хронический миелоидный лейкоз (ОМЛ либо ХМЛ), а все эти анемии (рефрактерные) являются лишь промежуточным (временным) состоянием болезни. В связи с этим МДС нередко называют «предлейкозом», «предлейкемией», «тлеющим» или «дремлющим» лейкозом. Все зависит от количества миелобластов - клеток-родоначальниц гранулоцитарного ряда.
Если рефрактерная анемия протекает с избытком бластов (>20% по данным ВОЗ или >30% согласно классификации FAB), то гематологи склоняются к диагнозу - миелоидный лейкоз. В ситуациях, когда численность бластных клеток вплотную не подходит к этому порогу, диагноз пациента остается прежним - миелодиспластический синдром.
Патологическое состояние главного кроветворного органа может сформироваться у человека в любом возрастном периоде (от грудного - до глубокой старости). У детей болезнь чаще всего дебютирует между 3 и 5 годами, хотя, в целом, в детском возрасте риск заболеть совсем низкий. Среди взрослых самыми уязвимыми становятся пожилые люди (60 лет и старше). Например, такой распространенной и рискующей перейти в острый лейкоз форме, как РЦМД, наиболее подвержены люди в возрасте от 70 до 80 лет. Общая частота встречаемости миелодиспластического синдрома колеблется в пределах 3-5 случаев на 100 тысяч населения (не так и редко), причем, мужчины страдают данной патологией несколько чаще, нежели женщины.
Причина первичных форм заболевания остается невыясненной. Основными вероятными «виновниками» вторичного МДС считаются:
- Воздействие ионизирующего излучения;
- Влияние антропогенных неблагоприятных факторов окружающей среды (химических соединений, созданных человеком);
- Последствия химио- и радиотерапии (после лечения опухолевых процессов);
- Инфекционные агенты (бактерии, вирусы).
Следует отметить, что до сих пор МДС, передаваемого по наследству или возникающего в кругу близких родственников, отмечено не было, однако из наблюдений определена группа пациентов, имеющих повышенный риск формирования синдрома. Это дети и взрослые люди, страдающие болезнью Дауна, анемией Фанкони, синдромами Луи-Бар и Блума.
Лечатся все по-разному
Следует сразу настроить пациента, что лечение МДС не будет одинаковым для всех его разновидностей. Набор терапевтических мероприятий рассматривается в индивидуальном порядке, исходя из формы болезни и категории риска, которой принадлежит пациент (согласно клинической классификации Международной Прогностической Системы - IPSS для МДС: низкий, промежуточный 1 и 2, высокий). Словом, существуют определенные каноны, которых доктор придерживается, прежде чем приступить к непосредственному лечению. К примеру:
- Люди, не перешагнувшие 60-летний рубеж, имеющие минимальные признаки болезни, но отнесенные к категории промежуточного или высокого риска с ожидаемой выживаемостью 0,3 - 1,8 года, подвергаются высокоинтенсивной терапии;
- Пациенты, принадлежащие к группе промежуточного и низкого риска с ожидаемой выживаемостью 5-12 лет, проходят лечение низкой интенсивности;
- Молодые люди и больные среднего возраста (до 60 лет) с относительно неплохими показателями (ожидаемая выживаемость от полугода до 5 лет) первоначально лечатся по схемам низкой интенсивности, хотя в любой момент им грозит оказаться в группе, получающей более жесткое лечение (высокие дозы химиотерапии, пересадка КМ).
Таким образом, схемы лечения миелодиспластического синдрома довольно сложны и знает их только врач, получивший в свое время определенную специализацию (гематолог). Он в своей лечебной тактике опирается на рекомендации, разработанные Британским комитетом по стандартизации в гематологии (редакция 2009 года). Читателю же, на наш взгляд, достаточно познакомиться с основными методами проведения терапевтических мероприятий, особо не вникая в тонкости, не ставя диагноз и не причисляя себя или своих близких к той или иной группе риска. И еще, наверное, не помешает знать, что:
- Лечение высокой интенсивности - это, во-первых, обязательное пребывание в специализированном стационаре, во-вторых, назначение высоких доз химиотерапии и, возможно, подготовка к пересадке стволовых клеток и сама пересадка;
- Низкоинтенсивная терапия подразумевает пребывание в больнице (или даже в условиях дневного стационара) время от времени для получения заместительной терапии, низких доз химиопрепаратов, симптоматического лечения.
К сожалению, способа избавиться от такого тяжелого недуга, как МДС, раз и навсегда, пока не придумали. Разве что пересадка главного кроветворного органа (костного мозга) могла бы решить проблему, однако она тоже сопряжена с определенными трудностями (иммунологическое типирование, поиск совместимого донора, высокая стоимость операции, если искать донора по всему миру). Правда, в последние годы, как на территории Российской Федерации и ближайшей соседки - Беларуси, так и на территории других государств бывшего СССР, создаются новые лаборатории тканевого типирования, объединяющие свои реестры в единый банк, чтобы иметь возможность помочь друг другу. На них и возлагаются будущие надежды.
Лечение

Если врач считает, что патологический процесс идет как бы доброкачественно (если можно так выразиться), с небольшим количеством бластов, то больные группы низкого риска, периодически получающие заместительное и поддерживающее лечение (эритроцитарную массу, тромбовзвесь), могут довольно продолжительное время работать и вести почти привычный образ жизни. В основном, лечение таких больных выглядит следующим образом:
- Больной направляется в стационар, чтобы не допустить значительного снижения гемоглобина и развития тяжелого анемического синдрома, поэтому борьбу с ним (анемическим синдромом) считают первостепенной задачей (переливание эритроцитарной массы, заготовленной от доноров);
- Не упускается из виду и такое проявление МДС, как геморрагический синдром, возникающий на почве снижения числа и функциональной неполноценности тромбоцитов. В принципе, симптоматическая терапия, которая позволяет удерживать количество форменных элементов на нужном уровне (гемотрансфузии - эрмасса, тромбовзвесь и т. д.), в общем-то, всегда присутствует в схеме лечения больных, имеющих относительно благоприятную форму болезни;
- Получая от случая к случаю донорские эритроциты, организм больного начинает перегружаться железом, что ликвидируется применением медикаментозных средств, образующих комплексы с этим химическим элементом (эксиджад, десферол);
- Иной раз больные нуждаются в назначении низких доз «химии» (цитарабин, децитабин), а также иммунодепрессивных средства для предотвращения иммунной агрессии против костного мозга (леналидомид), с добавлением к ним ATG (антимоноцитарный глобулин) и циклоспорина;
- Присоединение инфекционного агента требует лечения антибиотиками и противогрибковыми препаратами.
Гораздо сложнее лечить формы миелодиспластического синдрома с избытком бластов, входящие в категорию высокого риска, когда химиотерапевтические препараты почти не приносят желаемого результата и не «отправляют» больного в долгосрочную ремиссию. Однако это не значит, что от них отказываются вовсе, ведь новые, недавно разработанные лекарства, дают некоторую надежду в отношении МДС и даже применяются для лечения ОМЛ (острого миелобластного лейкоза). Однако при таких обстоятельствах существуют рекомендации разработчиков - применять подобные средства для лечения больных, не достигших 60-летнего возраста и имеющих неплохой иммунологический статус, в противном случае - есть риск развития серьезных осложнений, способных преждевременно прервать жизнь.
Пересадка стволовых клеток (возможна тоже только до 60 лет) на сегодняшний день - единственный способ избавить человека от страданий на долгие-долгие годы. К сожалению, трансплантация КМ - операция хоть и несложная в техническом плане, но трудновыполнимая в плане подбора по лейкоцитарной системе HLA совместимого с реципиентом (больным) донора (идентичными, то есть, имеющими абсолютно одинаковый набор генов являются только однояйцевые близнецы - это идеальные доноры друг другу).
Частные симптомы и диагностика
Клинические проявления и степень их выраженности по причине многообразия форм МДС позволяют себе широкие вариации. Случайной находкой синдром выступает редко (это бывает, если человек неплохо себя чувствует, а анализы назначаются в силу других обстоятельств). В основном же, больные направляются в поликлинику с определенными жалобами (постоянное ощущение усталости, одышка, физическая слабость, головокружения, частые подъемы температуры тела), где после тестирования крови становятся очевидными и другие признаки миелодиспластического синдрома:
- Цитопения (снижение количества полноценных форменных элементов крови);
- Анемия (низкий гемоглобин, мало эритроцитов), которая и определяет симптомы, заставившие пойти к врачу;
- Нейтропения (недостаточное содержание в крови нейтрофильных лейкоцитов, обладающих способностью поглощать бактериальные клетки в очаге воспаления - она становится причиной частых инфекций и лихорадки);
- Тромбоцитопения (уменьшение численности тромбоцитов, что обуславливает появление геморрагического синдрома - кровотечений, мелкоточечных подкожных кровоизлияний, синяков).
Между тем, отдельные пациенты относительно долго могут жить и не подозревать, что здоровье «пошатнулось». И тогда МДС становится случайной находкой уже на стадии проведения общего анализа крови.
Чаще всего поводом все же обратиться в поликлинику служат жалобы больного, которые в наибольшей степени связаны с анемией. Пробовать повысить уровень красного пигмента крови (Hb) и содержание красных кровяных телец (Er) препаратами железа и витаминами бесполезно, лечение успехов не приносит, ведь анемия при МДС - рефрактерная. При подозрении на МДС, которое возникает в ходе проведения общего анализа крови (ОАК), добавляются другие исследования:
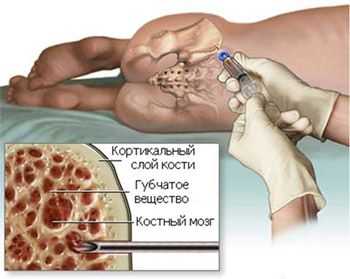
- Подсчет молодых форм красного ростка, которым уже «позволено» присутствовать в циркулирующей крови - ретикулоцитов, они «подскажут», насколько быстро идет процесс воспроизводства новых зрелых кровяных телец;
- Цитологическое исследование аспирата КМ (у пожилых пациентов данный тест не принадлежит к обязательным анализам);
трепанбиопсия костного мозга
Трепанобиопсия (процедура обязательна для всех больных) - после изучения морфологических особенностей гистологический анализ развеет сомнения или подтвердит подозрения;
Безусловно, диагностика миелодиспластического синдрома, начинается с жалоб больного и ОАК, но в дальнейшем опирается на более сложные лабораторные исследования. Здесь врачу есть над чем подумать, чтобы правильно оценить нарушения кроветворения, ведь изменения клеточного состава и морфологических особенностей клеток крови и костного мозга могут быть весьма многочисленны и многообразны. Впрочем, как и сама болезнь…
костный мозг при МДС
Прогноз и рекомендации
Прогноз в отношении продолжительности жизни при миелодиспластическом синдроме не очень оптимистичный, хотя многое зависит от разновидности болезни, степени риска и возрастной категории больного. В целом, пациенты, строго выполняющие рекомендации лечащего врача и получающие периодически поддерживающее лечение, могут рассчитывать прожить пять, а то и десять лет. Однако активное течение злокачественной формы болезни оставляет мало шансов - если не был найден донор и не пересажена стволовая клетка, жизнь может прерваться на 1-2 году от начала патологического процесса. Причиной смерти в большинстве случаев становится острый миелоидный лейкоз, который развился на почве вторичного МДС.
В заключение хочется дать совет людям, столкнувшимся с подобной проблемой и желающим продлить свою жизнь или жизнь близким: никогда не слушать рекомендации того, кто почерпнул сведения о болезнях из сомнительных источников (подобная информация вовсю «гуляет» на просторах Интернета) и возомнил себя доктором. Ни народными средствами, ни специальными физическими упражнениями миелодиспластический синдром не лечится. Нужно следовать рекомендациям врача и тогда, возможно, лечение будет успешным.
ДВС-синдром
ДВС-синдром относится к частым и наиболее тяжелым, жизненно опасным нарушениям системы гемостаза (гемостаз - комплекс реакций организма, направленных на предупреждение и остановку кровотечений).
Синонимы ДВС-синдрома - тромбогеморрагический синдром, коагулопатия потребления, гиперкоагуляционный синдром, синдром дефибринации.
ДВС-синдром (синдром диссеминированного внутрисосудистого свертывания) - это:
- вторичный патологический процесс, возникающий при постоянной и длительной стимуляции системы гемостаза;
- патологический процесс, имеющий фазовое течение, с первоначальной активацией и последующим глубоким нарастающим истощением всех звеньев системы гемостаза вплоть до полной утраты способности крови свертываться с развитием катастрофических неконтролируемых кровотечений и тяжелого генерализованного геморрагического синдрома;
- патологический процесс, при котором отмечается прогрессирующее рассеянное внутрисосудистое свертывание крови с множественным и повсеместным образованием микросгустков крови и агрегатов ее форменных элементов, что ухудшает ее реологические характеристики, блокирует микроциркуляцию в тканях и органах, вызывает в них ишемические повреждения и ведет к полиорганным поражениям.
В зависимости от интенсивности образования и поступления в кровь тромбопластина, который образуется при разрушении клеток, в том числе и кровяных, ДВС-синдром имеет различные клинические формы:
- молниеносную;
- острую;
- подострую;
- затяжную;
- хроническую;
- латентную;
- локальную;
- генерализованную;
- компенсированную;
- декомпенсированную.
Причины
Пусковыми факторами ДВС-синдрома могут явиться самые разнообразные интенсивные или длительные стимулы, так или иначе укладывающиеся в триаду Вирхова - нарушения циркуляции крови, ее свойств или сосудистой стенки.
1. При нарушении реологических характеристик крови и гемодинамики
- любой вид шока,
- кровопотеря,
- интоксикация,
- сепсис,
- резус-конфликтная беременность,
- остановка кровообращения и последующая реанимация, ,
- атония матки, ,
- массаж матки
2. При контакте крови с поврежденными клетками и тканями
- ,
- антенатальная гибель плода,
- онкологические заболевания
3. При изменении свойств крови и при массивном поступлении в кровь тромбопластических веществ
- лейкозы,
- эмболия околоплодными водами,
- переливание несовместимой крови,
- септический аборт,
- отслойка нормально расположенной плаценты с кровоизлиянием в матку,
- приращение плаценты, ,
- операции на паренхиматозных органах: матке, печени, легких, простате, почках;
- острая лучевая болезнь,
- синдром длительного сдавления,
- гангрена,
- трансплантация органов, химиотерапия, панкреонекроз, инфаркт миокарда и прочее).
Симптомы ДВС-синдрома
В течении ДВС-синдрома выделяют 4 стадии:
1 стадия - фаза гиперкоагуляции и гиперагреции тромбоцитов;
2 стадия - переходная фаза (разнонаправленные сдвиги в свертываемости крови как в сторону гипер-, так и в сторону гипокоагуляции);
3 стадия - фаза глубокой гипокоагуляции (кровь не сворачивается вообще);
4 стадия - разрешающая фаза (либо показатели гемостаза нормализуются, либо развиваются осложнения, приводящие к летальному исходу).
Симптоматика ДВС-синдрома зависит от многих факторов (причины, которая его вызвала, клиники шока, нарушений всех звеньев гемостаза, тромбозов, сниженного объема сосудистого русла, кровотечения, анемии, нарушения функций и дистрофии органов-мишеней, нарушения обмена веществ).
В первую фазу отмечается повышенная свертываемость крови, моментальное образование сгустков в крупных сосудах и тромбов в мелких (во время операции). У больного невозможно взять кровь на анализ, так как она тут же сворачивается. Как правило, первая фаза протекает очень быстро и остается незамеченной врачами. Отмечается резкое снижение артериального давления, кожные покровы бледные, покрыты холодным липким потом, пульс слабый (нитевидный). Затем развивается дыхательная недостаточность в силу поражения легких, влажный кашель и крепитация в легких, цианоз кожи, холодные ступни и кисти.
Во вторую фазу сохраняются те же симптомы, что и в первой стадии ДВС-синдрома, плюс в процесс вовлекаются почки (почечная недостаточность), надпочечники, пищеварительный тракт (тошнота, рвота, боли в животе, диарея). В головном мозге образуются микротромбы (головная боль, головокружение, судороги, потеря сознания вплоть до комы, парезы и параличи, инсульты).
Третья фаза (стадия гипокоагуляции) характеризуется массивными кровотечениями, как из первоначального очага, так и из других органов (кишечное и желудочное кровотечения вследствие изъязвления слизистой, кровь в моче - поражение почек, мокрота с примесью крови при откашливании).
Также характерно развитие геморрагического синдрома (появление массивных кровоизлияний, гематом, петехий, неостанавливающееся кровотечение в местах инъекций и во время проведения операции, кровоточивость десен, кровотечение из носа и прочее).
Четвертая фаза при своевременном и адекватном лечении ведет к восстановлению гемостаза и остановке кровотечения, но нередко заканчивается летальным исходом при массивном поражении внутренних органов и кровотечении.
Диагностика
Основные лабораторные исследования:
- (при ДВС-синдроме отмечается снижение тромбоцитов во 2, 3 и 4 фазы);
- время свертываемости крови (норма 5 - 9 минут, в 1 стадию укорочение показателя, в последующие - удлинение времени);
- время кровотечения (норма 1 - 3 минуты); (активированное частичное тромбопластическое время - увеличение во 2 и 3 фазах ДВС-синдрома); , тромбиновое время, определение активированного времени рекальцификации плазмы - АВР (увеличение во вторую и третью стадию ДВС-синдрома);
- лизис сгустка (в норме нет, в 3 фазу лизис быстрый, а в 4 фазу сгусток не формируется); (норма 2 - 4 г/л, снижается во 2, 3 и 4 стадии);
- исследование феномена фрагментации эритроцитов вследствие повреждения их нитями фибрина (в норме тест отрицательный, положительный тест свидетельствует о ДВС-синдроме);
- снижение эритроцитов (анемия, уменьшение объема крови);
- снижение гематокрита (гиповолемия);
- определение кислотно-щелочного и электролитного баланса.
Лечение ДВС-синдрома
Терапию ДВС-синдрома осуществляет врач, столкнувшийся с данной патологией (то есть лечащий врач) вкупе с реаниматологом. При хроническом течении ДВС-синдрома его лечением занимается терапевт с гематологом.
В первую очередь необходимо устранить причину ДВС-синдрома. Например, при сепсисе назначается антибактериальная и трансуфизионная (внутривенное вливание препаратов крови) терапия, при травматическом шоке - адекватное обезболивание, иммобилизация, оксигенация и раннее хирургическое вмешательство. Или при опухолевых заболеваниях - химио- и радиотерапия, при инфаркте миокарда - купирование болевого синдрома, восстановление сердечного ритма и гемодинамики, при акушерской и гинекологической патологии радикальные меры (экстирпация матки, кесарево сечение).
Восстановление гемодинамики и реологических свойств крови осуществляется путем инфузионно-трансфузионных вливаний.
Показано вливание свежезамороженной плазмы, которая не только восстанавливает объем циркулирующей крови, но и содержит все факторы свертывания.
Также вводят кристаллоидные (физ. раствор, глюкоза) и коллоидные растворы (полиглюкин, реополиглюкин) в отношении 4/1 и белковые препараты крови (альбумин, протеин).
Назначается антикоагулянт прямого действия - гепарин. Доза гепарина зависит от стадии ДВС-синдрома (в 1 - 2 фазы она значительная). При значительной анемии переливается свежая (не более 3 суток) эритроцитарная масса.
В лечении тяжелого генерализованного ДВС-синдрома применяют фибриноген и концентраты свертывающих факторов крови (криопреципетат). Используют игинбиторы протеолиза - антипротеазы, для подавления тканевых протеаз, которые высвобождаются при повреждении клеток (контрикал, трасилол, гордокс). Также назначаются кортикостероиды (гидрокортизон, дексаметазон), так как они повышают свертываемость крови.
Параллельно ведется борьба с полиорганной недостаточностью (поддержка функций легких, почек, желудочно-кишечного тракта, надпочечников). Во 2 - 4 фазах ДВС-синдрома для восстановления местного гемостаза применяют смесь из аминокапроновой кислоты, сухого тромбина, этамзилата натрия и адроксона. Данную смесь вводят в брюшную полость через дренажи, перорально, в виде тампонов в полость матки и влагалища, а смоченные раствором салфетки наносят на рану.
Весь процесс интенсивной терапии занимает 1 - 5 суток (в зависимости от тяжести ДВС-синдрома), а последующее лечение продолжается до полного или практически полного восстановления всех полиорганных нарушений.
Осложнения и прогноз
К основным осложнениям ДВС-синдрома относятся:
- гемокоагуляционный шок (критическое падение артериального давления, расстройства дыхательной и сердечной систем и прочее);
- постгеморрагическая анемия;
- летальный исход.
Прогноз зависит от тяжести, течения и стадии ДВС-синдрома. В 1 и 2 стадии прогноз благоприятный, в 3 стадию сомнительный, в 4 (при неадекватном или отсутствующем лечении) летальный.
Важно! Все материалы носят справочный характер и ни в коей мере не являются альтернативой очной консультации специалиста.
Этот сайт использует cookie-файлы для идентификации посетителей сайта: Google analytics, Yandex metrika, Google Adsense. Если для вас это неприемлемо, пожалуйста, откройте эту страницу в анонимном режиме.
Гипоталамический синдром
Гипоталамический синдром - комплекс эндокринных, обменных, вегетативных расстройств, обусловленных патологией гипоталамуса. Характеризуется изменением (чаще увеличением) массы тела, головными болями, неустойчивостью настроения, гипертензией, нарушением менструального цикла, повышенным аппетитом и жаждой, усилением или снижением либидо. Для диагностики гипоталамического синдрома проводится расширенное гормональное исследование, ЭЭГ, МРТ головного мозга, при необходимости УЗИ щитовидной железы, надпочечников. Лечение гипоталамического синдрома заключается в подборе эффективной стимулирующей или ингибирующей гормональной терапии, проведении симптоматического лечения.
Общие сведения
Гипоталамический синдром - комплекс эндокринных, обменных, вегетативных расстройств, обусловленных патологией гипоталамуса. Характеризуется изменением (чаще увеличением) массы тела, головными болями, неустойчивостью настроения, гипертензией, нарушением менструального цикла, повышенным аппетитом и жаждой, усилением или снижением либидо. Прогноз зависит от тяжести поражения гипоталамуса: от возможности полного выздоровления до прогрессирования заболевания (развитие выраженного ожирения, стойкой гипертонии, бесплодия и т. д.).
Патология гипоталамической области часто встречается в эндокринологической, гинекологической, неврологической практике, вызывая сложности в диагностике из-за многообразия форм проявления. Гипоталамический синдром чаще развивается в подростковом (13-15 лет) и репродуктивном (31-40 лет) возрасте, преобладая у лиц женского пола (12,5-17,5% женщин).
Проблема медицинской и социальной значимости гипоталамического синдрома определяется молодым возрастом пациентов, быстро прогрессирующим течением заболевания, выраженными нейроэндокринными нарушениями, нередко сопровождающимися частичным снижением или полной утратой трудоспособности. Гипоталамический синдром вызывает серьезные нарушения репродуктивного здоровья женщины, вызывая развитие эндокринного бесплодия, поликистоза яичников, акушерские и перинатальные осложнения.
Причины развития гипоталамического синдрома
Гипоталамический отдел головного мозга отвечает за регуляцию гуморальных и нервных функций, обеспечивающих гомеостаз (стабильность внутренней среды). Гипоталамус выполняет роль высшего вегетативного центра, регулирующего обмен веществ, терморегуляцию, деятельность кровеносных сосудов и внутренних органов, пищевое, половое поведение, психические функции. Кроме того, гипоталамус управляет физиологическими реакциями, поэтому при его патологии нарушается периодичность тех или иных функций, что выражается вегетативным кризом (пароксизмом).
Вызывать нарушения деятельности гипоталамуса и развитие гипоталамического синдрома могут следующие причины:
- опухоли головного мозга, сдавливающие гипоталамическую область;
- черепно-мозговые травмы с прямым повреждением гипоталамуса;
- нейроинтоксикации (токсикомания, наркомания, алкоголизм, производственные вредности, экологическое неблагополучие и т. д.);
- сосудистые заболевания, инсульт, остеохондроз шейного отдела позвоночника;
- вирусные и бактериальные нейроинфекции (грипп, ревматизм, малярия, хронический тонзиллит и др.);
- психогенные факторы (стрессы, шоковые ситуации, умственные нагрузки);
- беременность и сопряженные с ней гормональные перестройки;
- хронические заболевания с вегетативными компонентами (бронхиальная астма, гипертония, язвы желудка и двенадцатиперстной кишки, ожирение);
- конституциональная недостаточность гипоталамической области.
Классификация гипоталамического синдрома
Клиническая эндокринология насчитывает большое число исследований по изучению гипоталамического синдрома. Результаты этих исследований легли в основу современной расширенной классификации синдрома.
По этиологическому принципу гипоталамический синдром подразделяется на первичный (вследствие нейроинфекций и травм), вторичный (вследствие конституционального ожирения) и смешанный.
По ведущим клиническим проявлениям выделяют следующие формы гипоталамического синдрома:
- вегетативно-сосудистую;
- нарушения терморегуляции;
- гипоталамическую (диэнцефальную) эпилепсию;
- нейротрофическую;
- нервно-мышечную;
- псевдоневрастеническую и психопатологическую;
- расстройство мотиваций и влечений;
- нейроэндокринно-обменные расстройства.
Выделяют клинические варианты гипоталамического синдрома с преобладанием конституционального ожирения, гиперкортицизма, нейроциркуляторных нарушений, герминативных расстройств.
Тяжесть проявления гипоталамического синдрома может быть легкой, средней и тяжелой формы, а характер развития - прогрессирующий, стабильный, регрессирующий и рецидивирующий. В пубертатном периоде гипоталамический синдром может протекать с задержкой или ускорением полового созревания.
Симптомы гипоталамического синдрома
Проявления гипоталамического синдрома зависят от зоны поражения гипоталамуса (передний или задний отделы) и вызванных нейрогуморальных расстройств в гипоталамо-гипофизарной области. В проявлениях гипоталамического синдрома чаще преобладают следующие нарушения:
- вегетативно-сосудистые - 32%,
- эндокринно-обменные - 27%,
- нервно-мышечные - 10%,
- нарушения терморегуляции и др. - 4% и т. д.
Гипоталамический синдром проявляется общей слабостью, повышенной утомляемостью, физическим и психическим истощением, плохой переносимостью смены метеорологических условий, покалываниями в сердце, склонностью к аллергическим реакциям, неустойчивым стулом, чувством нехватки воздуха, эмоциональными расстройствами (тревогой, приступами панического страха), нарушениями сна, повышенной потливостью. Объективно выявляются тахикардия, асимметрия артериального давления со склонностью к его повышению, тремор пальцев и век.
У большей части пациентов гипоталамический синдром протекает пароксизмально (приступообразно), чаще в виде вагоинсулярных и симпатико-адреналовых кризов. Вазоинсулярные кризы при гипоталамическом синдроме сопровождаются чувством жара, прилива к лицу и голове, головокружением, удушьем, неприятными ощущениями в эпигастрии, тошнотой, замиранием сердца, потливостью, общей слабостью. Может наблюдаться усиленная перистальтика кишечника с послаблением стула, учащенное и обильное мочеиспускание, повторные позывы в туалет. Возможно развитие аллергических проявлений в форме крапивницы и даже отека Квинке. Частота сердечных сокращений урежается до 45-50 уд. в мин., АД снижается до 90/60-80/50 мм рт. ст.
Продолжительность криза может быть от 15 мин. до 3 и более часов, после чего на протяжении нескольких часов сохраняется слабость и страх повторения подобного приступа. Часто при гипоталамическом синдроме кризы носят смешанный характер, сочетая симптомы вагоинсулярного и симпатико-адреналового кризов.
Нарушение терморегуляции при гипоталамическом синдроме сопровождается развитием гипертермического криза, характеризующегося внезапным скачком температуры тела до 39-40 °С на фоне длительного субфебрилита. Для терморегуляционных нарушений типично утреннее повышение температуры и ее снижение к вечеру, отсутствие эффекта от приема жаропонижающих препаратов. Расстройства терморегуляции чаще наблюдаются в детском и юношеском возрасте и зависят от физического и эмоционального напряжения. У подростков они нередко связаны со школьными занятиями и исчезают в каникулярный период.
Проявлениями терморегуляционных нарушений при гипоталамическом синдроме могут служить постоянная зябкость, непереносимость сквозняков и низких температур. Такие пациенты постоянно кутаются, носят одежду не по погоде, даже в теплое время не открывают форточки и окна, избегают принимать ванну. Расстройство мотиваций и влечений при гипоталамическом синдроме характеризуется эмоционально-личностными нарушениями, различными фобиями, изменением либидо, патологической сонливостью (гиперсомнией) или бессонницей, частой сменой настроения, раздражительностью, гневом, слезливостью и т. д.
Нейроэндокринно-обменные расстройства при гипоталамическом синдроме проявляются нарушением белкового, углеводного, жирового, водно-солевого обмена, булимией, анорексией, жаждой. Нейроэндокринные нарушения могут сопровождаться синдромами Иценко-Кушинга, несахарного диабета с полиурией, полидипсией и низкой относительной плотностью мочи, акромегалией, ранним климаксом у молодых женщин, изменениями в щитовидной железе. Могут наблюдаться дистрофия костей и мышц, нарушения трофики кожи (сухость, зуд, пролежни), изъязвления слизистых внутренних органов (пищевода, 12-перстной кишки, желудка). Для гипоталамического синдрома характерно хроническое или длительное течение с рецидивами и обострениями.
Осложнения гипоталамического синдрома
Течение гипоталамического синдрома наиболее часто осложняется поликистозными изменениями яичников, гинекомастией, нарушениями менструального цикла от олиго- и аменореи до маточных кровотечений, миокардиодистрофией, гирсутизмом и инсулинорезистентностью. Осложнением беременности при гипоталамическом синдроме может являться тяжелая форма позднего гестоза.
Диагностика гипоталамического синдрома
Полиморфная клиника гипоталамического синдрома представляет немалые трудности в его диагностике. Поэтому ведущими критериями диагностики гипоталамического синдрома служат данные специфических тестов: сахарной кривой, термометрии в трех точках, ЭЭГ головного мозга, трехдневной пробы Зимницкого.
Глюкозу крови при гипоталамическом синдроме исследуют натощак и с нагрузкой 100 г сахара, определяя уровень глюкозы через каждые 30 минут. При гипоталамическом синдроме встречаются следующие варианты сахарной кривой:
- гипергликемический (подъем уровня глюкозы выше нормы);
- гипогликемический (содержание глюкозы ниже нормы);
- двугорбовый (снижение уровня глюкозы чередуется с новым подъемом);
- торпидный (небольшой подъем глюкозы фиксируется в одной точке).
Термометрию при гипоталамическом синдроме проводят в трех точках: обеих подмышечных впадинах и в прямой кишке. Термометрические нарушения могут выражаться в изотермии (равной температуре в прямой кишке и подмышечных областях, при норме в прямой кишке на 0,5-1°С выше); гипо- и гипертермии (в подмышечных впадинах температура ниже или выше нормы); термоинверсии (температура в прямой кишке ниже, чем в подмышечных впадинах).
Электроэнцефалография выявляет изменения, затрагивающие глубинные структуры мозга. В трехдневной пробе по Зимницкому у пациентов с гипоталамическим синдромом изменяется соотношение выпитой и выделяемой жидкости, ночного и дневного диуреза. Методом МРТ головного мозга при гипоталамическом синдроме выявляется повышенное внутричерепное давление, последствия гипоксии и травм, опухолевые образования.
Обязательным критерием диагностики гипоталамического синдрома является определение гормонов (пролактина, ЛГ, эстрадиола, ФСГ, тестостерона, кортизола, ТТГ, Т4 (свободного тироксина), адренотропного гормона в крови и 17-кетостероидов в суточной моче) и биохимических показателей для выявления эндокринно-обменных нарушений. Дифференцировать гипоталамический синдром с органическим поражением других систем позволяет УЗИ надпочечников, УЗИ щитовидной железы и внутренних органов. При необходимости дополнительно проводится МРТ или КТ надпочечников.
Лечение гипоталамического синдрома
Комплекс мероприятий по лечению гипоталамического синдрома должен осуществляться совместными усилиями эндокринолога, невролога и гинеколога (у женщин). Подбор методов лечения гипоталамического синдрома всегда индивидуален и зависит от ведущих проявлений. Целью терапии гипоталамического синдрома является коррекция нарушений и нормализация функции гипоталамических структур головного мозга.
На первом этапе лечения проводят устранение этиологического фактора: санацию инфекционных очагов, лечение травм и опухолей и т. д. При интоксикациях алкоголем, наркотиками, инсектицидами, пестицидами, тяжелыми металлами проводится активная дезинтоксикационная терапия: внутривенно вводятся солевые растворы, тиосульфат натрия, глюкоза, физиологический раствор и др. Для профилактики симпатико-адреналовых кризов назначаются пирроксан, алкалоиды красавки + фенобарбитал, сульпирид, тофизопам, антидепрессанты (тианептин, амитриптилин, миансерин и др.).
Нейроэндокринные нарушения корректируются заместительными, стимулирующими или тормозящими гормональными препаратами, назначением диеты и регуляторов нейромедиаторного обмена (бромокриптин, фенитоин) курсом до полугода. При развитии посттравматического гипоталамического синдрома проводят дегидратирующую терапию, цереброспинальную пункцию. При нарушениях обмена назначается диетотерапия, анорексанты, витамины.
При гипоталамическом синдроме назначаются средства, улучшающие мозговое кровообращение (пирацетам, гидрализат головного мозга свиней, винпоцетин), витамины группы В, аминокислоты (глицин), препараты кальция. В лечение гипоталамического синдрома включают рефлексотерапию, физиопроцедуры, лечебную гимнастику. В структуре лечения гипоталамического синдрома важная роль отводится нормализации режима отдыха и работы, диете, нормализации массы тела, курортотерапии.
Прогноз и профилактика гипоталамического синдрома
Гипоталамический синдром может приводить к снижению и утрате работоспособности в случаях часто повторяющихся вегетативных пароксизмов. Таким пациентам с учетом их профессиональной деятельности может устанавливаться инвалидность III группы. Резко выраженные нейроэндокринно-обменные формы гипоталамического синдрома также могут приводить к потере трудоспособности с установлением III или II группы инвалидности.
Поскольку кризы при гипоталамическом синдроме, как правило, возникают в определенное время и при изменениях метеоусловий, значительных эмоциональных и физических перенапряжениях, их профилактика заключается в предупреждающем приеме седативных средств, антидепрессантов, транквилизаторов. Также, по возможности, необходимо исключить провоцирующие приступы факторы, нервно-психические и физические нагрузки, работу в ночные смены.
Диссеминированное внутрисосудистое свёртывание крови (ДВС-синдром)

Диссеминированное внутрисосудистое свёртывание крови (ДВС-синдром) - это один из наиболее распространённых в интенсивной терапии и представляющих большую опасность для больных вид патологии гемостаза. ДВС-синдром в настоящее время является важной проблемой медицины, так как осложняет течение практически любого заболевания, может являться причиной их развития и нередко предопределяет прогноз заболевания. Данный синдром универсален и может протекать как молниеносно с развитием смертельного исхода, так и латентно. При ДВС-синдроме возможно свёртывание крови в сосудистом русле, так и регионарные и органные тромбозы.
ДВС-синдром является полиэтиологическим заболеванием и может развиваться при различных заболеваниях и патологических процессах, которые приведены в таблице 1.
Заболевания системы крови
Острый промиелоцитарный лейкоз
Хронический мегакориоцитарный лейкоз
Серповидноклеточная анемия (гемолитический криз)
Эмболия околоплодными водами
Внутриутробная смерть плода
Конфликт матери и плода по АВО и резус-фактору
Заболевания сосудистой стенки и сосудов
Тромбоэмболия лёгочной артерии
Тромботическая тромбоцитопеническая пурпура
Шок (травматический, ожоговый, септический)
Массивные поражения тканей (краш-синдром, большие операции)
Синдром массивных трансфузий
Переливание несовместимой крови
Отравления и интоксикации (лекарственные, змеиные яды)
В основе патогенеза ДВС-синдрома лежит преобладание активирующих свёртывающую систему механизмов над антикоагулянтной системой.
Развитие тяжёлого ДВС-синдрома начинается в результате массивной и длительной активации свёртывающей системы в под воздействием внешнего фактора. В результате этого развивается состояние гиперкоагуляции, что приводит к повсеместному образованию мелких сгустков, которые оседают в микроциркуляторном русле.
Обязательным элементом ДВС-синдрома является агрегация тромбоцитов. В результате гиперкоагуляции тромбоциты склеиваются между собой. Постепенно количество тромбоцитов уменьшается, в связи с чем развивается тромбоцитопения потребления.
В патогенезе ДВС-синдрома центральное место занимают образование в сосудистом русле тромбина и истощение механизмов, препятствующих свёртыванию крови и агрегации тромбоцитов. В процессе развития ДВС-синдрома может происходить снижение уровня основного физиологического антикоагулянта - антитромбина III в плазме. В результате запущенного патологического процесса в крови накапливается огромное количество активированных факторов свёртывания, что приводит к истощению системы фибринолиза и образовавшиеся сгустки практически перестают лизиироваться. Развивается блокада микроциркуляции, приводящая к нарушению кровоснабжения почек, печени, лёгких, слизистых оболочек кишечника, что создаёт предпосылки к развитию полиорганной недостаточности (ПОН).
Основными типичными клиническими проявлениями ДВС-синдрома являются геморрагии и/или тромбозы и ПОН. ПОН развивается в результате тромбогеморрагических поражений органов, имеющих богатую микроциркуляторную сеть. К данным органам относятся лёгкие, почки, головной мозг, кожа, надпочечники и печень.
Первыми признаками поражения лёгких является одышка и падение артериальной оксигенации. Нарушение микроциркуляции под воздействием вазоактивных субстанций приводит к развитию острой дыхательной недостаточности с нарастающей одышкой, цианозом, ателектазами в лёгких и прогрессирующим отёком лёгких.
Отложение фибрина в сосудах почечных клубочков может привести к почечной недостаточности. В клинической картине наблюдается олигоурия, рефрактерная к диуретикам, микро-и макрогематурия, высокие показатели мочевины и креатинина сыворотки крови.
Нарушения микроциркуляции головного мозга приводит к энцефалопатии, нарушению психики, потери сознания. В случае тяжёлого течения ДВС-синдрома возможно кровоизлияние в головной мозг.
Для ДВС-синдрома характерно образование стрессовых, гипоксических эрозий и язв слизистой желудочно-кишечного тракта, осложняющихся диффузным кровотечением.
При ДВС-синдроме отмечается геморрагический синдром, который носит смешанный гемотомно-петехиальный характер. На коже спонтанно или при незначительных воздействиях появляются синяки. Течение геморрагического синдрома сопровождается носовыми, десневыми кровотечениями и кровотечениями из места инъекций.
Кровотечения, геморрагический синдром и внутрисосудистый гемолиз приводят к развитию анемического синдрома. Анемический синдром сопровождается снижением уровня гемоглобина, эритроцитов.
В результате нарушения микроциркуляции, наличия гематом и повышения проницаемости слизистой оболочки желудочно-кишечного тракта создаются благоприятные условия для развития генерализованной инфекции - сепсиса.
По клиническому течению ДВС-синдрома выделяют:
Острый ДВС-синдром характерен для акушерской патологии, сепсиса, массивного краш-синдрома, обширных ожогов, массивного распада опухолей, переливания несовместимой крови. Для острого ДВС-синдрома характерна диффузная кровоточивость из операционной раны, носовые, десневые, постинъекционные кровотечения.
Подострое течение ДВС-синдрома наблюдается при аутоиммунных заболеваниях, хронических инфекциях и при всех перечисленных выше патологических состояниях. Длительность подострого течения занимает от нескольких недель до месяцев.
Хронический ДВС-синдром может длительное время не проявляться клинически. Возникновение ДВС-синдрома связано с прогрессированием основного заболевания. Хронический ДВС-синдром встречается при терапевтической патологии, например при сердечной недостаточности, хроническом гломерулонефрите, септическом эндокардите.
Рецедивирующий ДВС-синдром проявляется необильными носовыми кровотечениями, синяками на коже в период обострения основного заболевания.
В настоящее время в течение ДВС-синдрома выделяют три стадии:
I стадия - гиперкоагуляции. Для стадии гиперкоагуляции характерно повышение агрегации тромбоцитов и тромбообразование. При остром течении ДВС-синдрома данная стадия кратковременна и быстро переходит в стадию гипокоагуляции.
II стадия - нормокоагуляция. В этой стадии наблюдается субкомпенсация гемостаза.
III стадия - гипокоагуляция, при которой развивается выраженная кровоточивость, являющаяся следствием истощения фибринолиза.
ДВС-синдром является вторичным проявлением патологического процесса. Поэтому главной задачей является устранение провоцирующего фактора или своевременное лечение основного заболевания.
Лечение ДВС-синдрома включает в себя:
- Антикоагулянтную терапию.
- Заместительную терапию.
- Антифибринолизные препараты.
- Дезагреганты и препараты реологического действия.
- Экстракорпоральная детоксикация.
Использование гепарина оправдано на любой стадии ДВС-синдрома. В стадии гиперкоагуляции ДВС-синдрома гепарин применяется в суточной дозе 500-800 ЕД/кг. Доза гепарина подбирается в соответствии с лабораторными показателями гемостаза. Считается, что исходное время свертывания по Ли-Уайту должно увеличиться в 2 раза. Определёнными преимуществами обладают препараты фракционированного гепарина (фраксипарин, клексан, фрагмин), которые можно вводить 1-2 раза в сутки без значительных колебаний времени свертывания. В стадии гипокоагуляции гепарин вводят вместе со свежезамороженной плазмой (СЗП). В данном случае доза гепарина составляет 2500-5000 ЕД. Введение гепарина перед СЗП повышает активность антитромбина-III (AT-III) по отношению к факторам Ха и IХа, обрывает процесс внутрисосудистого свёртывания и тем самым не даёт развиться коагулопатии потребления.
Заместительная терапия предназначена для восстановления гемостаза больного. К заместительной терапии относится переливание СЗП, которая содержит достаточную концентрацию необходимых компонентов гемостаза. На начальных этапах лечения ДВС-синдрома доза СЗП составляет 800-1600 мл/сут. В стадии гипокоагуляции доза СЗП увеличивается до 15-20 мл/кг/сут.
Эффективно применение криопреципитата, содержащего более высокие концентрации фибриногена, фактора Виллебранда, фибронектина и фактора ХIII. Криопреципитат показан при остром или молниеносном течении ДВС-синдрома.
Для восстановления объёма циркулирующей крови используются растворы кристаллоидов, альбумина и коллоидов. В I стадии применяется растворы гидроксиэтилкрахмала, что способствует улучшению микроциркуляции.
При снижении уровня гемоглобина ниже 70-80 г/л, гематокрита менее 25% показано переливание отмытых эритроцитов, а при их отсутствии — эритроцитной массы. Тромбоцитарный концентрат переливают при снижении уровня тромбоцитов до 50•109/л.
В стадии гипокоагуляции показано введение ингибиторов протеаз: контрикала или апротинина (трисалол). Контрикал в водят внутривенно в начальной дозе 350000 АтрЕ и затем в поддерживающей дозе 140000 АтрЕ каждые 4 ч до нормализации показателей гемостаза. Начальная доза трасилола составляет 500000 КИЕ и поддерживающая - 50000 КИЕ/ч.
Одним из компонентов терапии ДВС-синдрома является использование препаратов улучшающих микроциркуляцию и дезагрегантов.
Важным компонентом комплексной терапии ДВС-синдрома являются методы экстракорпоральной детоксикации. Методы экстракорпоральной детоксикации повышают эффективность лечения ДВС-синдрома и его осложнений, что позволяет снизить летальность.
Плазмаферез (ПФ) позволяет удалять продукты паракоагуляции, активаторы свёртывания, циркулирующие иммунные комплексы, крупномолекулярные соединения. ПФ необходимо проводить в максимально ранние сроки ДВС-синдрома. Для достижения клинического эффекта необходимо, чтобы объём удаляемой плазмы за один сеанс ПФ был не менее 50% объёма циркулирующей плазмы. Замещение должно производиться СЗП в объёме, равном объёму удаляемой плазмы.
Развитие ПОН и в частности острого повреждения почек является показанием для проведения заместительной почечной терапии (ЗПТ): гемодиализ, гемофильтрация, гемодиафильтрация. ЗПТ удаляет низко- и среднемолекулярные токсины, медиаторы воспаления, снижает объём жидкости, улучшает кислородтранспортную функцию крови.
Прогноз при ДВС-синдроме определяется степенью его выраженности, распространенностью и характером течения. Опыт современной медицины даёт основание говорить о возможности эффективного лечения больных с острыми вариантами ДВС-синдрома, однако летальность может составлять 50 %.
Читайте также:
- Идиопатическое воспаление глазницы (псевдотумор, воспаление без причины)
- Диагностика травм у пострадавших в ДТП. Внутрибольничная транспортировка пострадавших
- Синдром Бурхаве (Boerhaave)
- Туберкулез ушной раковины. Папуло-некротический туберкулез наружного уха
- Одонтогенные опухоли и опухолеподобные образования. Фиброма полости рта.
