Сохранение репродуктивной функции (фертильности) при онкологических болезнях женщин
Добавил пользователь Алексей Ф. Обновлено: 21.01.2026
В обзоре обсуждаются методы сохранения генетического материала у пациенток репродуктивного возраста с новообразованиями органов репродуктивной системы. Приводятся данные зарубежных и отечественных статей, найденных в PubMed по актуальной теме. Лечение онкологических заболеваний органов репродуктивной системы проводится преимущественно радикальным удалением детородных органов. В связи с этим направление онкофертильности стало неотъемлемой частью жизни пациенток после хирургического и химио-лучевого лечения. В статье описывается влияние гонадотоксичного лечения на функцию яичников. Сохранение генетического материала и реализация репродуктивного потенциала женщины являются важными аспектами, влияющими на качество жизни в будущем. Применение инновационных технологий в сохранении фертильности позволяет определить оптимальную тактику ведения пациенток, страдающих различными видами онкологических заболеваний. Рассмотрены стандартные методы сохранения генетического материала у онкологических больных. Обсуждаются современные программы сохранения фертильности: in vitro дозревание ооцитов (IVM), полученных из ткани яичника, криоконсервация овариальной ткани и комбинация этих методов.
Заключение. Данный обзор научной литературы демонстрирует важную роль инновационных методов сохранения фертильности (IVM, криоконсервация овариальной ткани) для пациенток с онкологическими заболеваниями органов репродуктивной системы.
Направление «онкофертильность» появилось в конце 90-х гг. прошлого столетия и объединило специалистов, занимающихся реабилитацией репродуктивной функции онкологических больных. Было показано, что сохранение репродуктивного материала приводит к повышению качества жизни пациентов, снижает тяжесть психологического расстройства от потери фертильности, которое может быть сильнее и глубже, чем смирение с мыслью об онкологическом заболевании, предстоящей терапии и последующей за ней длительной реабилитации. Вероятное бесплодие из-за рака у женщин может быть более разрушительным для сознания, чем само принятие диагноза рак, и возможность иметь ребенка после излечения является важным стимулом в предстоящей терапии и реабилитации 2.
В связи с современной тенденцией отсроченного деторождения возрастает число женщин, у которых рак диагностируют раньше, чем наступает их первая беременность [4]. Исходя из этого, сохранение фертильности является важной проблемой для онкологических пациентов репродуктивного возраста и неотъемлемой составляющей в консультировании пациентов до начала лечения онкологического заболевания. Американское общество клинических онкологов указывает на то, что онкологические пациенты обеспокоены вопросом сохранения фертильности [4]. Своевременная оценка онкологических и репродуктивных характеристик больных и выбор доступных методов сохранения фертильности, не нарушающих лечение основного заболевания, стали важнейшими компонентами современной онкологической помощи женщинам. Тем не менее организация такой помощи далеко не совершенна. Так, в одном из опросов онкологов было показано, что 61% специалистов обсуждают с пациентами влияние потенциального гонадотоксичного лечения на будущую фертильность женщины, 45% опрошенных врачей никогда не задумывались о рекомендации пациентам консультации репродуктолога и лишь 15% направляли их к специалистам узкого профиля [5].
Эволюция вспомогательных репродуктивных технологий (ВРТ) способствовала разработке методов и стратегий для сохранения фертильности у больных раком. Они включают в себя фармакологическую защиту яичников от гонадотоксичного воздействия химиотерапии с применением агонистов гонадотропин-рилизинг-гормона (аГнРГ), транспозицию яичников, криоконсервацию ооцитов, эмбрионов или ткани яичника [6]. В 2013 г. Американское общество клинических онкологов разработало практическое руководство по оптимизации сохранения фертильности у онкологических больных, одна из рекомендаций которого - приступить к сохранению фертильности до начала гонадотоксичного лечения [4].
Выбор вариантов сохранения фертильности у пациенток с онкологическими заболеваниями органов репродуктивной системы напрямую зависит от многих факторов: характера онкологического процесса и тактики предстоящего лечения, прогноза ремиссии онкологического заболевания и выживаемости больной, вероятности потери репродуктивной функции, а также состояния репродуктивной системы пациентки и ее овариального резерва, дающих возможность получить и сохранить репродуктивный материал.
В настоящее время разработаны и используются в клинической практике методы получения и криоконсервации ооцитов/эмбрионов при ряде онкологических заболеваний [7]. Эти методы предполагают стимуляцию яичников в режимах «random start» и требуют отсрочки лечения на 12-14 дней. Такая тактика не может быть применима при ряде гинекологических раков, а именно раке яичников, рецидивирующих пограничных опухолях яичника, раке шейки матки с инвазией в параметрий, раке матки II-III стадий. Указанные нозологические формы рака требуют немедленного хирургического лечения, как правило, заключающегося в потере репродуктивных органов с последующей химио-лучевой терапией [8].
Кроме того, эти программы не подходят для девочек препубертатного возраста, реабилитация которых в плане нормального фенотипического развития и сохранение будущей фертильности являются актуальной проблемой современной медицины [9]. В связи с этим особенно актуальной является разработка инновационных методов сохранения фертильности для пациенток с гинекологическим раком. Таким пациентам требуется персональная стратегия в выборе оптимального варианта терапии, которая будет определяться совместно онкогинекологом и репродуктологом.
Эпидемиология новообразований репродуктивных органов малого таза
Ежегодно диагностируется почти 100 000 новых случаев гинекологических злокачественных новообразований, и 15-20% этих случаев приходится на женщин в возрасте до 40 лет [10]. Таким образом, значительное число пациенток, страдающих гинекологическими опухолями, имеют детородный возраст на момент постановки диагноза и еще не выполнили свою репродуктивную функцию. Известно, что 8% рака эндометрия, 12% рака яичников и 40% рака шейки матки встречаются у женщин в репродуктивном периоде [11]. Достижения в области раннего выявления рака и улучшенные протоколы лечения значительно увеличили выживаемость пациентов за последние несколько лет. Так, среди всех видов рака яични.
Сохранение репродуктивной функции (фертильности) при онкологических болезнях женщин
Кафедра акушерства, гинекологии, перинатологии и репродуктологии факультета последипломного профессионального обучения врачей Московской медицинской академии им. И.М. Сеченова;
Научный центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова
ФГБУ "Российский научный центр рентгенорадиологии" Минздрава РФ, Москва
ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова» Минздрава России, Москва, Россия
ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава России, Москва, Россия, 119991
Сохранение репродуктивного материала у онкологических больных как медико-социальная и организационная проблема
Журнал: Онкология. Журнал им. П.А. Герцена. 2020;9(1): 60‑65
Сохранение репродуктивного материала онкологических больных молодого возраста является актуальной и во многом нерешенной проблемой современной медицины. Развитие этого направления требует междисциплинарного подхода и консолидации действий онкологов, репродуктологов и ряда других специалистов. В обзоре представлено современное состояние проблемы онкофертильности в мире, обсуждены международные клинические рекомендации, проведен анализ спорных и нерешенных вопросов. Подчеркнута необходимость объединения профильных специалистов и развития этого направления в нашей стране.
Ежегодно все большее количество людей репродуктивного возраста сталкиваются с онкологическими заболеваниями и последующей терапией, способной нанести необратимый вред репродуктивному здоровью. Повышение частоты раннего выявления рака и улучшение качества лечения пациентов репродуктивного возраста значительно увеличили долгосрочную выживаемость и позволили пациентам рассмотреть их последующее качество жизни после выздоровления, включая возможность рождения биологического потомства [1—3]. Поэтому в 2007 г. в рамках гранта Национального института здравоохранения США по инициативе Т. Woodruff и ее коллег [4—5] был создан консорциум по онкофертильности (OC), который позиционировался как межведомственное, междисциплинарное объединение для расширения исследований в области бесплодия у онкологических больных, ускорения внедрения новых способов сохранения фертильности в клиническую практику и решения сложных проблем здравоохранения, касающихся качества жизни молодых пациентов, больных раком, чья фертильность может быть поставлена под угрозу в связи с их заболеванием или терапией [6—8].
С этого периода начался новый сложный этап медицины — этап исследований и клинической работы по сохранению репродуктивной функции онкологических больных [9]. В США под эгидой консорциума была создана Национальная ассоциация врачей, которая сегодня представляет 60 центров, занимающихся лечением бесплодия у мужчин и женщин, а также 19 центров, ориентированных на педиатрических пациентов. С момента своего создания консорциум стремится привлечь больше партнеров для организации общенационального сообщества, способного систематизировать ресурсы и практические разработки с целью улучшения предоставляемой пациентам помощи [10].
С помощью баз данных отслеживают информацию о пациенте, включая демографические данные, информацию об онкологическом заболевании и проблемах, связанных с фертильностью, возникших в результате онкологического заболевания или гонадотоксической терапии [11]. По примеру США крупные развитые страны стали заниматься проблемой сохранения репродуктивного материала онкологических больных, создавая собственные базы и национальные рекомендации [12].
Более того, понимая, что только консолидация усилий специалистов разных стран и широкомасштабный сбор фактического материала способны создать эффективную систему помощи этой категории больных, были сформированы международные регистры, среди которых наиболее крупными на сегодня являются следующие:
— Международное общество сохранения фертильности (ISFP) запустило регистр учета случаев криоконсервации овариальной ткани в 2014 г., который предназначен для сбора данных о процедуре и ее исходах.
— Северо-западный консорциум по онкофертильности проводит информационное исследование по наблюдению за фертильностью (реестр FIRST), в котором ежегодно собираются данные анкет женщин в возрасте 18—44 лет о влиянии лечения рака на репродуктивное здоровье молодых пациенток.
— The Human Oocyte Preservation Experience (HOPE) является проспективным многоцентровым регистром по учету криоконсервированных ооцитов, однако этот регистр не собирает данные об онкологических больных.
— Ряд стран выпускает национальные отчеты об успехах ВРТ, однако на сегодняшний день в них не включены конкретные данные по онкофертильности.
Большинство специалистов подчеркивает, что нынешняя нехватка основанных на фактических доказательствах данных по бесплодию у онкологических больных обусловливает острую необходимость в создании национальных регистров. Регистры предоставляют основанные на фактах сведения о применении и успехах различных вариантов сохранения репродуктивного материала. Эти данные будут использоваться для информирования пациентов, развития и усовершенствования служб и программ по онкофертильности, создания клинических рекомендаций и протоколов лечения, психосоциальной поддержки.
Важно, что в централизованных регистрах будет документирована и систематизирована информация об осложнениях применения ВРТ у онкологических больных, что позволит разработать национальные руководства по онкофертильности, а также даст уверенность клиницистам в своевременности и безопасности проводимых программ.
В большинстве центров, где активно занимаются вопросами онкофертильности, созданы регистры пациентов, обращающихся для сохранения и дальнейшей реализации репродуктивной функции. Национальные регистры идеально подходят для сбора данных о пациентах, нуждающихся в медицинской помощи по сохранению фертильности и в оценке эффективности предоставляемой помощи. В 2015 г. исследовательская группа «Fertility Understanding Through Registry and Evaluation» (FUTURE) запустила первый в Австралии и Новой Зеландии национальный интернет-регистр по учету онкологических больных, получивших помощь репродуктолога [14—15]. Крайне важно, и на это указывают все специалисты, чтобы консультация по поводу применения ВРТ у онкологических больных происходила в короткий промежуток времени между диагностикой рака и началом лечения. Основная цель создания многочисленных клинических рекомендаций состоит в том, чтобы этот разговор стал обычной практикой в процессе лечения данной когорты пациентов. Своевременное направление пациента онкологом к репродуктологу жизненно важно и требует эффективной взаимосвязи двух медицинских специалистов.
Согласно результатам опроса участников Oncofertility Consortium Global Partners Network, a National Institutes of Health—funded organization [16—20], 30 (75%) из 40 респондентов сообщили, что установили реферальную систему на своем сайте, и 35 (88%) из 40 — о наличии регистра пациентов. Самая большая группа респондентов (14 (38%) из 37) указали, что средний промежуток времени в их центре между диагностикой рака и консультацией по сохранению фертильности составляет 1—2 дня. Респонденты (9 (24%) из 37) сообщили, что время между консультацией и началом выполнения процедур по сохранению фертильности составляет 1—2 дня, а между консультациями и процедурами проходит в среднем от 3 до 5 дней. Часть пациентов (11 (31%) из 36) указали, что время между диагностикой рака и процедурами по сохранению фертильности составляет 3—5 дней. Это положительный опыт, но, к сожалению, не столь распространенный, как хотелось бы. Что касается ситуации в нашей стране, то не только больные, но и врачи не знают о возможности предварительного криоконсервирования репродуктивного материала, а пациенты во многих случаях обращаются на фоне уже проводимой химиотерапии или по ее завершении.
Согласно рекомендациям Британского общества фертильности, выпущенным в 2018 г. [21], информированность женщин о возможностях и потенциальных исходах применения ВРТ является одним из факторов успешности программы онкофертильности:
— женщины должны быть информированы о том, что риск врожденных аномалий или генетических заболеваний не увеличивается после лечения рака;
— женщины, получавшие лучевую терапию на область малого таза, включая матку, должны быть информированы об акушерских рисках;
— женщины должны быть информированы о том, что нет доказательств повышенного риска рецидива рака после наступления беременности, причем это касается большинства типов онкологических заболеваний;
— для оказания помощи в необходимом объеме риск бесплодия, снижения овариального резерва и возникновения преждевременной недостаточности яичников у данной когорты пациенток следует оценивать на основании возраста, типа и дозы применяемой химиотерапии.
По этим же рекомендациям женщинам репродуктивного возраста следует предлагать сохранение фертильности, если:
— существует весомый риск возникновения бесплодия в результате применяемого лечения;
— имеется перспектива для долгосрочного выживания;
— пациентка подходит для стимуляции яичников и получения необходимого количества ооцитов;
— время, необходимое для стимуляции овуляции и получения ооцитов, не ставит под угрозу прогноз по поводу исходов лечения основного заболевания.
В рекомендациях Американского общества репродуктивной медицины (ASRM) также говорится, что если заинтересованные пациенты не будут направлены на консультацию к репродуктологу перед проведением лечения, варианты для последующей реализации репродуктивной функции могут быть утрачены [22—23].
Большинство специалистов определяет алгоритм ведения больных как совокупность последовательных действий, представленных на рис. 1. Принятие решения зависит от онкологического статуса пациентки и характеристик состояния ее репродуктивной системы. К онкологическим характеристикам можно отнести тип рака, гонадотоксический эффект предполагаемой терапии, прогноз выживаемости, время, которое требуется для забора репродуктивного материала, общее состояние здоровья больной и ее настойчивое желание сохранить свой биологический материал. Необходимо учитывать и репродуктивные характеристики, позволяющие реально оценить возможность получения полноценного материала, сохранение которого впоследствии приведет к наступлению беременности. Это прежде всего возраст пациентки, состояние ее овариального резерва, характеристики менструального цикла, семейный статус.
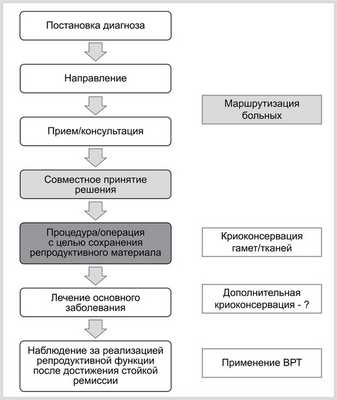
Рис. 1. Алгоритм ведения пациенток.
Примерная схема консультирования пациенток представлена на рис. 2.
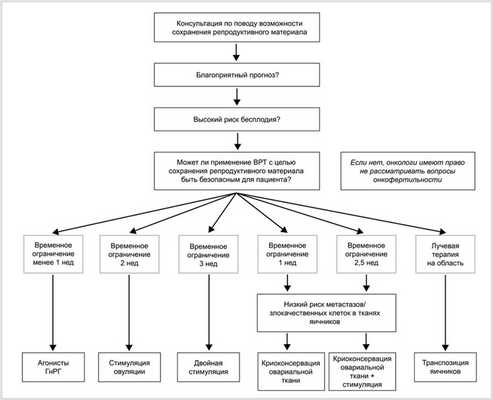
Рис. 2. Примерная схема консультирования пациенток [13].
Специалисты выделяют ряд значимых проблем, влияющих на принятие решений, касающихся сохранения репродуктивного материала у онкологических больных.
Во-первых, из-за невозможности надолго отложить лечение основного заболевания сбор информации, ее осмысление и принятие решений должны происходить быстро. Наиболее эффективные варианты сохранения репродуктивной функции (криоконсервация эмбрионов, ооцитов и сперматозоидов) — это те, которые предоставляются больным раком до начала лечения основного заболевания. В рекомендациях Американского общества клинической онкологии (ASCO) отмечено, что пациенты, заинтересованные в сохранении репродуктивного материала, как можно скорее должны рассмотреть возможные варианты, чтобы максимально повысить вероятность успеха [24—26]. Однако часто врачам не хватает времени для принятия решения и завершения выбранной методики сохранения репродуктивного материала до начала лечения рака, причем в конкретных случаях эти сроки варьируют. Например, в одних случаях у пациенток с раком молочной железы может проходить приблизительно 2 мес между диагностикой рака и началом химиотерапии [27—30], в случае планирования неадъювантной химиотерапии интервал между диагностикой и началом химиотерапии обычно составляет всего 1 мес. Протокол стимуляции требует приблизительно 2 нед, причем раньше стимуляцию начинали только в раннюю фолликулярную фазу, что не всегда было возможно в связи с необходимостью начинать терапию основного заболевания. В настоящее время стали доступны более гибкие протоколы стимуляции яичников для получения ооцитов и их последующей криоконсервации. Сроки этой процедуры больше не зависят от дня менструального цикла в большинстве случаев, и стимуляция может быть начата с меньшей задержкой по сравнению со старыми протоколами. Таким образом, отбор яйцеклеток с целью криоконсервации ооцитов или эмбрионов теперь возможен вне зависимости от дня менструального цикла, что значительно упростило лечение [31—33]. Несомненно, что возможность проведения процедуры сохранения репродуктивного материала зависит от типа и характера течения онкологического заболевания. К примеру, пациентки с некоторыми типами гематологических онкологических заболеваний часто находятся в тяжелом состоянии, сопровождающимся коагулопатией или нейтропенией, что затрудняет немедленное начало протокола стимуляции яичников [34]. Возможность и рациональность применения методов вспомогательной репродукции зависят также от ожидающихся перспектив долгосрочного выживания после лечения основного заболевания, степени риска возникновения бесплодия.
Во-вторых, пациенты, узнав о наличии у них тяжелого заболевания, находятся в состоянии выраженного психологического стресса, затрудняющего принятие адекватных решений, тем более что исследователи отмечают низкую осведомленность пациентов о базовых вопросах онкофертильности [35].
В-третьих, применения ВРТ может стать значительным финансовым бременем для пациентов. Несмотря на растущие доказательства необходимости сохранения репродуктивного материала у молодых больных, заболевших раком, предварительное лечение не покрывается большинством страховых компаний. Это обстоятельство еще раз подчеркивает необходимость создания национальных программ привлечения фондов и общественных организаций для помощи молодым пациентам, заболевшим раком и желающим сохранить репродуктивную функцию.
В-четвертых, применение ВРТ у онкологических больных требует вмешательства многопрофильной медицинской команды и межпрофессионального подхода. Межпрофессиональная деятельность подразумевает постоянное взаимодействие, открытую коммуникацию, обмен знаниями, понимание профессиональных ролей, общих задач и целей. Для обсуждения и применения вариантов сохранения репродуктивного материала у молодых онкологических больных, сталкивающихся с угрозой бесплодия, требуется вовлечение различных специалистов, включая репродуктолога, онколога, уролога, патолога, генетика, специалиста по психическому здоровью, социального работника, финансового консультанта и др. Чтобы обеспечить реализацию современных вариантов сохранения фертильности в клинической практике, важно координировать различные экспертные мнения с точки зрения времени и эффективности медицинского лечения, что обычно является сложной задачей и требует наличия клинических рекомендаций и протоколов ведения этой группы пациентов.
В нашей стране первые исследования, направленные на сохранение репродуктивного материала у молодых женщин, больных раком молочной железы, были опубликованы в 2011 г. [37]. Эта работа выполнялась в рамках междисциплинарного сотрудничества двух ведущих учреждений — «НМИЦ акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова» и «НМИЦ онкологии им. акад. Н.Н. Блохина». С этого времени проводится совместная работа репродуктологов и онкологов, направленная на сохранение репродуктивной функции у больных раком шейки матки, эндометрия и исследования по криоконсервации и трансплантации ткани яичников. Актуальным является новое направление по дозреванию in vitro ооцитов, полученных трансвагинально или из ткани яичника [39]. Вместе с тем не существует единой национальной программы, отечественных протоколов и рекомендаций по сохранению репродуктивного материала у онкологических больных, что делает этот вид помощи практически недоступным для большинства нуждающихся, особенно проживающих в регионах страны. Существует настоятельная необходимость в создании междисциплинарной системы, занимающейся вопросами сохранения репродуктивного материала у онкологических больных молодого возраста.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflicts of interest.
Сведения об авторах
Некоторые виды противораковой терапии приводят к потере фертильности. Но сегодня молодые пациентки не должны платить за победу над болезнью такую высокую цену! Криоконсервация репродуктивного биоматериала сохраняет для них возможность стать мамами после выздоровления.
Онкологический диагноз не дает времени прийти в себя: надо быстро сдать огромное количество анализов, определиться с клиникой, подготовиться к лечению. Чаще всего молодые женщины не знают о риске потери фертильности после лечения рака. Вопрос «онкофертильность» обязательно следует обсудить с лечащим онкологом. И если предстоящая терапия способна ухудшить репродуктивную функцию, воспользоваться одной из программ сохранения фертильности при онкодиагнозе.
Рак считается «возрастным» заболеванием. Тем не менее, ежегодно десяткам тысяч женщин 18−35 лет ставят онкологический диагноз. Современная противораковая терапия возвращает большинство этих пациенток к обычной жизни.
Показатель 5-летней выживаемости после лечения рака для женщин репродуктивного возраста составляет 67%. Исследования в США свидетельствуют о выживаемости, приближающейся к 90%*.
Но у методов борьбы с онкологией (в первую очередь, у химио- и радиотерапии) есть нежелательные побочные эффекты, главный из которых — снижение или даже полная утрата фертильности.
Преждевременное истощение яичников;Некроз примордиальных фолликулов Нарушение созревания примордиальных фолликулов;Снижение овариального резерва Разрушение клеток примордиальных фолликулов;Преждевременное истощение яичников Развитие бесплодия в 30-70% случаев;Стерилизация
Уровень негативного воздействия терапии зависит от вида рака и методов лечения. Во многих случаях возможность возобновления функции яичников у пациенток от 25 лет не превышает 5%.
Трансплантация кроветворных стволовых клеток с циклофосфамидом/тотальным облучением или циклофосфамидом/бусульфаном -Облучение зоны яичников;Высокий риск (> 80%) Терапия с использованием комбинаций циклофосфамида, метотрексата, фторурацила, доксорубицина, эпирубицина (6 циклов) у женщин в возрасте 30-39 лет;Промежуточный риск (20-80%) Терапия ABVD (доксорубицин/блеомицин/винбластин/дакарбазин) -Терапия CHOP (циклофосфамид/доксорубицин/ винкристин/преднизон) 4-6 циклов -Терапия CVP (циклофосфамид/винкристин/преднизон) -Терапия острой миелоидной лейкемии антрациклином/цитарабином -Терапия лимфобластной лейкемии (мультиагент) -Терапия с использованием комбинаций циклофосфамида, метотрексата, фторурацила, доксорубицина, эпирубицина (6 циклов) у женщин младше 30 лет -Терапия с доксорубицином/циклофосфамидом (4 цикла) у женщин младше 40 лет;Более низкий риск (<20%) Метотрексат, фторурацил, винкристин, блеомицин, дактиномицин;Очень низкий риск или отсутствие риска
Распространенные онкозаболевания женщин репродуктивного возраста, требующие применения гонадотоксической химио- и лучевой терапии****
Задача медицины — не только вылечить человека, но и обеспечить пациенту, пережившему рак, достойное качество жизни. Может ли чувствовать себя благополучной женщина, которая лишена шанса стать матерью? Конечно, нет.
Важно!
Наука нашла решение проблемы. Это — криоконсервация генетического биоматериала. В дальнейшем, после наступления ремиссии, он может использоваться для наступления беременности.
Сразу после постановки диагноза врачу следует обсудить с пациенткой репродуктивного возраста риск бесплодия в результате лечения и проинформировать ее о возможностях по сохранению фертильности. К сожалению, пока не все онкологи действуют по этому сценарию.
Важно!
Вам предстоит угнетающее репродуктивную функцию лечение, но онколог не затронул вопроса сохранения фертильности? Мы поможем вам разобраться с информацией и предложим варианты действий. После, предложенные варианты необходимо обсудить с лечащим врачом — без его направления и участия реализация программы невозможна.
В «Криотопе» доступны 3 программы сохранения репродуктивной функции женщин с онкодиагнозом: витрификация яйцеклеток, витрификация эмбрионов, заморозка яичниковой ткани. Оптимальный вариант определяют репродуктолог из нашей медицинской команды и онколог пациентки. Криоконсервация должна проводиться до начала лечения!
Криоконсервация яйцеклеток (ооцитов) и эмбрионов рекомендованы в качестве стандартных стратегий сохранения фертильности Американским обществом клинической онкологии (ASCO) и Европейским обществом медицинской онкологии (ESMO). Криоконсервация яичниковой ткани — экспериментальный, очень перспективный метод, который применяется в ситуациях, когда нельзя получить яйцеклетки. В нашей стране он успешно реализуется на базе МНИОИ им. Герцена.
Сегодня заморозка женских яйцеклеток широко используется в лечении бесплодия и программах отложенного материнства. Между тем, в конце 90-х метод был внедрен именно для сохранения фертильности онкопациентов. За прошедшие десятилетия он в полной мере продемонстрировал свою эффективность.
Метод предполагает стимуляцию овариальной функции пациентки для созревания в организме нескольких фолликулов, забор яйцеклеток путем трансвагинальной пункции фолликулов, витрификацию (быструю заморозку) полученных репродуктивных клеток и их помещение в криохранилище:
- для стимуляции яичников у женщин с онкологическим диагнозом применяются щадящие гормональные препараты последнего поколения. Медикаменты подбираются совместно с онкологом пациентки. Процесс роста фолликулов отслеживается репродуктологом с помощью УЗИ;
- пункция фолликулов — малоинвазивное вмешательство, которое длится около 20 минут;
- витрификация — самый оптимальный способ заморозки яйцеклеток, гарантирующий высокую сохранность биоматериала. Витрифицированные яйцеклетки десятилетиями хранятся в специальных резервуарах, не теряя жизнеспособности и потенциала к оплодотворению.
- задерживает начало противоопухолевого лечения (обычно на 2 недели). Если это недопустимо, пациенткам рекомендуется метод криоконсервации яичниковой ткани;
- при некоторых видах онкологии стимуляция овуляции может быть противопоказана. Решение — такое же, как в предыдущем пункте.
Сценарий практически такой же, как в программе криоконсервации яйцеклеток. Разница в том, что ооциты не замораживаются, а сразу оплодотворяются спермой супруга или донора. Полученные эмбрионы 5 дней культивируются в инкубаторе, после чего витрифицируются и помещаются в криохранилище. Но участия пациентки этап культивирования не требует, она может начать лечение онкозаболевания сразу после получения яйцеклеток.
- подходит женщинам, у которых есть супруг или постоянный партнер;
- имеет те же ограничения, что криоконсервация яйцеклеток;
- после разморозки витрифицированные эмбрионы не уступают в жизнеспособности «свежим».
Замораживание тканей яичников — революционный метод. С ним сохранение фертильности доступно для онкологических пациенток всех возрастов, включая девушек, не достигших половой зрелости.
Ценность яичниковой ткани в том, что она содержит примордиальные фолликулы — в них заключается репродуктивный потенциал женщины. Забор биоматериала производится лапароскопически, одновременно с вмешательством по основному заболеванию или независимо. После получения ткани эмбриологи готовят ее к криоконсервации и замораживают. Криоконсервированная яичниковая ткань может долгое время находиться в криохранилище с возможностью полного восстановления функций после размораживания.
Когда после выздоровления пациентка планирует беременность, сохраненную яичниковую ткань можно использовать двумя способами.
- Имплантация — ткань повторно «подсаживается» в рганизм женщины, после чего начинает вырабатывать гормоны и яйцеклетки. Возможно наступление беременности естественным путем.
- Извлечение из размороженной ткани незрелых яйцеклеток для дальнейшего созревания в лабораторных условиях и проведения ЭКО. Однако процент получения жизнеспособных эмбрионов из незрелых яйцеклеток низко (конечно, с дальнейшим развитием репродуктивных технологий ситуация улучшится)
- процедура заморозки яйцеклетки может быть выполнена быстро и не требует откладывать начало противоракового лечения;
- это единственный на сегодня способ сохранения фертильности для девочек с онкологическим диагнозом.
На данный момент криоконсервация яичниковой ткани считается экспериментальным методом. Но опыт в данной сфере увеличивается с каждым годом, в том числе в России. Впервые обратная подсадка ткани яичника привела к рождению здорового ребенка в 2004 году. *****
Специалисты пока не могут говорить о высоких шансах на беременность после заморозки ткани яичников. В этом отношении метод уступает криоконсервации зрелых ооцитов и эмбрионов. Однако в некоторых ситуациях он дает единственную возможность сохранить шансы на материнство после антираковой терапии.
Сохранение фертильности при лечении опухолей репродуктивной системы
Очень часто лечение опухолей репродуктивной системы у женщин невозможно без обширного хирургического вмешательства. Такие операции включают в себя удаление матки (гистерэктомию) и двустороннее удаление придатков - яичников и маточных труб (двусторонняя сальпингоофорэктомиея). В таком случае сохранение возможности зачатия (фертильности) невозможно.
На ранних стадиях возможны органосохраняющие операции. Однако после органосохраняющего лечения может потребоваться химиотерапия, которая также может повлиять на способность зачатия.
Женщине обязательно нужно сообщить своему лечащему врачу о желании иметь детей в будущем до начала лечения. Решение о возможности сохранения фертильности должно приниматься коллегиально врачом-онкологом, онкогинекологом и врачом-репродуктологом.
Что можно сделать, чтобы сохранить способность иметь детей после лечения
Традиционными методами сохранения фертильности являются криоконсервация (“замораживание”) яйцеклеток или ткани яичника. Также используются специальные лекарственные препараты, подавляющие функцию яичника.
Сохранение фертильности при хирургическом лечении рака яичников
Чаще всего первым этапом лечения рака яичников является хирургическое вмешательство. Главная цель такого вмешательств - удалить все или большинство опухолевых очагов из организма. Другая цель операции - определить распространенность процесса (даже если видимых очагов нет, в органах и тканях могут быть мелкие отсевы опухоли - микрометастазы).
Для лечения рака яичников чаще всего используется обширная операция. Однако если опухоль не распространилась за пределы яичников, женщина может обсудить со своим лечащим врачом возможность сохраняющей фертильность операции . Необходимо помнить, что такой подход возможен только при ранних стадиях рака.
К таким операциям можно отнести:
- Одностороннюю сальпингоофорэктомию без гистерэктомии. В данном случае удаляются только яичник и маточная труба с одной стороны. После такой операции можно забеременеть естественным путем. Однако для проведения такой операции опухоль должна находиться только в одном яичнике, без распространения за его пределы.
- Двусторонняя сальпингоофорэктомия без гистерэктомии - это удаление придатков с двух сторон с сохранением матки. Такой объем вмешательства может применяться, если опухоль находится в обоих яичниках, но не распространяется за их пределы. Естественное зачатие в таком случае невозможно. Однако можно провести процедуру экстракорпорального оплодотворения (ЭКО) с донорскими яйцеклетками.

Сохранение фертильности при раке шейки матки
При ранних стадиях рака шейки матки возможно проведение хирургического лечения. Способность к естественному зачатию сохраняется при двух типах вмешательств : конизации шейки матки и трахелэктомии.
- Конизация шейки матки - это конусообразное удаление части шейки матки. При конизации удаляется переходная зона шейки матки, в которой чаще всего возникает рак. Этот вид вмешательства используется с диагностической и лечебной целью при очень ранних стадиях рака шейки матки.

- Трахелэктомия - это полное удаление шейки матки. Матку и яичники при трахелэктомии сохраняют. Стоит помнить, что этот вид вмешательства используется также при очень ранних стадиях рака шейки матки.

Сохранение фертильности при раке тела матки
Стандартом лечения рака тела матки, который не распространился за ее пределы, является удаление матки и придатков с обеих сторон. Беременность в такой ситуации невозможна.
Если женщина очень хочет иметь детей, можно обсудить лечение, сохраняющее фертильность . При раке тела матки низкого риска можно начать лечение с гормональной терапии и отложить операцию. Если гормональная терапия будет хорошо работать и уничтожит все опухолевые клетки, можно попробовать забеременеть.
Для выбора такой тактики необходимо соблюдение условий :
- гистологический тип опухоли - эндометриоидный рак;
- по данным обследований опухоль ограничена маткой;
- низкая степень злокачественности опухоли (опухолевые клетки очень похожи на здоровые);
- нет противопоказаний к беременности;
- нет противопоказаний к гормональной терапии (к таковым относятся инсульт, инфаркт миокарда, тромбоэмболия легочной артерии, тромбоз глубоких вен нижних конечностей и курение);
- женщина полностью осознает, что данная тактика не является стандартом лечения рака тела матки и может привести к нежелательным онкологическим исходам;
- женщина согласна регулярно проходить биопсию эндометрия.
Для гормональной терапии может быть использован один из следующих препаратов :
- мегестрола ацетат (таблетки),
- медроксипрогестерона ацетат (таблетки),
- левоноргестрел (внутриматочная спираль).
Во время лечения каждые 3-6 месяцев проводится биопсия эндометрия. Если после 6 месяцев лечения опухолевые клетки при биопсии не обнаруживаются, то нужно остановить гормонотерапию и начать попытки забеременеть. После успешного завершения беременности необходимо провести хирургическое вмешательство в полном стандартном объеме
Если во время гормональной терапии при очередной биопсии снова обнаружены опухолевые клетки или нет ответа на лечение в течение 6-12 месяцев, рекомендовано хирургическое удаление матки и придатков.
Использование такого метода не является стандартом лечения. Необходимо обсудить с лечащим врачом пользу и риски такого подхода, чтобы принять обдуманное и взвешенное решение. Подробнее о том, что может повлиять на выбор лечения, вы можете прочитать в статье.
Правовые аспекты сохранения фертильности у лиц, страдающих онкологическими заболеваниями в сфере репродуктивной системы
В статье анализируется законодательство о применении вспомогательных репродуктивных технологий, в соответствии с которым противопоказаниями для применения базовой программы вспомогательных репродуктивных технологий являются злокачественные новообразования любой локализации. Тем не менее, многочисленные исследования в области онкогинекологии доказывают эффективность органосохраняющих методов лечения, применяемых для сохранения фертильной функции пациенток молодого возраста. Обосновывается необходимость законодательного закрепления возможности применения методов вспомогательных репродуктивных технологий для лечения бесплодия у лиц со злокачественными новообразованиями при условии наличия положительного решения врачебной комиссии под председательством онколога-гинеколога, а также информированного добровольного согласия самой пациентки.
Во все времена семья представляла собой важный социальный институт, обеспечивающий общественный механизм воспроизводства человека, в том или ином виде узаконенный обществом. Семья также играет роль системообразующего института, который выполняет сразу несколько функций, основными из которых являются репродуктивная, воспитательная, хозяйственно-экономическая и коммуникативная функции. В нашей стране семейные отношения традиционно регулируются специальным семейным законодательством. С 1995 года действует Семейный кодекс Российской Федерации [1] (далее - СК РФ), в котором в целом обеспечивается историческая преемственность в регулировании брачно-семейных отношений с законодательством бывшего СССР. Тем не менее, в современном семейном законодательстве появились новые юридические конструкции, восприняты положения Конвенции ООН о правах ребенка [2] и других международно-правовых актов, ратифицированных Российской Федерацией. СК РФ основывается на конституционных принципах о защите государством семьи, материнства, отцовства и детства (ст. 1).
Так, семейным законодательством регулируются отношения, связанные с установлением происхождения детей. При этом стремительное развитие медицины, позволяющей использовать вспомогательные репродуктивные технологии для лечения бесплодия, опережает принятие соответствующих правовых норм. Законодательство не успевает регулировать отношения, которые уже фактически сложились и требуют лишь легализации. Применение вспомогательных репродуктивных технологий позволяет мужчине и женщине, страдающих бесплодием, родить ребенка, осуществить свое естественное право на продолжение рода. Законодательство же содержит положения, которые препятствуют в ряде случаев воспользоваться своим естественным правом на выполнение репродуктивной функции, что является нарушением прав и свобод человека и гражданина.
Итак, Указом Президента от 9 октября 2007 г. № 1351 «Об утверждении концепции демографической политики Российской Федерации на период до 2025 года» [3] поставлена задача по сокращению уровня материнской и младенческой смертности, укреплению репродуктивного здоровья населения, здоровья детей и подростков. Для решения задачи по укреплению репродуктивного здоровья населения необходимо обеспечение доступности и повышение качества медицинской помощи по восстановлению репродуктивного здоровья, в том числе вспомогательных репродуктивных технологий. Таким образом, необходимость совершенствования законодательства в сфере применения репродуктивных технологий является актуальной задачей, стоящей перед государством.
Тем не менее, в настоящее время до сих пор отсутствует специальный закон, который бы регулировал отношения в сфере применения методов искусственной репродукции человека. Общие положения о возможности их использования содержатся в СК РФ (п. 4 ст. 51 и п. 3 ст. 52), Федеральном законе от 21.11.2011 г. №323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации» [4] (далее - Закон об охране здоровья граждан) (ст. 55);
Федеральном законе от 15.11.1997 № 143-ФЗ «Об актах гражданского состояния» [5] (ст. 16). В соответствии с СК РФ, существуют три способа репродуктивной деятельности: искусственное оплодотворение, имплантация эмбриона (п. 1. ч. 4 ст. 51) и имплантация эмбриона в тело суррогатной матери (п. 2 ч. 4 ст. 51).
В ст. 55 Закона об охране здоровья граждан содержится определение вспомогательных репродуктивных технологий, которые представляют собой методы лечения бесплодия, при применении которых отдельные или все этапы зачатия и раннего развития эмбрионов осуществляются вне материнского организма (в том числе с использованием донорских и/или криоконсервированных половых клеток, тк.
Читайте также:
